Reattore catalitico: Idrogenazione dell'etilene
Panoramica
Fonte: Kerry M. Dooley e Michael G. Benton, Dipartimento di Ingegneria Chimica, Louisiana State University, Baton Rouge, LA
L'idrogenazione dell'etilene (C2H4) all'etano (C2H6) è stata spesso studiata come reazione di riduzione modello nella caratterizzazione di nuovi catalizzatori metallici. 1-2 Mentre il nichel supportato non è il catalizzatore metallico più attivo per questa reazione, è abbastanza attivo che la reazione può avvenire a < 200 ° C.
La reazione coinvolge tipicamente idrogeno adsorbito e dissociato (H2)che reagisce con etilene adsorbito. In altre parole, sia gli atomi di idrogeno che le molecole di etilene formano legami con un sito metallico (qui indicato con "S"). Il forte legame dell'etilene con S indebolisce il doppio legame sufficientemente da consentire agli atomi di idrogeno di aggiungere all'etilene, formando etano, che non viene adsorbito.
Lo scopo di questo esperimento è, in primo luogo, quello di convertire le misurazioni della composizione grezza per limitare le conversioni frazionarie reagenti. 3 Queste conversioni possono quindi essere utilizzate in un reattore a flusso a spina (PFR) per adattare i dati a un modello standard di cinetica della legge di potenza mediante il "Metodo integrale". 3 Un confronto degli ordini sperimentali di reazione sia per l'etilene che per l'idrogeno con gli ordini teorici rivela in questo caso che la reazione è controllata cineticamente piuttosto che controllata dal trasferimento di massa.
Principi
Un meccanismo per la reazione (lasciando A = etilene, E = etano e S = un sito metallico) può essere scritto come:2
A + S  AS (1)
AS (1)
H2 + 2 S  HS + HS (2)
HS + HS (2)
AS + HS  AHS + S (3)
AHS + S (3)
AHS + HS  E + S + S (4)
E + S + S (4)
Se assumiamo che la terza reazione sia il passo limitante la velocità e che la quantità totale di siti S sia costante (So), possiamo usare un bilancio di massa approssimativo:
(So) ~ (S) + (AS) + (HS) (5)
e l'assunzione di quasi-equilibrio sui passi (1) - (2) per ottenere un'espressione cinetica teorica:
r = k (H2)1/2 (A) (So)2 [1 + K1 (A) + K21/2 (H2)1/2]-2 (6)
dove k è una costante di velocità, K è una costante di equilibrio, "1" rappresenta per la prima reazione, "2" per la seconda reazione, e (H2), (A) e (So) sono le concentrazioni di ciascuna delle componenti. Si noti che nel bilancio di massa approssimativo assumiamo che (S), (HS) e (AS) >> (AHS). Si noti inoltre che (So) è una costante finché il numero totale di siti metallici rimane lo stesso. Quando il numero di siti metallici diminuisce rispetto al tempo, diciamo che il catalizzatore "si disattiva"; quando aumenta, il catalizzatore "si attiva". In questa reazione, la disattivazione può essere causata da una reazione collaterale con questa stechiometria:
a C2H4  (CH)2a + a H2 (7)
(CH)2a + a H2 (7)
Il prodotto polimerico (CH)2a ("coke") è troppo pesante ("a" è grande) per desorbire dai siti metallici, e quindi questi siti metallici vengono effettivamente rimossi dai catalizzatori. 4 Tuttavia, le successive condizioni di reazione possono causare la rottura del coke, "riattivando" così il catalizzatore.
Per queste cinetiche, è evidente che per basse concentrazioni di etilene la velocità è di primo ordine in etilene, mentre per alte concentrazioni di etilene, la velocità di reazione è di -1 ordine. I valori comparabili per l'ordine dell'idrogeno sono da 0,5 a -0,5. Espressioni di velocità di questo tipo (comuni anche nelle reazioni catalizzato da enzimi) sono chiamate "Langmuir-Hinshelwood". Poiché la costante di equilibrio K 1 èdipendente dalla temperatura, questa espressione di velocità ci dice che l'ordine m per l'etilene in un'espressione di velocità "legge di potenza" del tipo:
r = k (A)m (H2)n (8)
cambierà con la temperatura. La maggior parte delle espressioni di velocità regredite dai dati sperimentali sono del tipo "legge di potenza", come si vede nei libri di testo standard sulla cinetica chimica. 5
Di seguito è riportato uno schema semplificato del sistema di reattori (Fig. 1). Molte delle valvole e dei componenti sono etichettati sul reattore. Il reattore è un tubo d'acciaio contenuto all'interno di un bagno di sabbia. Il bagno di sabbia viene fluidizzato utilizzando aria e riscaldato da riscaldatori a resistenza metallica. Una grande quantità di calore può essere trasferita rapidamente al reattore dell'impianto pilota.
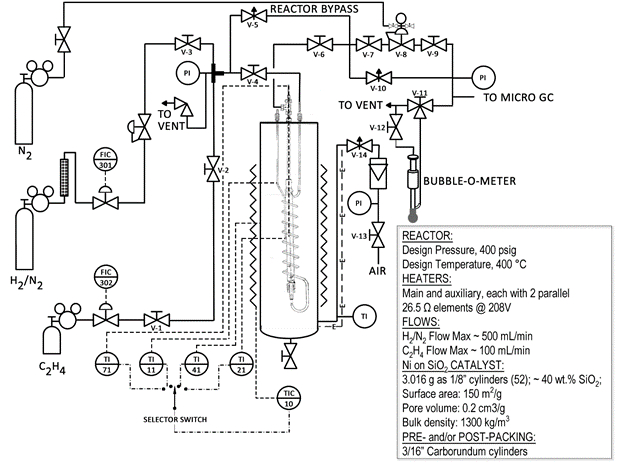
Figura 1: Schema del sistema di reattori catalitici
Sono state prese precauzioni per rendere questo un sistema sicuro. Ci sono valvole di sicurezza sul sistema, uno spegnimento ad alta temperatura e viene utilizzato solo idrogeno diluito (vedere la scheda tecnica sul cilindro). Tuttavia, con qualsiasi sistema di reazione, è necessario il rigoroso rispetto delle procedure di sicurezza. Il limite inferiore di esplosione dell'idrogeno nell'aria è di 4,0 vol. 6 Per questo motivo, è importante assicurarsi che il reattore non perda idrogeno nel bagno di sabbia circostante. A tale scopo è disponibile un rilevatore di perdite di gas combustibile CGD900.
Il catalizzatore utilizzato in questa dimostrazione (2,0 g) utilizza il nichel come componente attivo ma è circa il 40% in peso di silice (SiO2). La silice è chiamata "supporto" per il nichel e il suo scopo è quello di fornire un'ampia superficie per il nichel da coprire. Un materiale inerte, il carburo di silicio (SiC), viene utilizzato per riempire il resto del reattore. Il catalizzatore ha una superficie = 150 m2/g, volume dei pori = 0,2 cm3/g e una densità apparente di ~1300 kg/m3.
Il reattore ideale più vicino a un reattore catalitico a letto imballato è un PFR. L'analisi non mentale del reattore esula dallo scopo di questo esperimento. Il bilancio di massa PFR che utilizza il peso del catalizzatore come variabile indipendente e la conversione frazionaria come variabile dipendente diventa:
 (9)
(9)
dove fA è la conversione frazionaria del reagente limitante, "f" sta per condizioni finali (uscita), W è il peso del catalizzatore, FAo la portata molare di alimentazione di A e r' è l'espressione della velocità su base per wt. Come mettere r' in termini di fA solo per un gas ideale è coperto in uno qualsiasi dei riferimenti cinetici standard. 3 Si noti che ci saranno due classi di dati, una classe con limitazione dell'etilene e l'altra con limitazione dell'idrogeno, ma ci può essere solo un'espressione di velocità comune. La conversione frazionaria può essere trovata analizzando sia il gas di alimentazione che quello di prodotto con un gascromatografo. Attraverso la chiusura del bilancio di massa, la velocità della reazione può essere trovata e confrontata con l'energia di attivazione nominale per questo tipo di reazione catalitica. Si possono anche confrontare gli ordini della reazione.
Procedura
Il sistema è controllato attraverso un sistema di controllo distribuito commerciale; c'è solo un'interfaccia operatore.
1. Avvio del reattore
- Per avviare la visualizzazione della cronologia dei processi in tempo reale, passare a Start > DeltaV > Operator > Process History View, quindi aprire CATUnitOverview. Le scale dei grafici possono essere compresse o espanse facendo clic su tali pulsanti sulla barra dei menu. Le procedure per scaricare i dati dal sistema di controllo in un foglio di calcolo Excel sono disponibili sul computer.
- Assicurati che l'aria al bagno di sabbia sia accesa. Il rotametro dovrebbe leggere ≈5 o superiore ed essere tenuto costante da una corsa all'altra per fornire un riscaldamento costante.
- Abilitare l'alimentazione principale del riscaldatore a bagno di sabbia premendo il pulsante START di colore nero sulla scheda del pannello dell'unità CAT.
- Impostare il regolatore di temperatura (TIC-10, per il bagno di sabbia) sul set point iniziale desiderato, la modalità su AUTO. Per utilizzare il riscaldamento rapido all'inizio dell'esperimento, fare riferimento all'Appendice A.
- Le temperature possono essere monitorate sul grafico. La portata degli effluenti del reattore deve essere controllata periodicamente. Se si sviluppano problemi, come la perdita di flusso o la temperatura di fuga, arrestare entrambi i flussi reagenti utilizzando valvole di intercettazione appropriate e spegnere tutti i riscaldatori. Lasciare l'aria del bagno di sabbia accesa.
2. Imposta le portate
Impostare le portate prima del riscaldamento. Saranno fornite tarature per i due regolatori di flusso - FIC-301 per la miscela idrogeno-azoto e FIC-302 per l'etilene.
- Impostare il valore digitale sull'interfaccia che indica se il computer o la scheda del pannello verrà utilizzato su 1 per indicare l'utilizzo del computer.
- Bloccare la riga di esempio GC.
- Determinare la portata volumetrica cronometrando la velocità di aumento di una singola bolla tra due volumi in un misuratore di bolle. Un misuratore di bolle è un buretto di vetro con volumi graduati. Assicurarsi che la linea di campionamento GC sia bloccata quando il misuratore di bolle viene utilizzato attivamente per misurare il flusso (calibrazione, controllo della portata di uscita).
- Prendi almeno un campione del mangime attraverso il bypass (un campione in bianco) per verificarne la composizione. Va bene cambiare le portate al volo senza bypassare il reattore. La modifica delle portate modifica anche le concentrazioni relative dell'alimentazione (la pressione è costante), quindi le portate dovranno essere modificate spesso.
- Sbloccare la linea di campionamento GC e fare scorrere i reagenti attraverso il bypass del reattore e nella porta di ingresso GC.
- Utilizzare un gascromatografo per analizzare la composizione del prodotto gassoso. Ulteriori istruzioni sono incluse nell'Appendice B su come utilizzare il GC e determinare la composizione.
3. Spegnimento del reattore
- Spegnere l'alimentazione principale del riscaldatore del bagno di sabbia spingendo l'EMERG rosso. Pulsante STOP sul pannello dell'unità CAT.
- Posizionare TIC-10 in modalità MAN e impostare l'output su 0%. Impostare l'alimentazione ausiliaria (se attivata) su 0%.
- Impostare il flusso di etilene su 0% inserendo il controller in MAN e impostando l'uscita su 0%.
- Spegnere entrambe le valvole di blocco dell'etilene prima del tee di miscelazione e spegnere la valvola principale della bombola del gas.
- Lasciare scorrere idrogeno / azoto per ~ 2 minuti prima di spegnersi; questo prolungherà la vita del catalizzatore.
- Bloccare entrambe le valvole prima del tee di miscelazione. Quindi chiudere la valvola principale per la miscela idrogeno/azoto.
- Lasciare l'aria al letto fluidizzato acceso.
Risultati
La regressione non lineare per ottenere le migliori stime (usando Eqs. 8 - 9) degli ordini di reazione m e n, e la costante di velocità k, può essere noiosa. Tale algoritmo di soluzione richiede un'integrazione numerica per punto dati per iterazione di m e n, portando a molte migliaia di integrazioni numeriche. Una tecnica alternativa che è quasi altrettanto buona, ma molto meno costosa dal punto di vista computazionale, è quella di formulare coppie di prova di m, n basate sulla struttura di Eq. 6. Qualsiasi valore all'interno dell'intervallo degli ordini teorici è certamente possibile. Quindi formulare una funzione oggettiva del tipo:
 (10)
(10)
Questa funzione obiettivo per ogni coppia m, n può essere calcolata e la migliore misura determinata usando il suo minimo o quasi minimo insieme ad altri criteri di adattamento standard, come la casualità degli errori in Eq. 10 in funzione delle pressioni parziali. Si noti inoltre che Eq. 9 prevede che un grafico dell'integrale del lato sinistro (chiamatelo "Y") vs. 1/FAo (chiamatelo "X") dovrebbe essere lineare all'ottimale m, n. Verificare il grado di linearità e la casualità degli errori di questa formulazione è anche un metodo valido per determinare la bontà dell'adattamento.
Alcuni dati presi a P = 1 atm, T = 80°C, PC2H4 = 0,17-0,42 atm, PH2 = 0,23-0,33 atm (azoto come diluente) sono stati analizzati come descritto sopra. Il grafico lineare della cinetica "best fit" è mostrato nella Figura 2. Diverse altre coppie m, n sono state esaminate in modo simile e si è scoperto che danno adattamenti lineari più poveri. I valori di adattamento migliore di m e n suggeriscono che l'etilene è debolmente adsorbito sul catalizzatore di nichel (nessuna inibizione nel denominatore di Eq. 6), mentre l'idrogeno è fortemente adsorbito (l'ordine negativo denota inibizione). Per la maggior parte delle reazioni catalitiche, un adsorbimento troppo forte è altrettanto grave quanto un adsorbimento troppo debole, sebbene "troppo forte" si rifletta in un ordine di reazione negativo, mentre "troppo debole" si riflette in conversioni basse e una piccola costante di velocità k.

Figura 2. Analisi cinetica dell'idrogenazione dell'etilene a 80°C, 1 atm per catalizzatore Ni al 60% in peso. La "a" indica i dati in cui C2H4 è il reagente limitante, mentre "b" denota H2 come reagente limitante.
Entrambi i valori di adattamento migliore di m e n rientrano nell'intervallo di aspettative basato sull'equazione (6). Il valore di "m" è al suo massimo, quindi la reazione non è controllata dalla diffusione. Per una reazione controllata dalla diffusione sia "m" che "n" sarebbero vicini allo zero. Gli ordini sperimentali possono talvolta rispondere alla domanda tra controllato cineticamente e controllato a diffusione, ma se entrambi gli ordini fossero vicini allo zero nulla potrebbe essere dimostrato, perché lo zero rientra nell'intervallo di possibili ordini basati sull'equazione (6). Una prova delle affermazioni di cui sopra esula dallo scopo di questo esperimento.
Applicazione e Riepilogo
Il metodo qui descritto è chiamato "Metodo Integrale" nella maggior parte dei libri sulla cinetica e sulla progettazione del reattore. 3 Mentre è matematicamente molto più difficile da applicare rispetto ai metodi differenziali, è anche meglio adattato per analizzare i tipi di dati che sono facili da ottenere nella maggior parte dei sistemi di reattori su scala pilota, dove le pressioni parziali del reagente e del prodotto e le conversioni frazionarie possono variare su ampi intervalli. Poiché non ci affidiamo a reattori batch o a conversioni a basso reagente, tali "dati integrali" sono anche più accurati e rilevanti per lo scaleup. La prima parte del metodo consiste nel convertire i dati grezzi delle misurazioni del flusso e della composizione in conversione frazionaria rispetto allo spazio-tempo (il lato destro dell'equazione 9 è spesso chiamato spazio-tempo). Il passo successivo è quello di postulare ordini di reazione ragionevoli per i reagenti (e talvolta i prodotti) che influenzano la velocità. Il passo finale consiste nel confrontare il maggior numero possibile di insiemi di ordini usando Equazione (10), o la relazione di linearità in Equazione (9), e scegliere l'insieme che si adatta meglio a tutti i dati.
Quasi tutti i catalizzatori metallici supportati possono catalizzare l'idrogenazione dell'etilene in un certo intervallo di temperatura, e l'attività del catalizzatore, la selettività (all'etano) e la stabilità (resistenza alla cokeria) sono importanti descrittori dell'utilità di un potenziale catalizzatore metallico. Anche gli ordini cinetici della reazione sono descrittori importanti. Indicano i punti di forza di adsorbimento relativi di un idrocarburo rispetto all'idrogeno e se i tassi del catalizzatore potrebbero essere limitati dalla diffusione del reagente o del prodotto (nel qual caso, si trovano ordini vicini allo zero). Gli ordini possono anche suggerire se le ipotesi fatte nel derivare l'equazione 6 (ad esempio, un singolo passo limitante la velocità che è la reazione superficiale) sono anche corrette in primo luogo. Di solito conoscere l'espressione della velocità sperimentale è insufficiente per determinare il meccanismo corretto da solo, ma se l'espressione della velocità sperimentale è incoerente con un meccanismo di reazione proposto, allora quest'ultimo è certamente errato. Nell'esempio qui riportato, la cinetica osservata è coerente con il meccanismo proposto e il passo di limitazione del tasso, dando credito al meccanismo.
Con solo un leggero adattamento, i "metodi integrali" qui descritti sono stati utilizzati per determinare le espressioni di velocità per molte importanti reazioni catalitiche industriali. Queste espressioni di tasso sono state poi utilizzate per scalare questi processi a scale di tonnellaggio. Alcuni esempi ben noti includono il reforming a vapore del metano per generare H2, l'ossidazione dell'o-xilene in anidride ftalica e la sintesi dell'ammoniaca. 6 In questi casi, le espressioni di velocità per centinaia di catalizzatori candidati potrebbero essere calcolate, spesso a più temperature.
Per quanto riguarda le reazioni catalitiche sui metalli supportati, costituiscono alcune delle più importanti reazioni catalitiche industriali, tra cui la catalisi dei gas di scarico automobilistici (una combinazione di ossidazione del monossido di carbonio, ossidazione degli idrocarburi incombusti e riduzione dell'ossido nitrico), il reforming degli idrocarburi lineari a catena ramificata per aumentare il numero di ottani di vari combustibili e il reforming del vapore. Per il primo di questi il metallo attivo è solitamente una lega platino-palladio, per il secondo è platino o una lega di platino come il platino-renio, e per il terzo è nichel. 7 Anche altri metalli come rame, argento, oro e rodio trovano applicazione, da soli o come leghe con altri metalli.
APPENDICE A – Istruzioni per il riscaldatore ausiliario
Per un riscaldamento rapido, accendere il riscaldatore ausiliario (uscita ≤ 90%), ma assicurarsi di spegnerlo quando la temperatura della pelle o della parete esterna si avvicina alla temperatura desiderata del reattore; il riscaldatore ausiliario non è controllato in questo momento e il raffreddamento (≈10 °C/h) richiede molto più tempo del riscaldamento. La temperatura del reattore può ritardare significativamente la temperatura del riscaldatore. La termocoppia cutanea può essere selezionata come input per TIC-10. La temperatura massima da utilizzare in qualsiasi esperimento è di 200°C. Una spia "CRITICA" avvisa l'utente di temperature elevate. Il sistema di controllo monitora sia il bagno di sabbia che le temperature del reattore ed entrambi sono programmati per allarmare e spegnere i riscaldatori quando sono troppo alti.
APPENDICE B – Istruzioni per l'uso del cromatografo
Il MicroGC è controllato dal computer. Il metodo GC predefinito è "cooling-1". Per gli esperimenti, metodo di carico "PH-CAT4". Fare clic su Controllo → metodo di download. Visualizzare lo stato dello strumento facendo clic su Controllo → stato dello strumento. Non è possibile eseguire un'esecuzione finché tutti i parametri in Stato strumento non sono vicini ai punti impostati.
Quando si è pronti per eseguire un'esecuzione, fare clic su Controlla → singola esecuzione. Un menu a comparsa richiederà di inserire un ID di esempio, un file di dati e un nome del risultato. Per "File di dati", fai clic sulla punta della freccia a destra e seleziona Data e ora. Dopo averlo fatto, la schermata sarà nel campo e la data e l'ora saranno allegate ai nomi dei file. Per "Risultati", fai clic sulla punta della freccia a destra e seleziona ID campione, quindi ripeti selezionando Data e ora, quindi ripeti selezionando Incrementa numero. Tornare al campo e inserire un unico spazio vuoto tra il primo e il secondo elemento e il secondo e il terzo elemento. Per "Numero di ripetizioni" immettere il numero di analisi ripetute sequenziali desiderate. Ora fai clic su "Start". Appariranno trame in tempo reale per entrambi i canali A e B, che mostrano i cromatogrammi mentre vengono generati. H2 e N2 sono rilevati sul canale A, mentre H2, CH4, C2H4e C2H6 sono rilevati sul canale B. Attualmente, tuttavia, il metodo è stato calibrato solo per etilene ed etano. Quando tutte le ripetizioni sono complete, NON SALVATE IL METODO. Si aprirà la finestra Sequenza di risultati, che consente l'accesso ai risultati.
Per visualizzare i risultati, selezionare la finestra Sequenza di risultati, fare clic con il pulsante destro del mouse (ad esempio) sulla prima cella del numero di esecuzione, scegliere Seleziona record. Nel menu in alto selezionare Report → Visualizza area → %. Apparirà un rapporto con i composti noti.
Il GC registrerà in Area%. Per calcolare la conversione (A = area%): (11)
(11)
È anche possibile calcolare la conversione misurando la portata del prodotto con il misuratore di bolle, e questo può servire come controllo sui risultati GC. Assumendo un gas ideale e nessuna reazione diversa dall'idrogenazione dell'etilene, la seguente equazione può essere derivata usando una tavola stechiometrica:3 (12)
(12)
Dove FT0 è la portata volumetrica totale dell'alimentazione, FT è la portata volumetrica totale del flusso di prodotto misurata dal misuratore di bolle e 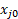 è la frazione mol o volumetrica di qualsiasi sia il reagente limitante.
è la frazione mol o volumetrica di qualsiasi sia il reagente limitante.
Riferimenti
- O. Beeck, Discuss. Faraday Soc.8, 118 (1950).
- J.B. Butt, AIChE J22, 1 (1976).
- H.S. Fogler, "Elements of Chemical Reaction Engineering," 4th Ed., Prentice-Hall, Upper Saddle River, NJ, 2006, Ch. 2-4; O. Levenspiel, "Chemical Reaction Engineering," 3rd Ed., John Wiley, New York, 1999, Ch. 4-6; C.G. Hill, Jr. and T.W. Root, "Introduction to Chemical Engineering Kinetics and Reactor Design," 2nd Ed., John Wiley, New York, 2014, Ch. 8.
- B. Peri, Discuss. Faraday Soc., 41, 121 (1966).
- Basic chemical kinetics - Fogler, Ch. 3, Levenspiel, Ch. 2, Hill and Root, Ch. 3.
- N. Bartknecht, "Explosions: Course, Prevention, Protection", Springer-Verlag, 1981.
- G.F. Froment, K.B. Bischoff and J. De Wilde, "Chemical Reactor Analysis and Design," 3rd Ed., John Wiley, Hoboken, Ch. 11.
- J.R.H. Ross, "Heterogeneous Catalysis: Fundamentals and Applications," Elsevier, Amsterdam, 2012, Ch. 8.
Vai a...
Video da questa raccolta:

Now Playing
Reattore catalitico: Idrogenazione dell'etilene
Chemical Engineering
30.3K Visualizzazioni

Verifica dell'efficienza del trasferimento di calore di uno scambiatore di calore a tubi alettati
Chemical Engineering
17.9K Visualizzazioni

Utilizzo di un essiccatore a vassoio per studiare il trasferimento di calore convettivo e conduttivo
Chemical Engineering
43.9K Visualizzazioni

Viscosità delle soluzioni di glicole propilenico
Chemical Engineering
32.6K Visualizzazioni

Porosimetria della polvere di silicato di alluminio
Chemical Engineering
9.6K Visualizzazioni

Dimostrazione del modello Power Law per estrusione
Chemical Engineering
10.0K Visualizzazioni

Assorbitore di gas
Chemical Engineering
36.5K Visualizzazioni

Equilibrio vapore-liquido
Chemical Engineering
88.3K Visualizzazioni

L'effetto del rapporto di riflusso sull'efficienza della distillazione dei vassoi
Chemical Engineering
77.6K Visualizzazioni

Efficienza di estrazione liquido-liquido
Chemical Engineering
48.4K Visualizzazioni

Reattore in fase liquida: inversione del saccarosio
Chemical Engineering
9.6K Visualizzazioni

Cristallizzazione dell'acido salicilico mediante modificazione chimica
Chemical Engineering
24.2K Visualizzazioni

Flusso monofase e bifase in un reattore a letto impaccato
Chemical Engineering
18.9K Visualizzazioni

Cinetica di polimerizzazione per addizione al polidimetilsilossano
Chemical Engineering
16.1K Visualizzazioni

Valutazione del trasferimento di calore di uno Spin-and-Chill
Chemical Engineering
7.3K Visualizzazioni