Reator Catalítico: Hidrogenação de etileno
Visão Geral
Fonte: Kerry M. Dooley e Michael G. Benton, Departamento de Engenharia Química, Louisiana State University, Baton Rouge, LA
A hidrogenação do etileno (C2H4) ao etano (C2H6) tem sido frequentemente estudada como uma reação de redução de modelo na caracterização de novos catalisadores metálicos. 1-2 Embora o níquel suportado não seja o catalisador metálico mais ativo para esta reação, é ativo o suficiente para que a reação possa ocorrer a < 200°C.
A reação normalmente envolve adsorbed, hidrogênio dissociado (H2) reagindo com etileno adsorte. Em outras palavras, tanto os átomos de hidrogênio quanto as moléculas de etileno formam ligações com um local de metal (aqui denotado "S"). A forte ligação do etileno com S enfraquece a ligação dupla o suficiente para permitir que os átomos de hidrogênio adicionem ao etileno, formando etano, que não é adsorvida.
O objetivo deste experimento é, em primeiro lugar, converter medidas de composição bruta para limitar conversões fracionárias reagentes. 3 Essas conversões podem então ser usadas em um reator de fluxo de plug-flow (PFR) para encaixar os dados em um modelo de cinética padrão de lei de energia pelo "Método Integral". 3 Uma comparação das ordens experimentais de reação para etileno e hidrogênio com as ordens teóricas revela neste caso que a reação é cineticamente controlada em vez de controlada por transferência de massa.
Princípios
Um mecanismo para a reação (deixando A = etileno, E = etano e S = um local de metal) pode ser escrito como:2
A + S  AS (1)
AS (1)
H2 + 2 S  HS + HS (2)
HS + HS (2)
AS + HS  AHS + S (3)
AHS + S (3)
AHS + HS  E + S + S (4)
E + S + S (4)
Se assumirmos que a terceira reação é a etapa limitante da taxa, e que a quantidade total de sites S é constante (So), podemos usar um equilíbrio de massa aproximado:
(So) ~ (S) + (AS) + (HS) (5)
e a suposição quase-equilíbrio nos passos (1) - (2) para obter uma expressão cinética teórica:
r = k (H2)1/2 (A) (So)2 [1 + K1 (A) + K21/2 (H2)1/2]-2 (6)
onde k é uma constante de taxa, K é uma constante de equilíbrio, "1" representa para a primeira reação, "2" para segunda reação, e (H2), (A) e (So) são as concentrações de cada um dos componentes. Note que no equilíbrio de massa aproximado assumimos que (S), (HS) e (AS) >> (AHS). Observe também que (So) é uma constante, desde que o número total de sites de metal permaneça o mesmo. Quando o número de sites metálicos diminui em relação ao tempo, dizemos que o catalisador "desativa"; quando aumenta, o catalisador "ativa". Nesta reação, a desativação pode ser causada por uma reação lateral com esta estequiometria:
a C2H4  (CH)2a + a H2 (7)
(CH)2a + a H2 (7)
O produto polímero (CH)2a ("coque") é muito pesado ("a" é grande) para desorb dos locais de metal, e assim esses locais de metal são efetivamente removidos dos catalisos. 4 No entanto, as condições de reação subsequentes podem fazer com que a coque se quebre, "reativando" o catalisador.
Para essas cinéticas, é evidente que para baixas concentrações de etileno a taxa é de primeira ordem no etileno, enquanto para altas concentrações de etileno, a taxa de reação é de -1 ordem. Os valores comparáveis para a ordem do hidrogênio são de 0,5 a -0,5. Expressões de taxa deste tipo (também comuns em reações enzimizadas) são chamadas de "Langmuir-Hinshelwood". Uma vez que o equilíbrio constante K1 é dependente da temperatura, esta expressão de taxa nos diz que a ordem mme para etileno em uma expressão de taxa de "poder-lei" do tipo:
r = k (A)m (H2)n (8)
vai mudar com a temperatura. A maioria das expressões de taxa regredidas de dados experimentais são do tipo "poder-lei", como visto em livros didáticos padrão sobre cinética química. 5
Um esquema simplificado do sistema do reator (Fig. 1) é mostrado abaixo. Muitas das válvulas e componentes estão rotulados no reator. O reator é um tubo de aço contido dentro de um banho de areia. O banho de areia é fluidizado usando ar e aquecido por aquecedores de resistência metálica. Uma grande quantidade de calor pode ser transferida rapidamente para o reator de planta piloto.
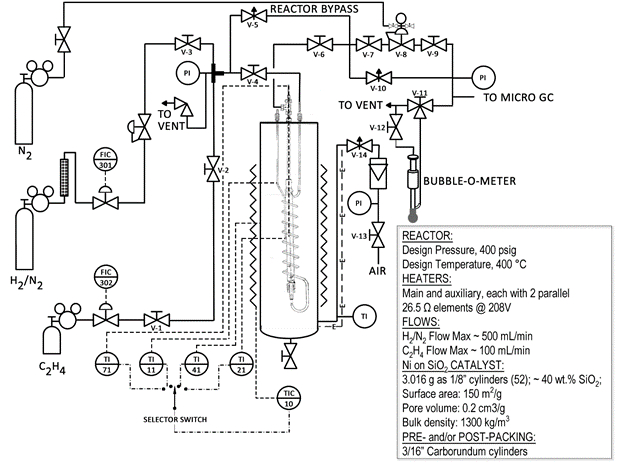
Figura 1: Esquema do Sistema de Reator Catalítico
Precauções foram tomadas para tornar este um sistema seguro. Existem válvulas de alívio no sistema, um desligamento de alta temperatura, e apenas hidrogênio diluído (ver folha de especificações no cilindro) é usado. No entanto, com qualquer sistema de reação, é necessária uma adesão rigorosa aos procedimentos de segurança. O menor limite de explosão de hidrogênio no ar é de 4,0 vol%. 6 Por essa razão, é importante garantir que o reator não esteja vazando hidrogênio para o banho de areia ao redor. Um detector de vazamento de gás combustível CGD900 está disponível para este fim.
O catalisador usado nesta demonstração (2,0 g) utiliza níquel como componente ativo, mas é aproximadamente 40 wt% de sílica (SiO2). A sílica é chamada de "suporte" para o níquel, e seu objetivo é fornecer uma grande área de superfície para o níquel cobrir. Um material inerte, carboneto de silício (SiC), é usado para encher o resto do reator. O catalisador tem área de superfície = 150 m2/g, volume de poros = 0,2 cm3/g, e uma densidade a granel de ~1300 kg/m3.
O reator ideal mais próximo de um reator catalítico de cama embalado é um PFR. A análise do reator não-natural está além do escopo deste experimento. O equilíbrio de massa pfr utilizando o peso catalisador como variável independente e conversão fracionada à medida que a variável dependente se torna:
 (9)
(9)
onde fA é a conversão fracionária do reagente limitante, "f" significa condições finais (saída), W é o peso catalisador, FAo a taxa de fluxo molar de alimentação de A, e r' é a expressão de taxa em uma base por wt. Como colocar r' em termos de fA apenas para um gás ideal é coberto em qualquer uma das referências cinéticas padrão. 3 Note que haverá duas classes de dados, uma classe com limitação de etileno e outra com limitação de hidrogênio, mas só pode haver uma expressão de taxa comum. A conversão fracionada pode ser encontrada analisando tanto a alimentação quanto o gás do produto com um cromatógrafo a gás. Ao fechar o equilíbrio de massa, a taxa da reação pode ser encontrada e comparada com a energia de ativação nominal para este tipo de reação catalítica. Pode-se também comparar as ordens da reação.
Procedimento
O sistema é controlado através de um sistema comercial de controle distribuído; há apenas uma interface de operador.
1. Inicialização do reator
- Para iniciar a exibição do histórico de processos em tempo real, navegue até Iniciar > > Do Operador > DeltaV > exibição de histórico de processos e, em seguida, abra o CATUnitOverview. As escalas do gráfico podem ser compactadas ou expandidas clicando nesses botões na barra de menu. Procedimentos para baixar dados do sistema de controle para uma planilha do Excel estão disponíveis no computador.
- Certifique-se de que o ar para o banho de areia está ligado. O rotador deve ler ≈5 ou superior e ser mantido constante da corrida para funcionar para fornecer um aquecimento consistente.
- Habilite a potência principal do aquecedor de banho de areia pressionando o botão START de cor preta na placa do painel da unidade CAT.
- Ajuste o controlador de temperatura (TIC-10, para o banho de areia) ao ponto de ajuste inicial desejado, modo para AUTO. Para usar o aquecimento rápido no início do experimento, consulte o apêndice A.
- As temperaturas podem ser monitoradas no gráfico. A vazão do efluente do reator deve ser verificada periodicamente. Se problemas, como perda de fluxo ou temperatura descontrolada se desenvolverem, desligue ambos os fluxos reagentes usando válvulas de desligamento apropriadas e desligue todos os aquecedores. Deixe o ar de banho de areia ligado.
2. Definir taxas de fluxo
Defina as taxas de fluxo antes do aquecimento. Calibrações para os dois controladores de fluxo - FIC-301 para a mistura hidrogênio-nitrogênio e FIC-302 para etileno - serão fornecidas.
- Defina o valor digital na interface que designa se o computador ou a placa do painel serão usados para 1, a fim de indicar o uso do computador.
- Bloqueie a linha de amostragem gc.
- Determine a taxa de fluxo volumoso cronometrando a taxa de elevação de uma única bolha entre dois volumes em um medidor de bolhas. Um medidor de bolhas é um burete de vidro com volumes graduados. Certifique-se de que a linha de amostragem GC está bloqueada quando o medidor de bolha estiver sendo usado ativamente para medir o fluxo (calibração, verificando a taxa de fluxo de saída).
- Pegue pelo menos uma amostra da alimentação através do bypass (uma amostra em branco) para verificar sua composição. Tudo bem mudar as taxas de fluxo na mosca sem contornar o reator. A alteração das taxas de fluxo também altera as concentrações relativas da alimentação (a pressão é constante), por isso as taxas de fluxo precisarão ser alteradas com frequência.
- Desbloqueie a linha de amostragem GC e flua os reagentes através do bypass do reator e para a porta de entrada GC.
- Use um cromatógrafo a gás para analisar a composição do produto do gás. Outras instruções estão incluídas no Apêndice B sobre como operar o GC e determinar a composição.
3. Desligamento do reator
- Desligue a energia principal do aquecedor de banho de areia empurrando o EMERG vermelho. Botão STOP na placa do painel da unidade CAT.
- Coloque o TIC-10 no modo MAN e ajuste a saída para 0%. Definir potência auxiliar (se ligado) para 0%.
- Ajuste o fluxo de etileno para 0% colocando o controlador em MAN e definindo a saída para 0%.
- Desligue ambas as válvulas de bloco de etileno antes que a caixa de mistura e desligue a válvula principal do cilindro de gás.
- Deixe o hidrogênio/nitrogênio fluir por ~2 minutos antes de desligar; isso prolongará a vida do catalisador.
- Bloqueie ambas as válvulas antes da mistura. Em seguida, desligue a válvula principal para a mistura hidrogênio/nitrogênio.
- Deixe o ar para a cama fluidizada.
Resultados
A regressão não linear para obter as melhores estimativas (usando Eqs. 8 - 9) das ordens de reação m e n, e a taxa constante k, pode ser tediosa. Tal algoritmo de solução requer uma integração numérica por ponto de dados por iteração de m e n, levando a milhares de integrações numéricas. Uma técnica alternativa que é quase tão boa, mas muito menos computacionalmente cara, é formular pares de ensaios de m, n com base na estrutura do Eq. 6. Qualquer valor dentro do alcance das ordens teóricas é certamente possível. Em seguida, forme uma função objetiva do tipo:
 (10)
(10)
Esta função objetiva para cada m, n par pode ser calculada, e o melhor ajuste determinado usando seu mínimo ou quase mínimo, juntamente com outros critérios de ajuste padrão, como a aleatoriedade dos erros em Eq. 10 em função das pressões parciais. Observe também que Eq. 9 prevê que um enredo da parte esquerda integral (chame-o de "Y") vs. 1/FAo (chame-o de "X") deve ser linear no m, n. Verificar o grau de linearidade e a aleatoriedade dos erros desta formulação também é um método válido para determinar a bondade do ajuste.
Alguns dados tomados em P = 1 atm, T = 80°C, PC2H4 = 0,17-0,42 atm, PH2 = 0,23-0,33 atm (nitrogênio como diluente) foram analisados conforme descrito acima. A trama linear da cinética "melhor ajuste" é mostrada na Figura 2. Vários outros pares m, n também foram examinados de forma semelhante e encontrados para dar ataques lineares mais pobres. Os melhores valores de ajuste de m e n sugerem que o etileno é fracamente adsorvida no catalisador de níquel (sem inibição no denominador de Eq. 6), enquanto o hidrogênio é fortemente adsorvido (a ordem negativa denota inibição). Para a maioria das reações catalíticas, uma adsorção muito forte é tão ruim quanto uma adsorção muito fraca, embora "muito forte" seja refletida em uma ordem de reação negativa, enquanto "muito fraco" é refletido em conversões baixas e uma pequena taxa constante k.

Figura 2. Análise cinética da hidrogenação de etileno a 80°C, 1 atm para catalisador ni de 60 wt%. O "a" denota dados onde C2H4 é o reagente limitante, enquanto "b" denota H2 como o reagente limitante.
Ambos os melhores valores de ajuste de m e n estão dentro do intervalo de expectativas com base na Equação (6). O valor de "m" está no seu máximo, portanto a reação não é controlada por difusão. Para uma reação controlada por difusão, tanto "m" quanto "n" seriam próximas de zero. As ordens experimentais às vezes podem responder à pergunta de kineticamente controlada vs. controlada por difusão, mas se ambas as ordens estavam perto de zero nada poderia ser provado, porque zero está dentro do intervalo de possíveis ordens com base na Equação (6). Uma prova das declarações acima está além do escopo deste experimento.
Aplicação e Resumo
O método descrito aqui é chamado de "Método Integral" na maioria dos livros sobre cinética e design de reator. 3 Embora seja matematicamente muito mais difícil de aplicar do que métodos diferenciais, também é melhor adaptado para analisar os tipos de dados que são fáceis de obter na maioria dos sistemas de reator em escala piloto, onde as pressões parciais do reagente e do produto e conversões fracionadas podem variar em grandes faixas. Como não estamos confiando em reatores em lote ou conversões de baixos reagentes, tais "dados integrais" também são mais precisos e relevantes para a scaleup. A primeira parte do método é converter os dados brutos das medidas de fluxo e composição em conversão fracionária versus espaço-tempo (o lado direito da Equação 9 é frequentemente chamado de tempo espacial). O próximo passo é postular ordens de reação razoáveis para os reagentes (e às vezes produtos) que afetam a taxa. O passo final é comparar o maior número possível de pedidos usando Equação (10), ou a relação de linearidade na Equação (9), e escolher o conjunto dando o melhor ajuste a todos os dados.
Quase qualquer catalisador metálico suportado pode catalisar a hidrogenação do etileno sobre alguma faixa de temperatura, e a atividade catalisadora, seletividade (para etano) e estabilidade (resistência ao coque) são descritores importantes da utilidade de um potencial catalisador de metais. As ordens cinéticas da reação também são descritores importantes. Eles indicam os pontos fortes relativos adsortivos de um hidrocarboneto versus hidrogênio, e se as taxas do catalisador podem ser limitadas por reações ou difusão do produto (nesse caso, ordens próximas a zero são encontradas). As ordens também podem sugerir se as suposições feitas na Equação 6 (por exemplo, uma única etapa limitante de taxa que é a reação superficial) estão mesmo corretas em primeiro lugar. Geralmente saber a expressão da taxa experimental é insuficiente para determinar o mecanismo correto por si só, mas se a expressão da taxa experimental é inconsistente com um mecanismo de reação proposto, então este último é certamente incorreto. No exemplo aqui dado, a cinética observada é consistente com o mecanismo proposto e a etapa limitante de taxas, dando alguma credibilidade ao mecanismo.
Com apenas uma leve adaptação, os "métodos integrais" aqui descritos têm sido utilizados para determinar as expressões de taxa para muitas reações catalíticas industriais importantes. Essas expressões de taxa têm sido então usadas para escalar esses processos para escalas de tonelagem. Alguns exemplos bem conhecidos incluem a reforma a vapor do metano para gerar H2, a oxidação do o-xileno ao anidrido ftálico, e a síntese de amônia. 6 Nesses casos, as expressões de taxa para centenas de catalisadores candidatos podem ser computadas, muitas vezes a múltiplas temperaturas.
Quanto às reações catalíticas sobre metais apoiados, constituem algumas das reações catalíticas industriais mais importantes, incluindo a catálise de exaustão automotiva (uma combinação de oxidação de monóxido de carbono, oxidação de hidrocarbonetos não queimados e redução de óxido nítrico), a reforma de hidrocarbonetos lineares para cadeia ramificada para aumentar o número de octano de vários combustíveis, e reforma de vapor. Para o primeiro deles o metal ativo é geralmente uma liga de platina-paládio, por segundo é platina ou uma liga de platina, como platina-rhenium, e para o terceiro é níquel. 7 Outros metais como cobre, prata, ouro e ródio também encontram aplicação, seja por si só ou como ligas com outros metais.
APÊNDICE A - Instruções auxiliares do aquecedor
Para um aquecimento rápido, ligue o aquecedor auxiliar (saída ≤ 90%), mas certifique-se de desligá-lo quando a temperatura da pele ou da parede externa se aproximar da temperatura desejada do reator; o aquecedor auxiliar não é controlado neste momento e o resfriamento (≈10 °C/h) leva muito mais tempo do que o aquecimento. A temperatura do reator pode atrasar significativamente a temperatura do aquecedor. O termopar da pele pode ser selecionado como a entrada para TIC-10. A temperatura mais alta a ser usada em qualquer experimento é de 200°C. Uma luz de aviso "CRÍTICA" alerta o usuário para alta temperatura. O sistema de controle monitora as temperaturas do banho de areia e do reator e ambos são programados para alarmar e desligar os aquecedores quando muito altos.
APÊNDICE B – Instruções de Operação do Cromatógrafo
O MicroGC é controlado por computador. O método GC padrão é "resfriamento-1". Para os experimentos, carregue o método "PH-CAT4". Clique em Controlar → Método de Download. Exibir o Status do instrumento clicando em Controle → Status do instrumento. Uma execução não pode ser executada até que todos os parâmetros em Status de Instrumento estejam próximos aos seus set points.
Quando estiver pronto para executar uma corrida, clique em Controlar → Única Execução. Um menu pop-up solicitará inserir um ID de exemplo, arquivo de dados e nome do resultado. Para "Arquivo de dados", clique na cabeça de seta à direita e selecione Data e Hora. Depois disso, a tela estará no campo, e a data e a hora serão anexadas aos nomes dos arquivos. Para "Resultados", clique na cabeça de seta à direita e selecione O ID da amostra e, em seguida, repita a seleção de Data e Hora e, em seguida, repita a seleção do número de incremento. Volte ao campo e insira um único espaço em branco entre o primeiro e o segundo item e o segundo e terceiro item. Para "Número de repetições" digite o número de análises repetidas sequenciais desejadas. Agora clique em "Iniciar". Gráficos ao vivo para os canais A e B aparecerão, mostrando os cromatógrafos à medida que são gerados. H2 e N2 são detectados nos canais A, enquanto H2, CH4, C2H4e C2H6 são detectados no canal B. Atualmente, no entanto, o método só foi calibrado para etileno e etano. Quando todos os representantes estiverem completos, NÃO SALVE O MÉTODO. A janela Sequência de Resultados será aberta, permitindo o acesso aos resultados.
Para ver os resultados, selecione a janela Sequência de resultados, clique com o botão direito do mouse (por exemplo) na célula de número de primeira execução, escolha Selecionar Registro. No menu superior selecione Relatórios → Exibir → Área %. Um relatório com os compostos conhecidos aparecerá.
O GC vai registrar em Área%. Para calcular a conversão (A = área%): (11)
(11)
Também é possível calcular a conversão medindo a taxa de fluxo do produto com o medidor de bolhas, e isso pode servir como uma verificação dos resultados do GC. Assumindo um gás ideal e nenhuma reações além da hidrogenação de etileno, a seguinte equação pode ser derivada usando uma tabela estequiométrica:3 (12)
(12)
Onde FT0 é a taxa de fluxo volumétrica total da alimentação, FT é a taxa de fluxo volumétrica total do fluxo do produto medida pelo medidor de bolha, e 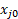 é a fração mol ou volume do que for o reagente limitante.
é a fração mol ou volume do que for o reagente limitante.
Referências
- O. Beeck, Discuss. Faraday Soc.8, 118 (1950).
- J.B. Butt, AIChE J22, 1 (1976).
- H.S. Fogler, "Elements of Chemical Reaction Engineering," 4th Ed., Prentice-Hall, Upper Saddle River, NJ, 2006, Ch. 2-4; O. Levenspiel, "Chemical Reaction Engineering," 3rd Ed., John Wiley, New York, 1999, Ch. 4-6; C.G. Hill, Jr. and T.W. Root, "Introduction to Chemical Engineering Kinetics and Reactor Design," 2nd Ed., John Wiley, New York, 2014, Ch. 8.
- B. Peri, Discuss. Faraday Soc., 41, 121 (1966).
- Basic chemical kinetics - Fogler, Ch. 3, Levenspiel, Ch. 2, Hill and Root, Ch. 3.
- N. Bartknecht, "Explosions: Course, Prevention, Protection", Springer-Verlag, 1981.
- G.F. Froment, K.B. Bischoff and J. De Wilde, "Chemical Reactor Analysis and Design," 3rd Ed., John Wiley, Hoboken, Ch. 11.
- J.R.H. Ross, "Heterogeneous Catalysis: Fundamentals and Applications," Elsevier, Amsterdam, 2012, Ch. 8.
Pular para...
Vídeos desta coleção:

Now Playing
Reator Catalítico: Hidrogenação de etileno
Chemical Engineering
30.3K Visualizações

Teste de eficiência da transferência de calor de um trocador de calor de tubos aletados
Chemical Engineering
17.9K Visualizações

Uso de um secador de bandeja para investigar a transferência de calor por convecção e condução
Chemical Engineering
43.9K Visualizações

Viscosidade de soluções de propilenoglicol
Chemical Engineering
32.6K Visualizações

Porosimetria de um pó de sílica alumina
Chemical Engineering
9.6K Visualizações

Demonstração do modelo de lei de potência por meio de extrusão
Chemical Engineering
10.0K Visualizações

Absorvedor de gás
Chemical Engineering
36.5K Visualizações

Equilíbrio vapor-líquido
Chemical Engineering
88.3K Visualizações

O efeito da taxa de refluxo na eficiência da destilação em bandejas
Chemical Engineering
77.6K Visualizações

Eficiência da Extração Líquido-Líquido
Chemical Engineering
48.4K Visualizações

Reator de fase líquida: Inversão de sacarose
Chemical Engineering
9.6K Visualizações

Cristalização de Ácido Salicílico via Modificação Química
Chemical Engineering
24.2K Visualizações

Fluxo monofásico e bifásico em um reator de leito compactado
Chemical Engineering
18.9K Visualizações

Cinética da Polimerização por Adição ao Polidimetilsiloxano
Chemical Engineering
16.1K Visualizações

Avaliação a Transferência de Calor de um Equipamento de Resfriamento e Agitação
Chemical Engineering
7.3K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados