Reactor catalítico: Hidrogenación de etileno
Visión general
Fuente: Kerry M. Dooley y Michael g. Benton, Departamento de ingeniería química, Universidad Estatal de Louisiana, Baton Rouge, LA
La hidrogenación de etileno (C2H4) a etano (C2H6) se ha estudiado a menudo como una reacción de reducción de modelo en la caracterización de nuevos catalizadores metálicos. 1-2 mientras que el níquel soportado no es el catalizador del metal más activo para esta reacción, es lo suficientemente activa como para que reacción puede tener lugar en < 200 ° C.
La reacción implica típicamente hidrógeno adsorbido, disociada (H2) reacciona con etileno adsorbida. En otras palabras, los átomos de hidrógeno y etileno forma moléculas enlaces con un sitio de metal (aquí denota "S"). La fuerte vinculación de etileno con S debilita el enlace doble lo suficiente como para permitir que los átomos de hidrógeno agregar a etileno, etano, que no se adsorbe de forma.
El propósito de este experimento es, en primer lugar, para convertir las medidas de composición cruda a limitar las conversiones fraccionario reactivo. 3 estas conversiones pueden entonces utilizarse en un reactor del flujo del enchufe (PFR) para ajustar los datos a un modelo de cinética de ley de potencia estándar por el "método Integral". 3 una comparación de las órdenes experimentales de reacción de etileno e hidrógeno las órdenes teóricos revela en este caso que la reacción está cinéticamente controlada en lugar de control de transferencia de masa.
Principios
Un mecanismo para la reacción (dejando A = etileno, E = etano y S = un sitio metal) puede escribirse como:2
A + S  (1)
(1)
H2 + 2 S  HS + HS (2)
HS + HS (2)
COMO HS  AHS + S (3)
AHS + S (3)
AHS + HS  E + S + S (4)
E + S + S (4)
Si asumimos la tercera reacción es el paso de limitación de velocidad, y que la cantidad total de sitios de S es constante (So), podemos usar un balance de masa aproximado:
(So) ~ (S) + (AS) (HS) (5)
y la asunción de cuasi-equilibrio en los pasos (1) - (2) para obtener una expresión cinética teórica :
r = k (H2)1/2 (A) (So)2 [1 + K1 (A) + K21/2 (H2)1/2]-2 (6)
donde k es una constante de velocidad, K es una constante de equilibrio, "1" representa la primera reacción, "2" para la segunda reacción y (H2), (A) y (So) son las concentraciones de cada uno de los componentes. Tenga en cuenta que en el aproximado total balance suponemos que (S), (HS) y (AS) >> (AHS). También tenga en cuenta que (So) es una constante siempre que el número total de sitios de metal sigue siendo el mismo. Cuando el número de sitios de metal disminuye con respecto al tiempo, decimos que el catalizador "desactiva"; cuando aumenta, el catalizador "activa". En esta reacción, la desactivación puede ser causada por una reacción de lado con esta estequiometría:
C2H4  (CH)2a + H2 (7)
(CH)2a + H2 (7)
El polímero producto (CH)2a ("coke") es demasiado pesado ("a" es grande) a la desorción del metal y por lo que estas metal efectivamente se quitan del catalyts. 4 sin embargo, las condiciones de reacción posterior pueden causar el coque romper, así "reactivar" el catalizador.
De estas cinéticas, es evidente que para bajas concentraciones de etileno la tasa de primer orden en etileno, mientras que para altas concentraciones de etileno, la velocidad de reacción es-1. Los valores comparables para la orden de hidrógeno son 0,5 a -0,5. Expresiones de la tasa de este tipo (también común en las reacciones enzima-catalizadas) se llaman a "Langmuir-Hinshelwood". Puesto que la constante K de equilibrio1 depende de la temperatura, esta expresión de velocidad nos dice que el m orden de etileno en una expresión del tipo "ley de potencia" del tipo:
r = k (A)m (H2)n (8)
cambia con la temperatura. Tasa más expresiones regresan de datos experimentales son del tipo "ley de potencia", como se ve en los libros de texto estándar sobre cinética química. 5
A continuación se muestra un esquema simplificado del sistema reactor (Fig. 1). Muchas de las válvulas y los componentes están marcados en el reactor. El reactor es un tubo de acero dentro de un sandbath. El sandbath es fluidizado con aire y calentado por calentadores de resistencia metálica. Una gran cantidad de calor se puede transferir rápidamente al reactor de la planta piloto.
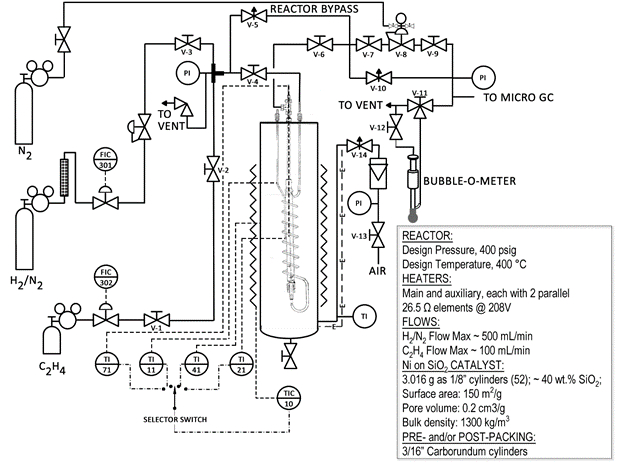
Figura 1: Esquema del sistema de Reactor catalítico
Se han tomado precauciones para hacer de este un sistema seguro. Hay válvulas en el sistema, un apagado de alta temperatura, y sólo hidrógeno diluido (ver hoja de especificaciones en el cilindro) se utiliza. Sin embargo, con cualquier sistema de reacción, la estricta observancia a los procedimientos de seguridad es necesaria. El límite inferior de explosión del hidrógeno en aire es 4,0% vol. 6 por esta razón, es importante asegurarse de que el reactor no escapa hidrógeno en el sandbath circundante. Un Detector de fugas de Gas Combustible CGD900 es disponible para este propósito.
El catalizador utilizado en esta demostración (2,0 g) utiliza el níquel como el componente activo pero es aproximadamente 40 wt % de sílice (SiO2). La silicona se llama una "ayuda" para el níquel, y su propósito es proporcionar una gran superficie para el níquel cubrir. Un material inerte, carburo de silicio (SiC), se utiliza para llenar el resto del reactor. El catalizador tiene superficie = 150 m2/g, volumen de poros = 0,2 cm3/g y una densidad aparente de ~ 1300 kg/m3.
El reactor ideal más cercano a un reactor catalítico de lecho empacado es un PFR. Análisis de Nonideal reactor está fuera del alcance de este experimento. El balance de masa de PFR con peso de catalizador como la variable independiente y la conversión fraccional como variable dependiente se convierte en:
 (9)
(9)
donde fA la conversión fraccional de reactivo limitante, "f" representa las condiciones final (salida), W es el peso de catalizador, FAo la tasa de alimentación de flujo molar de A y r' es la expresión de la tasa sobre una base por wt. Cómo poner r' en términos de fA sólo para un gas ideal está cubierto en cualquiera de las referencias estándar cinética. 3 tenga en cuenta que habrá dos clases de datos, una clase con limitación de etileno y otra con limitación de hidrógeno, pero sólo puede ser una expresión de tipo común. La conversión fraccional puede encontrarse mediante el análisis de gas de la alimentación y el producto con un cromatógrafo de gases. A través del cierre del balance de masa, la velocidad de la reacción se puede encontrar y en comparación con la energía de activación nominal para este tipo de reacción catalítica. También se pueden comparar las órdenes de la reacción.
Procedimiento
El sistema es controlado a través de un sistema de control distribuido comercial; hay sólo una interfaz de operador.
1. reactor arranque
- Para iniciar la vista de la historia de procesos en tiempo real, vaya a Inicio > DeltaV > operador > ver historia de proceso y después abra CATUnitOverview. Tabla escalas pueden ser comprimidos o ampliados haciendo clic en los botones de la barra de menús. Procedimientos para descargar datos desde el sistema de control a una hoja de cálculo de Excel están disponibles en el equipo.
- Asegúrese de que el aire a la sandbath es de. El rotámetro debe leer ≈5 o superior y constante de ejecución para proporcionar la calefacción constante.
- Permiten la alimentación al calentador de sandbath presionando el botón de inicio de color negro en el tablero de la unidad CAT.
- Controlador de temperatura (TIC-10, para el sandbath) a la consigna inicial deseado, modo auto. Para utilizar calentamiento al principio del experimento rápido, consulte el apéndice A.
- Las temperaturas pueden ser monitoreadas en la tabla. El caudal efluente reactor debe ser revisado periódicamente. Si presentar problemas, como la pérdida de temperatura de flujo o fugitivo, apague ambos flujos de reactivo mediante válvulas de cierre apropiado y todos los calentadores de. Dejar aire sandbath.
2. Ajuste de caudal
Establecer las tasas de flujo antes de la calefacción. Se proporcionarán las calibraciones para los controladores de dos flujo - FIC-301 para la mezcla hidrógeno-nitrógeno - y FIC-302 para etileno.
- Establezca el valor digital en la interfaz que señala si el equipo o el tablero del panel se utilizará 1 para indicar el uso de la computadora.
- Bloquear la línea de muestra del GC.
- Determinar la tasa de flujo volumétrico por la tasa de ascenso de una burbuja sola entre dos volúmenes en un medidor de burbuja de la sincronización. Un medidor de burbuja es una bureta de vidrio con volúmenes graduados. Asegúrese de que la línea de muestra del GC se bloquea cuando el medidor de burbuja se utiliza activamente para medir el flujo (calibración, control de velocidad de flujo de salida).
- Tomar al menos una muestra de la alimentación a través de la carretera de circunvalación (una muestra en blanco) para comprobar su composición. Está bien cambiar las tasas de flujo sobre la marcha sin pasar por el reactor. Cambiar las velocidades de flujo también cambios de las concentraciones relativas de los piensos (la presión es constante), caudales que tendrá que cambiarse a menudo.
- Desbloquear la línea de muestra del GC y fluir de los reactantes a través de la derivación del reactor y en el puerto de entrada de GC.
- Utilizar un cromatógrafo de gases para analizar la composición del gas producto. Más instrucciones se incluyen en el Apéndice B sobre cómo operar el GC y determinar la composición.
3. parada del reactor
- Alimentación principal apagado el calentador sandbath empujando el rojo EMERG. Botón de parada en la mesa de la unidad CAT.
- Lugar TIC-10 modo de hombre y la salida a 0%. Sistema de alimentación auxiliar (si está activado) al 0%.
- Flujo de etileno set a 0% por poner el controlador en el hombre y la salida en 0%.
- Cierre ambas válvulas de bloqueo de etileno antes de la t de mezcla y cierre la válvula principal de gas.
- Dejar fluir hidrógeno/nitrógeno ~ 2 minutos antes de apagarse; esto prolongará la vida del catalizador.
- Bloquear ambas válvulas antes de la t de mezcla. Luego cierre la válvula principal para la mezcla de hidrógeno/nitrógeno.
- Deje el aire en el lecho fluidizado.
Resultados
Regresión no lineal para obtener las mejores estimaciones (utilizando Eqs. 8-9) de la reacción de las órdenes de m y n y la tasa constante k, pueden ser tediosos. Un algoritmo de solución requiere una integración numérica por cada punto de datos por iteración de m y n, llevando a muchos miles de Integración numérica. Una técnica alternativa que es casi tan buena, pero mucho menos de cómputo costoso, es formular juicio pares de m, n, basado en la estructura de la ecuación 6. Los valores dentro de la gama de las órdenes teóricas es ciertamente posible. Luego formular una función objetivo del tipo:
 (10)
(10)
Esta función objetivo para cada m, par n se puede calcular, y el mejor ajuste determinado con el mínimo o cerca de mínimo junto con otros criterios de ajuste estándar, como la aleatoriedad de los errores en la ecuación 10 en función de las presiones parciales. También observe que la ecuación 9 predice que una parcela de la izquierda integral (lo llaman "Y") vs 1/FAo (lo llaman "X") debe ser linear en el óptimo m, n. comprobar el grado de linealidad y la aleatoriedad de los errores de esta formulación es también un método válido para disuadir bondad de ajuste de la mina.
Algunos datos tomados en P = 1 atm, T = 80° C, PC2H4 = 0.42 0.17 atm, PH2 = 0.23-0.33 atm (nitrógeno como diluyente) se analizaron como se describe anteriormente. La trama lineal de la cinética del "mejor ajuste" se muestra en la figura 2. Varios otros m, números pares también fueron examinados de la misma manera y que para dar ajustes lineales más pobres. El mejor ajuste de los valores de m y n indican que etileno es débil fijado por adsorción sobre el catalizador de níquel (ninguna inhibición en el denominador de la EC. 6), mientras que el hidrógeno se adsorbe fuertemente (la orden negativa denota inhibición). Para reacciones catalíticas más, demasiado fuerte que una adsorción es tan malo como demasiado débil una adsorción, aunque "demasiado fuerte" se refleja en un orden de reacción negativa, mientras que "demasiado débil" se refleja en las conversiones bajas y un pequeño índice constante k.

Figura 2 . Análisis de la cinética de hidrogenación de etileno a 80° C, 1 atm para el 60% en peso de catalizador de Ni. La "a" indica datos donde C24 H es el reactivo limitante, mientras que "b" denota H2 como el reactivo limitante.
Dos mejores valores de ajuste de m y n están dentro del rango de expectativas basadas en la ecuación (6). El valor de "m" está en su máximo, por lo tanto la reacción no está controlada por difusión. Para una reacción controlada por difusión tanto "m" y "n" sería cercana a cero. Las órdenes experimentales a veces pueden responder a la pregunta de cinéticamente controlado vs controlado por difusión, pero si ambas órdenes estaban cerca de cero no podría ser probado, porque cero es dentro de la gama de posibles órdenes basadas en la ecuación (6). Una prueba de las afirmaciones anteriores es más allá del alcance de este experimento.
Aplicación y resumen
El método descrito aquí se llama el "método Integral" en la mayoría de libros sobre diseño de cinética y reactores. 3 aunque es matemáticamente mucho más difícil de aplicar que los métodos de diagnóstico, también es mejor adaptado para analizar los tipos de datos que son fáciles de obtener en la mayoría de los sistemas de reactor piloto, donde las presiones parciales de reactivo y producto y conversiones de fracciones pueden variar en amplias gamas. Porque no confiamos en reactores batch o conversiones bajo reactivo, tales datos"integrados" también son más precisos y relevantes para evolucionen. La primera parte del método es convertir los datos crudos de las mediciones de flujo y composición de conversión fraccional vs espacio tiempo (la derecha de la ecuación 9 se llama a menudo el espacio tiempo). El siguiente paso es postular órdenes de reacción razonable para los reactivos (y a veces productos) que afectan a la tasa. El último paso es comparar tantos conjuntos de órdenes como sea posible usando la ecuación (10), o la relación de linealidad en la ecuación (9) y elegir el conjunto dando el mejor ajuste a los datos.
Casi cualquier catalizador de metal soportado puede catalizar la hidrogenación del etileno sobre cierta gama de temperaturas, y la actividad de catalizador, selectividad (al etano) y estabilidad (resistencia de coque) son descriptores importantes de utilidad de un potencial catalizador del metal. Las órdenes cinéticas de la reacción también son descriptores importantes. Indican la fuerza relativa de adsorción de un hidrocarburo vs hidrógeno, y si las tasas del catalizador pueden estar limitadas por difusión de reactivo o producto (en cuyo caso, se encuentran los órdenes cerca de cero). Las órdenes también sugerir si la hipótesis formulada en derivar la ecuación 6 (por ejemplo, una limitación de velocidad escalón que es la reacción superficial) son aún correcta en primer lugar. Generalmente conocer la expresión de velocidad experimental es insuficiente para determinar el mecanismo correcto por sí mismo, pero si la expresión de velocidad experimental es incompatible con un mecanismo de reacción propuesto, entonces éste es ciertamente incorrecto. En el ejemplo dado aquí, la cinética observada son consistentes con el mecanismo propuesto y el paso de limitación de velocidad, prestar alguna credibilidad al mecanismo.
Con sólo ligera adaptación, los "métodos integrales" descritos aquí se han utilizado para determinar las expresiones de velocidad de muchas reacciones catalíticas industriales importantes. Estas expresiones de índice entonces se han utilizado para ampliar estos procesos a escala de tonelaje. Algunos ejemplos bien conocidos incluyen el reformado con vapor de metano para generar H2, la oxidación de o-xileno anhídrido ftálico, y la síntesis del amoníaco. 6 en tales casos, las expresiones de velocidad para cientos de catalizadores candidato podrían ser computadas, a menudo a varias temperaturas.
En cuanto a reacciones catalíticas de metales soportados, constituyen algunas de las reacciones catalíticas industriales más importantes, incluyendo catálisis de escape automotriz (una combinación de oxidación de monóxido de carbono, la oxidación de hidrocarburos no quemados y óxido nítrico reducción), la reforma de lineal a hidrocarburos de cadena ramificada para aumentar el número de octano de varios combustibles y reformado con vapor. Para el primero de ellos el metal activo es generalmente una aleación de platino-paladio, para el segundo es platino o aleación de platino como platino-renio, y la tercera es níquel. 7 otros metales como el cobre, plata, oro y rodio también encuentran aplicación, ya sea por sí mismos o como aleaciones con otros metales.
Apéndice A-instrucciones para el calentador auxiliar
Para el calentamiento rápido, encienda el calentador auxiliar (salida ≤ 90%), pero asegúrese de apagarla cuando la piel o la pared exterior temperatura se acerca a la temperatura deseada reactor; el calentador auxiliar no se controla en este momento y enfriamiento (≈10 º C/hora) toma mucho más tiempo que de la calefacción. La temperatura del reactor puede retraso significativamente la temperatura del calentador. El termopar de piel puede seleccionarse como entrada a TIC-10. La temperatura más alta para ser utilizado en cualquier experimento es de 200° C. Una luz de advertencia de "Crítico" avisa al usuario a alta temperatura. El sistema de control monitorea temperaturas el sandbath y el reactor y ambos están programados para alarma y apague los calentadores cuando demasiado alto.
Apéndice B – instrucciones de funcionamiento del cromatógrafo
Para el Myrkos está controlado por ordenador. El método de GC por defecto es "1 enfriamiento." Para los experimentos, la carga método "PH-CAT4". Haga clic en el método de Control → Descargar. Indica que el instrumento haciendo clic en el Control → estado del instrumento. No se puede realizar una carrera hasta que todos los parámetros en el estado de instrumento están cerca de sus puntos.
Cuando esté listo para realizar una carrera, haga clic en Control → solo ejecutar. Un menú emergente pedirá que introduzca un ID de muestra, el archivo de datos y el nombre resultante. Para el "Fichero de datos", haga clic en la punta de flecha a la derecha y seleccione fecha y hora. Después de hacerlo, la pantalla será en el campo, y la fecha y hora se unirá a los nombres de archivo. Para obtener "resultados", haga clic en la punta de flecha a la derecha y seleccione ID de muestra, repita seleccionando fecha y hora, a continuación repita seleccionando número de incremento. Volver al campo e introduzca un único espacio en blanco entre el primer y segundo elemento y el segundo y tercer elemento. Para "número de repeticiones Introduzca el número de análisis repetidos secuenciales deseado. Ahora haga clic en "Inicio". Aparecerán energizados parcelas para los canales A y B, que muestra los cromatogramas como se generan. H2 y N2 son detectados en el canal A, mientras que H2, CH4, C2H4y C2H6 se detectan en el canal B. Actualmente, sin embargo, el método sólo se ha calibrado para etileno y etano. Cuando haya completado todos los REP, no guardar el método. Se abrirá la ventana de resultado secuencia, permitiendo el acceso a los resultados.
Para ver los resultados, seleccione la ventana de resultado de secuencia, haga clic derecho (por ejemplo) la primera celda número ejecución, elija Seleccionar registro. En el menú superior seleccione informes → vista → área %. Se abrirá un informe con los compuestos conocidos.
El CG registrará en el % de área. Para calcular la conversión (A = % de área): (11)
(11)
También es posible calcular la conversión mediante la medición de la tasa de flujo de producto con el medidor de burbuja, y esto puede servir como un control de los resultados de GC. Suponiendo que no reacciones que no sean de la hidrogenación de etileno y un gas ideal, la ecuación puede ser derivada usando una tabla estequiométrica:3 (12)
(12)
DondeT0 de F es el caudal volumétrico total de la alimentación, FT es la tasa de flujo volumétrico total de la corriente del producto medido por el medidor de burbuja, y 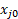 es la fracción mol o el volumen de lo que es el reactivo limitante.
es la fracción mol o el volumen de lo que es el reactivo limitante.
Referencias
- O. Beeck, Discuss. Faraday Soc.8, 118 (1950).
- J.B. Butt, AIChE J22, 1 (1976).
- H.S. Fogler, "Elements of Chemical Reaction Engineering," 4th Ed., Prentice-Hall, Upper Saddle River, NJ, 2006, Ch. 2-4; O. Levenspiel, "Chemical Reaction Engineering," 3rd Ed., John Wiley, New York, 1999, Ch. 4-6; C.G. Hill, Jr. and T.W. Root, "Introduction to Chemical Engineering Kinetics and Reactor Design," 2nd Ed., John Wiley, New York, 2014, Ch. 8.
- B. Peri, Discuss. Faraday Soc., 41, 121 (1966).
- Basic chemical kinetics - Fogler, Ch. 3, Levenspiel, Ch. 2, Hill and Root, Ch. 3.
- N. Bartknecht, "Explosions: Course, Prevention, Protection", Springer-Verlag, 1981.
- G.F. Froment, K.B. Bischoff and J. De Wilde, "Chemical Reactor Analysis and Design," 3rd Ed., John Wiley, Hoboken, Ch. 11.
- J.R.H. Ross, "Heterogeneous Catalysis: Fundamentals and Applications," Elsevier, Amsterdam, 2012, Ch. 8.
Saltar a...
Vídeos de esta colección:

Now Playing
Reactor catalítico: Hidrogenación de etileno
Chemical Engineering
30.3K Vistas

Prueba de la eficiencia de transferencia de calor de un intercambiador de calor de tubos con aletas
Chemical Engineering
17.9K Vistas

Uso de una bandeja de secado para investigar la transferencia de calor convectiva y conductiva
Chemical Engineering
43.9K Vistas

Viscosidad de las soluciones de propilenglicol
Chemical Engineering
32.6K Vistas

Porosimetría de un polvo de alúmina de sílice
Chemical Engineering
9.6K Vistas

Demostración del modelo de ley de energía a través de extrusión
Chemical Engineering
10.0K Vistas

Amortiguador de gas
Chemical Engineering
36.5K Vistas

Equilibrio vapor-líquido
Chemical Engineering
88.3K Vistas

El efecto de la relación de reflujo en la eficiencia de destilación de bandeja
Chemical Engineering
77.6K Vistas

Eficiencia de la extracción líquido-líquido
Chemical Engineering
48.4K Vistas

Reactor de fase líquida: Inversión de sacarosa
Chemical Engineering
9.6K Vistas

Cristalización del ácido salicílico mediante modificación química
Chemical Engineering
24.2K Vistas

Flujo monofásico y bifásico en un reactor de lecho compacto
Chemical Engineering
18.9K Vistas

Cinética de la polimerización por adición de polidimetilsiloxano
Chemical Engineering
16.1K Vistas

Spin y Chill
Chemical Engineering
7.3K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados