תאים סולאריים רגישים לצבע
Overview
מקור: תמרה מ. פאוורס, המחלקה לכימיה, אוניברסיטת טקסס A&M
העולם המודרני של ימינו דורש שימוש בכמות גדולה של אנרגיה. בעוד אנו רותמים אנרגיה מדלקים מאובנים כגון פחם ונפט, מקורות אלה אינם ניתנים לניתוק ולכן האספקה מוגבלת. כדי לשמור על אורח החיים הגלובלי שלנו, עלינו להפיק אנרגיה ממקורות מתחדשים. המקור המתחדש המבטיח ביותר, במונחים של שפע, הוא השמש, המספקת לנו יותר ממספיק אנרגיה סולארית כדי לתדלק את כוכב הלכת שלנו פעמים רבות.
אז איך אנחנו מפיקים אנרגיה מהשמש? הטבע היה הראשון להבין את זה: פוטוסינתזה היא התהליך שבו צמחים ממירים מים ופחמן דו חמצני לפחמימות וחמצן. תהליך זה מתרחש בעלים של צמחים, ונשען על פיגמנטים כלורופיל כי צבע את העלים ירוקים. המולקולות הצבעוניות האלה סופגות את האנרגיה מאור השמש, והאנרגיה הנספגת הזו מניעה את התגובות הכימיות.
בשנת 1839, אדמונד בקרל, אז פיזיקאי צרפתי בן 19 שהתנסה במעבדה של אביו, יצר את התא הפוטו-וולטאי הראשון. הוא האיר תמיסה חומצית של כלוריד כסף שהיה מחובר לאלקטרודות פלטינה שיצרו מתח וזרם. 1 תגליות והתקדמות רבות נעשו בסוף המאה ה-19 והראשונה של המאה ה -20, ורק בשנת 1954 נבנה התא הסולארי המעשי הראשון על ידי מעבדות בל. החל משנות ה-50 של ה-50, תאים סולאריים שימשו להפעלת לוויינים בחלל. 2
תאים סולאריים הם מכשירים חשמליים המשתמשים באור כדי ליצור זרם. וידאו זה מדגים הכנה ובדיקה של סוג אחד כזה של תא, תא סולארי רגיש צבע (DSSC). גרצאל, שהומצא לראשונה באוניברסיטת ברקלי על ידי בריאן או'רגן ומייקל גרצל, המשיך את עבודתו בפוליטכניקה Fédérale de Lausanne בשווייץ, שהגיעה לשיאה ב- DSSC היעיל הראשון בשנת 1991. 3 תאים סולאריים אלה, כמו צמחים, משתמשים בצבע כדי לעזור לרתום אנרגיה מהשמש.
Principles
תורת הלהקה:
כאשר שני אטומים מתאחדים ויוצרים מסלולית מולקולרית, נוצרים שני מסלולית, אחד עם מליטה והשני עם סימטריית נוגדנים. 4 אלה מופרדים על ידי כמות מסוימת של אנרגיה. כאשר n אטומים מתאחדים ויוצרים מסלולית מולקולרית, כגון בצורת מסלולים מולקולריים מוצקים. כאשר n גדול, מספר מסלולית כי הם מרווחים קרובים באנרגיה הוא גם גדול. התוצאה היא רצועת מסלוליות שלאנרגיה דומה (איור 1). אלקטרונים מהאטומים שוכנים בלהקות האלה. רצועת ואלאנס היא רצועת האנרגיה הגבוהה ביותר המאוכלסת באלקטרונים. זה דומה למסלול המולקולרי הכבוש הגבוה ביותר (HOMO) של מולקולות. רצועת ההולכה היא הרצועה הנמוכה ביותר שאינה מאוכלסת באלקטרונים, והיא דומה למסלול המולקולרי הנמוך ביותר (LUMO) של מולקולות. פער הרצועות הוא הפרש האנרגיה בין שתי הלהקות האלה.
כאשר פער הרצועה גדול, החומר המוצק הוא מבודד: אלקטרונים אינם יכולים לזרום בחופשיות בתוך החומר (איור 1). לעומת זאת, מנצחים הם אלה שבהם פער רצועת ההולכה-ואלאנס מטושטש. במוליך, כגון מתכת, החלת מתח מעלה חלק מהאלקטרונים בפס הערכיות לפס ההולכות. האלקטרונים הנרגשים האלה חופשיים לזוז. האלקטרונים משאירים מאחור חורים חיוביים, שגם הם חופשיים לזוז. במציאות, החורים אינם זזים, אלא אלקטרונים נעים כדי למלא את החורים החיוביים. במוליכים, ככל שהטמפרטורה עולה, תנודות מולקולריות גדלות, ובכך חוסמות את זרימת האלקטרונים ומפחיתות את המוליכות.
מוליכים למחצה הם חומרים המשמשים כמבודדים ב-0 קלווין, אך הופכים למוליכים ככל שהטמפרטורה עולה(איור 1). הסיבה לכך היא שהפער-הלהקה - האנרגיה בין הערכיות לרצועת ההולכת - היא קטנה, כך שאנרגיה תרמית מספיקה כדי לרגש אלקטרונים לתוך רצועת ההולכות. מוליכים למחצה מהותיים טיפוסיים כוללים סיליקון וגרמניום.
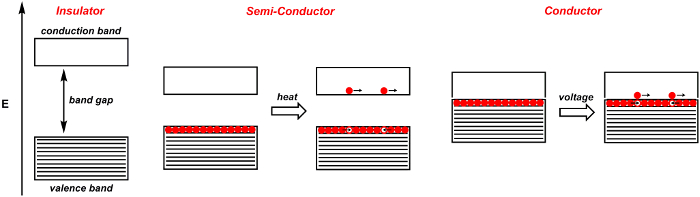
איור 1. דיאגרמת פס עבור מבודד, מוליך למחצה ומוליך. רצועות מוצלות מלאות באלקטרונים, בעוד הרצועות הלבנות ריקות. אלקטרונים נפרדים מסומנים על ידי כדור אדום, בעוד חורים נפרדים מסומנים על ידי כדור לבן.
אפקט פוטו-וולטאי:
כאשר האור פוגע במוליכים למחצה, הוא יכול לרגש אלקטרון מפס הערכיות לרצועת ההולכה. לאחר מכן, האלקטרון הזה יכול להתאחד מחדש עם החור שהוא השאיר מאחור, וכתוצאה מכך לא זרימה נטו של אלקטרונים. לחלופין, הוא יכול לנוע דרך המוליך למחצה, סביב מעגל, ולהתאחד מחדש עם חור בקצה השני של המעגל. זרימה זו של אלקטרונים הנוצרת מחשיפה לאור השמש מכונה האפקט הפוטו-וולטאי. תרחיש זה הוא הרצוי כדי לייצר חשמל, ולכן יש לתכנן מערכות לטובת זה על פני recombination.
דרך אחת להעדיף זאת היא לעצב תאים עם צומת p-n, כלומר,צומת בין מוליך למחצה n-ו p-מסומם. אלה הם מוליכים למחצה לפיהם חלק מהאטומים הוחלפו להיות אטומים שכנים בטבלה המחזורית. במוליכים למחצה עם סמים n, אלה מוחלפים על ידי אטומים שיש להם יותר אלקטרונים, ובמוליכים למחצה p-מסוממים, אלה מוחלפים על ידי אטומים שיש להם פחות אלקטרונים. תאים סולאריים מבוססי סיליקון "מסורתיים" עושים שימוש בגישה זו.
עם זאת, סוג מתפתח של תאים סולאריים הם DSSC, המכונה לעתים קרובות תא Grätzel. 5 אלה מבטיחים בכך שהם שקופים למחצה, ועלותם נמוכה משמעותית. תאים סולאריים אלה עדיין עושים שימוש במוליכים למחצה, אך זהו צבע המשמש לספיגת האור מהשמש.
רכיבים של DSSC:
ישנם רכיבים רבים ב- DSSC, המוצג באיור 2.
צבע
כדי לקדם את האפקט הפוטו-וולטאי, DSSC עושה שימוש בצבעים. מולקולת הצבע סופגת אור, מקדמת אלקטרון ממסלול מליטה למסלול אנטי מליטה. לאחר מכן, האלקטרון הנרגש הזה יכול לרדת חזרה למסלול המקשר, וכתוצאה מכך אין זרימה של אלקטרונים. או, זה יכול להיות מוזרק לתוך מוליך למחצה, המסלול היצרני של DSSC. זה משאיר מאחורי חור, אשר חייב להיות מלא כדי להשלים את המעגל. עבור המסלול היצרני, האנרגיה של אלקטרון המצב הנרגש בצבע חייבת להיות גדולה יותר מרצועת ההולכות של המוליך למחצה. הצבע צריך גם לספוג הרבה ספקטרום השמש, כדי לשפר את היעילות של התא. צבעים אופייניים מבוססים על רותניום (Ru), ולכן מגביל DSSC, כמו מתכת זו אינה חסכונית מאוד.
בניסוי זה, אנו נשתמש בצבע טבעי (אנתוציאנינים) שנמצאו בחלק מהגרגרים, כגון אוכמניות ופטל. המבנה של צבע האנתוציאנין חייב לכלול מספר קבוצות =O או -OH, המאפשרות לצבע להיקשר למשטח TiIVO2 (איור 3). 6
מוליכים למחצה
לאחר מכן, האלקטרון הנרגש זורם לרצועת ההולכות של המוליך למחצה. המוליך למחצה שנשתמש בו בניסוי זה הוא TiO2.
אנודה
האלקטרון זורם מהמוליך למחצה לאנודה, שבמקרה זה, היא זכוכית מצופה SnO2. SnO2 מאפשר משטח מוליך על הזכוכית, אשר אחרת יהיה מבודד.
קתודה
לאחר שעבר דרך עומס, האלקטרון מגיע לקתודה, אשר מכוסה גם SnO2. הקתודה מכוסה בנוסף עם זרז, במקרה זה, גרפיט, אשר מסייע לקדם את התגובה redox של המתווך.
מתווך
האלקטרון עובר מהקתודהל-I 3ומצמצםאותול-I . . מולקולה מופחתת זו יכולה לתרום אלקטרון לחור שנותר במולקולת הצבע, ובכך להשלים את המעגל. תהליך זה מחדש I3-. ההבדל בין פוטנציאל תאי I3- /I לבין רמת פרמי מתאים לפוטנציאל המעגל הפתוח של התא הסולארי, או למתח המרבי שניתן לייצר עם התא.
בסרטון וידאו זה, DSSC מוכן וביצועיו מוערכים.
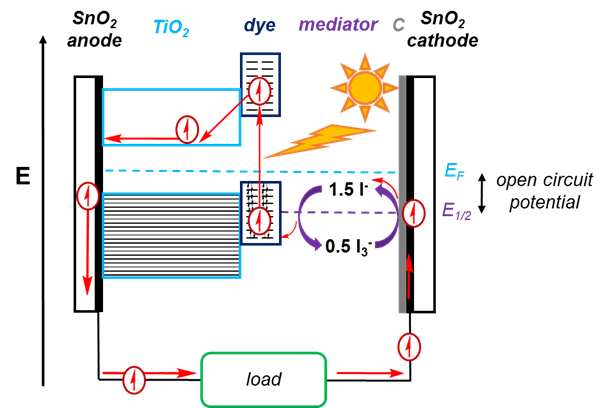
איור 2. סכמטי של DSSC. אור השמש נספג על ידי הצבע, מעלה אלקטרון למסלול אנטי מליטה בצבע. לאחר מכן, אלקטרון זה עובר לרצועת ההולכות של TiO2 ומשאיר אחריו חור. האלקטרון מסתובב במעגל ומעביר מטען, ומשמש להפחתת3- ל- I-ואז מחומצן בחזרה ל- I3- כשהאלקטרון ממלא את החור שנותר בצבע.

איור 3. פיגמנט אנתוציאנין שנמצא בחלק מהגרגרים יהיה כלאט על פני השטח TiO2.
Procedure
1. הכנת הדבקה של TiO2
- מסה החוצה 6 גרם של אבקת TiO2 קולואידי, ומניחים אותו במכתש.
- בזהירות להוסיף 2-3 מ"ל של חומץ TiO2, ולהתחיל לטחון את ההשעיה עם עלה עד הדבק אחיד מתקבל. הטחינה משמשת כדי לשבור גושים מצטברים באבקה.
- המשך להוסיף חומץ, במרווחים ~ 1 מ"ל תוך כדי טחינה, עד ~ 9 מ"ל נפח כולל. לפני כל תוספת, העקביות של הדבק צריך להיות אחיד וללא גושים. הדבק הסופי צריך להיות עבה, אבל לא כל כך עבה כי זה לא יכול להיות סחוט מתוך בקבוק טפטפת.
- מוסיפים טיפה אחת של סבון כלים ל 1 מ"ל של מים מזוקקים, מערבבים בעדינות.
- מוסיפים את תמיסתסבון הכלים להשעיית TiO 2 ומערבבים בעדינות, נזהרים שלא לייצר בועות.
- אפשר להשעיה להתפרק למשך 15 דקות. סבון הכלים משמש כחומש שטח, כדי לעזור להפוך את ההשעיה לפזר בקלות רבה יותר לסרט אחיד על הזכוכית.
2. תצהיר של TiO2 על זכוכית
- נקה שתי מגלשות זכוכית מוליכות. השרו קימבפה עם אתנול והשתמשו בו כדי לנגב שתי מגלשות זכוכית מוליכות. מניחים את השקופיות הנקיות על קיוויפה טרייה.
- לקבוע איזה צד של הזכוכית הוא מוליך. באמצעות ערכת מולטימטר לאוהם, מגע בשתי ההובלה לצד אחד של הזכוכית. אם נצפתה קריאה בין 10 ל -30 Ω, זהו הצד המוליך. קריאה של 0 Ω מצביעה על הצד הלא מוליך.
- להסוות את השקופית. מניחים שקופית זכוכית אחת עם הצד המוליך שלה למעלה והשנייה עם הצד המוליך שלה כלפי מטה. תוך שמירה קפדנית על המגלשות נוגעות, מדביק את שקופיות הזכוכית לספסל העליון. מקם את הקלטת על שלושה מארבעת הצדדים של השקופיות, ודא כי ~ 5-8 מ"מ של השקופית מכוסה על ידי קלטת בכל אחד משלושת הצדדים (איור 4). לחץ על הקלטת בחוזקה, כדי להבטיח שאין בועות אוויר.
- החל את הדבק TiO2. באמצעות מוט זכוכית, יש למרוח קו דק של הדבק על הקצה העליון המסיכה של השקופית. השתמש במוט הזכוכית כדי לגלגל בזהירות את הדבק לאורך השקופית, ולגבות. חזור על תנועה זו 2-3x מבלי להרים את המוט, או עד לקבלת סרט אחיד.
- אם הסרט אינו אחיד, פשוט לנגב אותו עם קימאוויפ, לנקות את הכוס עם אתנול, ופעם יבש, לנסות שוב.
- אפשר לסרט להתייבש קצת, ולאחר מכן להסיר בזהירות את הקלטת מהכוס. השקופית עם הסרט TiO2 צריכה להיות בצד המוליך. ניתן לנקות את השקופית האחרת ולהשתמש בה מאוחר יותר.
- אנאל הסרט טיו2. מניחים בזהירות את השקופית (TiO2 צד למעלה) על צלחת חמה כי מוגדר 450 °C (50 °F). צפו ב-TiO2 מחשיך לצבע סגול/חום, וחוזרים לצבעו הלבן. בשלב זה, לכבות את החום ולאפשר לסרט להתקרר לאט. אם השקופית מקוררת מהר מדי, היא עלולה להיסדק או להתנפץ.
- בסרגל, מדדו את שטח הפנים המכוסה בסרט ושימו לב לערך זה.

איור 4. תצהיר של טיו2 על זכוכית.
3. להכתים את הסרט TiO2 עם צבע
- מניחים כמה אוכמניות, פטל או דובדבנים במכתש ומועכים אותם עם עלה.
- מסננים את הפתרון דרך מסנן קפה לתוך צלחת פטרי. ייתכן שיהיה צורך להוסיף כמה mL של מים למיץ.
- מניחים את סרט TiO2 מקורר, עם הפנים כלפי מטה בצלחת פטרי. היזהר לא לגרד את כל TiO2. אפשר לצבע להיות מסוחח על הסרט. פעולה זו עשויה להימשך מספר דקות.
- ברגע שהסרט מצופה במלואו (הוא צריך להיות אדום כהה או סגול ואין כתמים לבנים), הרם את המגלשה עם מלקחיים (היזהר רק להקשיח את הזכוכית ולא את הסרט), ולשטוף את המגלשה במים, ואז אתנול. כתם את הסרט יבש עם קימפוויפ, ולהשתמש מיד.
- אם לא נעשה שימוש מיידי, אז לאחסן את הסרט בצלחת פטרי המכיל חומצה אצטית ב pH 3-5, ולכסות את המנה עם המכסה לעטוף בנייר כסף.
4. הכן את אלקטרודה הדלפק
- באמצעות שקופית זכוכית מוליכת אחרת, בצע את שלבים 2.1-2.2.
- החל את זרז הפחמן בצד המוליך. באמצעות פינצטה, להחזיק את השקופית, צד מוליך למטה, מעל קצה של מבער Bunsen. הזז את השקופית כך שהפיח יאסף על פני השטח כולו, אך לא יותר מ- 30 s. תן למגלשה להתקרר, ולנגב את הפיח לאורך צד אחד של המגלשה עם צמר גפן.
- לחלופין, באמצעות עיפרון HB, לכסות את כל משטח מוליך עם גרפיט. זה נותן אלקטרודה חזקה יותר, אבל אחד שמבצע פחות טוב.
5. להרכיב את התא הסולארי
- ייבש את הסרט המוכתם. שוטפים אותו באתנול ומניחים אותו על קימבפה. בעדינות כתם את הסרט עם קימפוויפ שני. הסרט חייב להיות יבש כדי לא להשפיע על פתרון האלקטרולייט.
- עם הצד של סרט האלקטרודה למעלה, הניחו בעדינות את האלקטרודה מצופה הפחמן למעלה (פחמן עם הפנים כלפי מטה). הקפד לקזז את השקופיות כך שהצדדים החשופים של שתי האלקטרודות יוכלו להיות מקוטעים לחוטים. הנח שני קליפים קלסר בצדדים הסמוכים זכוכית היסט.
- מניחים כמה טיפות של תמיסת האלקטרולייט לאורך קצה אחד של השקופיות, ופותחים/ סוגרים בזהירות כל צד של התא על ידי פתיחה/סגירה לסירוגין של קליפי הקלסר. ודא כי כל האזור המוכתם נמצא במגע עם פתרון אלקטרוליט, ולחזור על שלב 5.2 במידת הצורך.
- נגב את עודף האלקטרולית מהאזורים החשופים באמצעות קימוויפ ואתנול.
- הדקו את קליפי התנין לשני הצדדים החשופים של התא הסולארי.
6. מדידת ביצועי התאים
הערה: באופן אידיאלי, מדידות אלה ייעשו בחוץ. עם זאת, אם מזג האוויר אינו מותר, הם יכולים להיעשות בפנים באמצעות מנורת הלוגן. כל המדידות צריכות להיעשות ללא תנועה של התא, כך שהם מבוצעים בתנאים זהים.
- הקפד לכוון את התא כך שהסרט TiO2 פונה כלפי מעלה לכיוון השמש, והצב כיסוי פוליקרבונט מעל התא. זה מגן על התא מפני נזק UV.
- חברו את האלקטרודה השלילית (זכוכית מצופה TiO2)לחוט השלילי של המולטימטר, ואת האלקטרודה החיובית (C) לחוט החיובי של המולטימטר(איור 5).
- הגדר את המולטימטר לוולנטים, ומדוד את המתח. זהו פוטנציאל המעגל הפתוח (מתח מרבי בזרם אפס). לכסות את התא (עם יד או אובייקט מוצק) כדי להבטיח כי המתח פוחת.
- הגדר את המולטימטר למיליאמפר (mA) ומדוד את הזרם המרבי. זהו זרם קצר (זרם מרבי במתח אפס). לכסות את התא עם (ביד) כדי להבטיח כי הזרם פוחתת.
- הקלט עקומת מתח זרם מלאה באמצעות פוטנציומטר 500 Ω כעומס משתנה.
- קבע איזה קצה חוט בפוטנציומטר הוא הברז המרכזי. עופרת זו מאפשרת להתנגדות להיות מגוונת. כדי לעשות זאת, חבר את המולטימטר (מוגדר לאוהם) לשניים מהפניות בפוטנציומטר, ושנה את ההתנגדות על הפוטנציומטר. שים לב אם ההתנגדות משתנה. חזור על כך עם שני השילובים האחרים של הפניות. שינויים בהתנגדות יש לראות בשניים משלושת השילובים. ההפניה ששימשה בשני השילובים שהעניקו שינויים היא הברז המרכזי, והשניים האחרים זהים מבחינה פונקציונלית.
- הרכיבו את המעגל כפי שמוצג באיור 5 (מימין).
- הגדר את הפוטנציומטר להתנגדות מלאה (או אפסית) ושים לב לזרם ולמתח.
- לשנות את ההתנגדות על potentiometer במרווחים קטנים ולשים לב לזרם ומתח, כך שיש כמה נקודות המשתרעות על כל הטווח של potentiometer. הקפד לא להזיז את התא במהלך מדידות אלה. לאחר שהזרם מתחיל להשתנות, הקפד לאסוף נקודות נתונים רבות; ניתן להשיג פחות נקודות נתונים כאשר הוא קבוע.
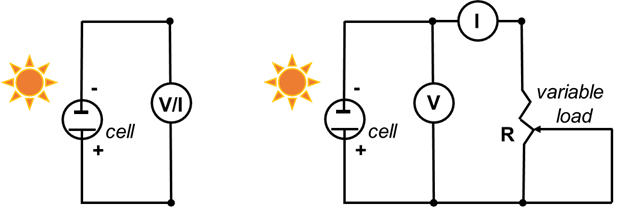
איור 5. דיאגרמת מעגלים כדי למדוד את הפוטנציאל של המעגל הפתוח ואת זרם המעגל הקצר (משמאל, שלבים 6.3 ו- 6.4) ולתעד את עקומת ה- I-V (מימין).
Results
עבור כל נקודת נתונים שנאספת בשלבים 6.5.3-6.5.4, חשב את הצפיפות הנוכחית (mA/ cm 2 ) ואתצפיפותההספק (mW / cm2). כדי לחשב את הצפיפות הנוכחית, חלק את הזרם לפי שטח הפנים של הסרט שנקבע בשלב 2.7. כדי לחשב את צפיפות הכוח, הכפל את המתח בצפיפות הזרם. התווה את הזרם (mA) לעומת מתח (mV) עבור הנתונים שנאספו בשלבים 6.3, 6.4 ו- 6.5.3-6.5.4. התווה את הצפיפות הנוכחית לעומת וולט עבור כל הנתונים. זה צריך להיות ליד "הברך" של העקומה. קבע את אור השמש ליעילות המרת האנרגיה החשמלית על ידי חלוקת ההספק המרבי (mW/cm2)על ידי האנרגיה הסולארית הנכנסת (נלקח להיות 800-1,000 W/m2),והכפלה ב -100%.
ניתוח הנתונים והכנת עקומות I-V הוא סטנדרטי בספרות התאים הסולאריים כאמצעי להשוות את הביצועים של תאים. מתח המעגל הפתוח שנמדד צריך להיות בין 0.3 ל 0.5 V, ופוטנציאל קצר של 1-2 mA / ס"מ2 צריך לקבל.
Application and Summary
וידאו זה הראה את ההכנה והניתוח של DSSC פשוט.
תאים סולאריים הופכים נפוצים יותר, ויש הרבה מחקר שנעשה כדי לקדם את הביצועים שלהם. תאים סולאריים מסורתיים המבוססים על מוליכים למחצה מסיליקון משמשים לייצור פאנלים סולאריים המשמשים בחלל ובכדור הארץ. נמל התעופה הבינלאומי של דנבר עושה שימוש באקלים שטוף השמש של קולורדו ויש לו ארבעה מערכים סולאריים המספקים 6% מצרך האנרגיה של שדה התעופה.
מחשבי DSSCs פועלים ביעילות של עד 15%,7% לעומת יעילות של 14%-17% עבור לוחות סיליקון מסחריים בעלות נמוכה מסורתיים. בעוד יעילות התפעול של DSSCs היא תחרותית, העלות הגבוהה של חומרים (כגון Ru-dye) היא בעייתית עבור יישומים בקנה מידה גדול. אולי החיסרון הגדול ביותר של DSSCs הוא השימוש באלקטרוליטים נוזליים הרגישים לשינויי טמפרטורה. האלקטרוליט הנוזלי יכול לקפוא בטמפרטורות נמוכות, ובכך לעצור את ייצור החשמל ו/או לגרום נזק מבני לפאנל הסולארי. בטמפרטורות גבוהות, האלקטרוליט הנוזלי מתרחב, מה שהופך את איטום הלוחות למאתגר.
References
- Williams, R. Becquerel Photovoltaic Effect in Binary Compounds. J Chem Phys, 32 (5), 1505-1514 (1960).
- Perlin (2005), Late 1950s - Saved by the Space Race", Solar Evolution - The history of Solar Energy. The Rahus Institute. Retrieved 28 June 2016.
- Regan, B., Gratzel, M. Nature, 353, 737-740 (1991).
- Miessler, G. L., Fischer, P. J., Tarr, D. A. Inorganic Chemistry, Pearson, 2014.
- Wikipedia page: Dye-sensitized solar cell,
- Smestad, G. P., Grätzel, M. Demonstrating Electron Transfer and Nanotechnology: A Natural Dye-Sensitized Nanocrystalline Energy Converter. J Chem Ed. 75 (6), 752 (1998).
- Burschka, J., Pellet, N., Moon, S.-J., Humphry-Baker, R., Nazeeruddin, M. K., Grätzel, M. Sequential deposition as a route to high-performance perovskite-sensitized solar cells. Nature, 499 (7458), 316-9 (2013).
Tags
Skip to...
Videos from this collection:

Now Playing
תאים סולאריים רגישים לצבע
Inorganic Chemistry
15.7K Views

סינתזה של מטלוקן Ti(III) בטכניקת קו שלנק
Inorganic Chemistry
31.5K Views

חיישני תא כפפות וטילמאה
Inorganic Chemistry
18.6K Views

טיהור פרוקן על ידי תת-הכרתיות
Inorganic Chemistry
54.3K Views

שיטת אוונס
Inorganic Chemistry
68.0K Views

עקיפה של קריסטל ואבקה
Inorganic Chemistry
103.9K Views

ספקטרוסקופיית תהודה פרמגנטית אלקטרונית (EPR)
Inorganic Chemistry
25.3K Views

Mössbauer Spectroscopy
Inorganic Chemistry
21.9K Views

אינטראקציה בסיס חומצה לואיס ב Ph3P-BH3
Inorganic Chemistry
38.7K Views

מבנה פרוקן
Inorganic Chemistry
79.1K Views

יישום תורת הקבוצות לספקטרוסקופיית IR
Inorganic Chemistry
44.9K Views

תורת מסלולית מולקולרית (MO)
Inorganic Chemistry
35.1K Views

גלגלי משוטים מרופדים ממתכת מתכתית
Inorganic Chemistry
15.3K Views

סינתזה של קומפלקס קובלט נושא חמצן(II)
Inorganic Chemistry
51.5K Views

ייזום פוטוכימי של תגובות פילמור רדיקליות
Inorganic Chemistry
16.7K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved