Farbstoffsensibilisierte Solarzellen
Überblick
Quelle: Tamara M. Powers, Department of Chemistry der Texas A & M University
Der heutigen modernen Welt erfordert die Verwendung einer großen Menge von Energie. Während wir Energie aus fossilen Brennstoffen wie Kohle und Öl nutzen, diese Quellen sind nicht erneuerbare und damit der Vorrat ist begrenzt. Um unseren globalen Lebensstil aufrecht zu erhalten, müssen wir Energie aus erneuerbaren Quellen extrahieren. Die vielversprechendsten erneuerbare Energiequelle in Hülle und Fülle, ist die Sonne, die uns mehr als genug Sonnenenergie vollständig unseren Planeten viele Male über Kraftstoff liefert.
Wie extrahiere wir Energie aus der Sonne? Natur war der erste, es herauszufinden: Photosynthese ist der Prozess, bei dem Pflanzen Wasser und Kohlendioxid in Kohlenhydrate und Sauerstoff konvertieren. Dieser Prozess tritt in den Blättern der Pflanzen, und stützt sich auf die Chlorophyll-Pigmente, die die Blätter grünen Farbe. Es ist diese farbige Moleküle, die die Energie aus dem Sonnenlicht aufnehmen, und dies absorbiert Energie, die die chemischen Reaktionen fährt.
Im Jahre 1839 erstellt Edmond Becquerel, dann 19 Jahre alten französischen Physiker experimentieren im Labor seines Vaters, die erste Photovoltaik-Zelle. Er beleuchtet eine saure Lösung von Silberchlorid, das war verbunden mit Platin-Elektroden, die eine Spannung erzeugt und aktuell. 1 viele Entdeckungen und Fortschritte wurden in den späten 19th understen Hälfte des 20. Jahrhunderts , und es war erst 1954 die erste praktische Solarzelle von Bell Laboratories gebaut wurde. Beginnend in den 1950er Jahren, wurden Solarzellen zur Stromversorgung von Satelliten im Weltraum. 2
Solarzellen sind elektrische Geräte, die Licht erstelle ich einen Strom nutzen. Dieses Video demonstriert, Vorbereitung und Erprobung von eine solche Art der Zelle, die farbstoffsensibilisierten Solarzelle (DSSC). Zuerst an der UC Berkeley von Brian O'Regan und Michael Grätzel erfunden, verfolgt Grätzel diese Arbeit an der École Polytechnique Fédérale de Lausanne in der Schweiz, ihren Höhepunkt in der ersten hocheffizienten DSSC 1991. 3 diese Solarzellen, wie Pflanzen, mithilfe einen Farbstoff Kabelbaum Energie von der Sonne.
Grundsätze
Band-Theorie:
Wenn zwei Atome zusammenkommen, Molekülorbitale zu bilden, werden zwei orbitale gebildet, eine mit einer Bindung und das andere mit einer antibonding Symmetrie. 4 diese sind getrennt durch eine bestimmte Menge an Energie. Wenn n Atome zusammenkommen, um Molekülorbitale, wie z. B. in fester, n Molekülorbitale Form zu bilden. Wenn n groß ist, ist die Anzahl der orbitale, die eng in Energie verteilt sind ebenfalls groß. Das Ergebnis ist eine Band der orbitale ähnliche Energie (Abbildung 1). Elektronen aus den Atomen befinden sich in diesen Bändern. Das Volant-Band ist die höchste Energieband, die mit Elektronen aufgefüllt wird. Es ist verwandt mit dem höchsten besetzten molekularen Orbital (HOMO) von Molekülen. Das Leitungsband ist am untersten Streifen, die nicht durch Elektronen aufgefüllt, und ist vergleichbar mit dem niedrigsten unbesetzten molekularen Orbital (LUMO) von Molekülen. Die Bandlücke ist die Energiedifferenz zwischen diesen beiden Bands.
Wenn die Bandlücke groß ist, das feste Material ist ein Isolator: Elektronen nicht frei fließen innerhalb des Materials (Abbildung 1). Im Gegensatz dazu sind Dirigenten in denen der Volant-Wärmeleitung Bandabstand verschwimmt. In einem Leiter, wie ein Metall löst Anlegen einer Spannung einige der Elektronen in den Valenzbandes auf das Leitungsband. Diese angeregten Elektronen sind frei beweglich. Die Elektronen hinterlassen positive Löcher, die auch frei beweglich sind. In der Realität die Löcher bewegen sich nicht, sondern eher Elektronen bewegen sich die positiven Löcher zu füllen. In Leitern erhöhen die Temperatur erhöht, molekulare Schwingungen, dadurch behindern den Fluss von Elektronen und die Leitfähigkeit abnimmt.
Halbleiter sind Materialien, die als Isolatoren bei 0 Kelvin, sondern Dirigenten zu werden, da die Temperatur (Abbildung 1 steigt). Deshalb, weil die Band Lücke-die Energie zwischen Valence und Wärmeleitung Band-ist klein, so thermische Energie ausreichend ist, um Elektronen in das Leitungsband anregen. Typische intrinsische Halbleiter gehören Silizium und Germanium.
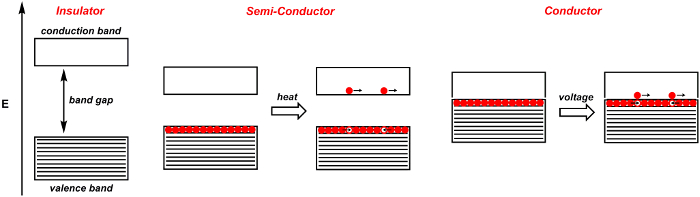
Abbildung 1. Band-Diagramm für ein Isolator, Halbleiter und Dirigent. Schattigen Bands sind gefüllt mit Elektronen, während weiße Bänder leer sind. Diskrete Elektronen sind durch eine rote Kugel angezeigt, während diskrete Löcher durch eine weiße Kugel gekennzeichnet sind.
Photovoltaischen Effekt:
Wenn Licht auf einen Halbleiter trifft, kann es ein Elektron aus der Valenzbandes auf das Leitungsband begeistern. Dieses Elektron kann dann mit dem Loch es zurückgelassen, was keine net Fluss von Elektronen rekombinieren. Oder es kann durch den Halbleiter, um eine Rennstrecke, bewegen und rekombinieren mit einem Loch am anderen Ende der Strecke. Dieser Fluss von Elektronen erzeugt aus Sonnenlicht ist den photovoltaischen Effekt bezeichnet. Dieses letztere Szenario ist erwünscht, um Elektrizität zu erzeugen, und so müssen Systeme entworfen werden, um dies über Rekombination bevorzugen.
Eine Möglichkeit, dies zu bevorzugen ist, Zellen mit einem PN-Übergang, d. h., eine Kreuzung zwischen einem n und p-dotierten Halbleiter zu entwerfen. Dies sind Halbleiter, wobei einige der Atome wurden, ersetzt werden benachbarte Atome auf der periodischen Tabelle. Im n-dotierten Halbleiter sind diese durch Atome, aus die mehr Elektronen haben, und im p-dotierten Halbleiter, diese sind ersetzt durch Atome, die weniger Elektronen haben. "Traditionelle" Silizium-basierte Solarzellen machen dieses Ansatzes zu verwenden.
Eine neue Art von Solarzellen sind jedoch DSSC, oft bezeichnet als die Grätzel-Zelle. 5 sind viel versprechend, dass sie semi-transparent sind, und ihre Kosten deutlich geringer sind. Diese Solarzellen noch machen Verwendung von Halbleitern, aber es ist ein Farbstoff, der verwendet wird, um das Licht von der Sonne zu absorbieren.
Komponenten eine DSSC:
Es gibt viele Komponenten, eine DSSC, der in Abbildung 2dargestellt ist.
Farbstoff
Um den photovoltaischen Effekt zu fördern, macht eine DSSC Farbstoffe verwenden. Dye-Molekül absorbiert Licht, ein Elektron aus einem orbital Verkleben zu einem Anti-Abbinden Orbital zu fördern. Dieses aufgeregt Elektron kann dann wieder auf dem Abbinden Orbital, wodurch kein Fluss von Elektronen fallen. Oder es kann in ein Halbleiter, der produktiven Weg ein DSSC injiziert werden. Dies hinterlässt ein Loch, das ausgefüllt werden muss, um den Stromkreis zu schließen. Für den produktiven Weg muss die Energie des Elektrons in der Farbstoff aufgeregt stand das Leitungsband des Halbleiters größer sein. Die Farbe sollte auch viel des Sonnenspektrums, zur Verbesserung der Effizienz der Zelle aufnehmen. Typische Farben sind Ruthenium (Ru)-basiert und somit eine DSSC begrenzt, da dieses Metall nicht sehr ergiebig ist.
In diesem Experiment nutzen wir einen natürlichen Farbstoff (Anthocyane) gefunden in einigen Beeren wie Brombeeren und Himbeeren. Die Struktur von dem Farbstoff Anthocyan muss verfügen über mehrere = O oder OH - Gruppen, die den Farbstoff binden an die TiIVO2 Oberfläche (Abbildung 3) ermöglichen. 6
Halbleiter
Aufgeregt Elektrons fließt dann in das Leitungsband des Halbleiters. Die Halbleiter-den wir in diesem Experiment verwenden ist TiO2.
Anode
Das Elektron fließt aus dem Halbleiter zur Anode, die in diesem Fall SnO2-beschichtetes Glas. Die SnO-2 ermöglicht eine leitfähige Oberfläche auf dem Glas, das sonst ein Isolator wäre.
Kathode
Nach dem durchlaufen einer Last, kommt das Elektron an der Kathode, die ebenfalls in SnO2behandelt wird. Die Kathode ist zusätzlich mit einem Katalysator, in diesem Fall Graphit, bedeckt welche die Redoxreaktion des Mediators fördert.
Mediator
Das Elektron wird von der Kathode auf ich3-, wodurch es zu ich–. Diese reduzierten Molekül kann dann ein Elektron, das Loch im Farbstoff Molekül, Abschluss der Strecke hinter sich gelassen Spenden. Dieser Prozess regeneriert ich3–. Der Unterschied zwischen dem ich3–/– i Zellen potenzielle und das Fermi-Niveau entspricht dem offenen Kreislauf Potenzial der Solarzelle oder die maximale Spannung, die mit der Zelle produziert werden können.
In diesem Video eine DSSC vorbereitet und seine Leistung wird bewertet.
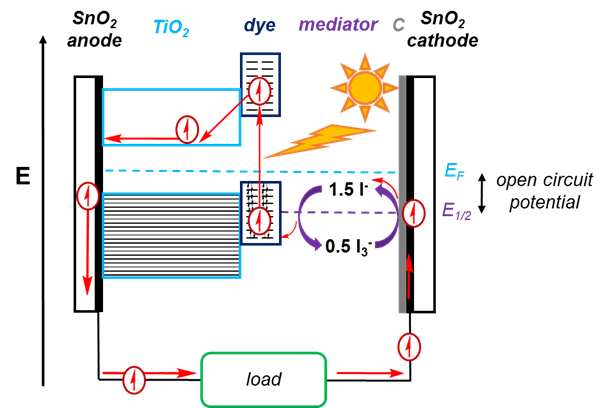
Abbildung 2. Schematische Darstellung einer DSSC. Sonnenlicht wird durch den Farbstoff, heben ein Elektron ein Orbital Anti-Bindung in der Farbstoff absorbiert. Dieses Elektron bewegt sich dann auf das Leitungsband TiO2 , hinterlässt ein Loch. Das Elektron geht rund um die Rennstrecke und übergibt eine Last und wird verwendet, um ich3– i-, die dann zurück zu ich oxidiert ist3– als das Elektron füllt das Loch links in den Farbstoff.

Abbildung 3. Anthocyanin Pigmente in einigen Beeren gefunden werden an die TiO2 Oberfläche Chelatkomplex.
Verfahren
1. Vorbereitung des TiO2 einfügen
- Masse 6 g kolloidalem TiO2 Pulver aus, und legen Sie sie in einem Mörser.
- Sorgfältig die TiO22-3 mL Essig hinzu, und beginnen Sie, die Suspension mit dem Stößel Schleifen, bis eine gleichmäßige Paste entsteht. Das Schleifen dient zur aggregierten Klumpen in das Pulver aufzulösen.
- Fügen Sie Essig, in ~ 1 mL erhöht während des Schleifens, bis zu ~ 9 mL Gesamtvolumen. Vor jeder Zugabe sollte die Konsistenz der Paste gleichmäßig und frei von Klumpen werden. Die endgültige Paste sollte dick, aber nicht so dick, dass es aus einer Tropfflasche herausgedrückt werden kann nicht.
- Tropfen Sie 1 Spülmittel auf 1 mL destilliertem Wasser, mischen Sie vorsichtig.
- Die TiO2 Aussetzung fügen Sie die Seifenlösung Gericht hinzu und mischen Sie vorsichtig, ohne dabei Luftblasen produzieren.
- Lassen Sie die Suspension für 15 min equilibrate. Das Spülmittel dient als ein Tensid, um die Aufhängung leichter machen zu einem gleichmäßigen Film auf dem Glas verteilt.
2. Ablagerung von TiO2 auf Glas
- Reinigen Sie zwei leitende Glasplatten. Genießen Sie ein Wischtuch mit Ethanol und verwenden Sie, um sauber zwei leitfähige Objektträger zu wischen. Legen Sie die sauberen Folien auf eine frische Windex.
- Bestimmen Sie, welche Seite des Glases leitend ist. Mit einem Multimeter auf Ohm eingestellt, berühren Sie beide führt zu einer Seite des Glases. Wenn eine Lesung zwischen 10 und 30 Ω beobachtet wird, ist es die leitende Seite. Eine Lesung von 0 Ω zeigt die nichtleitend Seite.
- Maskieren Sie die Folie. Legen Sie einen Objektträger mit seinen leitenden Seite nach oben und das andere mit seiner leitenden Seite nach unten. Halten Sie sorgfältig die Folien berühren, gleitet Band das Glas an die Bank-Spitze. Legen Sie das Maßband auf drei der vier Seiten der Folien, die dafür sorgen, dass ~ 5-8 mm der Folie fällt unter Band auf jeder der drei Seiten (Abbildung 4). Drücken Sie das Band fest, um sicherzustellen, dass keine Luftblasen vorhanden sind.
- Die TiO2 Paste auftragen. Mit einem Glasstab, wenden Sie eine dünne Linie der Paste auf die maskierten Oberkante der Folie. Verwenden der Glasstab vorsichtig Rollen die Paste über die gesamte Länge der Folie, und sichern Sie. Wiederholen Sie diese Bewegung 2-3x ohne Anheben der Rute, oder bis ein gleichmäßiger Film entsteht.
- Wenn der Film nicht einheitlich ist, einfach mit einem Wischtuch abwischen, reinigen Sie das Glas mit Ethanol, und nach dem Trocknen, versuchen Sie es erneut.
- Lassen Sie den Film ein wenig trocknen, dann entfernen Sie vorsichtig das Klebeband aus dem Glas. Die Folie mit dem TiO2 Film sollte die leitende Seite. Die andere Folie kann gereinigt und später verwendet werden.
- Tempern des TiO2 Films. Legen Sie vorsichtig die Folie (TiO2 Seite nach oben) auf einer heißen Platte, die auf 450 ° c eingestellt ist Beobachten Sie, wie die TiO2 eine lila/braun Farbe dunkelt und gewinnt ihre weißen Farbe. An dieser Stelle die Herdplatte ausschalten und den Film langsam abkühlen lassen. Wenn die Folie zu schnell abgekühlt wird, kann es zu knacken oder zerbrechen.
- Messen Sie mit einem Lineal die Fläche, die mit der Folie bedeckt ist, und notieren Sie sich diesen Wert.

Abbildung 4 . Ablagerung von TiO2 auf Glas.
(3) Fleck der TiO2 Film mit Farbstoff
- Legen Sie ein paar Brombeeren, Himbeeren oder Kirschen in einem Mörser zerstoßen und mit einem Stößel zerdrücken.
- Filtern Sie die Lösung durch einen Kaffeefilter und in eine Petrischale. Es möglicherweise notwendig, den Saft ein paar mL Wasser hinzuzufügen.
- Legen Sie die abgekühlten TiO2 Film, auf der Vorderseite nach unten in der Petrischale. Seien Sie vorsichtig, keiner TiO2Rubbel. Können Sie der Farbstoff auf die Folie adsorbiert werden. Dies kann mehrere Minuten dauern.
- Sobald der Film voll beschichtet ist (es sollte sein dunkles Rot oder violett und gibt es keine weißen Flecken), heben Sie die Folie mit einer Zange (vorsichtig nur zäh sein, das Glas und nicht der Film), und spülen Sie die Folie mit Wasser und Ethanol. Der Film mit einem Wischtuch trocken tupfen, und sofort nutzen.
- Wenn nicht sofort verwendet, dann speichern Sie den Film in einer Petrischale, die enthält Essigsäure bei pH 3-5, und bedecken Sie die Schüssel mit dem Deckel und in Folie wickeln.
4. bereiten Sie die Gegenelektrode
- Verwenden einen anderen leitfähigen Objektträger, Schritte 2.1-2.2.
- Den Kohlenstoff-Katalysator auf die leitfähige Seite auftragen. Mit einer Pinzette, die Rutsche, leitfähige Seite halten Sie, über die Spitze des einen Bunsenbrenner. Die Folie so verschieben, dass der Ruß auf der gesamten Oberfläche, aber nicht länger als 30 sammelt s. Lassen Sie die Folie abkühlen, und wischen Sie den Ruß auf der einen Seite der Folie mit einem Wattestäbchen.
- Alternativ mit einer HB-Bleistift, leitfähige vollflächig mit Graphit zu decken. Dies gibt eine robustere Elektrode, aber eine, die weniger gut führt.
5. Montieren Sie die Solarzelle
- Trocknen Sie die gefärbten Film. Spülen Sie ihn mit Ethanol und legen Sie es auf ein Wischtuch. Tupfen Sie den Film mit einem zweiten Windex. Der Film muss trocken, keinen Einfluss auf die Elektrolyt-Lösung sein.
- Legen Sie mit der Elektrode Folienseite, sanft die Kohlenstoff-beschichtete Elektrode auf (Kohlenstoff verdeckt). Achten Sie darauf, die Folien versetzt, sodass die exponierten Seiten der beiden Elektroden, Drähte befestigt werden können. Platzieren Sie zwei Binder Clips seitlich neben der Offset Glas.
- Legen Sie ein paar Tropfen von der Elektrolytlösung an einem Rand der Folien und sorgfältig öffnen/schließen jede Seite der Zelle durch abwechselnd öffnen/schließen der Bindemittel-Clips. Achten Sie darauf, dass alle von den verschmutzten Bereich steht in Kontakt mit der Elektrolytlösung, und wiederholen Sie Schritt 5.2, falls erforderlich.
- Wischen Sie die überschüssige Elektrolyt aus die belichteten Bereiche mit Kimwipes und Ethanol.
- Befestigen Sie die Krokodilklemmen an den zwei ausgesetzten Seiten der Solarzelle.
6. Zelle Leistungsmessung
Hinweis: Im Idealfall sind diese Messungen außerhalb erfolgen. Jedoch wenn das Wetter nicht zulässt, können sie im Inneren mit einer Halogenlampe getan werden. Alle Messungen sollte ohne Bewegung der Zelle erfolgen, so dass sie unter gleichen Bedingungen durchgeführt werden.
- Achten Sie darauf, die Zelle ausrichten, sodass die TiO2 Film nach oben in Richtung der Sonne, und legen Sie eine Polycarbonat-Abdeckung über der Zelle. Dies schützt die Zelle vor UV-Schäden.
- Verbinden Sie die negative Elektrode (TiO2-beschichtetes Glas), das negative Kabel des Multimeters und die positive Elektrode (C) mit dem positiven Kabel des Multimeters (Abbildung 5).
- Das Multimeter auf Volt und Messen Sie die Spannung zu. Dies ist die offene Schaltung potenzielle (maximale Spannung bei Null Strom). Decken Sie die Zelle (mit einer Hand oder einen festen Gegenstand) um sicherzustellen, dass die Spannung sinkt.
- Das Multimeter auf Milliampere (mA) und Messen Sie den maximalen Strom zu. Dies ist der Kurzschlussstrom (Maximalstrom bei Null Spannung). Decken Sie die Zelle mit (mit einer Hand) um sicherzustellen, dass die aktuellen abnimmt.
- Nehmen Sie eine volle Strom-Spannungs-Kurve mit einem 500-Ω-Potentiometer als eine Variable Last auf.
- Bestimmen Sie die führen auf das Potentiometer der zentralen Wasserhahn ist. Diese Führung ermöglicht den Widerstand variiert werden. Um dies zu tun, verbinden Sie das Multimeter (eingestellt auf Ohm) mit zwei der Leitungen auf die Potentiometer und variieren Sie den Widerstand auf das Potentiometer. Hinweis: Wenn der Widerstand ändert. Wiederholen Sie dies mit den anderen zwei Kombinationen von Leads. Widerstandsänderungen sollte in zwei der drei Kombinationen beobachtet werden. Die Führung, die in beiden Kombinationen verwendet wurde, die Änderungen gegeben hat ist die zentrale Hahn, und die anderen beiden sind funktional identisch.
- Montieren Sie die Schaltung, wie in Abbildung 5 (rechts) dargestellt.
- Legen Sie das Potentiometer zu voll (oder null) Widerstand, und notieren Sie sich den Strom und Spannung.
- Ändern Sie den Widerstand auf das Potentiometer in kleinen Schritten und beachten Sie Strom und Spannung, so dass es gibt einige Punkte, die das gesamte Spektrum des Potentiometers erstrecken. Achten Sie darauf, nicht die Zelle während dieser Messungen verschoben. Sobald der Strom beginnt zu ändern, achten Sie darauf, viele Datenpunkte zu sammeln; weniger Datenpunkte können erhalten werden, wenn es konstant ist.
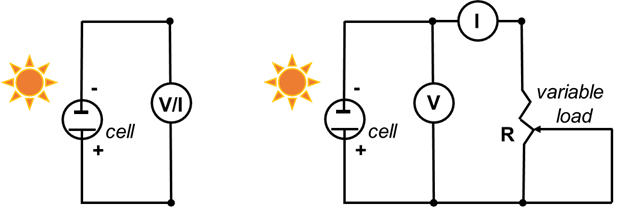
Abbildung 5 . Schaltplan zur Messung der offenen Potenzial und Kurzschlussstrom (links, Schritte 6.3 und 6.4) und der spannungs-Kurve (rechts) aufzuzeichnen.
Ergebnisse
Berechnen Sie für jeden Datenpunkt in Schritten 6.5.3-6.5.4 gesammelt die Stromdichte (mA/cm2) und die Leistungsdichte (mW/cm2). Um die Stromdichte berechnen, teilen Sie den Strom durch die Fläche des Films, der im Schritt 2.7 ermittelt wurde. Um die Leistungsdichte zu berechnen, multiplizieren Sie die Spannung mit Stromdichte. Plot des Stroms (mA) versus Spannung (mV) für die Datenerhebung in Schritten 6.3, 6.4 und 6.5.3-6.5.4. Zeichnen Sie die Stromdichte gegenüber Volt für alle Daten. Dies sollte in der Nähe das "Knie" der Kurve sein. Bestimmen Sie das Sonnenlicht elektrische Energie-Wirkungsgrad durch die Aufteilung der maximalen Leistung (mW/cm2) durch die eingehenden Solarstrom (genommen werden 800-1.000 W/m2) und Multiplikation mit 100 %.
Die Analyse der Daten und Erstellung von spannungs-Kurven ist standard in der Solarzelle-Literatur als ein Mittel, um die Leistung der Zellen zu vergleichen. Die Leerlaufspannung gemessen sollte zwischen 0,3 und 0,5 V, und ein Kurzschluss-Potenzial von 1 bis 2 mA/cm2 gesammelt werden.
Anwendung und Zusammenfassung
Dieses Video zeigt die Aufbereitung und Analyse von einem einfachen DSSC.
Solarzellen werden immer häufiger, und es gibt viel Forschung getan wird, um ihre Leistungen zu fördern. Traditionelle Solarzellen, die auf Silizium-Halbleitern basieren werden verwendet, um Sonnenkollektoren zu machen, die im Raum und auf der Erde verwendet werden. Der Denver International Airport macht nutzen Kolorados sonniges Klima und hat vier Solaranlagen bietet 6 % des Flughafens Energie braucht.
DSSCs arbeiten mit Wirkungsgraden bis zu 15 %,7 im Vergleich zu 14-17 % Wirkungsgrad für traditionelle Low Cost, kommerziellen Silizium-Panels. Während Betriebseffizienz DSSCs wettbewerbsfähig sind, ist die hohen Kosten der Materialien (z. B. der Ru-Farbstoff) problematisch für großflächige Anwendungen. Vielleicht der größte Nachteil von DSSCs ist die Verwendung eines flüssigen Elektrolyten, die empfindlich auf Temperaturschwankungen. Der flüssige Elektrolyt kann bei niedrigen Temperaturen, dadurch Eindämmung Stromerzeugung und/oder was zu strukturellen Schäden an der Solar-Panel einfrieren. Bei hohen Temperaturen erweitert flüssige Elektrolyten, wodurch die Abdichtung der Platten herausfordernd.
Referenzen
- Williams, R. Becquerel Photovoltaic Effect in Binary Compounds. J Chem Phys, 32 (5), 1505-1514 (1960).
- Perlin (2005), Late 1950s - Saved by the Space Race", Solar Evolution - The history of Solar Energy. The Rahus Institute. Retrieved 28 June 2016.
- Regan, B., Gratzel, M. Nature, 353, 737-740 (1991).
- Miessler, G. L., Fischer, P. J., Tarr, D. A. Inorganic Chemistry, Pearson, 2014.
- Wikipedia page: Dye-sensitized solar cell,
- Smestad, G. P., Grätzel, M. Demonstrating Electron Transfer and Nanotechnology: A Natural Dye-Sensitized Nanocrystalline Energy Converter. J Chem Ed. 75 (6), 752 (1998).
- Burschka, J., Pellet, N., Moon, S.-J., Humphry-Baker, R., Nazeeruddin, M. K., Grätzel, M. Sequential deposition as a route to high-performance perovskite-sensitized solar cells. Nature, 499 (7458), 316-9 (2013).
Tags
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Farbstoffsensibilisierte Solarzellen
Inorganic Chemistry
15.7K Ansichten

Synthese eines Ti(III)-Metallocen-Katalysators mittels Schlenk-Technik
Inorganic Chemistry
31.5K Ansichten

Handschuhbox und Verunreinigungssensoren
Inorganic Chemistry
18.6K Ansichten

Reinigung von Ferrocen durch Sublimation
Inorganic Chemistry
54.3K Ansichten

Die Evans-Methode
Inorganic Chemistry
68.0K Ansichten

Einkristall- und Pulverröntgendiffraktometrie
Inorganic Chemistry
103.9K Ansichten

Elektronenparamagnetische Rezonanzspektroskopie (EPR-Spektroskopie)
Inorganic Chemistry
25.3K Ansichten

Mößbauerspektroskopie
Inorganic Chemistry
21.9K Ansichten

Lewis-Säure-Base-Wechselwirkungen in Ph3P-BH3
Inorganic Chemistry
38.7K Ansichten

Struktur von Ferrocen
Inorganic Chemistry
79.1K Ansichten

Anwendung der Gruppentheorie auf die IR-Spektroskopie
Inorganic Chemistry
44.9K Ansichten

Molekülorbital (MO)-Theorie
Inorganic Chemistry
35.1K Ansichten

Vierfach-metallgeklebte Schaufelräder
Inorganic Chemistry
15.3K Ansichten

Synthese eines Sauerstoff-transportierenden Cobalt(II) - Komplex
Inorganic Chemistry
51.5K Ansichten

Photochemische Initiierung von radikalischen Polymerisationsreaktionen
Inorganic Chemistry
16.7K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten