Determinazione delle regole di solubilità di composti ionici
Panoramica
Fonte: Laboratorio del Dr. Neal Abrams - SUNY College of Environmental Science and Forestry
La solubilità di un composto ionico può essere determinata tramite analisi qualitativa. L'analisi qualitativa è una branca della chimica analitica che utilizza proprietà chimiche e reazioni per identificare il catione o l'anione presente in un composto chimico. Mentre le reazioni chimiche si basano su regole di solubilità note, quelle stesse regole possono essere determinate identificando i prodotti che si formano. L'analisi qualitativa non viene tipicamente eseguita nei moderni laboratori di chimica industriale, ma può essere facilmente utilizzata sul campo senza la necessità di strumentazione sofisticata. L'analisi qualitativa si concentra anche sulla comprensione delle reazioni ioniche e ioniche nette, nonché sull'organizzazione dei dati in un diagramma di flusso per spiegare le osservazioni e trarre conclusioni definitive.
Molti cationi hanno proprietà chimiche simili, così come le controparti anioniche. Una corretta identificazione richiede un'attenta separazione e analisi per identificare sistematicamente gli ioni presenti in una soluzione. È importante comprendere le proprietà acido/base, gli equilibri ionici, le reazioni redox e le proprietà del pH per identificare con successo gli ioni.
Mentre esiste un test qualitativo per praticamente ogni ione elementare e poliatomico, il processo di identificazione inizia tipicamente con la conoscenza di una "classe" di ioni analizzati; cationi o anioni, elementari o poliatomici, gruppi o periodi, transizione o gruppo principale. In questo esperimento, vengono identificati entrambi i tipi di ioni, cationi e anioni. I cationi includono anche ioni poliatomici.
Principi
L'identificazione di cationi e anioni si basa su reazioni chimiche note tra lo ione sconosciuto e un dato reagente. A volte, può essere la mancanza di una reazione che identifica positivamente anche lo ione. Tutti i composti ionici sono composti da un catione e un anione, e quando si verifica una reazione tra due diversi composti ionici, il catione di un composto viene attratto elettrostaticamente all'anione di un altro, formando un nuovo composto ionico. (NOTA: alcuni composti ionici unici hanno uno o più cationi o ioni. Un esempio potrebbe essere KNaC4H4O6 o (NH4)2Fe (SO4)2. La carica complessiva del composto ionico deve ancora sommarsi a zero.) Questo tipo di reazione è noto come reazione metatesica, o doppio spostamento, ed è mostrato di seguito:
w AB(aq) + xCD(aq)→yAD(s) + zCB(aq)
reazione molecolare
dove A e C sono reagenti cationici, B e D sono reagenti aninici, e i composti sono in proporzioni molari w e x, rispettivamente. Lo stesso vale per i prodotti AD(s) e CB(aq) con rapporti molari di y e z. Quando una reazione avviene in soluzione acquosa, la reazione molecolare può essere scritta come una combinazione di ioni liberi e prodotti insolubili nota come reazione ionica:
A+(aq) + B-(aq) + C+(aq) + D-(aq) →AD(s) + B-(aq) + C+(aq)
reazione ionica
Una reazione ionica mostra sia gli ioni coinvolti nella reazione sia quelli che non partecipano, noti come ioni spettatore. La formazione del prodotto insolubileAD(s) identifica gli ioni reagenti o potrebbe essere utilizzata per determinare una regola di solubilità per tali ioni. In tutti i casi, una reazione ionica netta è alla base di tutte le osservazioni, che è una forma semplificata della reazione ionica e mostra solo gli ioni coinvolti nella reazione.
A+(aq) + D-(aq)→ AD(s)
reazione ionica netta
Osservare una reazione chimica che produce un prodotto insolubile, o precipitato, è un marker per i partecipanti di una reazione ionica netta.
Le reazioni possono essere uniche per un certo catione o anione, o comuni a tutti gli ioni all'interno di un gruppo o classe di reagenti. Ad esempio, tutti gli ioni dei metalli di transizione reagiscono con lo ione solfuro, S2-, per formare precipitati insolubili. Molti metalli alcalino-terrosi formano precipitati bianchi in presenza di ioni carbonato o fosfato. Analisi di identificazione più selettive possono essere eseguite con soluzioni miste attraverso una combinazione di regole di solubilità e reattività chimica. Ad esempio, una soluzione contenente zinco, argento, nichel e ferro potrebbe essere separata in base al diagramma di flusso nella Figura 1. Il cloruro viene prima aggiunto alla soluzione, precipitando fuori cloruro d'argento, AgCl. I metalli rimanenti sono tutti precipitati in idrossido, con idrossido in eccesso che ri-dissolve lo zinco. Lo zinco è confermato in presenza di esacianoderrato di potassio, formando un precipitato verde. I restanti precipitati di ferro e nichel vengono raccolti e l'ammoniaca in eccesso viene aggiunta per sciogliere il nichel e il complesso di ferro solido viene raccolto. Il ferro viene ri-disciolto in presenza di acido e confermato con ione tiocianato. Il nichel viene identificato positivamente aggiungendo dimetilglioxima, formando un precipitato rossastro solido.
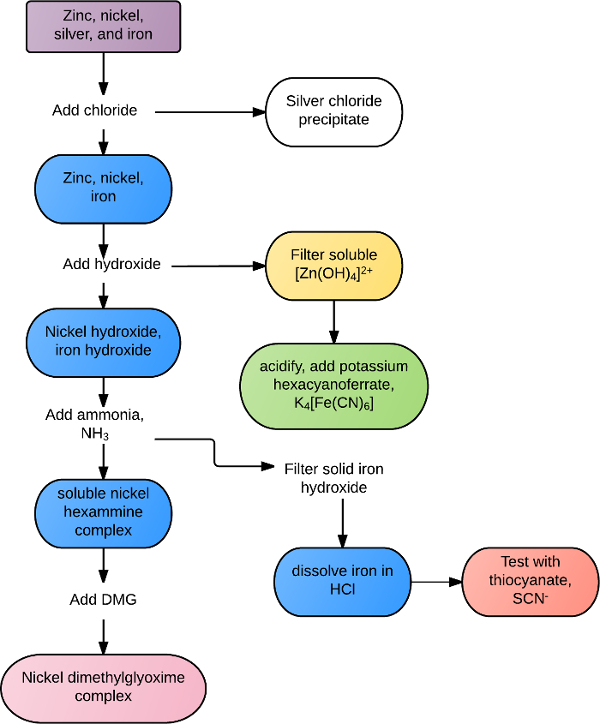
Figura 1. Esempio di diagramma di flusso di separazione della soluzione.
Procedura
1. Metodi generali
- Preparazione per l'analisi qualitativa
- Le reazioni sono generalmente fatte in piccole provette con volume di 5 ml o meno.
- Le soluzioni devono essere completamente solubili e devono essere relativamente diluite, in genere ~ 0,1 M.
- I reagenti devono essere aggiunti lentamente in termini di goccia e osservati attentamente.
- Sono necessarie diverse "soluzioni di prova" comuni per stabilire regole di solubilità o identificare uno ione sconosciuto. Questi contengono ioni noti per reagire specificamente con alcune specie chimiche (cationi o anioni).
- Le soluzioni comuni includono CaNO3, BaCl2, (NH4)2MoO4, HCl, AgNO3e NaOH e altre soluzioni secondo necessità.
- Miscelazione
- Mescolare le soluzioni picchiettando o ruotando la provetta in direzione verticale. Utilizzare un tappo o un tappo per evitare schizzi della soluzione.
- Rimuovere il tappo o il tappo, quindi riscaldare delicatamente le soluzioni con un bagno d'acqua o una fiamma fredda per indurre una reazione. Puntare la provetta lontano da qualsiasi individuo in laboratorio.
- Osservazione e recupero
- Separare il surnatante (soluzione non reagente) e precipitare usando la centrifugazione. Se si forma più precipitato quando viene aggiunto ulteriore ione di prova, la reazione è incompleta. Continuare ad aggiungere ioni di prova fino a quando non si formano più precipitati.
- Lavare il precipitato con centrifugazione e versando o decantando il surnatante. Aggiungere altra acqua e ripetere il processo per un totale di tre lavaggi.
- Lavare grandi quantità di precipitato mediante filtrazione sotto vuoto e recuperare il precipitato essiccato dalla carta da filtro.
- Si noti la formazione di un precipitato e le proprietà del precipitato come colore, spessore (gelatinoso, torbido, fine) e formazione di cristalli.
- Sicurezza e Rifiuti
- Indossare sempre occhiali di sicurezza durante l'esecuzione di esperimenti di analisi qualitativa. I guanti possono anche essere necessari in base ai reagenti utilizzati e ai prodotti formati.
- I metodi adeguati di smaltimento dei rifiuti devono essere seguiti da vicino. I prodotti nocivi possono formarsi quando più reagenti sono combinati in un unico contenitore.
2. Analisi degli anioni
- Identificazione di ioni fosfato, carbonato, cloruro e solfuro; PO43-, CO32-, Cl-, S2-
- Fosfato
- Aggiungere una soluzione contenente fosfato, PO43-, ad un'altra soluzione contenente ioni calcio, Ca2+. La formazione di un precipitato bianco indica la formazione di fosfato di calcio, Ca3(PO4)2.
- Poiché molti cationi formano prodotti insolubili con calcio, è possibile una reazione più specifica. Aggiungere H+ (acido) a Ca3(PO4)2 per sciogliere il solido e formare HPO42-. Quindi combinare l'HPO42- con molibdato di ammonio, (NH4)2MoO4. Un test positivo produce il precipitato giallo di fosfomolybdate di ammonio, NH4)3PO4(MoO3)12(s). Le reazioni ioniche nette sono le seguenti:
3 Ca2+(aq) + 2 PO43-(aq) → Ca 3PO4(s)
Ca3PO4(s) + 2 H+(aq) → 3 Ca2+ + 2 HPO42- (aq)
HPO42-(aq) + 12 (NH4)2MoO4(aq) + 23 H+(aq) → (NH4)3PO4 (MoO3)12(s) + 21 NH4+(aq) + 12 H2O(l)
- Carbonato
- I sali di carbonato sono generalmente insolubili tranne che in presenza di cationi di gruppo 1 e ammonio. Aggiungere qualche goccia di cloruro di calcio, CaCl2,alla soluzione contenente carbonato. In soluzioni con alte concentrazioni di carbonato, si forma un precipitato bianco e indica la possibile formazione di fosfato di calcio, CaCO3. La reazione ha molte interferenze, tra cui altri anioni come il fosfato.
Ca2+(aq) + CO32-(aq) → CaCO3(s) - Aggiungere H+ (acido) ad una soluzione contenente carbonato, CO32-. La formazione di bolle indica la presenza di CO2, che significa CO32- come reagente. Lo ione carbonato si comporta come una base in presenza di acido forte per formare gas e acqua di anidride carbonica.
CO32-(aq) + H+(aq) → CO2(g) + H2O(l)
- I sali di carbonato sono generalmente insolubili tranne che in presenza di cationi di gruppo 1 e ammonio. Aggiungere qualche goccia di cloruro di calcio, CaCl2,alla soluzione contenente carbonato. In soluzioni con alte concentrazioni di carbonato, si forma un precipitato bianco e indica la possibile formazione di fosfato di calcio, CaCO3. La reazione ha molte interferenze, tra cui altri anioni come il fosfato.
- Cloruro
- Aggiungere il nitrato d'argento a una soluzione contenente cloruro. La formazione di un precipitato bianco indica la formazione di AgCl(s):
Ag+(aq) + Cl-(aq) → AgCl(s)
- Aggiungere il nitrato d'argento a una soluzione contenente cloruro. La formazione di un precipitato bianco indica la formazione di AgCl(s):
- Solfuro
- Aggiungere una soluzione di cloruro di rame a una soluzione contenente solfuro. La formazione di un precipitato nero indica la formazione di solfuro di rame, CuS. In generale, le soluzioni contenenti ioni solfuro, S2-, reagiscono con gli ioni metallici per produrre un solfuro metallico insolubile.
S2- + Cu2+ → CuS(s).
Il valore del prodotto di solubilità, Ksp = 6,3 x 10-36, indica l'alto grado di insolubilità del prodotto.
- Aggiungere una soluzione di cloruro di rame a una soluzione contenente solfuro. La formazione di un precipitato nero indica la formazione di solfuro di rame, CuS. In generale, le soluzioni contenenti ioni solfuro, S2-, reagiscono con gli ioni metallici per produrre un solfuro metallico insolubile.
- Fosfato
3. Analisi dei cationi
- Tutti i metalli alcalini (gruppo 1) e alcuni metalli alcalino-terrosi (gruppo 2) sono solubili tranne che in condizioni specifiche.
- Quasi tutti i metalli del gruppo 3-13 sono considerati insolubili in presenza di solfuro, carbonato, fosfato e idrossido. Il colore e il tipo di precipitato varieranno.
- Posizionare una soluzione di cromo in una soluzione di idrossido. Si osserverà un precipitato verde. La reazione generale di un metallo +2 con un idrossido è mostrata di seguito:
M2+ + OH- → M(OH)2(s) - Non è possibile differenziare la maggior parte degli ioni metallici in base alla sola solubilità con alcune eccezioni degne di nota:
- L'aggiunta di argento, Ag+, mercurio,Hg 22+, o piombo, Pb2+ a cloruro, bromuro o ioduro provoca la formazione di precipitati.
- L'aggiunta di stronzio, Sr2+, bario, Ba2+, mercurio,Hg 22+, o piombo, Pb2+ provoca un precipitato in presenza di solfato.
- Ba2+ forma un solido giallo in presenza di CrO42-, BaCrO4(s). Questo è il pigmento utilizzato nella vernice a base di olio comunemente noto come "giallo bario".
- Posizionare una soluzione di cromo in una soluzione di idrossido. Si osserverà un precipitato verde. La reazione generale di un metallo +2 con un idrossido è mostrata di seguito:
- L'insolubilità limitata degli ioni metallici consente ad altri test qualitativi di identificare positivamente ciascun metallo. Mentre alcuni precipitano, altri subiscono cambiamenti di colore unici in presenza di ioni o molecole chelanti. Le identificazioni dei cationi includono nichel, ferro, alluminio e zinco; Ni2+, Fe3+, Al3+, Zn2+.
- Aggiungere nichel (II) in presenza di dimetilglioxima (H2dmg) per formare il precipitato rosso rosa Ni(H2dmg):
Ni2+(aq) + 2 H2dmg(aq) → Ni(Hdmg)2(s) + 2 H+(aq) - Aggiungere Ferro (III) allo ione tiocianato, SCN- per formare il complesso rosso sangue [FeNCS]2+]:
Fe3+(aq) + SCN-(aq) → [FeNCS]2+(aq) - Ioni di alluminio
- Combinare l'alluminio (III) con il pirocatecolo viola in una soluzione tampone di acetato di ammonio pH 6 per formare una soluzione blu.
- L'alluminio (III) viene anche precipitato in presenza di una base debole per formare il composto gelatinoso bianco Al(OH)3(s). L'aggiunta di più base fa sì che il composto formi il complesso solubile chiaro e incolore [Al(OH)4]-(aq).
- Ioni di zinco
- Aggiungere zinco (II) a una piccola quantità di base per formare un precipitato bianco. Quindi aggiungere più base per ri-dissolvere il precipitato e formare il solubile [Zn(OH)4]2- complesso.
- Aggiungere zinco (II) all'esacianoderrato di potassio, K4[Fe(CN)6] per formare il precipitato verde chiaro K2Zn 3[Fe(CN)6]2(s):
3 Zn2+(aq) + 2 K4[Fe(CN)6](aq) → K2Zn3[Fe(CN)6]2(s) + 6 K+(aq)
- Aggiungere nichel (II) in presenza di dimetilglioxima (H2dmg) per formare il precipitato rosso rosa Ni(H2dmg):
Applicazione e Riepilogo
Le reazioni qui mostrate possono essere utilizzate per identificare la presenza di una classe di cationi o anioni o essere utilizzate in modo molto specifico per un determinato ione. Poiché nelle analisi vengono utilizzati due reagenti, uno dei due reagenti può essere in genere rilevato utilizzando l'altro. Ad esempio, invece di analizzare la presenza di cloruro usando lo ione argento, lo ione argento può essere identificato usando il cloruro. Una combinazione di regole comuni di precipitazione seguite da specifici test colorimetrici o di precipitazione può essere utilizzata per identificare positivamente quasi tutti gli ioni, atomici o poliatomici, disponibili. Allo stesso tempo, la maggior parte di queste stesse regole può essere stabilita facendo reagire anioni e cationi insieme sistematicamente per generare una serie di regole per la solubilità dei cationi e degli anioni.
L'analisi qualitativa e le regole relative alla solubilità sono esperimenti comuni nel laboratorio di chimica generale. Ciò è dovuto, in parte, alla facilità, alla velocità e alla natura economica dei test. È per questi motivi che i test qualitativi vengono utilizzati anche nelle analisi sul campo e nei test di laboratorio di conferma. Ad esempio, un'azienda di geologia potrebbe voler sapere se esistono quantità significative di nichel nel deflusso del flusso da una miniera. Un semplice test aggiungendo l'acqua alla dimetilgloxima è selettivo per lo ione nichel. Allo stesso modo, le autorità di qualità dell'acqua possono utilizzare il bario (o altri metalli del gruppo 2) per rilevare il carbonato nell'acqua, rilevando così il livello di durezza dell'acqua. La strumentazione avanzata viene utilizzata, tuttavia, dove sono richiesti risultati quantitativi o è necessario identificare più ioni a livelli molto bassi. Ciò include varie forme di spettroscopia di massa, nonché cromatografia ionica e spettroscopia di luce.
Riferimenti
- Eaton, A. Standard Methods for the Examination of Water & Wastewater. Centennial ed. Washington, DC: American Public Health Association (2005).
Vai a...
Video da questa raccolta:

Now Playing
Determinazione delle regole di solubilità di composti ionici
General Chemistry
141.6K Visualizzazioni

Vetreria di laboratorio e relativi usi
General Chemistry
658.3K Visualizzazioni

Soluzioni e concentrazioni
General Chemistry
275.1K Visualizzazioni

Determinazione della densità di un solido e di un liquido
General Chemistry
556.8K Visualizzazioni

Determinazione della composizione percentuale di massa in una soluzione acquosa
General Chemistry
383.8K Visualizzazioni

Determinazione della formula empirica (minima)
General Chemistry
183.7K Visualizzazioni

Uso del pH-metro
General Chemistry
346.7K Visualizzazioni

Introduzione alla titolazione
General Chemistry
425.4K Visualizzazioni

Legge dei gas perfetti
General Chemistry
79.0K Visualizzazioni

Determinazione spettrofotometrica di una costante di equilibrio
General Chemistry
158.7K Visualizzazioni

Principio di Le Châtelier
General Chemistry
265.8K Visualizzazioni

Depressione del punto di congelamento per l'identificazione di un composto sconosciuto
General Chemistry
160.8K Visualizzazioni

Determinazione dell'equazione cinetica e dell'ordine di reazione
General Chemistry
196.3K Visualizzazioni

Utilizzo della calorimetria a scansione differenziale per misurare cambiamenti nell'entalpia
General Chemistry
44.7K Visualizzazioni

Complessi chimici di coordinazione
General Chemistry
91.7K Visualizzazioni