Method Article
Saggio di scambio lipidico in cellule viventi
In questo articolo
Riepilogo
Descriviamo un metodo per l'utilizzo della ciclodestrina per mediare lo scambio tra i lipidi della membrana plasmatica con i lipidi esogeni. Questa tecnica può essere abbinata a esperimenti che studiano le proteine transmembrana, che si comportano in modo diverso in ambienti lipidici simili a zattere rispetto agli ambienti non simili a zattere.
Abstract
I raft lipidici sono domini dinamici e ordinati nella membrana plasmatica spesso formati durante il raggruppamento e la segnalazione delle proteine di membrana. L'identità lipidica del lembo esterno guida la propensione della membrana a formare zattere lipidiche. La natura transitoria dei raft lipidici rende difficile lo studio nelle cellule viventi. Pertanto, i metodi che aggiungono o rimuovono i lipidi che formano zattere sul lembo esterno delle cellule viventi facilitano lo studio delle caratteristiche delle zattere, come i loro effetti sulle proteine di membrana. Gli esperimenti di scambio lipidico sviluppati nel nostro laboratorio utilizzano ciclodestrine caricate con lipidi per rimuovere e aggiungere fosfolipidi esogeni per modificare la costituzione lipidica della membrana plasmatica. La sostituzione della membrana con un lipide a zattera o non formante zattera può aiutare a studiare gli effetti sull'attività proteica transmembrana. Qui, descriviamo un metodo per lo scambio lipidico sul lembo esterno della membrana plasmatica utilizzando ciclodestrine caricate con lipidi. Dimostriamo la preparazione dei mezzi di scambio e il successivo trattamento delle cellule di mammifero attaccate. Mostriamo anche come misurare l'efficienza dello scambio utilizzando HP-TLC. Questo protocollo consente di sostituire quasi completamente il lembo esterno con lipidi esogeni senza alterare la vitalità cellulare, consentendo ulteriori sperimentazioni su membrane plasmatiche intatte modificate.
Introduzione
La membrana plasmatica è composta da un doppio strato lipidico arricchito con varie proteine di membrana, inclusi recettori transmembrana e canali ionici. I domini lipidici all'interno della membrana sono stati chiariti attraverso regioni solubili e insolubili in detergenti identificate in esperimenti di frazionamento a membrana resistente ai detergenti (DRM)1. Le frazioni insolubili erano caratterizzate dall'essere arricchite in colesterolo, sfingomieline strettamente impacchettate e fosfolipidi saturi, esibendo punti di fusione più elevati, in contrasto con le frazioni solubili che consistono prevalentemente di temperature di fusione più basse e fosfolipidi insaturi debolmente impacchettati. Le regioni strettamente impacchettate sono indicate come domini lipidici ordinati ai liquidi (Lo), o zattere lipidiche, mentre i domini lipidici disordinati dai liquidi (Ld) più vagamente organizzati sono le regioni non zattere della membrana plasmatica 2,3. È noto che le regioni delle zattere lipidiche facilitano i processi di segnalazione, con prove che indicano che il recettore attivo dell'insulina si associa a queste zattere 4,5. Tuttavia, a causa della natura dinamica della membrana cellulare e delle dimensioni generalmente ridotte dei domini, la visualizzazione diretta della presenza di zattere nelle cellule vive presenta sfide significative. In questo contesto, presentiamo un metodo per studiare l'impatto dei lipid rafts sul recettore dell'insulina attraverso tecniche di scambio lipidico.
Le ciclodestrine (CD) sono formate da monomeri di glucosio collegati che creano una struttura ad anello con una cavità centrale. La dimensione di questa cavità è determinata dal numero di unità di glucosio: sei unità formano l'alfa-ciclodestrina (α-CD), mentre sette unità creano beta-ciclodestrine (β-CD). I CD sono molecole altamente solubili in acqua in grado di incapsulare i lipidi all'interno della loro cavità, facilitandone così il trasporto alla membrana cellulare6. Le beta-ciclodestrine sono state ampiamente utilizzate per aggiungere e rimuovere lipidi dalle membrane7; Tuttavia, la sua cavità più grande manca di specificità per il colesterolo o i fosfolipidi8. Al contrario, le alfa-ciclodestrine, con la loro cavità più piccola, mostrano una maggiore selettività nel legare le molecole lipidiche rispetto agli steroli. In particolare, la metil-α-ciclodestrina (metil-α-CDs) non interagisce con gli steroli ed è stata efficacemente utilizzata per scambiare fosfolipidi e sfingomieline senza alterare la composizione del colesterolo della membrana cellulare 8,9.
In questo manoscritto, forniamo un protocollo dettagliato per l'utilizzo di metil-α-CD (MαCD) per scambiare lipidi nel foglietto esterno della membrana cellulare con lipidi esogeni che hanno proprietà che promuovono o interrompono la formazione di zattere lipidiche. Questo scambio viene utilizzato per studiare l'impatto dei raft lipidici sull'attività del recettore dell'insulina. La dimostrazione si concentrerà sull'introduzione di un fosfolipide e di una sfingomielina che influenzano la formazione di domini ordinati nei liquidi (Lo) nella membrana plasmatica di linee cellulari di ovaio di criceto cinese (CHO) che sovraesprimono stabilmente il recettore dell'insulina (IR)10. L'entità dello scambio lipidico nelle cellule CHO IR sarà valutata attraverso la cromatografia su strato sottile ad alte prestazioni (HP-TLC), mentre le variazioni dell'attività del recettore dell'insulina saranno quantificate mediante analisi western blot a seguito di stimolazione insulinica post-scambio lipidico.
Protocollo
1. Preparazione della soluzione di metil-α-CD
- Aggiungere 20 mL di soluzione salina tamponata con fosfato (PBS) a ~10 g di polvere di MαCD in un flacone di vetro. Incubare a bagnomaria (45 °C) per sciogliere, mescolando di tanto in tanto fino a quando non sarà ben sciolto.
NOTA: La soluzione potrebbe essere ancora torbida a causa di specie di CD insolubili. - Far passare la soluzione attraverso un filtro per siringa da 0,22 μm. La soluzione diventerà chiara.
- Utilizzare un rifrattometro per determinare l'esatta concentrazione di MαCD.
- Posizionare 10 μl di campione sull'area del campione di un rifrattometro, illuminarlo con una lampadina a incandescenza bianca e registrare l'indice di rifrazione della soluzione.
- Calcola la concentrazione di MαCD usando l'equazione
RI = (1,49 x 10 x C) + 1,33
dove RI = indice di rifrazione, C = concentrazione di MαCD (mM). L'equazione è stata ottenuta attraverso l'analisi gravimetrica, ovvero la misurazione dell'indice di rifrazione di un peso noto di MαCD disciolto in un volume noto.
- Chiudere la bottiglia di vetro con un coperchio e avvolgere il coperchio in una pellicola trasparente per evitare l'evaporazione. Conservare a 4 °C.
2. Preparazione di vescicole multilamellari (MLV)
- Mantenere le soluzioni stock dei lipidi esogeni desiderati disciolti nel cloroformio a concentrazioni comprese tra 20 mM e 50 mM e conservare a -20 °C o inferiori per ridurre al minimo l'evaporazione del solvente.
NOTA: Tutti i lipidi nella Tabella 1 possono essere completamente disciolti in cloroformio. Tuttavia, è possibile che i lipidi alternativi richiedano il cloroformio 1:1: metanolo per dissolversi completamente. - Aliquotare lo stock lipidico in provette di borosilicato utilizzando una pipetta a spostamento positivo con punta di vetro. In alternativa, è possibile utilizzare una microsiringa di vetro.
- Asciugare l'aliquota lipidica su un blocco riscaldante a una temperatura bassa di circa 50 °C sotto una corrente di gas N2 fino a quando tutto il cloroformio apparente evapora.
- Rimuovere il solvente rimanente dal lipide essiccato posizionando la provetta in una camera a vuoto ed esponendola a un vuoto elevato (inferiore a 200 mTorr) per 1 ora.
- Aggiungere il terreno F-12 Ham's F-12 senza siero al film lipidico secco per raggiungere una concentrazione finale di 20 mM. Coprire con un coperchio o del nastro di teflon e scaldare a bagnomaria a 70 °C per 5 minuti.
- Vortice per sospendere i lipidi e formare MLV. Il supporto dovrebbe ora apparire nuvoloso.
NOTA: Alcuni lipidi saturi potrebbero non essere completamente sospesi dal solo vortice e potrebbe essere necessario sospenderli pipettando su e giù fino a quando la pellicola non è più visibile.- Trasferire l'intero volume in una provetta da microcentrifuga. Gli MLV possono essere conservati fino a 3 giorni a 4 °C.
3. Preparazione dei mezzi di scambio lipidico
- Aggiungere lo stock di MαCD a una concentrazione finale di 40 mM, insieme ai MLV preparati alla concentrazione lipidica finale trovata nella Tabella 1.
NOTA: Se si utilizzano MLV conservati a 4 °C, verranno depositati sul fondo del tubo. Riscaldare a temperatura ambiente e assicurarsi che siano risospese muovendo o agitando il tubo.- Caricare i lipidi su MαCD incubando per 30 minuti in un bagno d'acqua a 37 °C o 55 °C secondo la Tabella 1. La temperatura scelta deve essere superiore al punto di fusione della fase gel-liquido del lipide scelto. I media dovrebbero passare da nuvolosi a sereni.
- Lasciare raffreddare i terreni di scambio lipidico a temperatura ambiente per 30-60 minuti.
4. Trattamento a scambio lipidico delle cellule
- Coltivare cellule CHO IR a 37 °C e 5% CO2 nel terreno di Eagle's modificato di Dulbecco (DMEM, 4,5 g/L di glucosio) integrato con il 10% di siero fetale bovino (FBS), 300 μg/mL di L-glutammina, 100 μg/mL di aminoacidi non essenziali, 50 μg/mL di G418, 2 μM di metotrexato e 1x antibiotico-antimicotico.
- Seminare 1,5 x 106 cellule in piastre da 60 mm e crescere fino a quando non sono confluenti all'80%-90%.
- Lavare le celle 3 volte aggiungendo 1 mL di PBS e quindi aspirando. Far morire di fame le cellule per una notte in 2 ml di terreno F12 di Ham's senza siero.
- Lavare le celle 3 volte con 1 mL di PBS. Aggiungere 1 mL di terreno di scambio preparato o terreno di scambio privo di siero come controllo alle cellule e incubare per 1 ora a temperatura ambiente (25 °C -27 °C). Agitare le celle ogni 15 minuti per garantire un'esposizione uniforme ai mezzi di scambio.
- Lavare le celle 3 volte con 1 mL di PBS. Ogni piastra può essere successivamente lavorata per l'estrazione dei lipidi nella fase 5 o per l'autofosforilazione IR nella fase 7.
5. Estrazione dei lipidi su piastra di coltura cellulare
- Rimuovere completamente il PBS e impostare la piastra a un angolo di 45° per 10 minuti o fino a completa asciugatura, rimuovendo eventuali tamponi che potrebbero accumularsi lungo il fondo.
- Aggiungere 1 mL di soluzione di esano: isopropanolo 3:2 (v:v) alle cellule essiccate e incubare per 10 minuti su un agitatore a temperatura ambiente.
- Trasferire la soluzione in una provetta di borosilicato. Coprire con nastro di teflon e conservare a -20 °C.
- Sciogliere i detriti cellulari rimanenti aggiungendo 500 μl di NaOH 1N e agitando per 10 minuti a temperatura ambiente.
- Utilizzare questa soluzione in un saggio di quantificazione delle proteine come il Bradford Assay per determinare la concentrazione proteica di ciascun campione. Questi valori di concentrazione possono essere utilizzati per normalizzare i volumi di carico degli estratti lipidici su piastre HP-TLC per un carico lipidico uguale in tutti i campioni.
6. Verifica dell'efficienza di scambio con HP-TLC
- Preparare 100 mL di cloroformio:metanolo:30% (v/v) idrossido di ammonio 65:25:5 (v:v:v) e versarlo in un serbatoio di vetro TLC. Coprire bene e lasciare che il vapore si equilibri per almeno 1 ora.
- Asciugare il campione di estratto lipidico su un blocco riscaldante a bassa impostazione sotto un flusso di gas N2 fino a quando tutto il solvente organico apparente evapora.
- Sciogliere il film lipidico in 50 μl di cloroformio 1:1 (v:v): metanolo.
- Utilizzare una siringa Hamilton da 10 μl per caricare 1-10 μl di campione in bande di 1 cm su una piastra HP-TLC in silice. Caricare un massimo di 10 bande su una piastra di 20 cm. Utilizzare i valori normalizzati per determinare i volumi necessari per caricare quantità uguali di lipidi su tutti i campioni.
NOTA: Prima di caricare ogni campione, la piastra deve essere attivata posizionandola su una piastra calda a un'impostazione medio-alta. - Posizionare la piastra in posizione verticale nel serbatoio TLC e lasciare che la parte anteriore del solvente si sposti di 8 cm per garantire la separazione delle specie fosfolipidiche.
- Lasciare asciugare la piastra per 10 minuti. Spruzzare con una soluzione acquosa di acetato rameico al 3% (p/v) e acido fosforico all'8% (v/v).
- Lasciare asciugare la piastra per 30 minuti a temperatura ambiente o con una pistola termica. La lastra dovrebbe passare dal blu traslucido al bianco opaco.
- Carbonizzare in forno a 180 °C-200 °C per 5-10 minuti o fino a quando le bande lipidiche nere diventano rilevabili.
7. Controllo dell'attivazione dei recettori con saggio di autofosforilazione e western blot
- Incubare le cellule con 500 μL di insulina da 100 nM in terreni privi di siero a temperatura ambiente per 5 minuti.
- Lavare le cellule con PBS ghiacciato e mettere le cellule sul ghiaccio per fermare la stimolazione. Aggiungere prontamente 1 mL di PBS ghiacciato alle cellule e raccogliere con un raschietto cellulare. Celle a pellet a 3000 x g per 5 min a 4 °C.
- Aggiungere 100-200 μL di tampone di lisi RIPA completo (50 mM Tris pH 8, 200 mM NaCl, 1 mM EDTA, 1% (v/v) Triton X-100, 1% (p/v) desossicolato di sodio, 1 mM di ortovanadato di sodio attivato, 10 μg/mL di aprotinina, 10 μg/mL di leupeptina) al pellet cellulare su ghiaccio. Pipettare su e giù 30x-40x per lisi.
- Incubare il lisato su ghiaccio per 10 minuti. Eliminare il lisato dai detriti cellulari centrifugando a 16.000 x g per 10 minuti a 4 °C e raccogliendo il surnatante. Riservare circa 20 μL di lisato per determinare la concentrazione proteica con il saggio Bradford.
- Combinare il lisato con 5 tamponi Laemmli (350 mM Tris HCl pH 6,8, 30% v/v glicerolo, 10% p/v SDS, 25% v/v β-mercaptoetanolo, 0,002 g di blu di bromofenolo) e far bollire a 95 °C per 5 min. Il volume di tampone aggiunto deve essere sufficiente per raggiungere una concentrazione finale di 1x tampone Laemmli.
- Far scorrere i lisati attraverso l'elettroforesi su gel di sodio dodecil solfato-poliacrilammide (SDS-PAGE).
- Caricare la stessa massa di proteine per tutti i campioni insieme al marcatore di peso molecolare su un gel SDS-PAGE. Funzionamento a 100 V-150 V in tampone di corsa (2,5 mM Tris pH 8, 19,2 mM glicina, 0,01% (p/v) SDS) fino a quando non si risolve correttamente nell'intervallo 100-250 kDa.
- Trasferire su una membrana di fluoruro di polivinilidene (PVDF) in tampone di trasferimento (2,5 mM Tris pH 8, 19,2 mM glicina) per 1 ora a 100 V e 4 °C.
- Bloccare la membrana in PVDF per 30 minuti a temperatura ambiente in una soluzione BSA al 5% in TBST (50 mM Tris pH 8, 150 mM NaCl, 0,1% (v/v) Tween 20).
- Incubare con l'anticorpo pYpY IR o l'anticorpo IR-β a una concentrazione 1:1000 in una soluzione di BSA al 5% in TBST per 1 ora a temperatura ambiente o per una notte a 4 °C.
NOTA: L'anticorpo pYpY IR riconosce specificamente le tirosine fosforilate 1162 e 1163 e serve a indicare l'autofosforilazione del recettore. L'anticorpo IR-β riconosce la subunità beta del recettore indiscriminatamente, indipendentemente dallo stato di fosforilazione, e serve a indicare i livelli globali del recettore. - Lavare 3 volte con TBST a temperatura ambiente. Incubare con α anticorpo Rabbit-HRP a una concentrazione 1:3000 in soluzione di BSA all'1% in TBST per 30 minuti a temperatura ambiente.
- Lavare 3 volte con TBST a temperatura ambiente. Incubare con un substrato chemiluminescente potenziato (ECL) per 1 minuto e creare un'immagine del film.
Risultati
Per dimostrare il cambiamento osservabile nella composizione lipidica cellulare dopo lo scambio, abbiamo eseguito HP-TLC su cellule CHO IR dopo lo scambio cerebrale SM (bSM) e 1,2-dioleoil-sn-glicero-3-fosfocolina (DOPC) (Figura 1). Nei casi in cui le sfingomieline come la bSM vengono utilizzate per lo scambio, è evidente un aumento dell'intensità della banda SM, insieme a una diminuzione dell'intensità della banda PC rispetto al controllo non trattato. Al contrario, quando si scambiano fosfatidilcoline come DOPC, la banda PC diventa più intensa mentre la banda SM diventa meno intensa. L'efficienza di scambio può essere determinata misurando le intensità della classe lipidica scambiata con il software ImageJ e prendendo il rapporto tra i campioni non trattati e trattati. Lo standard di caricamento, costituito da diverse diluizioni di un lipide disponibile in commercio, dimostra un'opzione per stimare la quantità di una classe di lipidi prima e dopo lo scambio. Misurando l'intensità delle bande standard SM e generando una curva standard, le intensità SM di tutti i campioni possono essere adattate alla curva per la quantificazione dei lipidi.
Successivamente, mostriamo come l'autofosforilazione del recettore possa essere saggiata dopo lo scambio lipidico mediante western blot (Figura 2). Nel caso del recettore dell'insulina, i livelli di autofosforilazione insulino-dipendente possono essere confrontati tra cellule non trattate e cellule scambiate con lipidi che formano zattere (bSM) o lipidi non formanti zattere (DOPC). Lo scambio di DOPC ha un impatto negativo sulla fosforilazione IR, così come altri lipidi, come l'1-palmitoil-2-oleoil-sn-glicerolo-3-fosfocolina (POPC)4. Le sfingomieline mantengono o aumentano moderatamente la fosforilazione dell'IR, così come la 1,2-distearoil-sn-glicero-3-fosfocolina (DSPC)4. Blotting dei livelli totali del recettore con l'anticorpo IR-β, i livelli di fosforilazione dell'anticorpo pYpY IR possono essere normalizzati ai livelli totali del recettore. I valori di intensità ImageJ per pYpY IR divisi per IR-β producono valori normalizzati (Tabella 2). Questo spiega eventuali differenze nel livello di espressione o comunque quantità disuguali di proteine di carico, come si può vedere nella prima corsia.
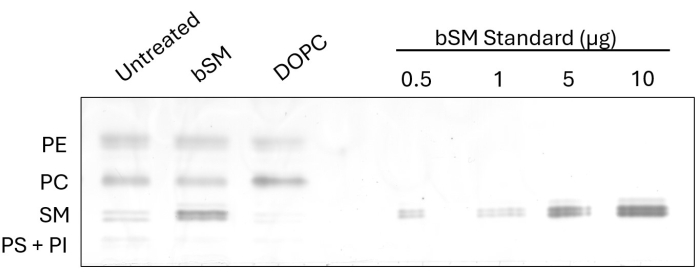
Figura 1: HP-TLC dello scambio bSM e DOPC nelle celle CHO IR. Le cellule CHO IR sono state affamate e incubate con terreni a scambio lipidico (bSM o DOPC) o terreni privi di siero come controllo. Volumi uguali di estratti lipidici sono stati caricati su una piastra HP-TLC insieme a quantità crescenti di bSM. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Immagine Western blot dell'autofosforilazione IR dopo lo scambio di bSM e DOPC. Le piastre di controllo sono state incubate con (controllo positivo) o senza (controllo negativo) insulina da 100 nM. Le piastre a scambio lipidico (bSM o DOPC) sono state incubate con insulina 100 nM dopo lo scambio. Quantità uguali di proteina totale sono state analizzate su SDS-PAGE e sottoposte a tamponamento per pYpY IR e IR-β. Il blot IR-β funge da controllo del caricamento. Clicca qui per visualizzare una versione più grande di questa figura.
| Lipide | Temperatura di preparazione del mezzo di scambio (°C) | Concentrazione di scambio (mM) | Carattere di saturazione |
| DOPC | 37 | 4 | Insaturo |
| POPC | 37 | 4 | Insaturo |
| DLPC | 37 | 4 | Saturo |
| DMPC | 37 | 2 | Saturo |
| DPPC | 55 | 1 | Saturo |
| DSPC | 55 | 0.5 | Saturo |
| Bsm | 37 | 1 | Saturi# |
| Mes | 37 | 1 | Saturo |
| #bSM è una miscela di specie di sfingomielina. La maggior parte di queste specie sono di carattere saturo con l'eccezione della sfingomielina 24:1. Non è noto quanto bene la sfingomielina 24:1 sia in grado di essere caricata su MαCD rispetto alle specie sature. | |||
Tabella 1: Lipidi utilizzati nei mezzi di scambio.
| pYpY | IR-β | pYpY/IR-β | pYpY/IR-β (normalizzato) | |
| Controllo negativo | 142.6 | 1229 | 0.12 | 0.09 |
| Controllo positivo | 5844 | 4446 | 1.31 | 1.00 |
| Bsm | 5886 | 5173 | 1.14 | 0.87 |
| DOPC | 2031 | 2740 | 0.74 | 0.56 |
Tabella 2: Valori di intensità dell'autofosforilazione IR western blot.
Discussione
Dalla concettualizzazione dell'esistenza di zattere lipidiche nella membrana cellulare, ci sono stati numerosi tentativi di visualizzarli nelle cellule e di studiare l'associazione tra lipidi e recettori. Gli esperimenti che coinvolgono la microscopia11 nelle cellule hanno utilizzato biomarcatori marcati in fluorescenza, di solito proteine e lipidi noti per associarsi con i raft, per studiare visivamente la localizzazione dei domini lipidici ordinati nella cellula12. Tuttavia, la membrana cellulare è piena di pieghe13,14, invaginazioni di caveole 1,13 e raggruppamento proteico2, che ostacolano la visualizzazione della dinamica dei biomarcatori raft. Un approccio alternativo è stato utilizzato per studiare le zattere nelle membrane modello preparando vescicole utilizzando i lipidi appropriati15. Sebbene facili da sintetizzare e lavorare, queste vescicole non sono una rappresentazione accurata della membrana cellulare in termini di proprietà biofisiche e composizione chimica del doppio strato cellulare. Un sistema di membrana naturale è costituito dalle vescicole di membrana plasmatica giganti (GPMV). I GPMV sono vescicole di membrana plasmatica con una composizione chimicamente accurata delle membrane cellulari. Questi sono prodotti incubando le cellule con reagenti che formano vescicole gemmando dalla membrana cellulare delle cellule vive16. Tuttavia, è noto che le soluzioni convenzionali per la formazione di GPMV modificano chimicamente e/o reticolano i lipidi e le proteine durante il processo di vescicolazione e attivano costitutivamente i recettori nelle vescicole. Il protocollo sviluppato nel nostro laboratorio influenza la capacità della membrana di formare zattere lipidiche scambiando lipidi esogeni con propensioni variabili a sostenere o distruggere le regioni ordinate della membrana cellulare in cellule intatte e senza modificare chimicamente le proteine 4,8.
Gli esperimenti di scambio lipidico possono essere immediatamente seguiti da saggi che misurano le proprietà della membrana plasmatica. HP-TLC fornisce la conferma che lo scambio ha avuto luogo ed è stato mantenuto dopo un esperimento, aggiungendo fiducia ai risultati di qualsiasi esperimento biochimico effettuato dopo i saggi di scambio. Visualizzando la composizione della sfingomielina e dei fosfolipidi della cellula prima e dopo lo scambio, è anche possibile determinare l'efficienza dello scambio in un nuovo insieme di condizioni, come nuove linee cellulari o ciclodestrine. Le fasi che portano al segmento di scambio del protocollo svolgono un ruolo significativo nel garantire la precisione delle repliche e l'efficiente scambio lipidico nelle cellule. La calibrazione, il pipettaggio e l'essiccazione dei lipidi devono essere considerati passaggi critici a causa dei piccoli volumi di solvente organico utilizzati e dei delicati requisiti di concentrazione per un corretto caricamento di MαCD. La corretta conservazione e calibrazione delle soluzioni stock lipidiche sono passaggi preliminari fondamentali del protocollo. Le soluzioni madre sono tipicamente preparate in cloroformio e possono evaporare nel tempo, anche se conservate a -20 °C, portando a variazioni graduali della concentrazione. L'essiccazione del volume specificato di lipidi per raggiungere la concentrazione desiderata è essenziale per garantire che la corretta quantità di lipidi venga caricata sulla ciclodestrina per il processo di scambio. Per evitare errori nel pipettaggio, si consiglia di calibrare mensilmente la concentrazione delle soluzioni stock.
Dopo aver calibrato le soluzioni madre, il volume di lipidi richiesto viene pipettato in provette borosilicate pulite, ad esempio con una pipetta Drummond a spostamento positivo, che utilizza fori di vetro. Elevate concentrazioni di lipidi potrebbero richiedere il pipettaggio di volumi eccessivamente piccoli, portando a inevitabili errori e variabilità nelle condizioni di scambio finali. Per evitare ciò, si consiglia di pipettare un volume corrispondente a una concentrazione intermedia tra quella dello stock e quella della soluzione di scambio finale. Questo approccio garantisce un'accuratezza ottimale del pipettaggio per formare le vescicole multilamellari (MLV) nella soluzione di scambio di lavoro. I lipidi vengono tipicamente essiccati su un blocco riscaldante sotto un flusso costante di azoto gassoso mantenuto a circa 10 psi per 10-20 minuti. Una pressione eccessiva del gas o il posizionamento dell'ugello del gas vicino al fondo del tubo possono causare schizzi del liquido di essiccazione contro le pareti, con conseguente perdita di volume lipidico e potenzialmente alterazione della concentrazione degli MLV. Per evitare la contaminazione incrociata, tutti i componenti dell'attrezzatura di essiccazione vengono lavati con etanolo al 100% sia prima che dopo il processo di essiccazione. Per garantire la completa asciugatura, la provetta viene posta sotto vuoto per 1 h e poi sigillata con pellicola trasparente per mantenere la purezza del lipide essiccato.
I limiti dell'esperimento possono essere attribuiti al ruolo delle flippasi e delle scramblasi nel mantenere l'asimmetria della membrana. Gli enzimi responsabili del movimento dei lipidi tra le foglioline interne ed esterne del doppio strato preservano la natura asimmetrica della membrana cellulare17. Nel corso dell'esperimento, la velocità con cui le flippasi e le scramblasi ridistribuiscono i lipidi aggiunti esogenamente tra i lembi è sconosciuta. Questo potrebbe stabilire la natura della membrana cellulare ed è un fattore esterno che non è stato ignorato.
Inoltre, questa azione flip-flop potrebbe, in alcune condizioni, esporre i lipidi prematuramente presenti nella membrana interna delle cellule, come la fosfatidilserina (PS), un lipide che è intrinsecamente responsabile della segnalazione dell'apoptosi cellulare18. I nostri esperimenti utilizzano gli scambi lipidici di sfingomielina (SM) e fosatidilcolina (PC). Questi lipidi sono presenti nel foglietto esterno della membrana plasmatica e impiegano molto tempo per ruotare verso il foglietto citosolico che alimenta il saggio principalmente al foglietto esterno 9,19,20. Un altro problema è che non tutti i lipidi esogeni aggiunti alle cellule possono supportare completamente l'integrità e la struttura della membrana cellulare 9,19. L'uso di tali lipidi danneggerà inavvertitamente la membrana cellulare dopo lo scambio, limitando i lipidi utilizzati nel protocollo di scambio. Eseguendo la vitalità cellulare, i saggi possono aiutare a misurare l'entità del danno subito dalle cellule dopo l'incubazione con il terreno di scambio4. L'analisi citofluorimetrica di cellule trattate con tripsinizzato e ioduro di propidio è un metodo per analizzare la vitalità delle cellule scambiate con lipidi. Il danno alla membrana potrebbe anche provocare l'internalizzazione del recettore. Grandi quantità di internalizzazione del recettore dell'insulina alterano i dati di autofosforilazione del recettore. La citometria a flusso eseguita su anticorpi marcati con ficoeritrina legati agli ectodomini del recettore dell'insulina in cellule trattate con mezzi di scambio può spiegare eventuali cambiamenti nell'espressione del recettore di superficie 4,20.
In questo manoscritto, abbiamo riportato le concentrazioni di una varietà di lipidi caricati su specifiche concentrazioni di MαCD per un efficiente scambio lipidico nelle cellule CHO IR. Per eseguire esperimenti di scambio in altre linee cellulari, il primo passo è determinare le concentrazioni lipidiche efficaci nei mezzi di scambio tollerati dalle cellule senza compromettere l'integrità della membrana o influire sulla vitalità cellulare 8,9,21. Un'ampia gamma di rapporti tra CD e lipidi esogeni dovrebbe essere testata insieme a cellule non trattate. In questo modo, si identificherà un rapporto ottimale tra CD: lipidi dove non vi è un arrotondamento visibile delle cellule o un distacco dalla piastra (nel caso di cellule aderenti), e la morfologia delle cellule trattate è simile a quelle non trattate. Dal punto di vista biochimico, le cellule trattate con CD: mezzi lipidici devono essere controllate per verificare la presenza di perturbazioni nella membrana dopo gli scambi lipidici utilizzando il trattamento con blu di tripano e la perdita di ioduro di propidio o il legame dell'annessina V all'esposizione al PS21 sulla superficie di prova. Le condizioni di temperatura ottimali e la durata dei periodi di scambio variano per le diverse vescicole lipidiche e devono essere determinate per le nuove linee cellulari. Il nostro esperimento di scambio lipidico è stato eseguito esclusivamente su membrane cellulari vive. Per quanto ne sappiamo, non ci sono prove di successo dello scambio lipidico nel lisato cellulare. Questa tecnica di scambio lipidico può essere estesa per alterare la membrana degli organelli all'interno della cellula se possono essere isolati dal lisato cellulare.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Il finanziamento è stato fornito dalla sovvenzione NIH GM 122493. Le celle CHO IR sono state un gentile dono del dottor Jonathan Whittaker (Case Western Reserve University).
Materiali
| Name | Company | Catalog Number | Comments |
| 1,2-dilauroyl-sn-glycero-3-phosphocholine (DLPC) | Avanti Polar Lipids | 850335 | |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) | Avanti Polar Lipids | 850345 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375 | |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Avanti Polar Lipids | 850355 | |
| 1,2-distearoyl-sn-glycero-3-phosphocholine (DSPC) | Avanti Polar Lipids | 850365 | |
| 1-palmitoyl-2-oleoyl-sn-glycerol-3-phosphocholine (POPC) | Avanti Polar Lipids | 850457 | |
| Anti-insulin receptor β antibody | Cell Signaling Technology | CST3025 | |
| Anti-pYpY1162/1163 Insulin receptor antibody | R&D Systems Inc. | AF2507 | |
| Anti-rabbit IgG, HRP-linked Antibody | Cell Signaling Technology | 7074 | |
| Borosilicate glass test tubes (12 x 75 mm) | Thermo Fisher Scientific | 14-961-26 | |
| Brain sphingomyelin (bSM) | Avanti Polar Lipids | 860062 | |
| Egg sphingomyelin (eSM) | Avanti Polar Lipids | 860061 | |
| Fetal bovine serum (FBS) | Corning | 35-016-CV | |
| G418 disulfate salt | Sigma Aldrich | A1720 | |
| Gibco Antibiotic-antimycotic solution (100x) | Thermo Fisher Scientific | 15240062 | |
| Gibco Dulbecco’s modified eagle medium (DMEM, 4.5 g/L glucose, L-glutamine, sodium pyruvate) | Thermo Fisher Scientific | 11965092 | |
| Gibco ham’s F12 media | Thermo Fisher Scientific | 11765054 | |
| Gibco L-glutamine | Thermo Fisher Scientific | 25030032 | |
| Gibco MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140050 | |
| Gibco phosphate buffered saline (PBS) without calcium and magnesium (0.144 g/L KH2PO4, 9 g/L NaCl, 0.795 g/L Na2- HPO4 (anhydrous)) | Thermo Fisher Scientific | 10010023 | |
| Gibco Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300054 | |
| High performance thin layer chromatography (HP-TLC) | Merck | HP-TLC Silica Gel 60 plates | |
| Immobilon-P PVDF Membrane | Millipore | IPVH00010 | |
| Methotrexate | Sigma Aldrich | 454126 | |
| Methyl-α-cyclodextrin (MαCD) | AraChem | CDexA076/BR | |
| Pierce ECL Western Blotting Substrate | Thermo Fisher Scientific | 32106 | |
| Sodium orthovanadate, Activated | Sigma Aldrich | 5.08605 |
Riferimenti
- Brown, D. A., London, E. Functions of lipid rafts in biological membranes. Annu Rev Cell Dev Biol. 14, 111-136 (1998).
- Brown, D. A. Lipid rafts, detergent-resistant membranes, and raft targeting signals. Physiology. 21, 430-439 (2006).
- Schroeder, R., London, E., Brown, D. Interactions between saturated acyl chains confer detergent resistance on lipids and glycosylphosphatidylinositol (GPI)-anchored proteins: GPI-anchored proteins in liposomes and cells show similar behavior. Proc Natl Acad Sci U S A. 91 (25), 12130-12134 (1994).
- Suresh, P., Miller, W. T., London, E. Phospholipid exchange shows insulin receptor activity is supported by both the propensity to form wide bilayers and ordered raft domains. J Biol Chem. 297 (3), 101010(2021).
- Delle Bovi, R. J., Kim, J., Suresh, P., London, E., Miller, W. T. Sterol structure dependence of insulin receptor and insulin-like growth factor 1 receptor activation. Biochim Biophys Acta Biomembr. 1861 (4), 819-826 (2019).
- Zidovetzki, R., Levitan, I. Use of cyclodextrins to manipulate plasma membrane cholesterol content: evidence, misconceptions and control strategies. Biochim Biophys Acta. 1768 (6), 1311-1324 (2007).
- Ohtani, Y., Irie, T., Uekama, K., Fukunaga, K., Pitha, J. Differential effects of α-, β- and γ-cyclodextrins on human erythrocytes. Eur J Biochem. 186 (1-2), 17-22 (1989).
- Suresh, P., London, E. Using cyclodextrin-induced lipid substitution to study membrane lipid and ordered membrane domain (raft) function in cells. Biochim Biophys Acta Biomembr. 1864 (1), 183774(2022).
- Li, G., et al. Efficient replacement of plasma membrane outer leaflet phospholipids and sphingolipids in cells with exogenous lipids. Proc Natl Acad Sci U S A. 113 (49), 14025-14030 (2016).
- Yoshimasa, Y., Paul, J. I., Whittaker, J., Steiner, D. F. Effects of amino acid replacements within the tetrabasic cleavage site on the processing of the human insulin receptor precursor expressed in Chinese hamster ovary cells. J Biol Chem. 265 (28), 17230-17237 (1990).
- Gaus, K., et al. Visualizing lipid structure and raft domains in living cells with two-photon microscopy. Proc Natl Acad Sci U S A. 100 (26), 15554-15559 (2003).
- Klymchenko, S., Kreder, R. Fluorescent probes for lipid rafts: From model membranes to living cells. Chem Biol. 21 (1), 97-113 (2014).
- Pike, L. J. Growth factor receptors, lipid rafts and caveolae: An evolving story. Biochim Biophys ActaMol Cell Res. 1746 (3), 260-273 (2005).
- Brown, D. A., London, E. Structure of detergent-resistant membrane domains: does phase separation occur in biological membranes. Biochem Biophys Res Commun. 240 (1), 1-7 (1997).
- Lin, Q., London, E. Preparation of artificial plasma membrane mimicking vesicles with lipid asymmetry. PLoS One. 9 (1), e87903(2014).
- Sezgin, E., et al. Elucidating membrane structure and protein behavior using giant plasma membrane vesicles. Nat Protoc. 7 (6), 1042-1051 (2012).
- Deveaux, P. F., Hermann, A., Ohlwein, N., Kozlov, M. M. How lipid flippases can modulate membrane structure. Biochimica et Biophysica Acta Biomembr. 1778 (7), 1591-1600 (2008).
- Balasubramaniam, K., Mirnikjoo, B., Schroit, A. J. Regulated externalization of phosphatidylserine at the cell surface: implications for apoptosis. J Biol Chem. 282 (25), 18357-18364 (2007).
- Li, G., et al. Replacing plasma membrane outer leaflet lipids with exogenous lipid without damaging membrane integrity. PLoS One. 14 (10), e0223572(2019).
- Contreras, F. X., Sanchez-Magraner, L., Alonso, A., Goni, F. M. Transbilayer (flip-flop) lipid motion and lipid scrambling in membranes. FEBS Letters. 584 (9), 1779-1786 (2010).
- Suresh, P., London, E. MαCD-based plasma membrane outer leaflet lipid exchange in mammalian cells to study insulin receptor activity. Biophys Approach Study Memb Struct A Exp. 700, 485-507 (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon