Method Article
Dosage de l’échange lipidique dans les cellules vivantes
Dans cet article
Résumé
Nous décrivons une méthode d’utilisation de la cyclodextrine pour médier l’échange entre les lipides de la membrane plasmique et les lipides exogènes. Cette technique peut être associée à des expériences étudiant les protéines transmembranaires, qui se comportent différemment dans des environnements de type radeau lipidique que dans des environnements non semblables à un radeau.
Résumé
Les radeaux lipidiques sont des domaines dynamiques et ordonnés de la membrane plasmique souvent formés lors de l’agrégation et de la signalisation des protéines membranaires. L’identité lipidique de la foliole externe détermine la propension de la membrane à former des radeaux lipidiques. La nature transitoire des radeaux lipidiques rend difficile leur étude dans les cellules vivantes. Par conséquent, les méthodes qui ajoutent ou éliminent des lipides formant des radeaux au niveau du feuillet externe des cellules vivantes facilitent l’étude des caractéristiques des radeaux, telles que leurs effets sur les protéines membranaires. Les expériences d’échange de lipides développées dans notre laboratoire utilisent des cyclodextrines chargées de lipides pour éliminer et ajouter des phospholipides exogènes afin de modifier la constitution lipidique de la membrane plasmique. Le remplacement de la membrane par un radeau ou un lipide non formant un radeau peut aider à étudier les effets sur l’activité des protéines transmembranaires. Ici, nous décrivons une méthode d’échange de lipides sur le feuillet externe de la membrane plasmique à l’aide de cyclodextrine chargée de lipides. Nous démontrons la préparation du milieu d’échange et le traitement ultérieur des cellules de mammifères attachées. Nous montrons également comment mesurer l’efficacité des échanges à l’aide de HP-TLC. Ce protocole permet de remplacer presque complètement le feuillet externe par des lipides exogènes sans altérer la viabilité cellulaire, ce qui permet de poursuivre les expériences sur des membranes plasmiques intactes modifiées.
Introduction
La membrane plasmique est composée d’une bicouche lipidique enrichie de diverses protéines membranaires, notamment des récepteurs transmembranaires et des canaux ioniques. Les domaines lipidiques à l’intérieur de la membrane ont été élucidés à l’aide de régions solubles et insolubles au détergent identifiées dans des expériences de fractionnement de membranes résistantes aux détergents (DRM)1. Les fractions insolubles ont été caractérisées par leur enrichissement en cholestérol, en sphingomyélines serrées et en phospholipides saturés, présentant des points de fusion plus élevés, contrairement aux fractions solubles qui consistent principalement en une température de fusion plus basse et en phospholipides insaturés faiblement emballés. Les régions étroitement tassées sont appelées domaines lipidiques ordonnés en liquide (Lo), ou radeaux lipidiques, tandis que les domaines lipidiques en désordre liquide (Ld) plus lâches sont les régions non en radeau de la membrane plasmique 2,3. Les régions des radeaux lipidiques sont connues pour faciliter les processus de signalisation, avec des preuves indiquant que le récepteur actif de l’insuline s’associe à ces radeaux 4,5. Cependant, en raison de la nature dynamique de la membrane cellulaire et de la taille généralement petite des domaines, la visualisation directe de la présence de radeaux dans les cellules vivantes présente des défis importants. Dans ce contexte, nous présentons une méthode pour étudier l’impact des radeaux lipidiques sur le récepteur de l’insuline par des techniques d’échange de lipides.
Les cyclodextrines (CD) sont formées de monomères de glucose liés qui créent une structure en forme d’anneau avec une cavité centrale. La taille de cette cavité est déterminée par le nombre d’unités de glucose : six unités forment de l’alpha-cyclodextrine (α-CD), tandis que sept unités créent des bêta-cyclodextrines (β-CD). Les CD sont des molécules très solubles dans l’eau capables d’encapsuler les lipides dans leur cavité, facilitant ainsi leur transport vers la membrane cellulaire6. Les bêta-cyclodextrines ont été largement utilisées pour ajouter et éliminer des lipides des membranes7 ; Cependant, sa cavité plus grande manque de spécificité pour le cholestérol ou les phospholipides8. En revanche, les alpha-cyclodextrines, avec leur cavité plus petite, présentent une plus grande sélectivité dans la liaison des molécules lipidiques par rapport aux stérols. Plus précisément, la méthyl-α-cyclodextrine (méthyl-α-CD) n’interagit pas avec les stérols et a été utilisée efficacement pour échanger des phospholipides et des sphingomyélines sans modifier la composition du cholestérol de la membrane cellulaire 8,9.
Dans ce manuscrit, nous fournissons un protocole détaillé pour l’utilisation des méthyl-α-CD (MαCD) pour échanger des lipides dans la foliole externe de la membrane cellulaire avec des lipides exogènes qui ont des propriétés favorisant ou perturbant la formation de radeaux lipidiques. Cet échange est utilisé pour étudier l’impact des radeaux lipidiques sur l’activité des récepteurs de l’insuline. La démonstration se concentrera sur l’introduction d’un phospholipide et d’une sphingomyéline affectant la formation de domaines ordonnés par un liquide (Lo) dans la membrane plasmique de lignées cellulaires d’ovaire de hamster chinois (CHO) surexprimant de manière stable le récepteur de l’insuline (IR)10. L’étendue de l’échange lipidique dans les cellules IR CHO sera évaluée par chromatographie sur couche mince à haute performance (HP-TLC), tandis que les changements dans l’activité des récepteurs de l’insuline seront quantifiés par analyse par transfert Western après une stimulation insulinique post-échange lipidique.
Protocole
1. Préparation de la solution de méthyle-α-CD
- Ajouter 20 mL de solution saline tamponnée au phosphate (PBS) à ~10 g de poudre de MαCD dans un flacon en verre. Incuber dans un bain d’eau chaude (45 °C) pour dissoudre, en remuant de temps en temps jusqu’à ce qu’il soit bien dissous.
REMARQUE : La solution peut encore être trouble en raison d’espèces de CD insolubles. - Faites passer la solution à travers un filtre à seringue de 0,22 μm. La solution deviendra claire.
- Utilisez un réfractomètre pour déterminer la concentration exacte de MαCD.
- Placez 10 μL d’échantillon sur la zone de l’échantillon d’un réfractomètre, éclairez-le à l’aide d’une ampoule à incandescence blanche et enregistrez l’indice de réfraction de la solution.
- Calculer la concentration de MαCD à l’aide de l’équation
IR = (1,49 x 10 x C) + 1,33
où RI = indice de réfraction, C = concentration de MαCD (mM). L’équation a été obtenue par analyse gravimétrique, c’est-à-dire par mesure de l’indice de réfraction d’un poids connu de MαCD dissous dans un volume connu.
- Fermez la bouteille en verre avec un couvercle et enveloppez le couvercle dans un film transparent pour éviter l’évaporation. Conserver à 4 °C.
2. Préparation des vésicules multilamellaires (MLV)
- Conserver les solutions mères des lipides exogènes désirés dissous dans le chloroforme à des concentrations de 20 mM à 50 mM et les stocker à -20 °C ou moins pour minimiser l’évaporation du solvant.
REMARQUE : Tous les lipides du tableau 1 peuvent être entièrement dissous dans les stocks de chloroforme. Cependant, il est possible que d’autres lipides nécessitent du chloroforme : méthanol 1:1 pour se dissoudre complètement. - Aliquote du stock lipidique dans des tubes borosilicatés à l’aide d’une pipette à déplacement positif avec une pointe en verre. Alternativement, une microseringue en verre peut être utilisée.
- Sécher l’aliquote lipidique sur un bloc chauffant à basse température d’environ 50 °C sous un courant de gazN2 jusqu’à ce que tout le chloroforme apparent s’évapore.
- Retirez le solvant restant du lipide séché en plaçant le tube dans une chambre à vide et en l’exposant à un vide poussé (moins de 200 mTorr) pendant 1 h.
- Ajouter le milieu F-12 de Ham sans sérum sur un film lipidique sec pour atteindre une concentration finale de 20 mM. Couvrir avec un couvercle ou du ruban adhésif en téflon et chauffer au bain-marie à 70 °C pendant 5 min.
- Vortex pour suspendre les lipides et former des MLV. Le support devrait maintenant apparaître trouble.
REMARQUE : Certains lipides saturés peuvent ne pas être complètement suspendus par vortex seul et peuvent avoir besoin d’être suspendus en pipetant de haut en bas jusqu’à ce que le film ne soit plus visible.- Transférez tout le volume dans un tube de microcentrifugation. Les MLV peuvent être stockés jusqu’à 3 jours à 4 °C.
3. Préparation des milieux d’échange de lipides
- Ajouter le stock de MαCD à une concentration finale de 40 mM, ainsi que les MLV préparées à la concentration finale de lipides indiquée dans le tableau 1.
REMARQUE : Si vous utilisez des MLV stockés à 4 °C, ils seront déposés au fond du tube. Réchauffez-les à température ambiante et assurez-vous qu’ils sont remis en suspension en effleurant ou en agitant le tube.- Chargez les lipides sur MαCD en l’incubant pendant 30 min dans un bain-marie à 37 °C ou 55 °C conformément au tableau 1. La température choisie doit être supérieure au point de fusion de la phase gel-liquide du lipide choisi. Le milieu doit passer de nuageux à clair.
- Laisser refroidir le milieu d’échange de lipides à température ambiante pendant 30 à 60 min.
4. Traitement d’échange lipidique des cellules
- Cultivez des cellules CHO IR à 37 °C et 5 % de CO2 dans le milieu Eagle’s modifié de Dulbecco (DMEM, 4,5 g/L de glucose) complété par 10 % de sérum de veau fœtal (FBS), 300 μg/mL de L-glutamine, 100 μg/mL d’acides aminés non essentiels, 50 μg/mL de G418, 2 μM de méthotrexate et 1x antibiotique-antimycosique.
- Ensemencez 1,5 x 106 cellules dans des plaques de 60 mm et cultivez jusqu’à ce qu’elles soient confluentes à 80 % à 90 %.
- Lavez les cellules 3 fois en ajoutant 1 mL de PBS, puis en aspirant. Affamez les cellules pendant la nuit dans 2 ml de milieu F12 de Ham sans sérum.
- Laver les cellules 3 fois avec 1 mL de PBS. Ajouter 1 mL de milieu d’échange préparé ou de milieu sans sérum comme témoin dans les cellules et incuber pendant 1 h à température ambiante (25 °C -27 °C). Faites tourner les cellules toutes les 15 minutes pour assurer une exposition uniforme aux milieux d’échange.
- Laver les cellules 3 fois avec 1 mL de PBS. Chaque plaque peut ensuite être traitée pour l’extraction des lipides à l’étape 5, ou pour l’autophosphorylation IR à l’étape 7.
5. Extraction des lipides sur plaque de culture cellulaire
- Retirez complètement le PBS et placez la plaque à un angle de 45° pendant 10 minutes ou jusqu’à ce qu’elle soit complètement sèche, en enlevant tout tampon qui pourrait s’accumuler le long du fond.
- Ajouter 1 mL de solution d’hexane 3:2 (v :v) : isopropanol aux cellules séchées et incuber pendant 10 min sur un agitateur à température ambiante.
- Transférez la solution dans un tube en borosilicate. Couvrir d’un ruban adhésif en téflon et conserver à -20 °C.
- Dissoudre les débris cellulaires restants en ajoutant 500 μL de NaOH 1N et en agitant pendant 10 minutes à température ambiante.
- Utilisez cette solution dans un test de quantification des protéines tel que le test de Bradford pour déterminer la concentration en protéines de chaque échantillon. Ces valeurs de concentration peuvent être utilisées pour normaliser les volumes de charge des extraits lipidiques sur les plaques HP-TLC pour une charge lipidique égale dans tous les échantillons.
6. Vérification de l’efficacité de l’échange avec HP-TLC
- Préparez 100 ml d’hydroxyde d’ammonium 65:25:5 (v :v :v) chloroforme :méthanol :30 % (v/v) et versez-le dans un réservoir en verre TLC. Couvrez hermétiquement et laissez la vapeur s’équilibrer pendant au moins 1 h.
- Sécher l’échantillon d’extrait lipidique sur un bloc chauffant à basse température sous un courant de gaz N2 jusqu’à ce que tout le solvant organique apparent s’évapore.
- Dissoudre le film lipidique dans 50 μL de chloroforme : méthanol 1:1 (v :v).
- À l’aide d’une seringue Hamilton de 10 μL, chargez 1 à 10 μL d’échantillon en bandes de 1 cm sur une plaque de silice HP-TLC. Chargez un maximum de 10 bandes sur une plaque de 20 cm. Utilisez des valeurs normalisées pour déterminer les volumes nécessaires pour charger des quantités égales de lipides dans tous les échantillons.
REMARQUE : Avant de charger chaque échantillon, la plaque doit être activée en la plaçant sur une plaque chauffante à un réglage moyen-élevé. - Placez la plaque à la verticale dans le réservoir de CCM et laissez le front du solvant se déplacer sur 8 cm pour assurer la séparation des espèces de phospholipides.
- Laissez sécher la plaque pendant 10 min. Vaporiser une solution aqueuse d’acétate cuivrique à 3 % (p/v) et d’acide phosphorique à 8 % (v/v).
- Laissez sécher la plaque pendant 30 min à température ambiante ou avec un pistolet thermique. La plaque doit passer du bleu translucide au blanc opaque.
- Carboniser la plaque dans un four à 180 °C-200 °C pendant 5 à 10 minutes ou jusqu’à ce que les bandes lipidiques noires deviennent détectables.
7. Vérification de l’activation du récepteur à l’aide d’un test d’autophosphorylation et d’un western blot
- Incuber des cellules avec 500 μL d’insuline 100 nM dans un milieu sans sérum à température ambiante pendant 5 min.
- Lavez les cellules avec du PBS glacé et mettez les cellules sur de la glace pour arrêter la stimulation. Ajoutez rapidement 1 ml de PBS glacé dans les cellules et récoltez à l’aide d’un grattoir cellulaire. Cellules à granulés à 3000 x g pendant 5 min à 4 °C.
- Ajouter 100 à 200 μL de tampon de lyse RIPA complet (50 mM Tris pH 8, 200 mM NaCl, 1 mM d’EDTA, 1 % (v/v) Triton X-100, 1 % (p/v) de désoxycholate de sodium, 1 mM d’orthovanadate de sodium activé, 10 μg/mL d’aprotinine, 10 μg/mL de leupeptine) à la pastille de cellule sur de la glace. Pipette de haut en bas 30x-40x pour lyser.
- Incuber le lysat sur glace pendant 10 min. Éliminer le lysat des débris cellulaires en tournant à 16 000 x g pendant 10 min à 4 °C et en recueillant le surnageant. Réservez environ 20 μL de lysat pour déterminer la concentration en protéines à l’aide du test de Bradford.
- Mélanger le lysat avec 5 tampons Laemmli (350 mM Tris HCl pH 6,8, 30 % v/v de glycérol, 10 % p/v SDS, 25 % v/v β-mercaptoéthanol, 0,002 g de bleu de bromophénol) et faire bouillir à 95 °C pendant 5 min. Le volume de tampon ajouté doit être suffisant pour obtenir une concentration finale de 1x tampon Laemmli.
- Analysez les lysats par électrophorèse sur gel de dodécylsulfate de sodium-polyacrylamide (SDS-PAGE).
- Chargez une masse égale de protéines pour tous les échantillons ainsi qu’un marqueur de poids moléculaire sur un gel SDS-PAGE. Fonctionner à 100 V-150 V dans un tampon de fonctionnement (2,5 mM Tris pH 8, 19,2 mM de glycine, 0,01 % (p/v) SDS) jusqu’à ce qu’il soit bien résolu dans la plage de 100 à 250 kDa.
- Transfert sur une membrane de fluorure de polyvinylidène (PVDF) dans un tampon de transfert (2,5 mM Tris pH 8, 19,2 mM glycine) pendant 1 h à 100V et 4 °C.
- Bloquer la membrane PVDF pendant 30 min à température ambiante dans une solution BSA à 5 % dans du TBST (50 mM Tris pH 8, 150 mM NaCl, 0,1 % (v/v) Tween 20).
- Incuber avec un anticorps IR pYpY ou un anticorps IR-β à une concentration de 1:1000 dans une solution BSA à 5 % dans du TBST pendant 1 h à température ambiante ou une nuit à 4 °C.
REMARQUE : L’anticorps anti-IR pYpY reconnaît spécifiquement les tyrosines 1162 et 1163 phosphorylées et sert à indiquer l’autophosphorylation du récepteur. L’anticorps IR-β reconnaît la sous-unité bêta du récepteur sans distinction, quel que soit l’état de phosphorylation, et sert à indiquer les niveaux globaux du récepteur. - Laver 3 fois avec du TBST à température ambiante. Incuber avec α anticorps Rabbit-HRP à une concentration de 1:3000 dans une solution de BSA à 1 % dans du TBST pendant 30 min à température ambiante.
- Laver 3 fois avec du TBST à température ambiante. Incuber avec un substrat chimiluminescent amélioré (ECL) pendant 1 min et imager le film.
Résultats
Pour démontrer le changement observable de la composition cellulaire des lipides après l’échange, nous avons effectué HP-TLC sur des cellules IR CHO après un échange cérébral SM (bSM) et 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) (Figure 1). Dans les cas où des sphingomyélines comme bSM sont utilisées pour l’échange, une augmentation de l’intensité de la bande SM est apparente, ainsi qu’une diminution de l’intensité de la bande PC par rapport au témoin non traité. À l’inverse, lors de l’échange de phosphatidylcholines comme le DOPC, la bande PC devient plus intense tandis que la bande SM devient moins intense. L’efficacité d’échange peut être déterminée en mesurant les intensités de la classe lipidique échangée à l’aide du logiciel ImageJ et en prenant le rapport entre les échantillons non traités et traités. L’étalon de charge, fabriqué à partir de plusieurs dilutions d’un lipide disponible dans le commerce, permet d’estimer la quantité d’une classe de lipides avant et après l’échange. En mesurant l’intensité des bandes d’étalon SM et en générant une courbe standard, les intensités MS de tous les échantillons peuvent être ajustées sur la courbe pour la quantification des lipides.
Ensuite, nous montrons comment l’autophosphorylation du récepteur peut être dosée après l’échange de lipides par western blot (Figure 2). Dans le cas du récepteur de l’insuline, les niveaux d’autophosphorylation insulino-dépendants peuvent être comparés entre les cellules non traitées et les cellules échangées avec des lipides formant des radeaux (bSM) ou des lipides non formant des radeaux (DOPC). L’échange de DOPC a un impact négatif sur la phosphorylation des IR, tout comme d’autres lipides, tels que la 1-palmitoyl-2-oléoyl-sn-glycérol-3-phosphocholine (POPC)4. Les sphingomamyélines maintiennent ou augmentent modérément la phosphorylation des IR, tout comme le fait la 1,2-distéaroyl-sn-glycéro-3-phosphocholine (DSPC)4. En atténuant les niveaux totaux des récepteurs avec l’anticorps IR-β, les niveaux de phosphorylation de l’anticorps IR pYpY peuvent être normalisés aux niveaux totaux des récepteurs. Les valeurs d’intensité ImageJ pour l’IR pYpY divisées par l’IR-β donnent des valeurs normalisées (Tableau 2). Cela tient compte de toute différence de niveau d’expression ou de quantités de protéines de charge inégales, comme on peut le voir dans la première voie.
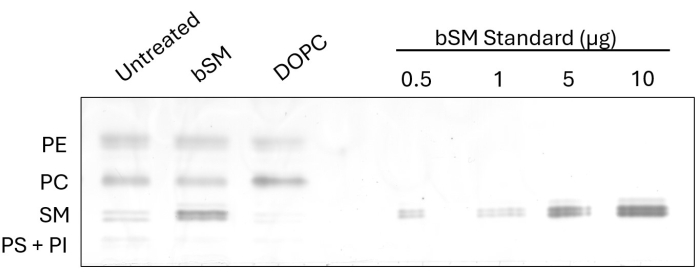
Figure 1 : HP-TLC de l’échange de bSM et DOPC dans des cellules IR CHO. Les cellules CHO IR ont été affamées et incubées avec des milieux échangeurs de lipides (bSM ou DOPC) ou des milieux sans sérum comme contrôle. Des volumes égaux d’extraits lipidiques ont été chargés sur une plaque HP-TLC avec des quantités croissantes de bSM. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Image par Western blot de l’autophosphorylation IR après échange de bSM et de DOPC. Les plaques de contrôle ont été incubées avec (contrôle positif) ou sans insuline (contrôle négatif) de 100 nM. Des plaques d’échange de lipides (bSM ou DOPC) ont été incubées avec de l’insuline 100 nM après l’échange. Des quantités égales de protéines totales ont été analysées sur SDS-PAGE et tamponnées pour pYpY IR et IR-β. Le transfert IR-β sert de contrôle de charge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Lipide | Température de préparation du milieu de remplacement (°C) | Concentration d’échange (mM) | Caractère de saturation |
| DOPC | 37 | 4 | Insaturé |
| POPC | 37 | 4 | Insaturé |
| DLPC | 37 | 4 | Saturé |
| DMPC | 37 | 2 | Saturé |
| DPPC | 55 | 1 | Saturé |
| DSPC | 55 | 0.5 | Saturé |
| Bsm | 37 | 1 | Saturé# |
| Esm | 37 | 1 | Saturé |
| #bSM est un mélange d’espèces de sphingomyéline. La plupart de ces espèces sont de caractère saturé, à l’exception de la sphingomyéline 24:1. On ne sait pas dans quelle mesure la sphingomyéline 24:1 peut être chargée sur MαCD par rapport aux espèces saturées. | |||
Tableau 1 : Lipides utilisés dans les milieux échangeurs.
| pYpY | IR-β | pYpY/IR-β | pYpY/IR-β (normalisé) | |
| Contrôle négatif | 142.6 | 1229 | 0.12 | 0.09 |
| Contrôle positif | 5844 | 4446 | 1.31 | 1.00 |
| Bsm | 5886 | 5173 | 1.14 | 0.87 |
| DOPC | 2031 | 2740 | 0.74 | 0.56 |
Tableau 2 : Valeurs d’intensité du western blot d’autophosphorylation IR.
Discussion
Depuis la conceptualisation de l’existence de radeaux lipidiques dans la membrane cellulaire, il y a eu de nombreuses tentatives pour les visualiser dans les cellules et étudier l’association des lipides et des récepteurs. Des expériences impliquant la microscopie11 dans des cellules ont utilisé des biomarqueurs marqués par fluorescence, généralement des protéines et des lipides connus pour s’associer à des radeaux, pour étudier visuellement la localisation des domaines lipidiques ordonnés dans la cellule12. Cependant, la membrane cellulaire est pleine de plis13,14, d’invaginations de cavéoles 1,13 et de regroupement de protéines2, qui entravent la visualisation de la dynamique des biomarqueurs de radeau. Une autre approche a été utilisée pour étudier les radeaux dans des membranes modèles en préparant les vésicules à l’aide des lipides appropriés15. Bien qu’elles soient faciles à synthétiser et à utiliser, ces vésicules ne sont pas une représentation précise de la membrane cellulaire en termes de propriétés biophysiques et de composition chimique de la bicouche cellulaire. Les vésicules géantes à membrane plasmique (GPMV) constituent un système membranaire naturel. Les GPMV sont des vésicules de membrane plasmique avec une composition chimiquement précise des membranes cellulaires. Ceux-ci sont produits en incubant des cellules avec des réactifs qui forment des vésicules en bourgeonnant de la membrane cellulaire des cellules vivantes16. Cependant, les solutions conventionnelles pour la formation du GPMV sont connues pour modifier chimiquement et/ou réticuler les lipides et les protéines au cours du processus de vésiculation et activer constitutivement les récepteurs dans les vésicules. Le protocole développé dans notre laboratoire influence la capacité de la membrane à former des radeaux lipidiques en échangeant des lipides exogènes avec des propensions variables à soutenir ou à détruire les régions ordonnées de la membrane cellulaire dans les cellules intactes et sans modifier chimiquement les protéines 4,8.
Les expériences d’échange de lipides peuvent être immédiatement suivies de tests qui mesurent les propriétés de la membrane plasmique. HP-TLC fournit la confirmation qu’un échange a eu lieu et qu’il a été maintenu après une expérience, ce qui ajoute de la confiance aux résultats de toutes les expériences biochimiques réalisées après les essais d’échange. En visualisant la composition en sphingomyéline et en phospholipides de la cellule avant et après l’échange, on peut également déterminer l’efficacité de l’échange dans un nouvel ensemble de conditions, telles que de nouvelles lignées cellulaires ou des cyclodextrines. Les étapes menant à la partie d’échange du protocole jouent un rôle important pour garantir la précision des réplicats et l’efficacité de l’échange de lipides dans les cellules. L’étalonnage, le pipetage et le séchage des lipides doivent être considérés comme des étapes critiques en raison des petits volumes de solvant organique utilisés et des exigences de concentration délicates pour un chargement correct de MαCD. Le stockage et l’étalonnage appropriés des solutions mères de lipides sont des étapes préliminaires essentielles du protocole. Les solutions mères sont généralement préparées sous forme de chloroforme et peuvent s’évaporer avec le temps, même lorsqu’elles sont stockées à -20 °C, ce qui entraîne des changements progressifs de concentration. Le séchage du volume spécifié de lipides pour atteindre la concentration souhaitée est essentiel pour garantir que la quantité correcte de lipides est chargée sur la cyclodextrine pour le processus d’échange. Pour éviter une erreur de pipetage, il est conseillé de calibrer la concentration des solutions mères sur une base mensuelle.
Après avoir calibré les solutions mères, le volume de lipides requis est pipeté dans des tubes en borosilicate propres, par exemple, avec une pipette Drummond à déplacement positif, qui utilise des alésages en verre. Des concentrations élevées de stocks de lipides pourraient nécessiter le pipetage de volumes extrêmement faibles, entraînant inévitablement des erreurs et une variabilité des conditions d’échange finales. Pour éviter cela, il est conseillé de pipeter un volume correspondant à une concentration intermédiaire entre celle du stock et celle de la solution d’échange finale. Cette approche garantit une précision de pipetage optimale pour former les vésicules multilamellaires (MLV) dans la solution d’échange de travail. Les lipides sont généralement séchés sur un bloc chauffant sous un flux constant d’azote gazeux maintenu à environ 10 psi pendant 10 à 20 min. Une pression de gaz excessive ou le fait de placer la buse de gaz près du fond du tube peut provoquer des éclaboussures du liquide de séchage contre les parois, entraînant une perte de volume lipidique et potentiellement une modification de la concentration des MLV. Pour éviter la contamination croisée, tous les composants de l’équipement de séchage sont lavés avec de l’éthanol à 100 % avant et après le processus de séchage. Pour assurer un séchage complet, le tube est placé sous vide poussé pendant 1 h puis scellé avec un film transparent pour maintenir la pureté du lipide séché.
Les limites de l’expérience peuvent être attribuées au rôle des flippases et des scramblases dans le maintien de l’asymétrie membranaire. Les enzymes responsables du mouvement des lipides entre les feuillets interne et externe de la bicouche préservent le caractère asymétrique de la membrane cellulaire17. Au cours de l’expérience, la vitesse à laquelle les flippases et les scramblases redistribuent les lipides ajoutés de manière exogène entre les folioles est inconnue. Cela pourrait établir la nature de la membrane cellulaire et constitue un facteur externe qui n’a pas été ignoré.
De plus, cette action de bascule pourrait, dans certaines conditions, exposer des lipides prématurément présents dans la membrane interne des cellules, comme la phosphatidylsérine (PS), un lipide intrinsèquement responsable de la signalisation de l’apoptose cellulaire18. Nos expériences utilisent des échanges lipidiques de sphingomyléine (SM) et de phosatidylcholine (PC). Ces lipides sont présents dans le feuillet externe de la membrane plasmique et mettent de longues durées à se retourner vers le feuillet cytosolique, ce qui permet de réaliser le test principalement vers le feuillet externe 9,19,20. Un autre problème est que tous les lipides exogènes ajoutés aux cellules ne peuvent pas soutenir pleinement l’intégrité et la structure de la membrane cellulaire 9,19. L’utilisation de tels lipides endommagera par inadvertance la membrane cellulaire après l’échange, limitant ainsi les lipides utilisés dans le protocole d’échange. En effectuant des tests de viabilité cellulaire, les tests peuvent aider à évaluer l’étendue des dommages subis par les cellules après l’incubation avec le milieu d’échange4. L’analyse par cytométrie en flux de cellules trypsinisées et traitées à l’iodure de propidium est une méthode permettant d’analyser la viabilité des cellules échangées de lipides. Les lésions membranaires pourraient également entraîner l’internalisation des récepteurs. De grandes quantités d’internalisation des récepteurs de l’insuline modifieront les données d’autophosphorylation des récepteurs. La cytométrie en flux effectuée sur des anticorps marqués à la phycoérythrine et liés aux ectodomaines du récepteur de l’insuline dans les cellules traitées avec des milieux d’échange peut expliquer tout changement dans l’expression des récepteurs de surface 4,20.
Dans ce manuscrit, nous avons rapporté les concentrations d’une variété de lipides chargés sur des concentrations spécifiques de MαCD pour un échange lipidique efficace dans les cellules IR CHO. Pour effectuer des expériences d’échange dans d’autres lignées cellulaires, la première étape consiste à déterminer les concentrations lipidiques efficaces dans le milieu d’échange tolérées par les cellules sans compromettre l’intégrité de la membrane ni affecter la viabilité cellulaire 8,9,21. Une large gamme de rapports CD/lipides exogènes doit être testée avec des cellules non traitées. De cette manière, un rapport optimal entre CD et lipides sera identifié lorsqu’il n’y a pas d’arrondi visible des cellules ou de détachement de la plaque (dans le cas des cellules adhérentes), et que la morphologie des cellules traitées est similaire à celle des cellules non traitées. D’un point de vue biochimique, les cellules traitées avec des milieux lipidiques CD doivent être vérifiées pour détecter des perturbations dans la membrane après les échanges lipidiques à l’aide d’un traitement au bleu de trypan et d’une fuite d’iodure de propidium ou d’une liaison à l’annexine V pour tester l’exposition à la PSde surface 21. Les conditions optimales de température et la durée des périodes d’échange varient selon les vésicules lipidiques et doivent être déterminées pour les nouvelles lignées cellulaires. Notre expérience d’échange de lipides a été réalisée exclusivement dans des membranes de cellules vivantes. À notre connaissance, il n’existe aucune preuve d’un échange de lipides réussi dans le lysat cellulaire. Cette technique d’échange lipidique peut être étendue pour modifier la membrane des organites à l’intérieur de la cellule s’ils peuvent être isolés du lysat cellulaire.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Le financement a été fourni par GM 122493, subvention des NIH. Les cellules CHO IR ont été offertes par le Dr Jonathan Whittaker (Case Western Reserve University).
matériels
| Name | Company | Catalog Number | Comments |
| 1,2-dilauroyl-sn-glycero-3-phosphocholine (DLPC) | Avanti Polar Lipids | 850335 | |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) | Avanti Polar Lipids | 850345 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375 | |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Avanti Polar Lipids | 850355 | |
| 1,2-distearoyl-sn-glycero-3-phosphocholine (DSPC) | Avanti Polar Lipids | 850365 | |
| 1-palmitoyl-2-oleoyl-sn-glycerol-3-phosphocholine (POPC) | Avanti Polar Lipids | 850457 | |
| Anti-insulin receptor β antibody | Cell Signaling Technology | CST3025 | |
| Anti-pYpY1162/1163 Insulin receptor antibody | R&D Systems Inc. | AF2507 | |
| Anti-rabbit IgG, HRP-linked Antibody | Cell Signaling Technology | 7074 | |
| Borosilicate glass test tubes (12 x 75 mm) | Thermo Fisher Scientific | 14-961-26 | |
| Brain sphingomyelin (bSM) | Avanti Polar Lipids | 860062 | |
| Egg sphingomyelin (eSM) | Avanti Polar Lipids | 860061 | |
| Fetal bovine serum (FBS) | Corning | 35-016-CV | |
| G418 disulfate salt | Sigma Aldrich | A1720 | |
| Gibco Antibiotic-antimycotic solution (100x) | Thermo Fisher Scientific | 15240062 | |
| Gibco Dulbecco’s modified eagle medium (DMEM, 4.5 g/L glucose, L-glutamine, sodium pyruvate) | Thermo Fisher Scientific | 11965092 | |
| Gibco ham’s F12 media | Thermo Fisher Scientific | 11765054 | |
| Gibco L-glutamine | Thermo Fisher Scientific | 25030032 | |
| Gibco MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140050 | |
| Gibco phosphate buffered saline (PBS) without calcium and magnesium (0.144 g/L KH2PO4, 9 g/L NaCl, 0.795 g/L Na2- HPO4 (anhydrous)) | Thermo Fisher Scientific | 10010023 | |
| Gibco Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300054 | |
| High performance thin layer chromatography (HP-TLC) | Merck | HP-TLC Silica Gel 60 plates | |
| Immobilon-P PVDF Membrane | Millipore | IPVH00010 | |
| Methotrexate | Sigma Aldrich | 454126 | |
| Methyl-α-cyclodextrin (MαCD) | AraChem | CDexA076/BR | |
| Pierce ECL Western Blotting Substrate | Thermo Fisher Scientific | 32106 | |
| Sodium orthovanadate, Activated | Sigma Aldrich | 5.08605 |
Références
- Brown, D. A., London, E. Functions of lipid rafts in biological membranes. Annu Rev Cell Dev Biol. 14, 111-136 (1998).
- Brown, D. A. Lipid rafts, detergent-resistant membranes, and raft targeting signals. Physiology. 21, 430-439 (2006).
- Schroeder, R., London, E., Brown, D. Interactions between saturated acyl chains confer detergent resistance on lipids and glycosylphosphatidylinositol (GPI)-anchored proteins: GPI-anchored proteins in liposomes and cells show similar behavior. Proc Natl Acad Sci U S A. 91 (25), 12130-12134 (1994).
- Suresh, P., Miller, W. T., London, E. Phospholipid exchange shows insulin receptor activity is supported by both the propensity to form wide bilayers and ordered raft domains. J Biol Chem. 297 (3), 101010 (2021).
- Delle Bovi, R. J., Kim, J., Suresh, P., London, E., Miller, W. T. Sterol structure dependence of insulin receptor and insulin-like growth factor 1 receptor activation. Biochim Biophys Acta Biomembr. 1861 (4), 819-826 (2019).
- Zidovetzki, R., Levitan, I. Use of cyclodextrins to manipulate plasma membrane cholesterol content: evidence, misconceptions and control strategies. Biochim Biophys Acta. 1768 (6), 1311-1324 (2007).
- Ohtani, Y., Irie, T., Uekama, K., Fukunaga, K., Pitha, J. Differential effects of α-, β- and γ-cyclodextrins on human erythrocytes. Eur J Biochem. 186 (1-2), 17-22 (1989).
- Suresh, P., London, E. Using cyclodextrin-induced lipid substitution to study membrane lipid and ordered membrane domain (raft) function in cells. Biochim Biophys Acta Biomembr. 1864 (1), 183774 (2022).
- Li, G., et al. Efficient replacement of plasma membrane outer leaflet phospholipids and sphingolipids in cells with exogenous lipids. Proc Natl Acad Sci U S A. 113 (49), 14025-14030 (2016).
- Yoshimasa, Y., Paul, J. I., Whittaker, J., Steiner, D. F. Effects of amino acid replacements within the tetrabasic cleavage site on the processing of the human insulin receptor precursor expressed in Chinese hamster ovary cells. J Biol Chem. 265 (28), 17230-17237 (1990).
- Gaus, K., et al. Visualizing lipid structure and raft domains in living cells with two-photon microscopy. Proc Natl Acad Sci U S A. 100 (26), 15554-15559 (2003).
- Klymchenko, S., Kreder, R. Fluorescent probes for lipid rafts: From model membranes to living cells. Chem Biol. 21 (1), 97-113 (2014).
- Pike, L. J. Growth factor receptors, lipid rafts and caveolae: An evolving story. Biochim Biophys ActaMol Cell Res. 1746 (3), 260-273 (2005).
- Brown, D. A., London, E. Structure of detergent-resistant membrane domains: does phase separation occur in biological membranes. Biochem Biophys Res Commun. 240 (1), 1-7 (1997).
- Lin, Q., London, E. Preparation of artificial plasma membrane mimicking vesicles with lipid asymmetry. PLoS One. 9 (1), e87903 (2014).
- Sezgin, E., et al. Elucidating membrane structure and protein behavior using giant plasma membrane vesicles. Nat Protoc. 7 (6), 1042-1051 (2012).
- Deveaux, P. F., Hermann, A., Ohlwein, N., Kozlov, M. M. How lipid flippases can modulate membrane structure. Biochimica et Biophysica Acta Biomembr. 1778 (7), 1591-1600 (2008).
- Balasubramaniam, K., Mirnikjoo, B., Schroit, A. J. Regulated externalization of phosphatidylserine at the cell surface: implications for apoptosis. J Biol Chem. 282 (25), 18357-18364 (2007).
- Li, G., et al. Replacing plasma membrane outer leaflet lipids with exogenous lipid without damaging membrane integrity. PLoS One. 14 (10), e0223572 (2019).
- Contreras, F. X., Sanchez-Magraner, L., Alonso, A., Goni, F. M. Transbilayer (flip-flop) lipid motion and lipid scrambling in membranes. FEBS Letters. 584 (9), 1779-1786 (2010).
- Suresh, P., London, E. MαCD-based plasma membrane outer leaflet lipid exchange in mammalian cells to study insulin receptor activity. Biophys Approach Study Memb Struct A Exp. 700, 485-507 (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon