Method Article
活细胞中的脂质交换测定
摘要
我们描述了一种使用环糊精介导质膜脂质与外源脂质之间交换的方法。该技术可以与研究跨膜蛋白的实验配对,这些蛋白在脂筏样环境中的行为与在非筏样环境中的行为不同。
摘要
脂筏是质膜中动态的有序结构域,通常在膜蛋白聚集和信号传导过程中形成。外小叶的脂质特性驱动膜形成脂筏的倾向。脂筏的瞬时性质使其难以在活细胞中进行研究。因此,在活细胞的外叶中添加或去除形成筏的脂质的方法有助于研究筏的特性,例如它们对膜蛋白的影响。我们实验室开发的脂质交换实验利用载脂环糊精去除和添加外源性磷脂以改变质膜的脂质组成。用筏或非筏形成脂质代替膜有助于研究对跨膜蛋白活性的影响。在这里,我们描述了一种使用载脂质的环糊精在质膜外小叶上进行脂质交换的方法。我们展示了交换培养基的制备和贴壁哺乳动物细胞的后续处理。我们还展示了如何使用 HP-TLC 测量交换效率。该方案产生外源性脂质几乎完全替换外小叶而不改变细胞活力,允许在修饰的完整质膜上进行进一步实验。
引言
质膜由富含各种膜蛋白(包括跨膜受体和离子通道)的脂质双层组成。膜内的脂质结构域已通过去污剂抗性膜 (DRM) 分级分离实验中鉴定的去污剂可溶性和不溶性区域进行阐明1。不溶性馏分的特征是富含胆固醇、紧密堆积的鞘磷脂和饱和磷脂,表现出较高的熔点,而可溶性馏分主要由较低的熔解温度和松散堆积的不饱和磷脂组成。紧密堆积的区域称为液体有序 (Lo) 脂质结构域或脂筏,而组织更松散的液体无序 (Ld) 脂质结构域是质膜的非筏区域 2,3。已知脂筏区域可促进信号转导过程,有证据表明活性胰岛素受体与这些脂筏相关 4,5。然而,由于细胞膜的动态性质和结构域的通常较小尺寸,直接可视化活细胞中筏的存在存在重大挑战。在这种情况下,我们提出了一种通过脂质交换技术研究脂筏对胰岛素受体影响的方法。
环糊精 (CDs) 由连接的葡萄糖单体形成,这些葡萄糖单体形成具有中心腔的环状结构。该腔的大小由葡萄糖单元的数量决定:6 个单元形成 α-环糊精 (α-CD),而 7 个单元形成 β-环糊精 (β-CD)。CD 是高度水溶性的分子,能够将脂质封装在其腔内,从而促进它们转运到细胞膜6。β-环糊精已广泛用于添加和去除膜中的脂质7;然而,其较大的空腔对胆固醇或磷脂缺乏特异性8。相比之下,α-环糊精具有较小的腔体,在结合脂质分子方面表现出比甾醇更大的选择性。具体来说,甲基-α-环糊精 (methyl-α-CDs) 不与甾醇相互作用,已被有效地用于交换磷脂和鞘磷脂,而不会改变细胞膜的胆固醇组成 8,9。
在本手稿中,我们提供了使用甲基-α-CD (MαCD) 将细胞膜外小叶中的脂质与外源脂质交换的详细方案,这些脂质具有促进或破坏脂筏形成的特性。这种交换用于研究脂筏对胰岛素受体活性的影响。该演示将侧重于磷脂和鞘磷脂的引入,该磷脂和鞘磷脂会影响稳定过表达胰岛素受体 (IR) 的中国仓鼠卵巢 (CHO) 细胞系质膜中液体有序 (Lo) 结构域的形成10。CHO IR 细胞中脂质交换的程度将通过高效薄层色谱 (HP-TLC) 进行评估,而胰岛素受体活性的变化将在脂质交换后胰岛素刺激后通过蛋白质印迹分析进行量化。
研究方案
1. 甲基-α-CD 溶液的制备
- 在玻璃瓶中将 20 mL 磷酸盐缓冲盐水 (PBS) 添加到 ~10 g MαCD 粉末中。在温水浴 (45 °C) 中孵育以溶解,偶尔搅拌直至完全溶解。
注:由于不溶性 CD 种类,溶液可能仍呈浑浊状态。 - 将溶液通过 0.22 μm 针式过滤器。解决方案将变得清晰。
- 使用折光仪确定 MαCD 的确切浓度。
- 将 10 μL 样品放在折光仪的样品区域,用白色白炽灯泡照射,并记录溶液的示差折光率。
- 使用方程式计算 MαCD 浓度
RI = (1.49 x 10 x C) + 1.33
其中 RI = 折光率,C = MαCD 浓度 (mM)。该方程是通过重量分析或测量溶解在已知体积中的已知重量的 MαCD 的折光率获得的。
- 用盖子盖上玻璃瓶,用透明薄膜包裹盖子以防止蒸发。储存在 4 °C。
2. 多层囊泡 (MLV) 的制备
- 保持溶解在氯仿中浓度为 20 mM 至 50 mM 的所需外源脂质的储备液,并储存在 -20 °C 或更低温度下,以尽量减少溶剂蒸发。
注: 表 1 中的所有脂质都可以完全溶解在氯仿原液中。然而,替代脂质可能需要 1:1 氯仿:甲醇才能完全溶解。 - 使用带有玻璃尖端的外置活塞式移液器将脂质原液分装到硼硅酸盐管中。或者,可以使用玻璃微量注射器。
- 在 N2 气体流下,在约 50 °C 的低温加热块上干燥脂质等分试样,直到所有表观的氯仿蒸发。
- 将试管放入真空室中,并将其暴露在高真空(低于 200 mTorr)中 1 小时,从干燥的脂质中去除剩余的溶剂。
- 将无血清 Ham's F-12 培养基添加到干燥的脂质膜中,以达到 20 mM 的最终浓度。盖上盖子或特氟龙胶带,在 70 °C 水浴中加热 5 分钟。
- 涡旋以悬浮脂质并形成 MLV。介质现在应该显示为云。
注意:一些饱和脂质可能无法仅通过涡旋完全悬浮,可能需要通过上下移液来悬浮,直到胶片不再可见。- 将整个体积转移到微量离心管中。MLV 可在 4 °C 下储存长达 3 天。
3. 脂质交换介质的制备
- 加入 MαCD 原液至终浓度为 40 mM,并将制备的 MLV 加入至 表 1 中的最终脂质浓度。
注意:如果使用储存在 4 °C 的 MLV,它们将沉淀在管的底部。预热至室温,并确保通过轻弹或搅动试管来重悬它们。- 根据 表 1,通过在 37 °C 或 55 °C 水浴中孵育 30 分钟,将脂质加载到 MαCD 上。选择的温度应高于所选脂质的凝胶-液相熔点。介质应从多云变为晴朗。
- 让脂质交换培养基冷却至室温 30-60 分钟。
4. 细胞的脂质交换处理
- 在 37 °C 和 5% CO2 中,在补充有 10% 胎牛血清 (FBS)、300 μg/mL L-谷氨酰胺、100 μg/mL 非必需氨基酸、50 μg/mL G418、2 μM 甲氨蝶呤和 1x 抗生素 - 抗真菌剂的 Dulbecco 改良 Eagle 培养基(DMEM,4.5 g/L 葡萄糖)中培养 CHO IR 细胞。
- 在 60 mm 板中接种 1.5 x 106 个细胞,并生长至 80%-90% 汇合。
- 通过加入 1 mL PBS 然后吸出来洗涤细胞 3 次。在 2 mL 无血清 Ham's F12 培养基中将细胞饥饿过夜。
- 用 1 mL PBS 洗涤细胞 3 次。向细胞中加入 1 mL 制备的交换培养基或无血清培养基作为对照,并在室温 (25 °C -27 °C) 下孵育 1 小时。每 15 分钟涡流一次细胞,以确保均匀暴露于交换介质中。
- 用 1 mL PBS 洗涤细胞 3 次。随后可以在步骤 5 中处理每个板以进行脂质提取,或在步骤 7 中处理 IR 自磷酸化。
5. 细胞培养板上的脂质提取
- 完全去除 PBS,将板以 45° 角放置 10 分钟或直到完全干燥,去除可能沿底部聚集的任何缓冲液。
- 向干燥的细胞中加入 1 mL 3:2 (v:v) 己烷:异丙醇溶液,并在室温下在摇床上孵育 10 分钟。
- 将溶液转移到硼硅酸盐管中。用特氟龙胶带覆盖并储存在 -20 °C。
- 通过加入 500 μL 1N NaOH 并在室温下摇动 10 分钟来溶解剩余的细胞碎片。
- 在蛋白质定量分析(如 Bradford 分析)中使用该溶液来确定每个样品的蛋白质浓度。这些浓度值可用于标准化 HP-TLC 板上脂质提取物的上样体积,以实现所有样品的脂质上样量相等。
6. 使用 HP-TLC 检查交换效率
- 制作 100 mL 的 65:25:5 (v:v:v) 氯仿:甲醇:30% (v/v) 氢氧化铵,然后将其倒入玻璃 TLC 罐中。盖紧盖子,让蒸汽平衡至少 1 小时。
- 在 N2 气体流下,将脂质提取物样品放在加热块上以低设置干燥,直到所有表观的有机溶剂蒸发。
- 将脂质膜溶解在 50 μL 1:1 (v:v) 氯仿:甲醇中。
- 使用 10 μL Hamilton 注射器在硅胶 HP-TLC 板上以 1 cm 条带加载 1-10 μL 样品。在 20 cm 板上加载最多 10 个条带。使用归一化值来确定在所有样品中上样等量脂质所需的体积。
注意:在加载每个样品之前,应将其以中高设置放在热板上以激活板。 - 将板直立放入 TLC 槽中,让溶剂前沿移动 8 cm,以确保磷脂种类的分离。
- 让板干燥 10 分钟。喷洒 3% (w/v) 乙酸铜和 8% (v/v) 磷酸的水溶液。
- 让板在室温下或用热风枪干燥 30 分钟。板应从半透明蓝色变为不透明白色。
- 在 180 °C-200 °C 的烘箱中炭化 5-10 分钟或直到可检测到黑色脂质带。
7. 使用自磷酸化测定和 western blot 检查受体激活
- 在室温下,将细胞与 500 μL 100 nM 胰岛素在无血清培养基中孵育 5 分钟。
- 用冰冷的 PBS 洗涤细胞,并将细胞置于冰上以停止刺激。立即向细胞中加入 1 mL 冰冷的 PBS,并用细胞刮刀收获。在 4 °C 下以 3000 x g 沉淀细胞 5 分钟。
- 将 100-200 μL 完全 RIPA 裂解缓冲液(50 mM Tris pH 8、200 mM NaCl、1 mM EDTA、1% (v/v) Triton X-100、1% (w/v) 脱氧胆酸钠、1 mM 活化原钒酸钠、10 μg/mL 抑肽酶、10 μg/mL 亮肽素)添加到冰上的细胞沉淀中。上下移液 30x-40x 以裂解。
- 将裂解物在冰上孵育 10 分钟。通过在 4°C 下以 16,000 x g 旋转 10 分钟并收集上清液来清除细胞碎片的裂解物。保留约 20 μL 裂解物,以使用 Bradford 测定法测定蛋白质浓度。
- 将裂解物与5x Laemmli缓冲液(350mM Tris HCl pH 6.8,30%v / v甘油,10%w / v SDS,25%v / v β-巯基乙醇,0.002g溴酚蓝)混合,并在95°C下煮沸5分钟。添加的缓冲液体积应足以达到 1x Laemmli 缓冲液的最终浓度。
- 通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (SDS-PAGE) 运行裂解物。
- 将所有样品的等质量蛋白质以及分子量标记物上样到 SDS-PAGE 凝胶上。在运行缓冲液(2.5 mM Tris pH 8、19.2 mM 甘氨酸、0.01% (w/v) SDS)中以 100 V-150 V 运行,直到在 100-250 kDa 范围内良好分离。
- 在转移缓冲液(2.5 mM Tris pH 8,19.2 mM 甘氨酸)中,在 100V 和 4 °C 下转移到聚偏二氟乙烯 (PVDF) 膜上 1 小时。
- 在室温下,在 TBST 中的 5% BSA 溶液(50 mM Tris pH 8、150 mM NaCl、0.1% (v/v) Tween 20)中封闭 PVDF 膜 30 分钟。
- 与 pYpY IR 抗体或 IR-β 抗体在 1:1000 浓度的 TBST 溶液中,在 5% BSA 溶液中,在室温下孵育 1 小时或在 4 °C 下过夜。
注:pYpY IR 抗体特异性识别磷酸化酪氨酸 1162 和 1163,并用于指示受体的自磷酸化。IR-β 抗体不加区分地识别受体的 β 亚基,无论磷酸化状态如何,并用于指示受体的整体水平。 - 在室温下用 TBST 洗涤 3 次。在室温下α 1:3000 浓度的 Rabbit-HRP 抗体在 TBST 溶液中的 1% BSA 溶液中孵育 30 分钟。
- 在室温下用 TBST 洗涤 3 次。与增强型化学发光 (ECL) 底物孵育 1 分钟,然后对胶片进行成像。
结果
为了证明交换后细胞脂质组成的可观察到的变化,我们在脑 SM (bSM) 和 1,2-二油酰-sn-甘油-3-磷酸胆碱 (DOPC) 交换后对 CHO IR 细胞进行了 HP-TLC(图 1)。在使用鞘磷脂(如 bSM)进行交换的情况下,SM 条带强度明显增加,而相对于未处理的对照,PC 条带强度降低。相反,当像 DOPC 一样交换磷脂酰胆碱时,PC 带变得更强,而 SM 带变得不那么强烈。可以通过使用 ImageJ 软件测量交换脂质类别的强度并取未处理和处理样品的比率来确定交换效率。该上样标准品由市售脂质的几种稀释液制成,展示了一种在交换前后估计一类脂质量的选项。通过测量 SM 标准条带的强度并生成标准曲线,可以将所有样品的 SM 强度拟合到曲线上以进行脂质定量。
接下来,我们展示了如何通过 western blot 进行脂质交换后检测受体自磷酸化(图 2)。在胰岛素受体的情况下,可以比较未处理细胞与与筏形成脂质 (bSM) 或非筏形成脂质 (DOPC) 交换的细胞之间的胰岛素依赖性自磷酸化水平。DOPC 交换对 IR 磷酸化产生负面影响,其他脂质也是如此,例如 1-棕榈酰-2-油酰-sn-甘油-3-磷酸胆碱 (POPC)4。鞘磷脂维持或适度增加 IR 磷酸化,1,2-二硬脂酰-sn-甘油-3-磷酸胆碱 (DSPC) 也是如此4。通过使用 IR-β 抗体印迹总受体水平,pYpY IR 抗体的磷酸化水平可正常化为总受体水平。pYpY IR 的 ImageJ 强度值除以 IR-β 得到归一化值(表 2)。这解释了表达水平的任何差异或其他不相等的负载蛋白量,如第一泳道所示。
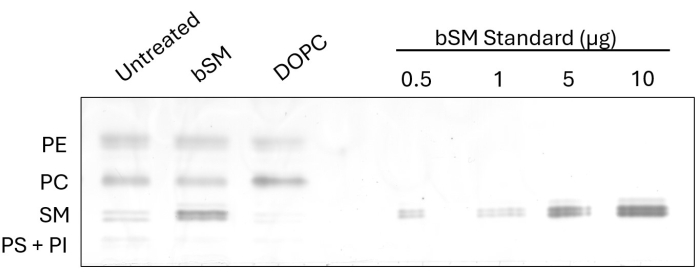
图 1:CHO IR 细胞中 bSM 和 DOPC 交换的 HP-TLC。 将 CHO IR 细胞饥饿并与脂质交换培养基 (bSM 或 DOPC) 或无血清培养基作为对照一起孵育。将等体积的脂质提取物与增加量的 bSM 一起加载到 HP-TLC 板上。 请单击此处查看此图的较大版本。

图 2:bSM 和 DOPC 交换后 IR 自磷酸化的蛋白质印迹图像。 对照板与(阳性对照)或不含(阴性对照)100 nM 胰岛素一起孵育。交换后,脂质交换板 (bSM 或 DOPC) 与 100 nM 胰岛素一起孵育。在 SDS-PAGE 上运行等量的总蛋白,并印迹 pYpY IR 和 IR-β。IR-β 印迹用作上样对照。 请单击此处查看此图的较大版本。
| 脂质 | Exchange 培养基制备温度 (°C) | 交换浓度 (mM) | 饱和度特征 |
| DOPC | 37 | 4 | 不饱和的 |
| 持久性有机化合物 | 37 | 4 | 不饱和的 |
| DLPC | 37 | 4 | 饱和的 |
| DMPC | 37 | 2 | 饱和的 |
| DPPC | 55 | 1 | 饱和的 |
| DSPC | 55 | 0.5 | 饱和的 |
| bSM | 37 | 1 | 饱和# |
| eSM 系列 | 37 | 1 | 饱和的 |
| #bSM 是鞘磷脂物种的混合物。这些物种中的大多数具有饱和特征,但 24:1 鞘磷脂除外。目前尚不清楚相对于饱和物种,24:1 鞘磷脂上样到 MαCD 的能力如何。 | |||
表 1:交换培养基中使用的脂质。
| pYpY | 红外β | pYpY/IR-β | pYpY/IR-β(归一化) | |
| 阴性对照 | 142.6 | 1229 | 0.12 | 0.09 |
| 阳性对照 | 5844 | 4446 | 1.31 | 1.00 |
| bSM | 5886 | 5173 | 1.14 | 0.87 |
| DOPC | 2031 | 2740 | 0.74 | 0.56 |
表 2:IR 自磷酸化 western blot 的强度值。
讨论
自从细胞膜中存在脂筏的概念化以来,已经进行了多次尝试在细胞中可视化它们并研究脂质和受体的结合。涉及细胞显微镜11 的实验使用荧光标记的生物标志物,通常是已知与筏相关的蛋白质和脂质,以直观地研究细胞中有序脂质结构域的定位12。然而,细胞膜上充满了褶皱13,14、小窝内陷 1,13 和蛋白质聚集2,这阻碍了筏生物标志物动力学的可视化。另一种方法已被用于研究模型膜中的筏,方法是使用适当的脂质制备囊泡15。虽然这些囊泡易于合成和使用,但就细胞双层的生物物理特性和化学组成而言,这些囊泡并不能准确表示细胞膜。天然膜系统是巨质膜囊泡 (GPMV)。GPMV 是质膜囊泡,具有细胞膜的化学精确组成。这些是通过用试剂孵育细胞产生的,这些试剂通过从活细胞的细胞膜上出芽形成囊泡16。然而,已知形成 GPMV 的常规溶液会在囊泡化过程中对脂质和蛋白质进行化学修饰和/或交联,并组成性地激活囊泡中的受体。我们实验室开发的方案通过交换具有不同倾向的外源脂质来影响膜形成脂筏的能力,以支持或破坏完整细胞中细胞膜的有序区域,而无需化学修饰蛋白质 4,8。
脂质交换实验之后可以立即进行测量质膜特性的分析。HP-TLC 可确认交换已发生并在实验后维持,增加了交换测定后进行的任何生化实验结果的可信度。通过可视化交换前后细胞的鞘磷脂和磷脂组成,还可以确定在一组新条件下的交换效率,例如新的细胞系或环糊精。导致方案交换部分的步骤在确保细胞中重复的精度和有效的脂质交换方面起着重要作用。校准、移液和干燥脂质应被视为关键步骤,因为使用的有机溶剂体积小,并且正确加载 MαCD 的浓度要求很微妙。脂质储备溶液的正确储存和校准是方案中的关键初步步骤。储备液通常用氯仿制备,即使储存在 -20 °C 下,也会随着时间的推移而蒸发,从而导致浓度逐渐变化。干燥规定体积的脂质以达到所需的浓度对于确保在交换过程中将正确量的脂质加载到环糊精上至关重要。为防止移液错误,建议每月校准储备液的浓度。
校准储备溶液后,将所需脂质的体积移液到干净的硼硅酸盐管中,例如,使用使用玻璃孔的外置活塞式 Drummond 移液器。高脂质原液浓度可能需要极小的体积移液,从而导致最终交换条件不可避免的误差和可变性。为防止这种情况,建议移液的体积对应于原液和最终交换溶液之间的中间浓度。这种方法可确保在工作交换溶液中形成多层囊泡 (MLV) 的最佳移液准确性。脂质通常在加热块上在稳定的氮气流下保持约 10 psi 的干燥 10-20 分钟。气压过大或将气嘴靠近管底放置可能会导致干燥液飞溅到管壁上,从而导致脂质体积损失并可能改变 MLV 的浓度。为防止交叉污染,干燥设备的所有组件在干燥过程之前和之后都用 100% 乙醇清洗。为确保完全干燥,将试管置于高真空下 1 小时,然后用透明薄膜密封以保持干燥脂质的纯度。
实验的局限性可归因于 flippases 和 scramblases 在维持膜不对称性中的作用。负责脂质在双层内小叶和外小叶之间移动的酶保持了细胞膜的不对称性质17。在实验过程中,flippase 和 scramblase 在小叶之间重新分配外源添加的脂质的速率是未知的。这可以确定细胞膜的性质,并且是一个并非未被解释的外部因素。
此外,在某些情况下,这种触发器作用可能会过早暴露细胞内膜中的脂质,如磷脂酰丝氨酸 (PS),这种脂质本身负责细胞凋亡信号传导18。我们的实验采用鞘磷脂 (SM) 和磷脂胆碱 (PC) 脂质交换。这些脂质存在于质膜的外小叶中,并且需要很长时间才能转向主要针对外小叶的测定的胞质小叶 9,19,20。另一个问题是,并非添加到细胞中的每种外源性脂质都可以完全支持细胞膜的完整性和结构 9,19。使用此类脂质会在交换后无意中损坏细胞膜,从而限制交换方案中使用的脂质。在进行细胞活力分析时,检测有助于测量细胞与交换培养基孵育后所承受的损伤程度4。胰蛋白酶消化和碘化丙啶处理的细胞的流式细胞术分析是一种分析脂质交换细胞活力的方法。膜损伤也可能导致受体内化。大量的胰岛素受体内化会改变受体自磷酸化数据。在用交换培养基处理的细胞中,对与胰岛素受体胞外结构域结合的藻红蛋白标记抗体进行流式细胞术可以解释表面受体表达的任何变化 4,20。
在这份手稿中,我们报告了加载到特定浓度的 MαCD 上的各种脂质的浓度,以便在 CHO IR 细胞中进行有效的脂质交换。为了在其他细胞系中进行交换实验,第一步是确定细胞耐受的交换培养基中的有效脂质浓度,而不会影响膜完整性或细胞活力 8,9,21。应与未处理的细胞一起测试各种 CD 与外源性脂质的比率。以这种方式,在没有可见的细胞聚集或从板中分离(在贴壁细胞的情况下)的地方确定 CD:脂质的最佳比例,并且处理过的细胞的形态与未处理的细胞相似。在生化方面,用 CD 处理的细胞:脂质培养基应使用台盼蓝处理和碘化丙啶泄漏或膜联蛋白 V 结合以测试表面 PS 暴露21 检查脂质交换后膜中的扰动。最佳温度条件和交换期长度因脂质囊泡而异,应针对新细胞系确定。我们的脂质交换实验仅在活细胞膜中进行。据我们所知,没有数据证据表明细胞裂解物中的脂质交换成功。如果可以从细胞裂解物中分离出细胞器,则可以扩展这种脂质交换技术以改变细胞内的细胞器膜。
披露声明
作者声明没有利益冲突。
致谢
资金由 NIH 赠款 GM 122493 提供。CHO IR 细胞是 Jonathan Whittaker 博士(凯斯西储大学)的一份善意礼物。
材料
| Name | Company | Catalog Number | Comments |
| 1,2-dilauroyl-sn-glycero-3-phosphocholine (DLPC) | Avanti Polar Lipids | 850335 | |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) | Avanti Polar Lipids | 850345 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375 | |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Avanti Polar Lipids | 850355 | |
| 1,2-distearoyl-sn-glycero-3-phosphocholine (DSPC) | Avanti Polar Lipids | 850365 | |
| 1-palmitoyl-2-oleoyl-sn-glycerol-3-phosphocholine (POPC) | Avanti Polar Lipids | 850457 | |
| Anti-insulin receptor β antibody | Cell Signaling Technology | CST3025 | |
| Anti-pYpY1162/1163 Insulin receptor antibody | R&D Systems Inc. | AF2507 | |
| Anti-rabbit IgG, HRP-linked Antibody | Cell Signaling Technology | 7074 | |
| Borosilicate glass test tubes (12 x 75 mm) | Thermo Fisher Scientific | 14-961-26 | |
| Brain sphingomyelin (bSM) | Avanti Polar Lipids | 860062 | |
| Egg sphingomyelin (eSM) | Avanti Polar Lipids | 860061 | |
| Fetal bovine serum (FBS) | Corning | 35-016-CV | |
| G418 disulfate salt | Sigma Aldrich | A1720 | |
| Gibco Antibiotic-antimycotic solution (100x) | Thermo Fisher Scientific | 15240062 | |
| Gibco Dulbecco’s modified eagle medium (DMEM, 4.5 g/L glucose, L-glutamine, sodium pyruvate) | Thermo Fisher Scientific | 11965092 | |
| Gibco ham’s F12 media | Thermo Fisher Scientific | 11765054 | |
| Gibco L-glutamine | Thermo Fisher Scientific | 25030032 | |
| Gibco MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140050 | |
| Gibco phosphate buffered saline (PBS) without calcium and magnesium (0.144 g/L KH2PO4, 9 g/L NaCl, 0.795 g/L Na2- HPO4 (anhydrous)) | Thermo Fisher Scientific | 10010023 | |
| Gibco Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300054 | |
| High performance thin layer chromatography (HP-TLC) | Merck | HP-TLC Silica Gel 60 plates | |
| Immobilon-P PVDF Membrane | Millipore | IPVH00010 | |
| Methotrexate | Sigma Aldrich | 454126 | |
| Methyl-α-cyclodextrin (MαCD) | AraChem | CDexA076/BR | |
| Pierce ECL Western Blotting Substrate | Thermo Fisher Scientific | 32106 | |
| Sodium orthovanadate, Activated | Sigma Aldrich | 5.08605 |
参考文献
- Brown, D. A., London, E. Functions of lipid rafts in biological membranes. Annu Rev Cell Dev Biol. 14, 111-136 (1998).
- Brown, D. A. Lipid rafts, detergent-resistant membranes, and raft targeting signals. Physiology. 21, 430-439 (2006).
- Schroeder, R., London, E., Brown, D. Interactions between saturated acyl chains confer detergent resistance on lipids and glycosylphosphatidylinositol (GPI)-anchored proteins: GPI-anchored proteins in liposomes and cells show similar behavior. Proc Natl Acad Sci U S A. 91 (25), 12130-12134 (1994).
- Suresh, P., Miller, W. T., London, E. Phospholipid exchange shows insulin receptor activity is supported by both the propensity to form wide bilayers and ordered raft domains. J Biol Chem. 297 (3), 101010 (2021).
- Delle Bovi, R. J., Kim, J., Suresh, P., London, E., Miller, W. T. Sterol structure dependence of insulin receptor and insulin-like growth factor 1 receptor activation. Biochim Biophys Acta Biomembr. 1861 (4), 819-826 (2019).
- Zidovetzki, R., Levitan, I. Use of cyclodextrins to manipulate plasma membrane cholesterol content: evidence, misconceptions and control strategies. Biochim Biophys Acta. 1768 (6), 1311-1324 (2007).
- Ohtani, Y., Irie, T., Uekama, K., Fukunaga, K., Pitha, J. Differential effects of α-, β- and γ-cyclodextrins on human erythrocytes. Eur J Biochem. 186 (1-2), 17-22 (1989).
- Suresh, P., London, E. Using cyclodextrin-induced lipid substitution to study membrane lipid and ordered membrane domain (raft) function in cells. Biochim Biophys Acta Biomembr. 1864 (1), 183774 (2022).
- Li, G., et al. Efficient replacement of plasma membrane outer leaflet phospholipids and sphingolipids in cells with exogenous lipids. Proc Natl Acad Sci U S A. 113 (49), 14025-14030 (2016).
- Yoshimasa, Y., Paul, J. I., Whittaker, J., Steiner, D. F. Effects of amino acid replacements within the tetrabasic cleavage site on the processing of the human insulin receptor precursor expressed in Chinese hamster ovary cells. J Biol Chem. 265 (28), 17230-17237 (1990).
- Gaus, K., et al. Visualizing lipid structure and raft domains in living cells with two-photon microscopy. Proc Natl Acad Sci U S A. 100 (26), 15554-15559 (2003).
- Klymchenko, S., Kreder, R. Fluorescent probes for lipid rafts: From model membranes to living cells. Chem Biol. 21 (1), 97-113 (2014).
- Pike, L. J. Growth factor receptors, lipid rafts and caveolae: An evolving story. Biochim Biophys ActaMol Cell Res. 1746 (3), 260-273 (2005).
- Brown, D. A., London, E. Structure of detergent-resistant membrane domains: does phase separation occur in biological membranes. Biochem Biophys Res Commun. 240 (1), 1-7 (1997).
- Lin, Q., London, E. Preparation of artificial plasma membrane mimicking vesicles with lipid asymmetry. PLoS One. 9 (1), e87903 (2014).
- Sezgin, E., et al. Elucidating membrane structure and protein behavior using giant plasma membrane vesicles. Nat Protoc. 7 (6), 1042-1051 (2012).
- Deveaux, P. F., Hermann, A., Ohlwein, N., Kozlov, M. M. How lipid flippases can modulate membrane structure. Biochimica et Biophysica Acta Biomembr. 1778 (7), 1591-1600 (2008).
- Balasubramaniam, K., Mirnikjoo, B., Schroit, A. J. Regulated externalization of phosphatidylserine at the cell surface: implications for apoptosis. J Biol Chem. 282 (25), 18357-18364 (2007).
- Li, G., et al. Replacing plasma membrane outer leaflet lipids with exogenous lipid without damaging membrane integrity. PLoS One. 14 (10), e0223572 (2019).
- Contreras, F. X., Sanchez-Magraner, L., Alonso, A., Goni, F. M. Transbilayer (flip-flop) lipid motion and lipid scrambling in membranes. FEBS Letters. 584 (9), 1779-1786 (2010).
- Suresh, P., London, E. MαCD-based plasma membrane outer leaflet lipid exchange in mammalian cells to study insulin receptor activity. Biophys Approach Study Memb Struct A Exp. 700, 485-507 (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。