Method Article
Lipidaustausch-Assay in lebenden Zellen
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Verfahren zur Verwendung von Cyclodextrin, um den Austausch zwischen Lipiden der Plasmamembran und exogenen Lipiden zu vermitteln. Diese Technik kann mit Experimenten kombiniert werden, in denen Transmembranproteine untersucht werden, die sich in Lipid-Raft-ähnlichen Umgebungen anders verhalten als in nicht-Raft-ähnlichen Umgebungen.
Zusammenfassung
Lipid Rafts sind dynamische, geordnete Domänen in der Plasmamembran, die häufig während der Clusterbildung und Signalübertragung von Membranproteinen gebildet werden. Die Lipididentität des äußeren Segels treibt die Neigung der Membran zur Bildung von Lipidflößen an. Die flüchtige Natur von Lipid Rafts macht es schwierig, sie in lebenden Zellen zu untersuchen. Methoden, die Raft-bildende Lipide an der äußeren Falte lebender Zellen hinzufügen oder entfernen, erleichtern daher die Untersuchung der Eigenschaften von Rafts, wie z. B. ihrer Auswirkungen auf Membranproteine. Bei Lipidaustauschexperimenten, die in unserem Labor entwickelt wurden, werden lipidbeladene Cyclodextrine verwendet, um exogene Phospholipide zu entfernen und hinzuzufügen, um die Lipidkonstitution der Plasmamembran zu verändern. Die Substitution der Membran durch ein Raft- oder nicht-Raft-bildendes Lipid kann helfen, die Auswirkungen auf die Transmembranproteinaktivität zu untersuchen. In dieser Arbeit beschreiben wir eine Methode zum Lipidaustausch auf dem äußeren Segel der Plasmamembran unter Verwendung von lipidbeladenem Cyclodextrin. Wir demonstrieren die Aufbereitung des Austauschmediums und die anschließende Behandlung von anhaftenden Säugetierzellen. Außerdem zeigen wir, wie Sie die Effizienz des Austauschs mit HP-TLC messen können. Dieses Protokoll führt zu einem nahezu vollständigen Ersatz des äußeren Segels durch exogene Lipide, ohne die zelluläre Lebensfähigkeit zu verändern, was weitere Experimente an modifizierten intakten Plasmamembranen ermöglicht.
Einleitung
Die Plasmamembran besteht aus einer Lipiddoppelschicht, die mit verschiedenen Membranproteinen angereichert ist, darunter Transmembranrezeptoren und Ionenkanäle. Lipiddomänen innerhalb der Membran wurden durch detergenslösliche und unlösliche Bereiche aufgeklärt, die in Fraktionierungsexperimenten mit detergensresistenten Membranen (DRM) identifiziert wurden1. Die unlöslichen Fraktionen zeichneten sich dadurch aus, dass sie mit Cholesterin, dicht gepackten Sphingomyelinen und gesättigten Phospholipiden angereichert waren und höhere Schmelzpunkte aufwiesen, im Gegensatz zu den löslichen Fraktionen, die überwiegend aus niedrigeren Schmelztemperaturen und lose gepackten ungesättigten Phospholipiden bestehen. Die dicht gepackten Regionen werden als flüssigkeitsgeordnete (Lo) Lipiddomänen oder Lipid Rafts bezeichnet, während die lockerer organisierten flüssigkeitsungeordneten (Ld) Lipiddomänen die Nicht-Raft-Regionen der Plasmamembran sind 2,3. Es ist bekannt, dass Lipid-Raft-Regionen Signalprozesse erleichtern, wobei Hinweise darauf hindeuten, dass der aktive Insulinrezeptor mit diesen Rafts assoziiertist 4,5. Aufgrund der dynamischen Natur der Zellmembran und der im Allgemeinen geringen Größe der Domänen stellt die direkte Visualisierung des Vorhandenseins von Rafts in lebenden Zellen jedoch eine große Herausforderung dar. In diesem Zusammenhang stellen wir eine Methode vor, um den Einfluss von Lipid Rafts auf den Insulinrezeptor durch Lipidaustauschtechniken zu untersuchen.
Cyclodextrine (CDs) bestehen aus verknüpften Glukosemonomeren, die eine ringförmige Struktur mit einem zentralen Hohlraum bilden. Die Größe dieses Hohlraums wird durch die Anzahl der Glukoseeinheiten bestimmt: Sechs Einheiten bilden Alpha-Cyclodextrin (α-CD), während sieben Einheiten Beta-Cyclodextrine (β-CDs) bilden. CDs sind hochgradig wasserlösliche Moleküle, die in der Lage sind, Lipide in ihrer Höhle einzukapseln und so ihren Transport zur Zellmembran zu erleichtern6. Beta-Cyclodextrine wurden in großem Umfang verwendet, um Lipide aus Membranen hinzuzufügen und zu entfernen7; Seinem größeren Hohlraum fehlt jedoch die Spezifität für Cholesterin oder Phospholipide8. Im Gegensatz dazu weisen Alpha-Cyclodextrine mit ihrem kleineren Hohlraum eine größere Selektivität bei der Bindung von Lipidmolekülen über Sterole auf. Insbesondere interagiert Methyl-α-Cyclodextrin (Methyl-α-CDs) nicht mit Sterolen und wurde wirksam zum Austausch von Phospholipiden und Sphingomyelinen eingesetzt, ohne die Cholesterinzusammensetzung der Zellmembran zu verändern 8,9.
In diesem Manuskript stellen wir ein detailliertes Protokoll für die Verwendung von Methyl-α-CDs (MαCD) vor, um Lipide im äußeren Segel der Zellmembran mit exogenen Lipiden auszutauschen, die Eigenschaften haben, die die Lipid-Raft-Bildung entweder fördern oder stören. Dieser Austausch wird genutzt, um den Einfluss von Lipid Rafts auf die Insulinrezeptoraktivität zu untersuchen. Die Demonstration konzentriert sich auf die Einführung eines Phospholipids und eines Sphingomyelins, die die Bildung von flüssigkeitsgeordneten (Lo) Domänen in der Plasmamembran von Zelllinien des chinesischen Hamster-Eierstocks (CHO) beeinflussen, die den Insulinrezeptor (IR) stabil überexprimieren10. Das Ausmaß des Lipidaustauschs in den CHO-IR-Zellen wird durch Hochleistungs-Dünnschichtchromatographie (HP-TLC) bewertet, während Veränderungen der Insulinrezeptoraktivität durch Western-Blot-Analyse nach Insulinstimulation nach dem Lipidaustausch quantifiziert werden.
Protokoll
1. Herstellung der Methyl-α-CD-Lösung
- Geben Sie 20 ml phosphatgepufferte Kochsalzlösung (PBS) zu ~10 g MαCD-Pulver in eine Glasflasche. In einem warmen Wasserbad (45 °C) inkubieren, um sich aufzulösen, und dabei gelegentlich umrühren, bis es sich gut aufgelöst hat.
HINWEIS: Die Lösung kann aufgrund unlöslicher Zöliakie-Spezies noch trüb sein. - Die Lösung wird durch einen 0,22 μm Spritzenvorsatzfilter geleitet. Die Lösung wird sich zeigen.
- Verwenden Sie ein Refraktometer, um die genaue Konzentration von MαCD zu bestimmen.
- Legen Sie 10 μl Probe auf den Probenbereich eines Refraktometers, beleuchten Sie sie mit einer weißen Glühbirne und zeichnen Sie den Brechungsindex der Lösung auf.
- Berechnen Sie die MαCD-Konzentration mit der Gleichung
RI = (1,49 x 10 x C) + 1,33
wobei RI = Brechungsindex, C = Konzentration von MαCD (mM). Die Gleichung wurde durch gravimetrische Analyse oder Messung des Brechungsindex eines bekannten Gewichts von MαCD erhalten, das in einem bekannten Volumen gelöst ist.
- Verschließen Sie die Glasflasche mit einem Deckel und wickeln Sie den Deckel in eine transparente Folie, um ein Verdampfen zu verhindern. Bei 4 °C lagern.
2. Präparation von multilamellären Vesikeln (MLVs)
- Halten Sie Stammlösungen der gewünschten exogenen Lipide, die in Chloroform gelöst sind, in Konzentrationen von 20 mM bis 50 mM und lagern Sie sie bei -20 °C oder darunter, um die Verdunstung des Lösungsmittels zu minimieren.
HINWEIS: Alle Lipide in Tabelle 1 können vollständig in Chloroform-Stämmen gelöst werden. Es ist jedoch möglich, dass alternative Lipide 1:1 Chloroform: Methanol benötigen, um sich vollständig aufzulösen. - Aliquotieren Sie das Lipidmaterial in Borosilikatröhrchen unter Verwendung einer Direktverdrängerpipette mit einer Glasspitze. Alternativ kann auch eine Mikrospritze aus Glas verwendet werden.
- Das aliquotierte Lipid auf einem Heizblock bei einer niedrigen Einstellung von etwa 50 °C unter einem Strom von N2 -Gas trocknen, bis das gesamte scheinbare Chloroform verdampft ist.
- Entfernen Sie das restliche Lösungsmittel aus dem getrockneten Lipid, indem Sie das Röhrchen in eine Vakuumkammer stellen und es 1 h lang einem Hochvakuum (unter 200 mTorr) aussetzen.
- Geben Sie serumfreies F-12-Medium von Ham zum trockenen Lipidfilm, um eine Endkonzentration von 20 mM zu erreichen. Mit einem Deckel oder Teflonband abdecken und in einem 70 °C warmen Wasserbad 5 Min. erhitzen.
- Vortex, um Lipide zu suspendieren und MLVs zu bilden. Die Medien sollten nun wolkig erscheinen.
HINWEIS: Einige gesättigte Lipide können durch das Vortexen allein nicht vollständig suspendiert werden und müssen möglicherweise durch Auf- und Abpipettieren suspendiert werden, bis der Film nicht mehr sichtbar ist.- Übertragen Sie das gesamte Volumen in ein Mikrozentrifugenröhrchen. MLVs können bis zu 3 Tage bei 4 °C gelagert werden.
3. Vorbereitung der Lipidaustauschmedien
- Es wird MαCD-Stamm bis zu einer Endkonzentration von 40 mM zusammen mit vorbereiteten MLVs bis zu der in Tabelle 1 angegebenen Endlipidkonzentration zugegeben.
HINWEIS: Bei Verwendung von MLVs, die bei 4 °C gelagert werden, setzen sie sich am Boden des Röhrchens ab. Erwärmen Sie sich auf Raumtemperatur und stellen Sie sicher, dass sie durch Schnippen oder Bewegen des Rohrs wieder aufgewirbelt werden.- Die Lipide werden auf MαCD geladen, indem sie 30 Minuten lang in einem 37 °C oder 55 °C heißen Wasserbad inkubieren, wie in Tabelle 1 angegeben. Die gewählte Temperatur sollte über dem Schmelzpunkt der Gel-Flüssig-Phase des gewählten Lipids liegen. Die Medien sollten von wolkig zu klar wechseln.
- Lassen Sie das Lipidaustauschmedium 30-60 Minuten lang auf Raumtemperatur abkühlen.
4. Behandlung des Lipidaustauschs von Zellen
- Züchten Sie CHO-IR-Zellen bei 37 °C und 5 % CO2 in Dulbeccos modifiziertem Eagle-Medium (DMEM, 4,5 g/l Glukose), ergänzt mit 10 % fötalem Rinderserum (FBS), 300 μg/ml L-Glutamin, 100 μg/ml nicht-essentiellen Aminosäuren, 50 μg/ml G418, 2 μM Methotrexat und 1x Antibiotikum-Antimykotikum.
- 1,5 x 106 Zellen in 60 mm Platten säen und wachsen, bis sie zu 80%-90% konfluent sind.
- Waschen Sie die Zellen 3x, indem Sie 1 mL PBS hinzufügen und dann aspirieren. Hungern Sie die Zellen über Nacht in 2 ml serumfreiem F12-Medium von Ham's.
- Waschen Sie die Zellen 3x mit 1 mL PBS. Geben Sie 1 ml vorbereitetes Austauschmedium oder serumfreies Medium als Kontrolle zu den Zellen und inkubieren Sie es 1 h lang bei Raumtemperatur (25 °C -27 °C). Schwenken Sie die Zellen alle 15 Minuten, um eine gleichmäßige Exposition gegenüber Austauschmedien zu gewährleisten.
- Waschen Sie die Zellen 3x mit 1 mL PBS. Jede Platte kann anschließend für die Lipidextraktion in Schritt 5 oder für die IR-Autophosphorylierung in Schritt 7 verarbeitet werden.
5. Lipidextraktion auf Zellkulturplatte
- Entfernen Sie PBS vollständig und stellen Sie die Platte 10 Minuten lang in einem Winkel von 45° auf, bis sie vollständig getrocknet ist, wobei Sie alle Puffer entfernen, die sich entlang der Unterseite ansammeln könnten.
- Geben Sie 1 ml 3:2 (v:v) Hexan: Isopropanol-Lösung zu den getrockneten Zellen und inkubieren Sie sie 10 Minuten lang auf einem Schüttler bei Raumtemperatur.
- Gib die Lösung in ein Borosilikatrohr. Mit Teflonband abdecken und bei -20 °C lagern.
- Lösen Sie die restlichen Zelltrümmer auf, indem Sie 500 μl 1N NaOH hinzufügen und 10 Minuten lang bei Raumtemperatur schütteln.
- Verwenden Sie diese Lösung in einem Proteinquantifizierungsassay wie dem Bradford-Assay, um die Proteinkonzentration jeder Probe zu bestimmen. Diese Konzentrationswerte können verwendet werden, um die Beladungsvolumina der Lipidextrakte auf HP-DC-Platten zu normalisieren, um eine gleichmäßige Lipidbeladung über alle Proben zu erzielen.
6. Überprüfung der Austauscheffizienz mit HP-TLC
- Stellen Sie 100 ml 65:25:5 (v:v:v) Chloroform:Methanol:30% (v/v) Ammoniumhydroxid her und gießen Sie es in einen DC-Glastank. Decken Sie es fest ab und lassen Sie den Dampf mindestens 1 h lang äquilibrieren.
- Trockene Lipidextraktprobe auf einem Heizblock bei niedriger Einstellung unter einemN2-Gasstrom , bis das gesamte sichtbare organische Lösungsmittel verdampft ist.
- Lösen Sie den Lipidfilm in 50 μl 1:1 (v:v) Chloroform: Methanol auf.
- Verwenden Sie eine 10-μl-Hamilton-Spritze, um 1-10 μl Probe in 1-cm-Banden auf eine Silica-HP-DC-Platte zu laden. Laden Sie maximal 10 Bänder auf eine 20 cm lange Platte. Verwenden Sie normierte Werte, um die Volumina zu bestimmen, die erforderlich sind, um gleiche Mengen an Lipiden über alle Proben zu laden.
HINWEIS: Vor dem Laden jeder Probe sollte die Platte aktiviert werden, indem sie auf eine Heizplatte mit mittlerer bis hoher Einstellung gestellt wird. - Stellen Sie die Platte aufrecht in den DC-Tank und lassen Sie die Lösungsmittelfront 8 cm lang wandern, um die Trennung der Phospholipidspezies zu gewährleisten.
- Den Teller 10 min trocknen lassen. Besprühen Sie es mit einer wässrigen Lösung aus 3 % (w/v) Kupferacetat und 8 % (v/v) Phosphorsäure.
- Lassen Sie die Platte 30 Minuten bei Raumtemperatur oder mit einer Heißluftpistole trocknen. Die Platte sollte sich von durchscheinendem Blau zu Deckweiß verfärben.
- Verkohlungsplatte in einem 180 °C-200 °C Ofen für 5-10 min oder bis die schwarzen Lipidbanden erkennbar sind.
7. Überprüfung der Rezeptoraktivierung mit Autophosphorylierungsassay und Western Blot
- Inkubieren Sie die Zellen mit 500 μl 100 nM Insulin in serumfreien Medien bei Raumtemperatur für 5 min.
- Waschen Sie die Zellen mit eiskaltem PBS und legen Sie die Zellen auf Eis, um die Stimulation zu stoppen. Geben Sie sofort 1 ml eiskaltes PBS zu den Zellen und ernten Sie mit einem Zellschaber. Pelletzellen bei 3000 x g für 5 min bei 4 °C.
- Geben Sie 100-200 μl vollständigen RIPA-Lysepuffer (50 mM Tris pH 8, 200 mM NaCl, 1 mM EDTA, 1 % (v/v) Triton X-100, 1 % (w/v) Natriumdesoxycholat, 1 mM aktiviertes Natriumorthovanadat, 10 μg/mL Aprotinin, 10 μg/mL Leupeptin) zu dem Zellpellet auf Eis. Piptieren Sie 30x-40x auf und ab, um zu lysieren.
- Inkubieren Sie das Lysat 10 Minuten lang auf Eis. Lysat von Zelltrümmern befreien, indem man 10 min lang bei 4 °C bei 16.000 x g schleudert und den Überstand auffängt. Reservieren Sie etwa 20 μl Lysat, um die Proteinkonzentration mit dem Bradford-Assay zu bestimmen.
- Lysat mit 5x Laemmli Puffer (350 mM Tris HCl pH 6,8, 30 % v/v Glycerin, 10 % w/v SDS, 25 % v/v β-Mercaptoethanol, 0,002 g Bromphenolblau) kombinieren und bei 95 °C 5 min kochen lassen. Das zugegebene Puffervolumen sollte ausreichend sein, um eine Endkonzentration von 1x Laemmli-Puffer zu erreichen.
- Lassen Sie die Lysate durch die Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese (SDS-PAGE) laufen.
- Laden Sie die gleiche Proteinmasse für alle Proben zusammen mit dem Molekulargewichtsmarker auf ein SDS-PAGE-Gel. Bei 100 V-150 V in Laufpuffer (2,5 mM Tris pH 8, 19,2 mM Glycin, 0,01 % (w/v) SDS) bis zur guten Auflösung im Bereich von 100-250 kDa laufen.
- 1 h bei 100 V und 4 °C auf eine Polyvinylidenfluorid (PVDF)-Membran in Transferpuffer (2,5 mM Tris pH 8, 19,2 mM Glycin) übertragen.
- PVDF-Membran für 30 min bei Raumtemperatur in 5%iger BSA-Lösung in TBST (50 mM Tris pH 8, 150 mM NaCl, 0,1% (v/v) Tween 20) blockieren.
- Inkubieren Sie mit einem pYpY-IR-Antikörper oder einem IR-β-Antikörper in einer Konzentration von 1:1000 in 5%iger BSA-Lösung in TBST für 1 h bei Raumtemperatur oder über Nacht bei 4 °C.
HINWEIS: Der pYpY-IR-Antikörper erkennt spezifisch phosphorylierte Tyrosine 1162 und 1163 und dient zur Anzeige einer Autophosphorylierung des Rezeptors. Der IR-β-Antikörper erkennt die Beta-Untereinheit des Rezeptors unterschiedslos unabhängig vom Phosphorylierungszustand und dient zur Anzeige der globalen Spiegel des Rezeptors. - 3x mit TBST bei Zimmertemperatur waschen. Inkubieren Sie mit α Kaninchen-HRP-Antikörper bei einer Konzentration von 1:3000 in 1%iger BSA-Lösung in TBST für 30 Minuten bei Raumtemperatur.
- 3x mit TBST bei Zimmertemperatur waschen. Inkubieren Sie 1 Minute lang mit Enhanced Chemiluminescent (ECL)-Substrat und belichten Sie den Film.
Ergebnisse
Um die beobachtbare Veränderung der zellulären Lipidzusammensetzung nach dem Austausch zu demonstrieren, führten wir HP-TLC an CHO IR-Zellen nach dem Austausch von SM (bSM) im Gehirn und 1,2-Dioleoyl-sn-glycero-3-phosphocholin (DOPC) durch (Abbildung 1). In Fällen, in denen Sphingomyeline wie bSM für den Austausch verwendet werden, ist eine Zunahme der SM-Bandenintensität offensichtlich, zusammen mit einer Abnahme der PC-Bandenintensität im Vergleich zur unbehandelten Kontrolle. Umgekehrt wird beim Austausch von Phosphatidylcholinen wie DOPC die PC-Bande intensiver, während die SM-Bande weniger intensiv wird. Die Austauscheffizienz kann bestimmt werden, indem die Intensitäten der ausgetauschten Lipidklasse mit der ImageJ-Software gemessen und das Verhältnis der unbehandelten und behandelten Proben genommen wird. Der Beladungsstandard, der aus mehreren Verdünnungen eines kommerziell erhältlichen Lipids hergestellt wird, zeigt eine Option zur Abschätzung der Menge einer Klasse von Lipiden vor und nach dem Austausch. Durch die Messung der Intensität der SM-Standardbanden und die Erstellung einer Standardkurve können die SM-Intensitäten aller Proben für die Lipidquantifizierung an die Kurve angepasst werden.
Als nächstes zeigen wir, wie die Rezeptor-Autophosphorylierung nach Lipidaustausch mittels Western Blot getestet werden kann (Abbildung 2). Im Falle des Insulinrezeptors können die insulinabhängigen Autophosphorylierungsniveaus zwischen unbehandelten Zellen und Zellen verglichen werden, die mit raftbildenden Lipiden (bSM) oder nicht-raftbildenden Lipiden (DOPC) ausgetauscht wurden. Der DOPC-Austausch wirkt sich negativ auf die IR-Phosphorylierung aus, ebenso wie andere Lipide wie 1-Palmitoyl-2-oleoyl-sn-glycerol-3-phosphocholin (POPC)4. Sphingomyeline halten die IR-Phosphorylierung aufrecht oder erhöhen sie moderat, ebenso wie 1,2-Distearoyl-sn-glycero-3-phosphocholin (DSPC)4. Durch die Blottung der Gesamtrezeptorspiegel mit IR-β-Antikörpern können die Phosphorylierungsniveaus des pYpY-IR-Antikörpers auf die Gesamtrezeptorspiegel normalisiert werden. Die ImageJ-Intensitätswerte für pYpY IR dividiert durch IR-β ergeben normierte Werte (Tabelle 2). Dies erklärt etwaige Unterschiede im Expressionsniveau oder anderweitig ungleiche Beladungsproteinmengen, wie in der ersten Spur zu sehen ist.
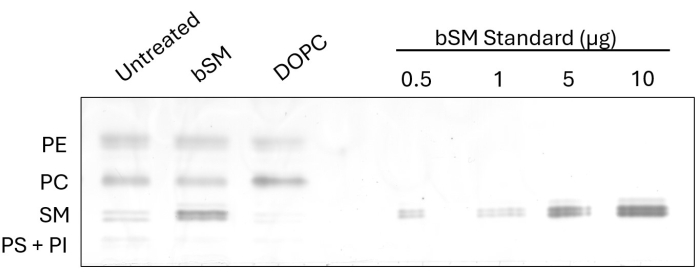
Abbildung 1: HP-TLC von bSM und DOPC-Austausch in CHO IR-Zellen. CHO-IR-Zellen wurden ausgehungert und mit Lipidaustauschmedien (bSM oder DOPC) oder serumfreien Medien als Kontrolle inkubiert. Gleiche Volumina an Lipidextrakten wurden zusammen mit zunehmenden Mengen an bSM auf eine HP-TLC-Platte geladen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Western-Blot-Bild der IR-Autophosphorylierung nach bSM- und DOPC-Austausch. Die Kontrollplatten wurden mit (Positivkontrolle) oder ohne (Negativkontrolle) 100 nM Insulin inkubiert. Lipidaustauschplatten (bSM oder DOPC) wurden nach dem Austausch mit 100 nM Insulin inkubiert. Gleiche Mengen des Gesamtproteins wurden auf SDS-PAGE laufen lassen und für pYpY IR und IR-β gelottet. Der IR-β-Blot dient als Ladekontrolle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Lipid | Vorbereitungstemperatur für Austauschmedien (°C) | Austauschkonzentration (mM) | Sättigungscharakter |
| DOPC | 37 | 4 | Ungesättigt |
| POPC | 37 | 4 | Ungesättigt |
| DLPC | 37 | 4 | Gesättigt |
| DMPC | 37 | 2 | Gesättigt |
| DPPC | 55 | 1 | Gesättigt |
| DSPC | 55 | 0.5 | Gesättigt |
| Bsm | 37 | 1 | Gesättigt# |
| Esm | 37 | 1 | Gesättigt |
| #bSM ist eine Mischung aus Sphingomyelin-Spezies. Die meisten dieser Spezies haben einen gesättigten Charakter, mit Ausnahme von 24:1 Sphingomyelin. Es ist nicht bekannt, wie gut 24:1-Sphingomyelin im Vergleich zu den gesättigten Spezies auf MαCD geladen werden kann. | |||
Tabelle 1: In Austauschmedien verwendete Lipide.
| pYpY | IR-β | pYpY/IR-β | pYpY/IR-β (normiert) | |
| Negativkontrolle | 142.6 | 1229 | 0.12 | 0.09 |
| Positive Kontrolle | 5844 | 4446 | 1.31 | 1.00 |
| Bsm | 5886 | 5173 | 1.14 | 0.87 |
| DOPC | 2031 | 2740 | 0.74 | 0.56 |
Tabelle 2: Intensitätswerte des IR-Autophosphorylierungs-Western-Blots.
Diskussion
Seit der Konzeptualisierung der Existenz von Lipid Rafts in der Zellmembran gab es zahlreiche Versuche, sie in Zellen sichtbar zu machen und die Assoziation von Lipiden und Rezeptoren zu untersuchen. Experimente mit der Mikroskopie11 in Zellen verwendeten fluoreszenzmarkierte Biomarker, in der Regel Proteine und Lipide, von denen bekannt ist, dass sie mit Rafts assoziiert sind, um die Lokalisierung geordneter Lipiddomänen in der Zellevisuell zu untersuchen 12. Die Zellmembran ist jedoch voller Falten13,14, Caveolae-Einstülpungen 1,13 und Proteinclustering2, die die Visualisierung der Dynamik von Raft-Biomarkern behindern. Ein alternativer Ansatz wurde verwendet, um Rafts in Modellmembranen zu untersuchen, indem Vesikel unter Verwendung der entsprechenden Lipidehergestellt wurden 15. Obwohl diese Vesikel einfach zu synthetisieren und zu verarbeiten sind, sind sie keine genaue Darstellung der Zellmembran in Bezug auf die biophysikalischen Eigenschaften und die chemische Zusammensetzung der zellulären Doppelschicht. Ein natürliches Membransystem sind die Riesenplasmamembranvesikel (GPMVs). GPMVs sind Plasmamembranvesikel mit einer chemisch genauen Zusammensetzung der Zellmembranen. Diese werden hergestellt, indem Zellen mit Reagenzien inkubiert werden, die Vesikel bilden, indem sie die Zellmembran lebender Zellen abknospen16. Es ist jedoch bekannt, dass herkömmliche Lösungen zur Bildung von GPMV Lipide und Proteine während des Vesikulationsprozesses chemisch modifizieren und/oder vernetzen und Rezeptoren in den Vesikeln konstitutiv aktivieren. Das in unserem Labor entwickelte Protokoll beeinflusst die Fähigkeit der Membran, Lipidflöße zu bilden, indem es exogene Lipide mit unterschiedlicher Neigung zur Unterstützung oder Zerstörung der geordneten Regionen der Zellmembran in intakten Zellen austauscht, ohne Proteine chemisch zu modifizieren 4,8.
Auf Lipidaustauschexperimente können unmittelbar Assays folgen, die die Eigenschaften der Plasmamembran messen. HP-TLC bestätigt den Austausch, dass ein Austausch stattgefunden hat und nach einem Experiment aufrechterhalten wurde, was die Zuverlässigkeit der Ergebnisse aller biochemischen Experimente, die nach Austausch-Assays durchgeführt wurden, erhöht. Durch die Visualisierung der Sphingomyelin- und Phospholipid-Zusammensetzung der Zelle vor und nach dem Austausch kann man auch die Effizienz des Austauschs unter einer neuen Reihe von Bedingungen, wie z. B. neuen Zelllinien oder Cyclodextrinen, bestimmen. Die Schritte, die zum Austauschsegment des Protokolls führen, spielen eine wichtige Rolle bei der Sicherstellung der Präzision von Replikaten und des effizienten Lipidaustauschs in den Zellen. Das Kalibrieren, Pipettieren und Trocknen der Lipide sollte aufgrund der geringen Mengen an organischem Lösungsmittel und der heiklen Konzentrationsanforderungen für eine ordnungsgemäße MαCD-Beladung als kritische Schritte angesehen werden. Die richtige Lagerung und Kalibrierung von Lipid-Stammlösungen sind wichtige vorbereitende Schritte im Protokoll. Stammlösungen werden in der Regel in Chloroform hergestellt und können mit der Zeit verdampfen, selbst wenn sie bei -20 °C gelagert werden, was zu allmählichen Konzentrationsänderungen führt. Das Trocknen des angegebenen Volumens an Lipiden, um die gewünschte Konzentration zu erreichen, ist unerlässlich, um sicherzustellen, dass die richtige Menge an Lipid für den Austauschprozess auf das Cyclodextrin geladen wird. Um einen Fehler beim Pipettieren zu vermeiden, wird empfohlen, die Konzentration der Stammlösungen monatlich zu kalibrieren.
Nach der Kalibrierung der Stammlösungen wird das benötigte Lipidvolumen in saubere Borosilikatröhrchen pipettiert, z. B. mit einer Drummond-Pipette mit positiver Verdrängung, die Glasbohrungen verwendet. Hohe Lipidbestandskonzentrationen können das Pipettieren extrem kleiner Volumina erforderlich machen, was zu unvermeidlichen Fehlern und Schwankungen bei den endgültigen Austauschbedingungen führt. Um dies zu verhindern, ist es ratsam, ein Volumen zu pipettieren, das einer Zwischenkonzentration zwischen der des Stammes und der endgültigen Austauschlösung entspricht. Dieser Ansatz gewährleistet eine optimale Pipettiergenauigkeit, um die mehrlamellären Vesikel (MLVs) in der Arbeitsaustauschlösung zu bilden. Lipide werden typischerweise auf einem Heizblock unter einem stetigen Strom von Stickstoffgas getrocknet, der 10-20 Minuten lang bei etwa 10 psi gehalten wird. Ein zu hoher Gasdruck oder die Platzierung der Gasdüse in der Nähe des Rohrbodens können dazu führen, dass die Trocknungsflüssigkeit gegen die Wände spritzt, was zu einem Verlust des Lipidvolumens führt und möglicherweise die Konzentration der MLVs verändert. Um Kreuzkontaminationen zu vermeiden, werden alle Komponenten der Trocknungsanlage sowohl vor als auch nach dem Trocknungsprozess mit 100 % Ethanol gewaschen. Um eine vollständige Trocknung zu gewährleisten, wird das Rohr 1 h lang unter ein Hochvakuum gestellt und dann mit einer transparenten Folie versiegelt, um die Reinheit des getrockneten Lipids zu erhalten.
Die Einschränkungen des Experiments können auf die Rolle von Flippasen und Scramblasen bei der Aufrechterhaltung der Membranasymmetrie zurückgeführt werden. Die Enzyme, die für die Bewegung der Lipide zwischen den inneren und äußeren Segeln der Doppelschicht verantwortlich sind, bewahren die asymmetrische Natur der Zellmembran17. Im Verlauf des Experiments ist nicht bekannt, mit welcher Geschwindigkeit Flippasen und Scramblasen die exogen hinzugefügten Lipide zwischen den Segeln umverteilen. Dies könnte die Natur der Zellmembran bestimmen und ist ein externer Faktor, der bisher nicht unberücksichtigt geblieben ist.
Darüber hinaus könnte diese Flip-Flop-Aktion unter bestimmten Bedingungen Lipide freilegen, die vorzeitig in der inneren Membran von Zellen vorhanden sind, wie Phosphatidylserin (PS), ein Lipid, das von Natur aus für die Signalisierung der zellulären Apoptose verantwortlich ist18. In unseren Experimenten werden Sphingomyein (SM) und Phosatidylcholin (PC) Lipidaustausche eingesetzt. Diese Lipide sind im äußeren Segel der Plasmamembran vorhanden und benötigen lange Zeiträume, um sich in Richtung des zytosolischen Segels zu verwandeln, so dass der Assay hauptsächlich auf das äußere Segelausgerichtet ist 9,19,20. Ein weiteres Problem ist, dass nicht jedes exogene Lipid, das den Zellen zugesetzt wird, die Integrität und Struktur der Zellmembran vollständig unterstützenkann 9,19. Die Verwendung solcher Lipide schädigt versehentlich die Zellmembran nach dem Austausch, wodurch die im Austauschprotokoll verwendeten Lipide eingeschränkt werden. Bei der Durchführung der Zellviabilität können Assays dabei helfen, das Ausmaß der Schädigung der Zellen nach der Inkubation mit dem Austauschmedium zu messen4. Die durchflusszytometrische Analyse von trypsinisierten und mit Propidiumiodid behandelten Zellen ist eine Methode zur Analyse der Lebensfähigkeit der lipidausgetauschten Zellen. Eine Schädigung der Membran kann auch zu einer Rezeptorinternalisierung führen. Große Mengen an Insulinrezeptor-Internalisierung verändern die Daten zur Autophosphorylierung von Rezeptoren. Die Durchflusszytometrie, die an Phycoerythrin-markierten Antikörpern durchgeführt wurde, die an die Ektodomänen des Insulinrezeptors in Zellen gebunden waren, die mit Austauschmedien behandelt wurden, kann Veränderungen in der Oberflächenrezeptorexpression erklären 4,20.
In diesem Manuskript berichteten wir über Konzentrationen einer Vielzahl von Lipiden, die auf spezifische Konzentrationen von MαCD geladen wurden, um einen effizienten Lipidaustausch in CHO-IR-Zellen zu ermöglichen. Um Austauschexperimente in anderen Zelllinien durchzuführen, besteht der erste Schritt darin, effektive Lipidkonzentrationen in den Austauschmedien zu bestimmen, die von den Zellen toleriert werden, ohne die Membranintegrität zu beeinträchtigen oder die Lebensfähigkeit der Zellen zu beeinträchtigen 8,9,21. Neben unbehandelten Zellen sollte ein breites Spektrum von Zöliakie zu exogenen Lipiden getestet werden. Auf diese Weise wird ein optimales Verhältnis von Zöliakie zu Lipid identifiziert, wenn es keine sichtbare Aufrundung der Zellen oder eine Ablösung von der Platte gibt (bei adhärenten Zellen) und die Morphologie der behandelten Zellen ähnlich ist wie bei unbehandelten. Biochemisch gesehen sollten Zellen, die mit CD:-Lipidmedien behandelt wurden, nach dem Lipidaustausch mittels Trypanblau-Behandlung und Propidiumiodid-Leckage oder Annexin-V-Bindung an die PS-Exposition der Testoberfläche auf Störungen in der Membran überprüft werden21. Die optimalen Temperaturbedingungen und die Länge der Austauschperioden variieren für verschiedene Lipidvesikel und sollten für neue Zelllinien bestimmt werden. Unser Lipidaustauschexperiment wurde ausschließlich in lebenden Zellmembranen durchgeführt. Unseres Wissens gibt es keine Daten, die einen erfolgreichen Lipidaustausch im zellulären Lysat belegen. Diese Lipidaustauschtechnik kann erweitert werden, um die Membran von Organellen innerhalb der Zelle zu verändern, wenn sie aus dem zellulären Lysat isoliert werden können.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Die Finanzierung erfolgte durch den NIH-Zuschuss GM 122493. CHO-IR-Zellen waren ein freundliches Geschenk von Dr. Jonathan Whittaker (Case Western Reserve University).
Materialien
| Name | Company | Catalog Number | Comments |
| 1,2-dilauroyl-sn-glycero-3-phosphocholine (DLPC) | Avanti Polar Lipids | 850335 | |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) | Avanti Polar Lipids | 850345 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375 | |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Avanti Polar Lipids | 850355 | |
| 1,2-distearoyl-sn-glycero-3-phosphocholine (DSPC) | Avanti Polar Lipids | 850365 | |
| 1-palmitoyl-2-oleoyl-sn-glycerol-3-phosphocholine (POPC) | Avanti Polar Lipids | 850457 | |
| Anti-insulin receptor β antibody | Cell Signaling Technology | CST3025 | |
| Anti-pYpY1162/1163 Insulin receptor antibody | R&D Systems Inc. | AF2507 | |
| Anti-rabbit IgG, HRP-linked Antibody | Cell Signaling Technology | 7074 | |
| Borosilicate glass test tubes (12 x 75 mm) | Thermo Fisher Scientific | 14-961-26 | |
| Brain sphingomyelin (bSM) | Avanti Polar Lipids | 860062 | |
| Egg sphingomyelin (eSM) | Avanti Polar Lipids | 860061 | |
| Fetal bovine serum (FBS) | Corning | 35-016-CV | |
| G418 disulfate salt | Sigma Aldrich | A1720 | |
| Gibco Antibiotic-antimycotic solution (100x) | Thermo Fisher Scientific | 15240062 | |
| Gibco Dulbecco’s modified eagle medium (DMEM, 4.5 g/L glucose, L-glutamine, sodium pyruvate) | Thermo Fisher Scientific | 11965092 | |
| Gibco ham’s F12 media | Thermo Fisher Scientific | 11765054 | |
| Gibco L-glutamine | Thermo Fisher Scientific | 25030032 | |
| Gibco MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140050 | |
| Gibco phosphate buffered saline (PBS) without calcium and magnesium (0.144 g/L KH2PO4, 9 g/L NaCl, 0.795 g/L Na2- HPO4 (anhydrous)) | Thermo Fisher Scientific | 10010023 | |
| Gibco Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300054 | |
| High performance thin layer chromatography (HP-TLC) | Merck | HP-TLC Silica Gel 60 plates | |
| Immobilon-P PVDF Membrane | Millipore | IPVH00010 | |
| Methotrexate | Sigma Aldrich | 454126 | |
| Methyl-α-cyclodextrin (MαCD) | AraChem | CDexA076/BR | |
| Pierce ECL Western Blotting Substrate | Thermo Fisher Scientific | 32106 | |
| Sodium orthovanadate, Activated | Sigma Aldrich | 5.08605 |
Referenzen
- Brown, D. A., London, E. Functions of lipid rafts in biological membranes. Annu Rev Cell Dev Biol. 14, 111-136 (1998).
- Brown, D. A. Lipid rafts, detergent-resistant membranes, and raft targeting signals. Physiology. 21, 430-439 (2006).
- Schroeder, R., London, E., Brown, D. Interactions between saturated acyl chains confer detergent resistance on lipids and glycosylphosphatidylinositol (GPI)-anchored proteins: GPI-anchored proteins in liposomes and cells show similar behavior. Proc Natl Acad Sci U S A. 91 (25), 12130-12134 (1994).
- Suresh, P., Miller, W. T., London, E. Phospholipid exchange shows insulin receptor activity is supported by both the propensity to form wide bilayers and ordered raft domains. J Biol Chem. 297 (3), 101010 (2021).
- Delle Bovi, R. J., Kim, J., Suresh, P., London, E., Miller, W. T. Sterol structure dependence of insulin receptor and insulin-like growth factor 1 receptor activation. Biochim Biophys Acta Biomembr. 1861 (4), 819-826 (2019).
- Zidovetzki, R., Levitan, I. Use of cyclodextrins to manipulate plasma membrane cholesterol content: evidence, misconceptions and control strategies. Biochim Biophys Acta. 1768 (6), 1311-1324 (2007).
- Ohtani, Y., Irie, T., Uekama, K., Fukunaga, K., Pitha, J. Differential effects of α-, β- and γ-cyclodextrins on human erythrocytes. Eur J Biochem. 186 (1-2), 17-22 (1989).
- Suresh, P., London, E. Using cyclodextrin-induced lipid substitution to study membrane lipid and ordered membrane domain (raft) function in cells. Biochim Biophys Acta Biomembr. 1864 (1), 183774 (2022).
- Li, G., et al. Efficient replacement of plasma membrane outer leaflet phospholipids and sphingolipids in cells with exogenous lipids. Proc Natl Acad Sci U S A. 113 (49), 14025-14030 (2016).
- Yoshimasa, Y., Paul, J. I., Whittaker, J., Steiner, D. F. Effects of amino acid replacements within the tetrabasic cleavage site on the processing of the human insulin receptor precursor expressed in Chinese hamster ovary cells. J Biol Chem. 265 (28), 17230-17237 (1990).
- Gaus, K., et al. Visualizing lipid structure and raft domains in living cells with two-photon microscopy. Proc Natl Acad Sci U S A. 100 (26), 15554-15559 (2003).
- Klymchenko, S., Kreder, R. Fluorescent probes for lipid rafts: From model membranes to living cells. Chem Biol. 21 (1), 97-113 (2014).
- Pike, L. J. Growth factor receptors, lipid rafts and caveolae: An evolving story. Biochim Biophys ActaMol Cell Res. 1746 (3), 260-273 (2005).
- Brown, D. A., London, E. Structure of detergent-resistant membrane domains: does phase separation occur in biological membranes. Biochem Biophys Res Commun. 240 (1), 1-7 (1997).
- Lin, Q., London, E. Preparation of artificial plasma membrane mimicking vesicles with lipid asymmetry. PLoS One. 9 (1), e87903 (2014).
- Sezgin, E., et al. Elucidating membrane structure and protein behavior using giant plasma membrane vesicles. Nat Protoc. 7 (6), 1042-1051 (2012).
- Deveaux, P. F., Hermann, A., Ohlwein, N., Kozlov, M. M. How lipid flippases can modulate membrane structure. Biochimica et Biophysica Acta Biomembr. 1778 (7), 1591-1600 (2008).
- Balasubramaniam, K., Mirnikjoo, B., Schroit, A. J. Regulated externalization of phosphatidylserine at the cell surface: implications for apoptosis. J Biol Chem. 282 (25), 18357-18364 (2007).
- Li, G., et al. Replacing plasma membrane outer leaflet lipids with exogenous lipid without damaging membrane integrity. PLoS One. 14 (10), e0223572 (2019).
- Contreras, F. X., Sanchez-Magraner, L., Alonso, A., Goni, F. M. Transbilayer (flip-flop) lipid motion and lipid scrambling in membranes. FEBS Letters. 584 (9), 1779-1786 (2010).
- Suresh, P., London, E. MαCD-based plasma membrane outer leaflet lipid exchange in mammalian cells to study insulin receptor activity. Biophys Approach Study Memb Struct A Exp. 700, 485-507 (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten