Method Article
فحص تبادل الدهون في الخلايا الحية
In This Article
Summary
نصف طريقة لاستخدام السيكلودكسترين للتوسط في التبادل بين دهون غشاء البلازما مع الدهون الخارجية. يمكن إقران هذه التقنية بتجارب تدرس بروتينات الغشاء ، والتي تتصرف بشكل مختلف في البيئات الشبيهة بالطوافة الدهنية عما تتصرف في البيئات غير الشبيهة بالطوافة.
Abstract
الطوافات الدهنية هي مجالات ديناميكية ومرتبة في غشاء البلازما غالبا ما تتشكل أثناء تجميع البروتين الغشائي والإشارات. تدفع الهوية الدهنية للنشرة الخارجية ميل الغشاء إلى تكوين طوافات دهنية. تجعل الطبيعة العابرة للطوافات الدهنية من الصعب الدراسة في الخلايا الحية. لذلك ، فإن الطرق التي تضيف أو تزيل الدهون المكونة للطوافة في النشرة الخارجية للخلايا الحية تسهل دراسة خصائص الطوافات ، مثل تأثيراتها على بروتينات الغشاء. تستخدم تجارب تبادل الدهون التي تم تطويرها في مختبرنا السيكلودكسترين المحملة بالدهون لإزالة وإضافة الدهون الفوسفورية الخارجية لتغيير تكوين الدهون في غشاء البلازما. يمكن أن يساعد استبدال الغشاء بطوف أو دهون غير مكونة للطوافة في دراسة التأثيرات على نشاط البروتين عبر الغشاء. هنا ، نصف طريقة لتبادل الدهون على النشرة الخارجية لغشاء البلازما باستخدام السيكلودكسترين المحمل بالدهون. نوضح تحضير وسائط التبادل والعلاج اللاحق لخلايا الثدييات المرفقة. نعرض أيضا كيفية قياس كفاءة التبادل باستخدام HP-TLC. ينتج عن هذا البروتوكول استبدالا شبه كامل للنشرة الخارجية بدهون خارجية دون تغيير الجدوى الخلوية ، مما يسمح بمزيد من التجارب على أغشية البلازما السليمة المعدلة.
Introduction
يتكون غشاء البلازما من طبقة ثنائية دهنية غنية ببروتينات غشائية مختلفة ، بما في ذلك مستقبلات الغشاء والقنوات الأيونية. تم توضيح مجالات الدهون داخل الغشاء من خلال المناطق القابلة للذوبان في المنظفات وغير القابلة للذوبان التي تم تحديدها في تجارب تجزئة الغشاء المقاوم للمنظفات (DRM)1. تميزت الأجزاء غير القابلة للذوبان بأنها غنية بالكوليسترول ، وأسفل الفنجوميلين المعبأ بإحكام والفوسفوليبيدات المشبعة ، مما يظهر نقاط انصهار أعلى ، على عكس الكسور القابلة للذوبان التي تتكون في الغالب من درجة حرارة انصهار منخفضة وفوسفوليبيدات غير مشبعة معبأة بشكل فضفاض. يشار إلى المناطق المعبأة بإحكام باسم مجالات الدهون السائلة (Lo) ، أو الطوافات الدهنية ، في حين أن مجالات الدهون الأكثر تنظيما بالسائل (Ld) هي المناطق غير الطوفية في غشاء البلازما2،3. من المعروف أن مناطق الطوافة الدهنية تسهل عمليات الإشارات ، مع وجود أدلة تشير إلى أن مستقبلات الأنسولين النشطة ترتبط بهذه الطوافات4،5. ومع ذلك ، نظرا للطبيعة الديناميكية لغشاء الخلية وصغر حجم المجالات بشكل عام ، فإن التصور المباشر لوجود الطوافات في الخلايا الحية يمثل تحديات كبيرة. في هذا السياق ، نقدم طريقة للتحقيق في تأثير الطوافات الدهنية على مستقبلات الأنسولين من خلال تقنيات تبادل الدهون.
تتكون السيكلوديكسترين (CDs) من مونومرات الجلوكوز المرتبطة التي تخلق بنية تشبه الحلقة مع تجويف مركزي. يتم تحديد حجم هذا التجويف من خلال عدد وحدات الجلوكوز: ست وحدات تشكل ألفا سيكلودكسترين (α-CD) ، بينما تخلق سبع وحدات بيتا سيكلودكسترين (β-CDs). الأقراص المضغوطة هي جزيئات عالية الذوبان في الماء قادرة على تغليف الدهون داخل تجويفها ، وبالتالي تسهيل نقلها إلى غشاء الخلية6. تم استخدام بيتا سيكلودكسترين على نطاق واسع لإضافة وإزالة الدهون من الأغشية7. ومع ذلك ، فإن تجويفه الأكبر يفتقر إلى خصوصية الكوليسترول أو الدهونالفوسفورية 8. في المقابل ، تظهر ألفا سيكلودكسترين ، بتجويفها الأصغر ، انتقائية أكبر في ربط جزيئات الدهون على الستيرولات. على وجه التحديد ، لا يتفاعل ميثيل α-سيكلودكسترين (الميثيل α-CDs) مع الستيرولات وقد تم استخدامه بشكل فعال لتبادل الدهون الفوسفورية والسفينجوميلين دون تغيير تكوين الكوليسترول في غشاء الخلية8،9.
في هذه المخطوطة ، نقدم بروتوكولا مفصلا لاستخدام الميثيل α-CDs (MαCD) لتبادل الدهون في النشرة الخارجية لغشاء الخلية مع الدهون الخارجية التي لها خصائص إما تعزز أو تعطل تكوين طوف الدهون. يستخدم هذا التبادل للتحقيق في تأثير الطوافات الدهنية على نشاط مستقبلات الأنسولين. سيركز العرض التوضيحي على إدخال الفوسفوليبيد والسفينجوميلين الذي يؤثر على تكوين مجالات سائلة (Lo) في غشاء البلازما لخطوط خلايا مبيض الهامستر الصيني (CHO) التي تفرط في التعبير بثبات عن مستقبلات الأنسولين (IR)10. سيتم تقييم مدى تبادل الدهون في خلايا CHO IR من خلال كروماتوغرافيا الطبقة الرقيقة عالية الأداء (HP-TLC) ، بينما سيتم قياس التغيرات في نشاط مستقبلات الأنسولين عن طريق تحليل اللطخة الغربية بعد تحفيز الأنسولين بعد تبادل الدهون.
Protocol
1. تحضير محلول الميثيل α-CD
- أضف 20 مل من محلول ملحي مخزن بالفوسفات (PBS) إلى ~ 10 جم من مسحوق MαCD في زجاجة زجاجية. احتضن في حمام ماء دافئ (45 درجة مئوية) حتى يذوب مع التحريك من حين لآخر حتى يذوب جيدا.
ملاحظة: قد يظل المحلول غائما بسبب أنواع الأقراص المضغوطة غير القابلة للذوبان. - مرر المحلول من خلال مرشح حقنة 0.22 ميكرومتر. سوف يصبح الحل واضحا.
- استخدم مقياس الانكسار لتحديد التركيز الدقيق ل MαCD.
- ضع 10 ميكرولتر من العينة على منطقة عينة مقياس الانكسار ، وقم بإضاءةها باستخدام لمبة متوهجة بيضاء ، وسجل معامل انكسار المحلول.
- احسب تركيز MαCD باستخدام المعادلة
RI = (1.49 × 10 × درجة مئوية) + 1.33
حيث RI = معامل الانكسار ، C = تركيز MαCD (مللي مولار). تم الحصول على المعادلة من خلال التحليل الوزني ، أو قياس معامل الانكسار لوزن معروف من MαCD المذاب في حجم معروف.
- أغلق الزجاجة بغطاء ولف الغطاء بغشاء شفاف لمنع التبخر. يحفظ في درجة حرارة 4 درجات مئوية.
2. تحضير الحويصلات متعددة الصفائح (MLVs)
- الحفاظ على محاليل مخزون الدهون الخارجية المرغوبة الذائبة في الكلوروفورم بتركيزات من 20 ملي مولار إلى 50 ملي مولار وتخزينها عند -20 درجة مئوية أو أقل لتقليل تبخر المذيبات.
ملاحظة: يمكن إذابة جميع الدهون الواردة في الجدول 1 بالكامل في مخزونات الكلوروفورم. ومع ذلك ، من الممكن أن تتطلب الدهون البديلة 1: 1 كلوروفورم: الميثانول ليذوب تماما. - قم بتخزين مخزون الدهون في أنابيب البورسليكات باستخدام ماصة ذات إزاحة موجبة بطرف زجاجي. بدلا من ذلك ، يمكن استخدام حقنة زجاجية.
- كمية الدهون الجافة على كتلة تسخين عند إعداد منخفض يبلغ حوالي 50 درجة مئوية تحت تيار من غاز N2 حتى يتبخر كل الكلوروفورم الظاهر.
- قم بإزالة المذيب المتبقي من الدهون المجففة عن طريق وضع الأنبوب في غرفة مفرغة وتعريضه لفراغ عال (أقل من 200 mTorr) لمدة 1 ساعة.
- أضف وسائط Ham F-12 الخالية من المصل لتجفيف طبقة الدهون للوصول إلى التركيز النهائي البالغ 20 ملم. غطيها بغطاء أو شريط تفلون وسخنيها في حمام مائي 70 درجة مئوية لمدة 5 دقائق.
- دوامة لتعليق الدهون وتشكيل MLVs. يجب أن تظهر الوسائط الآن غائمة.
ملاحظة: قد لا يتم تعليق بعض الدهون المشبعة بالكامل عن طريق الدوامة وحدها وقد تحتاج إلى تعليقها عن طريق سحب العينات لأعلى ولأسفل حتى يصبح الفيلم غير مرئي.- انقل الحجم بالكامل إلى أنبوب الطرد المركزي الدقيق. يمكن تخزين MLVs لمدة تصل إلى 3 أيام عند 4 درجات مئوية.
3. تحضير وسائط تبادل الدهون
- أضف مخزون MαCD إلى التركيز النهائي البالغ 40 ملي مولار ، جنبا إلى جنب مع MLVs المحضرة إلى تركيز الدهون النهائي الموجود في الجدول 1.
ملاحظة: في حالة استخدام MLVs المخزنة عند 4 درجات مئوية ، تسويتها في قاع الأنبوب. قم بالإحماء إلى درجة حرارة الغرفة وتأكد من تعليقها عن طريق النقر أو تحريك الأنبوب.- قم بتحميل الدهون على MαCD عن طريق الحضانة لمدة 30 دقيقة في حمام مائي 37 درجة مئوية أو 55 درجة مئوية وفقا للجدول 1. يجب أن تكون درجة الحرارة المختارة أعلى من نقطة انصهار طور الهلام إلى السائل للدهون المختارة. يجب أن تنتقل وسائل الإعلام من غائم إلى صافية.
- دع وسائط تبادل الدهون تبرد إلى درجة حرارة الغرفة لمدة 30-60 دقيقة.
4. علاج تبادل الدهون للخلايا
- تنمو خلايا CHO IR عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 في وسط النسر المعدل من Dulbecco (DMEM ، 4.5 جم / لتر جلوكوز) مكملا بنسبة 10٪ مصل بقري للجنين (FBS) ، 300 ميكروغرام / مل L-glutamine ، 100 ميكروغرام / مل من الأحماض الأمينية غير الأساسية ، 50 ميكروغرام / مل G418 ، 2 ميكرومتر ميثوتريكسات ، و 1x مضاد حيوي مضاد للفطريات.
- البذور 1.5 × 106 خلايا في ألواح 60 مم وتنمو حتى تصبح 80٪ -90٪ ملتقية.
- اغسل الخلايا 3 مرات عن طريق إضافة 1 مل من PBS ثم الشفط. تجويع الخلايا طوال الليل في 2 مل من وسائط هام F12 الخالية من المصل.
- اغسل الخلايا 3x مع 1 مل من PBS. أضف 1 مل من وسائط التبادل المحضرة أو الوسائط الخالية من المصل كعنصر تحكم للخلايا واحتضانها لمدة ساعة واحدة في درجة حرارة الغرفة (25 درجة مئوية -27 درجة مئوية). قم بتدوير الخلايا كل 15 دقيقة لضمان التعرض المتساوي لوسائط التبادل.
- اغسل الخلايا 3x مع 1 مل من PBS. يمكن معالجة كل لوحة لاحقا لاستخراج الدهون في الخطوة 5 ، أو للفسفرة الذاتية بالأشعة تحت الحمراء في الخطوة 7.
5. استخراج الدهون على لوحة زراعة الخلايا
- قم بإزالة PBS تماما واضبط اللوحة بزاوية 45 درجة لمدة 10 دقائق أو حتى تجف تماما ، مع إزالة أي مخزن مؤقت قد يتجمع على طول الجزء السفلي.
- أضف 1 مل من الهكسان 3: 2 (v: v): محلول الأيزوبروبانول إلى الخلايا المجففة واحتضنه لمدة 10 دقائق على شاكر في درجة حرارة الغرفة.
- انقل المحلول إلى أنبوب البورسيليكات. يغطى بشريط تفلون ويخزن في درجة حرارة -20 درجة مئوية.
- قم بإذابة بقايا الخلية المتبقية عن طريق إضافة 500 ميكرولتر من 1N هيدروكسيد الصوديوم والرج لمدة 10 دقائق في درجة حرارة الغرفة.
- استخدم هذا المحلول في مقايسة القياس الكمي للبروتين مثل اختبار برادفورد لتحديد تركيز البروتين لكل عينة. يمكن استخدام قيم التركيز هذه لتطبيع أحجام تحميل مستخلصات الدهون على ألواح HP-TLC لتحميل الدهون المتساوي عبر جميع العينات.
6. التحقق من كفاءة التبادل باستخدام HP-TLC
- اصنع 100 مل من 65: 25: 5 (v: v: v) كلوروفورم: ميثانول: 30٪ (v / v) هيدروكسيد الأمونيوم واسكبه في خزان TLC زجاجي. قم بتغطيته بإحكام واترك البخار يتوازن لمدة 1 ساعة على الأقل.
- عينة مستخلص الدهون الجافة على كتلة تسخين عند إعداد منخفض تحت تيار من غاز N2 حتى يتبخر كل المذيبات العضوية الظاهرة.
- قم بإذابة الطبقة الدهنية في 50 ميكرولتر من 1: 1 (v: v) كلوروفورم: الميثانول.
- استخدم حقنة هاميلتون سعة 10 ميكرولتر لتحميل 1-10 ميكرولتر من العينة في نطاقات 1 سم على لوحة HP-TLC من السيليكا. قم بتحميل 10 أشرطة كحد أقصى على لوحة مقاس 20 سم. استخدم القيم العادية لتحديد الأحجام اللازمة لتحميل كميات متساوية من الدهون عبر جميع العينات.
ملاحظة: قبل تحميل كل عينة ، يجب تنشيط اللوحة عن طريق وضعها على لوح تسخين عند إعداد متوسط إلى مرتفع. - ضع اللوحة في وضع مستقيم في خزان TLC واترك مقدمة المذيب تنتقل 8 سم لضمان فصل أنواع الفوسفوليبيد.
- دع الطبق يجف لمدة 10 دقائق. رش بمحلول مائي بنسبة 3٪ (وزن / حجم) أسيتات النحاسية و 8٪ (حجم / حجم) حمض الفوسفوريك.
- اترك الطبق يجف لمدة 30 دقيقة في درجة حرارة الغرفة أو بمسدس حراري. يجب أن تتحول اللوحة من اللون الأزرق الشفاف إلى الأبيض غير الشفاف.
- طبق الفحم في فرن 180 درجة مئوية -200 درجة مئوية لمدة 5-10 دقائق أو حتى تصبح عصابات الدهون السوداء قابلة للاكتشاف.
7. فحص تنشيط المستقبلات باستخدام فحص الفسفرة الذاتية واللطخة الغربية
- احتضان الخلايا ب 500 ميكرولتر من الأنسولين 100 نانومتر في وسائط خالية من المصل في درجة حرارة الغرفة لمدة 5 دقائق.
- اغسل الخلايا باستخدام PBS المثلج وضع الخلايا على الجليد لوقف التحفيز. أضف على الفور 1 مل من PBS المثلج إلى الخلايا والحصاد باستخدام مكشطة الخلايا. خلايا الحبيبات عند 3000 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- أضف 100-200 ميكرولتر من المخزن المؤقت الكامل لتحلل RIPA (50 ملي مولار Tris pH 8 ، 200 ملي كلوريد الصوديوم ، 1 ملي مولار EDTA ، 1٪ (حجم / حجم) Triton X-100 ، 1٪ (وزن / حجم) منقوص أوكسي كولات الصوديوم ، 1 ملي مولار أورثوفانادات الصوديوم المنشط ، 10 ميكروغرام / مل أبروتينين ، 10 ميكروغرام / مل ليوببتين) إلى حبيبات الخلية على الجليد. الماصة لأعلى ولأسفل 30x-40x للتحلل.
- احتضان المحللة على الثلج لمدة 10 دقائق. قم بمسح حطام الخلية عن طريق الدوران عند 16,000 × جم لمدة 10 دقائق عند 4 درجات مئوية وجمع المادة الطافية. احتفظ بحوالي 20 ميكرولتر من المحللة لتحديد تركيز البروتين باستخدام مقايسة برادفورد.
- يمزج المحللة مع 5x Laemmli buffer (350 ملي مولار Tris HCl درجة الحموضة 6.8 ، 30٪ حجم / حجم جلسرين ، 10٪ وزن / حجم SDS ، 25٪ حجم / حجم β-mercaptoethanol ، 0.002 جم من البروموفينول الأزرق) ويغلي عند 95 درجة مئوية لمدة 5 دقائق. يجب أن يكون حجم المخزن المؤقت المضاف كافيا لتحقيق تركيز نهائي يبلغ 1x Laemmli buffer.
- قم بتشغيل المحللات من خلال الرحلان الكهربائي لجل دوديسيل كبريتات الصوديوم - بولي أكريلاميد (SDS-PAGE).
- قم بتحميل كتلة متساوية من البروتين لجميع العينات جنبا إلى جنب مع علامة الوزن الجزيئي على هلام SDS-PAGE. تعمل عند 100 فولت -150 فولت في المخزن المؤقت قيد التشغيل (2.5 ملي مولار تريس درجة الحموضة 8 ، 19.2 ملي مولار جلايسين ، 0.01٪ (وزن / حجم) SDS) حتى يتم حلها جيدا في نطاق 100-250 كيلو دالتون.
- نقل إلى غشاء فلوريد البولي فينيلدين (PVDF) في مخزن مؤقت للنقل (2.5 ملي مولار تريس درجة الحموضة 8 ، 19.2 ملي مولار جلايسين) لمدة ساعة واحدة عند 100 فولت و 4 درجات مئوية.
- قم بحظر غشاء PVDF لمدة 30 دقيقة في درجة حرارة الغرفة في محلول BSA بنسبة 5٪ في TBST (50 ملي مولار Tris pH 8 ، 150 ملي كلوريد الصوديوم ، 0.1٪ (حجم / حجم) Tween 20).
- احتضان الجسم المضاد للأشعة تحت الحمراء pYpY أو الجسم المضاد IR-β بتركيز 1: 1000 في محلول BSA 5٪ في TBST لمدة ساعة واحدة في درجة حرارة الغرفة أو بين عشية وضحاها عند 4 درجات مئوية.
ملاحظة: يتعرف الجسم المضاد pYpY IR على وجه التحديد على التيروزينات الفسفرية 1162 و 1163 ويعمل على الإشارة إلى الفسفرة الذاتية للمستقبل. يتعرف الجسم المضاد IR-β على الوحدة الفرعية بيتا للمستقبل بشكل عشوائي بغض النظر عن حالة الفسفرة ويعمل على الإشارة إلى المستويات العالمية للمستقبل. - اغسل 3 مرات باستخدام TBST في درجة حرارة الغرفة. احتضان بجسم مضاد α Rabbit-HRP بتركيز 1: 3000 في محلول BSA 1٪ في TBST لمدة 30 دقيقة في درجة حرارة الغرفة.
- اغسل 3 مرات باستخدام TBST في درجة حرارة الغرفة. احتضان مع الركيزة الكيميائية المحسنة (ECL) لمدة 1 دقيقة وصور الفيلم.
النتائج
لإثبات التغيير الملحوظ في تكوين الدهون الخلوية بعد التبادل ، أجرينا HP-TLC على خلايا CHO IR بعد تبادل SM الدماغ (bSM) و 1،2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) (الشكل 1). في الحالات التي يتم فيها استخدام sphingomyelins مثل bSM للتبادل ، تظهر زيادة في شدة نطاق SM ، إلى جانب انخفاض في شدة نطاق الكمبيوتر بالنسبة للتحكم غير المعالج. على العكس من ذلك ، عند تبادل الفوسفاتيديل كولين مثل DOPC ، يصبح نطاق الكمبيوتر أكثر كثافة بينما يصبح نطاق SM أقل كثافة. يمكن تحديد كفاءة التبادل عن طريق قياس شدة فئة الدهون المتبادلة باستخدام برنامج ImageJ وأخذ نسبة العينات غير المعالجة والمعالجة. يوضح معيار التحميل ، المصنوع من عدة تخفيفات للدهون المتاحة تجاريا ، خيارا لتقدير كمية فئة الدهون قبل التبادل وبعده. من خلال قياس شدة نطاقات SM القياسية وتوليد منحنى قياسي ، يمكن تركيب شدة SM لجميع العينات على المنحنى لقياس الدهون.
بعد ذلك ، نوضح كيف يمكن فحص الفسفرة الذاتية للمستقبلات بعد تبادل الدهون بواسطة اللطخة الغربية (الشكل 2). في حالة مستقبلات الأنسولين ، يمكن مقارنة مستويات الفسفرة الذاتية المعتمدة على الأنسولين بين الخلايا غير المعالجة والخلايا المتبادلة بالدهون المكونة للطوافة (bSM) أو الدهون غير المكونة للطوافة (DOPC). يؤثر تبادل DOPC سلبا على فسفرة الأشعة تحت الحمراء ، كما هو الحال مع الدهون الأخرى ، مثل 1-palmitoyl-2-oleoyl-sn-glycerol-3-phosphocholine (POPC)4. يحافظ Sphingomyelins على فسفرة الأشعة تحت الحمراء أو يزيدها بشكل معتدل ، كما يفعل 1،2-distearoyl-sn-glycero-3-phosphocholine (DSPC) 4. من خلال نشاف مستويات المستقبلات الكلية بالجسم المضاد IR-β ، يمكن تطبيع مستويات الفسفرة من الجسم المضاد للأشعة تحت الحمراء pYpY إلى مستويات المستقبلات الإجمالية. تنتج قيم شدة ImageJ ل pYpY IR مقسومة على IR-β قيما طبيعية (الجدول 2). هذا يفسر أي اختلافات في مستوى التعبير أو كميات بروتين التحميل غير المتكافئة ، كما يتضح من الممر الأول.
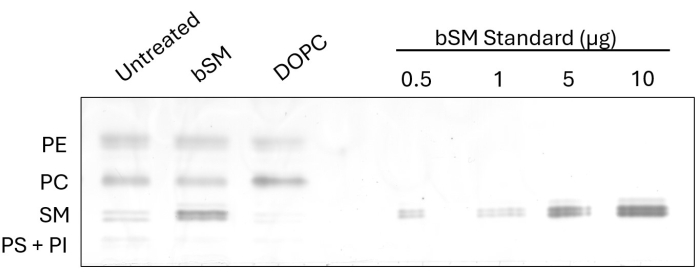
الشكل 1: HP-TLC لتبادل bSM و DOPC في خلايا CHO IR. تم تجويع خلايا CHO IR واحتضانها بوسائط تبادل الدهون (bSM أو DOPC) أو الوسائط الخالية من المصل كعنصر تحكم. تم تحميل كميات متساوية من مستخلصات الدهون على لوحة HP-TLC جنبا إلى جنب مع كميات متزايدة من bSM. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: صورة لطخة غربية للفسفرة الذاتية بالأشعة تحت الحمراء بعد تبادل bSM و DOPC. تم تحضين لوحات التحكم بأنسولين (تحكم إيجابي) أو بدون (تحكم سلبي) 100 نانومتر. تم تحضين ألواح تبادل الدهون (bSM أو DOPC) بالأنسولين 100 نانومتر بعد التبادل. تم تشغيل كميات متساوية من البروتين الكلي على SDS-PAGE وتم مسحها من أجل pYpY IR و IR-β. تعمل لطخة IR-β كعنصر تحكم في التحميل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الدهون | درجة حرارة تحضير وسائط التبادل (درجة مئوية) | تركيز التبادل (مللي مولار) | شخصية التشبع |
| دوبكسل | 37 | 4 | غير المشبعه |
| POPC | 37 | 4 | غير المشبعه |
| DLPC | 37 | 4 | المشبعه |
| DMPC | 37 | 2 | المشبعه |
| DPPC | 55 | 1 | المشبعه |
| DSPC | 55 | 0.5 | المشبعه |
| bSM | 37 | 1 | مشبع # |
| إي إس إم | 37 | 1 | المشبعه |
| # bSM هو مزيج من أنواع sphingomyelin. معظم هذه الأنواع ذات طابع مشبع باستثناء 24: 1 sphingomyelin. من غير المعروف مدى قدرة 24: 1 على Sphingomyelin ليتم تحميله على MαCD بالنسبة للأنواع المشبعة. | |||
الجدول 1: الدهون المستخدمة في وسائط التبادل.
| بي واي | الأشعة تحت الحمراء β | pYpY / IR-β | pYpY/IR-β (تطبيع) | |
| التحكم السلبي | 142.6 | 1229 | 0.12 | 0.09 |
| التحكم الإيجابي | 5844 | 4446 | 1.31 | 1.00 |
| bSM | 5886 | 5173 | 1.14 | 0.87 |
| دوبكسل | 2031 | 2740 | 0.74 | 0.56 |
الجدول 2: قيم شدة اللطخة الغربية للفسفرة الذاتية بالأشعة تحت الحمراء.
Discussion
منذ تصور وجود طوافات دهنية في غشاء الخلية ، كانت هناك محاولات عديدة لتصورها في الخلايا ودراسة ارتباط الدهون والمستقبلات. استخدمت التجارب التي تنطوي على الفحصالمجهري 11 في الخلايا المؤشرات الحيوية ذات العلامات الفلورية ، وعادة البروتينات والدهون المعروفة بارتباطها بالطوافات ، لدراسة توطين مجالات الدهون المرتبة في الخلية12 بصريا. ومع ذلك ، فإن غشاء الخلية مليء بالطيات13،14 ، وغزوات الكهف1،13 ، وتجميع البروتين2 ، مما يعيق تصور ديناميكيات المؤشرات الحيوية للطوافة. تم استخدام نهج بديل لدراسة الطوافات في أغشية النموذج عن طريق تحضير الحويصلات باستخدام الدهون المناسبة15. على الرغم من سهولة التصنيع والعمل بها ، إلا أن هذه الحويصلات ليست تمثيلا دقيقا لغشاء الخلية من حيث الخصائص الفيزيائية الحيوية والتركيب الكيميائي للطبقة الخلوية. نظام الغشاء الطبيعي هو حويصلات غشاء البلازما العملاقة (GPMVs). GPMVs عبارة عن حويصلات غشاء بلازما ذات تركيبة دقيقة كيميائيا للأغشية الخلوية. يتم إنتاجها عن طريق احتضان الخلايا بكواشف تشكل حويصلات عن طريق تبرعم غشاء الخلية للخلايا الحية16. ومع ذلك ، من المعروف أن الحلول التقليدية لتشكيل GPMV تعدل كيميائيا و / أو تشابك الدهون والبروتينات أثناء عملية الحويصلة وتنشط بشكل أساسي المستقبلات في الحويصلات. يؤثر البروتوكول الذي تم تطويره في مختبرنا على قدرة الغشاء على تكوين طوافات دهنية عن طريق تبادل الدهون الخارجية ذات الميول المختلفة لدعم أو تدمير المناطق المرتبة من غشاء الخلية في الخلايا السليمة ودون تعديل البروتيناتكيميائيا 4،8.
يمكن أن تتبع تجارب تبادل الدهون على الفور فحوصات تقيس خصائص غشاء البلازما. يوفر HP-TLC تأكيدا على حدوث التبادل وتم الحفاظ عليه بعد التجربة ، مما يضيف الثقة إلى نتائج أي تجارب كيميائية حيوية تم إجراؤها بعد فحوصات التبادل. من خلال تصور تركيبة السفينجوميلين والفوسفوليبيد للخلية قبل وبعد التبادل ، يمكن للمرء أيضا تحديد كفاءة التبادل في ظل مجموعة جديدة من الظروف ، مثل خطوط الخلايا الجديدة أو السيكلودكسترين. تلعب الخطوات المؤدية إلى جزء التبادل من البروتوكول دورا مهما في ضمان دقة التكرارات وتبادل الدهون الفعال في الخلايا. يجب النظر إلى المعايرة وسحب العينات وتجفيف الدهون على أنها خطوات حاسمة نظرا للكميات الصغيرة من المذيبات العضوية المستخدمة ومتطلبات التركيز الدقيقة لتحميل MαCD المناسب. يعد التخزين والمعايرة المناسبين لمحاليل مخزون الدهون خطوات أولية حاسمة في البروتوكول. عادة ما يتم تحضير محاليل المخزون في الكلوروفورم ويمكن أن تتبخر بمرور الوقت ، حتى عند تخزينها عند -20 درجة مئوية ، مما يؤدي إلى تغيرات تدريجية في التركيز. يعد تجفيف الحجم المحدد من الدهون لتحقيق التركيز المطلوب أمرا ضروريا لضمان تحميل الكمية الصحيحة من الدهون على السيكلودكسترين لعملية التبادل. لمنع حدوث خطأ في سحب العينات، ينصح بمعايرة تركيز محاليل المخزون على أساس شهري.
بعد معايرة محاليل المخزون ، يتم سحب حجم الدهون المطلوبة في أنابيب البورسليكات النظيفة ، على سبيل المثال ، مع ماصة دروموند ذات الإزاحة الإيجابية ، والتي تستخدم تجاويف زجاجية. ويمكن أن تستلزم تركيزات المخزون الدهني المرتفعة سحب العينات بكميات صغيرة للغاية، مما يؤدي إلى خطأ لا مفر منه وتباين في ظروف التبادل النهائية. لمنع ذلك ، ينصح بسحب حجم يتوافق مع تركيز وسيط بين تركيز المخزون ومحلول التبادل النهائي. يضمن هذا الأسلوب دقة سحب العينة المثلى لتشكيل الحويصلات متعددة الصفائح (MLVs) في محلول التبادل العامل. عادة ما يتم تجفيف الدهون على كتلة تسخين تحت تيار مستمر من غاز النيتروجين يتم الحفاظ عليه عند حوالي 10 رطل لكل بوصة مربعة لمدة 10-20 دقيقة. قد يتسبب ضغط الغاز المفرط أو وضع فوهة الغاز بالقرب من قاع الأنبوب في تناثر سائل التجفيف على الجدران ، مما يؤدي إلى فقدان حجم الدهون وربما تغيير تركيز MLVs. لمنع التلوث المتبادل ، يتم غسل جميع مكونات معدات التجفيف بالإيثانول بنسبة 100٪ قبل وبعد عملية التجفيف. لضمان التجفيف الكامل ، يتم وضع الأنبوب تحت فراغ عالي لمدة 1 ساعة ثم يتم إغلاقه بغشاء شفاف للحفاظ على نقاء الدهون المجففة.
يمكن أن تعزى قيود التجربة إلى دور التقلبات والتدافع في الحفاظ على عدم تناسق الغشاء. تحافظ الإنزيمات المسؤولة عن حركة الدهون بين المنشورات الداخلية والخارجية للطبقة الثنائية على الطبيعة غير المتماثلة لغشاء الخلية17. أثناء التجربة ، لا يعرف المعدل الذي تعيد به التقلبات والتقشير توزيع الدهون المضافة خارجيا بين المنشورات. هذا يمكن أن يحدد طبيعة غشاء الخلية وهو عامل خارجي لم يتم الكشف عنه.
بالإضافة إلى ذلك ، يمكن أن يؤدي إجراء الوجه هذا ، في ظل بعض الظروف ، إلى كشف الدهون الموجودة قبل الأوان في الغشاء الداخلي للخلايا ، مثل الفوسفاتيديل سيرين (PS) ، وهو دهون مسؤولة بطبيعتها عن إرسال إشارات موت الخلايا المبرمجالخلوي 18. تستخدم تجاربنا تبادل الدهون sphingomylein (SM) والفوساتيديل كولين (PC). توجد هذه الدهون في النشرة الخارجية لغشاء البلازما وتستغرق فترات طويلة للقلب نحو النشرة العصارية الخلوية التي تلبي الاختبار بشكل أساسي إلى النشرة الخارجية9،19،20. هناك مشكلة أخرى وهي أنه ليس كل دهون خارجية مضافة إلى الخلايا قد تدعم بشكل كامل سلامة غشاء الخلية وهيكلها9،19. سيؤدي استخدام هذه الدهون إلى إتلاف غشاء الخلية عن غير قصد بعد التبادل مما يحد من الدهون المستخدمة في بروتوكول التبادل. يمكن أن تساعد المقايسات في قياس مدى الضرر الذي تتعرض له الخلايا بعد الحضانة باستخدام وسائط التبادل4. يعد تحليل قياس التدفق الخلوي للخلايا المعالجة بالتربسين ويوديد البروبيديوم طريقة لتحليل جدوى الخلايا المتبادلة للدهون. يمكن أن يؤدي تلف الغشاء أيضا إلى استيعاب المستقبلات. ستؤدي الكميات الكبيرة من استيعاب مستقبلات الأنسولين إلى تغيير بيانات الفسفرة الذاتية للمستقبلات. يمكن أن يفسر قياس التدفق الخلوي الذي يتم إجراؤه على الأجسام المضادة الموسومة ب phycoerythrin-المرتبطة بالنطاقات الخارجية لمستقبلات الأنسولين في الخلايا المعالجة بوسائط التبادل أي تغييرات في تعبير المستقبلات السطحية4،20.
في هذه المخطوطة ، أبلغنا عن تركيزات مجموعة متنوعة من الدهون المحملة على تركيزات محددة من MαCD لتبادل الدهون بكفاءة في خلايا CHO IR. لإجراء تجارب التبادل في خطوط الخلايا الأخرى ، تتمثل الخطوة الأولى في تحديد تركيزات الدهون الفعالة في وسائط التبادل التي تتحملها الخلايا دون المساس بسلامة الغشاء أو التأثير على بقاءالخلية 8،9،21. يجب اختبار مجموعة واسعة من نسب الدهون المضغوطة إلى الدهون الخارجية جنبا إلى جنب مع الخلايا غير المعالجة. بهذه الطريقة ، سيتم تحديد النسبة المثلى من CD: الدهون حيث لا يوجد تقريب مرئي للخلايا أو انفصال عن اللوحة (في حالة الخلايا الملتصقة) ، ويكون مورفولوجيا الخلايا المعالجة مشابها للخلايا غير المعالجة. من الناحية الكيميائية الحيوية ، يجب فحص الخلايا المعالجة بالقرص المضغوط: الوسائط الدهنية بحثا عن الاضطرابات في التبادل الدهني بعد الغشاء باستخدام معالجة التريبان الأزرق وتسرب يوديد البروبيديوم أو ربط الملحق V لاختبار التعرض السطحي ل PS21. تختلف ظروف درجة الحرارة المثلى وطول فترات التبادل باختلاف الحويصلات الدهنية ويجب تحديدها لخطوط الخلايا الجديدة. تم إجراء تجربة تبادل الدهون حصريا في أغشية الخلايا الحية. على حد علمنا ، لا يوجد دليل بيانات على نجاح تبادل الدهون في المحللة الخلوية. يمكن تمديد تقنية تبادل الدهون هذه لتغيير غشاء العضيات داخل الخلية إذا كان من الممكن عزلها عن المحللة الخلوية.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم توفير التمويل من قبل منحة المعاهد الوطنية للصحة GM 122493. كانت خلايا CHO IR هدية لطيفة من الدكتور جوناثان ويتاكر (جامعة كيس ويسترن ريزيرف).
Materials
| Name | Company | Catalog Number | Comments |
| 1,2-dilauroyl-sn-glycero-3-phosphocholine (DLPC) | Avanti Polar Lipids | 850335 | |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) | Avanti Polar Lipids | 850345 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375 | |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Avanti Polar Lipids | 850355 | |
| 1,2-distearoyl-sn-glycero-3-phosphocholine (DSPC) | Avanti Polar Lipids | 850365 | |
| 1-palmitoyl-2-oleoyl-sn-glycerol-3-phosphocholine (POPC) | Avanti Polar Lipids | 850457 | |
| Anti-insulin receptor β antibody | Cell Signaling Technology | CST3025 | |
| Anti-pYpY1162/1163 Insulin receptor antibody | R&D Systems Inc. | AF2507 | |
| Anti-rabbit IgG, HRP-linked Antibody | Cell Signaling Technology | 7074 | |
| Borosilicate glass test tubes (12 x 75 mm) | Thermo Fisher Scientific | 14-961-26 | |
| Brain sphingomyelin (bSM) | Avanti Polar Lipids | 860062 | |
| Egg sphingomyelin (eSM) | Avanti Polar Lipids | 860061 | |
| Fetal bovine serum (FBS) | Corning | 35-016-CV | |
| G418 disulfate salt | Sigma Aldrich | A1720 | |
| Gibco Antibiotic-antimycotic solution (100x) | Thermo Fisher Scientific | 15240062 | |
| Gibco Dulbecco’s modified eagle medium (DMEM, 4.5 g/L glucose, L-glutamine, sodium pyruvate) | Thermo Fisher Scientific | 11965092 | |
| Gibco ham’s F12 media | Thermo Fisher Scientific | 11765054 | |
| Gibco L-glutamine | Thermo Fisher Scientific | 25030032 | |
| Gibco MEM Non-Essential Amino Acids Solution (100X) | Thermo Fisher Scientific | 11140050 | |
| Gibco phosphate buffered saline (PBS) without calcium and magnesium (0.144 g/L KH2PO4, 9 g/L NaCl, 0.795 g/L Na2- HPO4 (anhydrous)) | Thermo Fisher Scientific | 10010023 | |
| Gibco Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300054 | |
| High performance thin layer chromatography (HP-TLC) | Merck | HP-TLC Silica Gel 60 plates | |
| Immobilon-P PVDF Membrane | Millipore | IPVH00010 | |
| Methotrexate | Sigma Aldrich | 454126 | |
| Methyl-α-cyclodextrin (MαCD) | AraChem | CDexA076/BR | |
| Pierce ECL Western Blotting Substrate | Thermo Fisher Scientific | 32106 | |
| Sodium orthovanadate, Activated | Sigma Aldrich | 5.08605 |
References
- Brown, D. A., London, E. Functions of lipid rafts in biological membranes. Annu Rev Cell Dev Biol. 14, 111-136 (1998).
- Brown, D. A. Lipid rafts, detergent-resistant membranes, and raft targeting signals. Physiology. 21, 430-439 (2006).
- Schroeder, R., London, E., Brown, D. Interactions between saturated acyl chains confer detergent resistance on lipids and glycosylphosphatidylinositol (GPI)-anchored proteins: GPI-anchored proteins in liposomes and cells show similar behavior. Proc Natl Acad Sci U S A. 91 (25), 12130-12134 (1994).
- Suresh, P., Miller, W. T., London, E. Phospholipid exchange shows insulin receptor activity is supported by both the propensity to form wide bilayers and ordered raft domains. J Biol Chem. 297 (3), 101010 (2021).
- Delle Bovi, R. J., Kim, J., Suresh, P., London, E., Miller, W. T. Sterol structure dependence of insulin receptor and insulin-like growth factor 1 receptor activation. Biochim Biophys Acta Biomembr. 1861 (4), 819-826 (2019).
- Zidovetzki, R., Levitan, I. Use of cyclodextrins to manipulate plasma membrane cholesterol content: evidence, misconceptions and control strategies. Biochim Biophys Acta. 1768 (6), 1311-1324 (2007).
- Ohtani, Y., Irie, T., Uekama, K., Fukunaga, K., Pitha, J. Differential effects of α-, β- and γ-cyclodextrins on human erythrocytes. Eur J Biochem. 186 (1-2), 17-22 (1989).
- Suresh, P., London, E. Using cyclodextrin-induced lipid substitution to study membrane lipid and ordered membrane domain (raft) function in cells. Biochim Biophys Acta Biomembr. 1864 (1), 183774 (2022).
- Li, G., et al. Efficient replacement of plasma membrane outer leaflet phospholipids and sphingolipids in cells with exogenous lipids. Proc Natl Acad Sci U S A. 113 (49), 14025-14030 (2016).
- Yoshimasa, Y., Paul, J. I., Whittaker, J., Steiner, D. F. Effects of amino acid replacements within the tetrabasic cleavage site on the processing of the human insulin receptor precursor expressed in Chinese hamster ovary cells. J Biol Chem. 265 (28), 17230-17237 (1990).
- Gaus, K., et al. Visualizing lipid structure and raft domains in living cells with two-photon microscopy. Proc Natl Acad Sci U S A. 100 (26), 15554-15559 (2003).
- Klymchenko, S., Kreder, R. Fluorescent probes for lipid rafts: From model membranes to living cells. Chem Biol. 21 (1), 97-113 (2014).
- Pike, L. J. Growth factor receptors, lipid rafts and caveolae: An evolving story. Biochim Biophys ActaMol Cell Res. 1746 (3), 260-273 (2005).
- Brown, D. A., London, E. Structure of detergent-resistant membrane domains: does phase separation occur in biological membranes. Biochem Biophys Res Commun. 240 (1), 1-7 (1997).
- Lin, Q., London, E. Preparation of artificial plasma membrane mimicking vesicles with lipid asymmetry. PLoS One. 9 (1), e87903 (2014).
- Sezgin, E., et al. Elucidating membrane structure and protein behavior using giant plasma membrane vesicles. Nat Protoc. 7 (6), 1042-1051 (2012).
- Deveaux, P. F., Hermann, A., Ohlwein, N., Kozlov, M. M. How lipid flippases can modulate membrane structure. Biochimica et Biophysica Acta Biomembr. 1778 (7), 1591-1600 (2008).
- Balasubramaniam, K., Mirnikjoo, B., Schroit, A. J. Regulated externalization of phosphatidylserine at the cell surface: implications for apoptosis. J Biol Chem. 282 (25), 18357-18364 (2007).
- Li, G., et al. Replacing plasma membrane outer leaflet lipids with exogenous lipid without damaging membrane integrity. PLoS One. 14 (10), e0223572 (2019).
- Contreras, F. X., Sanchez-Magraner, L., Alonso, A., Goni, F. M. Transbilayer (flip-flop) lipid motion and lipid scrambling in membranes. FEBS Letters. 584 (9), 1779-1786 (2010).
- Suresh, P., London, E. MαCD-based plasma membrane outer leaflet lipid exchange in mammalian cells to study insulin receptor activity. Biophys Approach Study Memb Struct A Exp. 700, 485-507 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved