Method Article
Monitoraggio della progressione del nodulo polmonare mediante tomografia microcomputerizzata e prelievo di sangue in un modello murino
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive un metodo efficiente, semplice e minimamente invasivo per lo studio dei noduli polmonari. La raccolta del sangue della vena sottomascellare e l'imaging micro-CT sono utilizzate come tecniche investigative.
Abstract
La micro-tomografia computerizzata (micro-CT) è una tecnica in tempo reale, intuitiva, sensibile e minimamente invasiva per il monitoraggio dei cambiamenti dai noduli polmonari (PN) al cancro del polmone (LC). L'integrazione del prelievo di sangue della vena sottomandibolare consente un rilevamento rapido, stabile e diretto dell'imaging e delle principali alterazioni del bersaglio durante la progressione della PN a LC. In questo studio, abbiamo somministrato un dosaggio di 100 mg/kg di 4-(metilnitrosamino)-1-(3-piridil)-1-butanone in topi A/J per sviluppare un modello di adenocarcinoma polmonare. La progressione della malattia negli animali da esperimento è stata quindi monitorata attraverso il prelievo di sangue della vena sottomandibolare e il test micro-CT. I risultati sperimentali hanno mostrato la presenza di focolai nodulari nei polmoni di alcuni animali entro la 10asettimana, con lo sviluppo di immagini di adenocarcinoma polmonare che diventavano evidenti entro la 21a settimana. In conclusione, la micro-CT può osservare efficacemente i cambiamenti patologici nei polmoni dei topi e, se combinata con il prelievo di sangue della vena sottomandibolare, può monitorare dinamicamente i cambiamenti nel sangue, nelle proteine e nei bersagli. Questo metodo fornisce un approccio altamente specifico, semplice e sensibile per lo screening dei farmaci, i test farmacocinetici, gli esperimenti tossicologici e gli studi di sicurezza.
Introduzione
Il carcinoma polmonare (LC) è una grave neoplasia che origina nella mucosa bronchiale o nelle ghiandole polmonari. Secondo le statistiche del 2021, la LC causa circa due milioni di decessi a livello globale ogni anno, con tassi di incidenza e mortalità in aumento1. La diagnosi precoce e l'intervento nella LC contribuiscono a tassi di guarigione più elevati, a una riduzione della mortalità e a minori costi di trattamento. I noduli polmonari (PN) sono precursori specifici della LC, caratterizzati da ombre solide o subsolide localizzate, rotonde e più dense di ≤30 mm di diametro agli esami radiologici, senza evidenza di collasso polmonare, ingrossamento dei linfonodi mediastinici o versamento pleurico2. Il National Comprehensive Cancer Network (NCCN) nel 2022 ha classificato la PN per numero, diametro e densità, identificando combinazioni come un nodulo a vetro smerigliato isolato di 5 mm nel polmone destro3. Tuttavia, le linee guida NCCN indicano che il rischio di malignità nella PN aumenta con il diametro e la quantità dei noduli. L'applicazione diffusa della tomografia computerizzata a basse dosi ha aumentato notevolmente le diagnosi di PN, con milioni di nuovi casi identificati ogni anno4.
La combinazione di topi A/J con 4-(metilnitrosamino)-1-(3-piridil)-1-butanone (NNK) è il modello animale più comunemente usato per il cancro del polmone (LC)5,6. L'uso della micro-TC insieme al prelievo di sangue della vena sottomandibolare è un approccio efficace per il monitoraggio in tempo reale delle variazioni da noduli polmonari (PN) a LC. L'induzione di agenti chimici cancerogeni, in particolare con i topi NNK e A/J, è il metodo più diffuso per la modellazione del cancro del polmone e si è dimostrato un approccio efficace per stabilire il carcinoma in situ 7,8. Questo metodo di modellazione simula in modo più accurato la progressione della PN in LC rispetto al metodo di inoculazione ascellare.
Precedenti studi si sono concentrati sull'analisi statistica della morfologia dei noduli e sulla colorazione patologica di campioni di tessuto post-eutanasia9. Tuttavia, questi metodi non hanno la capacità di monitorare in tempo reale la progressione dinamica da PN a LC10. La micro-CT, come tecnica di imaging non invasiva, fornisce dati longitudinali accurati con alta risoluzione, imaging veloce, una bassa dose di radiazioni e sicurezza, rendendola adatta per rilevare immagini polmonari in tempo reale11,12. Il prelievo di sangue della vena sottomandibolare è il metodo più recente, semplice e veloce per ottenere campioni di sangue dai topi13. Questa tecnica non invasiva richiede una manipolazione minima degli animali e consente un rapido recupero, in linea con i principi delle 3R che mirano a ridurre il numero di animali utilizzati nella ricerca, minimizzare il disagio e promuovere un trattamento etico. Il volume ematico raccolto, circa 0,2-0,5 ml, è sufficiente per monitorare i parametri ematici con requisiti moderati14.
L'uso concomitante della micro-TC e del prelievo di sangue della vena sottomandibolare consente l'osservazione dinamica e in tempo reale della progressione da PN a LC nell'imaging e il rilevamento in tempo reale di bersagli chiave all'interno del flusso sanguigno15. Inoltre, questo approccio consente lo studio in tempo reale di metaboliti e altre sostanze biochimiche che, se combinato con tecniche come la cromatografia ad alte prestazioni, fa progredire la nostra comprensione della LC 16,17.
In questo studio, i topi A/J combinati con NNK sono stati utilizzati per creare un modello murino di cancro del polmone in situ. Le scansioni micro-CT sono state eseguite a 4, 10 e 20 settimane dopo l'induzione del modello per acquisire immagini polmonari, mentre il sangue è stato raccolto tramite campionamento della vena sottomandibolare durante l'esperimento. Questo studio mira a stabilire una base per la ricerca su PN e LC combinando il prelievo di sangue della vena sottomandibolare con la micro-CT.
In oncologia, la micro-CT è uno strumento altamente efficace per rilevare la crescita tumorale, offrendo una tecnica ad alta risoluzione per misurare i cambiamenti locali del fuoco ombra in qualsiasi momento durante tali studi18,19. Tuttavia, è essenziale riconoscere che la micro-CT da sola non fornisce informazioni sulle caratteristiche di focalizzazione delle ombre, sullo stato fisiologico dell'animale o sui livelli di fattori biologici chiave. Pertanto, il campionamento della vena sottomandibolare è stato utilizzato come metodo complementare in questo studio.
Protocollo
Tutti gli esperimenti sugli animali descritti in questo studio sono stati approvati dal Comitato Etico per il Benessere Animale Sperimentale dell'Università di Medicina Tradizionale Cinese di Chengdu e sono stati condotti in conformità con le leggi e gli standard etici pertinenti per la ricerca sugli animali (numero di revisione: 2024035). I topi femmina consanguinei A/JGpt (7-8 settimane di età) sono stati mantenuti a una temperatura di 20-24 °C con un'umidità relativa del 40%-70%. Sono stati forniti loro mangimi standard per animali e acqua purificata ad libitum per un ciclo luce-buio di 12 ore. Prima dell'esperimento, ogni animale è stato acclimatato a questo ambiente per 7 giorni. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei materiali.
1. Reagenti e preparazione animale
- Sostanze chimiche e reagenti
- Sciogliere NNK in soluzione salina fino a formare una master mix20 da 10 mg/mL. Somministrare una singola iniezione intraperitoneale di 0,2 mL con una concentrazione di 100 mg/kg al gruppo NNK, fornendo un volume uguale di soluzione fisiologica normale al gruppo bianco.
NOTA: Seguire Jang et al.21 per determinare i tempi per la scansione micro-CT e il prelievo di sangue.
- Sciogliere NNK in soluzione salina fino a formare una master mix20 da 10 mg/mL. Somministrare una singola iniezione intraperitoneale di 0,2 mL con una concentrazione di 100 mg/kg al gruppo NNK, fornendo un volume uguale di soluzione fisiologica normale al gruppo bianco.
- Prelievo di sangue
NOTA: Per garantire la salute dei topi, limitare la raccolta del sangue a non più di 0,2 ml alla volta e attendere una settimana per il recupero. A causa dell'abbondanza di peli nella regione sottomentoniera, fare attenzione a evitare la contaminazione del campione di sangue da parte dei capelli durante la raccolta.- Rimuovere i peli del viso dell'animale il giorno prima dell'esperimento utilizzando un rasoio appropriato.
- Afferrare saldamente la pelle sulla parte posteriore della testa del mouse con la mano sinistra per impedire qualsiasi movimento e mantenere la testa del mouse in una posizione fissa.
- Inserire rapidamente l'ago per la raccolta del sangue nell'arteria sottomascellare dall'area mandibolare dietro l'orbita obliqua. Tenere l'ago in posizione per almeno 3 secondi per consentire un flusso sanguigno ottimale. Raccogliere 50-200 μL di sangue.
- Raccogliere il sangue in una provetta EDTA. Usa un batuffolo di cotone per applicare una leggera pressione sulla pelle per fermare il sanguinamento. Una volta che l'emorragia si è fermata, rilasciare il mouse e osservarlo per 30 s.
- Agitare delicatamente la provetta per assicurarsi che il sangue sia accuratamente miscelato con il coagulante.
- Per gli esami del sangue di routine, posizionare il sangue raccolto nello strumento veterinario per i test di routine, premere il pulsante di raccolta e consentire allo strumento di raccogliere il sangue. Registra i risultati visualizzati. Smaltire il sangue rimanente in modo sicuro.
2. Imaging in vivo mediante micro-CT
NOTA: Rimuovere sempre gli oggetti metallici, come i marchi auricolari, dall'animale di prova prima di utilizzare la scansione micro-CT. Gli oggetti metallici possono causare gravi artefatti nell'immagine. La micro-CT emette una certa quantità di radiazioni; garantire che altri risultati sperimentali non siano influenzati.
- Avviare l'unità, avviare il software micro-CT ed eseguire la calibrazione e il riscaldamento della sonda. Utilizzare la base strumenti specifica per il mouse per la scansione.
- Creare un nuovo database e assegnargli un nome per questa scansione oppure connetterlo a un database esistente.
- Modificare i parametri nella finestra di configurazione del software. Impostare il filtro a raggi X su Cu0,06 + Al0,5, con una tensione di 70 kV, una corrente di 80 μA, un campo visivo di 36 mm × 36 mm, scansione rotazionale a 360° e un tempo di scansione di 4 min22.
- Anestetizzare i topi con isoflurano al 3% prima di eseguire la scansione23 (seguendo i protocolli approvati istituzionalmente). Aprire lo schermo di visualizzazione della micro-CT e fissare i mouse al letto degli strumenti con del nastro adesivo. Mantenere l'anestesia in modo continuo utilizzando un sondino nasogastrico posizionato all'interno dello strumento micro-CT sul letto dell'utensile.
- Guidare con attenzione l'animale all'interno dell'apparecchio e monitorare la sua posizione in tempo reale. Utilizzare i pulsanti appropriati per regolare la posizione del mouse, assicurandosi che il suo torace sia completamente visibile all'interno del campo visivo.
- Ruotare il piano degli attrezzi di 90° per posizionare il mouse. Utilizzare i pulsanti per regolare la posizione del mouse, assicurandosi che la regione polmonare sia situata centralmente all'interno del campo visivo. Quindi, riportare il piano degli attrezzi nella sua posizione originale.
- Per avviare la scansione, selezionare il pulsante Scansione . Consentire al sistema di completare la scansione senza interruzioni ed evitare di aprire la schermata di visualizzazione durante il processo. Osservare le fette transassiali, coronali e sagittali della ricostruzione attraverso il software.
- Valutare la qualità dell'immagine subito dopo la scansione. Se compaiono artefatti o immagini sfocate, ripetere la procedura di scansione.
- Rimuovi i topi dall'apparecchio e monitora la loro salute per assicurarti che siano in condizioni stabili prima di rimetterli nelle loro gabbie.
- Al termine dell'esperimento, rimuovere il nastro adesivo dal letto degli attrezzi, quindi pulire il letto. Salvare i dati e spegnere lo strumento.
- Trasferisci delicatamente i topi nelle loro gabbie per ridurre al minimo lo stress. Assicurarsi che le gabbie siano pulite e abbiano una lettiera adeguata.
- Monitorare i topi per segni di recupero dall'anestesia. Osserva il loro comportamento, la mobilità e l'appetito. Fornire cibo e acqua secondo necessità.
- Mantenere un ambiente caldo per i topi per prevenire l'ipotermia dopo l'anestesia. Se necessario, utilizzare termofori o coperte.
- Condurre controlli sanitari giornalieri per la prossima settimana. Cerca segni di angoscia, comportamenti insoliti o lesioni. Documenta le osservazioni per ogni topo.
- Se un topo mostra segni di malattia o angoscia, consultare un veterinario per un intervento e una cura appropriati.
- Assicurati che i topi tornino alle loro normali condizioni di alloggio dopo che si sono completamente ripresi e sono stabili.
3. Elaborazione e analisi dei dati
- Utilizza le statistiche e i software grafici come strumento prezioso per l'analisi dei dati e la creazione di tabelle per presentare i risultati.
- Apri il software. Seleziona i grafici XY dalla tabella dati appena creata, inserisci i dati settimanali per l'NNK e i gruppi di controllo e genera un grafico che mostra le variazioni di peso dei topi.
- Aprire nuovamente il software, selezionare il diagramma di contingenza dalla tabella dati appena creata, inserire i dati di routine del sangue per il gruppo NNK e il gruppo di controllo e generare un'icona.
- Selezionare le opzioni di analisi nel software. Analizza i dati complessivi utilizzando l'ANOVA unidirezionale, seguita dalla verifica dei dati attraverso l'implementazione di un t-test. Segna le differenze significative.
- Salvare i dati micro-CT in formato SimpleViewer o DICOM. Aprire il software SimpleViewer e osservare i dati di imaging sotto la guida di un medico di imaging professionista. Etichettare i noduli e quantificare il volume d'ombra utilizzando gli strumenti di misurazione forniti.
Risultati
Questo studio ha dimostrato la costruzione di un modello stabile di cancro del polmone utilizzando NNK in combinazione con topi A/J. Il disegno sperimentale è illustrato nella Figura 1. L'obiettivo era quello di osservare il processo in tempo reale della transizione dai noduli polmonari (PN) al carcinoma polmonare (LC) nei polmoni di topo, utilizzando la micro-TC e il prelievo di sangue della vena sottomandibolare. Di conseguenza, la micro-TC e il prelievo di sangue dai polmoni di topo sono stati condotti alla quarta, decima e ventesima settimana.
I risultati sperimentali hanno mostrato che l'approccio modellistico di NNK in combinazione con topi A/J ha imitato efficacemente il processo patologico da PN a LC. In primo luogo, si può affermare che il test utilizzato in questo studio non ha avuto un impatto significativo sul benessere degli animali da esperimento. Come illustrato nella Figura 2, il peso corporeo degli animali da esperimento durante il periodo di alimentazione di 20 settimane non ha mostrato differenze notevoli rispetto al gruppo di controllo. In secondo luogo, i risultati degli esami del sangue di routine condotti su campioni prelevati dagli animali da esperimento hanno rivelato un aumento significativo del numero di leucociti e piastrine nel gruppo modello, mentre il numero di globuli rossi e di emoglobina è rimasto invariato (Figura 3). Ciò indica che il processo di trasformazione da PN a LC è anche associato a un graduale aumento dell'infiammazione cronica. È importante sottolineare che sia la micro-TC che il campionamento del sangue della vena sottomandibolare non hanno danneggiato la funzione ematopoietica degli animali da esperimento, in linea con i risultati di numerosi studi precedenti. Inoltre, un'attenta osservazione del comportamento, delle condizioni del mantello, della respirazione, della dieta e dell'assunzione di acqua degli animali da esperimento durante lo studio non ha rivelato anomalie.
Dopo la somministrazione iniziale di NNK agli animali da esperimento, abbiamo condotto una micro-TC dei polmoni il primo giorno della quarta, decima e ventesima settimana24. I risultati hanno indicato che, rispetto al gruppo di controllo, la struttura polmonare del gruppo modello mostrava un graduale ispessimento. Entro ladecima settimana, la formazione di minuscoli focolai nodulari era osservabile e alla ventesimasettimana i noduli si erano sviluppati in focolai d'ombra distinguibili. Alla luce di questi risultati, si può ipotizzare che la formazione di focolai d'ombra nei polmoni sia associata all'infiammazione cronica indotta da NNK25. Tuttavia, poiché questo studio è stato progettato per osservare lo sviluppo sicuro, efficiente e innocuo di PN in LC senza coinvolgere studi patologici negli animali, gli studi successivi devono essere condotti in conformità con specifici protocolli sperimentali26. La Figura 4 illustra le alterazioni nell'imaging polmonare osservate negli animali da esperimento alle settimane 4, 10 e 20.

Figura 1: Disegno sperimentale per il trattamento con NNK in topi A/J. Cinque topi femmina A/J sono stati iniettati con il composto NNK in un unico momento, mentre altri cinque sono stati iniettati con soluzione salina come controllo. I campioni di sangue sono stati raccolti alle settimane 4, 10 e 20 utilizzando scansioni micro-TC dei polmoni di topo e prelievo di sangue della vena sottomascellare. I dati ottenuti sono stati convalidati in modo incrociato per valutare la progressione della malattia nei topi. (A) Panoramica del disegno sperimentale. (B) Diagramma del prelievo di sangue dell'arteria sottomascellare. (C) Rappresentazione schematica della configurazione di imaging micro-CT, che mostra il topo posizionato sul letto dell'animale (blu) e la cornice gialla come mirino, che dovrebbe coprire completamente il tessuto polmonare del topo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Variazioni di peso nei topi nell'arco di 20 settimane. L'andamento del peso ha indicato che il trattamento con NNK nei topi A/J non ha ridotto significativamente il peso corporeo. La micro-TC e l'estrazione del sangue della vena sottomascellare possono causare stress ai topi; Tuttavia, si sono ripresi rapidamente. I dati sono espressi come media ± SEM, (n = 5). Clicca qui per visualizzare una versione più grande di questa figura.
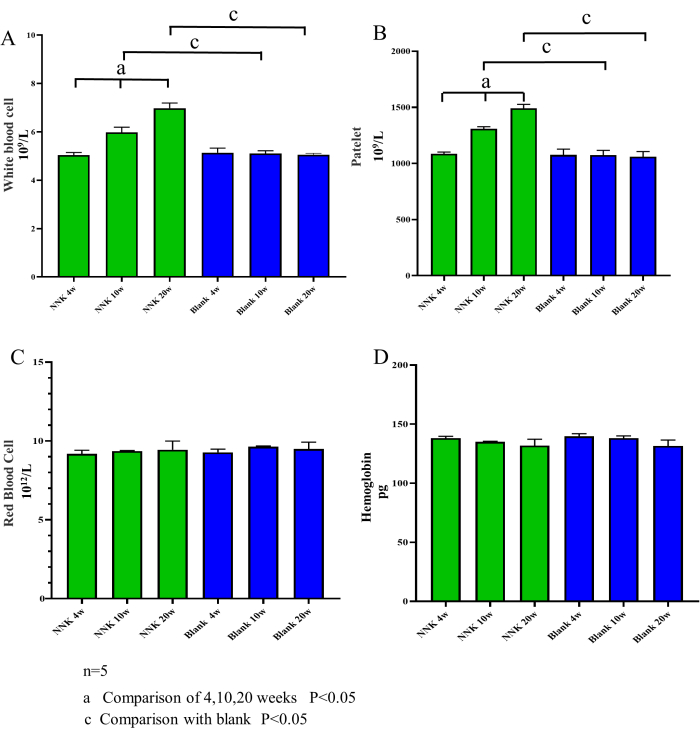
Figura 3: Conta delle cellule del sangue nel tempo. Il contenuto di globuli bianchi, piastrine, globuli rossi ed emoglobina è stato misurato nei topi alle settimane 4, 10 e 20. Rispetto al gruppo di controllo, il gruppo NNK ha mostrato una tendenza all'aumento del numero di globuli bianchi e piastrine, mentre i livelli di emoglobina e globuli rossi non sono cambiati in modo significativo. Questi risultati suggeriscono che il processo di trasformazione del PN-LC è associato ad un aumento dell'infiammazione e che il metodo di raccolta del sangue della vena sottomascellare, eseguito a intervalli superiori a 4 settimane, non causa infezione o danni alla funzione ematopoietica nei topi. (A) Globuli bianchi. (b) Piastrine. (C) Globuli rossi. (D) Emoglobina. I dati sono espressi come media ± SEM, (n = 5). Clicca qui per visualizzare una versione più grande di questa figura.
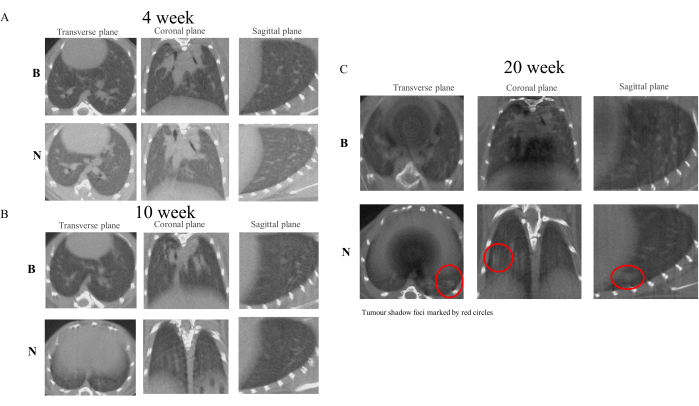
Figura 4: Immagini di scansione micro-CT di topi alle settimane 4, 10 e 20. I risultati dell'imaging micro-CT dimostrano che il trattamento con NNK nei topi A/J simula efficacemente il processo di trasformazione di PN-LC. Rispetto al gruppo di controllo, il gruppo NNK ha iniziato a mostrare caratteristiche di ispessimento e consistenza alterata nelle immagini polmonari entro la settimana 10. Alla settimana 20, robusti focolai d'ombra erano distinguibili all'interno del tessuto polmonare. (A) Immagini della settimana 4. (B) Immagini della settimana 10. (C) Immagini della settimana 20. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
È importante ribadire diversi punti chiave di questo studio. In primo luogo, sebbene la raccolta del sangue della vena sottomandibolare sia una procedura relativamente a basso numero di lesioni, può comunque causare un certo grado di danno agli animali. Pertanto, è necessario condurre più procedure per ridurre l'onere sui topi e completare il processo in modo tempestivo27. In secondo luogo, la rimozione dei peli prima della raccolta del campione di sangue garantisce la purezza del campione. In terzo luogo, è imperativo utilizzare recipienti appropriati per la raccolta del sangue. Nel presente studio, i recipienti di raccolta del sangue contenenti EDTA sono stati utilizzati per gli esami del sangue di routine. Se si dovesse utilizzare il siero, sarebbero necessari vasi specificamente progettati per la raccolta di sangue puro28. In quarto luogo, tutti gli anestetici hanno un certo livello di letalità; Pertanto, ridurre al minimo il tempo di anestesia e imaging può salvaguardare efficacemente la salute dei topi. In quinto luogo, poiché la micro-CT può osservare una varietà di tessuti e organi, le impostazioni dei parametri specifici nel software micro-CT utilizzato durante l'imaging PN possono essere citate da questo studio, ma potrebbero non essere applicabili ad altri tessuti29,30.
Studi precedenti erano più inclini all'eutanasia degli animali in momenti fissi e all'esame del processo di trasformazione del nodulo polmonare attraverso la colorazione patologica31. Questo approccio ha provocato un numero considerevole di decessi tra gli animali da esperimento e ha ostacolato il monitoraggio in tempo reale dei cambiamenti polmonari. Rispetto alle tecniche convenzionali, il prelievo di sangue sottomandibolare e la micro-TC offrono diversi vantaggi, tra cui danni minimi, monitoraggio in tempo reale, funzionamento intuitivo e versatilità. In questo studio, la raccolta del sangue sottomandibolare è stata scelta come metodo preferito per ottenere campioni di sangue per i test di routine32. Inoltre, il sangue può essere utilizzato per analisi proteomiche, sierologiche e biochimiche del sangue.
Allo stesso modo, la micro-CT è stata impiegata in questo studio per osservare la crescita dinamica della PN nei topi sperimentali senza la necessità di sopprimerli. Questo approccio facilita una valutazione più intuitiva e accurata dell'effetto inibitorio del farmaco sulla PN, riducendo significativamente il numero di animali necessari per l'esperimento, migliorando così l'accuratezza dei risultati sperimentali. In particolare, la combinazione di queste due tecnologie consente un monitoraggio completo dei processi di formazione, sviluppo e cancerogenesi dei noduli negli animali da esperimento, nonché la localizzazione di alterazioni in bersagli chiave (come il TNF-α)33. Questo presenta un concetto unico per questa ricerca sulla PN e persino sul cancro ai polmoni.
Ciononostante, diverse questioni richiedono un'ulteriore considerazione per migliorare la qualità della ricerca futura. Dato il lungo periodo sperimentale richiesto per il modello animale di NNK combinato con topi A/J, è imperativo che le prime iniezioni di farmaci siano condotte con la massima precisione34. In secondo luogo, il metodo standard per la produzione di adenocarcinoma polmonare nei topi coinvolge NNK in coordinamento con topi femmina A/J, con il meccanismo sottostante legato all'estradiolo. Pertanto, è essenziale considerare i meccanismi d'azione specifici dei farmaci terapeutici coinvolti35. Inoltre, la micro-CT non è stata utilizzata per determinare la natura dei focolai ombra, richiedendo l'uso della colorazione con ematossilina e della colorazione a fluorescenza, che richiedono ancora l'eutanasia dei topi per ottenere campioni di tessuto polmonare. Infine, sebbene la micro-CT abbia il vantaggio di una bassa esposizione alle radiazioni, può comunque causare alcuni danni al corpo umano, rendendo necessaria l'evitamento della vicinanza a personale non imparentato36. Per affrontare questi problemi, la differenziazione e l'etichettatura di vari tessuti, vie aeree e vasi sanguigni possono essere ottenute efficacemente attraverso l'iniezione nella vena caudale di un agente di contrasto. Inoltre, la micro-CT combinata con nuovi farmaci materiali (ad esempio, nanoparticelle) può essere impiegata per un trattamento più preciso. Infine, la tecnologia micro-CT è stata gradualmente integrata con la patologia, come l'istologia spaziale e di imaging, per tracciare in modo più dinamico i cambiamenti nei noduli polmonari36,37.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il professor Cong Huang della Scuola di Scienze Mediche di Base e il professor Yan Huang della Scuola di Farmacia dell'Università di Medicina Tradizionale Cinese di Chengdu, per il loro sostegno. Vorremmo anche ringraziare il Dr. Binjie Xu e il Dr. Pengmei Guo. (Istituto Innovativo di Medicina e Farmacia Cinese, Chengdu
Università di Medicina Tradizionale Cinese) per la fornitura di strumenti e supporto tecnico.
Materiali
| Name | Company | Catalog Number | Comments |
| A/J mice | GemPharmatech LLC. | N000018 | |
| 0.5 mL EDTA tubes | Labshark | 130201070 | |
| 1-Butanone,4-(methylnitrosoamino)-1-(3-pyridinyl) | Gu Shi Gong Yuan Medical Equipment Co. | N589770 | |
| 75% ethanol | ChengDu Chron Chemicals Co,.Ltd | 2023052901 | |
| Animal shaver | Codos | BM010220 | |
| Isoflurane | Shenzhen Reward Life Technology Co. | R510-22-16 | |
| medical tricorder | MedChemexpress | 69652 | |
| Quantum GX2 microCT imaging system | PerkinElme | 2020166501 | |
| Saline (medicine) | Beijing Biolabs Technology Co. | GL1736 |
Riferimenti
- Sung, H., et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
- Baum, P., et al. Incidental pulmonary nodules: Differential diagnosis and clinical management. Dtsch Arztebl Int. , (2024).
- Ajani, J. A., et al. Gastric cancer, version 2.2022, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 20 (2), 167-192 (2022).
- Kondo, K. K., et al. Lung cancer diagnosis and mortality beyond 15 years since quit in individuals with a 20+ pack-year history: A systematic review. CA Cancer J Clin. 74 (1), 84-114 (2024).
- Ray, E., et al. Inhalable chitosan-coated nano-assemblies potentiate niclosamide for targeted abrogation of non-small-cell lung cancer through dual modulation of autophagy and apoptosis. Int J Biol Macromol. 279 (Pt 4), 135411 (2024).
- Ali, N. A., et al. Chia seed (Salvia hispanica) attenuates chemically induced lung carcinomas in rats through suppression of proliferation and angiogenesis. Pharmaceuticals (Basel). 17 (9), 1129 (2024).
- Kiran, A., Kumari, G. K., Krishnamurthy, P. T. Preliminary evaluation of anticancer efficacy of pioglitazone combined with celecoxib for the treatment of non-small cell lung cancer. Invest New Drugs. 40 (1), 1-9 (2022).
- Marshall, K., Twum, Y., Gao, W. Proteome derangement in malignant epithelial cells and its stroma following exposure to 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone. Arch Toxicol. 97 (3), 711-720 (2023).
- Li, B., et al. LNCRNA XIST modulates miR-328-3p ectopic expression in lung injury induced by tobacco-specific lung carcinogen NNK both in vitro and in vivo. Br J Pharmacol. 181 (15), 2509-2527 (2024).
- Liang, F., et al. Tobacco carcinogen induces tryptophan metabolism and immune suppression via induction of indoleamine 2,3-dioxygenase 1. Signal Transduct Target Ther. 7 (1), 311 (2022).
- Ding, R., et al. The effect of immunotherapy PD-1 blockade on acute bone cancer pain: Insights from transcriptomic and microbiomic profiling. Int Immunopharmacol. 142 (Pt A), 113100 (2024).
- Kayı Cangır, A., et al. Microcomputed tomography as a diagnostic tool for detection of lymph node metastasis in non-small cell lung cancer: A decision-support approach for pathological examination "a pilot study for method validation"). J Pathol Inform. 15, 100373 (2024).
- Packialakshmi, B., et al. A clinically-relevant mouse model that displays hemorrhage exacerbates tourniquet-induced acute kidney injury. Front Physiol. 14, 1240352 (2023).
- Sørensen, D. B., et al. Time-dependent pathologic and inflammatory consequences of various blood sampling techniques in mice. J Am Assoc Lab Anim Sci. 58 (3), 362-372 (2019).
- Wu, G. L., Li, T. Y., Pu, X. H., Yu, G. Y. Effect of prescriptions replenishing vital essence, tonifying qi and activating blood on TNF-alpha, IL-1beta expressions in serum and submaxillary gland of nod mice with Sjogren's syndrome. Zhongguo Zhong Yao Za Zhi. 38 (3), 413-416 (2013).
- Schroeder, J. A., et al. Thromboelastometry assessment of hemostatic properties in various murine models with coagulopathy and the effect of factor VIII therapeutics. J Thromb Haemost. 19 (10), 2417-2427 (2021).
- Guo, K., et al. Integration of microbiomics, metabolomics, and transcriptomics reveals the therapeutic mechanism underlying Fuzheng-Qushi decoction for the treatment of lipopolysaccharide-induced lung injury in mice. J Ethnopharmacol. 334, 118584 (2024).
- Luo, T., Zhang, S., Li, X., Huang, M. Challenges in the differential diagnosis of pulmonary tuberculosis vs. lung cancer: A case report. Oncol Lett. 28 (4), 494 (2024).
- Mascalchi, M., et al. Large cell carcinoma of the lung: LDCT features and survival in screen-detected cases. Eur J Radiol. 179, 111679 (2024).
- Peng, M., et al. P27 specifically decreases in squamous carcinoma and mediates NNK-induced transformation of human bronchial epithelial cells. J Cell Mol Med. 28 (15), e18577 (2024).
- Jang, H. J., et al. Tobacco-induced hyperglycemia promotes lung cancer progression via cancer cell-macrophage interaction through paracrine IGF2/IR/NPM1-driven PD-L1 expression. Nat Commun. 15 (1), 4909 (2024).
- Zhang, Y., et al. Curcumin analogue EF24 prevents alveolar epithelial cell senescence to ameliorate idiopathic pulmonary fibrosis via activation of PTEN. Phytomedicine. 133, 155882 (2024).
- Li, M., et al. Isoflurane anesthesia decreases excitability of inhibitory neurons in the basolateral amygdala leading to anxiety-like behavior in aged mice. Exp Ther Med. 28 (4), 399 (2024).
- Xiong, R., et al. Hypermethylation of the ADIRF promoter regulates its expression level and is involved in NNK-induced malignant transformation of lung bronchial epithelial cells. Arch Toxicol. 97 (12), 3243-3258 (2023).
- Shaikh, Z. M., et al. Thearubigins/polymeric black tea polyphenols (PBPs) do not prevent benzo[a]pyrene (B[a]P) induced lung tumors in A/J mice. Am J Transl Res. 15 (9), 5826-5834 (2023).
- Li, M. Y., et al. Targeting CD36 determines nicotine derivative NNK-induced lung adenocarcinoma carcinogenesis. iScience. 26 (8), 107477 (2023).
- Arlt, E., et al. A flow cytometry-based examination of the mouse white blood cell differential in the context of age and sex. Cells. 13 (18), 1583 (2024).
- Su, Z., et al. Feasibility of using serum, plasma, and platelet 5-hydroxytryptamine as peripheral biomarker for the depression diagnosis and response evaluation to antidepressants: Animal experimental study. Clin Psychopharmacol Neurosci. 22 (4), 594-609 (2024).
- Zhou, X., et al. Mechanosensitive lncRNA H19 promotes chondrocyte autophagy, but not pyroptosis, by targeting miR-148a in post-traumatic osteoarthritis. Noncoding RNA Res. 10, 163-176 (2025).
- Chen, C., et al. Cardamonin attenuates iron overload-induced osteoblast oxidative stress through the HIF-1α/ROS pathway. Int Immunopharmacol. 142 (Pt A), 112893 (2024).
- Yan, F., et al. Hypoxia promotes non-small cell lung cancer cell stemness, migration, and invasion via promoting glycolysis by lactylation of SOX9. Cancer Biol Ther. 25 (1), 2304161 (2024).
- Inoue, S., et al. Utility of ultrasound imaging in monitoring fracture healing in rat femur: Comparison with other imaging modalities. Bone Rep. 23, 101807 (2024).
- An, Y., et al. Quercetin through miR-147-5p/CLIP3 axis reducing Th17 cell differentiation to alleviate periodontitis. Regen Ther. 27, 496-505 (2024).
- Tian, J., et al. Diallyl disulfide blocks cigarette carcinogen 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone-induced lung tumorigenesis via activation of the Nrf2 antioxidant system and suppression of NF-κB inflammatory response. J Agric Food Chem. 71 (46), 17763-17774 (2023).
- Han, L., et al. Wutou decoction alleviates arthritis inflammation in CIA mice by regulating Treg cell stability and Treg/Th17 balance via the JAK2/STAT3 pathway. J Ethnopharmacol. 334, 118463 (2024).
- Napieczyńska, H., et al. µCT imaging of a multi-organ vascular fingerprint in rats. PLoS One. 19 (10), e0308601 (2024).
- Liu, H., et al. Using broadly targeted plant metabolomics technology combined with network pharmacology to explore the mechanism of action of the Yishen Gushu formula in the treatment of postmenopausal osteoporosis in vivo. J Ethnopharmacol. 333, 118469 (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon