Method Article
مراقبة تطور العقيدات الرئوية باستخدام التصوير المقطعي المحوسب الدقيق وأخذ عينات الدم في نموذج الفأر
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول طريقة فعالة وبسيطة وطفيفة التوغل لدراسة العقيدات الرئوية. يتم استخدام جمع الدم في الوريد تحت الفك العلوي والتصوير المضغوط المجهري كتقنيات استقصائية.
Abstract
التصوير المقطعي المحوسب الدقيق (micro-CT) هو تقنية في الوقت الفعلي وبديهية وحساسة وطفيفة التوغل لمراقبة التغيرات من العقيدات الرئوية (PN) إلى سرطان الرئة (LC). يتيح دمج أخذ عينات الدم في الوريد تحت الفك السفلي الكشف السريع والمستقر والمباشر للتصوير والتعديلات الرئيسية في الهدف أثناء تطور PN إلى LC. في هذه الدراسة ، قمنا بإعطاء جرعة 100 مجم / كجم من 4- (ميثيل نيتروزامينو) -1- (3-بيريديل) -1-بوتانون في الفئران A / J لتطوير نموذج سرطان الرئة. ثم تمت مراقبة تطور المرض في التجارب من خلال أخذ عينات الدم في الوريد تحت الفك السفلي ومقايسة التصوير المقطعي المحوسب الدقيق. أظهرت النتائج التجريبية وجود بؤر عقيدية في رئتي بعضبحلول الأسبوع العاشر ، مع ظهور صور سرطان الرئة الغدي الذي أصبح واضحابحلول الأسبوع الحادي والعشرين. في الختام ، يمكن للتصوير المقطعي المحوسب الصغير أن يلاحظ بشكل فعال التغيرات المرضية في رئتي الفئران ، وعندما يقترن بأخذ عينات دم الوريد تحت الفك السفلي ، يمكنه مراقبة التغيرات في الدم والبروتين والأهداف ديناميكيا. توفر هذه الطريقة نهجا محددا وبسيطا وحساسا للغاية لفحص الأدوية واختبار الحرائك الدوائية والتجارب السمية ودراسات السلامة.
Introduction
سرطان الرئة (LC) هو ورم شديد ينشأ في الغشاء المخاطي للقصبات الهوائية أو غدد الرئة. وفقا لإحصاءات عام 2021 ، يتسبب LC في ما يقرب من مليوني حالة وفاة على مستوى العالم كل عام ، مع ارتفاع معدلات الإصابة والوفيات1. يساهم التشخيص والتدخل المبكر في LC في ارتفاع معدلات الشفاء وتقليل الوفيات وخفض تكاليف العلاج. العقيدات الرئوية (PN) هي سلائف محددة ل LC ، تتميز بظلال صلبة أو شبه صلبة موضعية ومستديرة وأكثر كثافة يبلغ قطرها ≤30 مم في الفحوصات الإشعاعية ، دون دليل على انهيار الرئة أو تضخم العقدة الليمفاوية المنصف أو الانصباب الجنبي2. صنفت الشبكة الوطنية الشاملة للسرطان (NCCN) في عام 2022 PN حسب العدد والقطر والكثافة ، وحددت مجموعات مثل عقيدة زجاجية أرضية معزولة مقاس 5 مم في الرئة اليمنى3. ومع ذلك ، تشير إرشادات NCCN إلى أن خطر الإصابة بالورم الخبيث في PN يزداد مع قطر العقيدات وكميتها. أدى التطبيق الواسع النطاق للتصوير المقطعي المحوسب بجرعة منخفضة إلى زيادة تشخيص PN بشكل كبير ، مع تحديد ملايين الحالات الجديدة كل عام4.
مزيج الفئران A / J مع 4- (ميثيل نيتروسامينو) -1- (3-بيريديل) -1-بوتانون (NNK) هو النموذج الحيواني الأكثر استخداما لسرطان الرئة (LC) 5،6. يعد استخدام التصوير المقطعي المحوسب الصغير جنبا إلى جنب مع أخذ عينات الدم في الوريد تحت الفك السفلي نهجا فعالا للمراقبة في الوقت الفعلي للتغيرات من العقيدات الرئوية (PN) إلى LC. يعد الحث الكيميائي المسرطن ، خاصة مع الفئران NNK و A / J ، الطريقة الأكثر انتشارا لنمذجة سرطان الرئة وقد أثبت أنه نهج فعال لإنشاء السرطان في الموقع7،8. تحاكي طريقة النمذجة هذه بشكل أكثر دقة تطور PN إلى LC مقارنة بطريقة التلقيح الإبطي.
ركزت الدراسات السابقة على التحليل الإحصائي لمورفولوجيا العقيدات والتلوين المرضي لعينات الأنسجة بعد القتل الرحيم9. ومع ذلك ، تفتقر هذه الأساليب إلى القدرة على الرصد في الوقت الفعلي للتقدم الديناميكي من PN إلى LC10. يوفر التصوير المقطعي المحوسب الصغير ، كتقنية تصوير غير جراحية ، بيانات طولية دقيقة بدقة عالية وتصوير سريع وجرعة إشعاع منخفضة وأمان ، مما يجعله مناسبا للكشف عن صور الرئة في الوقت الفعلي11،12. أخذ عينات الدم في الوريد تحت الفك السفلي هو أحدث وأبسط وأسرع طريقة للحصول على عينات الدم من الفئران13. تتطلب هذه التقنية غير الغازية الحد الأدنى من التعامل مع وتسمح بالتعافي السريع ، بما يتماشى مع مبادئ 3R التي تهدف إلى تقليل عدد المستخدمة في البحث ، وتقليل الانزعاج ، وتعزيز العلاج الأخلاقي. حجم الدم الذي تم جمعه ، حوالي 0.2-0.5 مل ، يكفي لمراقبة معلمات الدم ذات المتطلباتالمعتدلة 14.
يسمح الاستخدام المتزامن لأخذ عينات الدم بالوريد تحت الفك السفلي والتصوير المقطعي المحوسب وتحت الفك السفلي بالمراقبة الديناميكية في الوقت الفعلي لتقدم PN-to-LC في التصوير والكشف في الوقت الفعلي عن الأهداف الرئيسية داخل مجرى الدم15. بالإضافة إلى ذلك ، يتيح هذا النهج التحقيق في الوقت الفعلي للمستقلبات والمواد الكيميائية الحيوية الأخرى ، والتي ، عند دمجها مع تقنيات مثل الكروماتوغرافيا عالية الأداء ، تعزز فهمنا ل LC16،17.
في هذه الدراسة ، تم استخدام الفئران A / J جنبا إلى جنب مع NNK لإنشاء نموذج فأر سرطان الرئة في الموقع. تم إجراء فحوصات التصوير المقطعي المحوسب الدقيقة بعد 4 و 10 و 20 أسبوعا من الحث النموذجي لالتقاط صور الرئة ، بينما تم جمع الدم عن طريق أخذ عينات من الوريد تحت الفك السفلي طوال التجربة. تهدف هذه الدراسة إلى إنشاء أساس لأبحاث PN و LC من خلال الجمع بين أخذ عينات الدم في الوريد تحت الفك السفلي والتصوير المقطعي المحوسب الدقيق.
في علم الأورام ، يعد التصوير المقطعي المحوسب الدقيق أداة فعالة للغاية للكشف عن نمو الورم ، حيث يقدم تقنية عالية الدقة لقياس تغيرات تركيز الظل المحلي في أي وقت خلال هذه الدراسات18،19. ومع ذلك ، من الضروري إدراك أن التصوير المقطعي المحوسب الصغير وحده لا يوفر معلومات عن خصائص تركيز الظل ، أو الحالة الفسيولوجية للحيوان ، أو مستويات العوامل البيولوجية الرئيسية. لذلك ، تم استخدام أخذ عينات الوريد تحت الفك السفلي كطريقة تكميلية في هذه الدراسة.
Protocol
تمت الموافقة على جميع التجارب على الموصوفة في هذه الدراسة من قبل لجنة أخلاقيات رعاية التجريبية التابعة لجامعة تشنغدو للطب الصيني التقليدي وتم إجراؤها وفقا للقوانين والمعايير الأخلاقية ذات الصلة للأبحاث على (رقم المراجعة: 2024035). تم الحفاظ على إناث الفئران الفطرية A / JGpt (7-8 أسابيع) عند درجة حرارة 20-24 درجة مئوية مع رطوبة نسبية تتراوح بين 40٪ -70٪. تم تزويدهم بعلف حيواني قياسي ومياه نقية طوال دورة فاتحة وظلام مدتها 12 ساعة. قبل التجربة ، تأقلم كل مع هذه البيئة لمدة 7 أيام. تفاصيل الكواشف والمعدات المستخدمة مدرجة في جدول المواد.
1. الكواشف وإعداد
- المواد الكيميائية والكواشف
- قم بإذابة NNK في محلول ملحي لتشكيل مزيج رئيسي 10 مجم / مل20. يجب إعطاء حقنة واحدة داخل الصفاق بمقدار 0.2 مل بتركيز 100 ملغم/كغ لمجموعة NNK، مع توفير كمية متساوية من المحلول الملحي الطبيعي للمجموعة الفارغة.
ملاحظة: اتبع Jang et al.21 لتحديد توقيت الفحص بالتصوير المقطعي المحوسب المجهري وأخذ عينات الدم.
- قم بإذابة NNK في محلول ملحي لتشكيل مزيج رئيسي 10 مجم / مل20. يجب إعطاء حقنة واحدة داخل الصفاق بمقدار 0.2 مل بتركيز 100 ملغم/كغ لمجموعة NNK، مع توفير كمية متساوية من المحلول الملحي الطبيعي للمجموعة الفارغة.
- جمع الدم
ملاحظة: لضمان صحة الفئران ، قلل من جمع الدم بما لا يزيد عن 0.2 مل في كل مرة ، واترك أسبوعا واحدا للشفاء. نظرا لوفرة الشعر في المنطقة تحت العقل ، احرص على تجنب تلوث عينة الدم بالشعر أثناء التجميع.- قم بإزالة شعر وجه في اليوم السابق للتجربة باستخدام ماكينة حلاقة مناسبة.
- أمسك الجلد على الجانب الخلفي من رأس الماوس بإحكام باليد اليسرى لمنع أي حركة والحفاظ على رأس الماوس في وضع ثابت.
- أدخل إبرة جمع الدم بسرعة في الشريان تحت الفك العلوي من منطقة الفك السفلي خلف محجر العين المائل. احتفظ بالإبرة في مكانها لمدة 3 ثوان على الأقل للسماح بتدفق الدم الأمثل. اجمع 50-200 ميكرولتر من الدم.
- اجمع الدم في أنبوب EDTA. استخدم قطعة قطن لتطبيق ضغط لطيف على الجلد لوقف النزيف. بمجرد توقف النزيف ، حرر الماوس وراقبه لمدة 30 ثانية.
- حرك أنبوب الاختبار برفق للتأكد من خلط الدم تماما مع مادة التخثر.
- لفحص الدم الروتيني ، ضع الدم الذي تم جمعه في أداة اختبار الدم البيطري الروتيني ، واضغط على زر التجميع ، واترك الجهاز بجمع الدم. سجل النتائج المعروضة. تخلص من أي دم متبقي بأمان.
2. التصوير في الجسم الحي بواسطة التصوير المقطع المضغوط
ملاحظة: قم دائما بإزالة الأشياء المعدنية ، مثل علامات الأذن ، من الاختبار قبل استخدام الفحص بالأشعة المقطعية الدقيقة. يمكن أن تسبب الأجسام المعدنية القطع الأثرية الشديدة في الصورة. ينبعث من Micro-CT كمية معينة من الإشعاع. تأكد من عدم تأثر النتائج التجريبية الأخرى.
- ابدأ تشغيل الوحدة ، وقم بتشغيل برنامج micro-CT ، وقم بإجراء معايرة المسبار والإحماء. استخدم مجموعة الأدوات الخاصة بالماوس للمسح الضوئي.
- قم بإنشاء قاعدة بيانات جديدة وقم بتسميتها لهذا الفحص ، أو قم بتوصيلها بقاعدة بيانات موجودة.
- قم بتعديل المعلمات في نافذة إعداد البرنامج. اضبط مرشح الأشعة السينية على Cu0.06 + Al0.5 ، بجهد 70 كيلو فولت ، وتيار 80 ميكرو أمبير ، ومجال رؤية 36 مم × 36 مم ، ومسح دوراني 360 درجة ، ووقت مسح 4 دقائق22.
- قم بتخدير الفئران ب 3٪ من الأيزوفلوران قبل مسح23 (باتباع البروتوكولات المعتمدة مؤسسيا). افتح شاشة عرض التصوير المتوافق مع micro-CT وقم بتثبيت الفئران على سرير الأدوات بشريط لاصق. حافظ على التخدير بشكل مستمر باستخدام أنبوب أنفي معدي يوضع داخل أداة التصوير المقطعي المحوسب المجهري على سرير الأدوات.
- قم بتوجيه بعناية إلى الجهاز ومراقبة موقعه في الوقت الفعلي. استخدم الأزرار المناسبة لضبط موضع الماوس ، مما يضمن أن صدره مرئي تماما في مجال الرؤية.
- قم بتدوير طبقة الأدوات بزاوية 90 درجة لوضع الماوس. استخدم الأزرار لضبط موضع الماوس ، والتأكد من أن منطقة الرئة تقع في موقع مركزي داخل مجال الرؤية. ثم أعد سرير الأدوات إلى موضعه الأصلي.
- لبدء الفحص، حدد الزر Scan (مسح ضوئي ). اسمح للنظام بإكمال الفحص دون انقطاع ، وتجنب فتح شاشة العرض أثناء العملية. راقب الشرائح عبر المحور والإكليل والسهمي لإعادة الإعمار من خلال البرنامج.
- قم بتقييم جودة الصورة مباشرة بعد المسح الضوئي. إذا ظهرت عناصر أو صور ضبابية، كرر إجراء المسح.
- قم بإزالة الفئران من الجهاز ومراقبة صحتها للتأكد من أنها في حالة مستقرة قبل إعادتها إلى أقفاصها.
- في نهاية التجربة ، قم بإزالة الشريط اللاصق من سرير الأدوات ، ثم نظف السرير. احفظ البيانات وقم بإيقاف تشغيل الأداة.
- انقل الفئران مرة أخرى إلى أقفاصها برفق لتقليل التوتر. تأكد من أن الأقفاص نظيفة وبها فراش مناسب.
- راقب الفئران بحثا عن علامات التعافي من التخدير. راقب سلوكهم وحركتهم وشهيتهم. توفير الطعام والماء حسب الحاجة.
- الحفاظ على بيئة دافئة للفئران لمنع انخفاض حرارة الجسم بعد التخدير. استخدم وسادات التدفئة أو البطانيات إذا لزم الأمر.
- إجراء فحوصات صحية يومية للأسبوع المقبل. ابحث عن علامات الضيق أو السلوك غير العادي أو أي إصابات. توثيق الملاحظات لكل فأر.
- إذا ظهرت على أي فأر علامات المرض أو الضيق ، فاستشر الطبيب البيطري للحصول على التدخل والرعاية المناسبة.
- تأكد من إعادة الفئران إلى ظروف سكنها الطبيعية بعد أن تتعافى تماما وتكون مستقرة.
3. معالجة البيانات وتحليلها
- استخدم برامج الإحصائيات والرسوم البيانية كأداة قيمة لتحليل البيانات وإنشاء جداول لتقديم النتائج.
- افتح البرنامج. حدد الرسوم البيانية XY من جدول البيانات الذي تم إنشاؤه حديثا ، وأدخل البيانات الأسبوعية ل NNK ومجموعات التحكم ، وقم بإنشاء مخطط يعرض التغييرات في وزن الفئران.
- افتح البرنامج مرة أخرى ، وحدد مخطط الطوارئ من جدول البيانات الذي تم إنشاؤه حديثا ، وأدخل بيانات روتين الدم لمجموعة NNK ومجموعة التحكم ، وقم بإنشاء أيقونة.
- حدد خيارات التحليل في البرنامج. قم بتحليل البيانات الإجمالية باستخدام ANOVA أحادي الاتجاه ، متبوعا بالتحقق من البيانات من خلال تنفيذ اختبار t. ضع علامة على الاختلافات الكبيرة.
- احفظ بيانات التصوير المقطعي المحوسب الصغير بتنسيق SimpleViewer أو DICOM. افتح برنامج SimpleViewer ، وراقب بيانات التصوير تحت إشراف طبيب تصوير محترف. قم بتسمية العقيدات وتحديد حجم الظل باستخدام أدوات القياس المتوفرة.
النتائج
أظهرت هذه الدراسة بناء نموذج مستقر لسرطان الرئة باستخدام NNK بالاشتراك مع الفئران A / J. ويوضح التصميم التجريبي في الشكل 1. كان الهدف هو مراقبة العملية في الوقت الفعلي للانتقال من العقيدات الرئوية (PN) إلى سرطان الرئة (LC) في رئتي الفئران ، باستخدام أخذ عينات الدم من الوريد تحت الفك السفلي بالتصوير المقطعي المحوسب الدقيق. وفقا لذلك ، تم إجراء الفحص بالأشعة المصغرة وأخذ عينات الدم من رئتي الفأر في الأسابيع الرابع والعاشر والعشرين.
أظهرت النتائج التجريبية أن نهج النمذجة ل NNK بالاشتراك مع الفئران A / J يحاكي بشكل فعال العملية المرضية من PN إلى LC. أولا ، يمكن القول أن الاختبار المستخدم في هذه الدراسة لم يؤثر بشكل كبير على رفاهية التجارب. كما هو موضح في الشكل 2 ، لم تظهر أوزان جسم التجارب خلال فترة التغذية التي استمرت 20 أسبوعا اختلافات ملحوظة مقارنة بالمجموعة الضابطة. ثانيا ، كشفت نتائج اختبارات الدم الروتينية التي أجريت على عينات مأخوذة من التجربة عن زيادة كبيرة في عدد الكريات البيض والصفائح الدموية في المجموعة النموذجية ، بينما ظلت أعداد خلايا الدم الحمراء والهيموجلوبين دون تغيير (الشكل 3). يشير هذا إلى أن عملية التحول من PN إلى LC ترتبط أيضا بزيادة تدريجية في الالتهاب المزمن. الأهم من ذلك ، أن كلا من الفحص بالتصوير المقطعي المحوسب الدقيق وأخذ عينات الدم في الوريد تحت الفك السفلي لم يضر بوظيفة المكونة للدم لحيوانات التجارب ، بما يتفق مع نتائج العديد من الدراسات السابقة. بالإضافة إلى ذلك ، كشفت المراقبة الدقيقة للسلوك وحالة المعطف والتنفس والنظام الغذائي وتناول الماء لحيوانات التجربة طوال الدراسة عن عدم وجود تشوهات.
بعد الإعطاء الأولي ل NNK لحيوانات التجارب ، أجرينا الفحص المحظوذ للرئتين في اليوم الأول من الأسابيع الرابع والعاشر والعشرين24. أشارت النتائج إلى أنه بالمقارنة مع المجموعة الضابطة ، أظهر نسيج الرئة للمجموعة النموذجية سماكة تدريجية. بحلولالأسبوع العاشر ، كان من الممكن ملاحظة تكوين البؤر العقدية الدقيقة ، وبحلولالأسبوع العشرين ، تطورت العقيدات إلى بؤر ظل يمكن تمييزها. في ضوء هذه النتائج ، يمكن افتراض أن تكوين بؤر الظل في الرئتين يرتبط بالالتهاب المزمن الناجم عن NNK25. ومع ذلك ، نظرا لأن هذه الدراسة مصممة لمراقبة التطور الآمن والفعال وغير الضار ل PN إلى LC دون إشراك دراسات مرضية على ، يجب إجراء الدراسات اللاحقة وفقا لبروتوكولات تجريبيةمحددة 26. يوضح الشكل 4 التغيرات في تصوير الرئة التي لوحظت في التجارب في الأسابيع 4 و 10 و 20.

الشكل 1: التصميم التجريبي لعلاج NNK في الفئران A / J. تم حقن خمس فئران من الإناث A / J بمركب NNK في نقطة زمنية واحدة ، بينما تم حقن خمسة أخرى بالمحلول الملحي كعنصر تحكم. تم جمع عينات الدم في الأسابيع 4 و 10 و 20 باستخدام فحوصات التصوير المقطعي المحوسب الدقيقة لرئتي الفأر وجمع الدم في الوريد تحت الفك العلوي. تم التحقق من صحة البيانات التي تم الحصول عليها لتقييم تطور المرض في الفئران. (أ) لمحة عامة عن التصميم التجريبي. (ب) رسم تخطيطي لأخذ عينات دم الشريان تحت الفك العلوي. (ج) تمثيل تخطيطي لإعداد التصوير المصغر بالتصوير المقطعي المحوسب، يظهر الماوس الموضوع على فراش (الأزرق) والإطار الأصفر كمعين المنظر، والذي يجب أن يغطي أنسجة رئة الماوس بالكامل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تغيرات الوزن في الفئران على مدى 20 أسبوعا. أشارت اتجاهات الوزن إلى أن علاج NNK في الفئران A / J لم يقلل بشكل كبير من وزن الجسم. قد يسبب الفحص المصغر بالتصوير المقطعي المحوسب واستخراج الدم في الوريد تحت الفك العلوي بعض الضغط على الفئران. ومع ذلك ، تعافوا بسرعة. يتم التعبير عن البيانات كمتوسط ± SEM ، (ن = 5). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
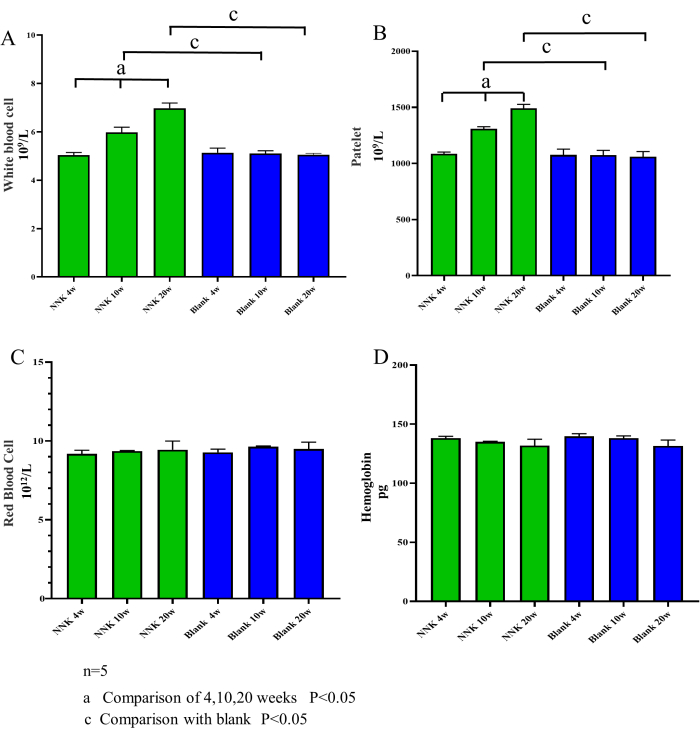
الشكل 3: تعداد خلايا الدم بمرور الوقت. تم قياس محتويات خلايا الدم البيضاء والصفائح الدموية وخلايا الدم الحمراء والهيموجلوبين في الفئران في الأسابيع 4 و 10 و 20. بالمقارنة مع المجموعة الضابطة ، أظهرت مجموعة NNK اتجاها متزايدا في عدد خلايا الدم البيضاء والصفائح الدموية ، بينما لم تتغير مستويات الهيموجلوبين وخلايا الدم الحمراء بشكل كبير. تشير هذه النتائج إلى أن عملية تحويل PN-LC مرتبطة بزيادة الالتهاب وأن طريقة جمع الدم في الوريد تحت الفك العلوي ، التي يتم إجراؤها على فترات تزيد عن 4 أسابيع ، لا تسبب عدوى أو تلفا لوظيفة المكونة للدم في الفئران. (أ) خلايا الدم البيضاء. (ب) الصفائح الدموية. (ج) خلايا الدم الحمراء. (د) الهيموجلوبين. يتم التعبير عن البيانات كمتوسط ± SEM ، (ن = 5). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
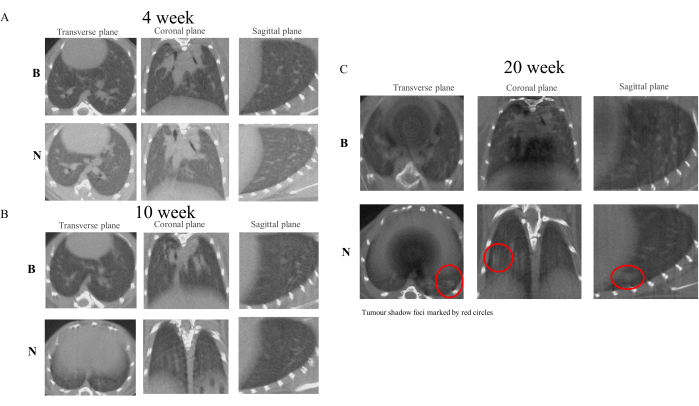
الشكل 4: صور الفحص بالأشعة المقطعية الدقيقة للفئران في الأسابيع 4 و 10 و 20. تظهر نتائج التصوير المصغر بالأشعة المناوية أن علاج NNK في الفئران A / J يحاكي بشكل فعال عملية تحويل PN-LC. بالمقارنة مع المجموعة الضابطة ، بدأت مجموعة NNK في إظهار خصائص سماكة وتغيير الملمس في صور الرئة بحلول الأسبوع 10. في الأسبوع 20 ، كان من الممكن تمييز بؤر الظل القوية داخل أنسجة الرئة. (أ) صور من الأسبوع 4. (ب) صور من الأسبوع 10. (ج) صور من الأسبوع 20. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
من المهم إعادة التأكيد على عدة نقاط رئيسية من هذه الدراسة. أولا ، على الرغم من أن جمع الدم في الوريد تحت الفك السفلي هو إجراء منخفض الإصابات نسبيا ، إلا أنه قد يؤدي إلى درجة معينة من الضرر للحيوانات. لذلك ، من الضروري إجراء إجراءات متعددة لتقليل العبء على الفئران وإكمال العملية في الوقت المناسب27. ثانيا ، تضمن إزالة الشعر قبل جمع عينات الدم نقاء العينة. ثالثا ، من الضروري استخدام الأوعية المناسبة لجمع الدم. في هذه الدراسة ، تم استخدام أوعية تجميع الدم المحتوية على EDTA لاختبارات الدم الروتينية. إذا تم استخدام المصل ، فستكون هناك حاجة إلى أوعية مصممة خصيصا لجمع الدم النقي28. رابعا ، جميع التخدير لديها مستوى معين من الفتاك. وبالتالي ، فإن تقليل وقت التخدير والتصوير يمكن أن يحمي صحة الفئران بشكل فعال. خامسا ، نظرا لأن التصوير المقطعي المحوسب الصغير يمكنه مراقبة مجموعة متنوعة من الأنسجة والأعضاء ، يمكن الرجوع إلى إعدادات المعلمات المحددة في برنامج التصوير المقطعي المحوسب الصغير المستخدم أثناء تصوير PN من هذه الدراسة ولكنها قد لا تنطبق على الأنسجة الأخرى29،30.
كانت الدراسات السابقة أكثر ميلا إلى القتل الرحيم للحيوانات في نقاط زمنية محددة وفحص عملية تحول العقيدات الرئوية من خلال التلوين المرضي31. أدى هذا النهج إلى عدد كبير من الوفيات بين التجارب وأعاق تتبع تغيرات الرئة في الوقت الفعلي. بالمقارنة مع التقنيات التقليدية ، توفر أخذ عينات الدم تحت الفك السفلي والتصوير المقطعي المحوسب الدقيق العديد من المزايا ، بما في ذلك الحد الأدنى من الضرر ، والمراقبة في الوقت الفعلي ، والتشغيل البديهي ، وتعدد الاستخدامات. في هذه الدراسة ، تم اختيار جمع الدم تحت الفك السفلي كطريقة مفضلة للحصول على عينات الدم للاختبارات الروتينية32. علاوة على ذلك ، يمكن استخدام الدم في التحليلات الكيميائية الحيوية للبروتين والمصل والدوائية والدم.
وبالمثل ، تم استخدام التصوير المقطعي المحوسب الصغير في هذه الدراسة لمراقبة النمو الديناميكي ل PN في الفئران التجريبية دون الحاجة إلى القتل الرحيم لها. يسهل هذا النهج تقييما أكثر سهولة ودقة للتأثير المثبط للدواء على PN مع تقليل عدد المطلوبة للتجربة بشكل كبير ، وبالتالي تعزيز دقة النتائج التجريبية. والجدير بالذكر أن الجمع بين هاتين التقنيتين يسمح بالتتبع الشامل لعمليات تكوين العقيدات وتطورها وتكاثرها في التجارب ، بالإضافة إلى توطين التعديلات في الأهداف الرئيسية (مثل TNF-α)33. يقدم هذا مفهوما فريدا لهذا البحث عن PN وحتى سرطان الرئة.
ومع ذلك، فإن العديد من القضايا تتطلب مزيدا من الدراسة لتحسين جودة البحوث المستقبلية. بالنظر إلى الفترة التجريبية الطويلة المطلوبة للنموذج الحيواني ل NNK جنبا إلى جنب مع الفئران A / J ، من الضروري إجراء حقن الأدوية المبكر بأقصى قدر من الدقة34. ثانيا ، تتضمن الطريقة القياسية لإنتاج سرطان الرئة الغدي في الفئران NNK بالتنسيق مع إناث الفئران A / J ، مع الآلية الأساسية المرتبطة بالاستراديول. لذلك ، من الضروري النظر في آليات عمل الأدوية العلاجية المعنية35. بالإضافة إلى ذلك ، لم يتم استخدام التصوير المقطعي المحوسب الدقيق لتحديد طبيعة بؤر الظل ، مما استلزم استخدام تلطيخ الهيماتوكسيلين وتلوين التألق ، والتي لا تزال تتطلب القتل الرحيم للفئران للحصول على عينات من أنسجة الرئة. أخيرا ، على الرغم من أن التصوير المقطعي المحوسب الصغير يتمتع بميزة التعرض المنخفض للإشعاع ، إلا أنه لا يزال بإمكانه التسبب في بعض الضرر لجسم الإنسان ، مما يستلزم تجنب القرب من أفراد غيرمرتبطين 36. لمعالجة هذه المشكلات ، يمكن تحقيق التمايز ووضع العلامات على مختلف الأنسجة والممرات الهوائية والأوعية الدموية بشكل فعال من خلال حقن عامل تباين في وريد الذيل. علاوة على ذلك ، يمكن استخدام التصوير المقطعي المحوسب المجهري جنبا إلى جنب مع أدوية المواد الجديدة (مثل الجسيمات النانوية) لعلاج أكثر دقة. أخيرا ، تم دمج تقنية التصوير المقطعي المحوسب الدقيق تدريجيا مع علم الأمراض ، مثل الأنسجة المكانية والتصويرية ، لتتبع التغيرات في العقيدات الرئوية بشكل أكثر ديناميكية36،37.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
نشكر البروفيسور كونغ هوانغ من كلية العلوم الطبية الأساسية والبروفيسور يان هوانغ من كلية الصيدلة بجامعة تشنغدو للطب الصيني التقليدي على دعمهم. نود أيضا أن نشكر الدكتور بينجي شو والدكتور بينغمي قوه. (المعهد المبتكر للطب الصيني والصيدلة ، تشنغدو
جامعة الطب الصيني التقليدي) لتوفير الأدوات والدعم الفني.
Materials
| Name | Company | Catalog Number | Comments |
| A/J mice | GemPharmatech LLC. | N000018 | |
| 0.5 mL EDTA tubes | Labshark | 130201070 | |
| 1-Butanone,4-(methylnitrosoamino)-1-(3-pyridinyl) | Gu Shi Gong Yuan Medical Equipment Co. | N589770 | |
| 75% ethanol | ChengDu Chron Chemicals Co,.Ltd | 2023052901 | |
| Animal shaver | Codos | BM010220 | |
| Isoflurane | Shenzhen Reward Life Technology Co. | R510-22-16 | |
| medical tricorder | MedChemexpress | 69652 | |
| Quantum GX2 microCT imaging system | PerkinElme | 2020166501 | |
| Saline (medicine) | Beijing Biolabs Technology Co. | GL1736 |
References
- Sung, H., et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
- Baum, P., et al. Incidental pulmonary nodules: Differential diagnosis and clinical management. Dtsch Arztebl Int. , (2024).
- Ajani, J. A., et al. Gastric cancer, version 2.2022, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 20 (2), 167-192 (2022).
- Kondo, K. K., et al. Lung cancer diagnosis and mortality beyond 15 years since quit in individuals with a 20+ pack-year history: A systematic review. CA Cancer J Clin. 74 (1), 84-114 (2024).
- Ray, E., et al. Inhalable chitosan-coated nano-assemblies potentiate niclosamide for targeted abrogation of non-small-cell lung cancer through dual modulation of autophagy and apoptosis. Int J Biol Macromol. 279 (Pt 4), 135411 (2024).
- Ali, N. A., et al. Chia seed (Salvia hispanica) attenuates chemically induced lung carcinomas in rats through suppression of proliferation and angiogenesis. Pharmaceuticals (Basel). 17 (9), 1129 (2024).
- Kiran, A., Kumari, G. K., Krishnamurthy, P. T. Preliminary evaluation of anticancer efficacy of pioglitazone combined with celecoxib for the treatment of non-small cell lung cancer. Invest New Drugs. 40 (1), 1-9 (2022).
- Marshall, K., Twum, Y., Gao, W. Proteome derangement in malignant epithelial cells and its stroma following exposure to 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone. Arch Toxicol. 97 (3), 711-720 (2023).
- Li, B., et al. LNCRNA XIST modulates miR-328-3p ectopic expression in lung injury induced by tobacco-specific lung carcinogen NNK both in vitro and in vivo. Br J Pharmacol. 181 (15), 2509-2527 (2024).
- Liang, F., et al. Tobacco carcinogen induces tryptophan metabolism and immune suppression via induction of indoleamine 2,3-dioxygenase 1. Signal Transduct Target Ther. 7 (1), 311 (2022).
- Ding, R., et al. The effect of immunotherapy PD-1 blockade on acute bone cancer pain: Insights from transcriptomic and microbiomic profiling. Int Immunopharmacol. 142 (Pt A), 113100 (2024).
- Kayı Cangır, A., et al. Microcomputed tomography as a diagnostic tool for detection of lymph node metastasis in non-small cell lung cancer: A decision-support approach for pathological examination "a pilot study for method validation"). J Pathol Inform. 15, 100373 (2024).
- Packialakshmi, B., et al. A clinically-relevant mouse model that displays hemorrhage exacerbates tourniquet-induced acute kidney injury. Front Physiol. 14, 1240352 (2023).
- Sørensen, D. B., et al. Time-dependent pathologic and inflammatory consequences of various blood sampling techniques in mice. J Am Assoc Lab Anim Sci. 58 (3), 362-372 (2019).
- Wu, G. L., Li, T. Y., Pu, X. H., Yu, G. Y. Effect of prescriptions replenishing vital essence, tonifying qi and activating blood on TNF-alpha, IL-1beta expressions in serum and submaxillary gland of nod mice with Sjogren's syndrome. Zhongguo Zhong Yao Za Zhi. 38 (3), 413-416 (2013).
- Schroeder, J. A., et al. Thromboelastometry assessment of hemostatic properties in various murine models with coagulopathy and the effect of factor VIII therapeutics. J Thromb Haemost. 19 (10), 2417-2427 (2021).
- Guo, K., et al. Integration of microbiomics, metabolomics, and transcriptomics reveals the therapeutic mechanism underlying Fuzheng-Qushi decoction for the treatment of lipopolysaccharide-induced lung injury in mice. J Ethnopharmacol. 334, 118584 (2024).
- Luo, T., Zhang, S., Li, X., Huang, M. Challenges in the differential diagnosis of pulmonary tuberculosis vs. lung cancer: A case report. Oncol Lett. 28 (4), 494 (2024).
- Mascalchi, M., et al. Large cell carcinoma of the lung: LDCT features and survival in screen-detected cases. Eur J Radiol. 179, 111679 (2024).
- Peng, M., et al. P27 specifically decreases in squamous carcinoma and mediates NNK-induced transformation of human bronchial epithelial cells. J Cell Mol Med. 28 (15), e18577 (2024).
- Jang, H. J., et al. Tobacco-induced hyperglycemia promotes lung cancer progression via cancer cell-macrophage interaction through paracrine IGF2/IR/NPM1-driven PD-L1 expression. Nat Commun. 15 (1), 4909 (2024).
- Zhang, Y., et al. Curcumin analogue EF24 prevents alveolar epithelial cell senescence to ameliorate idiopathic pulmonary fibrosis via activation of PTEN. Phytomedicine. 133, 155882 (2024).
- Li, M., et al. Isoflurane anesthesia decreases excitability of inhibitory neurons in the basolateral amygdala leading to anxiety-like behavior in aged mice. Exp Ther Med. 28 (4), 399 (2024).
- Xiong, R., et al. Hypermethylation of the ADIRF promoter regulates its expression level and is involved in NNK-induced malignant transformation of lung bronchial epithelial cells. Arch Toxicol. 97 (12), 3243-3258 (2023).
- Shaikh, Z. M., et al. Thearubigins/polymeric black tea polyphenols (PBPs) do not prevent benzo[a]pyrene (B[a]P) induced lung tumors in A/J mice. Am J Transl Res. 15 (9), 5826-5834 (2023).
- Li, M. Y., et al. Targeting CD36 determines nicotine derivative NNK-induced lung adenocarcinoma carcinogenesis. iScience. 26 (8), 107477 (2023).
- Arlt, E., et al. A flow cytometry-based examination of the mouse white blood cell differential in the context of age and sex. Cells. 13 (18), 1583 (2024).
- Su, Z., et al. Feasibility of using serum, plasma, and platelet 5-hydroxytryptamine as peripheral biomarker for the depression diagnosis and response evaluation to antidepressants: Animal experimental study. Clin Psychopharmacol Neurosci. 22 (4), 594-609 (2024).
- Zhou, X., et al. Mechanosensitive lncRNA H19 promotes chondrocyte autophagy, but not pyroptosis, by targeting miR-148a in post-traumatic osteoarthritis. Noncoding RNA Res. 10, 163-176 (2025).
- Chen, C., et al. Cardamonin attenuates iron overload-induced osteoblast oxidative stress through the HIF-1α/ROS pathway. Int Immunopharmacol. 142 (Pt A), 112893 (2024).
- Yan, F., et al. Hypoxia promotes non-small cell lung cancer cell stemness, migration, and invasion via promoting glycolysis by lactylation of SOX9. Cancer Biol Ther. 25 (1), 2304161 (2024).
- Inoue, S., et al. Utility of ultrasound imaging in monitoring fracture healing in rat femur: Comparison with other imaging modalities. Bone Rep. 23, 101807 (2024).
- An, Y., et al. Quercetin through miR-147-5p/CLIP3 axis reducing Th17 cell differentiation to alleviate periodontitis. Regen Ther. 27, 496-505 (2024).
- Tian, J., et al. Diallyl disulfide blocks cigarette carcinogen 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone-induced lung tumorigenesis via activation of the Nrf2 antioxidant system and suppression of NF-κB inflammatory response. J Agric Food Chem. 71 (46), 17763-17774 (2023).
- Han, L., et al. Wutou decoction alleviates arthritis inflammation in CIA mice by regulating Treg cell stability and Treg/Th17 balance via the JAK2/STAT3 pathway. J Ethnopharmacol. 334, 118463 (2024).
- Napieczyńska, H., et al. µCT imaging of a multi-organ vascular fingerprint in rats. PLoS One. 19 (10), e0308601 (2024).
- Liu, H., et al. Using broadly targeted plant metabolomics technology combined with network pharmacology to explore the mechanism of action of the Yishen Gushu formula in the treatment of postmenopausal osteoporosis in vivo. J Ethnopharmacol. 333, 118469 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved