Method Article
Überwachung des Fortschreitens der Lungenknoten mittels Mikrocomputertomographie und Blutentnahme im Mausmodell
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine effiziente, einfache und minimalinvasive Methode zur Untersuchung von Lungenknoten. Als Untersuchungstechniken kommen die Blutentnahme aus der Unterkiefervene und die Mikro-CT-Bildgebung zum Einsatz.
Zusammenfassung
Die Mikro-Computertomographie (Mikro-CT) ist eine intuitive, empfindliche und minimal-invasive Echtzeittechnik zur Überwachung von Veränderungen von Lungenknoten (PN) bis Lungenkrebs (LC). Die Integration der Blutentnahme aus der submandibulären Vene ermöglicht eine schnelle, stabile und unkomplizierte Detektion der Bildgebung und wichtiger Zielveränderungen während des Fortschreitens von PN zu LC. In dieser Studie verabreichten wir A/J-Mäusen eine Dosierung von 100 mg/kg 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanon, um ein Lungenadenokarzinommodell zu entwickeln. Das Fortschreiten der Erkrankung bei den Versuchstieren wurde dann durch Blutproben aus der submandibulären Vene und einen Mikro-CT-Assay überwacht. Experimentelle Ergebnisse zeigten das Vorhandensein von knotigen Herden in der Lunge einiger Tiere in der 10. Woche, wobei die Entwicklung von Lungenadenokarzinombildern in der 21. Woche offensichtlich wurde. Zusammenfassend lässt sich sagen, dass die Mikro-CT pathologische Veränderungen in der Lunge von Mäusen effektiv beobachten und in Kombination mit der Blutentnahme aus der Submandibulavene Veränderungen des Blutes, des Proteins und der Ziele dynamisch überwachen kann. Diese Methode bietet einen hochspezifischen, einfachen und sensitiven Ansatz für Wirkstoffscreenings, pharmakokinetische Tests, toxikologische Experimente und Sicherheitsstudien.
Einleitung
Lungenkrebs (LC) ist eine schwere Neubildung, die ihren Ursprung in der Bronchialschleimhaut oder den Lungendrüsen hat. Laut Statistik aus dem Jahr 2021 verursacht LC jedes Jahr weltweit etwa zwei Millionen Todesfälle, wobei die Inzidenz- und Sterblichkeitsraten steigen1. Eine frühzeitige Diagnose und Intervention bei LC tragen zu höheren Heilungsraten, einer geringeren Mortalität und niedrigeren Behandlungskosten bei. Lungenknoten (PN) sind spezifische Vorläufer der LC, die bei radiologischen Untersuchungen durch lokalisierte, runde und dichtere feste oder subsolide Schatten ≤30 mm Durchmesser gekennzeichnet sind, ohne Hinweise auf einen Lungenkollaps, eine mediastinale Lymphknotenvergrößerung oder einen Pleuraerguss2. Das National Comprehensive Cancer Network (NCCN) kategorisierte PN im Jahr 2022 nach Anzahl, Durchmesser und Dichte und identifizierte Kombinationen wie einen 5 mm isolierten Milchglasknoten in der rechten Lunge3. Die NCCN-Leitlinien weisen jedoch darauf hin, dass das Risiko für Malignität bei PN mit dem Durchmesser und der Menge der Knötchen steigt. Die weit verbreitete Anwendung der Niedrigdosis-Computertomographie hat die Zahl der PN-Diagnosen drastisch erhöht, wobei jedes Jahr Millionen neuer Fälle identifiziert werden4.
Die Kombination von A/J-Mäusen mit 4-(Methylnitrosamino)-1-(3-pyridyl)-1-butanon (NNK) ist das am häufigsten verwendete Tiermodell für Lungenkrebs (LC)5,6. Der Einsatz von Mikro-CT zusammen mit der Blutentnahme aus der Submandibula-Vene ist ein effektiver Ansatz für die Echtzeitüberwachung von Veränderungen von Lungenknoten (PN) zu LC. Die chemische Karzinogen-Induktion, insbesondere bei NNK- und A/J-Mäusen, ist die am weitesten verbreitete Methode zur Modellierung von Lungenkrebs und hat sich als wirksamer Ansatz zur Etablierung von Karzinomen in situ erwiesen 7,8. Diese Modellierungsmethode simuliert den Verlauf von PN zu LC genauer als die axilläre Inokulationsmethode.
Frühere Studien konzentrierten sich auf die statistische Analyse der Knötchenmorphologie und die pathologische Färbung von Gewebeproben nach der Euthanasie9. Diesen Methoden fehlt jedoch die Fähigkeit, den dynamischen Verlauf von PN zu LC10 in Echtzeit zu überwachen. Die Mikro-CT als nicht-invasive Bildgebungstechnik liefert genaue Längsschnittdaten mit hoher Auflösung, schneller Bildgebung, geringer Strahlendosis und Sicherheit und eignet sich daher für die Detektion von Lungenbildern in Echtzeit 11,12. Die Blutentnahme aus der Submandibula-Vene ist die neueste, einfachste und schnellste Methode zur Entnahme von Blutproben von Mäusen13. Diese nicht-invasive Technik erfordert nur minimalen Umgang mit den Tieren und ermöglicht eine schnelle Genesung, im Einklang mit den 3R-Prinzipien, die darauf abzielen, die Anzahl der in der Forschung verwendeten Tiere zu reduzieren, Beschwerden zu minimieren und eine ethische Behandlung zu fördern. Das entnommene Blutvolumen, etwa 0,2-0,5 ml, ist ausreichend für die Überwachung von Blutparametern bei moderaten Anforderungen14.
Die gleichzeitige Verwendung von Mikro-CT und Blutproben aus der submandibulären Vene ermöglicht eine dynamische Echtzeit-Beobachtung der PN-zu-LC-Progression in der Bildgebung und die Echtzeit-Erkennung wichtiger Ziele im Blutkreislauf15. Darüber hinaus ermöglicht dieser Ansatz die Echtzeituntersuchung von Metaboliten und anderen Biochemikalien, was in Kombination mit Techniken wie der Hochleistungschromatographie unser Verständnis von LC16,17 erweitert.
In dieser Studie wurden A/J-Mäuse in Kombination mit NNK verwendet, um ein in-situ-Lungenkrebs-Mausmodell zu erstellen. Mikro-CT-Scans wurden 4, 10 und 20 Wochen nach der Modelleinleitung durchgeführt, um Lungenbilder aufzunehmen, während während des gesamten Experiments Blutproben aus submandibulären Venen entnommen wurden. Ziel dieser Studie ist es, eine Grundlage für die PN- und LC-Forschung zu schaffen, indem die Blutentnahme aus der Submandibulärvene mit der Mikro-CT kombiniert wird.
In der Onkologie ist die Mikro-CT ein hochwirksames Instrument zur Erkennung von Tumorwachstum und bietet eine hochauflösende Technik, um lokale Veränderungen des Schattenfokus jederzeit während solcher Studien zu messen18,19. Es ist jedoch wichtig zu erkennen, dass die Mikro-CT allein keine Informationen über die Eigenschaften des Schattenfokus, den physiologischen Status des Tieres oder das Ausmaß wichtiger biologischer Faktoren liefert. Daher wurde in dieser Studie die Probenahme der submandibulären Venen als ergänzende Methode eingesetzt.
Protokoll
Alle in dieser Studie beschriebenen Tierversuche wurden von der Ethikkommission für experimentellen Tierschutz der Chengdu Universität für Traditionelle Chinesische Medizin genehmigt und in Übereinstimmung mit den einschlägigen Gesetzen und ethischen Standards für Tierversuche durchgeführt (Prüfnummer: 2024035). Weibliche Inzucht-A/JGpt-Mäuse (7-8 Wochen alt) wurden bei einer Temperatur von 20-24 °C und einer relativen Luftfeuchtigkeit von 40%-70% gehalten. Sie erhielten in einem 12-stündigen Hell-Dunkel-Zyklus ad libitum Standard-Tierfutter und gereinigtes Wasser. Vor dem Experiment wurde jedes Tier 7 Tage lang an diese Umgebung gewöhnt. Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Reagenzien und Zubereitung der Tiere
- Chemikalien und Reagenzien
- NNK wird in Kochsalzlösung gelöst, um einen 10 mg/ml-Mastermix20 zu bilden. Verabreichen Sie eine einzelne intraperitoneale Injektion von 0,2 ml mit einer Konzentration von 100 mg/kg an die NNK-Gruppe, während Sie der Blindgruppe ein gleiches Volumen an normaler Kochsalzlösung zuführen.
HINWEIS: Befolgen Sie Jang et al.21 , um den Zeitpunkt für Mikro-CT-Scans und Blutentnahmen zu bestimmen.
- NNK wird in Kochsalzlösung gelöst, um einen 10 mg/ml-Mastermix20 zu bilden. Verabreichen Sie eine einzelne intraperitoneale Injektion von 0,2 ml mit einer Konzentration von 100 mg/kg an die NNK-Gruppe, während Sie der Blindgruppe ein gleiches Volumen an normaler Kochsalzlösung zuführen.
- Blutentnahme
HINWEIS: Um die Gesundheit der Mäuse zu gewährleisten, begrenzen Sie die Blutentnahme auf nicht mehr als 0,2 ml zu jedem Zeitpunkt und warten Sie eine Woche für die Genesung. Aufgrund des Überflusses an Haaren im submentalen Bereich ist darauf zu achten, dass die Blutprobe während der Entnahme nicht mit Haaren kontaminiert wird.- Entfernen Sie die Gesichtsbehaarung des Tieres am Tag vor dem Versuch mit einem geeigneten Rasierer.
- Fassen Sie die Haut an der hinteren Seite des Mauskopfes mit der linken Hand fest, um jede Bewegung zu verhindern und den Kopf der Maus in einer festen Position zu halten.
- Führen Sie die Blutentnahmenadel aus dem Unterkieferbereich hinter der schrägen Augenhöhle zügig in die Arteria submaxillaris ein. Halten Sie die Nadel mindestens 3 s lang an Ort und Stelle, um einen optimalen Blutfluss zu ermöglichen. Sammeln Sie 50-200 μl Blut.
- Sammle das Blut in ein EDTA-Röhrchen. Verwenden Sie ein Wattestäbchen, um sanften Druck auf die Haut auszuüben, um Blutungen zu stoppen. Sobald die Blutung aufgehört hat, lassen Sie die Maus los und beobachten Sie sie 30 s lang.
- Rühren Sie das Reagenzglas vorsichtig um, um sicherzustellen, dass das Blut gründlich mit dem Gerinnungsmittel vermischt ist.
- Geben Sie für routinemäßige Blutuntersuchungen das gesammelte Blut in das veterinärmedizinische Blutroutinetestgerät, drücken Sie die Entnahmetaste und lassen Sie das Instrument das Blut sammeln. Notieren Sie die angezeigten Ergebnisse. Entsorgen Sie das restliche Blut sicher.
2. In-vivo-Bildgebung mittels Mikro-CT
HINWEIS: Entfernen Sie immer Metallgegenstände, wie z. B. Ohrmarken, vom Versuchstier, bevor Sie den Mikro-CT-Scan verwenden. Metallobjekte können schwere Artefakte im Bild verursachen. Mikro-CT sendet eine bestimmte Menge an Strahlung aus; Stellen Sie sicher, dass andere Versuchsergebnisse nicht beeinflusst werden.
- Starten Sie das Gerät, starten Sie die Micro-CT-Software und führen Sie die Sondenkalibrierung und das Aufwärmen durch. Verwenden Sie zum Scannen das mausspezifische Werkzeugbett.
- Erstellen Sie eine neue Datenbank, und benennen Sie sie für diesen Scan, oder verbinden Sie sie mit einer vorhandenen Datenbank.
- Ändern Sie die Parameter im Software-Setup-Fenster. Stellen Sie den Röntgenfilter auf Cu0,06 + Al0,5 ein, mit einer Spannung von 70 kV, einem Strom von 80 μA, einem Sichtfeld von 36 mm × 36 mm, 360°-Rotationsabtastung und einer Scanzeit von 4 min22.
- Betäuben Sie die Mäuse mit 3 % Isofluran, bevor Sie23 scannen (gemäß institutionell anerkannten Protokollen). Öffnen Sie den Micro-CT-Bildschirm und befestigen Sie die Mäuse mit Klebeband auf dem Werkzeugbett. Halten Sie die Anästhesie kontinuierlich mit einer Nasensonde aufrecht, die im Mikro-CT-Instrument auf dem Werkzeugbett platziert wird.
- Führen Sie das Tier vorsichtig in das Gerät und überwachen Sie seine Position in Echtzeit. Verwenden Sie die entsprechenden Tasten, um die Position der Maus anzupassen und sicherzustellen, dass ihre Brust im Sichtfeld vollständig sichtbar ist.
- Drehen Sie das Werkzeugbett um 90°, um die Maus zu positionieren. Verwenden Sie die Tasten, um die Position der Maus anzupassen, und stellen Sie sicher, dass sich die Lungenregion mittig im Sichtfeld befindet. Bringen Sie dann das Werkzeugbett wieder in seine ursprüngliche Position.
- Um den Scan zu starten, wählen Sie die Schaltfläche Scannen . Lassen Sie das System den Scan ohne Unterbrechung abschließen, und vermeiden Sie es, den Bildschirm während des Vorgangs zu öffnen. Beobachten Sie die transaxialen, koronalen und sagittalen Schnitte der Rekonstruktion mit der Software.
- Bewerten Sie die Bildqualität unmittelbar nach dem Scan. Wenn Artefakte oder verschwommene Bilder angezeigt werden, wiederholen Sie den Scanvorgang.
- Nehmen Sie die Mäuse aus dem Gerät und überwachen Sie ihren Gesundheitszustand, um sicherzustellen, dass sie in stabilem Zustand sind, bevor Sie sie in ihre Käfige zurückbringen.
- Entfernen Sie am Ende des Experiments das Klebeband vom Werkzeugbett und reinigen Sie dann das Bett. Speichern Sie die Daten und schalten Sie das Gerät aus.
- Bringen Sie die Mäuse vorsichtig zurück in ihre Käfige, um Stress zu minimieren. Stellen Sie sicher, dass die Käfige sauber sind und eine angemessene Einstreu haben.
- Überwachen Sie die Mäuse auf Anzeichen einer Genesung nach der Narkose. Beobachte ihr Verhalten, ihre Mobilität und ihren Appetit. Stellen Sie bei Bedarf Futter und Wasser bereit.
- Halten Sie eine warme Umgebung für die Mäuse aufrecht, um eine Unterkühlung nach der Anästhesie zu verhindern. Verwenden Sie bei Bedarf Heizkissen oder Decken.
- Führen Sie in der nächsten Woche tägliche Gesundheitschecks durch. Achte auf Anzeichen von Stress, ungewöhnlichem Verhalten oder Verletzungen. Dokumentieren Sie Beobachtungen für jede Maus.
- Wenn eine Maus Anzeichen von Krankheit oder Stress zeigt, konsultieren Sie einen Tierarzt, um geeignete Interventionen und Behandlungen zu erhalten.
- Stellen Sie sicher, dass die Mäuse wieder in ihre normalen Haltungsbedingungen zurückkehren, nachdem sie sich vollständig erholt haben und stabil sind.
3. Datenverarbeitung und -analyse
- Verwenden Sie Statistik- und Grafiksoftware als wertvolles Werkzeug für die Datenanalyse und die Erstellung von Tabellen zur Präsentation der Ergebnisse.
- Öffnen Sie die Software. Wählen Sie XY-Diagramme aus der neu erstellten Datentabelle aus, geben Sie die wöchentlichen Daten für die NNK- und Kontrollgruppen ein und generieren Sie ein Diagramm, das die Änderungen des Gewichts der Mäuse anzeigt.
- Öffnen Sie die Software erneut, wählen Sie das Kontingenzdiagramm aus der neu erstellten Datentabelle aus, geben Sie die Blutroutinedaten für die NNK-Gruppe und die Kontrollgruppe ein und generieren Sie ein Symbol.
- Wählen Sie die Analyseoptionen in der Software aus. Analysieren Sie die Gesamtdaten mit einer unidirektionalen ANOVA, gefolgt von der Verifizierung der Daten durch die Implementierung eines t-Tests. Markieren Sie signifikante Unterschiede.
- Speichern Sie die Micro-CT-Daten im SimpleViewer-Format oder DICOM. Öffnen Sie die SimpleViewer-Software und beobachten Sie die Bilddaten unter Anleitung eines professionellen Arztes für Bildgebung. Beschriften Sie die Knötchen und quantifizieren Sie das Schattenvolumen mit den bereitgestellten Messwerkzeugen.
Ergebnisse
Diese Studie zeigte die Konstruktion eines stabilen Lungenkrebsmodells unter Verwendung von NNK in Kombination mit A/J-Mäusen. Das Versuchsdesign ist in Abbildung 1 dargestellt. Ziel war es, den Echtzeitprozess des Übergangs von Lungenknoten (PN) zu Lungenkrebs (LC) in der Lunge von Mäusen mit Hilfe von Mikro-CT und Blutproben aus der Submandibulärvene zu beobachten. Dementsprechend wurden in der vierten, zehnten und zwanzigsten Woche Mikro-CT-Scans und Blutproben aus der Lunge der Maus durchgeführt.
Die experimentellen Ergebnisse zeigten, dass der Modellierungsansatz von NNK in Verbindung mit A/J-Mäusen den pathologischen Prozess von PN zu LC effektiv nachahmte. Zunächst kann festgestellt werden, dass der in dieser Studie verwendete Assay keinen signifikanten Einfluss auf das Wohlbefinden der Versuchstiere hatte. Wie in Abbildung 2 dargestellt, zeigten die Körpergewichte der Versuchstiere über den 20-wöchigen Fütterungszeitraum keine nennenswerten Unterschiede im Vergleich zur Kontrollgruppe. Zweitens zeigten die Ergebnisse der routinemäßigen Blutuntersuchungen an Proben der Versuchstiere einen signifikanten Anstieg der Anzahl der Leukozyten und Blutplättchen in der Modellgruppe, während die Anzahl der roten Blutkörperchen und des Hämoglobins unverändert blieb (Abbildung 3). Dies deutet darauf hin, dass der Transformationsprozess von PN zu LC auch mit einer allmählichen Zunahme chronischer Entzündungen einhergeht. Wichtig ist, dass sowohl die Mikro-CT-Scans als auch die Blutentnahme aus der Unterkiefervene die hämatopoetische Funktion der Versuchstiere nicht beeinträchtigten, was mit den Ergebnissen zahlreicher früherer Studien übereinstimmt. Darüber hinaus ergab eine genaue Beobachtung des Verhaltens, des Fellzustands, der Atmung, der Ernährung und der Wasseraufnahme der Versuchstiere während der gesamten Studie keine Anomalien.
Nach der ersten Verabreichung von NNK an die Versuchstiere führten wir am ersten Tag der vierten, zehnten und zwanzigsten Woche Mikro-CT-Scans der Lunge durch24. Die Ergebnisse zeigten, dass die Lungentextur der Modellgruppe im Vergleich zur Kontrollgruppe eine allmähliche Verdickung aufwies. In der 10. Woche war die Bildung von winzigen Knotenherden zu beobachten, und in der 20. Woche hatten sich die Knötchen zu erkennbaren Schattenherden entwickelt. Vor dem Hintergrund dieser Befunde kann postuliert werden, dass die Bildung von Schattenherden in der Lunge mit der durch NNK25 induzierten chronischen Entzündung assoziiert ist. Da diese Studie jedoch darauf ausgelegt war, die sichere, effiziente und harmlose Entwicklung von PN zu LC zu beobachten, ohne pathologische Studien an Tieren zu umfassen, müssen nachfolgende Studien in Übereinstimmung mit spezifischen Versuchsprotokollen durchgeführt werden26. Abbildung 4 zeigt die Veränderungen in der Lungenbildgebung, die bei Versuchstieren in den Wochen 4, 10 und 20 beobachtet wurden.

Abbildung 1: Versuchsdesign für die NNK-Behandlung bei A/J-Mäusen. Fünf weiblichen A/J-Mäusen wurde die Substanz NNK zu einem einzigen Zeitpunkt injiziert, während weitere fünf als Kontrolle mit Kochsalzlösung injiziert wurden. Blutproben wurden in den Wochen 4, 10 und 20 mittels Mikro-CT-Scans der Mauslunge und der Blutentnahme aus der Unterkiefervene entnommen. Die erhaltenen Daten wurden kreuzvalidiert, um das Fortschreiten der Erkrankung bei den Mäusen zu bewerten. (A) Überblick über das Versuchsdesign. (B) Diagramm der Blutentnahme der Arteria submaxillar. (C) Schematische Darstellung des Mikro-CT-Bildgebungsaufbaus, der die Maus auf dem Tierbett (blau) und den gelben Rahmen als Sucher zeigt, der das Lungengewebe der Maus vollständig abdecken sollte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Gewichtsveränderungen bei Mäusen über 20 Wochen. Gewichtstrends deuteten darauf hin, dass die NNK-Behandlung bei A/J-Mäusen das Körpergewicht nicht signifikant reduzierte. Mikro-CT-Scans und Blutentnahme aus der Unterkiefervene können bei den Mäusen Stress verursachen. Sie erholten sich jedoch schnell. Die Daten werden als Mittelwert ± SEM ausgedrückt (n = 5). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
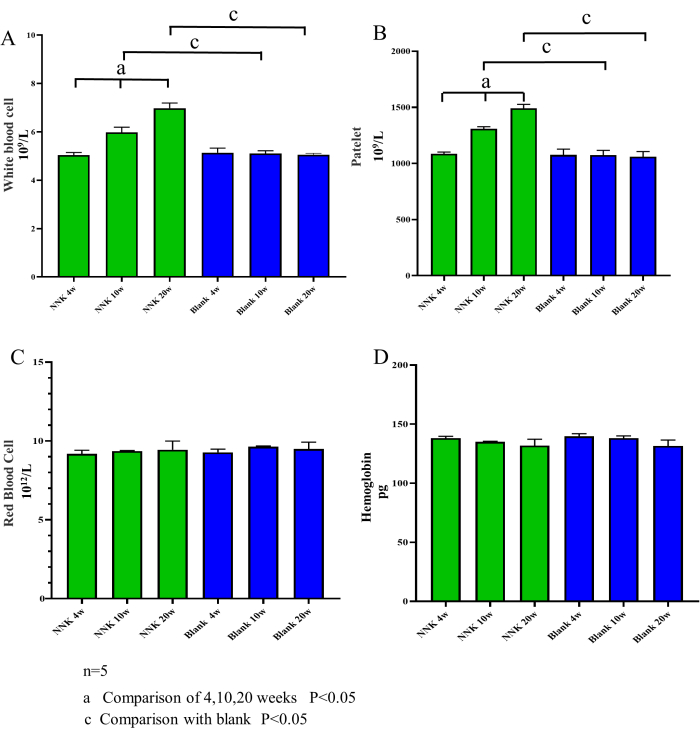
Abbildung 3: Anzahl der Blutzellen im Laufe der Zeit. Der Gehalt an weißen Blutkörperchen, Blutplättchen, roten Blutkörperchen und Hämoglobin wurde bei Mäusen in den Wochen 4, 10 und 20 gemessen. Im Vergleich zur Kontrollgruppe zeigte die NNK-Gruppe einen zunehmenden Trend in der Anzahl der weißen Blutkörperchen und Blutplättchen, während sich die Hämoglobin- und Erythrozytenspiegel nicht signifikant veränderten. Diese Befunde deuten darauf hin, dass der Transformationsprozess von PN-LC mit einer erhöhten Entzündung verbunden ist und dass die Blutentnahmemethode der Submaxillarvene, die in Abständen von mehr als 4 Wochen durchgeführt wird, bei Mäusen keine Infektion oder Schädigung der hämatopoetischen Funktion verursacht. (A) Weiße Blutkörperchen. (B) Blutplättchen. (C) Rote Blutkörperchen. (D) Hämoglobin. Die Daten werden als Mittelwert ± SEM ausgedrückt (n = 5). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
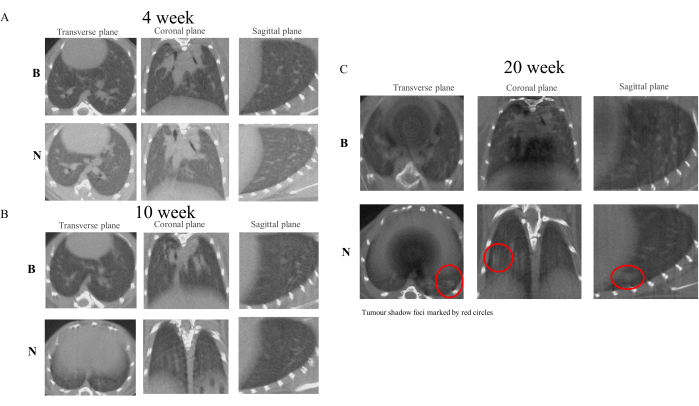
Abbildung 4: Mikro-CT-Scanbilder von Mäusen in den Wochen 4, 10 und 20. Die Ergebnisse der Mikro-CT-Bildgebung zeigen, dass die NNK-Behandlung bei A/J-Mäusen den Transformationsprozess von PN-LC effektiv simuliert. Im Vergleich zur Kontrollgruppe zeigte die NNK-Gruppe in Woche 10 Merkmale einer Verdickung und einer veränderten Textur in den Lungenbildern. In Woche 20 waren robuste Schattenherde im Lungengewebe erkennbar. (A) Bilder aus Woche 4. (B) Bilder aus Woche 10. (C) Bilder aus Woche 20. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Es ist wichtig, einige wichtige Punkte aus dieser Studie noch einmal zu wiederholen. Erstens, obwohl die Blutentnahme aus der Unterkiefervene ein relativ verletzungsarmes Verfahren ist, kann sie dennoch zu einem gewissen Grad an Schäden für die Tiere führen. Daher ist es notwendig, mehrere Verfahren durchzuführen, um die Belastung der Mäuse zu verringern und den Prozess rechtzeitig abzuschließen27. Zweitens stellt die Entfernung von Haaren vor der Blutentnahme die Reinheit der Probe sicher. Drittens ist es zwingend erforderlich, geeignete Blutentnahmegefäße zu verwenden. In der vorliegenden Studie wurden Blutentnahmegefäße, die EDTA enthielten, für routinemäßige Blutuntersuchungen eingesetzt. Wenn Serum verwendet werden sollte, wären Gefäße erforderlich, die speziell für die Entnahme von reinem Blut ausgelegt sind28. Viertens haben alle Anästhetika ein gewisses Maß an Letalität; So kann durch die Minimierung der Anästhesie- und Bildgebungszeit die Gesundheit der Mäuse effektiv geschützt werden. Fünftens, da die Mikro-CT eine Vielzahl von Geweben und Organen beobachten kann, können die spezifischen Parametereinstellungen in der Mikro-CT-Software, die während der PN-Bildgebung verwendet wird, aus dieser Studie referenziert werden, sind aber möglicherweise nicht auf andere Gewebe anwendbar29,30.
Frühere Studien neigten eher dazu, Tiere zu festen Zeitpunkten einzuschläfern und den Prozess der Lungenknotentransformation durch pathologische Färbung zu untersuchen31. Dieser Ansatz führte zu einer beträchtlichen Anzahl von Todesfällen bei Versuchstieren und behinderte die Echtzeit-Verfolgung von Lungenveränderungen. Im Vergleich zu herkömmlichen Techniken bieten die submandibuläre Blutentnahme und die Mikro-CT mehrere Vorteile, darunter minimale Schäden, Echtzeitüberwachung, intuitive Bedienung und Vielseitigkeit. In dieser Studie wurde die submandibuläre Blutentnahme als bevorzugte Methode zur Entnahme von Blutproben für Routineuntersuchungen gewählt32. Darüber hinaus kann das Blut für proteomische, serumpharmakologische und blutbiochemische Analysen verwendet werden.
In ähnlicher Weise wurde in dieser Studie Mikro-CT eingesetzt, um das dynamische Wachstum von PN bei Versuchsmäusen zu beobachten, ohne dass sie eingeschläfert werden mussten. Dieser Ansatz ermöglicht eine intuitivere und genauere Bewertung der hemmenden Wirkung des Medikaments auf PN bei gleichzeitiger erheblicher Reduzierung der Anzahl der für das Experiment erforderlichen Tiere, wodurch die Genauigkeit der experimentellen Ergebnisse erhöht wird. Insbesondere ermöglicht die Kombination dieser beiden Technologien eine umfassende Verfolgung der Prozesse der Knöllchenbildung, -entwicklung und -karzinogenese bei Versuchstieren sowie die Lokalisierung von Veränderungen in Schlüsselzielen (wie TNF-α)33. Dies stellt ein einzigartiges Konzept für diese Forschung an PN und sogar Lungenkrebs dar.
Nichtsdestotrotz bedürfen mehrere Aspekte weiterer Überlegungen, um die Qualität künftiger Forschung zu verbessern. Angesichts der langen Versuchszeit, die für das Tiermodell von NNK in Kombination mit A/J-Mäusen erforderlich ist, ist es zwingend erforderlich, dass frühe Medikamenteninjektionen mit äußerster Präzision durchgeführt werden34. Zweitens beinhaltet die Standardmethode zur Erzeugung von Lungenadenokarzinomen bei Mäusen NNK in Koordination mit weiblichen A/J-Mäusen, wobei der zugrunde liegende Mechanismus mit Östradiol verbunden ist. Daher ist es wichtig, die spezifischen Wirkmechanismen der beteiligten therapeutischen Arzneimittel zu berücksichtigen35. Darüber hinaus wurde die Mikro-CT nicht verwendet, um die Art der Schattenherde zu bestimmen, was die Verwendung von Hämatoxylin-Färbung und Fluoreszenzfärbung erforderlich machte, die immer noch eine Euthanasierung der Mäuse erfordert, um Lungengewebeproben zu erhalten. Obwohl die Mikro-CT den Vorteil einer geringen Strahlenbelastung hat, kann sie dennoch gewisse Schäden am menschlichen Körper verursachen, so dass die Nähe zu nicht verwandten Personen vermieden werden muss36. Um diese Probleme zu lösen, kann die Differenzierung und Markierung verschiedener Gewebe, Atemwege und Blutgefäße durch Injektion eines Kontrastmittels in die Schwanzvene effektiv erreicht werden. Darüber hinaus kann die Mikro-CT in Kombination mit neuartigen materiellen Medikamenten (z. B. Nanopartikeln) für eine präzisere Behandlung eingesetzt werden. Schließlich wurde die Mikro-CT-Technologie nach und nach in die Pathologie, wie z. B. die räumliche und bildgebende Histologie, integriert, um Veränderungen der Lungenknoten dynamischer zu verfolgen36,37.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir danken Professor Cong Huang von der School of Basic Medical Sciences und Professor Yan Huang von der School of Pharmacy der Chengdu University of Traditional Chinese Medicine für ihre Unterstützung. Wir möchten uns auch bei Dr. Binjie Xu und Dr. Pengmei Guo bedanken. (Innovatives Institut für Chinesische Medizin und Pharmazie, Chengdu
Universität für Traditionelle Chinesische Medizin) für die Bereitstellung von Instrumenten und technischem Support.
Materialien
| Name | Company | Catalog Number | Comments |
| A/J mice | GemPharmatech LLC. | N000018 | |
| 0.5 mL EDTA tubes | Labshark | 130201070 | |
| 1-Butanone,4-(methylnitrosoamino)-1-(3-pyridinyl) | Gu Shi Gong Yuan Medical Equipment Co. | N589770 | |
| 75% ethanol | ChengDu Chron Chemicals Co,.Ltd | 2023052901 | |
| Animal shaver | Codos | BM010220 | |
| Isoflurane | Shenzhen Reward Life Technology Co. | R510-22-16 | |
| medical tricorder | MedChemexpress | 69652 | |
| Quantum GX2 microCT imaging system | PerkinElme | 2020166501 | |
| Saline (medicine) | Beijing Biolabs Technology Co. | GL1736 |
Referenzen
- Sung, H., et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
- Baum, P., et al. Incidental pulmonary nodules: Differential diagnosis and clinical management. Dtsch Arztebl Int. , (2024).
- Ajani, J. A., et al. Gastric cancer, version 2.2022, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 20 (2), 167-192 (2022).
- Kondo, K. K., et al. Lung cancer diagnosis and mortality beyond 15 years since quit in individuals with a 20+ pack-year history: A systematic review. CA Cancer J Clin. 74 (1), 84-114 (2024).
- Ray, E., et al. Inhalable chitosan-coated nano-assemblies potentiate niclosamide for targeted abrogation of non-small-cell lung cancer through dual modulation of autophagy and apoptosis. Int J Biol Macromol. 279 (Pt 4), 135411 (2024).
- Ali, N. A., et al. Chia seed (Salvia hispanica) attenuates chemically induced lung carcinomas in rats through suppression of proliferation and angiogenesis. Pharmaceuticals (Basel). 17 (9), 1129 (2024).
- Kiran, A., Kumari, G. K., Krishnamurthy, P. T. Preliminary evaluation of anticancer efficacy of pioglitazone combined with celecoxib for the treatment of non-small cell lung cancer. Invest New Drugs. 40 (1), 1-9 (2022).
- Marshall, K., Twum, Y., Gao, W. Proteome derangement in malignant epithelial cells and its stroma following exposure to 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone. Arch Toxicol. 97 (3), 711-720 (2023).
- Li, B., et al. LNCRNA XIST modulates miR-328-3p ectopic expression in lung injury induced by tobacco-specific lung carcinogen NNK both in vitro and in vivo. Br J Pharmacol. 181 (15), 2509-2527 (2024).
- Liang, F., et al. Tobacco carcinogen induces tryptophan metabolism and immune suppression via induction of indoleamine 2,3-dioxygenase 1. Signal Transduct Target Ther. 7 (1), 311 (2022).
- Ding, R., et al. The effect of immunotherapy PD-1 blockade on acute bone cancer pain: Insights from transcriptomic and microbiomic profiling. Int Immunopharmacol. 142 (Pt A), 113100 (2024).
- Kayı Cangır, A., et al. Microcomputed tomography as a diagnostic tool for detection of lymph node metastasis in non-small cell lung cancer: A decision-support approach for pathological examination "a pilot study for method validation"). J Pathol Inform. 15, 100373 (2024).
- Packialakshmi, B., et al. A clinically-relevant mouse model that displays hemorrhage exacerbates tourniquet-induced acute kidney injury. Front Physiol. 14, 1240352 (2023).
- Sørensen, D. B., et al. Time-dependent pathologic and inflammatory consequences of various blood sampling techniques in mice. J Am Assoc Lab Anim Sci. 58 (3), 362-372 (2019).
- Wu, G. L., Li, T. Y., Pu, X. H., Yu, G. Y. Effect of prescriptions replenishing vital essence, tonifying qi and activating blood on TNF-alpha, IL-1beta expressions in serum and submaxillary gland of nod mice with Sjogren's syndrome. Zhongguo Zhong Yao Za Zhi. 38 (3), 413-416 (2013).
- Schroeder, J. A., et al. Thromboelastometry assessment of hemostatic properties in various murine models with coagulopathy and the effect of factor VIII therapeutics. J Thromb Haemost. 19 (10), 2417-2427 (2021).
- Guo, K., et al. Integration of microbiomics, metabolomics, and transcriptomics reveals the therapeutic mechanism underlying Fuzheng-Qushi decoction for the treatment of lipopolysaccharide-induced lung injury in mice. J Ethnopharmacol. 334, 118584 (2024).
- Luo, T., Zhang, S., Li, X., Huang, M. Challenges in the differential diagnosis of pulmonary tuberculosis vs. lung cancer: A case report. Oncol Lett. 28 (4), 494 (2024).
- Mascalchi, M., et al. Large cell carcinoma of the lung: LDCT features and survival in screen-detected cases. Eur J Radiol. 179, 111679 (2024).
- Peng, M., et al. P27 specifically decreases in squamous carcinoma and mediates NNK-induced transformation of human bronchial epithelial cells. J Cell Mol Med. 28 (15), e18577 (2024).
- Jang, H. J., et al. Tobacco-induced hyperglycemia promotes lung cancer progression via cancer cell-macrophage interaction through paracrine IGF2/IR/NPM1-driven PD-L1 expression. Nat Commun. 15 (1), 4909 (2024).
- Zhang, Y., et al. Curcumin analogue EF24 prevents alveolar epithelial cell senescence to ameliorate idiopathic pulmonary fibrosis via activation of PTEN. Phytomedicine. 133, 155882 (2024).
- Li, M., et al. Isoflurane anesthesia decreases excitability of inhibitory neurons in the basolateral amygdala leading to anxiety-like behavior in aged mice. Exp Ther Med. 28 (4), 399 (2024).
- Xiong, R., et al. Hypermethylation of the ADIRF promoter regulates its expression level and is involved in NNK-induced malignant transformation of lung bronchial epithelial cells. Arch Toxicol. 97 (12), 3243-3258 (2023).
- Shaikh, Z. M., et al. Thearubigins/polymeric black tea polyphenols (PBPs) do not prevent benzo[a]pyrene (B[a]P) induced lung tumors in A/J mice. Am J Transl Res. 15 (9), 5826-5834 (2023).
- Li, M. Y., et al. Targeting CD36 determines nicotine derivative NNK-induced lung adenocarcinoma carcinogenesis. iScience. 26 (8), 107477 (2023).
- Arlt, E., et al. A flow cytometry-based examination of the mouse white blood cell differential in the context of age and sex. Cells. 13 (18), 1583 (2024).
- Su, Z., et al. Feasibility of using serum, plasma, and platelet 5-hydroxytryptamine as peripheral biomarker for the depression diagnosis and response evaluation to antidepressants: Animal experimental study. Clin Psychopharmacol Neurosci. 22 (4), 594-609 (2024).
- Zhou, X., et al. Mechanosensitive lncRNA H19 promotes chondrocyte autophagy, but not pyroptosis, by targeting miR-148a in post-traumatic osteoarthritis. Noncoding RNA Res. 10, 163-176 (2025).
- Chen, C., et al. Cardamonin attenuates iron overload-induced osteoblast oxidative stress through the HIF-1α/ROS pathway. Int Immunopharmacol. 142 (Pt A), 112893 (2024).
- Yan, F., et al. Hypoxia promotes non-small cell lung cancer cell stemness, migration, and invasion via promoting glycolysis by lactylation of SOX9. Cancer Biol Ther. 25 (1), 2304161 (2024).
- Inoue, S., et al. Utility of ultrasound imaging in monitoring fracture healing in rat femur: Comparison with other imaging modalities. Bone Rep. 23, 101807 (2024).
- An, Y., et al. Quercetin through miR-147-5p/CLIP3 axis reducing Th17 cell differentiation to alleviate periodontitis. Regen Ther. 27, 496-505 (2024).
- Tian, J., et al. Diallyl disulfide blocks cigarette carcinogen 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone-induced lung tumorigenesis via activation of the Nrf2 antioxidant system and suppression of NF-κB inflammatory response. J Agric Food Chem. 71 (46), 17763-17774 (2023).
- Han, L., et al. Wutou decoction alleviates arthritis inflammation in CIA mice by regulating Treg cell stability and Treg/Th17 balance via the JAK2/STAT3 pathway. J Ethnopharmacol. 334, 118463 (2024).
- Napieczyńska, H., et al. µCT imaging of a multi-organ vascular fingerprint in rats. PLoS One. 19 (10), e0308601 (2024).
- Liu, H., et al. Using broadly targeted plant metabolomics technology combined with network pharmacology to explore the mechanism of action of the Yishen Gushu formula in the treatment of postmenopausal osteoporosis in vivo. J Ethnopharmacol. 333, 118469 (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten