Method Article
Confronto tra l'accesso retroperitoneale transperitoneale e la puntura percutanea per la modellazione della degenerazione del disco lombare nei conigli
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo ha confrontato le punture percutanee e trans-retroperitoneali in un modello di degenerazione del disco intervertebrale di coniglio (IVDD). Entrambi i metodi hanno indotto IVDD; Tuttavia, l'approccio trans-retroperitoneale ha portato a cambiamenti più estesi e a una minore mortalità.
Abstract
Questo studio confronta l'efficacia di due metodi per indurre la degenerazione del disco intervertebrale (IVDD) nei conigli: la puntura percutanea e trans-retroperitoneale dell'anulus fibrosus. Quindici conigli bianchi maschi sani della Nuova Zelanda sono stati assegnati in modo casuale a tre gruppi: sham, puntura percutanea e puntura trans-retroperitoneale. È stata condotta una valutazione completa, che include i tassi di mortalità, le valutazioni morfologiche e istologiche, l'imaging radiologico e l'analisi dei biomarcatori, per garantire un confronto accurato e dettagliato tra i due metodi. I risultati dimostrano che entrambe le tecniche di puntura hanno indotto con successo l'IVDD nel modello di coniglio. Tuttavia, l'approccio trans-retroperitoneale ha determinato alterazioni degenerative più pronunciate nei dischi intervertebrali, mantenendo un tasso di mortalità significativamente inferiore rispetto al metodo percutaneo. Questi risultati evidenziano i vantaggi dell'approccio trans-retroperitoneale nella modellazione IVDD. Questo studio fornisce preziose informazioni sulla creazione di modelli IVDD e getta le basi per future indagini su strategie di trattamento efficaci per la lombalgia, migliorando in ultima analisi i risultati dei pazienti.
Introduzione
Negli ultimi decenni, la lombalgia (LBP) è emersa come il disturbo muscoloscheletrico più significativo che influisce sulla qualitàdella vita1. La lombalgia è diventata una preoccupazione sempre più importante per la salute pubblica, imponendo un notevole onere economico alla società a causa della perdita di manodopera e delle spese mediche aggiuntive 2,3. Solo negli Stati Uniti, i costi diretti e indiretti associati al LBP superano i 100 miliardi di dollari all'anno, comprese le spese mediche, le perdite di reddito e le perdite di manodopera4. La lombalgia è spesso causata dalla degenerazione del disco intervertebrale (IVDD)5,6,7,8. Data l'elevata prevalenza e l'impatto economico del LBP, una modellazione accurata dell'IVDD è fondamentale per esplorare le strategie di trattamento.
Per comprendere la fisiopatologia dell'IVDD e valutare le strategie di trattamento, sono stati sviluppati e utilizzati vari modelli animali preclinici in vivo 9. In questi modelli sono stati impiegati diversi metodi per indurre la degenerazione del disco, tra cui lesioni chirurgiche o chimiche del disco, stress meccanico non invasivo, modificazione genetica e evento naturale10. Tra questi metodi, la lesione chirurgica rappresenta fino al 64,9% dell'induzione dell'IVDD, con la puntura dell'ago che è la tecnica chirurgica primaria11. Il modello di puntura dell'ago si caratterizza per la sua facilità di insediamento e il minimo danno agli animali da esperimento. Gli approcci comuni alla puntura con ago includono l'accesso retroperitoneale aperto allo spazio del disco lombare e la puntura posterolaterale percutanea. La profondità di inserimento può essere determinata utilizzando il monitoraggio radiografico o la lunghezza dell'ago. In particolare, l'approccio percutaneo può ridurre il danno tissutale iatrogeno rispetto ai metodi chirurgici a cielo aperto, mentre l'accesso retroperitoneale offre il vantaggio di caratteristiche di visualizzazione diretta che non sono state confrontate quantitativamente nella letteratura precedente. Mentre gli studi hanno studiato gli effetti dell'uso di aghi di diverso diametro12 e della perforazione di dischi diversi10 sull'induzione IVDD, gli studi comparativi incentrati su diversi approcci di puntura dell'ago rimangono limitati. Il modello di coniglio selezionato offre una particolare utilità per i ricercatori che richiedono studi longitudinali convenienti con frequenti valutazioni di imaging, data la sua somiglianza anatomica con i dischi umani e i suoi vantaggi rispetto ai modelli di roditori in termini di dimensioni e struttura13.
In questo studio, sono stati stabiliti modelli di coniglio di IVDD lombare utilizzando due metodi: accesso retroperitoneale aperto per perforare lo spazio del disco lombare e puntura posterolaterale percutanea. È stata analizzata una serie completa di misure di esito, tra cui cambiamenti morfologici, istologici e radiologici.
Protocollo
Le procedure sperimentali sugli animali hanno aderito rigorosamente alla Guida per la cura e l'uso degli animali da laboratorio emessa dal National Institutes of Health e sono state approvate dal Comitato etico per gli animali sperimentali dell'Università di Medicina Tradizionale Cinese di Chengdu (Numero di approvazione etica: 2021-23). Sono stati utilizzati quindici conigli bianchi della Nuova Zelanda sani, di 4 mesi, di qualità pulita (2,25 kg ± 0,25 kg), tra cui sette maschi e otto femmine. Gli animali sono stati alloggiati in un ambiente con una temperatura ambiente compresa tra 23 °C ± 3 °C e un'umidità di circa il 60% ± il 10% per una settimana di adattamento, con libero accesso ad acqua e cibo. Prima dell'esperimento, i 15 conigli sono stati assegnati in modo casuale a uno dei tre gruppi: il gruppo fittizio (Gruppo A), il gruppo di puntura percutanea dell'anello fibroso (Gruppo B) e il gruppo di puntura dell'anello fibroso dello spazio trans-retroperitoneale (Gruppo C), con cinque conigli in ciascun gruppo. I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. Definizione del modello IVDD di coniglio tramite puntura percutanea dell'anulus fibroso
NOTA: Il modello IVDD di coniglio è stato stabilito utilizzando il metodo di puntura percutanea dell'anulus fibroso. La procedura ha seguito il metodo di modellazione della puntura descritto da Luo TD et al.14 ed è stata eseguita sotto guida a raggi X (Figura 1).
- Preparate il coniglio.
- Digiunare i conigli per 24 ore prima dell'intervento, garantendo l'accesso all'acqua.
- Somministrare l'anestesia tramite iniezione endovenosa di pentobarbital sodico al 3% (1,3 ml/kg) nella vena dell'orecchio (seguendo protocolli approvati istituzionalmente).
- Confermare l'esito positivo dell'anestesia controllando l'immobilità, i muscoli rilassati, la mancanza di riflesso corneale e l'assenza di risposta al dolore.
- Posiziona e segna il coniglio.
- Fissa il coniglio in posizione prona su una tavola di fissaggio.
- Radere e preparare l'area chirurgica, quindi palpare i punti di riferimento ossei.
- Palpare i punti di riferimento ossei sul dorso lombare del coniglio. Individua la costola più bassa del coniglio, che in genere corrisponde alla vertebra appena sopra il processo spinoso L1.
- Identificare il processo spinoso immediatamente sotto questa vertebra per determinare il processo spinoso L1.
- Individuare i punti più alti delle creste iliache, approssimativamente all'altezza della vertebra L6.
- Tracciare il processo spinoso L1 per identificare in sequenza ogni processo spinoso fino a L7.
- Usa un pennarello per marcare chiaramente il processo spinoso L1 sul dorso del coniglio.
- Passa al processo spinoso successivo e contrassegnalo come L2.
- Continua a contrassegnare ogni processo spinoso successivo come L3, L4, L5, L6 e L7. Assicurarsi che ogni segno sia distinto e in ordine sequenziale per una chiara identificazione.
- Individuare e contrassegnare il sito di puntura.
- Palpare i processi trasversali e individuare il punto medio tra le estremità distali di L5 e L6.
- Segna questo punto e preparati a inserire l'ago da puntura a circa 1 cm sopra di esso.
- Inserire l'ago per puntura.
- Tenere l'ago della puntura orizzontalmente e inserirlo verso il suolo, rompendo la pelle.
- Far avanzare l'ago per raggiungere il corpo vertebrale L4 e verificare il corretto posizionamento sotto guida radiografica.
- Inclinare leggermente l'ago cefalico con un angolo di circa 20° verso il disco intervertebrale L4-5. Forare il disco e confermare l'accuratezza della puntura durante l'esame a raggi X.
- Eseguire le forature del disco.
- Perforare con precisione l'anulus fibroso, utilizzando la guida a raggi X se necessario.
- Ripetere il processo di puntura per i dischi intervertebrali L2-3 e L3-4, forandoli una volta.
- Mantenere una profondità di foratura di circa 5 mm con un tempo di permanenza di 5 s per ogni disco.
- Assistenza post-procedura
- Disinfettare e fasciare il sito di puntura.
- Iniettare la penicillina per via intramuscolare nel grande gluteo alla dose di 40.000 U per coniglio al giorno per 3 giorni.
NOTA: Regolare l'approccio se l'ago incontra il tessuto duro. Utilizzare la guida a raggi X per una foratura precisa. Monitora il recupero del coniglio e fornisci cure adeguate.
2. Definizione del modello IVDD del coniglio tramite puntura dell'anello fibroso dello spazio trans-retroperitoneale
NOTA: Il modello IVDD di coniglio è stato stabilito utilizzando il metodo di puntura dell'anulus fibroso dello spazio trans-retroperitoneale12 (Figura 2).
- Digiunare i conigli per 24 ore prima dell'intervento, consentendo l'accesso all'acqua.
- Anestetizzare il coniglio iniettando per via endovenosa il 3% di pentobarbital sodico (1,3 ml/kg) nella vena dell'orecchio (seguendo protocolli istituzionalmente approvati).
- Assicurati che il coniglio sia immobile, con i muscoli rilassati, nessun riflesso corneale e nessuna risposta al dolore alla pressione per confermare il successo dell'anestesia.
- Fissa il coniglio in posizione prona su una tavola di fissaggio.
- Radersi e preparare l'area chirurgica.
- Palpare i punti di riferimento ossei, segnando i processi spinosi lombari L1-L7 sulla schiena lombare del coniglio con un pennarello.
- Ripalpare i processi trasversali del coniglio per determinare la posizione dell'incisione chirurgica.
- Posizionare un telo sterile e disinfettare la pelle locale per garantire condizioni asettiche.
- Utilizzare un approccio retroperitoneale posteriore per sezionare la fascia e i muscoli strato per strato, esponendo l'aspetto laterale del disco intervertebrale lombare.
- Perforare l'anulus fibroso con un ago da puntura a una profondità di circa 5 mm e un tempo di permanenza di 5 s.
- Forare in sequenza i dischi intervertebrali L3-4, L4-5 e L5-6, assicurandosi che ogni disco venga forato una sola volta.
- Sutura i tessuti strato per strato utilizzando un filo di sutura di 0,25 mm di diametro.
- Disinfettare e fasciare il sito di puntura dopo la modellazione.
- Iniettare la penicillina per via intramuscolare nel grande gluteo del coniglio ogni giorno alla dose di 40.000 U per coniglio per tre giorni consecutivi.
NOTA: Utilizzare la penicillina con una specifica di 800.000 unità/fiala e numero di approvazione Veterinary Drug 140051251.
3. Selezione dei modelli IVDD e valutazione degli esiti
- Valutazione della mortalità e dello stato generale dei conigli
- Osservare i conigli settimanalmente per determinare la sopravvivenza e registrare le condizioni generali, compreso lo stato mentale, i modelli di attività, l'assunzione di cibo e acqua, nonché la produzione fecale e urinaria.
- Registra le osservazioni in modo accurato e annota eventuali cambiamenti nelle condizioni.
- Monitoraggio del peso dei conigli
- Registrare il peso corporeo dei conigli prima e dopo l'istituzione del modello, nonché prima della raccolta dei tessuti.
- Garantisci una registrazione accurata del peso e annota eventuali modifiche significative.
- Valutazione radiologica
- Ottenere la risonanza magnetica sagittale 1.5T pesata in T2 dell'intera sequenza di espianti vertebrali lombari di ciascun coniglio bianco prima e 4 settimane dopo l'istituzione del modello.
- Osservare l'entità della degenerazione del disco intervertebrale.
- Eseguire una valutazione quantitativa della degenerazione del disco intervertebrale utilizzando il sistema di classificazione Pfirrmann modificato proposto da Griffith et al.15. Chiedere a tre radiologi indipendenti in cieco di valutare le sequenze di risonanza magnetica pesate in T2 secondo criteri stabiliti: altezza del disco, intensità del segnale del nucleo polposo e integrità dell'anulus fibroso.
- Determinare i voti finali attraverso il consenso quando le discrepanze superano un livello di classe. Conduci tutte le valutazioni utilizzando un software di visualizzazione DICOM standardizzato con impostazioni di visualizzazione calibrate.
- Valutazione istopatologica e scoring
- Eutanasia dei conigli 4 settimane dopo la modellazione utilizzando un sovradosaggio endovenoso di pentobarbital sodico (seguendo protocolli istituzionalmente approvati), quindi raccogliere rapidamente i dischi intervertebrali L2-L3, L3-L4 e L4-L5 su ghiaccio15.
- Fissare i dischi L2-L3 in paraformaldeide al 4% e conservare i campioni rimanenti a -80 °C.
- Immergere i dischi fissati in una soluzione decalcificante, come EDTA al 10%, garantendo la completa immersione. Cambiare la soluzione decalcificante ogni 2-3 giorni per mantenere l'efficacia.
- Monitorare regolarmente il processo di decalcificazione fino al raggiungimento della completa decalcificazione, che può richiedere da diversi giorni a una settimana, a seconda delle dimensioni e dello spessore del disco.
- Sciacquare accuratamente i dischi decalcificati con acqua corrente per rimuovere eventuali tracce della soluzione decalcificante.
- Disidratare i dischi immergendoli in una serie di soluzioni di etanolo graduato, iniziando con etanolo al 70% e aumentando gradualmente fino al 100% di etanolo. Condurre ogni fase di disidratazione per 1-2 ore per grado.
- Infiltrare i dischi disidratati con cera di paraffina (punto di fusione 56-58 °C) per un minimo di 2 ore, garantendo la completa infiltrazione.
- Incorporare i dischi infiltrati in un blocco di cera, posizionandoli per il sezionamento. Lasciare raffreddare il blocco di cera e solidificarlo completamente.
- Sezionare i dischi incorporati in fette sottili e uniformi (5-10 μm) utilizzando un microtomo. Montare le sezioni su vetrini per ulteriori analisi, come la colorazione istologica o l'immunoistochimica12,13.
- Eseguire la colorazione con ematossilina ed eosina (HE), acquisire immagini al microscopio ottico e assegnare punteggi di colorazione HE utilizzando la scala di classificazione istopatologica IVD12.
- Saggio TUNEL
- Decerare e reidratare le sezioni di tessuto del disco intervertebrale, quindi eseguire il recupero dell'antigene e la permeabilizzazione della membrana.
- Aggiungere una miscela di reagente 1 (TdT) e reagente 2 (dUTP) in un rapporto di 1:9 e incubare in una camera umidificata.
- Lavare le sezioni con tampone PBS, applicare il colorante DAPI e incubare al buio a temperatura ambiente per 10 minuti.
- Acquisisci immagini utilizzando uno scanner panoramico completamente automatizzato e un software di elaborazione.
- Rilevamento di citochine
- Eutanasia dei conigli sperimentali (passaggio 3.4.1) e raccolta di campioni di sangue dall'aorta addominale.
- Centrifugare campioni di sangue di coniglio a 2000 × g per 10 minuti a 25 °C per separare il siero dalle cellule del sangue. Raccogliere con cura il surnatante (siero), assicurandosi che non siano inclusi detriti cellulari.
- Seguire le istruzioni fornite nel kit ELISA per rilevare l'espressione di TGF-β nei campioni di siero.
- Preparare i reagenti e gli standard come indicato nel kit ELISA.
- Aggiungere campioni di siero nei pozzetti appropriati nella piastra ELISA.
- Incubare la piastra alla temperatura e alla durata consigliate secondo le istruzioni del kit.
- Lavare la piastra come indicato per rimuovere i reagenti non legati.
- Aggiungere l'anticorpo di rilevamento e gli altri reagenti necessari, seguendo il protocollo del kit.
- Incubare nuovamente la piastra per il tempo e la temperatura specificati.
- Lavare accuratamente la piastra per rimuovere i reagenti in eccesso.
- Aggiungere la soluzione di substrato ai pozzetti e incubare per il periodo consigliato per consentire lo sviluppo del colore.
- Misurare la densità ottica (OD) utilizzando uno spettrofotometro alla lunghezza d'onda specificata nelle istruzioni del kit.
- Calcolare le concentrazioni del campione sostituendo i valori OD nell'equazione fornita o utilizzando la curva standard generata dalle concentrazioni note degli standard.
4. Analisi statistica
- Eseguire analisi statistiche utilizzando software disponibili in commercio.
- Esprimere le variabili continue come media ± deviazione standard.
- Utilizzare l'ANOVA unidirezionale per testare le differenze tra i gruppi.
- Applica i test LSD per confronti a coppie.
- Utilizzare l'ANOVA a misure ripetute per analizzare i dati delle misure ripetute.
- Esegui l'analisi di correlazione di Spearman per valutare la correlazione tra le variabili.
- Imposta il livello di significatività a α = 0,05 e considera i valori P inferiori a 0,05 come statisticamente significativi.
Risultati
Le procedure chirurgiche sono state eseguite senza complicazioni. Un coniglio del gruppo B (gruppo di puntura percutanea) è morto dopo la procedura. Tutti gli altri animali hanno ripreso i normali modelli di alimentazione e attività dopo l'intervento e sono sopravvissuti per tutto il periodo sperimentale. Non sono stati osservati sanguinamenti o infezioni prolungate nei siti chirurgici.
Valutazione della mortalità e dello stato generale
Il tasso di mortalità è stato dello 0% sia per il gruppo A che per il gruppo C, mentre è stato del 20% per il gruppo B (Tabella 1). I conigli del gruppo A hanno mostrato condizioni generali normali. Prima della modellazione, i conigli del gruppo B mostravano condizioni simili a quelli del gruppo fittizio. Tuttavia, il secondo giorno dopo la modellazione, i conigli del gruppo B hanno mostrato una ridotta vitalità, una diminuzione dell'attività, una preferenza per rannicchiarsi negli angoli delle loro gabbie, un'assunzione di cibo significativamente ridotta, un'assunzione di acqua relativamente invariata, pelo più opaco, aumento della produzione fecale e feci molli. Nel corso del tempo, un coniglio del gruppo B è morto, mentre i conigli rimanenti hanno gradualmente riacquistato l'assunzione di cibo ai livelli pre-modellazione. Tuttavia, la loro vitalità, attività, condizione del pelo e consistenza delle feci sono rimaste inferiori ai livelli pre-modellazione. Al contrario, i conigli del gruppo C hanno mostrato una migliore vitalità, attività, assunzione di cibo, lucentezza del pelo e consistenza fecale rispetto a quelli del gruppo B, a partire dalla seconda settimana dopo il modello.
Valutazione del peso corporeo
Il peso corporeo dei conigli era simile in tutti i gruppi prima della modellazione. Tuttavia, prima del campionamento, i conigli del gruppo B pesavano più di quelli dei gruppi A e C (Figura 3).
Valutazione radiologica dei dischi intervertebrali
La perdita di altezza del disco intervertebrale (IVD) è stata osservata nei gruppi B e C a partire da una settimana dopo l'intervento (Figura 4). La classificazione di Pfirrmann ha dimostrato differenze significative tra i gruppi (p < 0,001, test di Kruskal-Wallis con analisi post hoc di Dunn). Il gruppo fittizio (Gruppo A) ha mantenuto intatta la morfologia del disco, con punteggi uniformi di grado 1 in tutti i campioni (mediana [intervallo]: 1 [1-1]). Il gruppo con puntura percutanea (Gruppo B) ha mostrato una degenerazione da moderata a grave (mediana [intervallo]: 6 [5-6]), mentre il gruppo con approccio retroperitoneale (Gruppo C) ha mostrato un grado di degenerazione comparabile (mediana [intervallo]: 5 [5-6]). I confronti a coppie hanno rivelato differenze significative tra: (1) Gruppo A vs. Gruppo B (p = 0,0039); (2) Gruppo A vs. Gruppo C (p = 0,0039); (3) Gruppo B vs. Gruppo C (p = 0,206). L'affidabilità tra i valutatori è rimasta eccellente (α di Krippendorff = 0,87) (Tabella 2).
Valutazione istopatologica e scoring
L'analisi istologica qualitativa ha rivelato differenze nell'ultrastruttura, nell'infiltrazione vascolare e nella deposizione di tessuto di granulazione tra i gruppi A, B e C (Figura 5). Il punteggio patologico ha indicato punteggi significativamente più alti nei gruppi B e C rispetto al gruppo A, con il gruppo C che mostrava un punteggio più alto rispetto al gruppo B (Tabella 3).
Risultati del test TUNEL
Nel Gruppo A non sono state osservate cellule apoptotiche punteggiate verdi significative o apoptosi delle cellule del nucleo polposo. Al contrario, i gruppi B e C mostravano numerose cellule apoptotiche punteggiate verdi e una grave apoptosi delle cellule del nucleo polposo rispetto al gruppo A. Tuttavia, il gruppo B ha mostrato un numero relativamente inferiore di cellule apoptotiche punteggiate verdi e una minore apoptosi delle cellule del nucleo polposo rispetto al gruppo C (Figura 6).
Risultati del rilevamento TGF-β
L'analisi quantitativa dei livelli di TGF-β ha rivelato variazioni significative tra i gruppi (ANOVA unidirezionale, F(2,12) = 87,3, p < 0,0001). Il gruppo fittizio (Gruppo A) ha dimostrato concentrazioni di TGF-β al basale (media ± DS: 1944,6 pg/mL ± 182,3 pg/mL), mentre il gruppo di puntura percutanea (Gruppo B) ha mostrato un aumento moderato (2635,4 pg/mL ± 136,7 pg/mL). In particolare, il gruppo con approccio retroperitoneale (Gruppo C) ha mostrato una sostanziale sovraregolazione del TGF-β (4143,7 pg/mL ± 353,7 pg/mL), superando i livelli del Gruppo B del 57,2% (post hoc: p < 0,0001 di Tukey). Le variazioni biologiche individuali sono rimaste entro il 15% delle medie di gruppo (coefficiente di variazione: 5,2%-8,5%) (Figura 7, Tabella 4).

Figura 1: Modellazione della puntura dell'anello fibroso percutaneo sotto guida radiografica. L'imaging a raggi X è stato utilizzato per garantire una perforazione precisa dell'anulus fibrosus. La figura mostra l'ago da puntura localizzato ai raggi X prima della penetrazione del disco. Clicca qui per visualizzare una versione più grande di questa figura.
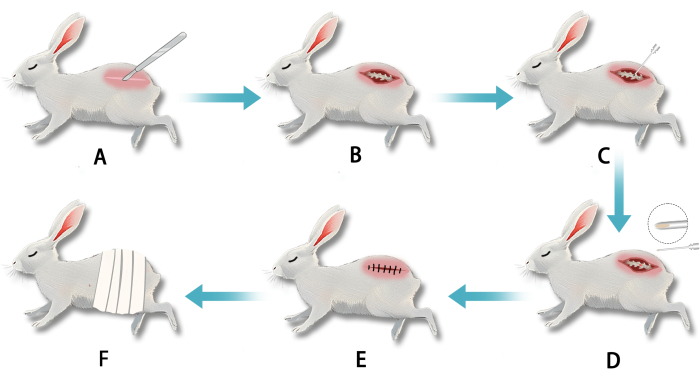
Figura 2: Definizione di un modello di degenerazione del disco intervertebrale (IVDD) su un coniglio bianco utilizzando una puntura transperitoneale retroperitoneale dell'anulus fibroso. (A) Dopo l'anestesia, è stata praticata un'incisione nel segmento vertebrale lombare. (B) La dissezione smussata ha esposto l'anulus fibroso lombare. (C) L'anulus fibroso è stato perforato con un ago per distruggere il nucleo polposo. (D) Il tessuto bianco del nucleo polposo gelatinoso era visibile sulla punta dell'ago al momento del ritiro. (E) L'incisione è stata suturata dopo il completamento della puntura. (F) La ferita è stata medicata dopo l'intervento. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Peso corporeo medio dei conigli bianchi in ciascun gruppo prima della modellazione e del campionamento. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Immagini MRI di dischi intervertebrali di coniglio prima e dopo la modellazione. Una significativa perdita di altezza è stata osservata nei gruppi B e C dopo la modellazione, con una perdita maggiore nel gruppo C rispetto al gruppo B. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Immagini istologiche dei dischi intervertebrali di coniglio. (A) Il gruppo A mostrava una forma regolare del nucleo polposo, un'abbondante distribuzione cellulare, vacuoli nella matrice gelatinosa (frecce nere) e placche fibrocartilaginee organizzate (frecce gialle). (B) Il gruppo B mostrava una forma irregolare del nucleo polposo, una ridotta conta cellulare, una distribuzione di matrici raggruppate, grandi cavità (frecce blu) e placche fibrocartilaginee disgregate separate dal nucleo polposo (frecce verdi). (C) Il gruppo C mostrava una forma irregolare del nucleo polposo, una significativa perdita di cellule (frecce viola), una distribuzione di matrici raggruppate, forme irregolari e placche fibrocartilaginee interrotte (frecce rosse). Barra di scala: 200 μm (vale per tutti i pannelli). Clicca qui per visualizzare una versione più grande di questa figura.
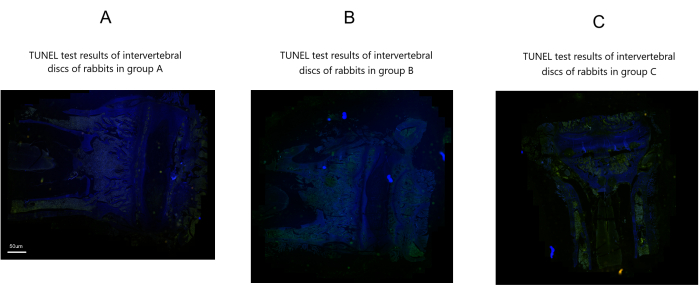
Figura 6: Risultati del saggio TUNEL dei dischi intervertebrali di coniglio post-modellazione in tre gruppi. Barra di scala: 50 μm (vale per tutti i pannelli). Clicca qui per visualizzare una versione più grande di questa figura.
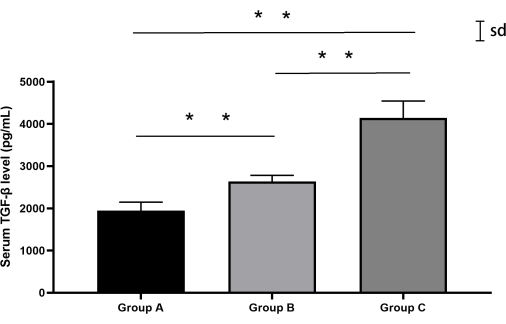
Figura 7: Livelli sierici di TGF-β nei conigli di ciascun gruppo. Sia il gruppo B che il gruppo C hanno mostrato livelli di TGF-β più elevati rispetto al gruppo A, con il gruppo C che ha mostrato i livelli più alti. Le barre di errore rappresentano la media ± la deviazione standard (SD). Clicca qui per visualizzare una versione più grande di questa figura.
| Gruppo | Un | B | C |
| Mortalità | 0 | 20% | 0 |
Tabella 1: Tasso di mortalità post-modellazione in gruppi di conigli.
| n | Distribuzione dei gradi Pfirrmann | Mediana [Intervallo] | Confronto tra gruppi (valore p) |
| 5 | 1 (100%) | 1 [1-1] | A contro B: 0,0039 |
| 5 | 5 (40%), 6 (60%) | 6 [5-6] | A contro C: 0,0039 |
| 5 | 5 (60%), 6 (40%) | 5 [5-6] | B contro C: 0,206 |
Tabella 2: Analisi comparativa della degenerazione del disco intervertebrale utilizzando il sistema di classificazione Pfirrmann modificato.
| Gruppo | Un | B | C |
| Punteggio di patologia | 4 | 10 | 11 |
Tabella 3: Punteggi patologici medi dei conigli in ciascun gruppo.
| Gruppo | n | Media ± SD (pg/mL) | Mediana [Intervallo] (pg/mL) | Confronti a coppie (HSD di Tukey) |
| Un | 5 | 1944.6 ± 182.3 | 2054.5 [1709.1-2126.6] | A contro B: p = 0,0012 |
| B | 5 | 2635,4 ± 136,7 | 2544.6 [2526.6-2889.6] | A contro C: p < 0,0001 |
| C | 5 | 4143,7 ± 353,7 | 4090.3 [3694.9-4595.5] | B contro C: p < 0,0001 |
| Tutti i valori sono normalizzati al contenuto proteico totale (μg/mg tissutale) Ipotesi ANOVA verificate (test di Levene p = 0,18, Shapiro-Wilk p > 0,15) Dimensioni dell'effetto: f di Cohen = 2,16 (effetto grande)* |
Tabella 4: Profili di concentrazione di TGF-β nei gruppi sperimentali.
Discussione
I risultati di questo studio indicano che sia l'approccio di puntura percutanea che quello trans-retroperitoneale sono efficaci nell'indurre la degenerazione del disco intervertebrale (IVDD) nei modelli di coniglio. In particolare, sulla base di una valutazione completa delle condizioni generali, della mortalità, della valutazione istopatologica, del dosaggio TUNEL e dei livelli sierici di TGF-β, il modello di puntura trans-retroperitoneale ha determinato alterazioni degenerative più estese nei dischi intervertebrali, mantenendo un tasso di mortalità inferiore.
La lesione chirurgica è il metodo più comunemente usato per stabilire modelli IVDD. Da quando Lipson e Muir (1981) hanno sviluppato con successo un modello IVDD nei conigli utilizzando l'annulotomia chirurgica con bisturi16, sono emerse varie tecniche di lesione, tra cui la puntura dell'ago 12,14,17, l'escissione dell'anulus fibroso 18, la discectomia totale, la nucleotomia parziale e totale19, l'aspirazione del nucleo polposo 20,21,22 e la lesione da trapano 23,24. 26. Questi metodi chirurgici impongono diversi carichi fisiologici agli animali, portando a vari gradi di induzione dell'IVDD. Rispetto ai modelli con lesione da bisturi, i modelli con puntura dell'ago imitano meglio la natura lenta e progressiva della degenerazione del disco14.
Mentre Masuda et al.12 hanno introdotto la tecnica di puntura trans-retroperitoneale, questo approccio chirurgico aperto richiede un tempo operatorio più lungo, una maggiore abilità chirurgica e risorse chirurgiche più estese. Inoltre, l'incisione creata durante la chirurgia a cielo aperto può aumentare il rischio di infezione, dolore postoperatorio e mortalità negli animali da esperimento. Al contrario, la tecnica di puntura percutanea posterolaterale proposta da Luo et al.14 è più semplice e fattibile. I risultati di questo studio confermano che il modello di puntura trans-retroperitoneale induce cambiamenti degenerativi più estesi nei dischi intervertebrali mantenendo un tasso di mortalità inferiore.
Nei modelli di puntura dell'ago, l'entità e la natura delle alterazioni degenerative del disco intervertebrale sono influenzate da molteplici fattori meccanici e biologici che variano nel tempo27,28. Questi fattori sono noti fattori patologici che contribuiscono alla degenerazione del disco. La puntura dell'ago interrompe l'integrità dell'anulus fibrosus, riduce l'elasticità del nucleo polposo, promuove l'apoptosi delle cellule del nucleo polposo e altera la distribuzione meccanica delle sollecitazioni all'interno della colonna vertebrale29. Inoltre, il sito danneggiato suscita risposte infiammatorie e di riparazione precoce, tra cui la proliferazione capillare nell'anulus fibroso esterno e la deposizione di granulazione e tessuti fibrotici. Queste reazioni patologiche sono state descritte in numerosi modelli animali di degenerazione del disco30,31 e sono state osservate anche nell'ernia del disco lombare umana.
In questo studio, queste risposte patologiche erano evidenti in entrambi i modelli. Rispetto alla puntura percutanea, la puntura trans-retroperitoneale offre una visione più chiara della puntura, facilitando una rottura più precisa dell'anulus fibroso e portando a una maggiore infiammazione nel sito della lesione. Questo potrebbe spiegare perché il modello di puntura trans-retroperitoneale induce cambiamenti degenerativi più estesi nei dischi intervertebrali. Al contrario, la visibilità limitata nella puntura percutanea aumenta la probabilità di perforare erroneamente il midollo spinale o altre strutture, spiegando potenzialmente il tasso di mortalità più elevato osservato in questo studio.
I modelli di puntura dell'ago per la degenerazione del disco sono comunemente stabiliti in piccoli animali come ratti e topi32, così come nei conigli 12,14,16. Tuttavia, questa tecnica è applicabile anche ad animali più grandi, tra cui cani33, pecore34, bovini35 e scimmie rhesus36, per lo sviluppo di modelli IVDD. Sebbene esistano preoccupazioni riguardo alle differenze tra i modelli animali quadrupedi e la colonna vertebrale umana bipede, gli studi biomeccanici suggeriscono che le spine quadrupedi subiscono principalmente una compressione assiale, simile alle spine umane37,38. Le intense forze di flessione e torsione che agiscono sulle spine quadrupedi sono contrastate dai muscoli e dai legamenti paraspinali che generano notevoli forze di trazione lungo l'asselungo 38. Dati i vincoli etici e pratici, i quadrupedi più grandi sono costosi e difficili da acquisire, rendendo i conigli un modello ideale per la ricerca sull'IVDD. Inoltre, l'omologia anatomica tra i dischi intervertebrali del coniglio e quelli umani, in particolare la presenza di faccette articolari, muscoli paraspinali e legamenti, supporta ulteriormente l'idoneità dei conigli per questa ricerca13,39.
Tuttavia, esistono differenze significative tra questi modelli animali e i dischi intervertebrali umani, che rappresentano un limite di questo studio. Queste differenze includono variazioni nelle dimensioni del disco, nelle caratteristiche anatomiche, nella presenza di cellule notocordali e nella traducibilità dei risultati sperimentali. Di conseguenza, questo studio deve affrontare alcune sfide. Inoltre, nella pratica clinica, i pazienti spesso presentano alterazioni degenerative preesistenti nel disco intervertebrale, che possono portare all'ernia del disco e alla compressione neurale. Al contrario, i modelli animali in questo studio hanno indotto la degenerazione danneggiando i dischi sani. I dischi degenerati possono avere ridotte capacità di autoriparazione e rigenerazione dopo una lesione o possono mostrare una degenerazione più grave rispetto ai dischi sani esaminati in questo esperimento. La ricerca futura su modelli animali di degenerazione del disco intervertebrale dovrebbe tenere in piena considerazione questi fattori.
Sia l'approccio della puntura percutanea che quello trans-retroperitoneale sono efficaci nello stabilire modelli di degenerazione del disco intervertebrale nei conigli. Tuttavia, la tecnica di puntura trans-retroperitoneale induce alterazioni degenerative più estese ed è anche associata a un tasso di mortalità inferiore.
Divulgazioni
Nessuno.
Riconoscimenti
Questo progetto è stato sostenuto dalla National Natural Science Foundation of China (n. 82004497), dalla China Postdoctoral Science Foundation (n. 2021M693788), dalla National Natural Science Foundation of China (n. 82105043) e dalla Natural Science Foundation della provincia del Sichuan (n. 2023NSFSC1814).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.3 T Veterinary Maenetic Resonance lmaging(MRI) | NINGBO CHUANSHANJIA | CSJ-MR | |
| Alcohol medical | LIRCON | 20230107 | |
| Benzylpenicillin potassium | Jiangxi Keda Animal Pharmaceutical | 140051251 | |
| Haemostatic forceps | SHINVA | 20211239 | |
| Injection syringe | CONPUVON | 20153151307 | |
| Knife blades | Hons Medincal | 20210615 | |
| Medical absorbent cotton ball | Cofoe | 20210006 | |
| Medical suture needle | Shanghai Xiaoyi Medical Devices | 20192020430 | |
| Medullo-puncture needle | Yangzhou Jiangzhou Medical Devices | 20190902 | Used to puncture lumbar disc |
| Physiological saline | NeilMed | C1210504D2 | |
| Povidone iodine solution | Sichuan IJIS Medical Technology | 20221209 | |
| Quasi-microbalance | Explorer | ||
| Rabbit dissection operating table | Zhenhua Biomedical | ZH-BXT-3Z | |
| Shaver | AUX | ||
| Statistical analysis softeare | IBM | SPSS | |
| Sterile gauze | Cofoe | 20202140675 | |
| Surgical gloves | DR.LERSH | 20172140028 | |
| Surgical knife | Hons Medinca | 20210019 | |
| Surgical tweezers | SHINVA | 20210233 | |
| USB-C data transmission line | KINI | ||
| White light photography microscope | Nikon | Eclipse Ci-L |
Riferimenti
- Vos, T., et al. Years lived with disability (YLDS) for 1160 sequelae of 289 diseases and injuries 1990-2010: A systematic analysis for the global burden of disease study 2010. Lancet. 380 (9859), 2163-2196 (2012).
- Daly, C., Ghosh, P., Jenkin, G., Oehme, D., Goldschlager, T. A review of animal models of intervertebral disc degeneration: Pathophysiology, regeneration, and translation to the clinic. Biomed Res Int. 2016, 5952165(2016).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: Pain and disc content. Nat Rev Rheumatol. 10 (1), 44-56 (2014).
- Katz, J. N. Lumbar disc disorders and low-back pain: Socioeconomic factors and consequences. J Bone Joint Surg Am. 88 (Suppl 2), 21-24 (2006).
- Cheung, K. M. The relationship between disc degeneration, low back pain, and human pain genetics. Spine J. 10 (11), 958-960 (2010).
- Knezevic, N. N., Candido, K. D., Vlaeyen, J. W. S., Van Zundert, J., Cohen, S. P. Low back pain. Lancet. 398 (10294), 78-92 (2021).
- Livshits, G., et al. Lumbar disc degeneration and genetic factors are the main risk factors for low back pain in women: The UK twin spine study. Ann Rheum Dis. 70 (10), 1740-1745 (2011).
- Takatalo, J., et al. Does lumbar disc degeneration on magnetic resonance imaging associate with low back symptom severity in young finnish adults. Spine (Phila Pa 1976). 36 (25), 2180-2189 (2011).
- Singh, K., Masuda, K., An, H. S. Animal models for human disc degeneration. Spine J. 5 (6 Suppl), 267s-279s (2005).
- Liang, T., et al. Constructing intervertebral disc degeneration animal model: A review of current models. Front Surg. 9, 1089244(2022).
- Poletto, D. L., Crowley, J. D., Tanglay, O., Walsh, W. R., Pelletier, M. H. Preclinical in vivo animal models of intervertebral disc degeneration. Part 1: A systematic review. JOR Spine. 6 (1), e1234(2023).
- Masuda, K., et al. A novel rabbit model of mild, reproducible disc degeneration by an anulus needle puncture: Correlation between the degree of disc injury and radiological and histological appearances of disc degeneration. Spine (Phila Pa 1976). 30 (1), 5-14 (2005).
- Kroeber, M. W., et al. New in vivo animal model to create intervertebral disc degeneration and to investigate the effects of therapeutic strategies to stimulate disc regeneration. Spine (Phila Pa 1976). 27 (23), 2684-2690 (2002).
- Luo, T. D., et al. A percutaneous, minimally invasive annulus fibrosus needle puncture model of intervertebral disc degeneration in rabbits. J Orthop Surg (Hong Kong). 26 (3), 2309499018792715(2018).
- Griffith, J. F., et al. Modified Pfirrmann grading system for lumbar intervertebral disc degeneration. Spine (Phila Pa 1976). 32 (24), E708-E712 (2007).
- Lipson, S. J., Muir, H. Experimental intervertebral disc degeneration: Morphologic and proteoglycan changes over time. Arthritis Rheum. 24 (1), 12-21 (1981).
- Wang, Y., Wu, Y., Deng, M., Kong, Q. Establishment of a rabbit intervertebral disc degeneration model by percutaneous posterolateral puncturing of lumbar discs under local anesthesia. World Neurosurg. 154, e830-e837 (2021).
- Gruber, H. E., et al. A new small animal model for the study of spine fusion in the sand rat: Pilot studies. Lab Anim. 43 (3), 272-277 (2009).
- Alini, M., et al. Are animal models useful for studying human disc disorders/degeneration. Eur Spine J. 17 (1), 2-19 (2008).
- Gandhi, S. D., et al. Intradiscal delivery of anabolic growth factors and a metalloproteinase inhibitor in a rabbit acute lumbar disc injury model. Int J Spine Surg. 14 (4), 585-593 (2020).
- Omlor, G. W., et al. A new porcine in vivo animal model of disc degeneration: Response of anulus fibrosus cells, chondrocyte-like nucleus pulposus cells, and notochordal nucleus pulposus cells to partial nucleotomy. Spine (Phila Pa 1976). 34 (25), 2730-2739 (2009).
- Serigano, K., et al. Effect of cell number on mesenchymal stem cell transplantation in a canine disc degeneration model. J Orthop Res. 28 (10), 1267-1275 (2010).
- Daly, C. D., et al. A comparison of two ovine lumbar intervertebral disc injury models for the evaluation and development of novel regenerative therapies. Global Spine J. 8 (8), 847-859 (2018).
- Kim, J. S., et al. The rat intervertebral disk degeneration pain model: Relationships between biological and structural alterations and pain. Arthritis Res Ther. 13 (5), R165(2011).
- Lim, K. Z., et al. Ovine lumbar intervertebral disc degeneration model utilizing a lateral retroperitoneal drill bit injury. J Vis Exp. (123), e55753(2017).
- Zhang, Y., et al. Histological features of the degenerating intervertebral disc in a goat disc-injury model. Spine (Phila Pa 1976). 36 (19), 1519-1527 (2011).
- Freemont, A. J. The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain. Rheumatology (Oxford). 48 (1), 5-10 (2009).
- Vergroesen, P. P., et al. Mechanics and biology in intervertebral disc degeneration: A vicious circle. Osteoarthritis Cartilage. 23 (7), 1057-1070 (2015).
- Natarajan, R. N., Andersson, G. B., Patwardhan, A. G., Verma, S. Effect of annular incision type on the change in biomechanical properties in a herniated lumbar intervertebral disc. J Biomech Eng. 124 (2), 229-236 (2002).
- Hoogendoorn, R. J., Wuisman, P. I., Smit, T. H., Everts, V. E., Helder, M. N. Experimental intervertebral disc degeneration induced by chondroitinase ABC in the goat. Spine (Phila Pa 1976). 32 (17), 1816-1825 (2007).
- Melrose, J., Roberts, S., Smith, S., Menage, J., Ghosh, P. Increased nerve and blood vessel ingrowth associated with proteoglycan depletion in an ovine annular lesion model of experimental disc degeneration. Spine (Phila Pa 1976). 27 (12), 1278-1285 (2002).
- Elmounedi, N., et al. Impact of needle size on the onset and the progression of disc degeneration in rats. Pain Physician. 25 (6), 509-517 (2022).
- Tellegen, A. R., et al. Intradiscal delivery of celecoxib-loaded microspheres restores intervertebral disc integrity in a preclinical canine model. J Control Release. 286, 439-450 (2018).
- Vadalà, G., et al. The transpedicular approach as an alternative route for intervertebral disc regeneration. Spine. 38 (6), E319-E324 (2013).
- Yang, J. J., Li, F., Hung, K. C., Hsu, S. H., Wang, J. L. Intervertebral disc needle puncture injury can be repaired using a gelatin-poly (γ-glutamic acid) hydrogel: An in vitro bovine biomechanical validation. Eur Spine J. 27 (10), 2631-2638 (2018).
- Xi, Y., et al. Minimally invasive induction of an early lumbar disc degeneration model in rhesus monkeys. Spine (Phila Pa 1976). 38 (10), E579-E586 (2013).
- Elliott, D. M., Sarver, J. J. Young investigator award winner: Validation of the mouse and rat disc as mechanical models of the human lumbar disc. Spine (Phila Pa 1976). 29 (7), 713-722 (2004).
- Smit, T. H. The use of a quadruped as an in vivo model for the study of the spine - biomechanical considerations. Eur Spine J. 11 (2), 137-144 (2002).
- Romaniyanto, F. N. U., et al. Effectivity of puncture method for intervertebral disc degeneration animal models: Review article. Annals Med Surg. 85 (7), 3501-3505 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon