Method Article
مقارنة الوصول إلى خلف الصفاق عبر الصفاق والثقب عن طريق الجلد لنمذجة تنكس القرص القطني في الأرانب
* These authors contributed equally
In This Article
Summary
قارن هذا البروتوكول الثقوب عن طريق الجلد وعبر خلف الصفاق في نموذج تنكس القرص الفقري للأرانب (IVDD). كلتا الطريقتين تحفزت IVDD. ومع ذلك ، أدى النهج عبر خلف الصفاق إلى تغييرات أكثر شمولا وانخفاض معدل الوفيات.
Abstract
تقارن هذه الدراسة فعالية طريقتين لإحداث تنكس القرص الفقري (IVDD) في الأرانب: ثقب الحلقة الليفية عن طريق الجلد وعبر خلف الصفاق. تم تعيين خمسة عشر من الأرانب البيضاء النيوزيلندية السليمة بشكل عشوائي إلى ثلاث مجموعات: الزائفة ، والثقب عن طريق الجلد ، والثقب عبر خلف الصفاق. تم إجراء تقييم شامل ، بما في ذلك معدلات الوفيات ، والتقييمات المورفولوجية والنسيجية ، والتصوير الإشعاعي ، وتحليل المؤشرات الحيوية ، لضمان مقارنة دقيقة ومفصلة بين الطريقتين. توضح النتائج أن كلتا تقنيتي الثقب نجحتا في تحفيز IVDD في نموذج الأرانب. ومع ذلك ، أدى النهج عبر خلف الصفاق إلى تغيرات تنكسية أكثر وضوحا في الأقراص الفقرية مع الحفاظ على معدل وفيات أقل بكثير مقارنة بالطريقة عن طريق الجلد. تسلط هذه النتائج الضوء على مزايا النهج عبر خلف الصفاق في نمذجة IVDD. تقدم هذه الدراسة رؤى قيمة حول إنشاء نماذج IVDD وتضع أساسا للتحقيقات المستقبلية في استراتيجيات العلاج الفعالة لآلام أسفل الظهر ، مما يؤدي في النهاية إلى تحسين نتائج المرضى.
Introduction
على مدى العقود القليلة الماضية ، ظهرت آلام أسفل الظهر (LBP) كأهم اضطراب عضلي هيكلي يؤثر على نوعية الحياة1. أصبح الليرة اللبنانية مصدر قلق متزايد الأهمية للصحة العامة ، حيث يفرض عبئا اقتصاديا كبيرا على المجتمع بسبب العمالة المفقودة والنفقات الطبية الإضافية2،3. في الولايات المتحدة وحدها ، تتجاوز التكاليف المباشرة وغير المباشرة المرتبطة بالليرة اللبنانية 100 مليار دولار سنويا ، بما في ذلك النفقات الطبية وخسائر الدخل وخسائرالعمالة. غالبا ما يحدث LBP بسبب تنكس القرص الفقري (IVDD) 5،6،7،8. نظرا لارتفاع معدل انتشار LBP وتأثيره الاقتصادي ، فإن النمذجة الدقيقة ل IVDD أمر بالغ الأهمية لاستكشاف استراتيجيات العلاج.
لفهم الفيزيولوجيا المرضية ل IVDD وتقييم استراتيجيات العلاج ، تم تطوير واستخدام العديد من النماذج الحيوانية قبل السريرية في الجسم الحي 9. تم استخدام طرق متعددة في هذه النماذج للحث على تنكس القرص ، بما في ذلك إصابة القرص الجراحي أو الكيميائي ، والإجهاد الميكانيكي غير الجراحي ، والتعديل الجيني ، والحدوث الطبيعي10. من بين هذه الطرق ، تمثل الإصابة الجراحية ما يصل إلى 64.9٪ من تحريض IVDD ، مع كون ثقب الإبرة هو التقنية الجراحية الأساسية11. يتميز نموذج ثقب الإبرة بسهولة إنشائه والحد الأدنى من الضرر الذي يلحق بحيوانات التجارب. تشمل مناهج ثقب الإبرة الشائعة الوصول المفتوح خلف الصفاق إلى مساحة القرص القطني والثقب الخلفي الوحشي عن طريق الجلد. يمكن تحديد عمق الإدخال باستخدام المراقبة الشعاعية أو طول الإبرة. والجدير بالذكر أن النهج عن طريق الجلد قد يقلل من تلف الأنسجة علاجي المنشأ مقارنة بالطرق الجراحية المفتوحة ، بينما يوفر الوصول إلى خلف الصفاق فائدة ميزات التصور المباشر التي لم تتم مقارنتها كميا في الأدبيات السابقة. بينما بحثت الدراسات في آثار استخدام الإبر بأقطار مختلفة12 وثقب أقراصمختلفة 10 على تحريض IVDD ، فإن الدراسات المقارنة التي تركز على مناهج ثقب الإبرة المختلفة لا تزال محدودة. يوفر نموذج الأرانب المختار فائدة خاصة للباحثين الذين يحتاجون إلى دراسات طولية فعالة من حيث التكلفة مع تقييمات تصوير متكررة ، نظرا لتشابهه التشريحي مع الأقراص البشرية ومزاياه على نماذج القوارض من حيث الحجم والهيكل13.
في هذه الدراسة ، تم إنشاء نماذج الأرانب من IVDD القطني باستخدام طريقتين: الوصول المفتوح خلف الصفاق لثقب مساحة القرص القطني والبزل الخلفي الجانبي عن طريق الجلد. تم تحليل مجموعة شاملة من مقاييس النتائج ، بما في ذلك التغيرات المورفولوجية والنسيجية والإشعاعية.
Protocol
التزمت الإجراءات التجريبية الحيوانية بصرامة بدليل رعاية واستخدام المختبر الصادر عن المعاهد الوطنية للصحة وتمت الموافقة عليها من قبل لجنة أخلاقيات التجريبي بجامعة تشنغدو للطب الصيني التقليدي (رقم الموافقة على الأخلاقيات: 2021-23). تم استخدام خمسة عشر أرنبا نيوزيلندا أبيض سليما يبلغ من العمر 4 أشهر ونظيفا (2.25 كجم ± 0.25 كجم) ، بما في ذلك سبعة ذكور وثماني إناث. تم إيواء في بيئة بدرجة حرارة الغرفة تتراوح بين 23 درجة مئوية ± 3 درجات مئوية ورطوبة تتراوح بين 60٪ ± 10٪ تقريبا لمدة أسبوع واحد من التكيف ، مع حرية الوصول إلى الماء والغذاء. قبل التجربة ، تم تعيين الأرانب ال 15 بشكل عشوائي إلى واحدة من ثلاث مجموعات: المجموعة الوهمية (المجموعة أ) ، ومجموعة البزل الليفي الحلقي عن طريق الجلد (المجموعة ب) ، ومجموعة ثقب الحلقة الليفية الفضائية عبر الصفاق (المجموعة ج) ، مع خمسة أرانب في كل مجموعة. تفاصيل الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. إنشاء نموذج IVDD للأرانب عن طريق ثقب الحلقة الليفية عن طريق الجلد
ملاحظة: تم إنشاء نموذج IVDD للأرانب باستخدام طريقة البزل الحلقي الليفي عن طريق الجلد. اتبع الإجراء طريقة نمذجة الثقب الموصوفة بواسطة Luo TD et al.14 وتم إجراؤه تحت توجيه الأشعة السينية (الشكل 1).
- تحضير الأرنب.
- قم بصيام الأرانب لمدة 24 ساعة قبل الجراحة ، مع ضمان الوصول إلى الماء.
- يتم تطبيق التخدير عن طريق الحقن الوريدي بنسبة 3٪ من البنتوباربيتال الصوديوم (1.3 مل/كغ) في وريد الأذن (باتباع البروتوكولات المعتمدة مؤسسيا).
- تأكد من التخدير الناجح عن طريق التحقق من عدم الحركة ، واسترخاء العضلات ، ونقص منعكس القرنية ، وغياب الاستجابة للألم.
- ضع ووضع علامة على الأرنب.
- ثبت الأرنب في وضع الانبطاح على لوحة التثبيت.
- حلق وإعداد المنطقة الجراحية ، ثم تحسس معالم العظام.
- المس المعالم العظمية على ظهر أسفل ظهر الأرنب. حدد موقع الضلع السفلي على الأرنب ، والذي يتوافق عادة مع الفقرة فوق العملية الشوكية L1 مباشرة.
- حدد العملية الشائكة أسفل هذه الفقرة مباشرة لتحديد العملية الشائكة L1.
- حدد أعلى نقاط القمم الحرقفية ، تقريبا مع الفقرة L6.
- تتبع من العملية الشائكة L1 لتحديد كل عملية شائكة بالتتابع وصولا إلى L7.
- استخدم قلم وسم لتمييز العملية الشائكة L1 بوضوح على ظهر الأرنب.
- انتقل إلى العملية الشائكة التالية وقم بتمييزها على أنها L2.
- استمر في وضع علامة على كل عملية شائكة لاحقة على أنها L3 و L4 و L5 و L6 و L7. تأكد من أن كل علامة مميزة وبترتيب تسلسلي لتحديد الهوية بوضوح.
- حدد موقع الثقب وحدد موقعه.
- جس العمليات المستعرضة وحدد موقع نقطة المنتصف بين الأطراف البعيدة ل L5 و L6.
- ضع علامة على هذه النقطة واستعد لإدخال إبرة الثقب فوقها حوالي 1 سم.
- أدخل إبرة الثقب.
- أمسك إبرة الثقب أفقيا وأدخلها باتجاه الأرض ، مما يؤدي إلى كسر الجلد.
- تقدم الإبرة للوصول إلى الجسم الفقري L4 وتحقق من الوضع الصحيح تحت توجيه الأشعة السينية.
- قم بإمالة الإبرة رأسية قليلا بزاوية حوالي 20 درجة باتجاه القرص الفقري L4-5. ثقب القرص وتأكيد دقة الثقب تحت فحص الأشعة السينية.
- إجراء ثقوب القرص.
- ثقب الحلقة الليفية بدقة ، باستخدام توجيه الأشعة السينية إذا لزم الأمر.
- كرر عملية الثقب للأقراص الفقرية L2-3 و L3-4 ، مع ثقب كل مرة.
- حافظ على عمق ثقب يبلغ حوالي 5 مم مع وقت مكوث يبلغ 5 ثوان لكل قرص.
- رعاية ما بعد العملية
- تطهير وتضميد موقع البزل.
- حقن البنسلين في العضل في الألوية الكبرى بجرعة 40,000 U لكل أرنب يوميا لمدة 3 أيام.
ملاحظة: اضبط النهج إذا واجهت الإبرة أنسجة صلبة. استخدم توجيه الأشعة السينية للثقب الدقيق. راقب تعافي الأرنب وقدم الرعاية المناسبة.
2. إنشاء نموذج IVDD للأرانب عن طريق ثقب الحلقة الليفية عبر الفضاء خلف الصفاق
ملاحظة: تم إنشاء نموذج IVDD للأرانب باستخدام طريقة ثقب الحلقة الليفية الليفية عبر خلف الصفاق12 (الشكل 2).
- قم بصيام الأرانب لمدة 24 ساعة قبل الجراحة ، مما يسمح بالوصول إلى الماء.
- تخدير الأرنب عن طريق حقن 3٪ من الصوديوم البنتوباربيتال (1.3 مل / كغ) في وريد الأذن (باتباع البروتوكولات المعتمدة مؤسسيا).
- تأكد من أن الأرنب غير متحرك ، مع عضلات مسترخية ، ولا يوجد رد فعل للقرنية ، ولا استجابة للألم للضغط لتأكيد التخدير الناجح.
- ثبت الأرنب في وضع الانبطاح على لوحة التثبيت.
- حلق وإعداد المنطقة الجراحية.
- ملامح العظام ، بمناسبة العمليات الشائكة القطنية L1-L7 على ظهر أسفل الظهر للأرنب بقلم وسم.
- أعد ملامسة العمليات العرضية للأرنب لتحديد موقع الشق الجراحي.
- ضع ستارة معقمة وقم بتطهير الجلد المحلي لضمان ظروف معقمة.
- استخدم نهجا خلف الصفاق الخلفي لتشريح اللفافة والعضلات طبقة تلو الأخرى ، مما يؤدي إلى تعريض الجانب الجانبي للقرص الفقري القطني.
- ثقب الحلقة الليفية بإبرة ثقب على عمق حوالي 5 مم ووقت سكون 5 ثوان.
- قم بثقب الأقراص الفقرية L3-4 و L4-5 و L5-6 بالتتابع ، مما يضمن ثقب كل قرص مرة واحدة فقط.
- خياطة الأنسجة طبقة تلو الأخرى باستخدام خيط خياطة قطرها 0.25 مم.
- تطهير وضمادة موقع البزل بعد النمذجة.
- حقن البنسلين في العضل في الألوية الكبيرة للأرنب يوميا بجرعة 40,000 U لكل أرنب لمدة ثلاثة أيام متتالية.
ملاحظة: استخدم البنسلين بمواصفات 800,000 وحدة / قارورة ورقم الموافقة 140051251 الأدوية البيطرية.
3. اختيار نماذج IVDD وتقييم النتائج
- تقييم الوفيات والحالة العامة للأرانب
- راقب الأرانب أسبوعيا لتحديد البقاء على قيد الحياة وتسجيل الحالة العامة ، بما في ذلك الحالة العقلية وأنماط النشاط وتناول الطعام والماء ، بالإضافة إلى إخراج البراز والبول.
- سجل الملاحظات بدقة ولاحظ أي تغييرات في الحالة.
- مراقبة وزن الأرانب
- سجل وزن جسم الأرانب قبل وبعد إنشاء النموذج ، وكذلك قبل جمع الأنسجة.
- تأكد من تسجيل الوزن بدقة ولاحظ أي تغييرات مهمة.
- التقييم الإشعاعي
- احصل على تصوير رنين مغناطيسي سهمي 1.5T T2 لتسلسل النبات الفقري القطني بالكامل لكل أرنب أبيض قبل وبعد 4 أسابيع من إنشاء النموذج.
- لاحظ مدى تنكس القرص الفقري.
- قم بإجراء تقييم كمي لتنكس القرص الفقري باستخدام نظام تصنيف Pfirrmann المعدل الذي اقترحه Griffith et al.15. اطلب من ثلاثة أخصائيي أشعة مستقلين أعمى تقييم تسلسلات التصوير بالرنين المغناطيسي المرجحة ب T2 وفقا للمعايير المعمول بها: ارتفاع القرص ، وشدة إشارة النواة اللبية ، وسلامة الليف الحلقي.
- تحديد الدرجات النهائية من خلال الإجماع عندما تتجاوز التناقضات مستوى صف واحد. قم بإجراء جميع التقييمات باستخدام برنامج عرض DICOM القياسي مع إعدادات العرض المعايرة.
- التقييم النسيجي المرضي والتسجيل
- قم بالقتل الرحيم للأرانب بعد 4 أسابيع من النمذجة باستخدام جرعة زائدة في الوريد من الصوديوم البنتوباربيتال (باتباع البروتوكولات المعتمدة مؤسسيا) ، ثم قم بحصاد الأقراص الفقرية L2-L3 و L3-L4 و L4-L5 بسرعة على الجليد15.
- قم بتثبيت أقراص L2-L3 في 4٪ بارافورمالدهيد وقم بتخزين العينات المتبقية عند -80 درجة مئوية.
- اغمر الأقراص الثابتة في محلول مزيل للتكلس ، مثل 10٪ EDTA ، مما يضمن الغمر الكامل. قم بتغيير محلول إزالة الكلس كل 2-3 أيام للحفاظ على الفعالية.
- راقب عملية إزالة الكلس بانتظام حتى يتم تحقيق إزالة الكلس الكامل ، والتي قد تستغرق من عدة أيام إلى أسبوع ، اعتمادا على حجم القرص وسمكه.
- اشطف الأقراص منزوعة الكلس جيدا بالماء الجاري لإزالة أي آثار لمحلول إزالة الكلس.
- قم بتجفيف الأقراص عن طريق غمرها في سلسلة من محاليل الإيثانول المتدرجة ، بدءا من 70٪ من الإيثانول وزيادة تدريجية إلى 100٪ من الإيثانول. قم بإجراء كل خطوة من خطوات الجفاف لمدة 1-2 ساعة لكل درجة.
- تسلل الأقراص المجففة بشمع البارافين (نقطة الانصهار 56-58 درجة مئوية) لمدة 2 ساعة على الأقل ، مما يضمن التسلل الكامل.
- قم بتضمين الأقراص المخللة في كتلة شمع ، ووضعها للتقسيم. اترك كتلة الشمع تبرد وتتصلب تماما.
- قسم الأقراص المدمجة إلى شرائح رفيعة وموحدة (5-10 ميكرومتر) باستخدام ميكروتوم. قم بتركيب الأقسام على شرائح زجاجية لمزيد من التحليل ، مثل التلوين النسيجي أو الكيمياء المناعية12،13.
- قم بإجراء تلطيخ الهيماتوكسيلين واليوزين (HE) ، والتقط الصور تحت المجهر البصري ، وقم بتعيين درجات تلطيخ HE باستخدام مقياس الدرجات النسيجيالمرضي IVD 12.
- اختبار TUNEL
- إزالة الشمع وإعادة ترطيب أقسام أنسجة القرص الفقري ، ثم إجراء استرجاع المستضد ونفاذية الغشاء.
- أضف خليطا من الكاشف 1 (TdT) والكاشف 2 (dUTP) بنسبة 1: 9 واحتضانه في غرفة رطبة.
- اغسل الأقسام باستخدام المخزن المؤقت PBS ، وقم بتطبيق صبغة DAPI ، واحتضانها في الظلام في درجة حرارة الغرفة لمدة 10 دقائق.
- التقط الصور باستخدام ماسح ضوئي بانورامي مؤتمت بالكامل وبرنامج معالجة.
- كشف السيتوكين
- قتل الأرانب التجريبية (الخطوة 3.4.1) وجمع عينات الدم من الشريان الأورطي البطني.
- عينات دم أرنب الطرد المركزي عند 2000 × جم لمدة 10 دقائق عند 25 درجة مئوية لفصل المصل عن خلايا الدم. اجمع المادة الطافية (المصل) بعناية ، مع التأكد من عدم تضمين أي بقايا خلوية.
- اتبع التعليمات الواردة في مجموعة ELISA للكشف عن تعبير TGF-β في عينات المصل.
- قم بإعداد الكواشف والمعايير وفقا للتوجيهات الواردة في مجموعة ELISA.
- أضف عينات المصل إلى الآبار المناسبة في لوحة ELISA.
- احتضن اللوحة في درجة الحرارة والمدة الموصى بها وفقا لتعليمات المجموعة.
- اغسل اللوحة حسب التعليمات لإزالة الكواشف غير المرتبطة.
- أضف الجسم المضاد للكشف والكواشف الضرورية الأخرى ، باتباع بروتوكول المجموعة.
- احتضان اللوحة مرة أخرى للوقت ودرجة الحرارة المحددين.
- اغسل الطبق جيدا لإزالة الكواشف الزائدة.
- أضف محلول الركيزة إلى الآبار واحتضنه للفترة الموصى بها للسماح بتطوير اللون.
- قم بقياس الكثافة الضوئية (OD) باستخدام مقياس الطيف الضوئي بالطول الموجي المحدد في تعليمات المجموعة.
- احسب تركيزات العينة عن طريق استبدال قيم OD في المعادلة المقدمة أو باستخدام المنحنى القياسي المتولد من التركيزات المعروفة للمعايير.
4. التحليل الإحصائي
- إجراء التحليل الإحصائي باستخدام البرامج المتاحة تجاريا.
- عبر عن المتغيرات المستمرة كمتوسط ± انحراف معياري.
- استخدم ANOVA أحادي الاتجاه لاختبار الاختلافات بين المجموعات.
- تطبيق اختبارات LSD للمقارنات الزوجية.
- استخدم المقاييس المتكررة ANOVA لتحليل بيانات المقاييس المتكررة.
- إجراء تحليل ارتباط سبيرمان لتقييم الارتباط بين المتغيرات.
- اضبط مستوى الدلالة على α = 0.05 واعتبر قيم P الأقل من 0.05 ذات دلالة إحصائية.
النتائج
تم إجراء العمليات الجراحية دون مطارقات. توفي أرنب واحد من المجموعة ب (مجموعة البزل عن طريق الجلد) بعد العملية. استأنفت جميع الأخرى أنماط التغذية والنشاط الطبيعية بعد الجراحة ونجت طوال الفترة التجريبية. لم يلاحظ أي نزيف أو عدوى طويلة الأمد في مواقع الجراحة.
تقييم الوفيات والحالة العامة
كان معدل الوفيات 0٪ لكل من المجموعة A والمجموعة C ، بينما كان 20٪ لكل من المجموعة B (الجدول 1). أظهرت الأرانب في المجموعة أ ظروفا عامة طبيعية. قبل النمذجة ، عرضت الأرانب في المجموعة B ظروفا مماثلة لتلك الموجودة في المجموعة الوهمية. ومع ذلك ، في اليوم الثاني بعد النمذجة ، أظهرت الأرانب في المجموعة ب انخفاضا في الحيوية ، وانخفاض النشاط ، وتفضيلا للتجمع في زوايا أقفاصها ، وانخفاض كبير في تناول الطعام ، وتناول الماء دون تغيير نسبيا ، والفراء الباهت ، وزيادة إنتاج البراز ، والبراز الرخو. بمرور الوقت ، مات أرنب واحد من المجموعة ب ، بينما استعادت الأرانب المتبقية تدريجيا تناولها الغذائي إلى مستويات ما قبل النمذجة. ومع ذلك ، ظلت حيويتها ونشاطها وحالة الفراء واتساق البراز أدنى من مستويات ما قبل النمذجة. في المقابل ، أظهرت الأرانب في المجموعة C حيوية ونشاطا وتناول طعام ولمعان الفراء واتساق البراز مقارنة بتلك الموجودة في المجموعة ب ، بدءا من الأسبوع الثاني بعد النمذجة.
تقييم وزن الجسم
كان وزن جسم الأرانب متشابها في جميع المجموعات قبل النمذجة. ومع ذلك ، قبل أخذ العينات ، كانت الأرانب في المجموعة B تزن أكثر من تلك الموجودة في المجموعتين A و C (الشكل 3).
التقييم الإشعاعي للأقراص الفقرية
لوحظ فقدان ارتفاع القرص الفقري (IVD) في المجموعتين B و C بدءا من أسبوع واحد بعد الجراحة (الشكل 4). أظهر تصنيف Pfirrmann اختلافات كبيرة بين المجموعات (p < 0.001 ، اختبار Kruskal-Wallis مع تحليل Dunn اللاحق). حافظت المجموعة الوهمية (المجموعة أ) على مورفولوجيا القرص السليمة ، مع درجات موحدة من الدرجة 1 عبر جميع العينات (متوسط [النطاق]: 1 [1-1]). أظهرت مجموعة البزل عن طريق الجلد (المجموعة ب) تنكسا معتدلا إلى شديدا (متوسط [النطاق]: 6 [5-6]) ، بينما أظهرت مجموعة النهج خلف الصفاق (المجموعة ج) درجة مماثلة من التنكس (متوسط [النطاق]: 5 [5-6]). كشفت المقارنات الزوجية عن اختلافات كبيرة بين: (1) المجموعة أ مقابل المجموعة ب (ص = 0.0039) ؛ (2) المجموعة أ مقابل. المجموعة ج (ص = 0.0039) ؛ (3) المجموعة ب مقابل. المجموعة ج (ص = 0.206). ظلت الموثوقية بين المقيمين ممتازة (α كريبندورف = 0.87) (الجدول 2).
التقييم النسيجي المرضي والتسجيل
كشف التحليل النسيجي النوعي عن اختلافات في البنية التحتية وتسلل الأوعية الدموية وترسب الأنسجة الحبيبية بين المجموعات A و B و C (الشكل 5). أشارت الدرجات المرضية إلى درجات أعلى بشكل ملحوظ في المجموعتين B و C مقارنة بالمجموعة A ، حيث أظهرت المجموعة C درجة أعلى من المجموعة B (الجدول 3).
نتائج فحص TUNEL
لم يلاحظ أي خلايا موت الخلايا المبرمج ذات النقاط الخضراء أو موت الخلايا المبرمج للخلايا اللبية في المجموعة أ. في المقابل ، أظهرت المجموعتان B و C العديد من الخلايا المبرمج المبرمج الخضراء المنقطة وموت الخلايا المبرمج لخلايا النواة اللبية الشديدة مقارنة بالمجموعة أ. ومع ذلك ، عرضت المجموعة B عددا أقل نسبيا من الخلايا المبرمج الخضراء المنقطة وموت الخلايا المبرمج للنواة اللبية أقل من المجموعة C (الشكل 6).
نتائج الكشف عن TGF-β
كشف التحليل الكمي لمستويات TGF-β عن اختلافات كبيرة بين المجموعات (ANOVA أحادي الاتجاه ، F (2،12) = 87.3 ، ص < 0.0001). أظهرت المجموعة الوهمية (المجموعة ألف) تركيزات خط الأساس TGF-β (متوسط ± SD: 1944.6 بيكوغرام/مل ± 182.3 بيكوغرام/مل)، بينما أظهرت مجموعة البزل عن طريق الجلد (المجموعة ب) ارتفاعا معتدلا (2635.4 بيكوغرام/مل ± 136.7 بيكوغرام/مل). والجدير بالذكر أن مجموعة النهج خلف الصفاق (المجموعة C) أظهرت تنظيما كبيرا ل TGF-β (4143.7 بيكوغرام / مل ± 353.7 بيكوغرام / مل) ، متجاوزة مستويات المجموعة ب بنسبة 57.2٪ (بعد هوك توكي: ص < 0.0001). ظلت الاختلافات البيولوجية الفردية في حدود 15٪ من متوسط المجموعة (نطاق معامل التباين: 5.2٪ -8.5٪) (الشكل 7 ، الجدول 4).

الشكل 1: نمذجة ثقب الحلقة الليفية عن طريق الجلد تحت توجيه الأشعة السينية. تم استخدام التصوير بالأشعة السينية لضمان ثقب دقيق للحلقة الليفية. يوضح الشكل إبرة الثقب الموضعية تحت الأشعة السينية قبل اختراق القرص. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
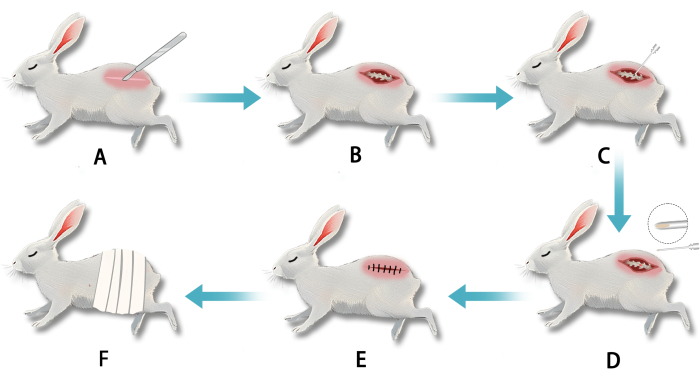
الشكل 2: إنشاء نموذج أرنب أبيض لتنكس القرص الفقري (IVDD) باستخدام ثقب فجوة خلف الصفاق عبر الصفاق في الحلقة الليفية. (أ) بعد التخدير ، تم إجراء شق في الجزء الفقري القطني. (ب) كشف التشريح الحاد عن الحلقة الليفية القطنية. (ج) تم ثقب الحلقة الليفية بإبرة لتعطيل النواة اللبية. (د) كان نسيج النواة اللبية البيضاء الشبيهة بالهلام مرئيا عند طرف الإبرة عند الانسحاب. (ه) تم خياطة الشق بعد اكتمال البزل. (و) تم تضميد الجرح بعد الجراحة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: متوسط أوزان جسم الأرانب البيضاء في كل مجموعة قبل النمذجة وأخذ العينات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 4: صور التصوير بالرنين المغناطيسي للأقراص الفقرية للأرانب قبل النمذجة وبعدها. ولوحظ فقدان كبير في الارتفاع في المجموعتين باء وجيم بعد النمذجة، مع خسارة أكبر في المجموعة جيم مقارنة بالمجموعة باء.

الشكل 5: الصور النسيجية للأقراص الفقرية للأرانب. (أ) أظهرت المجموعة أ شكل نواة لب منتظمة ، وتوزيع وفير للخلايا ، وفجوات في المصفوفة الجيلاتينية (الأسهم السوداء) ، والصفائح الليفية الغضرفية المنظمة (الأسهم الصفراء). (ب) أظهرت المجموعة ب شكل نواة لب غير منتظمة ، وانخفاض عدد الخلايا ، وتوزيع المصفوفة العنقودية ، والتجاويف الكبيرة (الأسهم الزرقاء) ، والصفائح الليفية الغضروفية المعطلة المنفصلة عن النواة اللبية (الأسهم الخضراء). (ج) أظهرت المجموعة C شكل نواة لب غير منتظم ، وفقدان كبير للخلايا (الأسهم الأرجوانية) ، وتوزيع المصفوفة العنقودية ، والأشكال غير المنتظمة ، والصفائح الليفية الغضروفي المعطلة (الأسهم الحمراء). شريط المقياس: 200 ميكرومتر (ينطبق على جميع الألواح). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
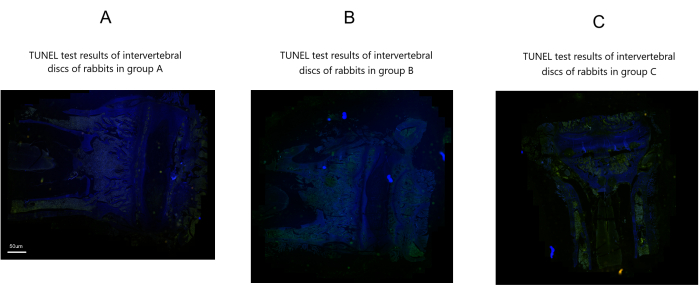
الشكل 6: نتائج فحص TUNEL للأقراص الفقرية للأرانب بعد النمذجة في ثلاث مجموعات. شريط المقياس: 50 ميكرومتر (ينطبق على جميع الألواح). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
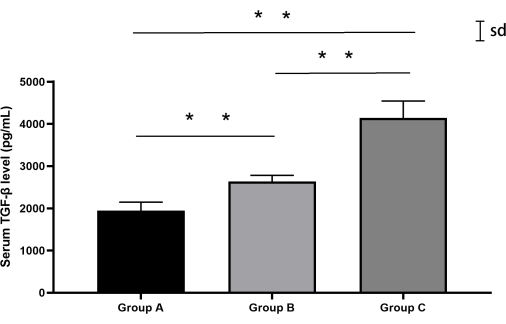
الشكل 7: مستويات مصل TGF-β في الأرانب من كل مجموعة. أظهرت كلتا المجموعتين B و C مستويات أعلى من TGF-β مقارنة بالمجموعة A ، حيث أظهرت المجموعة C أعلى المستويات. تمثل أشرطة الخطأ متوسط ± الانحراف المعياري (SD). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مجموعة | A | B | C |
| وفيات | 0 | 20% | 0 |
الجدول 1: معدل الوفيات بعد النمذجة في مجموعات الأرانب.
| n | توزيع الصف Pfirrmann | الوسيط [النطاق] | مقارنة بين المجموعات (القيمة الاحتمالية) |
| 5 | 1 (100%) | 1 [1-1] | أ مقابل ب: 0.0039 |
| 5 | 5 (40%), 6 (60%) | 6 [5-6] | A مقابل C: 0.0039 |
| 5 | 5 (60%), 6 (40%) | 5 [5-6] | B مقابل C: 0.206 |
الجدول 2: تحليل مقارن لتنكس القرص الفقري باستخدام نظام تصنيف Pfirrmann المعدل.
| مجموعة | A | B | C |
| درجة علم الأمراض | 4 | 10 | 11 |
الجدول 3: متوسط الدرجات المرضية للأرانب في كل مجموعة.
| مجموعة | n | متوسط ± SD (بيكوغرام / مل) | متوسط [المدى] (بيكوغرام / مل) | المقارنات الزوجية (Tukey's HSD) |
| A | 5 | 1944.6 ± 182.3 | 2054.5 [1709.1-2126.6] | أ مقابل ب: ع = 0.0012 |
| B | 5 | 2635.4 ± 136.7 | 2544.6 [2526.6-2889.6] | A مقابل C: p < 0.0001 |
| C | 5 | 4143.7 ± 353.7 | 4090.3 [3694.9-4595.5] | B مقابل C: p < 0.0001 |
| تم تطبيع جميع القيم إلى إجمالي محتوى البروتين (ميكروغرام / مجم من الأنسجة) تم التحقق من افتراضات ANOVA (اختبار ليفين ص = 0.18 ، شابيرو ويلك ص > 0.15) أحجام التأثير: كوهين f = 2.16 (تأثير كبير) * |
الجدول 4: ملامح تركيز TGF-β عبر المجموعات التجريبية.
Discussion
تشير نتائج هذه الدراسة إلى أن كلا من أساليب البزل عن طريق الجلد وعبر خلف الصفاق فعالة في إحداث تنكس القرص الفقري (IVDD) في نماذج الأرانب. والجدير بالذكر أنه بناء على تقييم شامل للحالة العامة ، والوفيات ، والتقييم النسيجي المرضي ، ومقايسة TUNEL ، ومستويات TGF-β في الدم ، أدى نموذج البزل عبر خلف الصفاق إلى تغييرات تنكسية أكثر شمولا في الأقراص الفقرية مع الحفاظ على معدل وفيات أقل.
الإصابة الجراحية هي الطريقة الأكثر استخداما لإنشاء نماذج IVDD. منذ أن نجح ليبسون وموير (1981) في تطوير نموذج IVDD في الأرانب باستخدام بضع الحلقة الجراحيةللمشرط 16 ، ظهرت تقنيات إصابة مختلفة ، بما في ذلك ثقب الإبرة12،14،17 ، واستئصال الحلقة الليفية18 ، واستئصال القرص الكلي ، وبضع النواة الجزئي والكلي19 ، وشفط النواة اللبية20،21،22 ، وإصابةالحفر 23،24 ، 26. تفرض هذه الطرق الجراحية أعباء فسيولوجية مختلفة على ، مما يؤدي إلى درجات متفاوتة من تحريض IVDD. بالمقارنة مع نماذج إصابة المشرط ، فإن نماذج ثقب الإبرة تحاكي بشكل أفضل الطبيعة البطيئة والتقدمية لتنكس القرص14.
بينما قدم Masuda et al.12 تقنية البزل عبر خلف الصفاق ، فإن هذا النهج الجراحي المفتوح يتطلب وقتا أطول للعملية ، ومهارة جراحية أكبر ، وموارد جراحية أكثر شمولا. بالإضافة إلى ذلك ، قد يزيد الشق الذي تم إنشاؤه أثناء الجراحة المفتوحة من خطر الإصابة بالعدوى وألم ما بعد الجراحة والوفيات في التجارب. في المقابل ، فإن تقنية البزل الخلفي الوحشي عن طريق الجلد التي اقترحها Luo et al.14 أكثر وضوحا وجدوى. تؤكد نتائج هذه الدراسة أن نموذج البزل عبر الصفاق خلف الصفاق يحفز تغييرات تنكسية أكثر شمولا في الأقراص الفقرية مع الحفاظ على معدل وفيات أقل.
في نماذج ثقب الإبرة ، يتأثر مدى وطبيعة التغيرات التنكسية في القرص الفقري بعوامل ميكانيكية وبيولوجية متعددة تختلف بمرور الوقت27،28. هذه العوامل هي المساهمات المرضية المعروفة في تنكس القرص. يؤدي ثقب الإبرة إلى تعطيل سلامة الحلقة الليفية ، ويقلل من مرونة النواة اللبية ، ويعزز موت الخلايا المبرمج للنواة اللبية ، ويغير توزيع الإجهاد الميكانيكي داخل العمودالفقري 29. بالإضافة إلى ذلك ، يثير الموقع المصاب استجابات التهابية وإصلاح مبكرة ، بما في ذلك تكاثر الشعيرات الدموية في الحلقة الليفية الخارجية وترسب التحبيب والأنسجة الليفية. تم وصف هذه التفاعلات المرضية في العديد من النماذج الحيوانية لتنكس القرص30،31ولوحظت أيضا في فتق القرص القطني البشري.
في هذه الدراسة ، كانت هذه الاستجابات المرضية واضحة في كلا النموذجين. بالمقارنة مع البزل عن طريق الجلد ، يوفر البزل عبر خلف الصفاق رؤية ثقب أوضح ، مما يسهل تعطيلا أكثر دقة للحلقة الليفية ويؤدي إلى التهاب أكبر في موقع الإصابة. قد يفسر هذا سبب إحداث نموذج البزل عبر خلف الصفاق إلى تغييرات تنكسية أكثر شمولا في الأقراص الفقرية. على العكس من ذلك ، فإن الرؤية المحدودة في البزل عن طريق الجلد تزيد من احتمالية حدوث خلل في الحبل الشوكي أو الهياكل الأخرى ، مما قد يفسر معدل الوفيات الأعلى الذي لوحظ في هذه الدراسة.
يتم إنشاء نماذج ثقب الإبرة لتنكس القرص بشكل شائع في الصغيرة مثل الفئران والفئران32 ، وكذلك الأرانب12،14،16. ومع ذلك ، فإن هذه التقنية قابلة للتطبيق أيضا على الكبيرة ، بما في ذلك33 ، والأغنام34 ، والماشية35 ،الريسوس 36 ، لتطوير نموذج IVDD. على الرغم من وجود مخاوف بشأن الاختلافات بين النماذج الحيوانية رباعية الأرجل والعمود الفقري البشري ذو القدمين ، تشير الدراسات الميكانيكية الحيوية إلى أن العمود الفقري رباعي الأرجل يعاني في المقام الأول من الضغط المحوري ، على غرار العمود الفقري البشري37،38. يتم مواجهة قوى الانحناء والالتواء الشديدة التي تعمل على العمود الفقري رباعي الأرجل من خلال العضلات والأربطة المجاورة للنشاع التي تولد قوى شد كبيرة على طول المحورالطويل 38. نظرا للقيود الأخلاقية والعملية ، فإن الأرانب الأكبر حجما مكلفة ويصعب الحصول عليها ، مما يجعل الأرانب نموذجا مثاليا لأبحاث IVDD. علاوة على ذلك ، فإن التماثل التشريحي بين الأرانب والأقراص الفقرية البشرية - لا سيما وجود مفاصل الوجه والعضلات المجاورة الشوكية والأربطة - يدعم أيضا ملاءمة الأرانب لهذا البحث13،39.
ومع ذلك ، توجد اختلافات كبيرة بين هذه النماذج الحيوانية والأقراص الفقرية البشرية ، مما يمثل قيدا لهذه الدراسة. تشمل هذه الاختلافات الاختلافات في حجم القرص ، والخصائص التشريحية ، ووجود الخلايا الظهرية ، وقابلية ترجمة النتائج التجريبية. وبالتالي ، تواجه هذه الدراسة بعض التحديات. بالإضافة إلى ذلك ، في الممارسة السريرية ، غالبا ما يعاني المرضى من تغيرات تنكسية موجودة مسبقا في القرص الفقري ، مما قد يؤدي في النهاية إلى فتق القرص والضغط العصبي. في المقابل ، تسببت النماذج الحيوانية في هذه الدراسة في التنكس عن طريق إصابة الأقراص السليمة. قد تقل الأقراص المتدهورة من قدرات الإصلاح الذاتي والتجدد بعد الإصابة أو قد تظهر تنكسا أكثر حدة مقارنة بالأقراص السليمة التي تم فحصها في هذه التجربة. يجب أن تأخذ الأبحاث المستقبلية حول النماذج الحيوانية لتنكس القرص الفقري هذه العوامل في الاعتبار الكامل.
تعتبر كل من أساليب البزل عن طريق الجلد وعبر خلف الصفاق فعالة في إنشاء نماذج تنكس القرص الفقري في الأرانب. ومع ذلك ، فإن تقنية البزل عبر خلف الصفاق تحفز تغييرات تنكسية أكثر شمولا بينما ترتبط أيضا بمعدل وفيات أقل.
Disclosures
اي.
Acknowledgements
تم دعم هذا المشروع من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 82004497) ، ومؤسسة علوم ما بعد الدكتوراه الصينية (رقم 2021M693788) ، والمؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 82105043) ، ومؤسسة العلوم الطبيعية لمقاطعة سيتشوان (رقم 2023NSFSC1814).
Materials
| Name | Company | Catalog Number | Comments |
| 0.3 T Veterinary Maenetic Resonance lmaging(MRI) | NINGBO CHUANSHANJIA | CSJ-MR | |
| Alcohol medical | LIRCON | 20230107 | |
| Benzylpenicillin potassium | Jiangxi Keda Animal Pharmaceutical | 140051251 | |
| Haemostatic forceps | SHINVA | 20211239 | |
| Injection syringe | CONPUVON | 20153151307 | |
| Knife blades | Hons Medincal | 20210615 | |
| Medical absorbent cotton ball | Cofoe | 20210006 | |
| Medical suture needle | Shanghai Xiaoyi Medical Devices | 20192020430 | |
| Medullo-puncture needle | Yangzhou Jiangzhou Medical Devices | 20190902 | Used to puncture lumbar disc |
| Physiological saline | NeilMed | C1210504D2 | |
| Povidone iodine solution | Sichuan IJIS Medical Technology | 20221209 | |
| Quasi-microbalance | Explorer | ||
| Rabbit dissection operating table | Zhenhua Biomedical | ZH-BXT-3Z | |
| Shaver | AUX | ||
| Statistical analysis softeare | IBM | SPSS | |
| Sterile gauze | Cofoe | 20202140675 | |
| Surgical gloves | DR.LERSH | 20172140028 | |
| Surgical knife | Hons Medinca | 20210019 | |
| Surgical tweezers | SHINVA | 20210233 | |
| USB-C data transmission line | KINI | ||
| White light photography microscope | Nikon | Eclipse Ci-L |
References
- Vos, T., et al. Years lived with disability (YLDS) for 1160 sequelae of 289 diseases and injuries 1990-2010: A systematic analysis for the global burden of disease study 2010. Lancet. 380 (9859), 2163-2196 (2012).
- Daly, C., Ghosh, P., Jenkin, G., Oehme, D., Goldschlager, T. A review of animal models of intervertebral disc degeneration: Pathophysiology, regeneration, and translation to the clinic. Biomed Res Int. 2016, 5952165 (2016).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: Pain and disc content. Nat Rev Rheumatol. 10 (1), 44-56 (2014).
- Katz, J. N. Lumbar disc disorders and low-back pain: Socioeconomic factors and consequences. J Bone Joint Surg Am. 88 (Suppl 2), 21-24 (2006).
- Cheung, K. M. The relationship between disc degeneration, low back pain, and human pain genetics. Spine J. 10 (11), 958-960 (2010).
- Knezevic, N. N., Candido, K. D., Vlaeyen, J. W. S., Van Zundert, J., Cohen, S. P. Low back pain. Lancet. 398 (10294), 78-92 (2021).
- Livshits, G., et al. Lumbar disc degeneration and genetic factors are the main risk factors for low back pain in women: The UK twin spine study. Ann Rheum Dis. 70 (10), 1740-1745 (2011).
- Takatalo, J., et al. Does lumbar disc degeneration on magnetic resonance imaging associate with low back symptom severity in young finnish adults. Spine (Phila Pa 1976). 36 (25), 2180-2189 (2011).
- Singh, K., Masuda, K., An, H. S. Animal models for human disc degeneration. Spine J. 5 (6 Suppl), 267s-279s (2005).
- Liang, T., et al. Constructing intervertebral disc degeneration animal model: A review of current models. Front Surg. 9, 1089244 (2022).
- Poletto, D. L., Crowley, J. D., Tanglay, O., Walsh, W. R., Pelletier, M. H. Preclinical in vivo animal models of intervertebral disc degeneration. Part 1: A systematic review. JOR Spine. 6 (1), e1234 (2023).
- Masuda, K., et al. A novel rabbit model of mild, reproducible disc degeneration by an anulus needle puncture: Correlation between the degree of disc injury and radiological and histological appearances of disc degeneration. Spine (Phila Pa 1976). 30 (1), 5-14 (2005).
- Kroeber, M. W., et al. New in vivo animal model to create intervertebral disc degeneration and to investigate the effects of therapeutic strategies to stimulate disc regeneration. Spine (Phila Pa 1976). 27 (23), 2684-2690 (2002).
- Luo, T. D., et al. A percutaneous, minimally invasive annulus fibrosus needle puncture model of intervertebral disc degeneration in rabbits. J Orthop Surg (Hong Kong). 26 (3), 2309499018792715 (2018).
- Griffith, J. F., et al. Modified Pfirrmann grading system for lumbar intervertebral disc degeneration. Spine (Phila Pa 1976). 32 (24), E708-E712 (2007).
- Lipson, S. J., Muir, H. Experimental intervertebral disc degeneration: Morphologic and proteoglycan changes over time. Arthritis Rheum. 24 (1), 12-21 (1981).
- Wang, Y., Wu, Y., Deng, M., Kong, Q. Establishment of a rabbit intervertebral disc degeneration model by percutaneous posterolateral puncturing of lumbar discs under local anesthesia. World Neurosurg. 154, e830-e837 (2021).
- Gruber, H. E., et al. A new small animal model for the study of spine fusion in the sand rat: Pilot studies. Lab Anim. 43 (3), 272-277 (2009).
- Alini, M., et al. Are animal models useful for studying human disc disorders/degeneration. Eur Spine J. 17 (1), 2-19 (2008).
- Gandhi, S. D., et al. Intradiscal delivery of anabolic growth factors and a metalloproteinase inhibitor in a rabbit acute lumbar disc injury model. Int J Spine Surg. 14 (4), 585-593 (2020).
- Omlor, G. W., et al. A new porcine in vivo animal model of disc degeneration: Response of anulus fibrosus cells, chondrocyte-like nucleus pulposus cells, and notochordal nucleus pulposus cells to partial nucleotomy. Spine (Phila Pa 1976). 34 (25), 2730-2739 (2009).
- Serigano, K., et al. Effect of cell number on mesenchymal stem cell transplantation in a canine disc degeneration model. J Orthop Res. 28 (10), 1267-1275 (2010).
- Daly, C. D., et al. A comparison of two ovine lumbar intervertebral disc injury models for the evaluation and development of novel regenerative therapies. Global Spine J. 8 (8), 847-859 (2018).
- Kim, J. S., et al. The rat intervertebral disk degeneration pain model: Relationships between biological and structural alterations and pain. Arthritis Res Ther. 13 (5), R165 (2011).
- Lim, K. Z., et al. Ovine lumbar intervertebral disc degeneration model utilizing a lateral retroperitoneal drill bit injury. J Vis Exp. (123), e55753 (2017).
- Zhang, Y., et al. Histological features of the degenerating intervertebral disc in a goat disc-injury model. Spine (Phila Pa 1976). 36 (19), 1519-1527 (2011).
- Freemont, A. J. The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain. Rheumatology (Oxford). 48 (1), 5-10 (2009).
- Vergroesen, P. P., et al. Mechanics and biology in intervertebral disc degeneration: A vicious circle. Osteoarthritis Cartilage. 23 (7), 1057-1070 (2015).
- Natarajan, R. N., Andersson, G. B., Patwardhan, A. G., Verma, S. Effect of annular incision type on the change in biomechanical properties in a herniated lumbar intervertebral disc. J Biomech Eng. 124 (2), 229-236 (2002).
- Hoogendoorn, R. J., Wuisman, P. I., Smit, T. H., Everts, V. E., Helder, M. N. Experimental intervertebral disc degeneration induced by chondroitinase ABC in the goat. Spine (Phila Pa 1976). 32 (17), 1816-1825 (2007).
- Melrose, J., Roberts, S., Smith, S., Menage, J., Ghosh, P. Increased nerve and blood vessel ingrowth associated with proteoglycan depletion in an ovine annular lesion model of experimental disc degeneration. Spine (Phila Pa 1976). 27 (12), 1278-1285 (2002).
- Elmounedi, N., et al. Impact of needle size on the onset and the progression of disc degeneration in rats. Pain Physician. 25 (6), 509-517 (2022).
- Tellegen, A. R., et al. Intradiscal delivery of celecoxib-loaded microspheres restores intervertebral disc integrity in a preclinical canine model. J Control Release. 286, 439-450 (2018).
- Vadalà, G., et al. The transpedicular approach as an alternative route for intervertebral disc regeneration. Spine. 38 (6), E319-E324 (2013).
- Yang, J. J., Li, F., Hung, K. C., Hsu, S. H., Wang, J. L. Intervertebral disc needle puncture injury can be repaired using a gelatin-poly (γ-glutamic acid) hydrogel: An in vitro bovine biomechanical validation. Eur Spine J. 27 (10), 2631-2638 (2018).
- Xi, Y., et al. Minimally invasive induction of an early lumbar disc degeneration model in rhesus monkeys. Spine (Phila Pa 1976). 38 (10), E579-E586 (2013).
- Elliott, D. M., Sarver, J. J. Young investigator award winner: Validation of the mouse and rat disc as mechanical models of the human lumbar disc. Spine (Phila Pa 1976). 29 (7), 713-722 (2004).
- Smit, T. H. The use of a quadruped as an in vivo model for the study of the spine - biomechanical considerations. Eur Spine J. 11 (2), 137-144 (2002).
- Romaniyanto, F. N. U., et al. Effectivity of puncture method for intervertebral disc degeneration animal models: Review article. Annals Med Surg. 85 (7), 3501-3505 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved