Method Article
Vergleich des transperitonealen retroperitonealen Zugangs und der perkutanen Punktion für die Modellierung der lumbalen Bandscheibendegeneration bei Kaninchen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In diesem Protokoll wurden perkutane und transretroperitoneale Punktionen in einem Modell der Bandscheibendegeneration (IVDD) bei Kaninchen verglichen. Beide Methoden induzierten IVDD; Der transretroperitoneale Ansatz führte jedoch zu umfangreicheren Veränderungen und einer geringeren Mortalität.
Zusammenfassung
In dieser Studie wird die Wirksamkeit von zwei Methoden zur Induktion der Bandscheibendegeneration (IVDD) bei Kaninchen verglichen: die perkutane und die transretroperitoneale Punktion des Anulus fibrosus. Fünfzehn gesunde männliche neuseeländische weiße Kaninchen wurden nach dem Zufallsprinzip in drei Gruppen eingeteilt: Scheinpunktion, perkutane Punktion und transretroperitoneale Punktion. Eine umfassende Bewertung, die Mortalitätsraten, morphologische und histologische Bewertungen, radiologische Bildgebung und Biomarker-Analysen umfasste, wurde durchgeführt, um einen genauen und detaillierten Vergleich zwischen den beiden Methoden zu gewährleisten. Die Ergebnisse zeigen, dass beide Punktionstechniken erfolgreich IVDD im Kaninchenmodell induzierten. Der transretroperitoneale Ansatz führte jedoch zu ausgeprägteren degenerativen Veränderungen der Bandscheiben bei einer signifikant niedrigeren Mortalitätsrate im Vergleich zur perkutanen Methode. Diese Ergebnisse unterstreichen die Vorteile des transretroperitonealen Ansatzes bei der IVDD-Modellierung. Diese Studie liefert wertvolle Einblicke in die Etablierung von IVDD-Modellen und legt den Grundstein für zukünftige Untersuchungen zu effektiven Behandlungsstrategien für Kreuzschmerzen, die letztendlich die Patientenergebnisse verbessern.
Einleitung
In den letzten Jahrzehnten haben sich Rückenschmerzen (LBP) als die bedeutendste Muskel-Skelett-Erkrankung herausgestellt, die die Lebensqualität beeinträchtigt1. LBP ist zu einem immer wichtigeren Problem der öffentlichen Gesundheit geworden und stellt eine erhebliche wirtschaftliche Belastung für die Gesellschaft dar, da Arbeitskräfte ausfallen und zusätzliche medizinische Kosten anfallen 2,3. Allein in den Vereinigten Staaten belaufen sich die direkten und indirekten Kosten im Zusammenhang mit LBP auf über 100 Milliarden US-Dollar pro Jahr, einschließlich medizinischer Ausgaben, Einkommensverluste und Arbeitsverluste4. LBP wird häufig durch Bandscheibendegeneration (IVDD) verursacht5,6,7,8. Angesichts der hohen Prävalenz und der wirtschaftlichen Auswirkungen von LBP ist eine genaue Modellierung der IVDD entscheidend für die Erforschung von Behandlungsstrategien.
Um die Pathophysiologie der IVDD zu verstehen und Behandlungsstrategien zu evaluieren, wurden verschiedene präklinische in vivo Tiermodelle entwickelt und eingesetzt9. In diesen Modellen wurden mehrere Methoden eingesetzt, um eine Bandscheibendegeneration zu induzieren, darunter chirurgische oder chemische Bandscheibenverletzungen, nicht-invasive mechanische Beanspruchung, genetische Modifikation und natürliches Auftreten10. Unter diesen Methoden machen chirurgische Verletzungen bis zu 64,9 % der IVDD-Induktion aus, wobei die Nadelpunktion die primäre chirurgische Technik ist11. Das Nadelpunktionsmodell zeichnet sich durch seine einfache Etablierung und minimale Schädigung der Versuchstiere aus. Zu den gängigen Ansätzen der Nadelpunktion gehören der offene retroperitoneale Zugang zum lumbalen Bandscheibenraum und die perkutane posterolaterale Punktion. Die Einstichtiefe kann mittels Röntgenüberwachung oder Nadellänge bestimmt werden. Insbesondere kann der perkutane Ansatz die iatrogene Gewebeschädigung im Vergleich zu offenen chirurgischen Methoden reduzieren, während der retroperitoneale Zugang den Vorteil direkter Visualisierungsmerkmale bietet, die in der bisherigen Literatur nicht quantitativ verglichen wurden. Während Studien die Auswirkungen der Verwendung von Nadeln mit unterschiedlichen Durchmessern12 und der Punktion verschiedener Bandscheiben10 auf die IVDD-Induktion untersucht haben, sind vergleichende Studien, die sich auf verschiedene Ansätze zur Nadelpunktion konzentrieren, nach wie vor begrenzt. Das ausgewählte Kaninchenmodell bietet aufgrund seiner anatomischen Ähnlichkeit mit menschlichen Bandscheiben und seiner Vorteile gegenüber Nagetiermodellen in Bezug auf Größe und Struktur einen besonderen Nutzen für Forscher, die kostengünstige Längsschnittstudien mit häufigen bildgebenden Untersuchungen benötigen13.
In dieser Studie wurden Kaninchenmodelle der lumbalen IVDD mit zwei Methoden etabliert: offener retroperitonealer Zugang zur Punktion des lumbalen Bandscheibenraums und perkutane posterolaterale Punktion. Eine umfassende Reihe von Ergebnismessungen, einschließlich morphologischer, histologischer und radiologischer Veränderungen, wurde analysiert.
Protokoll
Die tierexperimentellen Verfahren hielten sich strikt an den von den National Institutes of Health herausgegebenen Leitfaden für die Pflege und Verwendung von Labortieren und wurden von der Ethikkommission für Versuchstiere der Universität für Traditionelle Chinesische Medizin Chengdu genehmigt (Ethik-Zulassungsnummer: 2021-23). Fünfzehn gesunde, 4 Monate alte, saubere neuseeländische weiße Kaninchen (2,25 kg ± 0,25 kg) wurden verwendet, darunter sieben männliche und acht weibliche Kaninchen. Die Tiere wurden eine Woche lang in einer Umgebung mit einer Raumtemperatur von 23 °C ± 3 °C und einer Luftfeuchtigkeit von ca. 60 % ± 10 % untergebracht, mit freiem Zugang zu Wasser und Futter. Vor dem Experiment wurden die 15 Kaninchen nach dem Zufallsprinzip einer von drei Gruppen zugeteilt: der Scheingruppe (Gruppe A), der perkutanen Anulus-Fibrosus-Punktionsgruppe (Gruppe B) und der transretroperitonealen Raumanulus-Fibrosus-Punktionsgruppe (Gruppe C), mit jeweils fünf Kaninchen. Die Einzelheiten zu den in dieser Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Etablierung des Kaninchen-IVDD-Modells durch perkutane Anulus-Fibrosus-Punktion
HINWEIS: Das Kaninchen-IVDD-Modell wurde mit der perkutanen Anulus-Fibrosus-Punktionsmethode erstellt. Das Verfahren folgte der von Luo TD et al.14 beschriebenen Punktionsmodellierungsmethode und wurde unter Röntgenkontrolle durchgeführt (Abbildung 1).
- Bereiten Sie das Kaninchen vor.
- Fasten Sie die Kaninchen vor der Operation 24 Stunden lang, um den Zugang zu Wasser zu gewährleisten.
- Verabreichen Sie eine Anästhesie durch intravenöse Injektion von 3% Pentobarbital-Natrium (1,3 ml/kg) in die Ohrvene (gemäß den institutionell anerkannten Protokollen).
- Bestätigen Sie eine erfolgreiche Anästhesie, indem Sie auf Immobilität, entspannte Muskeln, fehlenden Hornhautreflex und fehlende Schmerzreaktion prüfen.
- Positionieren und markieren Sie das Kaninchen.
- Befestigen Sie das Kaninchen in Bauchlage auf einem Fixierbrett.
- Rasieren und bereiten Sie den Operationsbereich vor, dann tasten Sie die Knochenmarkierungen ab.
- Palpieren Sie die knöchernen Orientierungspunkte auf dem Lendenwirbel des Kaninchens ab. Lokalisieren Sie die unterste Rippe des Kaninchens, die typischerweise dem Wirbel direkt über dem Dornfortsatz L1 entspricht.
- Identifizieren Sie den Dornfortsatz unmittelbar unter diesem Wirbel, um den Dornfortsatz L1 zu bestimmen.
- Lokalisieren Sie die höchsten Punkte der Beckenkämme, etwa auf Höhe des L6-Wirbels.
- Verfolgen Sie den Dornfortsatz L1 zurück, um jeden Dornfortsatz sequentiell bis hinunter zu L7 zu identifizieren.
- Verwenden Sie einen Markierungsstift, um den L1-Dornfortsatz deutlich auf dem Rücken des Kaninchens zu markieren.
- Wechseln Sie zum nächsten Dornfortsatz und markieren Sie ihn als L2.
- Markieren Sie weiterhin jeden nachfolgenden Dornfortsatz als L3, L4, L5, L6 und L7. Stellen Sie sicher, dass jede Markierung eindeutig und in sequenzieller Reihenfolge ist, um eine eindeutige Identifizierung zu gewährleisten.
- Lokalisieren und markieren Sie die Einstichstelle.
- Palpieren Sie die Querfortsätze und lokalisieren Sie den Mittelpunkt zwischen den distalen Enden von L5 und L6.
- Markieren Sie diesen Punkt und bereiten Sie sich darauf vor, die Einstichnadel ca. 1 cm darüber einzuführen.
- Führen Sie die Einstichnadel ein.
- Halten Sie die Einstichnadel waagerecht und führen Sie sie in Richtung Boden ein, wobei Sie die Haut verletzen.
- Schieben Sie die Nadel vor, um den L4-Wirbelkörper zu erreichen und überprüfen Sie die korrekte Positionierung unter Röntgenkontrolle.
- Kippen Sie die Nadel leicht kopfförmig in einem Winkel von ca. 20° in Richtung Bandscheibe L4-5. Punktion der Bandscheibe und Bestätigung der Genauigkeit der Punktion unter Röntgenuntersuchung.
- Führen Sie Bandscheibenpunktionen durch.
- Punktion des Anulus fibrosus präzise, ggf. mit Röntgenführung.
- Wiederholen Sie den Punktionsvorgang für die Bandscheiben L2-3 und L3-4 und punktieren Sie jeweils einmal.
- Eine Einstichtiefe von ca. 5 mm bei einer Verweilzeit von 5 s pro Scheibe ist einzuhalten.
- Pflege nach dem Eingriff
- Desinfizieren und verbinden Sie die Einstichstelle.
- Injizieren Sie Penicillin intramuskulär in den Gluteus maximus in einer Dosierung von 40.000 U pro Kaninchen täglich für 3 Tage.
HINWEIS: Passen Sie den Ansatz an, wenn die Nadel auf hartes Gewebe trifft. Verwenden Sie die Röntgenführung für eine präzise Punktion. Überwachen Sie die Genesung des Kaninchens und sorgen Sie für eine angemessene Pflege.
2. Etablierung eines Kaninchen-IVDD-Modells mittels transretroperitonealer Raumanulus-Fibrosus-Punktion
HINWEIS: Das Kaninchen-IVDD-Modell wurde unter Verwendung der transretroperitonealen Raumanulus-Punktionsmethode12 etabliert (Abbildung 2).
- Fasten Sie die Kaninchen vor der Operation 24 Stunden lang, um Zugang zu Wasser zu erhalten.
- Betäuben Sie das Kaninchen, indem Sie intravenös 3% Pentobarbital-Natrium (1,3 ml/kg) in die Ohrvene injizieren (gemäß den institutionell anerkannten Protokollen).
- Stellen Sie sicher, dass das Kaninchen unbeweglich ist, mit entspannten Muskeln, ohne Hornhautreflex und ohne Schmerzreaktion auf Druck, um eine erfolgreiche Anästhesie zu bestätigen.
- Befestigen Sie das Kaninchen in Bauchlage auf einem Fixierbrett.
- Rasieren Sie sich und bereiten Sie das Operationsgebiet vor.
- Palpatieren Sie Knochenmarkierungen, indem Sie die L1-L7-Dornfortsätze L1-L7 auf dem Lendenwirbelrücken des Kaninchens mit einem Markierungsstift markieren.
- Palpieren Sie die Querfortsätze des Kaninchens erneut, um die Stelle des chirurgischen Schnitts zu bestimmen.
- Legen Sie ein steriles Tuch auf und desinfizieren Sie die lokale Haut, um aseptische Bedingungen zu gewährleisten.
- Verwenden Sie einen posterioren retroperitonealen Ansatz, um die Faszie und die Muskeln Schicht für Schicht zu präparieren und den lateralen Aspekt der lumbalen Bandscheibe freizulegen.
- Den Anulus fibrosus mit einer Punktionsnadel bis zu einer Tiefe von ca. 5 mm und einer Verweilzeit von 5 s punktieren.
- Punktion der Bandscheiben L3-4, L4-5 und L5-6 nacheinander und stellen Sie sicher, dass jede Bandscheibe nur einmal punktiert wird.
- Vernähen Sie das Gewebe Schicht für Schicht mit einem Nahtfaden mit einem Durchmesser von 0,25 mm.
- Desinfizieren und verbinden Sie die Einstichstelle nach dem Modellieren.
- Injizieren Sie Penicillin täglich intramuskulär in den Gluteus maximus des Kaninchens in einer Dosierung von 40.000 U pro Kaninchen an drei aufeinanderfolgenden Tagen.
HINWEIS: Verwenden Sie Penicillin mit einer Spezifikation von 800.000 Einheiten/Durchstechflasche und der Zulassungsnummer Veterinary Drug 140051251.
3. Auswahl von IVDD-Modellen und Outcome-Evaluation
- Beurteilung der Mortalität und des Allgemeinzustands von Kaninchen
- Beobachten Sie Kaninchen wöchentlich, um das Überleben zu bestimmen und den Allgemeinzustand aufzuzeichnen, einschließlich des mentalen Zustands, der Aktivitätsmuster, der Nahrungs- und Wasseraufnahme sowie der Kot- und Harnausscheidung.
- Notieren Sie die Beobachtungen genau und notieren Sie alle Änderungen des Zustands.
- Gewichtsüberwachung von Kaninchen
- Erfassen Sie das Körpergewicht von Kaninchen vor und nach der Etablierung des Modells sowie vor der Gewebeentnahme.
- Stellen Sie eine genaue Gewichtsaufzeichnung sicher und notieren Sie alle wesentlichen Änderungen.
- Radiologische Beurteilung
- Erhalten Sie eine sagittale 1,5 T T2-gewichtete Magnetresonanztomographie der gesamten Lendenwirbelexplantatsequenz jedes weißen Kaninchens vor und 4 Wochen nach der Modelletablierung.
- Beobachten Sie das Ausmaß der Bandscheibendegeneration.
- Durchführung einer quantitativen Beurteilung der Bandscheibendegeneration unter Verwendung des modifizierten Pfirrmann-Grading-Systems, das von Griffith et al. vorgeschlagen wurde.15. Lassen Sie drei unabhängige verblindete Radiologen T2-gewichtete MRT-Sequenzen nach festgelegten Kriterien bewerten: Bandscheibenhöhe, Signalintensität des Nucleus pulposus und Integrität des Anulus fibrosus.
- Bestimmen Sie die Abschlussnoten im Konsens, wenn die Abweichungen eine Notenstufe überschreiten. Führen Sie alle Bewertungen mit standardisierter DICOM-Anzeigesoftware mit kalibrierten Anzeigeeinstellungen durch.
- Histopathologische Bewertung und Bewertung
- Einschläferung der Kaninchen 4 Wochen nach der Modellierung mit einer intravenösen Überdosis Pentobarbital-Natrium (gemäß institutionell anerkannten Protokollen) und rasche Entnahme der Bandscheiben L2-L3, L3-L4 und L4-L5 auf Eis15.
- Fixieren Sie die L2-L3-Scheiben in 4 % Paraformaldehyd und lagern Sie die restlichen Proben bei -80 °C.
- Tauchen Sie die festen Scheiben in eine Entkalkungslösung, z. B. 10 % EDTA, um ein vollständiges Eintauchen zu gewährleisten. Wechseln Sie die Entkalkungslösung alle 2-3 Tage, um die Wirksamkeit zu erhalten.
- Überwachen Sie den Entkalkungsprozess regelmäßig, bis eine vollständige Entkalkung erreicht ist, was je nach Scheibengröße und -dicke mehrere Tage bis zu einer Woche dauern kann.
- Spülen Sie die entkalkten Scheiben gründlich mit fließendem Wasser ab, um alle Spuren der Entkalkungslösung zu entfernen.
- Dehydrieren Sie die Scheiben, indem Sie sie in eine Reihe von abgestuften Ethanollösungen tauchen, beginnend mit 70 % Ethanol und allmählich auf 100 % Ethanol erhöhend. Führen Sie jeden Dehydratisierungsschritt 1-2 Stunden pro Klasse durch.
- Infiltrieren Sie die dehydrierten Scheiben mindestens 2 Stunden lang mit Paraffinwachs (Schmelzpunkt 56-58 °C), um eine vollständige Infiltration zu gewährleisten.
- Betten Sie die infiltrierten Scheiben in einen Wachsblock ein und positionieren Sie sie für das Schneiden. Lassen Sie den Wachsblock abkühlen und vollständig erstarren.
- Schneiden Sie die eingebetteten Discs mit einem Mikrotom in dünne, gleichmäßige Scheiben (5-10 μm). Die Schnitte werden für weitere Analysen, wie z. B. histologische Färbung oder Immunhistochemie, auf Objektträger montiert12,13.
- Führen Sie Hämatoxylin- und Eosin (HE)-Färbungen durch, nehmen Sie Bilder unter einem optischen Mikroskop auf und weisen Sie HE-Färbewerte mit der histopathologischen IVD-Notenskala12 zu.
- TUNEL-Assay
- Entwachsung und Rehydrierung von Bandscheibengewebeschnitten, anschließende Antigen-Retrieval und Membranpermeabilisierung.
- Eine Mischung aus Reagenz 1 (TdT) und Reagenz 2 (dUTP) im Verhältnis 1:9 zugeben und in einer befeuchteten Kammer inkubieren.
- Waschen Sie die Abschnitte mit PBS-Puffer, tragen Sie DAPI-Beize auf und inkubieren Sie sie 10 Minuten lang im Dunkeln bei Raumtemperatur.
- Nehmen Sie Bilder mit einem vollautomatischen Panoramascanner und einer Verarbeitungssoftware auf.
- Nachweis von Zytokinen
- Die Versuchskainchen einschläfern (Schritt 3.4.1) und Blutproben aus der Bauchschlagader entnehmen.
- Kaninchenblutproben bei 2000 × g für 10 min bei 25 °C zentrifugieren, um das Serum von den Blutzellen zu trennen. Sammeln Sie den Überstand (Serum) vorsichtig und stellen Sie sicher, dass keine Zelltrümmer enthalten sind.
- Befolgen Sie die Anweisungen im ELISA-Kit, um die Expression von TGF-β in Serumproben nachzuweisen.
- Bereiten Sie Reagenzien und Standards gemäß den Anweisungen im ELISA-Kit vor.
- Geben Sie Serumproben in die entsprechenden Vertiefungen in der ELISA-Platte.
- Inkubieren Sie die Platte bei der empfohlenen Temperatur und Dauer gemäß den Anweisungen des Kits.
- Waschen Sie die Platte wie angewiesen, um ungebundene Reagenzien zu entfernen.
- Fügen Sie den Nachweisantikörper und andere notwendige Reagenzien gemäß dem Protokoll des Kits hinzu.
- Inkubieren Sie die Platte erneut für die angegebene Zeit und Temperatur.
- Waschen Sie die Platte gründlich, um überschüssige Reagenzien zu entfernen.
- Geben Sie die Substratlösung in die Vertiefungen und inkubieren Sie sie für den empfohlenen Zeitraum, damit sich die Farbe entwickeln kann.
- Messen Sie die optische Dichte (OD) mit einem Spektralphotometer bei der in den Kit-Anweisungen angegebenen Wellenlänge.
- Berechnen Sie die Probenkonzentrationen, indem Sie die OD-Werte in die bereitgestellte Gleichung einfügen oder die Standardkurve verwenden, die aus den bekannten Konzentrationen der Standards generiert wird.
4. Statistische Auswertung
- Führen Sie statistische Analysen mit kommerziell erhältlicher Software durch.
- Drückt stetige Variablen als Mittelwert ± Standardabweichung aus.
- Verwenden Sie die unidirektionale ANOVA, um Unterschiede zwischen Gruppen zu testen.
- Wenden Sie LSD-Tests für paarweise Vergleiche an.
- Verwenden Sie die ANOVA für wiederholte Messungen, um Daten zu wiederholten Messungen zu analysieren.
- Führen Sie eine Spearman-Korrelationsanalyse durch, um die Korrelation zwischen Variablen zu bewerten.
- Legen Sie das Signifikanzniveau auf α = 0,05 fest, und betrachten Sie P-Werte kleiner als 0,05 als statistisch signifikant.
Ergebnisse
Die chirurgischen Eingriffe verliefen ohne Komplikationen. Ein Kaninchen aus Gruppe B (perkutane Punktionsgruppe) starb nach dem Eingriff. Alle anderen Tiere nahmen postoperativ ihre normalen Fress- und Aktivitätsmuster wieder auf und überlebten während des gesamten Versuchszeitraums. An den Operationsstellen wurden keine anhaltenden Blutungen oder Infektionen beobachtet.
Bewertung der Mortalität und des Allgemeinzustands
Die Sterblichkeitsrate lag sowohl in Gruppe A als auch in Gruppe C bei 0 %, während sie in Gruppe B bei 20 % lag (Tabelle 1). Kaninchen der Gruppe A wiesen normale Allgemeinbedingungen auf. Vor der Modellierung zeigten Kaninchen in Gruppe B ähnliche Bedingungen wie die in der Scheingruppe. Am zweiten Tag nach der Modellierung zeigten Kaninchen in Gruppe B jedoch eine verminderte Vitalität, eine verminderte Aktivität, eine Vorliebe für das Zusammenkauern in den Ecken ihrer Käfige, eine signifikant reduzierte Futteraufnahme, eine relativ unveränderte Wasseraufnahme, ein stumpferes Fell, eine erhöhte Kotausscheidung und losen Stuhl. Im Laufe der Zeit starb ein Kaninchen aus Gruppe B, während die restlichen Kaninchen ihre Nahrungsaufnahme allmählich wieder auf das Niveau vor der Modellierung brachten. Ihre Vitalität, Aktivität, ihr Fellzustand und ihre Stuhlkonsistenz blieben jedoch unter dem Niveau vor der Modellierung. Im Gegensatz dazu zeigten Kaninchen in Gruppe C eine bessere Vitalität, Aktivität, Nahrungsaufnahme, Fellglanz und Kotkonsistenz im Vergleich zu Kaninchen in Gruppe B, beginnend in der zweiten Woche nach der Modellierung.
Beurteilung des Körpergewichts
Das Körpergewicht der Kaninchen war vor der Modellierung in allen Gruppen ähnlich. Vor der Probenahme wogen Kaninchen der Gruppe B jedoch mehr als die Kaninchen der Gruppen A und C (Abbildung 3).
Radiologische Beurteilung von Bandscheiben
Ein Höhenverlust der Bandscheibe (IVD) wurde in den Gruppen B und C ab einer Woche postoperativ beobachtet (Abbildung 4). Die Pfirrmann-Einstufung zeigte signifikante Unterschiede zwischen den Gruppen (p < 0,001, Kruskal-Wallis-Test mit der Post-hoc-Analyse von Dunn). Die Scheingruppe (Gruppe A) behielt eine intakte Bandscheibenmorphologie bei, mit einheitlichen Werten des Grades 1 über alle Proben hinweg (Median [Bereich]: 1 [1-1]). Die perkutane Punktionsgruppe (Gruppe B) zeigte eine mittelschwere bis schwere Degeneration (Median [Bereich]: 6 [5-6]), während die Gruppe des retroperitonealen Zugangs (Gruppe C) einen vergleichbaren Degenerationsgrad aufwies (Median [Bereich]: 5 [5-6]). Paarweise Vergleiche zeigten signifikante Unterschiede zwischen: (1) Gruppe A vs. Gruppe B (p = 0,0039); (2) Gruppe A vs. Gruppe C (p = 0,0039); (3) Gruppe B vs. Gruppe C (p = 0,206). Die Inter-Rater-Reliabilität blieb ausgezeichnet (Krippendorffs α = 0,87) (Tabelle 2).
Histopathologische Beurteilung und Bewertung
Die qualitative histologische Analyse ergab Unterschiede in der Ultrastruktur, der vaskulären Infiltration und der Ablagerung von Granulationsgewebe zwischen den Gruppen A, B und C (Abbildung 5). Das pathologische Scoring zeigte signifikant höhere Werte in den Gruppen B und C im Vergleich zu Gruppe A, wobei Gruppe C eine höhere Punktzahl als Gruppe B aufwies (Tabelle 3).
Ergebnisse des TUNEL-Assays
In Gruppe A wurde keine signifikante Apoptose von grün punktierten apoptotischen Zellen oder Nucleus pulposus-Zellen beobachtet. Im Gegensatz dazu wiesen die Gruppen B und C im Vergleich zu Gruppe A zahlreiche grün punktförmige apoptotische Zellen und eine schwere Apoptose der Nucleus pulposus-Zellen auf. Gruppe B wies jedoch relativ weniger grün punktförmige apoptotische Zellen und weniger Apoptose der Nucleus pulposus-Zellen auf als Gruppe C (Abbildung 6).
TGF-β Nachweisergebnisse
Die quantitative Analyse der TGF-β-Spiegel ergab signifikante Unterschiede zwischen den Gruppen (unidirektionale ANOVA, F(2,12) = 87,3, p < 0,0001). Die Scheingruppe (Gruppe A) wies zu Studienbeginn TGF-β-Konzentrationen auf (mittlere ± SD: 1944,6 pg/ml ± 182,3 pg/ml), während die perkutane Punktionsgruppe (Gruppe B) eine moderate Erhöhung aufwies (2635,4 pg/ml ± 136,7 pg/ml). Bemerkenswert ist, dass die Gruppe des retroperitonealen Ansatzes (Gruppe C) eine erhebliche TGF-β-Hochregulation aufwies (4143,7 pg/ml ± 353,7 pg/ml) und damit die Werte von Gruppe B um 57,2 % übertraf (Tukey's post hoc: p < 0,0001). Die individuellen biologischen Variationen blieben innerhalb von 15 % der Gruppenmittelwerte (Variationskoeffizient: 5,2 %-8,5 %) (Abbildung 7, Tabelle 4).

Abbildung 1: Modellierung der perkutanen Anulus-Fibrosus-Punktion unter Röntgenkontrolle. Mit Hilfe von Röntgenaufnahmen wurde eine präzise Punktion des Anulus fibrosus gewährleistet. Die Abbildung zeigt die Punktionsnadel, die unter dem Röntgenbild vor der Bandscheibenpenetration lokalisiert ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
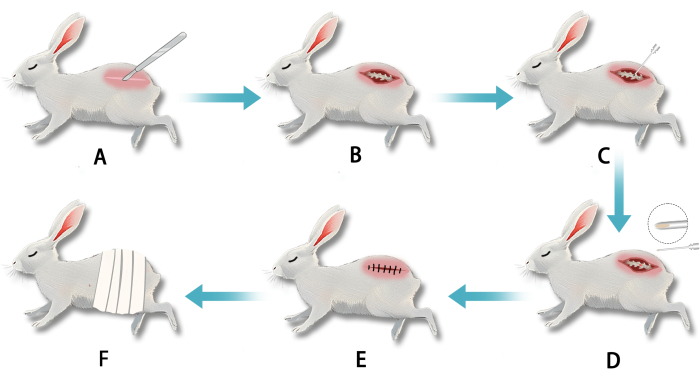
Abbildung 2: Etablierung eines Weißkaninchenmodells der Bandscheibendegeneration (IVDD) mittels transperitonealer retroperitonealer Lückenpunktion des Anulus fibrosus. (A) Nach der Anästhesie wurde ein Schnitt im Lendenwirbelsegment gesetzt. (B) Eine stumpfe Dissektion legte den lumbalen Anulus fibrosus frei. (C) Der Anulus fibrosus wurde mit einer Nadel punktiert, um den Nucleus pulposus zu stören. (D) Weißes, geleeartiges Nucleus pulposus-Gewebe war bei der Entnahme an der Nadelspitze sichtbar. (E) Der Schnitt wurde nach Abschluss der Punktion genäht. (F) Die Wunde wurde postoperativ verbunden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Mittleres Körpergewicht von weißen Kaninchen in jeder Gruppe vor der Modellierung und Probenahme. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: MRT-Bilder von Bandscheiben von Kaninchen vor und nach der Modellierung. In den Gruppen B und C nach der Modellierung wurde ein signifikanter Höhenverlust beobachtet, wobei der Verlust in Gruppe C im Vergleich zu Gruppe B größer war. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Histologische Bilder von Bandscheiben bei Kaninchen. (A) Gruppe A wies eine regelmäßige Form des Nucleus pulposus, eine reichliche Zellverteilung, Vakuolen in der gallertartigen Matrix (schwarze Pfeile) und organisierte faserknorpelige Platten (gelbe Pfeile) auf. (B) Gruppe B zeigte eine unregelmäßige Form des Nucleus pulposus, eine reduzierte Zellzahl, eine geclusterte Matrixverteilung, große Hohlräume (blaue Pfeile) und gestörte faserknorpelige Platten, die vom Nucleus pulposus getrennt waren (grüne Pfeile). (C) Gruppe C wies eine unregelmäßige Form des Nucleus pulposus, einen signifikanten Zellverlust (violette Pfeile), eine gehäufte Matrixverteilung, unregelmäßige Formen und gestörte faserknorpelige Platten (rote Pfeile) auf. Maßstabsleiste: 200 μm (gilt für alle Panels). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
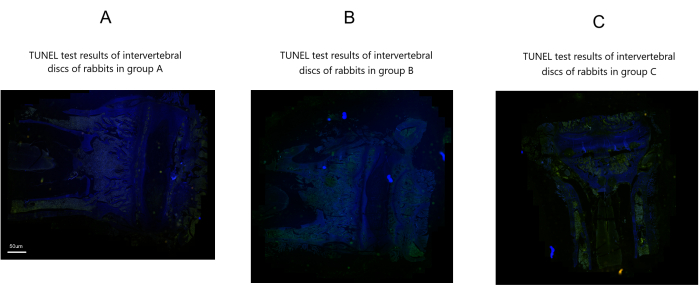
Abbildung 6: TUNEL-Assay-Ergebnisse von Kaninchen-Bandscheiben nach der Modellierung in drei Gruppen. Maßstabsleiste: 50 μm (gilt für alle Panels). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
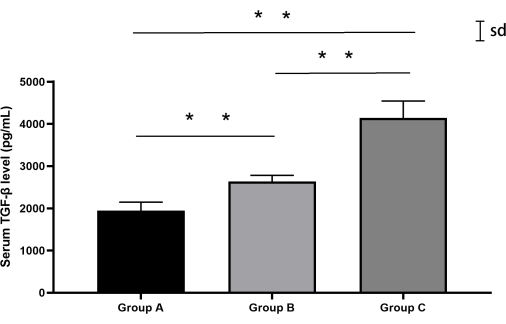
Abbildung 7: Serum-TGF-β-Spiegel bei Kaninchen aus jeder Gruppe. Sowohl Gruppe B als auch Gruppe C wiesen im Vergleich zu Gruppe A höhere TGF-β-Werte auf, wobei Gruppe C die höchsten Werte aufwies. Fehlerbalken stellen den Mittelwert ± Standardabweichung (SD) dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Gruppe | Ein | B | C |
| Sterblichkeit | 0 | 20% | 0 |
Tabelle 1: Mortalitätsrate nach der Modellierung in Kaninchengruppen.
| n | Pfirrmann Sortenverteilung | Median [Bereich] | Vergleich zwischen den Gruppen (p-Wert) |
| 5 | 1 (100%) | 1 [1-1] | A gegen B: 0,0039 |
| 5 | 5 (40%), 6 (60%) | 6 [5-6] | A gegen C: 0,0039 |
| 5 | 5 (60%), 6 (40%) | 5 [5-6] | B gegen C: 0,206 |
Tabelle 2: Vergleichende Analyse der Bandscheibendegeneration mit dem modifizierten Pfirrmann-Gradiersystem.
| Gruppe | Ein | B | C |
| Pathologische Punktzahl | 4 | 10 | 11 |
Tabelle 3: Durchschnittliche pathologische Werte von Kaninchen in jeder Gruppe.
| Gruppe | n | Mittlere ± SD (pg/ml) | Median [Bereich] (pg/ml) | Paarweise Vergleiche (Tukey's HSD) |
| Ein | 5 | 1944,6 ± 182,3 | 2054.5 [1709.1-2126.6] | A gegen B: p = 0,0012 |
| B | 5 | 2635,4 ± 136,7 | 2544.6 [2526.6-2889.6] | A gegen C: p < 0,0001 |
| C | 5 | 4143,7 ± 353,7 | 4090.3 [3694.9-4595.5] | B gegen C: p < 0,0001 |
| Alle Werte normiert auf den Gesamtproteingehalt (μg/mg Gewebe) ANOVA-Annahmen verifiziert (Levene-Test p = 0,18, Shapiro-Wilk p > 0,15) Effektstärken: Cohens f = 2,16 (großer Effekt)* |
Tabelle 4: TGF-β Konzentrationsprofile in Versuchsgruppen.
Diskussion
Die Ergebnisse dieser Studie deuten darauf hin, dass sowohl die perkutane als auch die transretroperitoneale Punktion bei der Induktion einer Bandscheibendegeneration (IVDD) in Kaninchenmodellen wirksam sind. Basierend auf einer umfassenden Bewertung des Allgemeinzustands, der Mortalität, der histopathologischen Beurteilung, des TUNEL-Assays und der TGF-β-Spiegel im Serum führte das transretroperitoneale Punktionsmodell zu umfangreicheren degenerativen Veränderungen der Bandscheiben bei gleichzeitig niedrigerer Mortalitätsrate.
Die chirurgische Verletzung ist die am häufigsten verwendete Methode zur Etablierung von IVDD-Modellen. Seit Lipson und Muir (1981) erfolgreich ein IVDD-Modell bei Kaninchen unter Verwendung der chirurgischen Skalpell-Anulotomie16 entwickelt haben, haben sich verschiedene Verletzungstechniken herausgebildet, darunter die Nadelpunktion 12,14,17, die Exzision des Anulus fibrosus 18, die totale Diskektomie, die partielle und totale Nukleotomie19, die Nucleus pulposus-Aspiration 20,21,22 und die Bohrverletzung 23,24. 26. Urheberrecht Diese chirurgischen Methoden stellen unterschiedliche physiologische Belastungen für die Tiere dar, was zu einer unterschiedlich starken IVDD-Induktion führt. Im Vergleich zu Modellen mit Skalpellverletzung ahmen Nadelpunktionsmodelle die langsame und fortschreitende Natur der Bandscheibendegeneration besser nach14.
Während Masuda et al.12 die transretroperitoneale Punktionstechnik einführten, erfordert dieser offene chirurgische Ansatz eine längere Operationszeit, größere chirurgische Fähigkeiten und umfangreichere chirurgische Ressourcen. Darüber hinaus kann der während der offenen Operation erstellte Schnitt das Risiko von Infektionen, postoperativen Schmerzen und Mortalität bei Versuchstieren erhöhen. Im Gegensatz dazu ist die von Luo et al.14 vorgeschlagene perkutane posterolaterale Punktionstechnik einfacher und praktikabler. Die Ergebnisse dieser Studie bestätigen, dass das transretroperitoneale Punktionsmodell bei geringerer Mortalitätsrate zu ausgedehnteren degenerativen Veränderungen der Bandscheiben führt.
Bei Nadelpunktionsmodellen werden das Ausmaß und die Art der degenerativen Veränderungen der Bandscheibe von mehreren mechanischen und biologischen Faktoren beeinflusst, die sich im Laufe der Zeit ändern27,28. Diese Faktoren sind bekanntermaßen pathologisch für die Bandscheibendegeneration verantwortlich. Die Nadelpunktion stört die Integrität des Anulus fibrosus, verringert die Elastizität des Nucleus pulposus, fördert die Apoptose der Nucleus pulposus-Zellen und verändert die mechanische Spannungsverteilung innerhalb der Wirbelsäule29. Darüber hinaus löst die verletzte Stelle entzündliche und frühe Reparaturreaktionen aus, einschließlich der Kapillarproliferation im äußeren Anulus fibrosus und der Ablagerung von Granulations- und fibrotischem Gewebe. Diese pathologischen Reaktionen wurden in zahlreichen Tiermodellen der Bandscheibendegeneration beschrieben30,31 und werden auch beim lumbalen Bandscheibenvorfall beim Menschen beobachtet.
In dieser Studie waren diese pathologischen Reaktionen in beiden Modellen offensichtlich. Im Vergleich zur perkutanen Punktion bietet die transretroperitoneale Punktion eine klarere Punktionsansicht, was eine präzisere Unterbrechung des Anulus fibrosus ermöglicht und zu einer stärkeren Entzündung an der Verletzungsstelle führt. Dies könnte erklären, warum das transretroperitoneale Punktionsmodell umfangreichere degenerative Veränderungen der Bandscheiben induziert. Umgekehrt erhöht die eingeschränkte Sichtbarkeit bei der perkutanen Punktion die Wahrscheinlichkeit, dass das Rückenmark oder andere Strukturen falsch punktiert werden, was möglicherweise für die in dieser Studie beobachtete höhere Mortalitätsrate verantwortlich ist.
Nadelpunktionsmodelle für Bandscheibendegeneration sind häufig bei Kleintieren wie Ratten und Mäusen32 sowie bei Kaninchen 12,14,16 etabliert. Diese Technik ist jedoch auch auf größere Tiere, einschließlich Hunde33, Schafe34, Rinder35 und Rhesusaffen36, für die IVDD-Modellentwicklung anwendbar. Obwohl Bedenken hinsichtlich der Unterschiede zwischen vierbeinigen Tiermodellen und der zweibeinigen menschlichen Wirbelsäule bestehen, deuten biomechanische Studien darauf hin, dass vierbeinige Wirbelsäulen in erster Linie axiale Kompression erfahren, ähnlich wie menschliche Wirbelsäulen37,38. Den intensiven Biege- und Torsionskräften, die auf die vierbeinigen Wirbelsäulen wirken, werden durch paraspinale Muskeln und Bänder entgegengewirkt, die entlang der Längsachse38 erhebliche Zugkräfte erzeugen. Angesichts ethischer und praktischer Zwänge sind größere Vierbeiner kostspielig und schwer zu erwerben, was Kaninchen zu einem idealen Modell für die IVDD-Forschung macht. Darüber hinaus unterstützt die anatomische Homologie zwischen Kaninchen und menschlichen Bandscheiben - insbesondere das Vorhandensein von Facettengelenken, paraspinalen Muskeln und Bändern - die Eignung von Kaninchen für diese Forschungweiter 13,39.
Es bestehen jedoch signifikante Unterschiede zwischen diesen Tiermodellen und menschlichen Bandscheiben, was eine Einschränkung dieser Studie darstellt. Zu diesen Unterschieden gehören Unterschiede in der Bandscheibengröße, anatomischen Eigenschaften, dem Vorhandensein von notochordalen Zellen und der Übertragbarkeit experimenteller Ergebnisse. Folglich steht diese Studie vor gewissen Herausforderungen. Darüber hinaus weisen Patienten in der klinischen Praxis häufig bereits bestehende degenerative Veränderungen der Bandscheibe auf, die letztendlich zu Bandscheibenvorfällen und neuraler Kompression führen können. Im Gegensatz dazu induzierten die Tiermodelle in dieser Studie eine Degeneration, indem sie gesunde Bandscheiben verletzten. Degenerierte Bandscheiben können nach einer Verletzung eine verminderte Selbstreparatur- und Regenerationsfähigkeit aufweisen oder eine schwerere Degeneration aufweisen als die in diesem Experiment untersuchten gesunden Bandscheiben. Zukünftige Forschungen an Tiermodellen der Bandscheibendegeneration sollten diese Faktoren in vollem Umfang berücksichtigen.
Sowohl die perkutane als auch die transretroperitoneale Punktion sind wirksam bei der Etablierung von Bandscheibendegenerationsmodellen bei Kaninchen. Die transretroperitoneale Punktionstechnik führt jedoch zu umfangreicheren degenerativen Veränderungen und ist gleichzeitig mit einer geringeren Mortalitätsrate verbunden.
Offenlegungen
Nichts.
Danksagungen
Dieses Projekt wurde von der National Natural Science Foundation of China (Nr. 82004497), der China Postdoctoral Science Foundation (Nr. 2021M693788), der National Natural Science Foundation of China (Nr. 82105043) und der Natural Science Foundation der Provinz Sichuan (Nr. 2023NSFSC1814) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.3 T Veterinary Maenetic Resonance lmaging(MRI) | NINGBO CHUANSHANJIA | CSJ-MR | |
| Alcohol medical | LIRCON | 20230107 | |
| Benzylpenicillin potassium | Jiangxi Keda Animal Pharmaceutical | 140051251 | |
| Haemostatic forceps | SHINVA | 20211239 | |
| Injection syringe | CONPUVON | 20153151307 | |
| Knife blades | Hons Medincal | 20210615 | |
| Medical absorbent cotton ball | Cofoe | 20210006 | |
| Medical suture needle | Shanghai Xiaoyi Medical Devices | 20192020430 | |
| Medullo-puncture needle | Yangzhou Jiangzhou Medical Devices | 20190902 | Used to puncture lumbar disc |
| Physiological saline | NeilMed | C1210504D2 | |
| Povidone iodine solution | Sichuan IJIS Medical Technology | 20221209 | |
| Quasi-microbalance | Explorer | ||
| Rabbit dissection operating table | Zhenhua Biomedical | ZH-BXT-3Z | |
| Shaver | AUX | ||
| Statistical analysis softeare | IBM | SPSS | |
| Sterile gauze | Cofoe | 20202140675 | |
| Surgical gloves | DR.LERSH | 20172140028 | |
| Surgical knife | Hons Medinca | 20210019 | |
| Surgical tweezers | SHINVA | 20210233 | |
| USB-C data transmission line | KINI | ||
| White light photography microscope | Nikon | Eclipse Ci-L |
Referenzen
- Vos, T., et al. Years lived with disability (YLDS) for 1160 sequelae of 289 diseases and injuries 1990-2010: A systematic analysis for the global burden of disease study 2010. Lancet. 380 (9859), 2163-2196 (2012).
- Daly, C., Ghosh, P., Jenkin, G., Oehme, D., Goldschlager, T. A review of animal models of intervertebral disc degeneration: Pathophysiology, regeneration, and translation to the clinic. Biomed Res Int. 2016, 5952165 (2016).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: Pain and disc content. Nat Rev Rheumatol. 10 (1), 44-56 (2014).
- Katz, J. N. Lumbar disc disorders and low-back pain: Socioeconomic factors and consequences. J Bone Joint Surg Am. 88 (Suppl 2), 21-24 (2006).
- Cheung, K. M. The relationship between disc degeneration, low back pain, and human pain genetics. Spine J. 10 (11), 958-960 (2010).
- Knezevic, N. N., Candido, K. D., Vlaeyen, J. W. S., Van Zundert, J., Cohen, S. P. Low back pain. Lancet. 398 (10294), 78-92 (2021).
- Livshits, G., et al. Lumbar disc degeneration and genetic factors are the main risk factors for low back pain in women: The UK twin spine study. Ann Rheum Dis. 70 (10), 1740-1745 (2011).
- Takatalo, J., et al. Does lumbar disc degeneration on magnetic resonance imaging associate with low back symptom severity in young finnish adults. Spine (Phila Pa 1976). 36 (25), 2180-2189 (2011).
- Singh, K., Masuda, K., An, H. S. Animal models for human disc degeneration. Spine J. 5 (6 Suppl), 267s-279s (2005).
- Liang, T., et al. Constructing intervertebral disc degeneration animal model: A review of current models. Front Surg. 9, 1089244 (2022).
- Poletto, D. L., Crowley, J. D., Tanglay, O., Walsh, W. R., Pelletier, M. H. Preclinical in vivo animal models of intervertebral disc degeneration. Part 1: A systematic review. JOR Spine. 6 (1), e1234 (2023).
- Masuda, K., et al. A novel rabbit model of mild, reproducible disc degeneration by an anulus needle puncture: Correlation between the degree of disc injury and radiological and histological appearances of disc degeneration. Spine (Phila Pa 1976). 30 (1), 5-14 (2005).
- Kroeber, M. W., et al. New in vivo animal model to create intervertebral disc degeneration and to investigate the effects of therapeutic strategies to stimulate disc regeneration. Spine (Phila Pa 1976). 27 (23), 2684-2690 (2002).
- Luo, T. D., et al. A percutaneous, minimally invasive annulus fibrosus needle puncture model of intervertebral disc degeneration in rabbits. J Orthop Surg (Hong Kong). 26 (3), 2309499018792715 (2018).
- Griffith, J. F., et al. Modified Pfirrmann grading system for lumbar intervertebral disc degeneration. Spine (Phila Pa 1976). 32 (24), E708-E712 (2007).
- Lipson, S. J., Muir, H. Experimental intervertebral disc degeneration: Morphologic and proteoglycan changes over time. Arthritis Rheum. 24 (1), 12-21 (1981).
- Wang, Y., Wu, Y., Deng, M., Kong, Q. Establishment of a rabbit intervertebral disc degeneration model by percutaneous posterolateral puncturing of lumbar discs under local anesthesia. World Neurosurg. 154, e830-e837 (2021).
- Gruber, H. E., et al. A new small animal model for the study of spine fusion in the sand rat: Pilot studies. Lab Anim. 43 (3), 272-277 (2009).
- Alini, M., et al. Are animal models useful for studying human disc disorders/degeneration. Eur Spine J. 17 (1), 2-19 (2008).
- Gandhi, S. D., et al. Intradiscal delivery of anabolic growth factors and a metalloproteinase inhibitor in a rabbit acute lumbar disc injury model. Int J Spine Surg. 14 (4), 585-593 (2020).
- Omlor, G. W., et al. A new porcine in vivo animal model of disc degeneration: Response of anulus fibrosus cells, chondrocyte-like nucleus pulposus cells, and notochordal nucleus pulposus cells to partial nucleotomy. Spine (Phila Pa 1976). 34 (25), 2730-2739 (2009).
- Serigano, K., et al. Effect of cell number on mesenchymal stem cell transplantation in a canine disc degeneration model. J Orthop Res. 28 (10), 1267-1275 (2010).
- Daly, C. D., et al. A comparison of two ovine lumbar intervertebral disc injury models for the evaluation and development of novel regenerative therapies. Global Spine J. 8 (8), 847-859 (2018).
- Kim, J. S., et al. The rat intervertebral disk degeneration pain model: Relationships between biological and structural alterations and pain. Arthritis Res Ther. 13 (5), R165 (2011).
- Lim, K. Z., et al. Ovine lumbar intervertebral disc degeneration model utilizing a lateral retroperitoneal drill bit injury. J Vis Exp. (123), e55753 (2017).
- Zhang, Y., et al. Histological features of the degenerating intervertebral disc in a goat disc-injury model. Spine (Phila Pa 1976). 36 (19), 1519-1527 (2011).
- Freemont, A. J. The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain. Rheumatology (Oxford). 48 (1), 5-10 (2009).
- Vergroesen, P. P., et al. Mechanics and biology in intervertebral disc degeneration: A vicious circle. Osteoarthritis Cartilage. 23 (7), 1057-1070 (2015).
- Natarajan, R. N., Andersson, G. B., Patwardhan, A. G., Verma, S. Effect of annular incision type on the change in biomechanical properties in a herniated lumbar intervertebral disc. J Biomech Eng. 124 (2), 229-236 (2002).
- Hoogendoorn, R. J., Wuisman, P. I., Smit, T. H., Everts, V. E., Helder, M. N. Experimental intervertebral disc degeneration induced by chondroitinase ABC in the goat. Spine (Phila Pa 1976). 32 (17), 1816-1825 (2007).
- Melrose, J., Roberts, S., Smith, S., Menage, J., Ghosh, P. Increased nerve and blood vessel ingrowth associated with proteoglycan depletion in an ovine annular lesion model of experimental disc degeneration. Spine (Phila Pa 1976). 27 (12), 1278-1285 (2002).
- Elmounedi, N., et al. Impact of needle size on the onset and the progression of disc degeneration in rats. Pain Physician. 25 (6), 509-517 (2022).
- Tellegen, A. R., et al. Intradiscal delivery of celecoxib-loaded microspheres restores intervertebral disc integrity in a preclinical canine model. J Control Release. 286, 439-450 (2018).
- Vadalà, G., et al. The transpedicular approach as an alternative route for intervertebral disc regeneration. Spine. 38 (6), E319-E324 (2013).
- Yang, J. J., Li, F., Hung, K. C., Hsu, S. H., Wang, J. L. Intervertebral disc needle puncture injury can be repaired using a gelatin-poly (γ-glutamic acid) hydrogel: An in vitro bovine biomechanical validation. Eur Spine J. 27 (10), 2631-2638 (2018).
- Xi, Y., et al. Minimally invasive induction of an early lumbar disc degeneration model in rhesus monkeys. Spine (Phila Pa 1976). 38 (10), E579-E586 (2013).
- Elliott, D. M., Sarver, J. J. Young investigator award winner: Validation of the mouse and rat disc as mechanical models of the human lumbar disc. Spine (Phila Pa 1976). 29 (7), 713-722 (2004).
- Smit, T. H. The use of a quadruped as an in vivo model for the study of the spine - biomechanical considerations. Eur Spine J. 11 (2), 137-144 (2002).
- Romaniyanto, F. N. U., et al. Effectivity of puncture method for intervertebral disc degeneration animal models: Review article. Annals Med Surg. 85 (7), 3501-3505 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten