Method Article
Progettazione e sviluppo di un modello per studiare l'effetto dell'ossigeno supplementare sul microbioma delle vie aeree della fibrosi cistica
In questo articolo
Riepilogo
L'obiettivo di questo protocollo è quello di sviluppare un sistema modello per l'effetto dell'iperossia sulle comunità microbiche delle vie aeree della fibrosi cistica. Il mezzo espettorato artificiale emula la composizione dell'espettorato e le condizioni di coltura iperossica modellano gli effetti dell'ossigeno supplementare sulle comunità microbiche polmonari.
Abstract
Si ritiene che le comunità microbiche delle vie aeree svolgano un ruolo importante nella progressione della fibrosi cistica (FC) e di altre malattie polmonari croniche. I microbi sono stati tradizionalmente classificati in base alla loro capacità di utilizzare o tollerare l'ossigeno. L'ossigeno supplementare è una terapia medica comune somministrata a persone con fibrosi cistica (pwCF); tuttavia, gli studi esistenti sull'ossigeno e sul microbioma delle vie aeree si sono concentrati su come l'ipossia (basso livello di ossigeno) piuttosto che l'iperossia (alto livello di ossigeno) colpisce le comunità microbiche polmonari anaerobiche prevalentemente aerobiche e facoltative. Per affrontare questa lacuna critica di conoscenza, questo protocollo è stato sviluppato utilizzando un mezzo espettorato artificiale che imita la composizione dell'espettorato da pwCF. L'uso della sterilizzazione con filtro, che produce un mezzo trasparente, consente ai metodi ottici di seguire la crescita di microbi unicellulari in colture in sospensione. Per creare condizioni iperossiche, questo sistema modello sfrutta le tecniche di coltivazione anaerobica consolidate per studiare le condizioni iperossiche; invece di rimuovere l'ossigeno, l'ossigeno viene aggiunto alle colture mediante spargimento quotidiano di flaconi di siero con una miscela di ossigeno compresso e aria. L'espettorato da 50 pwCF è stato sottoposto a sparging giornaliero per un periodo di 72 ore per verificare la capacità di questo modello di mantenere condizioni di ossigeno differenziale. Il sequenziamento metagenomico shotgun è stato eseguito su campioni di espettorato in coltura e non coltivati da 11 pwCF per verificare la capacità di questo mezzo di supportare la crescita di microbi commensali e patogeni comunemente presenti nell'espettorato della fibrosi cistica. Le curve di crescita sono state ottenute da 112 isolati ottenuti da pwCF per verificare la capacità di questo mezzo espettorato artificiale di supportare la crescita di comuni patogeni della fibrosi cistica. Troviamo che questo modello può coltivare un'ampia varietà di agenti patogeni e commensali nell'espettorato CF, recupera una comunità molto simile all'espettorato non coltivato in condizioni normossiche e crea diversi fenotipi di coltura in condizioni di ossigeno variabili. Questo nuovo approccio potrebbe portare a una migliore comprensione degli effetti imprevisti indotti dall'uso di ossigeno in pwCF sulle comunità microbiche delle vie aeree e sui comuni patogeni respiratori.
Introduzione
La fibrosi cistica (FC) è una malattia genetica caratterizzata dall'incapacità di eliminare il muco denso dai polmoni, che porta a infezioni ripetute e progressivo declino della funzione polmonare che spesso si traduce nella necessità di trapianto di polmone o morte. Il microbioma delle vie aeree delle persone con fibrosi cistica (pwCF) sembra tracciare l'attività della malattia1, con una riduzione della diversità microbica associata a esiti avversi a lungo termine2,3. Negli studi clinici di pwCF, l'ossigenoterapia supplementare è stata associata alla malattia più avanzata4,5, anche se tradizionalmente, l'uso dell'ossigenoterapia è stato visto semplicemente come un marcatore per la gravità della malattia6. Recenti studi di uno studio clinico su pazienti con insufficienza respiratoria hanno dimostrato che livelli più elevati di ossigeno nei pazienti sono paradossalmente associati ad un aumento delle infezioni batteriche gravi e ad una maggiore mortalità7, suggerendo che l'ossigeno supplementare può contribuire alla patogenesi della malattia. L'effetto dell'ossigeno supplementare sul microbioma polmonare della fibrosi cistica e sulle comunità microbiche polmonari e aeree associate non è stato ben studiato.
Gli studi meccanicistici spesso non possono essere eseguiti direttamente su soggetti umani a causa di difficoltà logistiche e potenziali problemi etici associati a interventi di beneficio o danno medico sconosciuto. Gli approcci traslazionali che integrano i biocampioni umani in sistemi modello possono offrire importanti intuizioni biologiche in questi casi. Mentre la capacità di utilizzare o tollerare l'ossigeno è stata tradizionalmente una componente importante della classificazione microbica, poco si sa su come l'introduzione terapeutica di ossigeno supplementare nell'ambiente potrebbe perturbare le comunità microbiche delle vie aeree. Per far luce sugli effetti sconosciuti dell'ossigeno supplementare sui microbiomi delle vie aeree di pwCF, dovevamo affrontare due sfide principali; in primo luogo, la creazione di un terreno di coltura che approssima fisiologicamente la composizione dell'espettorato CF; in secondo luogo, la creazione di un sistema modello che consenta il mantenimento di elevate concentrazioni di ossigeno in coltura per lunghi periodi di tempo.
I mezzi di espettorato artificiale (ASM) sono ampiamente utilizzati per emulare l'espettorato polmonare ex vivo8,9,10, ma non esiste un chiaro consenso su una ricetta specifica. Questo protocollo descrive una ricetta e una strategia di preparazione del mezzo espettorato artificiale attentamente progettata per approssimare fisiologicamente l'espettorato da pwCF. La Tabella 1 delinea i valori delle ricette scelte in base alla letteratura pubblicata. I componenti chimici di base e il pH sono stati abbinati ai valori identificati dagli studi sull'espettorato CF umano11,12,13. Nutrienti fisiologici a bassa concentrazione sono stati aggiunti utilizzando il tuorlo d'uovo, che è stato incluso come 0,25% del volume finale10, così come le miscele di vitamine e traccemetalliche 14,15. La mucina, il componente chiave dell'espettorato16,è stata inclusa all'1% p/v14. Sebbene più laboriosa, la sterilizzazione con filtro è stata scelta rispetto alla pratica più convenzionale della sterilizzazione a caldo per ridurre i potenziali problemi derivanti dalla denaturazione indotta dal calore dei componenti essenziali dei mezzi10. Un ulteriore vantaggio della sterilizzazione con filtro è che genera mezzi trasparenti (la sterilizzazione a caldo può creare mezzi torbidi a causa della precipitazione e della coagulazione di sali e proteine), consentendo a questo mezzo espettorato artificiale di essere utilizzato per seguire la crescita microbica in base all'aumento della torbidità.
Questo sistema modello per la coltura iperossica si basa su tecniche di coltivazione anaerobica in cui l'ossigeno viene aggiunto piuttosto che rimosso, creando un modello per l'effetto dell'uso supplementare di ossigeno per pwCF. La Figura 1 e il protocollo di sparging dell'ossigeno associato delineano i componenti di un sistema di sparging di ossigeno, che può essere ottenuto a basso costo da fornitori generali di laboratorio e ospedalieri. Questo sistema consente la miscelazione di ossigeno compresso e aria a concentrazioni fisse che vanno dal 21% al 100% di ossigeno. L'integrazione di un sensore di ossigeno consente la verifica della concentrazione della miscela di gas in uscita, nonché il controllo della composizione del gas di deflusso di bombole di siero precedentemente spargate per verificare che le condizioni di ossigeno siano state mantenute entro l'intervallo desiderato.
Questo protocollo delinea le procedure per creare un mezzo espettorato artificiale, la costruzione e l'uso di un sistema di spargimento di ossigeno e l'applicazione di entrambi per coltivare l'espettorato CF in condizioni di ossigeno differenziale.
Protocollo
Questo studio ha ricevuto l'approvazione del Partners Institutional Review Board (Protocollo # 2018P002934). Il criterio di inclusione includeva pazienti adulti con fibrosi cistica che hanno fornito il consenso informato scritto per lo studio. Non esisteva un criterio di esclusione. Secondo le linee guida del protocollo, tutti i campioni di espettorato sono stati raccolti da pazienti con fibrosi cistica durante una visita ambulatoriale programmata con il loro fornitore clinico.
1. Preparazione del mezzo espettorato artificiale
NOTA: Le quantità qui elencate sono per la produzione di 1 L di mezzo espettorato artificiale finale e assumono i reagenti specifici elencati nella Tabella dei materiali. I numeri devono essere adeguati per altri volumi o per l'uso di reagenti diversi per garantire lo stesso prodotto finale. Vedere tabella 1 per le concentrazioni target.
- Miscela chimica artificiale di espettorato (ASCM)
NOTA: ASCM costituisce il 25% del volume medio finale. È stabile a scaffale e può essere preparato alla rinfusa o in anticipo. Se si sta preparando per un uso successivo, autoclavare la miscela chimica e conservarla in modo sicuro a temperatura ambiente.- Mescolare le soluzioni di riserva chimica costituenti.
- Preparare 1 M di Brodo di NaCl: Aggiungere 58,44 g di NaCl per litro di acqua sterile.
- Preparare 1 M KCl stock: Aggiungere 74,55 g di KCl per litro di acqua sterile.
- Preparare 1 M MgSO4 stock: Aggiungere 246,47 g di MgSO4·7H2O per litro di acqua sterile o 120,37 g di MgSO4 anidro per litro di acqua sterile.
- Preparare 1 M di brodo di glucosio: aggiungere 180,16 g di glucosio per litro di acqua sterile.
- L'autoclave sterilizza le soluzioni di riserva chimica e una bottiglia vuota da 250 ml. Eseguire le fasi di autoclave ad almeno valori standard di 121 °C e 15 PSI per 30 min.
- Aggiungere 80,59 ml di acqua sterile alla bottiglia vuota da 250 ml.
- Aggiungere 152,30 ml di 1 M Di NaCl alla miscela.
- Aggiungere 15,8 ml di stock di 1 M KCl al mix.
- Aggiungere 610 μL di 1 M MgSO4 stock alla miscela.
- Aggiungere 700 μL di 1 M di brodo di glucosio alla miscela.
- Mescolare le soluzioni di riserva chimica costituenti.
- Miscela di mucina artificiale di espettorato (ASMM)
NOTA: ASMM costituisce il 50% del volume medio finale. Assicurarsi che sia preparato lo stesso giorno del lotto medio finale.- Aggiungere 450 ml di acqua sterile in una bottiglia vuota da 1 L.
- Aggiungere 50 ml di 10x soluzione salina tamponata con fosfato (PBS) al flacone.
- Aggiungere una barra magnetica monouso alla bottiglia.
- Autoclave la bottiglia contenente PBS e la barra di agitazione.
- Misurare 10 g di mucina in polvere e aggiungerlo al PBS.
- Agitare vigorosamente la bottiglia per la miscelazione preliminare.
- Posizionare la bottiglia su una piastra calda con un agitatore magnetico. Impostare il calore su medio-alto puntando a 50 °C e la velocità di agitazione a 1100 giri/min. Aumentare gradualmente la velocità in modo che la barra non voli via dal magnete.
- Lasciare scaldare e mescolare per 15 min.
- Raccogli la bottiglia con guanti resistenti al calore. Osservare per verificare se la polvere di mucina si deposita fuori dalla soluzione.
- Se la polvere di mucina non è completamente sciolta, riportare la bottiglia a caldo / agitatore per intervalli di 5 minuti fino a quando non è completamente sciolta.
- Lasciare raffreddare la miscela di mucina a temperatura ambiente.
- Miscela biologica di espettorato artificiale (ASBM)
NOTA: ASBM è il 25% del volume medio finale. Prepararlo lo stesso giorno del lotto medio finale e, a differenza delle altre miscele, non esporre i suoi componenti a calore.- Scongelare il brodo vitaminico 100x in un frigorifero a 4 °C o sul ghiaccio.
NOTA: Pre-porzionare lo stock vitaminico in aliquote da 10 ml per ridurre al minimo il numero di cicli di congelamento/scongelamento. - Aggiungere 124,24 ml di acqua sterile alla bottiglia vuota da 250 mL autoclavata.
- Aggiungere 25,76 ml di 50x aminoacidi essenziali alla miscela.
- Aggiungere 80,14 ml di 100x di aminoacidi non essenziali alla miscela.
- Aggiungere 10 ml di (scongelato) 100x brodo vitaminico al mix.
- Aggiungere 1 mL di 1000x stock di metalli in traccia al mix.
- Aggiungere 8,33 ml di emulsione di tuorlo d'uovo al 30% alla miscela.
- Aggiungere 400 μL di 10 g/L di ferritina alla miscela.
- Mescolare bene la soluzione agitando manualmente.
- Scongelare il brodo vitaminico 100x in un frigorifero a 4 °C o sul ghiaccio.
- Mezzo espettorato artificiale (ASM)
- Aggiungere 250 ml di ASCM al flacone da 1 L contenente ASMM.
- Aggiungere 250 ml di ASBM al flacone medio.
- Titolare il mezzo con tampone MOPS di base (1 M) per raggiungere un pH di 6,3 su una carta a pH di intervallo ristretto. Prima della titolazione, la miscela media sarà troppo acida.
- Conservare in frigorifero il mezzo espettorato artificiale risultante a 4 °C fino a quando non è pronto per la filtrazione.
- Per avviare il processo di filtrazione, trasferire 200 ml di terreno espettorato artificiale non filtrato a un sistema di filtrazione a vuoto con un filtro di dimensioni dei pori di 0,22 μm.
- Collegare il sistema di filtrazione alla pompa per vuoto, accendere la pompa per vuoto, impostarla su 70 mbar, quindi posizionare la camera su uno shaker orbitale che scuote a 90 giri / min in una cella frigorifera a 4 ° C.
- Completare con ulteriori 150 ml del mezzo mentre viene filtrata una quantità apprezzabile. Ci vogliono 1-2 giorni per filtrare completamente 1 L di mezzo.
- Ripetere con camere aggiuntive fino a quando tutti i supporti non vengono filtrati.
NOTA: Cercare di non filtrare più di 350 ml del mezzo attraverso lo stesso filtro da 0,22 μm poiché la mucina collegherà il filtro nel tempo.
- Conservare in frigorifero il mezzo di espettorato artificiale filtrato a 4 °C fino al momento dell'uso. Utilizzare ASM entro un mese dalla preparazione per ottenere i migliori risultati.
2. Sparging di ossigeno
- Configurazione della stazione di sparging
NOTA: questo protocollo deve essere eseguito per intero una sola volta, dopodiché l'installazione può essere mantenuta attraverso una semplice manutenzione, se necessario. Vedere la Figura 1 per uno schema visivo del sistema di spargimento di ossigeno.- Ottenere e fissare correttamente i serbatoi di aria compressa e ossigeno.
ATTENZIONE: l'alta pressione rende i serbatoi estremamente pericolosi se mal gestiti. Assicurarsi che i serbatoi siano completamente sigillati e fissati, che non ci siano perdite quando il serbatoio è chiuso e che tutto il personale di movimentazione sia completamente addestrato al loro utilizzo. - Collegare un regolatore d'aria al serbatoio dell'aria compressa con una chiave inglese. Per una lettura ottimale del flusso sul regolatore, collegare il regolatore il più vicino possibile a una posizione verticale.
- Collegare un regolatore di ossigeno al serbatoio di ossigeno compresso, collegandolo il più vicino possibile a una posizione verticale. A seconda del serbatoio di ossigeno, potrebbe essere necessario invertire la direzione per stringere.
- Collegare il tubo dai regolatori a un connettore a Y per combinare il flusso di gas dai due serbatoi.
- Collegare l'uscita del connettore a Y alla valvola centrale di giunzione a T.
- Collegare un lato della valvola centrale a giunzione a T a un manometro del gas.
- Collegare l'altro lato del manometro del gas a un filtro a siringa sterile di 25 mm di diametro con una dimensione dei pori di 0,22 μm.
- Collegare un secondo filtro a siringa da 25 mm di diametro a una siringa senza stantuffo da utilizzare come rilascio di gas durante lo sparging.
- Collegare il lato finale della valvola centrale a giunzione a T a una seconda valvola di giunzione a T per il monitor dell'ossigeno.
- Collegare un filtro a siringa da 25 mm di diametro su un lato di questa seconda valvola a giunzione a T, insieme al tubo per fissare aghi da 18 G.
- Collegare il lato finale della seconda valvola a giunzione a T all'apparecchiatura di monitoraggio dell'ossigeno.
- Collegare un tubo di interruzione all'altro lato dell'apparecchiatura di monitoraggio dell'ossigeno da utilizzare come rilascio di gas durante il monitoraggio.
ATTENZIONE: durante il test/l'utilizzo del sistema di sparging dell'ossigeno, prendere nota della posizione delle giunzioni a T e assicurarsi che corrisponda al percorso previsto attraverso il sistema. In caso contrario, si verificherà un accumulo di pressione all'interno del sistema e causerà il guasto e la rottura dei componenti. - Per la manutenzione del sistema e per mantenerlo funzionante a prestazioni ottimali, le seguenti pratiche sono utili.
- Rinforzare le connessioni con quantità liberali di nastro in Teflon per migliorare notevolmente la loro tenuta e ridurre la possibilità che i componenti si allontanino dalla pressione interna.
- Mantenere la portata combinata al di sotto di 10 L/min per mitigare la pressione massima e prevenire guasti.
- Se si sospetta una perdita, utilizzare una soluzione detergente come rilevatori di perdite di liquidi disponibili in commercio per identificarne facilmente la posizione, poiché bollerà al di sopra di eventuali perdite di gas. Perdite di patch utilizzando un nastro in politetrafluoroetilene (ad esempio, Teflon).
- Sostituire i filtri a siringa da 25 mm di diametro nel sistema di sparging dell'ossigeno due volte alla settimana, ma questo varia con la frequenza d'uso. Nel corso del tempo, le particelle catturate nel filtro riducono la portata del gas e causano accumuli di pressione.
- Calibrare il monitor dell'ossigeno al 21% di aria compressa di ossigeno prima di effettuare le misurazioni.
- Al termine dell'uso del sistema, spegnere i serbatoi e spurgare il gas in eccesso dai regolatori fino a quando il flusso non si arresta completamente.
- Ottenere e fissare correttamente i serbatoi di aria compressa e ossigeno.
- Siero bottiglia coltura sparging
- Etichettare flaconi di siero autoclavati da 500 ml con identificatori del campione, data / ora di inoculazione e percentuale di ossigeno target.
- In una cappa biologica, aggiungere 24 ml di terreno espettorato artificiale a ciascun flacone di siero in fase di installazione.
- Aggiungere 1 mL dell'espettorato del paziente omogeneizzato con un ago da 18 G (diluito con soluzione salina sterile se necessario per ottenere un volume sufficiente di campione per ogni condizione di coltura) a ciascun flacone di siero.
- Utilizzando una pinzetta sterile, posizionare i tappi di gomma autoclavati sulla parte superiore di ogni flacone di siero.
- Premere verso il basso i tappi di gomma, fare attenzione a non toccare la parte inferiore del tappo con le mani.
- Rimuovere le bottiglie dal cappuccio, applicare e crimpare i sigilli in alluminio. Rimuovere il pezzo centrale dai sigilli.
- Pulire la parte superiore delle bottiglie con una salvietta imbevuta di alcol e passarle attraverso una fiamma del bruciatore Bunsen.
- Applicare un ago sterile da 18 G su una siringa senza stantuffo con un filtro. Inserire prima questo rilascio di gas nella bottiglia.
- Applicare un ago sterile da 18 G all'uscita del gas dal sistema e inserire anche l'ago di uscita del gas nella bottiglia.
- Instradare le giunzioni a T dai serbatoi attraverso il monitor dell'ossigeno. Verificare che la concentrazione di ossigeno target scorra attraverso il sistema. Target di circa 5 L/min di flusso di gas.
- Reindirizzare le giunzioni a T dai serbatoi fino all'uscita del gas. Il gas inizia a fluire attraverso la bottiglia di siero.
ATTENZIONE: Prestare molta attenzione al manometro durante lo spargimento di ossigeno. Se la pressione aumenta inaspettatamente, spegnere immediatamente il sistema. - Eseguire lo sparge di ossigeno attraverso il flacone del siero per 1 minuto. A 5 L/min, ciò consente 10 ricambi d'aria e garantisce che l'atmosfera interna raggiunga la pressione parziale desiderata.
- Rimuovere l'ago da 18 G a rilascio di gas.
- Lasciare che la pressione nel flacone del siero si accumuli a +1 atmosfera (2 atmosfere a livello del mare) e quindi rimuovere immediatamente l'ago di uscita del gas.
NOTA: Mantenimento della ritenzione degli ausili a pressione delle condizioni iperossiche nel tempo. - Posizionare il flacone di siero in uno shaker incubatore a 37 °C a 150 giri/min. Incubare i campioni per tre intervalli di 24 ore. Ad ogni intervallo di 24 ore, prelevare un'aliquota per l'analisi a valle, rifare i campioni e riportarli in incubazione per un tempo totale di incubazione di 72 ore.
- Misurazione dell'ossigeno di deflusso
- Calibrare il misuratore di ossigeno al 21% di aria compressa, quindi spegnere il serbatoio.
- Instradare l'assunzione del flacone di siero attraverso il monitor dell'ossigeno e apporre un ago sterile all'estremità.
- Inserire l'ago attraverso il tappo di gomma nel flacone del siero.
- Attendere che la lettura del deflusso si stabilizzi. Una bassa portata fuori dai flaconi di siero significa che questo può richiedere fino a 2 minuti. Segnala la differenza di picco dall'aria ambiente (numero più lontano dal 21%).
- Se si eseguono più letture, lavare il sistema con aria compressa tra le letture.
Risultati
Questi protocolli sono stati applicati a 50 campioni di espettorato da pwCF che si presentano per cure di routine a una clinica ambulatoriale per la fibrosi cistica presso il Massachusetts General Hospital di Boston, Massachusetts. L'espettorato di ogni paziente è stato coltivato in condizioni di ossigeno al 21%, 50% e 100% utilizzando il mezzo artificiale dell'espettorato, con aliquote di 0,5 ml prelevate da ciascuna coltura a 24 ore, 48 ore e 72 ore di tempo di coltura per il test. Le culture sono state fotografate quando sono state effettuate estrazioni per tenere traccia dei cambiamenti visivi. Inoltre, prima della coltura è stata prelevata un'aliquota di 0,5 ml di ciascun campione di espettorato primario. Ciò ha portato a 10 campioni discreti per paziente e un N finale di 500 campioni. Di questi, l'espettorato di 11 pazienti (11 sputa non coltivata, 11 sputa coltivata dal 21% di ossigeno a 48 ore di incubazione) è stato sottoposto a estrazione di acidi nucleici17, le librerie di sequenziamento sono state generate utilizzando un kit di preparazione della libreria di DNA commerciale e il sequenziamento metagenomico è stato eseguito su una piattaforma di sequenziamento dell'intero genoma mirata a ~ 5 Gb di sequenza per campione con 150 coppie di basi, letture di fine accoppiata. Le letture grezze sono state elaborate utilizzando la suite di strumenti bioBakery18, che include il controllo di qualità e la rimozione di sequenze "contaminanti" umane e la profilazione tassonomica con il profiler MetaPhlAn319. Al momento dell'estrazione dell'acido nucleico, 10 milioni di cellule di Imtechella halotolerans,una specie halotolerant normalmente presente negli ecosistemi dell'estuario e non nelle comunità microbiche umane, sono state inserite in ciascun campione, consentendo la quantificazione della carica microbica assoluta per ogni campione20.
La Figura 2 mostra le misurazioni individuali e medie dell'ossigeno di deflusso e i livelli di pH nel corso del processo di coltura per 50 campioni di espettorato coltivati in ciascuna condizione di ossigeno e un esempio di fenotipo di coltura differenziale visivo. Le colture sono state mantenute a 37 °C, tranne durante brevi periodi in cui è stata eseguita la sparging e la rimozione delle aliquote del campione. Con entrambi gli intervalli di sparging di 12 ore e 24 ore, sono state mantenute elevate concentrazioni di ossigeno, sebbene sia stato osservato un calo nel tempo per tutte e tre le condizioni di ossigeno, con il 100% di ossigeno che scende a circa l'85%, il 50% di ossigeno che scende al 40% e il 21% di ossigeno che scende al 18%. Le condizioni di ossigeno sono rimaste distinte e, soprattutto, sono state mantenute elevate concentrazioni di ossigeno durante tutto il processo per i campioni iperossici. Le misurazioni del pH hanno mostrato un maggior grado di variabilità, ma sono rimaste ben all'interno di un intervallo fisiologicamente normale senza cambiamenti statisticamente significativi nel tempo. Queste misurazioni indicano che questi metodi mantengono condizioni discrete di ossigeno differenziale durante tutto il processo di coltura. Infine, viene mostrato un esempio di uno dei tanti fenotipi di cultura visiva che si differenziano tra la concentrazione di ossigeno. Questo campione presentava marcate differenze di torbidità dopo 72 ore di coltura, con ossigeno più elevato associato a una minore torbidità visiva. I fenotipi di coltura differenziale supportano la presenza di effetti indotti dall'iperossia sulle comunità di coltura.
La Figura 3 confronta la carica microbica, la diversità microbica e la composizione della comunità microbica tra espettorato non coltivato ed espettorato coltivato (condizione di ossigeno al 21% per un periodo di 48 ore). Le misurazioni rivelano che l'unica grande differenza introdotta dall'atto di coltivare è un aumento di circa 20 volte della carica microbica rispetto all'espettorato non coltivato. Il sistema immunitario e i tipici meccanismi meccanici di clearance dell'espettorato come la tosse normalmente fungono da processo regolatore che limita la carica microbica nel polmone, anche in casi di disfunzione e infezione come quelli osservati in pwCF. La coltura ex vivo non ha tali meccanismi regolatori e le comunità microbiche sono invece libere di procedere verso la saturazione cellulare. Le metriche di diversità alfa e beta indicano che, nonostante questa differenza nella carica microbica, la composizione della comunità sottostante rimane ben conservata, con differenze globali minime introdotte dal processo di coltura.
La Figura 4 espande il confronto tra campioni di espettorato non coltivato e coltivato, osservando la presenza/assenza binaria delle 120 specie microbiche identificate in modo conclusivo dal sequenziamento metagenomico shotgun da espettorato in coltura e non coltivato ottenuto da 11 pazienti. I microbi sono raggruppati in base a somiglianze filogenetiche. 46 (38,3%) di queste specie sono state identificate sia in campioni non coltivati che in colture (colore ciano), mentre 35 (29,2%) sono state identificate esclusivamente in campioni non coltivati (giallo) e 39 (32,5%) sono state identificate esclusivamente in campioni coltivati (blu). È probabile che ci sia una parità maggiore di quella che abbiamo identificato usando il sequenziamento in termini di ciò che è presente e ciò che è assente, ma alcuni taxa scendono al di sotto della soglia di rilevamento del sequenziamento in alcuni casi. Le differenze indicano che il processo di coltura introduce alcuni pregiudizi in coltura rispetto all'espettorato non coltivato. In particolare, la coltivazione aumenta la presenza di funghi come Candida e Aspergillus, così come i membri di Enterobacterales tra cui Escherichia, Serratiae Streptococcus membri. Al contrario, i membri di Bacteroidetes come Prevotella e Clostridiales, che sono anaerobi, erano presenti in campioni non coltivati ma non presenti in campioni coltivati. Ciò può essere attribuito alla mancanza di una condizione anaerobica nel nostro modello sperimentale.
La Figura 5 mostra le curve di crescita basate sull'assorbanza di comuni patogeni polmonari CF isolati dall'espettorato ottenuto da 50 diversi pwCF. Questi isolati rappresentano isolati clinici fenotipicamente diversi ottenuti utilizzando procedure di coltura di arricchimento dal Massachusetts General Hospital Clinical Microbiology Laboratory e includono Pseudomonas aeruginosa (N = 53), Staphylococcus aureus (N = 37), Stenotrophomonas maltophilia (N = 12), Klebsiella pneumoniae (N = 3) e Achromobacter sp (N = 7). Le curve di crescita sono state ottenute coltivando ogni isolato in mezzi espettorati artificiali a 37 ° C al buio, con l'inoculazione batterica ASM sans che funge da controllo negativo. La qualità trasparente dell'ASM (che è dovuta al filtro piuttosto che alla sterilizzazione a caldo) consente di condurre misure ottiche per stimare le curve di crescita. Le letture ottiche a 600 nm (OD600) sono state prese ogni 10 minuti e vengono mostrate le prime 24 ore di ogni curva. L'assenza di cambiamenti nelle letture ottiche nel controllo negativo solo ASM indica colture prive di contaminazione. Le curve dimostrative mostrate qui seguono i tipici modelli di curva di crescita che indicano la fattibilità di questa ricetta ASM come mezzo per la generazione di curve di crescita basate sull'assorbanza.
| Colonna 1 | Colonna 2 | Colonna 3 | Colonna 4 | Colonna 5 | Colonna 6 | Colonna 7 | Colonna 8 | Colonna 9 | |
| Valore | Comstock | Kirchner | Sriramulu · | Palmer | Flynn | Gallagher | Lai | Fonte | |
| Mucina | 2% p/v | 0,5% p/v | 0,5% p/v | - | 1% p/v | 2% p/v | 1% p/v | Flynn | |
| Cloruro di sodio | 85,5 mM | 85,5 mM | 85,5 mM | 66,6 mM | 89,8 mM | 85,5 mM | 152,3 mM | Lapierre | |
| Cloruro di potassio | 29,5 mM | 29,5 mM | 29,5 mM | 15,8 mM | - | 2,95 mM | 15,8 mM | Palmer | |
| Solfato di magnesio | - | - | - | 0,6 mM | 1 mM | 1 mM | 0,61 mM | Palmer | |
| Solfato di ferro | - | - | - | 0,0036 mM | - | - | - | - | |
| Cloruro di ammonio | - | - | - | 2,3 mM | 60 metri quadrati | - | - | - | |
| Fosfato monopotassico | - | - | - | 2,5 mM | 60 metri quadrati | - | - | - | |
| Glucosio | - | - | - | 3,2 mM | 13 mM | 40 metri quadrati | 0,7 mM | Sambeek · | |
| Lattato | - | - | - | 9 mM | - | - | - | - | |
| Aminoacidi essenziali | 14,45x | 0,25 g/L | 0,25 g/L | Per acido | 0,5x | 0,375x | 1,29x | Palmer | |
| Aminoacidi non essenziali | 28,9x | 0,25 g/L | 0,25 g/L | Per acido | 0,25x | 0,5x | 8,01x | Palmer | |
| Vitamine | - | - | - | - | - | 1x | 1x | Gallagher | |
| Metalli in traccia | - | - | - | - | 1x | 1x | 1x | Flynn | |
| Tuorlo | 0.25% | 0.25% | 0.25% | - | - | 0.25% | 0.25% | Kirchner | |
| Ferritina | 0,0003 g/L | - | - | - | - | 0,0004 g/L | 0,0004 g/L | Gallagher | |
| DNA dello sperma di salmone | 1,4 g/L | 4 g/L | 4 g/L | - | - | 1,4 g/L | - | - | |
| DPTA · | - | - | 0,0059 g/L | - | - | - | - | - | |
| ph | - | 6.9 | - | 6.8 | - | - | 6.3 | Lapierre | |
| Immagazzinamento | 0 | 4° | - | - | 4° | 4° | 4° | Kirchner | |
| Sterilizzazione | Autoclave | Filtro | Autoclave | - | Autoclave | Autoclave | Filtro | Kirchner | |
Tabella 1: Ricetta del mezzo espettorato artificiale derivato dalla revisione della letteratura. (Colonna 1) Reagenti e valori chiave nella formulazione del mezzo espettorato artificiale. (Colonne 2-7) Confronto di ricette dalla letteratura esistente8,9,10,12,14,15. (Colonne 8-9) Ricetta del mezzo espettorato artificiale dettagliato in questo protocollo e le fonti corrispondenti che hanno informato ogni valore selezionato10,11,12,13,14,15.
| Colonna 1 | Colonna 2 | Colonna 3 |
| ESPETTORATO CF | ASM | |
| Aminoacidi totali | 10,25 mM | 10,76 mM |
| Alanina | 0,96 mM | 0,80 mM |
| Arginina | 0,17 mM | 0,94 mM |
| Asparagina | 0,91 mM | |
| Acido aspartico | 0,45 mM | 0,80 mM |
| Cisteina | 0,09 mM | 0,33 mM |
| Acido glutammico | 0,84 mM | 0,80 mM |
| Glicina | 0,65 mM | 0,80 mM |
| Istidina | 0,28 mM | 0,35 mM |
| Isoleucina | 0,60 mM | 0,52 mM |
| Leucina | 0,87 mM | 0,52 mM |
| Lisina | 1,15 mM | 0,64 mM |
| Metionina | 0,34 mM | 0,13 mM |
| Ornitina | 0,36 mM | |
| Fenilalanina | 0,29 mM | 0,26 mM |
| Prolina | 0,90 mM | 0,80 mM |
| Serina | 0,78 mM | 0,80 mM |
| Treonina | 0,58 mM | 0,52 mM |
| Triptofano | 0,07 mM | 0,06 mM |
| Tirosina | 0,43 mM | 0,26 mM |
| Valina | 0,60 mM | 0,52 mM |
Tabella 2: Concentrazioni di aminoacidi precedentemente descritte nell'espettorato della fibrosi cistica e nella ricetta del mezzo espettorato artificiale descritta in questo protocollo. (Colonna 1) Aminoacidi chiave. (Colonna 2) Concentrazioni di aminoacidi di espettorato da persone con fibrosi cistica12. (Colonna 3) Concentrazioni di aminoacidi nel mezzo espettorato artificiale dettagliato in questo protocollo

Figura 1: Schema di connessione dei componenti del sistema di sparging dell'ossigeno. Diagramma di flusso delle connessioni tra i componenti del sistema utilizzato per spargere i flaconi di siero alle concentrazioni di ossigeno desiderate tra il 21% e il 100%. Il sistema ha 3 modalità di utilizzo determinate dalla posizione delle due valvole di giunzione a T. Il sistema può instradare il gas dai serbatoi attraverso l'uscita del gas o attraverso il monitor della percentuale di ossigeno, nonché instradare il gas di deflusso dalle bombole di siero precedentemente spargate attraverso il monitor per verificare la concentrazione dopo che il tempo è trascorso. Fare clic qui per visualizzare una versione più grande di questa figura.
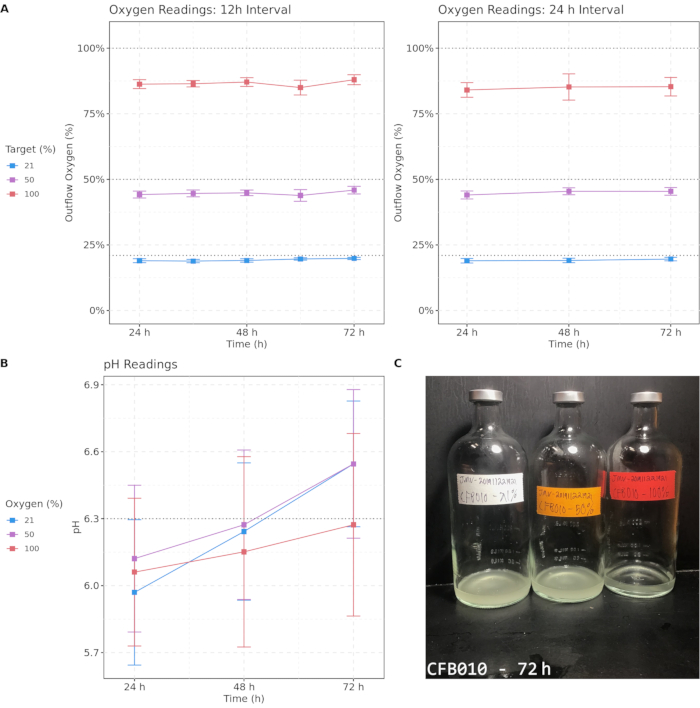
Figura 2: Le concentrazioni target di ossigeno sono approssimativamente mantenute con intervalli di sparging di 12 ore e 24 ore e il pH rimane nell'intervallo fisiologico durante la coltura. (A) Letture di ossigeno in uscita da intervalli di spargimento di ossigeno di 12 ore e 24 ore su un periodo di 72 ore. (B) Letture del pH per campioni misurati ogni 24 ore. (C) Un'immagine di esempio del campione in coltura CFB010 dopo 72 ore, che mostra la torbidità differenziale tra le concentrazioni di ossigeno. Il colore indica la percentuale di ossigeno target; le barre di errore indicano intervalli di confidenza del 95%. Le soglie critiche sono enfatizzate con linee tratteggiate. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: La coltura aumenta la carica microbica, ma la composizione della comunità sottostante è preservata. Espettorato non coltivato (giallo) ed espettorato coltivato (blu) utilizzando un mezzo espettorato artificiale al 21% di ossigeno per 48 ore. Le aliquote sono state sottoposte all'estrazione di acidi nucleici e al sequenziamento della metagenomica shotgun per rilevare possibili bias introdotti dalle condizioni di coltura. (A) Carico microbico assoluto (determinato da controlli spike-in) e metriche di diversità alfa. Utilizzando modelli lineari a effetti misti, l'espettorato non coltivato rispetto all'espettorato in coltura ha previsto la carica microbica ma non la diversità alfa. (B) Ordinazione delle prime due componenti delle metriche di diversità beta, controllando la differenza di carica microbica. Nessuna differenza significativa in nessuna delle due metriche dopo PERMANOVA. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: La maggior parte dei taxa identificati sono presenti sia nell'espettorato di origine che nella cultura, mentre altri appaiono solo nell'espettorato o nella cultura di origine. Sequenziamento della metagenomica shotgun utilizzato per confrontare le differenze nella composizione della comunità microbica tra campioni di espettorato non coltivati e coltivati. Albero filogenetico di tutte le specie microbiche identificate in campioni sequenziati (N = 120). Le specie contrassegnate con il giallo (N = 35, 29,2%) sono state osservate solo in campioni di espettorato non coltivati. Le specie contrassegnate con il blu (N = 39, 32,5%) sono state osservate solo in campioni di coltura di medie di espettorato artificiale. Specie marcate con ciano (N = 46, 38,3%) sono state osservate sia in campioni non coltivati che coltivati. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Il mezzo espettorato artificiale è sufficientemente trasparente per essere utilizzato come mezzo della curva di crescita per la coltura di isolati clinici. Le letture di densità ottimali a 600 nm sono state prese ogni 10 minuti e vengono mostrate le prime 24 ore di ogni curva. Le linee grigie rappresentano le letture individuali e le linee arancioni rappresentano l'assorbanza media per ogni taxon. Espettorato artificiale medio vuoto incluso come controllo. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
In questo studio, è stato sviluppato un modello in vitro per studiare l'effetto dell'iperossia sulle comunità microbiche polmonari. Questo modello, basato sul mezzo espettorato artificiale e sullo spargimento giornaliero di flaconi di siero, mantiene elevate concentrazioni di ossigeno e supporta la crescita dei microbi identificati nell'espettorato da pwCF.
Ci sono diversi passaggi critici di questo approccio. Il primo è la scelta di utilizzare la sterilizzazione con filtro piuttosto che la sterilizzazione a caldo del mezzo espettorato artificiale. La sterilizzazione con filtro impedisce la denaturazione della mucina e di altri componenti sensibili al calore del mezzo e produce un mezzo chiaro che può essere utilizzato per misure ottiche della crescita microbica. Mentre la sterilizzazione del filtro è stata proposta in altri protocolli10, abbiamo scoperto che l'aggiunta di scuotimento orbitale durante il processo di filtrazione era essenziale per prevenire l'intasamento del filtro che altrimenti si verificava quando una quantità minima del mezzo preparato era stata filtrata. Mentre il mezzo espettorato artificiale filtrato può avere una concentrazione finale di mucina inferiore a quella prevista a causa dell'impatto della mucina nel filtro, l'espettorato da pwCF ha dimostrato di avere concentrazioni di mucina più basse rispetto all'espettorato di persone senza fibrosi cistica21. La concentrazione iniziale di mucina dell'1% utilizzata in questo protocollo è superiore rispetto ad altri approcci che hanno utilizzato la sterilizzazione con filtro, con un gruppo che utilizza una concentrazione iniziale di mucina dello 0,5%10, mentre le ricette tipiche utilizzano concentrazioni di mucina che vanno dallo 0,5% al 2% (Tabella 1). Pertanto, anche con una perdita di mucina nel processo di sterilizzazione del filtro, il mezzo finale preparato utilizzando questo protocollo è probabile che abbia concentrazioni di mucina all'interno dell'intervallo fisiologico22.
Il secondo è la composizione del mezzo espettorato artificiale. La ricetta per il mezzo espettorato artificiale è stata scelta sulla base degli studi fisiologici esistenti sull'espettorato da pwCF (Tabella 1). Utilizzando il sequenziamento metagenomico shotgun, siamo stati in grado di verificare che l'espettorato coltivato con questo mezzo espettorato artificiale ricapitola ampiamente la composizione della comunità microbica dell'espettorato non coltivato (Figura 3). In condizioni normossiche, questo mezzo ha anche supportato la crescita di 112 diversi isolati clinici che rappresentano patogeni comuni isolati dall'espettorato dei pazienti con fibrosi cistica. Pertanto, questi dati dimostrano che questa formulazione di mezzo espettorato artificiale supporta la crescita del microbiota delle vie aeree da pwCF. Il DNA dello sperma di salmone, un'aggiunta comune alle ricette esistenti(Tabella 1),è stato omesso. Un'applicazione prevista di questo modello è il sequenziamento metagenomico, e quindi il DNA degli spermatozoi di salmone non è stato incluso al fine di ridurre l'aggiunta di acidi nucleici non microbici in quanto queste letture verrebbero filtrate dopo il sequenziamento, diminuendo così la nostra effettiva profondità di sequenziamento. Mentre l'espettorato da pwCF ha alte concentrazioni di DNA extracellulare23, una percentuale significativa di esso è microbica in origine24, e non è chiaro se l'aggiunta di DNA spermatico di salmone al mezzo espettorato artificiale lo renda più fisiologico o se l'approccio di coltura descritto in questo protocollo porti ad alti livelli di DNA extracellulare derivato microbicamente; non abbiamo distinto tra concentrazioni di DNA extra- e intra-cellulare nei nostri studi. Studi futuri potrebbero voler verificare la concentrazione di DNA extracellulare generato da questo metodo di coltivazione.
In terzo luogo, per quanto ne sappiamo, nessuno studio pubblicato sulle comunità microbiche polmonari della fibrosi cistica ha affrontato le condizioni iperossiche. Questo modello utilizza apparecchiature economiche e comunemente disponibili da fornitori generali di laboratorio o ospedalieri per costruire un sistema di sparging di ossigeno. Considerazioni importanti per il mantenimento delle condizioni iperossiche includono il volume del terreno di coltura rispetto allo spazio di testa disponibile nei flaconi di siero. Nei tentativi iniziali durante lo sviluppo del protocollo, sono stati utilizzati flaconi di siero da 125 ml. Tuttavia, l'uso di flaconi di siero da 500 mL (consentendo un rapporto di coltura da 475 mL a 25 mL di spazio di testa) ha permesso il mantenimento della concentrazione desiderata fino a 24 ore, riducendo così la frequenza di spargimento di ossigeno. Questo approccio genera condizioni di ossigeno discrete, consentendo così la coltura simultanea di diversi campioni di pazienti in più condizioni di ossigeno. Altri strumenti della coltura anaerobica possono essere sfruttati per la coltura iperossica, incluso l'uso di barattoli anaerobici o tubi di tipo Balch spargiti con ossigeno. Le analisi delle comunità microbiche polmonari utilizzando il sequenziamento metagenomico indicano che la diversità alfa e beta complessiva è comparabile tra espettorato coltivato e non coltivato. Quando si valuta l'abbondanza differenziale a livello di specie, coltura al 21% di ossigeno, arricchita per la crescita di aerobi e anaerobi facoltativi, tra cui Enterobacterale, Streptococco e funghi. Ciò è probabilmente dovuto all'esclusione di una condizione anaerobica che è stata osservata nelle vie aeree di pwCF25,26. Studi futuri potrebbero prendere in considerazione l'inclusione di azoto gassoso in questo modello per studiare una serie di condizioni anossiche e ossiche e il corrispondente microbiota aerobico e anaerobico trovato nelle comunità microbiche delle vie aeree.
I principi chiave delineati in questi protocolli possono essere istruttivi per la conduzione di studi simili relativi all'influenza dell'ossigeno su comunità microbiche complesse o comuni patogeni polmonari. L'ossigeno è la terapia più comune utilizzata nel trattamento di tutte le malattie polmonari avanzate e una migliore comprensione di come potrebbe portare a effetti collaterali imprevisti sulle comunità microbiche delle vie aeree e sui comuni agenti patogeni respiratori sarà importante per la cura del pwCF e di altre malattie polmonari croniche.
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Parte di questo lavoro è stato eseguito presso il Marine Biological Lab con il supporto del Marine Biological Lab, DOE (DE-SC0016127), NSF (MCB1822263), HHMI (numero di sovvenzione 5600373) e un dono della Simons Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| BME Vitamins (100x) Solution | MilliporeSigma | B6891 | Concentrated solution of supplemental vitamins. |
| Crimper, 30 mm | DWK Life Sciences | 224307 | Crimper for attaching aluminum seals to serum bottles. |
| D-(+)-Glucose | MilliporeSigma | G7021 | Solid glucose powder (dextrorotatory isomer). |
| Diaphragm Pump ME 2 NT | VACUUBRAND | 20730003 | Vacuum pump for vacuum filtration. |
| Egg Yolk Emulsion | HiMedia | FD045 | Sterile emulsion of 30% egg yolk in saline. |
| Ferritin, Cationized from Horse Spleen | MilliporeSigma | F7879 | Ferritin (iron-storage protein) solution. |
| FIREBOY plus Safety Bunsen Burner | Integra Biosciences | 144000 | Bunsen burner with user interface and safety features. |
| Hydrion pH Paper (1.0–14.0) | Micro Essential Laboratory | 94 | pH testing paper for the range of 1.0–14.0. |
| Hydrion pH Paper (4.0–9.0) | Micro Essential Laboratory | 55 | pH testing paper for the range of 4.0–9.0. |
| Hydrion pH Paper (6.0–8.0) | Micro Essential Laboratory | 345 | pH testing paper for the range of 6.0–8.0. |
| Hypodermic Needle-Pro EDGE Safety Device, 18 G | Smiths Medical | 401815 | 18 G needles with safety caps. |
| In-Line Pressure Gauge | MilliporeSigma | 20469 | Gas pressure gauge for monitoring bottle pressure. |
| Innova 42 Incubated Shaker | Eppendorf | 2231000756 | Combination incubator/orbital shaker. |
| Luer-Lok Syringe with Attached Needle | Becton Dickinson | 309580 | Combination 3 mL syringe and 18 G needle. |
| Luer Valve Assortment | World Precision Instruments | 14011 | Valves for gas flow tubing. |
| LSE Orbital Shaker | ThermoFisher Scientific | 6780-NP | Orbital shaker to agitate media during filtration. |
| Magnesium Sulfate Heptahydrate | MilliporeSigma | M2773 | Solid epsom salt (magnesium sulfate heptahydrate). |
| Medical Air Single Stage Regulator with Flowmeter | Western Enterprises | M1-346-15FM | Air flow rate regulator with 15 L/min meter. |
| MEM Amino Acids (50x) Solution | MilliporeSigma | M5550 | Concentrated solution of essential amino acids. |
| MEM Non-Essential Amino Acids (100x) Solution | MilliporeSigma | M7145 | Concentrated solution of non-essential amino acids. |
| Millex-GP Filter, 0.22 µm | MilliporeSigma | SLMP25SS | 0.22 µm polyethersulfone membrane sterile syringe filter. |
| Milli-Q Academic | MilliporeSigma | ZMQS60E01 | Milli-Q sterile water filtration system. |
| MiniOX 3000 Oxygen Monitor | MSA | 814365 | Gas flow oxygen percentage monitor. |
| MOPS Buffer (1 M, pH 9.0) | Boston BioProducts | BBM-90 | MOPS buffer for adjusting media pH. |
| Mucin from Porcine Stomach | MilliporeSigma | M2378 | Mucin (glycosylated gel-forming protein) powder. |
| Natural Polypropylene Barbed Fitting Kit | Harvard Apparatus | 72-1413 | Connectors for gas flow tubing. |
| Nextera XT DNA Library Preparation Kit | Illumina | FC-131-1096 | Library preparation for identification during sequencing. |
| NovaSeq 6000 Sequencing System | Illumina | 770-2016-025-N | Shotgun sequencing platform for generating sample reads. |
| Oxygen Single Stage Regulator with Flowmeter | Western Enterprises | M1-540-15FM | Oxygen flow rate regulator with 15 L/min meter. |
| Oxygen Tubing with 2 Standard Connectors | SunMed | 2001-01 | Tubing for connecting gas system components. |
| Phosphate buffered saline, 10x, pH 7.4 | Molecular Biologicals International | MRGF-6235 | Concentrated phosphate-buffered saline solution. |
| PC 420 Hot Plate/Stirrer | Marshall Scientific | CO-PC420 | Combination hot plate/stirrer. |
| Potassium Chloride | MilliporeSigma | P9541 | Solid potassium chloride salt. |
| PTFE Disposable Stir Bars | ThermoFisher Scientific | 14-513-95 | Disposable magnetic stir bars. |
| PTFE Thread Seal Teflon Tape | VWR | 470042-938 | Teflon tape for reinforcing gas system connections. |
| Q-Gard 2 Purification Cartridge | MilliporeSigma | QGARD00D2 | Purification cartridge for Milli-Q system. |
| Reusable Media Storage Bottles | ThermoFisher Scientific | 06-423A | Bottles for mixing and storing culture media. |
| Rubber Stopper, 30 mm, Gray Bromobutyl | DWK Life Sciences | 224100-331 | Rubber stoppers for serum bottles. |
| Serum Bottle with Molded Graduations, 500 mL | DWK Life Sciences | 223952 | Glass serum bottles for sealed culturing. |
| Small Bore Extension Set | Braun Medical | 471960 | Tubing extension with luer lock connectors. |
| Sodium Chloride | MilliporeSigma | S3014 | Solid sodium chloride salt. |
| Spike-in Control I (High Microbial Load) | ZymoBIOMICS | D6320 | Spike-in microbes (I. halotolerans and A. halotolerans) for absolute microbial load calculations |
| Stericup Quick Release Sterile Vacuum Filtration System | MilliporeSigma | S2GPU02RE | 250 mL 0.22 µm vacuum filtration chamber. |
| Super Sani-Cloth Germicidal Disposable Wipes | Professional Disposables International | H04082 | Disposable germicidal wipes for sterilization. |
| Trace Metals Mixture, 1000x | ThermoFisher Scientific | NC0112668 | Concentrated solution of physiological trace metals. |
| Unlined Aluminum Seal, 30 mm | DWK Life Sciences | 224187-01 | Aluminum seals crimped over top of rubber stoppers. |
| USP Medical Grade Air Tank | Airgas | AI USP200 | Compressed air tank for input to sparging system. |
| USP Medical Grade Oxygen Tank | Airgas | OX USP200 | Compressed oxygen tank for input to sparging system. |
Riferimenti
- Carmody, L. A., et al. Fluctuations in airway bacterial communities associated with clinical states and disease stages in cystic fibrosis. PLoS One. 13 (3), 0194060 (2018).
- Acosta, N., et al. Sputum microbiota is predictive of long-term clinical outcomes in young adults with cystic fibrosis. Thorax. 73 (11), 1016-1025 (2018).
- Muhlebach, M. S., et al. Initial acquisition and succession of the cystic fibrosis lung microbiome is associated with disease progression in infants and preschool children. PLoS Pathogens. 14 (1), 1006798 (2018).
- Zolin, A., Bossi, A., Cirilli, N., Kashirskaya, N., Padoan, R. Cystic fibrosis mortality in childhood. Data from European cystic fibrosis society patient registry. International Journal of Environmental Research and Public Health. 15 (9), (2018).
- Ramos, K. J., et al. Heterogeneity in survival in adult patients with cystic fibrosis with FEV1 30% of predicted in the United States. Chest. 30 (6), 1320-1328 (2017).
- Ramos, K. J., et al. Predictors of non-referral of patients with cystic fibrosis for lung transplant evaluation in the United States. Journal of Cystic Fibrosis. 15 (2), 196-203 (2016).
- Girardis, M., et al. Effect of conservative vs conventional oxygen therapy on mortality among patients in an intensive care unit: The Oxygen-ICU randomized clinical trial. JAMA. 316 (15), 1583-1589 (2016).
- Comstock, W. J., et al. The WinCF model - An inexpensive and tractable microcosm of a mucus plugged bronchiole to study the microbiology of lung infections. Journal of Visualized Experiments: JoVE. (123), e55532 (2017).
- Diraviam Dinesh, S. Artificial sputum medium. Protocol Exchange. , (2010).
- Kirchner, S., et al. Use of artificial sputum medium to test antibiotic efficacy against Pseudomonas aeruginosa in conditions more relevant to the cystic fibrosis lung. Journal of Visualized Experiments: JoVE. (64), e3857 (2012).
- Grandjean Lapierre, S., et al. Cystic fibrosis respiratory tract salt concentration: An Exploratory Cohort Study. Medicine. 96 (47), 8423 (2017).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Van Sambeek, L., Cowley, E. S., Newman, D. K., Kato, R. Sputum glucose and glycemic control in cystic fibrosis-related diabetes: a cross-sectional study. PLoS One. 10 (3), 0119938 (2015).
- Flynn, J. M., Niccum, D., Dunitz, J. M., Hunter, R. C. Evidence and role for bacterial mucin degradation in cystic fibrosis airway disease. PLoS Pathogens. 12 (8), 1005846 (2016).
- Gallagher, T., et al. Liquid chromatography mass spectrometry detection of antibiotic agents in sputum from persons with cystic fibrosis. Antimicrobial Agents and Chemotherapy. 65 (2), (2021).
- Voynow, J. A., Rubin, B. K. Mucins, mucus, and sputum. Chest. 135 (2), 505-512 (2009).
- Sui, H. Y., et al. Impact of DNA extraction method on variation in human and built environment microbial community and functional profiles assessed by shotgun metagenomics sequencing. Frontiers in Microbiology. 11, 953 (2020).
- McIver, L. J., et al. bioBakery: a meta'omic analysis environment. Bioinformatics. 34 (7), 1235-1237 (2018).
- Truong, D. T., et al. MetaPhlAn2 for enhanced metagenomic taxonomic profiling. Nature Methods. 12 (10), 902-903 (2015).
- Stammler, F., et al. Adjusting microbiome profiles for differences in microbial load by spike-in bacteria. Microbiome. 4 (1), 28 (2016).
- Henke, M. O., Renner, A., Huber, R. M., Seeds, M. C., Rubin, B. K. MUC5AC and MUC5B mucins are decreased in cystic fibrosis airway secretions. American Journal of Respiratory Cell and Molecular Biology. 31 (1), 86-91 (2004).
- Henderson, A. G., et al. Cystic fibrosis airway secretions exhibit mucin hyper concentration and increased osmotic pressure. Journal of Clinical Investigation. 124 (7), 3047-3060 (2014).
- Matthews, L. W., Spector, S., Lemm, J., Potter, J. L. Studies on pulmonary secretions. I. The over-all chemical composition of pulmonary secretions from patients with cystic fibrosis, bronchiectasis, and laryngectomy. American Review of Respiratory Disease. 88, 199-204 (1963).
- Ibanez de Aldecoa, A. L., Zafra, O., Gonzalez-Pastor, J. E. Mechanisms and regulation of extracellular DNA release and its biological roles in microbial communities. Frontiers in Microbiology. 8, 1390 (2017).
- Tunney, M. M., et al. Detection of anaerobic bacteria in high numbers in sputum from patients with cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 177 (9), 995-1001 (2008).
- Worlitzsch, D., et al. Effects of reduced mucus oxygen concentration in airway Pseudomonas infections of cystic fibrosis patients. Journal of Clinical Investigation. 109 (3), 317-325 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon