Method Article
Agrobacterium tumefaciens e Agrobacterium rhizogenes-mediata trasformazione di patate e l'attività del promotore di un Gene di suberina da GUS Staining
In questo articolo
Riepilogo
Qui, presentiamo due protocolli per trasformare piante di patate. La trasformazione di Agrobacterium tumefaciens conduce ad una pianta transgenica completa mentre l' Agrobacterium rhizogenes produce radici transgeniche pelosi in un tiro di tipo selvatico che può essere auto-propagato. Individuiamo quindi l'attività del promotore di GUS colorazione nelle radici trasformate.
Abstract
Agrobacterium SP. è uno dei metodi più diffusi per ottenere piante transgeniche in quanto ha la capacità di trasferire e integrare la propria T-DNA nel genoma della pianta. Qui, presentiamo due sistemi di trasformazione per modificare geneticamente le piante di patata (Solanum tuberosum). Nella trasformazione di a. tumefaciens , foglie sono infetti, le cellule trasformate sono selezionate e un nuovo impianto completo trasformato viene rigenerato utilizzando fitormoni in 18 settimane. Nella trasformazione di a. rhizogenes , steli sono infettati iniettando i batteri con un ago, le nuove radici pelosi trasformate emerse vengono rilevate utilizzando un marcatore fluorescente rosso e le radici non trasformate vengono rimossi. In 5-6 settimane, la pianta risultante è un composito di un germoglio di tipo selvaggio con radici pelosi trasformate completamente sviluppate. Per aumentare la biomassa, le radici di pelosi trasformate possono essere asportate e self-propagate. Abbiamo applicato entrambi metodi di trasformazione dell'agrobatterio -mediata per ottenere radici che esprimono il gene reporter GUS guidato da un promotore del gene biosintetici suberina. La procedura di colorazione di GUS è fornita e permette la localizzazione cellulare dell'induzione promotore. In entrambi i metodi, le radici di patata trasformata ha mostrato macchiatura nella quali endodermis ed exodermis e inoltre, nelle radici di a. rhizogenes trasformato l'attività GUS GUS inoltre è stato rilevato nell'emersione di radici laterali. Questi risultati suggeriscono che a. rhizogenes può essere uno strumento veloce alternativo per studiare i geni che sono espressi nelle radici.
Introduzione
A parte di interesse economico, la generazione di piante transgeniche ha una propria rilevanza nella ricerca per dimostrare la funzione dei geni e capire meglio la fisiologia vegetale e sviluppo. Il più diffuso metodo per pianta inserimento del DNA è Agrobacterium-mediata trasformazione. Agrobacterium tumefaciens è in grado di generare corona Galle nel tessuto infetto di molte specie vegetali dall'azione del suo tumore-induzione plasmide (Ti). Il plasmide contiene una regione T-DNA con un set di geni che sarà integrato nel genoma della pianta e indurre il tessuto dedifferenziazione1,2. Lo scambio di questi geni all'interno del T-DNA di transgene ha permesso la generazione di modifiche specifiche impianto evitando effetti fenotipici3. Per facilitare il transgene clonazione nel T-DNA, regione del T-DNA è stata asportata in un plasmide indipendente chiamato un plasmide binario, mentre il resto dei geni del plasmide Ti (i geni di virulenza che consentono i meccanismi di trasferimento e inserimento di T-DNA) sono stati collocato in un plasmide helper. Per ricerca di biotecnologia della pianta, trasformazione di a. tumefaciens ha diversi vantaggi: essa non ha bisogno di costosi dispositivi, è in grado di generare sia trasformazione in pianta stabile e transitoria e basso numero di copie sono integrate nel gene la cromosoma4. Tuttavia, per la maggior parte delle piante, ma non, di Arabidopsis la generazione di trasformanti stabile richiede la rigenerazione della pianta da una sola o poche cellule utilizzando esogeni fitormoni, rendendo questo processo laborioso e che richiede tempo. A. rhizogenes è anche in grado di modificare il genoma della pianta, producendo radici pelosi o radici avventizie presso i siti di infezione a causa dell'espressione dei geni rol (radice loci) codificato in radice-induzione (Ri) plasmide5. Anche se meno studiata rispetto a. tumefaciens, a. rhizogenes è utilizzato anche per ottenere radici transgeniche. In questo caso, a. rhizogenes contiene l'originale T-DNA nel plasmide Ri e un plasmide binario con un secondo T-DNA che trasportano il transgene. Quando il sito di infezione è in fusti o ipocotili, una pianta composita può essere ottenuta, con nuove radici transgeniche pelosi emergenti dai germogli di tipo selvaggio. In alternativa, pelosa radici trasformate possono crescere autonomamente in vitro nei media con ingressi sorgente di carbonio. L'uso di a. rhizogenes invece di a. tumefaciens per produrre tessuti transgenici sta guadagnando importanza quando la radice è l'organo bersaglio, perché pianta rigenerazione non è necessaria e quindi è più veloce e meno costoso. Gli studi precedenti hanno dimostrato questa metodologia ha stanziata per la caratterizzazione fenotipica di radice specifici geni6,7,8,9.
La patata (Solanum tuberosum) è il quarto più importanti delle colture del mondo secondo la Food and Agriculture Organization delle Nazioni Unite (FAO) poiché il tubero ha rilevanza nutrizionale destinati al consumo umano per essere una buona fonte di vitamine e minerali. Per questo motivo, patata è stata posta sotto i riflettori di biotecnologia agricola e inoltre è considerata come un buon modello biologico per genetica ed evolutiva Studi10,11. Trasformazione di patate ha contribuito significativamente alla comprensione dei meccanismi molecolari sottostanti quali tessuti attraverso la caratterizzazione di geni coinvolti nella Suberina e cera biosintesi12,13,14 ,15,16,17, Suberina monomero trasporto18 e trascrizione regolamento19. Il gene della transferasi feruloil suberina, FHT, è uno di questi geni biosintetici caratterizzati; la downregulation dà luogo ad un danno forte della protezione del periderma, che è correlata con una diminuzione forte in miscela di etanolo esteri di Suberina e cere di tuberi di patata14. In concomitanza, nelle radici e semi di Arabidopsis, il Ko di suo putativo ortologo (Massimo/RWP1) inoltre ha dimostrato suo ruolo nella produzione di alchil ferulates in suberina20,21. Patata, la linea di transcriptional reporter FHT e l'anticorpo FHT hanno mostrato rispettivamente che l'attività del promotore e le proteine si trovano in exodermis, endodermis, i phellogen-derivati e in tessuti feriti15.
In questo lavoro, dettagliamo un protocollo utilizzando a. rhizogenes per produrre transgeniche radici pelosi che sono mantenute in un tiro di tipo selvaggio, generazione di piante di patate composito o asportato per crescere autonomamente in vitro. Forniamo anche il protocollo utilizza a. tumefaciens per ottenere piante di patate transgeniche completa. Come caso di studio, a. rhizogenes e a. tumefaciens trasformato con lo stesso vettore binario sono utilizzati per ottenere le radici con il promotore FHT Guida di espressione del gene reporter GUS . I risultati sono segnalati e rispetto.
Protocollo
Il protocollo di trasformazione a. rhizogenes è stato adattato e modificato da corno et al.7 e il genotipo testato era S. tuberosum ssp. tuberosum (c.v. Désirée). Il protocollo di trasformazione a. tumefaciens è stato adattato e modificato da Bono et al.22 e i genotipi testati erano S. tuberosum ssp. tuberosum (c.v. Désirée) e S. tuberosum SSP. andigena. Le fasi principali di entrambe le procedure sono riassunti nella Figura 1 e figura 2, rispettivamente.
Nota: In tutte le fasi della procedura di esecuzione in vitro trasferimenti, farlo rapidamente e quando possibile, mantenere le piastre o vasi chiusi, riducendo così al minimo pianta esposizione all'aria per evitare l'avvizzimento e contaminazione. Diversamente indicato, tutte le incubazioni di pianta sono state fatte in armadi nelle condizioni di 12h di 24 ° C luce/12 h di 20 ° C scuro e 67 µmol m-1 s-1. Altrimenti, eseguire tutti i batteri manipolazione e in vitro pianta trasferimenti in condizioni asettiche in cappa a flusso laminare. Tutte le ricette di media per Agrobacterium e in vitro di colture vegetali sono fornite in Tabella S1.
Attenzione: Deposito di tutti i batteri geneticamente modificati e le piante per il contenitore di raccolta appropriato.
1. culture Agrobacterium usate per la trasformazione
Nota: Il ceppo utilizzato per la trasformazione di a. rhizogenes era la C58C1:Pri15837 (gentilmente fornito da Dr. Inge Broer) e che per la a. tumefaciens era il GV2260 (gentilmente fornito da Dr. Salomé Prat). A. rhizogenes è stato trasformato con il vettore binario PK7GWIWG2_II-RedRoot (VIB-dipartimento di biologia dei sistemi vegetali presso Universiteit Gent; http://gateway.psb.ugent.be) che contiene un T-DNA che trasportano un marcatore di trasformazione per monitorare la radice pelosa formazione. Per confrontare le radici trasformate generate da a. rhizogenes e a. tumefaciens, entrambi sono stati trasformati con il pKGWFS7 di vettore binario che contiene un T-DNA che trasportano il promotore FHT guida il gene reporter β-glucoronidase (GUS) ed il gene di resistenza alla kanamicina come un marcatore selezionabile15.
- Scegli una colonia di Agrobacterium e crescere durante la notte (O/N) in 5 mL di medium YEB completate con gli antibiotici (Tabella S1) in una provetta da centrifuga 50 mL a 28 ° C con agitazione a 200 giri/min.
- Per la trasformazione di a. tumefaciens , misurare la densità ottica, che deve essere OD600 = 0.6-1.0.
- Se la densità ottica è più alta, fare una sottocultura abbassandola a OD600 = 0.3 con media fresco e aspettare finché raggiunge la cultura OD600 = 0,6-1.
- Centrifugare 1 mL di coltura di Agrobacterium a 3.000 x g in una centrifuga di banco per 10 min a temperatura ambiente.
- Pipettaggio per rimuovere il supernatante e risospendere le cellule in 1 mL di mezzo YEB fresco senza antibiotici. Ripetere questo passaggio per garantire la rimozione completa di antibiotici.
- Per la trasformazione di a. tumefaciens , nella risospensione ultimo aggiungere il volume appropriato di YEB per ottenere una densità ottica finale di OD600 = 0,8.
- Mantenere le cellule sul ghiaccio durante la preparazione le piante per essere infettati.
2. il materiale vegetale per la trasformazione
- Fare uno o due nodo talee o contenenti l'apicale o i germogli ausiliari da sterile in vitro patata piante (donatore); farle crescere in mezzo solido 2MS in vasi per 3-4 settimane (Figura 1A e Figura 2A).
3. impianto di trasformazione utilizzando a. rhizogenes (Figura 1)
Nota: Questa procedura permette di ottenere delle radici pelosi trasformate. Per valutare l'espressione del transgene, è necessario un controllo negativo. Per preparare il controllo negativo, seguire la procedura utilizzando un ceppo di a. rhizogenes trasformato o trasformato con il vettore vuoto che include il gene marcatore di trasformazione.
- Utilizzare mezzi freschi piatti; in alternativa, le piastre possono essere tenute a 4 ° C dal lato del coperchio, ermeticamente sigillate con pellicola trasparente per evitare la disidratazione media. Per preparare i piatti quadrati media, loro inclinazione ~ 15°, riempimento con 40 mL di MS e farli solidificare. Questo ridurrà al minimo il contatto della parte aerea della pianta con il mezzo.
- Trasferimento molto attentamente una pianta di donatore da 2MS medio a piastra quadrata 120 x 120 mm.
- Iniettare a uno stelo internodo 3 μL della cultura a. rhizogenes utilizzando un ago chirurgico e ripeterlo due volte per pianta in diversi internodi quando possibile.
Nota: Considerare ogni iniezione come un evento di trasformazione indipendente (Figura 1B). - Trasferire immediatamente l'intera pianta ad una piastra quadrata con tinta MS supplementato con acetosyringone di 0,1 mM. Ospitare 2 piante per piastra.
Nota: La soluzione di riserva acetosyringone 1m è preparata in DMSO e possa essere conservata a-20 ° C. - Sigillare la piastra utilizzando nastro chirurgico e disporre verticalmente all'interno di un armadietto di crescita per 4 giorni.
- Trasferire la pianta ad una nuova piastra quadrata con MS supplementato con cefotaxime sodium [500 µ g/mL] di uccidere a. rhizogenes.
- Dopo 10-12 giorni, radici pelosi inizieranno ad apparire (Figura 1,1D). Quindi, asportare le radici native della pianta e trasferire la pianta ad una nuova piastra quadrata con MS supplementato con cefotaxime sodico [500 µ g/mL].
Nota: Radici pelosi trasformate possono essere controllate da fluorescenza rossa quando usando un pennarello di trasformazione DsRed (Figura 3D). - Per ottenere una pianta composita (Figura 1E), lasciare le radici pelosi transgeniche crescere per 3-4 settimane in MS supplementato con cefotaxime sodico [500 μg/mL] (cambiare il mezzo ogni settimana).
- A seconda dello scopo, propagare le radici pelosi transgeniche e controlli negativi come segue.
- Trasferire la pianta intera composita a idroponici (Tabella S2) o medio del terreno per consentire lo sviluppo massiccio.
- Per propagare individualmente le radici trasformate pelosi, usando un bisturi tagliata le radici che esprime l'indicatore rosso fluorescente trasformazione (proteina DsRed) quando sono lunghe 4-8 cm (Figura 1E) e trasferirli in una capsula di Petri con terreno solido Gamborg B5 completato con 2% di saccarosio e cefotaxime sodium [500 μg/mL]. Sigillare le piastre con parafilm plastica e farle crescere al buio a 20 ° C.
Nota: Le radici possono essere manipolate sotto un microscopio stereoscopico in grado di rilevare la fluorescenza in condizioni sterili (Vedi Tabella materiali). - Per la produzione di biomassa (cioè, analisi di espressione genica), tagliare una radice lunga pelosi di 5 cm e si propagano in una beuta da 150 mL con 20 mL di liquido Gamborg B5 supplementato con 2% di saccarosio e cefotaxime sodium [500 µ g/mL]. Crescere per 6 settimane al buio a 20 ° C e 60 giri/min.
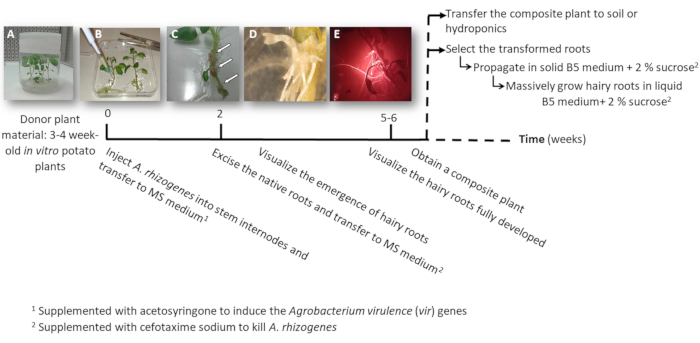
Figura 1: Sequenza temporale per ottenere patate transgeniche radici pelosi utilizzando a. rhizogenes. Le settimane cumulative per raggiungere ogni fase del processo di trasformazione e i passi successivi per crescere le radici pelosi sono mostrate. Sono raffigurate immagini rappresentative di diverse fasi: l'iniziazione del processo utilizzando 3-settimana-vecchio in vitro di piante (A), quindi l'infezione delle piante iniettando a. rhizogenes (B), la formazione della proliferativa tessuto (C, frecce) con radici pelosi emergenti (D) e le radici sviluppate pelosi che esprime l'indicatore rosso fluorescente trasformazione DsRed (E). Clicca qui per visualizzare una versione più grande di questa figura.
4. impianto trasformazione utilizzando a. tumefaciens (Figura 2)
Nota: Questa procedura permette di ottenere delle piante trasformate. Per valutare effetto del transgene, è necessario un controllo negativo. È possibile seguire la procedura utilizzando un a. tumefaciens trasformate con il vettore vuoto. In alternativa, possono essere utilizzati piante wild type.
- Tagliare e posizionare una foglia dalle piante di 3-4-settimana-vecchio (Figura 2A) in una capsula di Petri. Usando un bisturi escludere il picciolo e fare tagli trasversali (1-3 a seconda delle dimensioni della foglia) dal centro della foglia ai bordi evitando loro tagliando (Figura 2B).
- Immediatamente posto la foglia che galleggia su 10 mL di 2MS fresco liquido media in una capsula di Petri con il lato abbagliai fino e chiudere la piastra. Ripetere il passo in grado di ospitare fino a 15 fogli per CV Désirée e 25 foglie per SSP. unndigena (a seconda delle dimensioni di foglia).
- Immediatamente aggiungere 80 µ l di a. tumefaciens cultura OD600 = 0,8 in mezzi liquidi e omogeneizzare la piastra manualmente per 1 min distribuire la soluzione batterica.
- Con attenzione sigillare con pellicola sigillante, coprire con carta stagnola e incubare per 2 giorni in una camera a 24 ° C per consentire la trasformazione si verificano.
- Trasferire le foglie mantenendo abbagliai laterale fino a medie CIM (Figura 2B) e incubare a loro per una settimana in un armadietto di crescita.
- Raschiare il mezzo CIM con le pinzette, affinché le foglie possono essere risolte al meglio sui media.
- Trasferire le foglie mantenendo abbagliai laterale fino a mezzo SIM (Figura 2) e incubare a loro in un armadietto, rinfrescante il mezzo ogni 7-10 giorni, fino a quando i germogli sono circa 2 cm di altezza di crescita.
- Raschiare il mezzo SIM con le pinzette, affinché le foglie possono essere completamente circondate dai media. Quando i germogli emersi raggiungono il coperchio, lavorare con altezza di Petri (100 x 20 mm, altezza x diametro).
Nota: Il callo si forma dopo 2-3 settimane in media SIM (Figura 2D) e i germogli dopo 6-7 settimane (Figura 2E). I germogli saranno considerati eventi di trasformazione indipendente quando emergono dal callo formato dalle ferite indipendente.
- Raschiare il mezzo SIM con le pinzette, affinché le foglie possono essere completamente circondate dai media. Quando i germogli emersi raggiungono il coperchio, lavorare con altezza di Petri (100 x 20 mm, altezza x diametro).
- Taglio tre tiri è emerso da ogni callo (considerato lo stesso evento di trasformazione) (Figura 2E), trasferimento per matracci di cultura con il mezzo di MG completati con cefotaxime sodium [250 mg/L] per consentire il tifo, etichettare il sottoinsieme con un numero e Incubare in una crescita armadietto per 3-4 settimane o fino a quando i germogli sono vigoroso (Figura 2F).
Nota: Quando si tagliano i germogli, rimuovere bene il callo altrimenti che la radice non si formerà.- Ripetere il passaggio tante volte quante sono necessarie linee indipendenti. Fino a 5 diversi trasformazione eventi possono essere messo in un matraccio di cultura con un diametro di 8 cm per lavorare in piena fiducia che le piante da eventi diversi non sono mescolate.
- Selezionare la pianta più vigorosa di ciascun evento, tagliare il segmento apicale delle riprese con internodi di 3-4 e posizionarlo in un matraccio di cultura nuova con 2MS supplementato con cefotaxime sodium [250 mg/L].
Nota: In 3-6 settimane che la pianta crescerà in modo efficiente, lo sviluppo di una vigorosa ripresa e radici.- Riportare alla camera i germogli non selezionati fino a quando la pianta selezionata è completamente sviluppato.
- Tagliare segmenti di fusto dalla pianta con almeno un internodo o con la gemma apicale e trasferirli al nuovo 2MS supplementato con cefotaxime [250 mg/L]. Incubare a loro nella crescita armadietto.
- Replicare ogni 3-4 settimane per stabilire le linee in vitro trasformato.
Nota: Il sodio cefotaxima è necessaria in almeno tre trasferimenti successivi a 2MS medio per essere sicuri di uccidere a. tumefaciens; in seguito, se si osserva la crescita eccessiva di a. tumefaciens , trasferire le piante nuovamente ai media di 2MS completati con cefotaxime sodium.
- Replicare ogni 3-4 settimane per stabilire le linee in vitro trasformato.
- Per caratterizzare il fenotipo della pianta, è necessario trasferire piante al suolo per la loro completa caratterizzazione o alla coltura idroponica per ispezione di radice.
- Mantenere i tuberi prodotti nel terreno per propagare e mantenere le linee stabilite.

Figura 2: Timeline per ottenere patate trasformato piante utilizzando a. tumefaciens. Le settimane cumulative per raggiungere ogni fase del processo di trasformazione e i passi successivi per coltivare le piante sono mostrate. Sono raffigurate immagini rappresentative di diverse fasi: l'iniziazione del processo utilizzando foglie da 3 - settimana-vecchio in vitro le piante (A), il trasferimento dei feriti e infetto foglie ai media CIM (B), le foglie quando trasferito a Media SIM (C), la visualizzazione del callo intorno alle aree feriti dopo 2-3 settimane in SIM media (D), la formazione di sparare dopo 9-11 settimane in media SIM (E) e i germogli dopo essere stato trasferito ai media di MG (F). Clicca qui per visualizzare una versione più grande di questa figura.
5. idroponico cultura
- Preparare la soluzione di Hoagland a una mezza forza (0.5 x) (Tabella S2) in un secchio di 10 L.
- Immergere una pompa da acquario per mantenere condizioni di ossigeno adeguato e omogeneità.
- Ricoprono le pareti del secchio con foglio di alluminio di crescere radici in condizioni di oscurità.
- Evitando danni alle radici, trasferimento in vitro le piante in coltura idroponica.
Nota: Rimuovere qualsiasi supporto restante in vitro dalle radici per evitare la proliferazione di microrganismi durante l'incubazione agitando accuratamente le radici immerse in acqua. - Coprire le piante con pellicola trasparente come una serra per consentire un'adeguata acclimatazione e incubare in camera di crescita.
- Forare la pellicola dopo 3 giorni e rimuoverlo completamente una settimana dopo.
- Sostituire con mezzi freschi ogni 10 giorni.
6. analisi del gene del reporter istochimiche GUS
Nota: Nel nostro caso il GUS analisi è stata eseguita con radici di 2-3 settimane coltivate in idroponica o in vitro.
- Difficoltà le radici con acetone refrigerati il 90% (v/v) e incubare per 20 minuti sul ghiaccio.
- Effettuare due lavaggi con acqua distillata.
- Aggiungere GUS fresco colorazione soluzione (tabella 1) e applicare il vuoto (-70 Pa) per 20 min.
- Incubare a 37 ° C nel buio per proteggere il GUS fotosensibile per 4 h o fino a quando un colore blu è visibile.
Nota: La presenza di ferri - e ferrocianuro in soluzione di GUS minimizzare la diffusione dei prodotti di reazione e fornire la localizzazione più precisa.
Attenzione: Utilizzare un aspiratore e indossare indumenti protettivi quando si maneggia i derivati del cianuro tossico in soluzione di GUS (il ferricianuro di potassio e ferrocianuro di potassio). Il substrato di GUS e il materiale di smaltimento devono essere eliminati in modo sicuro. - Rimuovere GUS soluzione di colorazione e gettarlo negli appositi contenitori.
- Effettuare due lavaggi con etanolo 70% (v/v).
- Osservare sotto un microscopio a campo chiaro.
Nota: GUS macchiatura è stabile per un paio di settimane; Tuttavia, durante la prima settimana, il segnale di GUS è chiaro e diffonde meno in cellule vicine. Per conservarli più a lungo, sigillare il tubo e conservare a 4 ° C.

Tabella 1: Ricetta di soluzione colorante GUS.
Risultati
Agrobacterium rhizogenes -mediata trasformazione di patate
In questo manoscritto, viene presentata la procedura dettagliata per ottenere trasformato radice con a. rhizogenes . Figura 1 presenta una panoramica della procedura, che richiede complessivamente circa 5-6 settimane (da iniezione di a. rhizogenes per ottenere pienamente sviluppate radici pelosi). Quindi, l'impianto può essere studiato come un composito (tipo selvaggio sparare, radice transgenici) o la radice pelosa transgenica cloni possono essere asportati e coltivati in modo autonomo in tinta Gamborg B5 supplementato con 2% di saccarosio. In alternativa, le radici pelosi possono essere propagate massicciamente utilizzando mezzi liquidi Gamborg B5. La procedura presentata è proceduta con S. tuberosum spp. tuberosum (c.v. Désirée).
Il metodo per monitorare la procedura e ottenere patate transgeniche radici pelosi è stato convalidato utilizzando un vettore binario con il DsRed come un marcatore di trasformazione (PK7GWIWG2_II-RedRoot da VIB-dipartimento di biologia dei sistemi vegetali presso Universiteit Gent). Questo ha permesso la distinzione delle radici transgeniche pelosi da non transgenica di fluorescenza rossa. Secondo che, nella Figura 3 le radici pelosi trasformate esibito fluorescenza rossa quando illuminato con luce verde. Il controllo negativo utilizzando il codificano Agrobacterium ha mostrato alcuna fluorescenza rossa (Figura 3), generale che indica l'idoneità del marcatore trasformazione DsRed per identificare le radici pelosi transgeniche (Figura 3D). Altri marcatori di trasformazione come la resistenza agli antibiotico possono essere usati come descritto da altri autori23,24; Tuttavia, gli antibiotici nei media possono produrre un ritardo di crescita nelle radici transgenici contenenti il marcatore.

Figura 3: Fluorescente transgeniche pelosi radici della patata (c.v. Désirée) trasformate da a. rhizogenes. Le radici pelosi sono state ottenute utilizzando un non trasformate a. rhizogenes (ceppo C58C1: pRI1583) (A e C) e con a. rhizogenes (ceppo C58C1:pRI1583) trasformate con il vettore vuoto pK7GWIWG2_II-rosso-radice portando un Marcatore di trasformazione DsRed (B e D). Le radici pelosi sono formate in entrambe le infezioni (A, B) ma fluorescenza rossa è sola osservato in radici pelosi trasformate con l' a. rhizogenes contenente il vettore binario. Le immagini sono state scattate con uno stereomicroscopio dotato di una lampada e un filtro specifico per visualizzare la fluorescenza rossa. Clicca qui per visualizzare una versione più grande di questa figura.
Agrobacterium tumefaciens -mediata trasformazione di patate
Il secondo protocollo descritto in questo manoscritto è impostato per ottenere, passo dopo passo, una pianta di patata completo trasformata con a. tumefaciens. Figura 2 presenta una panoramica della procedura, che dura complessivamente tra 15-18 settimane (da infezione di foglia con a. tumefaciens all'ottenimento di piante completamente rigenerati). La parte più lunga della procedura è la rigenerazione di pianta di organogenesi. Questo particolare passaggio rende questo metodo più laborioso rispetto all'utilizzo di a. rhizogenes. La procedura è stata eseguita con S. tuberosum spp. tuberosum (c.v. Désirée) e S. tuberosum SSP. andigena, il primo è meno dipendente dalle condizioni brevidiurna per indurre tuberization.
In a. tumefaciens-trasformazione mediata, in contrasto con la a. rhizogenes -mediata trasformazione, le piante rigenerate sono organismi transgenici completamente. Tuttavia, anche se le piante transgeniche vengono rigenerate in un mezzo selettivo di kanamicina, non tutte le linee di esprimono in modo efficiente il transgene. Quindi, è necessaria la convalida dell'espressione del transgene.
Confronto tra l'attività del promotore FHT nelle radici ottenute utilizzando A. tumefaciens e a. rhizogenes
Le suddette procedure sono state applicate per la produzione di radici che esprimono il gene GUS sotto il promotore del gene FHT . Il completo trasformato piante con a. tumefaciens erano precedentemente segnalati15, utilizzando il pKGWFS7 di vettore binario contenente il promotore FHT . Ora, questo vettore binario è stato utilizzato per produrre nuove radici pelosi trasformate per confrontare i tessuti dove il promotore è attivo e quindi di testare il sistema di radice peloso come uno strumento per studiare l'attivazione del promotore.
La figura 4 Mostra GUS colorazione nelle radici di piante transgeniche ottenute da a. tumefaciens (Figura 4AB) e radici pelosi transgeniche ottenute da a. rhizogenes (Figura 4D, E, F), rispettivamente. Come si può vedere, radici trasformate con a. tumefaciens e coltivati in vitro mostrano una colorazione blu in endodermis (Figura 4A), uno strato di cellule tra la corteccia e la stele. In più sviluppato le radici, l'etichettatura blu è irregolare nello strato esterno corrispondente al exodermis (Figura 4B). Nelle radici pelosi trasformate coltivate in idroponica, il marcatore di GUS in particolare è stato situato in endodermis (Figura 4E), l'emergere di radici laterali (Figura 4E), nelle aree ferite (Figura 4E ) e in exodermis (Figura 4F). Le radici hanno mostrate nessuna macchia di GUS in controlli negativi che erano entrambi radici pelosi senza le radici di cassette o wild-type PromFHT:GUS T-DNA.

Figura 4: Osservazione istochimiche delle radici di patate transgeniche che esprimono il gene reporter GUS guidato dal promotore di FHT. Le radici da piante transgeniche complete ottenute da a. tumefaciens blue di Visualizza trasformazione (A-B) (S. tuberosum SSP. andigena) colorazione nel endodermis (A) ed exodermis (B). Le radici di pelosi transgeniche ottenute da a. rhizogenes (S. tuberosum SSP. tuberosum c.v. Désirée) trasformazione (C-F) visualizzare GUS macchiatura in endodermis (C ed E), nelle radici laterali emersione (D ed E), nella zona di guarigione (E) e in exodermis (F). Endodermis (EN); Exodermis (EX); Xilema (XL); Primordi di una radice laterale (LR). La freccia rossa indica l'area ferita. Clicca qui per visualizzare una versione più grande di questa figura.
S1 della tabella: Ricette di media piante usate per la crescita di batteri e in vitro . Per favore clicca qui per scaricare questa tabella
Tavolo S2: Soluzione di mezza forza Hoagland per coltivazione di piante di patata in coltura idroponica. Per favore clicca qui per scaricare questa tabella
Discussione
Patata, il sistema più comune per ottenere piante transgeniche complete stabile utilizza la trasformazione da ceppi di Agrobacterium tumefaciens che richiedono organogenesi utilizzando fitormoni esogeni. Anche se i protocolli di Agrobacterium basato ha il potenziale per integrare non-T-DNA vettore sequenza25, questa metodologia è ancora il metodo più semplice e meno costoso disponibile per trasformare piante di patate. Negli ultimi anni, l'interesse in a. rhizogenes-trasformazione mediata ha ottenuto l'attenzione dei ricercatori per permettendo di ottenere radici transgeniche in periodi più brevi rispetto all'utilizzo di a. tumefaciens. A. rhizogenes conserva ancora il plasmide di (Ri) radice-induzione che trasporta un set di geni che codificano gli enzimi per la biosintesi di controllo e citochinine auxina di fitormoni, e codifica per opina26. Una volta che il Ri T-DNA viene inserito il DNA di genomic di host, il nuovo equilibrio ormonale allenta le cellule infettate che inducono la formazione di radici proliferanti, chiamato radici pelosi, emergenti presso i punti di infezione27. Quando un vettore binario aggiuntivo viene utilizzato per l'integrazione di un DNA estraneo, la conservazione del plasmide Ri conferisce la possibilità di ottenere radici trasformate pelosi senza bisogno di organogenesi utilizzando fitormoni esogenicamente applicata28. Le radici pelosi possono essere mantenute attaccato per le riprese di tipo selvaggio generando una pianta composita o possono essere auto-propagate. Questa capacità di radici pelosi di auto-propagazione viene sfruttata per produrre in parecchie radici di piante peloso come un sistema biologico per forgiare preziosi metaboliti o proteine estranee, generando interesse in prodotti farmaceutici e phytoremediation anche aree ( Vedi recensione29,30). Patata (var. Kufri Bahar), piante transgeniche completi sono stati infettati con wild-type a. rhizogenes ceppo per produrre radici pelosi che esprimono gli antigeni di superficie (HBsAg) epatite B23. In alternativa, può essere ottenuta una pianta transgenica completa rigenerata dalle radici pelosi, ma pianta di patate e tuberi ha mostrato lo sviluppo distinto rispetto ai controlli non trasformati. Queste differenze nel fenotipo sono dovuto Ri originale T-DNA integrato all'interno del genoma31,32.
In questo lavoro, le procedure dettagliate per ottenere transgenici stabili radici pelosi utilizzando a. rhizogenes e piante transgeniche stabili, utilizzando a. tumefaciens vengono presentati (Figura 1 e Figura 2). Completamente sviluppate radici pelosi transgeniche sono state ottenute in 5-6 settimane, mentre le radici transgeniche utilizzando a. tumefaciens necessari 15-18 settimane a causa del requisito di organogenesi da cellule trasformate e la selezione e propagazione delle piante trasformate. Nelle nostre mani, la procedura di trasformazione di a. tumefaciens funziona in modo efficiente in S. tuberosum SSP. andigena e SSP. tuberosum (c.v. Désirée), con un'efficienza di trasformazione riferito circa 35%22 e 48% 12, rispettivamente. La descritta procedura di trasformazione a. rhizogenes è basato su quello segnalato dal corno7, che ha mostrato un alto (80-100%) l'efficienza di trasformazione in CV. Désirée e altre cultivar di tre patate (Albatros, Sabina e Saturna).
Per presentare a. rhizogenes come un sistema di trasformazione alternativi per le patate da studi funzionali e per indicare che se la presenza iniziale di Ri T-DNA era fonte di preoccupazione, abbiamo utilizzato entrambi i sistemi per trasformare le radici di patate con lo stesso binario vector che conteneva un T-DNA con un promotore di un gene biosintetico di suberina (FHT) guida l'espressione del gene reporter GUS . L'analisi istochimica ha rivelato che in a. tumefaciens trasformato piante, l'attività del promotore FHT era negli strati interni ed esterni quali delle radici (endodermis ed exodermis, rispettivamente) (Figura 4A,B ) e anche nelle zone del foglia, gambo e tubero15ferite. In a. rhizogenes trasformato pelosi radici, l'attività inoltre è stata rilevata nel endodermis ed exodermis e nelle aree feriti radice (Figura 4E). La co-occorrenza dell'attività del promotore di suberina in entrambi i tipi di radici trasformate indica che il Ri integrato T-DNA non è che interessano i processi di sviluppo legati alla suberization almeno in questi tessuti di radice. Nelle radici pelosi trasformate inoltre abbiamo rilevato attività del promotore FHT nelle aree circostanti l'emergere di radici laterali (Figura 4,E). Questo concorda con l'attività del promotore segnalato da altri geni coinvolti nel trasporto di monomeri suberina come ABCG11 / WBC1133,34,35,36 o il regolatore StNAC103 19. la trasformazione di patate di a. rhizogenes per studiare un gene suberina è già stata segnalata recentemente37 e radici anche in quel caso pelosi hanno permesso di mostrare l'attivazione del promotore di CYP86A33, un acido grasso Ω-idrossilasi. Tuttavia, il GUS colorazione nelle radici era massa quantificato tramite un'analisi fluorometrica, da qui l'espressione specifica in quali tessuti è stata solo presunta.
Complessivamente queste prove di risultati che a. rhizogenes trasformazione è uno strumento alternativo più veloce per esplorare l'attivazione del promotore di tipo-specific di cella di geni correlati alla suberina nelle radici, che possono essere estesa a studi basati su altri processi che verificarsi nelle radici. D'accordo, alcuni altri studi di genetiche funzionale hanno avuto successo nel usando a. rhizogenes in patata, pomodoro ed eucalipto per dimostrare il gene funzione6,8,7,9, per studiare la risposta ormonale38,39 o il promotore attività40,41. Tuttavia, questa strategia può comunque presentare limitazioni, soprattutto quando lo studio dei processi inerenti allo sviluppo strettamente controllata che possono essere liberalizzati di Ri T-DNA o quando il di piante intere o i tuberi o altri organi diversi dalle radici desiderano essere studiato. In queste situazioni, il sistema di trasformazione di a. tumefaciens è ancora comodo.
Divulgazioni
Gli autori non hanno conflitti di interesse a divulgare.
Riconoscimenti
Questo lavoro è stato supportato dal Ministerio de Innovación y Ciencia (AGL2009-13745, FPI grant a PB), il Ministerio de Economía y Competitividad e FEDER finanziamenti (AGL2012-36725, AGL2015-67495-C2-1-R) e l'Università di Girona (borsa di dottorato a SF e grant SING11/1). Gli autori sono grati al Dr. Inge Broer (Istituto di uso del territorio, Università di Rostock, Rostock, Germania) e Dr. Salomé Prat (Centro Nacional de Biotecnología, Madrid, Spagna) per la fornitura a. rhizogenes e il ceppo di a. tumefaciens , rispettivamente e Dr. Marçal Soler e Dr. Anna Plasencia per l'aiuto e il sostegno ricevuto nell'inizio degli esperimenti di trasformazione a. rhizogenes (Università di Tolosa III Paul Sabatier — CNRS, Plant Research Laboratory (LRSV), Castanet Tolosan, Francia). Gli autori ringraziano Sara Gómez (Departament de Biologia, UdG, Girona) per la sua preziosa assistenza nella realizzazione dei lavori di laboratorio e prendersi cura di piante e Ferran Fontdecaba e Carla Sánchez, che ci ha assistito con alcuni esperimenti mentre stavano facendo loro progetti di laurea finale.
Materiali
| Name | Company | Catalog Number | Comments |
|
Acetone |
Panreac |
1.310.071.21 | |
|
Acetosyringone |
Acros |
115540050 | |
|
Aquarium pump |
Prodac |
MP350 | |
|
Autoclave |
Ragpa Strelimatic | ||
|
Bacteriological agar |
Lab Conda |
1800 | |
|
BAP |
Duchefa |
B0904 | |
|
Beef extract |
Lab Conda |
1700 | |
|
Plant growing cabinet |
Nuaire | ||
|
Carbenicillin |
Duchefa |
C0109 | |
|
Cefotaxime sodium |
Duchefa |
C0111 | |
|
DMSO |
Merck |
1029310161 | |
|
Ecotron infors |
HT |
29378 | |
|
Ethanol |
Merck |
1,009,831,011 | |
|
Falcon tube |
Control tecnica |
CFT011500 | |
|
Ferricyanate |
Sigma |
101001081 | |
|
Ferrocyanate |
Sigma |
100979088 | |
|
Flask (8.06 cm diameter and 11.3 cm height) and plastic lid for in vitro culture |
Apiglass |
ref16 | |
|
GA3 |
Sigma |
G7645 | |
|
Gamborg B5 media |
Duchefa |
G0210 | |
|
Gelrite |
Duchefa |
G1101 | |
|
Glucosa |
Sigma |
G5767 | |
|
Kanamycin |
Sigma |
K1377 | |
|
Leukopor tape |
BSN Leukopor |
BDF47467 | |
|
Lupe |
Wild-Heerbrugg |
M420 | |
|
Magnetic shaker |
Agimatic |
7000243 | |
|
MES hydrate |
Sigma |
M2933-25G | |
|
MgSO4 |
Panreac |
131404 | |
|
Microscope |
Olympus | ||
|
Minufugue centrifugue 5415R |
Eppendorf | ||
|
Murashige and Skoog media |
Duchefa |
M0254.0050 | |
|
Na2HPO4 |
Panreac |
131679 | |
|
NAA |
Duchefa |
N0903 | |
|
NaCl |
Panreac |
131659 | |
|
NaH2PO4 |
Sigma |
58282 | |
|
NightSea Stereo |
SFA Moonting Adapter | ||
|
Parafilm |
Anorsa |
PRFL-001-001 | |
|
Peptone |
Lab Conda |
1616 | |
|
Petri dishes (90 x 14) |
Anorsa |
200200 | |
|
pHmetre |
Crison | ||
|
Phytotron |
Inkoa |
RFTI-R5485 | |
|
Plant Agar |
Duchefa |
P1001 | |
|
Refrigeratot |
Liebherr Medline | ||
|
Rifampicin |
Duchefa |
R0146 | |
|
Spectinomycin |
Sigma |
59007 | |
|
Spectrophotometer |
Shimadzu | ||
|
Square plates (120 x 120) |
Deltalab |
200204 | |
|
Streptomycin |
Sigma |
S6501 | |
|
Sucrose |
Panreac |
131621 | |
|
Surgical blades |
Swann-Morton |
201 | |
|
Surgical needle |
NIPRO |
015/0204 | |
|
Triptone |
Lab Conda |
1612 | |
|
Triton |
Serva |
37240 | |
|
Unimax 1010 shaker |
Heidolph | ||
|
Vacuum |
Dinko | ||
|
x-GlcA (5-Bromo-4-chloro-3-indoxyl-beta-D-glucuronic acid, sodium salt anhydrous) |
Biosynth |
B-7398 | |
|
Yeast extract |
Lab Conda |
1702.00 | |
|
Zeatin riboside |
Sigma |
1001042850 |
Riferimenti
- Gelvin, S. B. Traversing the Cell: Agrobacterium T-DNA's journey to the host genome. Frontiers in Plant Science. 3, 1-11 (2012).
- Lacroix, B., Citovsky, V. The roles of bacterial and host plant factors in Agrobacterium-mediated genetic transformation. The International Journal of Developmental Biology. 57 (6-8), 467-481 (2013).
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Ishida, Y., et al. High efficiency transformation of maize (Zea mays L.) mediated by Agrobacteriumtumefaciens. Nature Biotechnology. 14 (6), 745-750 (1996).
- White, F. F., Taylor, B. H., Huffman, G. A., Gordon, M. P., Nester, E. W. Molecular and genetic analysis of the transferred DNA regions of the root-inducing plasmid of Agrobacterium rhizogenes. Journal of Bacteriology. 164 (1), 33-44 (1985).
- Dinh, P. T. Y., Brown, C. R., Elling, A. A. RNA Interference of effector gene Mc16D10L confers resistance against Meloidogyne chitwoodi in Arabidopsis and Potato. Phytopathology. 104 (10), 1098-1106 (2014).
- Horn, P., et al. Composite potato plants with transgenic roots on non-transgenic shoots: a model system for studying gene silencing in roots. Plant Cell Reports. 33 (12), 1977-1992 (2014).
- Plasencia, A., et al. Eucalyptus hairy roots, a fast, efficient and versatile tool to explore function and expression of genes involved in wood formation. Plant Biotechnology Journal. 14 (6), 1381-1393 (2015).
- Ron, M., et al. Hairy root transformation using Agrobacteriumrhizogenes as a tool for exploring cell type-specific gene expression and function using tomato as a model. Plant Physiology. 166 (2), 455-469 (2014).
- Zhang, W., et al. Development and application of a universal and simplified multiplex RT-PCR assay to detect five potato viruses. Journal of General Plant Pathology. 83 (1), 33-45 (2017).
- Almasia, N. I., et al. Successful production of the potato antimicrobial peptide Snakin-1 in baculovirus-infected insect cells and development of specific antibodies. BMC Biotechnology. 17 (1), 1-11 (2017).
- Serra, O., et al. Silencing of StKCS6 in potato periderm leads to reduced chain lengths of suberin and wax compounds and increased peridermal transpiration. Journal of Experimental Botany. 60 (2), 697-707 (2009).
- Serra, O., et al. CYP86A33-Targeted gene silencing in potato tuber alters suberin composition, distorts suberin lamellae, and impairs the periderm's water barrier function. Plant Physiology. 149 (2), 1050-1060 (2008).
- Serra, O., et al. A feruloyl transferase involved in the biosynthesis of suberin and suberin-associated wax is required for maturation and sealing properties of potato periderm. The Plant Journal. 62 (2), 277-290 (2010).
- Boher, P., Serra, O., Soler, M., Molinas, M., Figueras, M. The potato suberin feruloyl transferase FHT which accumulates in the phellogen is induced by wounding and regulated by abscisic and salicylic acids. Journal of Experimental Botany. 64 (11), 3225-3236 (2013).
- Serra, O., Chatterjee, S., Figueras, M., Molinas, M., Stark, R. E. Deconstructing a plant macromolecular assembly: chemical architecture, molecular flexibility, and mechanical performance of natural and engineered potato suberins. Biomacromolecules. 15 (3), 799-811 (2014).
- Vulavala, V. K. R., et al. Identification of genes related to skin development in potato. Plant Molecular Biology. 94 (4-5), 481-494 (2017).
- Landgraf, R., et al. The ABC transporter ABCG1 is required for suberin formation in potato tuber periderm. The Plant Cell. 26 (8), 3403-3415 (2014).
- Verdaguer, R., et al. Silencing of the potato StNAC103 gene enhances the accumulation of suberin polyester and associated wax in tuber skin. Journal of Experimental Botany. 67 (18), 5415-5427 (2016).
- Molina, I., Li-Beisson, Y., Beisson, F., Ohlrogge, J. B., Pollard, M. Identification of an Arabidopsis feruloyl-coenzyme A transferase required for suberin synthesis. Plant Physiology. 151 (3), 1317-1328 (2009).
- Gou, J. Y., Yu, X. -. H., Liu, C. J. A hydroxycinnamoyltransferase responsible for synthesizing suberin aromatics in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 106 (44), 18855-18860 (2009).
- Banerjee, A. K., Prat, S., Hannapel, D. J. Efficient production of transgenic potato (S. tuberosum L. ssp. andigena) plants via Agrobacterium tumefaciens-mediated transformation. Plant Science. 170 (4), 732-738 (2006).
- Sunil Kumar, G. B., Ganapathi, T. R., Srinivas, L., Revathi, C. J., Bapat, V. a. Expression of hepatitis B surface antigen in potato hairy roots. Plant Science. 170 (5), 918-925 (2006).
- Schmidt, J. F., Moore, M. D., Pelcher, L. E., Covello, P. S. High efficiency Agrobacteriumrhizogenes-mediated transformation of Saponariavaccaria L. (Caryophyllaceae) using fluorescence selection. Plant Cell Reports. 26 (9), 1547-1554 (2007).
- Petti, C., Wendt, T., Meade, C., Mullins, E. Evidence of genotype dependency within Agrobacteriumtumefaciens in relation to the integration of vector backbone sequence in transgenic Phytophthorainfestans-tolerant potato. Journal of Bioscience and Bioengineering. 107 (3), 301-306 (2009).
- Gaudin, V., Vrain, T., Jouanin, L. Bacterial genes modifying hormonal balances in plants. Plant Physiology and Biochemistry. 32 (1), 11-29 (1994).
- Nemoto, K., et al. Function of the aux and rol genes of the Ri plasmid in plant cell division in vitro. Plant Signaling &. Behavior. 4 (12), 1145-1147 (2009).
- Visser, R. G. F., et al. Expression and inheritance of inserted markers in binary vector carrying Agrobacteriumrhizogenes-transformed potato (Solanumtuberosum L.). Theoretical and Applied Genetics. 78 (5), 705-714 (1989).
- Guillon, S., Trémouillaux-Guiller, J., Pati, P. K., Rideau, M., Gantet, P. Hairy root research: recent scenario and exciting prospects. Current Opinion in Plant Biology. 9 (3), 341-346 (2006).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Ooms, G., Lenton, J. R. T-DNA genes to study plant development: precocious tuberisation and enhanced cytokinins in A. tumefaciens transformed potato. Plant Molecular Biology. 5 (4), 205-212 (1985).
- de Vries-Uijtewaal, E., et al. Fate of introduced genetic markers in transformed root clones and regenerated plants of monohaploid and diploid potato genotypes. TAG. Theoretical and applied genetics. 78 (2), 185-193 (1989).
- Bird, D., et al. Characterization of Arabidopsis ABCG11/WBC11, an ATP binding cassette (ABC) transporter that is required for cuticular lipid secretion. The Plant Journal: For Cell and Molecular Biology. 52 (3), 485-498 (2007).
- Luo, B., Xue, X. Y., Hu, W. L., Wang, L. J., Chen, X. Y. An ABC transporter gene of Arabidopsis thaliana, AtWBC11, is involved in cuticle development and prevention of organ fusion. Plant and Cell Physiology. 48 (12), 1780-1802 (2007).
- Panikashvili, D., et al. The Arabidopsis DESPERADO/AtWBC11 transporter is required for cutin and wax secretion. Plant Physiology. 145 (4), 1345-1360 (2007).
- Panikashvili, D., et al. The Arabidopsis DSO/ABCG11 transporter affects cutin metabolism in reproductive organs and suberin in roots. Molecular Plant. 3 (3), 563-575 (2010).
- Bjelica, A., et al. Fatty acid ω-hydroxylases from Solanum tuberosum. Plant Cell Reports. 35 (12), 2435-2448 (2016).
- Ding, Y., et al. Abscisic acid coordinates nod factor and cytokinin signaling during the regulation of nodulation in Medicago truncatula. The Plant Cell. 20 (10), 2681-2695 (2008).
- Isayenkov, S., Mrosk, C., Stenzel, I., Strack, D., Hause, B. Suppression of allene oxide cyclase in hairy roots of Medicagotruncatula reduces jasmonate levels and the degree of mycorrhization with glomus intraradices 1[w]. Plant Physiology. 139 (3), 1401-1410 (2005).
- Dalton, D. A., et al. Physiological roles of glutathione S-Transferases in soybean root Nodules 1[C][W][OA]. Plant Physiology. 150 (1), 521-530 (2009).
- Limpens, E., et al. RNA interference in Agrobacteriumrhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55 (399), 983-992 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon