Method Article
农杆菌和根瘤菌--马铃薯介导的马铃薯转化与葡萄染色诱导素基因的启动子活性
摘要
在这里, 我们提出了两个协议, 以改造马铃薯植物。农杆菌的转化导致一个完整的转基因植物, 而农杆菌根状茎产生转基因毛状根在野生类型的芽, 可以自我繁殖。然后, 我们通过 GUS 染色检测转化根系中的启动子活性。
摘要
农杆菌是获得转基因植物最广泛使用的方法之一, 因为它有能力将自己的 t-dna 转移并整合到植物的基因组中。在这里, 我们提出了两个转化系统, 基因改造马铃薯 (刺过木豆)植物。在肿瘤转化过程中, 叶子被感染, 转化后的细胞被选择, 一个新的完整的转化植物在18周内被再生。在根瘤菌转化过程中, 茎通过注射针头感染细菌, 用红色荧光标记检测新出现的转化的多毛根, 去除未转化的根。在5-6 内, 所产生的植物是一种野生类型的芽的组合, 具有完全发育的转化的毛状根。为了增加生物量, 转化后的毛状根系可以被切除和自我繁殖。我们应用这两种农杆菌介导的转化方法来获得根系表达 gus 记者基因驱动的亚素生物合成基因启动子。提供 GUS 染色程序, 并允许细胞定位的启动子诱导。在这两种方法中, 转化后的马铃薯根系在亚皮内皮和外真皮中都显示了 GUS 染色, 此外,在 a. 根瘤菌转化的根系中, 在侧根的出现中也检测到了 gus 活性。这些结果表明, a. 根瘤菌可以成为研究根系中表达的基因的快速替代工具。
引言
除了经济利益, 转基因植物的产生有其自身的相关性, 在研究中可以证明基因的最终功能, 并更好地了解植物的生理和发育。植物 DNA 插入最广泛使用的方法是农杆菌介导的转化。农杆菌通过其诱导肿瘤 (ti) 质粒的作用, 能够在许多植物物种的受感染组织中产生冠状凝块。质粒包含一个 t-dna 区域, 具有一组基因, 这些基因将被整合到植物基因组中, 并诱导组织去分化 1,2。转基因在 T-DNA 内交换这些基因, 使植物进行了特定的修饰, 避免了表型效应3。为了促进对 T-DNA 的转基因克隆, T-DNA 区域在一个称为二元质粒的独立质粒中被切除, 而 Ti 质粒 (允许 T-DNA 转移和插入机制的毒力基因) 的其余基因则被切除。放置在辅助质粒中。对于植物生物技术研究来说, 由a. tumefaciens进行改造有几个优点: 它不需要昂贵的设备, 能够产生稳定和短暂的植物转化, 并且将少量的基因副本集成到4号染色体.然而, 对于大多数植物, 但不是拟南芥,建立稳定的转化物需要植物再生从一个单一或几个细胞使用外源植物激素, 使这一过程费力和耗时。根瘤菌也能够改变植物基因组, 产生毛茸茸的根或不定根在感染部位由于表达的滚动(根位点) 基因编码在根诱导 (ri) 质粒 5.虽然研究较少, 但根瘤菌也被用于获得转基因根。在这种情况下, a. 根瘤菌在 ri 质粒中含有原始的 t-dna, 并在二元质粒中含有第二个携带转基因的 t-dna。当感染部位在茎或下胚轴时, 可以获得一种复合植物, 新的多毛转基因根从野生类型的芽中出现。另外, 毛状转化的根可以在有碳源输入的培养基中在体外自主生长。当根是靶器官时, 使用根质体而不是肿瘤产生转基因组织的方法正在变得越来越重要, 因为不需要植物再生, 因此它的速度更快, 成本更低。以往的研究已经证明了这种方法, 用于根特异性基因的表型表征 6,7,8,9。
根据联合国粮食及农业组织 (FAO) 的数据, 马铃薯(Solanum tuberom而d) 是世界上第四大最重要的作物, 因为块茎作为维生素的良好来源, 对人类消费具有营养意义和矿物。因此, 马铃薯已成为农业生物技术的焦点, 也被认为是遗传和发展研究的良好生物模式10、11.马铃薯转化通过对亚素和蜡生物合成所涉及的基因的表征, 对亚化组织的分子机制有显著的贡献, 12、13、14 ,15,16, 17, 亚素单体运输18和转录条例19。亚铁蛋白烯基转移酶基因Fht是这些具有特征的生物合成基因之一;其下调对表皮保护的影响很大, 这与马铃薯块茎14中的亚、酸和蜡的发酵酯率大幅下降有关。此外, 在拟南芥的根部和种子中, 其假定的正位词 (asft/rwp1) 的敲除也证明了其在亚、核素20、21中生成烷基发酵的作用。在马铃薯中, Fht转录记者行和 FHT 抗体分别表明启动子活性和蛋白质分别位于外皮、内皮、phellogn 衍生物和受伤组织15。
在这项工作中, 我们详细介绍了一个协议, 使用a. 根瘤菌生产转基因毛状根, 保存在野生类型的芽, 产生复合马铃薯植物, 或切除在体外自主生长。我们还提供了使用a. tumefaciens获得完整转基因马铃薯植物的协议。作为一个案例研究, 用相同的二元载体转化的a. 根瘤菌和a. tumefaciens 被用来获得根系与fht启动子驱动 gus 记者基因的表达。报告并比较结果。
研究方案
从 Horn 等人的研究中对 a. 根瘤菌转化协议进行了调整和修改, 所测试的基因型为块茎.对 Banerjee 等人进行了 a. tumefaciens 转化协议的改编和修改, 所测试的基因型为块茎菌(Cv. désirée)和刺五加. 图1和图 2分别总结了这两个过程的主要步骤。
请注意:在进行体外转移的所有步骤中, 快速进行转移, 并在可能的情况下保持板材或锅的关闭, 从而最大限度地减少植物对空气的暴露, 以避免枯萎和污染。否则, 所有植物孵育都是在24°c 光的 12小时/20°c 暗的12小时和 67μmol m-1-1 的条件下在柜内进行的.否则, 在层流罩中, 在无菌条件下进行所有细菌操作和体外植物转移。表 S1提供了农杆菌和体外植物培养物的所有培养基配方。
注意事项:将所有转基因细菌和植物存放在废弃容器中。
1. 用于转化的农杆菌培养物
注: 用于 A.根瘤菌转化的菌株是 C58c1:prip1583 7 (由 inge broer 博士善意提供), 用于a. TUMEFACIENS的菌株是 Gv2260 (由 saloméprat 博士善意提供)。a. 根状茎被转化为二元载体 PK7GWIWG2_II 红根 (Vib 系植物系统生物系在大学根特; http://gateway.psb.ugent.be), 其中包含一个 t-dna 携带转化标记, 以监测毛根形成。为了比较a. 根瘤菌和a. tumefaciens所产生的转化根, 两者都被二元载体 pkggwfs7 转化, 其中含有携带 fht 启动子驱动β-葡萄糖酮酶 (gus)记者基因的 t-dna dna和卡那霉素耐药基因作为一个可选择的标记15。
- 选择一个农杆菌群体, 并在 yeb 培养基5毫升中种植, 并在28°c 的50毫升离心管中与抗生素 (表 s1) 补充, 在200点转速下晃动。
- 对于a. tumefaciens变换, 测量光学密度, 这必须是 od600 = 0.6-1.0。
- 如果光学密度较高, 则使用新鲜介质将其降低到 OD600 = 0.3, 并等待培养达到 od600 = 0.6-1。
- 在台式离心机中, 以 3, 000 x克的速度离心1毫升的农杆菌培养, 在室温下进行10分钟的离心。
- 通过移液去除上清液, 在不使用抗生素的情况下, 在1毫升新鲜 YEB 培养基中重新悬浮细胞。重复此步骤, 以确保完全去除抗生素。
- 对于a. tumefaciens变换, 在最后一次重新悬浮液中添加适当的 yeb 体积, 以获得 od600 = 0.8 的最终光学密度。
- 在准备植物被感染的同时, 将细胞保持在冰上。
2. 用于转化的植物材料
- 从离体马铃薯植物 (供体植物) 中制作一个或两个包含顶端或辅助芽的节结;在盆中的固体2MS 介质中生长 3至4周 (图 1 a 和图 2 a)。
3.利用根瘤菌进行植物转化 (图 1)
注: 此过程允许获得转化的毛根。为了评估转基因表达, 需要进行负控制。要准备负对照, 请使用a. 根瘤菌菌株进行未转化或与包含转化标记基因的空载体转化。
- 使用新鲜的介质板;或者, 板材可以保持在4°c 与盖子一侧向上, 密封与透明的薄膜, 以避免介质脱水。准备方形介质板, 倾斜 ~ 15°, 填充40毫升的 MS, 并让它们固化。这将最大限度地减少工厂空中部分与介质的接触。
- 非常小心地将供体植物从2MS 介质转移到120毫米 x120 毫米方板。
- 使用手术针将a. 根瘤菌培养的一个茎节间3Μl 注入, 并在可能的情况下, 在不同的节间对每个植物重复两次。
注: 将每个注入视为独立的转换事件 (图 1b)。 - 立即将整个工厂转移到一个方形的板与固体 ms 介质补充 0.1 mm 乙酰环酮。每个板材可容纳2家植物。
注: 1 M 乙酰环酮库存溶液在 DMSO 中制备, 可存储在-20°c。 - 用手术胶带密封盘子, 并将其垂直排列在生长柜内4天。
- 将植物转移到一个新的方板与 ms 介质补充头孢噻嗪钠 [500Μg/ml] 杀死a.根瘤菌。
- 10-12 后, 毛茸茸的根将开始出现 (图 1c,1C)。然后, 对植物的原生根进行切除, 并将植物转移到新的方形板上, 用 MS 培养基补充头孢噻嗪钠 [500μg/ml]。
注: 当使用 DsRed 变换标记时, 可通过红色荧光检查变形的毛根 (图 3d)。 - 为了获得复合植物 (图 1e), 让转基因多毛根在 ms 培养基中生长 3-4周, 辅以头孢噻嗪钠 [500μg/ml] (每周更换培养基)。
- 根据目的, 繁殖转基因多毛根和阴性对照如下。
- 将整个复合植物转移到水培 (表 s2) 或土壤介质, 以实现大规模开发。
- 为了单独繁殖转化后的多毛根, 使用手术刀切割表达红色荧光转化标记 (DsRed 蛋白) 的根, 当它们是4-8 厘米长 (图 1e), 并将它们转移到一个培养皿与 Gamborg b5 固体介质补充2% 蔗糖和头孢噻嗪钠 [500μg/ml]。用塑料实验室薄膜密封板材, 并在20°c 的黑暗中生长。
注: 根部可在配备无菌条件下检测荧光的立体显微镜下进行操作 (见材料表)。 - 对于生物量生产 (即基因表达分析), 切割一个5厘米长的毛根, 并在一个150毫升的 Erlenmeyer 瓶中繁殖, 其中20毫升的 Gamborg B5 液体培养基, 辅以2% 蔗糖和头孢噻嗪钠 [500μg/ml]。在20°c 和60转/分的黑暗中生长6周。
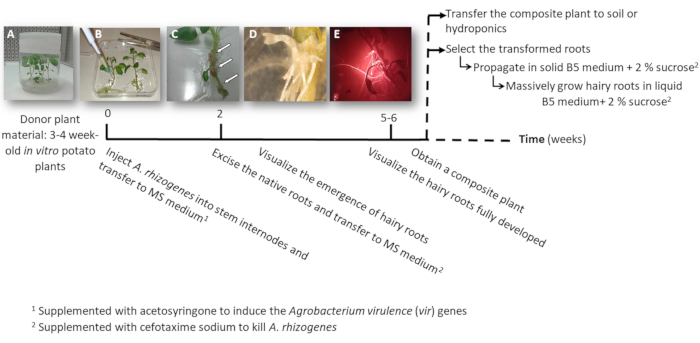
图 1: 利用a. 根瘤菌获得马铃薯转基因毛状根的时间轴.显示了到达转化过程的每个阶段的累计周数以及生长毛茸茸的根的后续步骤。描绘了不同阶段的代表性图像: 开始使用3周的体外植物(a) 的过程, 然后通过注射a. 根瘤菌(b) 感染植物, 形成增殖组织 (c, 箭头) 与出现多毛根 (d), 和发展的多毛根表示红色荧光转化标记 dsred (e)。请点击这里查看此图的较大版本.
4.利用 a. tumefaciens进行植物转化 (图 2)
注: 此过程允许获得转化后的植物。为了评估转基因的效果, 需要进行负控制。一种选择是使用使用空向量转换的a. tumefaciens执行该过程。或者, 也可以使用野生类型的植物。
- 在培养皿中切下并放置一个为期3-4周的植物的叶子 (图 2a)。使用手术刀排除叶柄, 并使横向切割 (1-3 取决于叶的大小) 从叶的中心到边缘, 避免切断他们 (图 2b)。
- 立即将漂浮在新鲜2MS 液体介质10毫升上的叶子放在一个培养皿中, 背面向上并关闭板。重复步骤, 最多可容纳 15条 Désirée 的叶子, 25 片叶子为 ssp.ndigena (取决于叶子大小)。
- 立即在 od600 = 0.8 的液体介质中加入 80μl的 a. tumefacens培养, 并手动将板材均匀 1分钟, 以分配细菌溶液。
- 用密封膜小心密封, 用铝箔覆盖, 在24°c 的室内孵育 2天, 让转变发生。
- 将保持背面的叶子转移到 CIM 介质 (图 2B), 并在生长柜中孵育一周。
- 用推子刮伤 CIM 介质, 以便在介质上更好地容纳叶子。
- 将叶子保持在 sim 介质 (图 2C) 的背面, 并在生长柜中孵育, 每7-10 刷新一次培养基, 直到芽约2厘米高。
- 用推子刮伤 sim 介质, 使叶子完全被介质包围。当出现的芽到达盖子时, 使用高大的 Petri 菜肴 (100 x 20 毫米, 高度 x 直径)。
注: 在 SIM 介质中, 愈伤组织将在2-3周后形成 (图 2E), 6-7 后形成拍摄 (图 2e)。当它们从独立伤口形成的愈伤组织中出现时, 它们将被视为独立的转化事件。
- 用推子刮伤 sim 介质, 使叶子完全被介质包围。当出现的芽到达盖子时, 使用高大的 Petri 菜肴 (100 x 20 毫米, 高度 x 直径)。
- 切三芽出现在每个愈伤组织 (被认为是相同的转化事件) (图 2E), 转移到培养瓶与 mg 介质补充头孢噻嗪钠 [250 mg/L], 以允许生根, 标签子集与一个数字和在生长柜中孵育3-4周或直到芽有活力 (图 2f)。
注: 切割芽时, 请充分取出愈伤组织, 否则根部将无法形成。- 重复此步骤的次数与需要的独立行一样多。最多5个不同的转化事件可以放置在直径为8厘米的培养瓶中, 以充分信任来自不同事件的植物不混合。
- 选择每个事件中最有活力的植物, 用3-4 节间切割出茎的顶端段, 并将其放入新的培养瓶中, 用2MS 培养基补充头孢噻嗪钠 [250 mg/L]。
注: 在3-6 内, 植物将有效生长, 形成一个旺盛的芽和根。- 将未选择的芽带回室内, 直到所选植物完全发育。
- 从植物中切割茎段, 至少有一个节间或柱芽, 并将其转移到新的2MS 培养基, 辅以头孢噻嗪 [250 Mg/2]。在生长柜里孵化。
- 每3-4周复制一次, 以建立体外转化线。
注: 头孢噻嗪钠是需要在至少三个随后转移到2MS 介质, 以确保杀死a.肿瘤;之后, 如果观察到a.肿瘤过度生长, 将植物再次转移到2ms 培养基, 辅以头孢噻嗪钠。
- 每3-4周复制一次, 以建立体外转化线。
- 为了表征植物的表型, 将植物转移到土壤中进行全面表征, 或转移到水培培养进行根系检查。
- 保持土壤中生产的块茎, 以繁殖和维护既定的路线。

图 2: 利用a. tumefaciens获得马铃薯转化植物的时间轴.显示了到转化过程的每个阶段的累计周数以及种植植物的后续步骤。不同阶段的代表性图像描述: 开始使用 3周龄的体外植物(a) 的叶子的过程, 将受伤和受感染的叶子转移到 cim 培养基 (b), 这些叶子在转移到SIM 介质 (c), sim 介质 (d) 2-3周后受伤区域周围的愈伤组织的可视化, sim 介质 (e) 9-11周后的拍摄形成, 以及转移到 mg 介质 (f) 后的拍摄。请点击这里查看此图的较大版本.
5. 水培培养
- 准备霍格兰的解决方案, 以一半的强度 (0.5倍) (表 S2) 在一个10升桶。
- 浸渍水族馆泵, 以保持均匀性和适当的氧气条件。
- 用铝箔覆盖桶壁, 在黑暗的条件下生长根。
- 避免根部损伤, 将植物体外转移到水培培养中。
注: 通过仔细晃动浸入水中的根部, 从根部取出任何残留的体外培养基, 以避免微生物在孵育过程中增殖。 - 用透明的薄膜覆盖植物, 就像温室一样, 以便在生长室中进行充分的驯化和孵化。
- 3天后在胶片上打洞, 一周后将其完全取出。
- 每隔10天更换一次新鲜介质。
6. gus组织化学报告基因检测
注: 在我们的情况下, GUS 分析是在水培或体外生长2-3周的根。
- 用90% 的冷冻丙酮 (v/v) 固定根部, 在冰上孵育20分钟。
- 用蒸馏水进行两次清洗。
- 加入新鲜的 GUS 染色溶液 (表 1), 并应用真空 (-70 帕) 20分钟。
- 在37°c 的黑暗中孵化, 以保护光敏 GUS 4小时或直到可以看到蓝色。
注: 在 GUS 溶液中存在铁氰化铁和氰化铁, 最大限度地减少反应产物的扩散, 并提供更精确的定位。
注意: 在处理 GUS 溶液 (铁氰化钾和氰化铁钾) 中的有毒氰化物衍生物时, 请使用烟罩并穿上防护服。GUS 基板和处置材料应安全处置。 - 取出 GUS 染色溶液, 并将其丢弃在适当的容器中。
- 用乙醇清洗两次 70% (v/v)。
- 在明亮的田野显微镜下观察。
注: GUS 染色在几个星期内保持稳定;然而, 在第一周, GUS 信号是清晰的, 扩散到相邻细胞的较少。为了更长的储存时间, 请密封管并将其存放在4°c。

表 1:GUS 染色解决方案配方。
结果
根瘤菌-介导的马铃薯转化
在这篇手稿中, 提出了逐步建立的程序, 以获得转化根与 a. 根瘤菌。图 1概述了该过程, 总共需要大约 5-6 (从注射a. 根瘤菌到获得完全发育的多毛根)。然后, 该植物可以作为一种复合 (野生类型的芽, 转基因根) 或转基因毛状根克隆可以切除和自主生长在固体 Gamborg B5 介质补充2% 蔗糖。或者, 多毛的根可以使用液体 Gamborg B5 培养基大规模繁殖。所提出的程序是用tuberosum (cv. désirée )进行的。
监测该程序和获得马铃薯转基因毛根的方法已验证使用二进制载体与 DsRed 作为转化标记 (PK7GWIWG2_II-redroot 从 Vib 系系在大学根特)。这使得转基因多毛根从非转基因的红色荧光的区别。据此, 在图 3中, 转化后的毛状根在被绿光照射时显示出红色荧光。使用未转化农杆菌的负对照没有显示红色荧光 (图 3c), 总体上表明 dsred 转化标记适合识别转基因多毛根 (图 3C)。其他转化标记, 如抗生素耐药性, 可以使用其他作者描述的23,24;然而, 培养基中的抗生素会在含有标记物的转基因根系中产生生长延迟。

图 3:由 a. 根瘤菌转化的马铃薯荧光转基因多毛根.毛根是使用未转化的a. 根瘤菌(株 c58c1:pri1583) (a和c) 和 a. 根瘤菌 (株 C58C1:pRI1583) 转化的空向量 pK7GWIWG2_II 红根携带DsRed 变换标记 (b和d)。毛状根形成于这两种感染 (a, b), 但红色荧光只观察到与含有二元载体的 a. 根瘤菌转化的毛状根. 这些图像是用配备了一盏灯和一个特定的滤光片的立体显微镜拍摄的, 用于显示红色荧光。请点击这里查看此图的较大版本.
农杆菌-介导的马铃薯转化
本手稿中描述的第二个协议是为了一步一步地获得一个完整的马铃薯植物, 并与a. tumefaciens一起转化。图 2概述了该过程, 该过程总共需要 15-18周 (从叶片感染a.肿瘤到获得完全再生的植物)。这个过程中最耗时的部分是植物的器官再生。这一特殊步骤使这种方法比使用a. 根瘤菌更费力。该程序是用块茎菌和黄原体(Cv. désirée) 和s. tuberosum ssp. andigena 进行的, 前者较少依赖短日条件诱导结节化.
在a. 肿瘤介导的转化中, 与根系介导的转化相比, 再生植物完全是转基因生物。然而, 尽管转基因植物是在卡那霉素选择性培养基中再生的, 但并不是所有的基因都能有效地表达转基因。因此, 需要验证转基因表达。
FHT 启动子活性在根系中的活性比较a. 肿瘤 和根瘤菌
上述程序被应用于fht基因启动子下表达 gus 基因的根系。以前报告过15个完整的转化植物, 使用含有 fht启动子的二元载体 pKGWFS7。现在, 这个二元载体已被用来产生新的转化的毛状根, 以比较启动子是活跃的组织, 因此测试毛根系统作为一个工具, 研究启动子激活。
图 4显示了由 a. tumefaciens获得的转基因植物根系的 Gus 染色 (图 4a、b) 和根瘤菌获得的转基因毛状根 (图 4A、d、e、f),分别。可以看出, 与a.肿瘤转化并在体外生长的根系在内皮 (图 4a) 中显示出蓝色染色, 这是皮层和石碑之间的细胞层。在较发达的根部, 与外皮相对应的外层的蓝色标签是斑驳的 (图 4b)。在水培生长的转化毛根中, GUS 标记专门位于受伤区域的内皮 (图 4C, e)、侧根的出现 (图 4C, e) (图 4C)) 和外皮 (图 4f)。在没有Promfht:gus t-dna 盒式磁带或野生类型根的负对照中, 根没有 gus 染色。

图 4: 转基因马铃薯根系的组织化学观察, 表达了Fht启动子驱动的gus记者基因.由a-b 转化获得的完整转基因植物的根显示出内皮 ( a)和外皮 (b) 的蓝色染色。a. 根瘤菌获得的转基因毛状根 (刺五加) 转化 (c-f) 在外侧根的内皮 (c和e) 中显示 gus 染色出现 (d和e), 在伤口愈合区 (e) 和外皮 (f)。内皮 (EN);外皮 (EX);赛莱默 (XL);侧根 (LR) 的原生。红色箭头表示受伤区域。请点击这里查看此图的较大版本.
表 s1:用于培养细菌和体外植物的培养基配方。 请点击此处下载此表格
表 s2:一半强度霍格兰的解决方案, 在水培种植马铃薯植物。请点击此处下载此表格
讨论
在马铃薯中, 获得稳定完整转基因植物的最常见系统使用农杆菌菌株的转化, 这些菌株需要利用外源植物激素进行器官生成。尽管基于农杆菌的协议有可能整合非 t-dna 载体序列 25, 但这种方法仍然是最简单、成本更低的方法, 可以改造马铃薯植物。在过去的几年里, 人们对a. 根瘤菌介导的转化的兴趣引起了研究人员的关注, 因为它允许在比使用a. 肿瘤更短的时间内获得转基因根。根瘤菌仍然保留根诱导 (ri) 质粒, 其中携带一组编码酶的植物激素生长素控制和细胞分裂素生物合成, 并编码蛋白26。一旦 Ri T - DNA 入宿主基因组 DNA , 新的激素平衡会放松对受感染细胞的调节 , 从而导致增生的根的形成 , 称为毛状根 , 在感染点出现 27。当一个额外的二元载体用于整合一个外来 DNA, Ris 质粒的保存提供了获得转化毛根的可能性, 而不需要使用外源应用的植物激素28进行器官发生。多毛的根可以保持附着在产生复合植物的野生类型的芽上, 也可以自我繁殖。这种多毛根系自我繁殖的能力正被利用, 在几个植物中生产毛茸茸的根系, 作为大规模生产有价值的代谢物或外来蛋白质的生物系统, 在制药甚至植物修复领域产生兴趣 (见评论29,30)。在马铃薯 (Kufri Bahar) 中, 转基因成套植物感染了野生a 型根瘤菌株, 以产生表达乙型肝炎表面抗原 (hbsag)23的多毛根。另外, 可以获得一个完整的转基因植物再生从毛茸茸的根, 但马铃薯植物和块茎显示出明显的发展相比, 未转化的控制。表型的这些差异是由于原始的 ri t-dna 集成在基因组 31,32。
在这项工作中, 详细的程序, 以获得转基因稳定多毛根使用 a. 根瘤菌和转基因稳定植物使用 a . 肿瘤 ( 图 1和图 2)。在5-6 内获得了完全发育的转基因多毛根, 而使用a. tumefacens的转基因根需要15-18周的时间, 因为转化细胞的器官发生要求, 以及转化植物的选择和繁殖。在我们手中, 肿瘤转化过程在黄曲霉和块茎草 (cv. Désirée) 中有效地工作, 据报告转化效率在35% 22% 和48%左右 分别为 12人。所描述的 a. 根瘤菌转化程序是基于霍恩7号报告的程序, 该程序显示出很高 (80-100)cv. Désirée 和其他三个马铃薯品种 (Albatars、Sabina 和 Saturna) 的转化效率。
为了提出a. 根瘤菌作为马铃薯功能研究的替代转化系统, 并指出 ri t-dna 的最初存在是否值得关注, 我们使用这两种系统来转换马铃薯根具有相同的二元载体,含有一个 T-DNA, 具有亚素生物合成基因 (fht) 的启动子, 推动gus记者基因的表达。组织化学分析显示, 在a. tumefaciens转化植物中, fht启动子的活性在根部的内层和外层 (分别为内皮和外皮层) (图4a, b).) 并且在叶子、茎和块茎15的受伤的区域。在根瘤菌转化毛根, 该活性也检测到内皮和外皮和受伤的根部 (图 4e)。在两种转化根系中, 亚素启动子活性的共同发生表明, Ri 集成 T-DNA 至少在这些根系组织中并不影响与亚化有关的发育过程。在转化的毛根中, 我们还检测到Fht启动子在侧根出现周围区域的活性 (图 4d,e)。这与参与转运亚素单体的其他基因 (如 abcg11/wbc1133、34、35、36或调节器) 报告的启动子活性一致施纳卡 10319. 最近已经有 37种研究亚素基因的马铃薯转化, 在这种情况下, 多毛的根系也可以显示一种脂肪酸CYP86A33 的启动子激活-羟化酶。然而, 在根部的 GUS 染色是散装定量使用荧光法, 因此在亚化组织中的特异性表达只假定。
总之, 这些结果证明, a. 根瘤菌转化是一个更快的替代工具, 以探索细胞类型特异性启动子启动激活的亚素相关基因在根, 这可能会扩大到基于其他过程的研究,发生在根部。在这方面, 其他一些功能遗传研究已经成功地使用了马铃薯、番茄和桉树中的根瘤菌来证明其基因功能6、7、8、9激素反应38,39或启动子活动40,41。然而, 这一战略可能仍然存在局限性, 特别是在研究 Rit-dna 可能放松管制的严格控制的发育过程时, 或者当整个植物或块茎或其他与根系不同的器官需要研究时。在这些情况下, a. tumefaciens转换系统仍然是首选。
披露声明
提交人没有利益冲突可供披露。
致谢
这项工作得到了 innovo y Ciencia 部长 (AGL2009-13745, FPI 向 PB 提供的赠款)、经济和竞争事务部的赠款和 FEDER 的资助 (AGLUS-36725, AGL2015-675-C2-R) 和 Girona 大学 (向 SF 提供博士补助金, 并向 sf 提供博士赠款)单一/)。提交人感谢 Inge Broer 博士 (德国罗斯托克大学土地使用研究所) 和 Saloméprat 博士 (西班牙马德里国家生物技术中心) 提供了 a. Rhizogenes 和a. tumefaciens 菌株,并提供了 Marçal Soler 博士和 Anna Plasencia 博士在启动a.根瘤菌转化实验方面得到的帮助和支持 (Toulouse III Paul Sabatier 大学-CNRS, 植物研究实验室, Castanet tolosan,法国)。作者感谢 Sara Gómez (UdG、Girona 的 Biologia 省、Girona) 在开展实验室工作和照料植物方面提供的宝贵协助, 并感谢 Ferran Fontdecaba 和 Carla Sánchez 在进行一些实验时提供了协助。他们的最终学位项目。
材料
| Name | Company | Catalog Number | Comments |
|
Acetone |
Panreac |
1.310.071.21 | |
|
Acetosyringone |
Acros |
115540050 | |
|
Aquarium pump |
Prodac |
MP350 | |
|
Autoclave |
Ragpa Strelimatic | ||
|
Bacteriological agar |
Lab Conda |
1800 | |
|
BAP |
Duchefa |
B0904 | |
|
Beef extract |
Lab Conda |
1700 | |
|
Plant growing cabinet |
Nuaire | ||
|
Carbenicillin |
Duchefa |
C0109 | |
|
Cefotaxime sodium |
Duchefa |
C0111 | |
|
DMSO |
Merck |
1029310161 | |
|
Ecotron infors |
HT |
29378 | |
|
Ethanol |
Merck |
1,009,831,011 | |
|
Falcon tube |
Control tecnica |
CFT011500 | |
|
Ferricyanate |
Sigma |
101001081 | |
|
Ferrocyanate |
Sigma |
100979088 | |
|
Flask (8.06 cm diameter and 11.3 cm height) and plastic lid for in vitro culture |
Apiglass |
ref16 | |
|
GA3 |
Sigma |
G7645 | |
|
Gamborg B5 media |
Duchefa |
G0210 | |
|
Gelrite |
Duchefa |
G1101 | |
|
Glucosa |
Sigma |
G5767 | |
|
Kanamycin |
Sigma |
K1377 | |
|
Leukopor tape |
BSN Leukopor |
BDF47467 | |
|
Lupe |
Wild-Heerbrugg |
M420 | |
|
Magnetic shaker |
Agimatic |
7000243 | |
|
MES hydrate |
Sigma |
M2933-25G | |
|
MgSO4 |
Panreac |
131404 | |
|
Microscope |
Olympus | ||
|
Minufugue centrifugue 5415R |
Eppendorf | ||
|
Murashige and Skoog media |
Duchefa |
M0254.0050 | |
|
Na2HPO4 |
Panreac |
131679 | |
|
NAA |
Duchefa |
N0903 | |
|
NaCl |
Panreac |
131659 | |
|
NaH2PO4 |
Sigma |
58282 | |
|
NightSea Stereo |
SFA Moonting Adapter | ||
|
Parafilm |
Anorsa |
PRFL-001-001 | |
|
Peptone |
Lab Conda |
1616 | |
|
Petri dishes (90 x 14) |
Anorsa |
200200 | |
|
pHmetre |
Crison | ||
|
Phytotron |
Inkoa |
RFTI-R5485 | |
|
Plant Agar |
Duchefa |
P1001 | |
|
Refrigeratot |
Liebherr Medline | ||
|
Rifampicin |
Duchefa |
R0146 | |
|
Spectinomycin |
Sigma |
59007 | |
|
Spectrophotometer |
Shimadzu | ||
|
Square plates (120 x 120) |
Deltalab |
200204 | |
|
Streptomycin |
Sigma |
S6501 | |
|
Sucrose |
Panreac |
131621 | |
|
Surgical blades |
Swann-Morton |
201 | |
|
Surgical needle |
NIPRO |
015/0204 | |
|
Triptone |
Lab Conda |
1612 | |
|
Triton |
Serva |
37240 | |
|
Unimax 1010 shaker |
Heidolph | ||
|
Vacuum |
Dinko | ||
|
x-GlcA (5-Bromo-4-chloro-3-indoxyl-beta-D-glucuronic acid, sodium salt anhydrous) |
Biosynth |
B-7398 | |
|
Yeast extract |
Lab Conda |
1702.00 | |
|
Zeatin riboside |
Sigma |
1001042850 |
参考文献
- Gelvin, S. B. Traversing the Cell: Agrobacterium T-DNA's journey to the host genome. Frontiers in Plant Science. 3, 1-11 (2012).
- Lacroix, B., Citovsky, V. The roles of bacterial and host plant factors in Agrobacterium-mediated genetic transformation. The International Journal of Developmental Biology. 57 (6-8), 467-481 (2013).
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Ishida, Y., et al. High efficiency transformation of maize (Zea mays L.) mediated by Agrobacteriumtumefaciens. Nature Biotechnology. 14 (6), 745-750 (1996).
- White, F. F., Taylor, B. H., Huffman, G. A., Gordon, M. P., Nester, E. W. Molecular and genetic analysis of the transferred DNA regions of the root-inducing plasmid of Agrobacterium rhizogenes. Journal of Bacteriology. 164 (1), 33-44 (1985).
- Dinh, P. T. Y., Brown, C. R., Elling, A. A. RNA Interference of effector gene Mc16D10L confers resistance against Meloidogyne chitwoodi in Arabidopsis and Potato. Phytopathology. 104 (10), 1098-1106 (2014).
- Horn, P., et al. Composite potato plants with transgenic roots on non-transgenic shoots: a model system for studying gene silencing in roots. Plant Cell Reports. 33 (12), 1977-1992 (2014).
- Plasencia, A., et al. Eucalyptus hairy roots, a fast, efficient and versatile tool to explore function and expression of genes involved in wood formation. Plant Biotechnology Journal. 14 (6), 1381-1393 (2015).
- Ron, M., et al. Hairy root transformation using Agrobacteriumrhizogenes as a tool for exploring cell type-specific gene expression and function using tomato as a model. Plant Physiology. 166 (2), 455-469 (2014).
- Zhang, W., et al. Development and application of a universal and simplified multiplex RT-PCR assay to detect five potato viruses. Journal of General Plant Pathology. 83 (1), 33-45 (2017).
- Almasia, N. I., et al. Successful production of the potato antimicrobial peptide Snakin-1 in baculovirus-infected insect cells and development of specific antibodies. BMC Biotechnology. 17 (1), 1-11 (2017).
- Serra, O., et al. Silencing of StKCS6 in potato periderm leads to reduced chain lengths of suberin and wax compounds and increased peridermal transpiration. Journal of Experimental Botany. 60 (2), 697-707 (2009).
- Serra, O., et al. CYP86A33-Targeted gene silencing in potato tuber alters suberin composition, distorts suberin lamellae, and impairs the periderm's water barrier function. Plant Physiology. 149 (2), 1050-1060 (2008).
- Serra, O., et al. A feruloyl transferase involved in the biosynthesis of suberin and suberin-associated wax is required for maturation and sealing properties of potato periderm. The Plant Journal. 62 (2), 277-290 (2010).
- Boher, P., Serra, O., Soler, M., Molinas, M., Figueras, M. The potato suberin feruloyl transferase FHT which accumulates in the phellogen is induced by wounding and regulated by abscisic and salicylic acids. Journal of Experimental Botany. 64 (11), 3225-3236 (2013).
- Serra, O., Chatterjee, S., Figueras, M., Molinas, M., Stark, R. E. Deconstructing a plant macromolecular assembly: chemical architecture, molecular flexibility, and mechanical performance of natural and engineered potato suberins. Biomacromolecules. 15 (3), 799-811 (2014).
- Vulavala, V. K. R., et al. Identification of genes related to skin development in potato. Plant Molecular Biology. 94 (4-5), 481-494 (2017).
- Landgraf, R., et al. The ABC transporter ABCG1 is required for suberin formation in potato tuber periderm. The Plant Cell. 26 (8), 3403-3415 (2014).
- Verdaguer, R., et al. Silencing of the potato StNAC103 gene enhances the accumulation of suberin polyester and associated wax in tuber skin. Journal of Experimental Botany. 67 (18), 5415-5427 (2016).
- Molina, I., Li-Beisson, Y., Beisson, F., Ohlrogge, J. B., Pollard, M. Identification of an Arabidopsis feruloyl-coenzyme A transferase required for suberin synthesis. Plant Physiology. 151 (3), 1317-1328 (2009).
- Gou, J. Y., Yu, X. -. H., Liu, C. J. A hydroxycinnamoyltransferase responsible for synthesizing suberin aromatics in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 106 (44), 18855-18860 (2009).
- Banerjee, A. K., Prat, S., Hannapel, D. J. Efficient production of transgenic potato (S. tuberosum L. ssp. andigena) plants via Agrobacterium tumefaciens-mediated transformation. Plant Science. 170 (4), 732-738 (2006).
- Sunil Kumar, G. B., Ganapathi, T. R., Srinivas, L., Revathi, C. J., Bapat, V. a. Expression of hepatitis B surface antigen in potato hairy roots. Plant Science. 170 (5), 918-925 (2006).
- Schmidt, J. F., Moore, M. D., Pelcher, L. E., Covello, P. S. High efficiency Agrobacteriumrhizogenes-mediated transformation of Saponariavaccaria L. (Caryophyllaceae) using fluorescence selection. Plant Cell Reports. 26 (9), 1547-1554 (2007).
- Petti, C., Wendt, T., Meade, C., Mullins, E. Evidence of genotype dependency within Agrobacteriumtumefaciens in relation to the integration of vector backbone sequence in transgenic Phytophthorainfestans-tolerant potato. Journal of Bioscience and Bioengineering. 107 (3), 301-306 (2009).
- Gaudin, V., Vrain, T., Jouanin, L. Bacterial genes modifying hormonal balances in plants. Plant Physiology and Biochemistry. 32 (1), 11-29 (1994).
- Nemoto, K., et al. Function of the aux and rol genes of the Ri plasmid in plant cell division in vitro. Plant Signaling &. Behavior. 4 (12), 1145-1147 (2009).
- Visser, R. G. F., et al. Expression and inheritance of inserted markers in binary vector carrying Agrobacteriumrhizogenes-transformed potato (Solanumtuberosum L.). Theoretical and Applied Genetics. 78 (5), 705-714 (1989).
- Guillon, S., Trémouillaux-Guiller, J., Pati, P. K., Rideau, M., Gantet, P. Hairy root research: recent scenario and exciting prospects. Current Opinion in Plant Biology. 9 (3), 341-346 (2006).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Ooms, G., Lenton, J. R. T-DNA genes to study plant development: precocious tuberisation and enhanced cytokinins in A. tumefaciens transformed potato. Plant Molecular Biology. 5 (4), 205-212 (1985).
- de Vries-Uijtewaal, E., et al. Fate of introduced genetic markers in transformed root clones and regenerated plants of monohaploid and diploid potato genotypes. TAG. Theoretical and applied genetics. 78 (2), 185-193 (1989).
- Bird, D., et al. Characterization of Arabidopsis ABCG11/WBC11, an ATP binding cassette (ABC) transporter that is required for cuticular lipid secretion. The Plant Journal: For Cell and Molecular Biology. 52 (3), 485-498 (2007).
- Luo, B., Xue, X. Y., Hu, W. L., Wang, L. J., Chen, X. Y. An ABC transporter gene of Arabidopsis thaliana, AtWBC11, is involved in cuticle development and prevention of organ fusion. Plant and Cell Physiology. 48 (12), 1780-1802 (2007).
- Panikashvili, D., et al. The Arabidopsis DESPERADO/AtWBC11 transporter is required for cutin and wax secretion. Plant Physiology. 145 (4), 1345-1360 (2007).
- Panikashvili, D., et al. The Arabidopsis DSO/ABCG11 transporter affects cutin metabolism in reproductive organs and suberin in roots. Molecular Plant. 3 (3), 563-575 (2010).
- Bjelica, A., et al. Fatty acid ω-hydroxylases from Solanum tuberosum. Plant Cell Reports. 35 (12), 2435-2448 (2016).
- Ding, Y., et al. Abscisic acid coordinates nod factor and cytokinin signaling during the regulation of nodulation in Medicago truncatula. The Plant Cell. 20 (10), 2681-2695 (2008).
- Isayenkov, S., Mrosk, C., Stenzel, I., Strack, D., Hause, B. Suppression of allene oxide cyclase in hairy roots of Medicagotruncatula reduces jasmonate levels and the degree of mycorrhization with glomus intraradices 1[w]. Plant Physiology. 139 (3), 1401-1410 (2005).
- Dalton, D. A., et al. Physiological roles of glutathione S-Transferases in soybean root Nodules 1[C][W][OA]. Plant Physiology. 150 (1), 521-530 (2009).
- Limpens, E., et al. RNA interference in Agrobacteriumrhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55 (399), 983-992 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。