Method Article
Agrobacterium tumefaciens et Agrobacterium rhizogenes-Mediated Transformation des pommes de terre et de l’activité du promoteur d’un gène de subérine par GUS Staining
Dans cet article
Résumé
Nous présentons ici deux protocoles pour transformer les plantes de pomme de terre. La transformation par Agrobacterium tumefaciens mène à une plante transgénique complète tandis que l' Agrobacterium rhizogenes produit transgéniques racines velues lors d’un shooting de type sauvage pouvant être autonome propagés. Ensuite, nous détectons activité du promoteur par GUS coloration dans les racines transformées.
Résumé
Agrobacterium SP est l’une des méthodes plus largement utilisées pour obtenir des plantes transgéniques, car il a la capacité de transférer et d’intégrer son propre ADN-T dans le génome de la plante. Nous présentons ici les deux systèmes de transformation pour modifier génétiquement les plantes de pomme de terre (Solanum tuberosum). Dans la transformation d’a. tumefaciens , feuilles sont infectées, les cellules transformées sont sélectionnés et une nouvelle usine de transformation complète est régénérée en utilisant les phytohormones à 18 semaines. Dans la transformation d’a. rhizogenes , tiges sont infectés par la bactérie l’injection avec une aiguille, nouvelles racines velues transformés son apparition sont détectés à l’aide d’un marqueur fluorescent rouge et les racines non transformées sont supprimés. 5-6 semaines, la plante qui en résulte est un composite d’un tournage de type sauvage avec racines velues transformés entièrement développées. Pour augmenter la biomasse, les racines velues transformés peuvent être excisés et se propage. Nous avons appliqué les deux méthodes de transformation Agrobactérie -médié afin d’obtenir des racines exprimant le gène rapporteur GUS pilotée par un promoteur du gène biosynthétique de subérine. La procédure de marquage de GUS est fournie et permet la localisation cellulaire de l’induction du promoteur. Dans les deux méthodes, les racines de pommes de terre transformées ont montré GUS coloration dans l’endoderme subérifiée et l’exoderme et en outre, dans les racines de a. rhizogenes transformé l’activité GUS a aussi été détecté dans l’émergence des racines latérales. Ces résultats suggèrent qu’a. rhizogenes peut être un outil rapide alternatif pour étudier les gènes qui sont exprimés dans les racines.
Introduction
En dehors de l’intérêt économique, la génération de plantes transgéniques a sa propre pertinence dans la recherche pour démontrer la fonction ultime de gènes et de mieux comprendre la physiologie des plantes et le développement. Le plus largement utilisé la méthode pour plante insertion de l’ADN est Agrobacterium-mediated transformation. Agrobacterium tumefaciens est capable de générer des Galles de couronne dans les tissus infectés de nombreuses espèces végétales par l’action de son plasmide (Ti) inducteurs de tumeurs. Le plasmide contient une région de l’ADN-T avec un ensemble de gènes qui seront intégrés dans le génome de la plante et induisent des tissus dédifférenciation1,2. L’échange de ces gènes dans l’ADN-T par le transgène a permis à la génération des modifications de végétaux spécifiques en évitant les effets phénotypiques3. Pour faciliter le transgène clonage dans l’ADN-T, la région de l’ADN-T a été excisée dans un plasmide indépendant appelé un plasmide binaire, tandis que le reste des gènes du plasmide Ti (les gènes de virulence qui permettent les mécanismes de transfert et d’insertion d’ADN-T) ont été placé dans un plasmide d’assistance. Pour la recherche en biotechnologie végétale, transformation par a. tumefaciens a plusieurs avantages : il n’a pas besoin des dispositifs coûteux, est capable de générer la transformation des plantes stables et transitoires et faibles effectifs du gène copies sont intégrés dans le chromosome4. Cependant, pour la plupart des plantes, mais pas de, d’Arabidopsis, la génération des transformants stables nécessite régénération des plantes d’un seul ou quelques cellules en utilisant les phytohormones exogènes, rendant ce processus laborieux et fastidieux. A. rhizogenes est également en mesure de modifier le génome de la plante, produisant des racines velues ou racines adventives sur les sites d’infection due à l’expression des gènes rol (racine locus) encodé en induisant la racine (Ri) plasmide5. Bien que moins étudiées qu’a. tumefaciens, a. rhizogenes est également utilisé pour l’obtention de racines transgéniques. Dans ce cas, la a. rhizogenes contient original l’ADN-T dans le plasmide Ri et un plasmide binaire avec un ADN-T deuxième transportant le transgène. Lorsque le site de l’infection est dans les tiges ou les hypocotyles, une usine de composite peut être obtenue, avec les nouvelles racines transgéniques poilues qui sortent d’un type sauvage pousses. Alternativement, poilus racines transformées peuvent croître autonome in vitro dans les médias avec apports de sources de carbone. L’utilisation de a. rhizogenes , au lieu de a. tumefaciens pour produire des tissus transgéniques gagne en pertinence lorsque la racine est l’organe cible, parce que la régénération des plantes n’est pas nécessaire et il est donc plus rapide et moins coûteuse. Des études antérieures ont démontré cette méthodologie a ouvert pour la caractérisation phénotypique de la racine des gènes spécifiques6,7,8,9.
La pomme de terre (Solanum tuberosum) est la quatrième plus importante récolte dans le monde selon l’alimentation et l’Agriculture Organization (FAO) de l’ONU, étant donné que le tubercule a pertinence nutritionnelle pour la consommation humaine pour être une bonne source de vitamines et des minéraux. Pour cette raison, la pomme de terre a été mis à l’honneur de la biotechnologie agricole et aussi est considéré comme un bon modèle biologique pour la génétique et le développement d’études de10,11. Transformation de la pomme de terre a grandement contribué à la compréhension des mécanismes moléculaires des tissus sous-jacents subérifiées grâce à la caractérisation des gènes impliqués dans la subérine et cire biosynthèse12,13,14 ,15,16,17, subérine monomère transport18 et transcription règlement19. Le gène de subérine féruloyl transférase, ESF, est l’un de ces gènes de biosynthèse caractérisées ; la diminution de l’expression donne lieu à une forte altération de la protection périderme, qui est corrélée à une forte diminution des esters férulate de subérine et cires de tubercules de pommes de terre14. En même temps, dans les racines et les graines de l’Arabidopsis, la partie détachable de son putatif orthologue (ASFT/RWP1) a également démontré son rôle dans la production de ferulates d’alkyle en subérine20,21. En pomme de terre, la ligne de transcriptional journaliste FHT et l’anticorps FHT ont montré respectivement que l’activité du promoteur et les protéines sont trouvent dans l’exoderme, l’endoderme, les phellogène-dérivés et tissus blessés15.
Dans ce travail, nous détaillons un protocole à l’aide d’a. rhizogenes pour produire des racines velues transgéniques qui sont conservés dans un tournage de type sauvage, centrales de composite de pommes de terre ou excisées pour se développer de manière autonome in vitro. Nous fournissons également le protocole à l’aide d’a. tumefaciens afin d’obtenir des plantes de pomme de terre transgénique complet. Une étude de cas, a. rhizogenes et a. tumefaciens transformée avec le même vecteur binaire servent à obtenir des racines avec le promoteur FHT conduite d’expression du gène rapporteur GUS . Les résultats sont publiés et comparés.
Protocole
Le protocole de transformation a. rhizogenes a été adapté et modifié du Horn et coll.7 et le génotype testé était S. tuberosum ssp. tuberosum (cultivar Désirée). Le protocole de transformation a. tumefaciens a été adapté et modifié du Banerjee et coll.22 et les génotypes testés étaient S. tuberosum ssp. tuberosum (cultivar Désirée) et S. tuberosum SSP andigena. Les principales étapes des deux procédures sont résumées dans Figure 1 et Figure 2, respectivement.
Remarque : Dans toutes les étapes de la procédure d’exécution en vitro transferts, faites-le rapidement et lorsque cela est possible, conserver les plaques ou les pots fermés, minimisant ainsi l’exposition de la plante pour éviter le flétrissement et la contamination de l’air. Indication contraire, tous les incubations d’usine ont été effectuées dans les armoires, dans les conditions des 12 h de h de lumière/12 24 ° C de 20 ° C sombre et 67 µmol m-1 s-1. Contraire, effectuer toutes les bactéries manipulation et in vitro végétales transferts dans des conditions aseptiques dans une hotte à flux laminaire. Toutes les recettes de médias pour les cultures de plantes Agrobacterium et in vitro sont fournis au Tableau S1.
Mise en garde : Déposer toutes les bactéries génétiquement modifiées et les plantes à la poubelle appropriée.
1. cultures de Agrobacterium utilisés pour la transformation
Remarque : La souche utilisée pour la transformation d’a. rhizogenes était le C58C1:Pri15837 (aimablement fourni par le Dr. Inge Broer) et que pour le a. tumefaciens était le GV2260 (aimablement fourni par le Dr Salomé Prat). A. rhizogenes a été transformée avec le vecteur binaire PK7GWIWG2_II-amarante (VIB-département de biologie des systèmes végétaux à l’Universiteit Gent ; http://gateway.psb.ugent.be) qui contient un ADN-T transportant un marqueur de transformation pour surveiller les racines chevelues formation. Pour comparer les racines transformées générés par a. rhizogenes et a. tumefaciens, tous deux ont été transformées avec les pKGWFS7 de vecteur binaire qui contient un ADN-T transportant le promoteur FHT conduite le gène rapporteur β-glucuronidase (GUS) et le gène de résistance de kanamycine comme un marqueur de sélection15.
- Prélever une colonie d’Agrobacterium et développez-le pendant la nuit (O/N) dans 5 mL de milieu YEB additionné d’antibiotiques (Tableau S1) dans un tube à centrifuger 50 mL à 28 ° C sous agitation à 200 tr/min.
- Pour la transformation d’a. tumefaciens , mesurer la densité optique, qui doit être OD600 = 0,6 à 1,0.
- Si la densité optique est plus élevée, faire une sous-culture abaissant à OD600 = 0,3 avec supports neufs et attendre jusqu'à ce que la culture atteint OD600 = 0,6-1.
- Centrifuger 1 mL de culture Agrobacterium à 3 000 x g dans une centrifugeuse de paillasse pendant 10 min à température ambiante.
- Retirez le surnageant en pipettant également et remettre en suspension des cellules dans 1 mL de milieu frais de YEB sans antibiotiques. Répétez cette étape pour assurer l’élimination complète des antibiotiques.
- Pour la transformation d’a. tumefaciens , dans la dernière remise en suspension ajouter le volume approprié de YEB pour obtenir une densité optique finale de OD600 = 0,8.
- Garder les cellules sur la glace tout en préparant les plantes infectées.
2. matériel pour la transformation des végétaux
- Faire un ou deux boutures de tiges de nœud contenant soit l’apicale ou les bourgeons auxiliaires de stérile en vitro plants de pomme de terre (plantes de donateurs) ; cultivez-les dans un milieu solide 2MS dans des pots pendant 3 à 4 semaines (Figure 1 et Figure 2 a).
3. usine de transformation à l’aide de a. rhizogenes (Figure 1)
Remarque : Cette procédure permet l’obtention de racines velues transformées. Afin d’évaluer l’expression du transgène, un contrôle négatif est nécessaire. Pour préparer le contrôle négatif, suivez la procédure à l’aide d’une souche d’a. rhizogenes , non transformé ou transformée avec le vecteur vide contenant le gène marqueur de transformation.
- Utiliser des plaques supports neufs ; par ailleurs, les plaques peuvent être conservés à 4 ° C avec le côté du couvercle vers le haut, hermétiques avec un film transparent pour éviter la déshydratation des médias. Pour préparer les plaques supports carrés, leur inclinaison ~ 15°, remplissage avec 40 mL de MS et laissez-les se solidifier. Cela réduira le contact de la partie aérienne de la plante avec le milieu.
- Transférer très soigneusement une plante donneur du milieu 2MS dans une assiette carrée 120 x 120 mm.
- Injecter à une seule tige entre-nœud 3 μL de la culture a. rhizogenes , à l’aide d’une aiguille chirurgicale et répéter deux fois par la plante dans les entre-nœuds différents lorsque cela est possible.
Remarque : Pensez à chaque injection comme un événement de transformation indépendant (Figure 1 b). - Transférer immédiatement la plante entière à une assiette carrée avec solide milieu MS additionné de 0,1 mM acétosyringone. Accueillir 2 plants par plaque.
Remarque : La solution 1 M acétosyringone est préparée dans le DMSO et peut être conservée à-20 ° C. - Sceller la plaque à l’aide de ruban chirurgical et arranger verticalement à l’intérieur d’une placard de croissance pendant 4 jours.
- Transférer l’usine d’une nouvelle plaque carrée avec MS additionné de céfotaxime sodique [500 µg/mL] de tuer a. rhizogenes.
- Après 10 à 12 jours, racines velues commencera à apparaître (Figure 1,1D). Puis, d’accise les racines autochtones de la plante et transfert de l’usine vers une nouvelle plaque carrée avec MS additionné de céfotaxime sodique [500 µg/mL].
NOTE : Les racines velues transformées peuvent être vérifiées par fluorescence rouge lorsque vous utilisez un marqueur de transformation DsRed (Figure 3D). - Pour obtenir une plante composite (Figure 1E), laisser les racines velues transgéniques pousser pendant 3-4 semaines dans MS additionné de céfotaxime sodique [500 μg/mL] (changer le milieu chaque semaine).
- Selon le but, propager les racines velues transgéniques et les témoins négatifs comme suit.
- Transférer l’usine ensemble composite à un hydroponique (Tableau S2) ou milieu de sol pour permettre le développement massif.
- Pour individuellement propager les racines velues transformées, à l’aide d’un scalpel coupe les racines exprimant le marqueur rouge fluorescent transformation (protéine DsRed) quand ils sont 4-8 cm de long (Figure 1E) et transférer dans un plat de pétri avec un milieu solide Gamborg B5 additionné de 2 % de sucrose et céfotaxime sodique [500 μg/mL]. Sceller les plaques avec du film plastique de laboratoire et cultivez-les dans l’obscurité à 20 ° C.
Remarque : Les racines peuvent être manipulés sous un stéréomicroscope équipé pour détecter la fluorescence dans des conditions stériles (voir Table des matières). - Pour la production de biomasse (c.-à-d., analyse de l’expression génique), couper une racine long poilu de 5 cm et propager dans un Erlenmeyer de 150 mL avec 20 mL de milieu liquide Gamborg B5 additionné de 2 % de sucrose et céfotaxime sodique [500 µg/mL]. Développez-le pendant 6 semaines dans l’obscurité à 20 ° C et 60 t/mn.
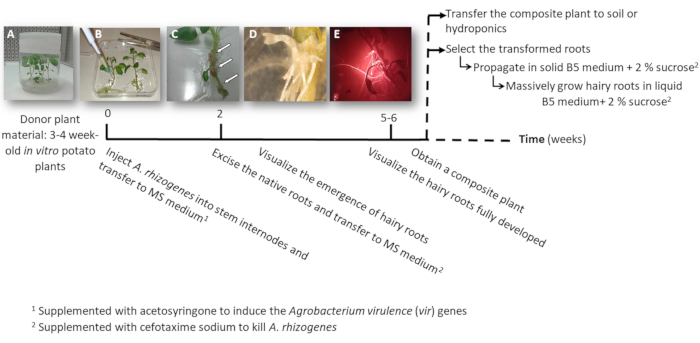
Figure 1 : Chronologie d’obtenir des pommes de terre transgéniques racines velues à l’aide d’a. rhizogenes. Les semaines cumulées pour atteindre chaque étape du processus de transformation et les étapes ultérieures de croître les racines velues sont indiqués. Des images représentatives des différents stades sont représentés : l’initiation du processus à l’aide de 3 semaines in vitro de plantes (A), puis l’infection des plantes par injection a. rhizogenes (B), la formation de la prolifération tissus (C, flèches) avec de nouvelles racines velues (D) et les racines velues développés exprimant le marqueur rouge fluorescent transformation DsRed (E). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
4. usine de transformation à l’aide de a. tumefaciens (Figure 2)
Remarque : Cette procédure permet l’obtention de plantes transformées. Pour évaluer l’effet du transgène, un contrôle négatif est nécessaire. Une option consiste à suivre la procédure à l’aide d’un a. tumefaciens transformée avec le vecteur vide. Par ailleurs, les plantes de type sauvage peuvent être utilisés.
- Couper et placer une feuille de la plante de 3-4-week-old (Figure 2 a) dans une boîte de pétri. À l’aide d’un scalpel exclure le pétiole et faire des coupes transversales (1-3 selon la taille de la feuille) depuis le centre de la feuille aux bords en évitant de les couper (Figure 2 b).
- Placer les feuilles flottant sur 10 mL de 2MS fraîches des milieux liquides dans une boîte de pétri avec la face abaxiale vers le haut immédiatement et fermer la plaque. Répétez l’étape pouvant accueillir jusqu'à 15 feuilles de cultivar Désirée et 25 feuilles pour SSP. unndigena (selon la taille de la feuille).
- Immédiatement ajouter 80 µL de la culture a. tumefaciens OD600 = 0,8 dans les milieux liquides et homogénéiser la plaque manuellement pendant 1 min distribuer la solution bactérienne.
- Soigneusement sceller avec film d’étanchéité, couvrir avec du papier aluminium et incuber pendant 2 jours dans une chambre à 24 ° C pour permettre la transformation se produisent.
- Transférer les feuilles en gardant un côté abaxial jusqu'à milieu de CIM (Figure 2 b) et les incuber pendant une semaine dans une placard de croissance.
- Grattez le milieu CIM avec la pince à épiler afin que les feuilles peuvent être mieux adaptées sur les médias.
- Transférer les feuilles en gardant un côté abaxial jusqu'à milieu SIM (Figure 2) et les incuber dans une armoire, rafraîchissant la moyenne tous les 7-10 jours, jusqu'à ce que les pousses sont d’environ 2 cm de hauteur de la croissance.
- Gratter le support SIM avec la pince à épiler afin que les feuilles peuvent être entièrement entourés par les médias. Lorsque les pousses émergés atteignent le couvercle, travailler avec grands plats de pétri (100 x 20 mm, hauteur x diamètre).
Remarque : Le Cal se forme après 2-3 semaines en milieu SIM (Figure 2D) et les pousses après 6 à 7 semaines (Figure 2E). Les pousses sont considérées comme des événements de transformation indépendant lorsqu’ils sortent de cals formés à partir de plaies indépendants.
- Gratter le support SIM avec la pince à épiler afin que les feuilles peuvent être entièrement entourés par les médias. Lorsque les pousses émergés atteignent le couvercle, travailler avec grands plats de pétri (100 x 20 mm, hauteur x diamètre).
- Coupe trois pousses émergée de chaque cals (considéré comme l’événement de transformation même) (Figure 2E), transfert à des flacons de culture avec milieu de MG additionnés de céfotaxime sodique [250 mg/L] pour permettre l’enracinement, étiqueter le sous-ensemble avec un certain nombre et incuber à une croissance du cabinet pendant 3 à 4 semaines ou jusqu'à ce que les tiges sont vigoureuses (Figure 2F).
Remarque : Lorsque vous coupez les pousses, retirez bien Cal sinon que la racine ne sera pas incluse.- Répétez l’étape autant de fois que des lignes indépendantes sont nécessaires. Jusqu'à 5 transformation différents événements peuvent être placés dans un flacon de culture avec un diamètre de 8 cm pour travailler en toute confiance que les plantes de différents événements ne sont pas mélangés.
- Sélectionnez la plante plus vigoureuse de chaque événement, couper le segment apical de la tige avec 3-4 entre-nœuds et placez-le dans un nouveau flacon de culture avec 2MS additionné de céfotaxime sodique [250 mg/L].
Remarque : Dans les 3 à 6 semaines, que la plante poussera efficacement, développant une pousse vigoureuse et les racines.- Faire revenir à la chambre les pousses non retenus jusqu'à ce que la plante sélectionnée a entièrement développé.
- Coupez des segments de tige de la plante avec au moins un entre-noeud ou avec le bourgeon apical et de les transférer à nouveau 2MS additionné à la céfotaxime [250 mg/L]. Les incuber dans la croissance du cabinet.
- Reproduire toutes les 3-4 semaines pour établir les lignes en vitro transformé.
Remarque : Le céfotaxime sodique est nécessaire au moins trois transferts ultérieurs au milieu de 2 ms pour être sûr de tuer le a. tumefaciens; par la suite, si surcroissance d’a. tumefaciens est observée, transférer les plantes à nouveau aux médias de 2MS additionné de céfotaxime sodique.
- Reproduire toutes les 3-4 semaines pour établir les lignes en vitro transformé.
- Afin de caractériser le phénotype de la plante, transférer les plantes dans le sol pour leur caractérisation complète ou à la culture hydroponique pour l’inspection de la racine.
- Garder les tubercules produits dans le sol à propager et à maintenir les lignes établies.

Figure 2 : Chronologie d’obtenir des pommes de terre transformées plantes à l’aide d’a. tumefaciens. Les semaines cumulées pour atteindre chaque étape du processus de transformation et les étapes ultérieures à cultiver les plantes apparaissent. Des images représentatives des différents stades sont représentés : l’initiation du processus à l’aide laisse partir 3 - semaine vieux in vitro de plantes (A), le transfert des blessés et infectées laisse aux médias CIM (B), les feuilles lorsque transféré à Médias SIM (C), la visualisation du Cal autour des zones blessés après 2-3 semaines dans les médias (D), la formation de la tige après 9-11 semaines dans les médias (E) de la carte SIM et les pousses après avoir été transféré aux médias MG (F) SIM. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
5. hydroponique
- Préparer la solution de Hoagland à une moitié de la traction (0,5 x) (Tableau S2) dans un seau de 10 L.
- Immerger une pompe d’aquarium pour maintenir l’homogénéité et des conditions d’oxygène adéquat.
- Couvrir les parois du seau avec du papier d’aluminium à s’enraciner dans l’obscurité.
- Évitant les dommages racinaires, transfert in vitro de plantes de culture hydroponique.
Remarque : Retirez tout restant dans vitro support de racines pour éviter la prolifération de micro-organismes pendant l’incubation en agitant soigneusement les racines immergées dans l’eau. - Couvrir les plantes avec une pellicule transparente comme une serre pour permettre l’acclimatation adéquate et incuber dans la chambre de croissance.
- Faites des trous dans le film après 3 jours et retirez-le complètement une semaine après.
- Remplacez les supports neufs tous les 10 jours.
6. test de gène GUS journaliste histochimiques
Remarque : Dans notre cas le GUS analyse a été réalisée avec des racines de 2 à 3 semaines, cultivés en culture hydroponique ou in vitro.
- Difficulté les racines avec de l’acétone 90 % réfrigérés (v/v) et il incuber pendant 20 minutes sur la glace.
- Effectuer deux lavages à l’eau distillée.
- Ajouter frais GUS coloration solution (tableau 1) et appliquer sous vide (-70 Pa) pendant 20 min.
- Incuber à 37 ° C dans l’obscurité, afin de protéger le GUS photosensible pendant 4 h ou jusqu'à ce qu’une couleur bleue est visible.
Remarque : La présence de ferrocyanure en solution de GUS et ferri - réduire au minimum la diffusion des produits de réaction et fournir une localisation plus précise.
Attention : Utiliser une hotte aspirante et porter des vêtements de protection pour manipuler les dérivés toxiques de cyanure en solution de GUS (le ferricyanure de potassium et ferrocyanure de potassium). Le substrat de GUS et le matériel d’évacuation doivent être éliminés en toute sécurité. - Retirez les GUS solution de coloration et jetez-le dans un emballage adéquat.
- Effectuer deux lavages avec l’éthanol 70 % (v/v).
- Observer au microscope champ lumineux.
NOTE : GUS la coloration est stable pendant quelques semaines ; Cependant, durant la première semaine, le signal de GUS est clair et diffuse moins dans les cellules voisines. Pour une conservation plus longue, fermer le tube et conserver à 4 ° C.

Tableau 1 : Recette de la solution coloration GUS.
Résultats
Agrobacterium rhizogenes -médiée par la transformation de la pomme de terre
Dans ce manuscrit, la procédure étape par étape, mises en place pour obtenir des racines transformées avec a. rhizogenes est présentée. La figure 1 présente une vue d’ensemble de la procédure, qui prend au total environ 5-6 semaines (de l’injection d’a. rhizogenes à l’obtention de racines velues entièrement développées). Ensuite, la plante peut être étudiée comme un composite (type sauvage pousse, racine transgénique) ou les racines chevelues transgéniques clones peuvent être excisés et cultivés autonome en milieu solide de Gamborg B5 additionné de 2 % de sucrose. Alternativement, les racines poilues peuvent être massivement propagées à partir du support liquid de Gamborg B5. La procédure présentée a été réalisée avec le S. tuberosum SPP. tuberosum (cultivar Désirée).
La méthode à suivre la procédure et d’obtenir des pommes de terre transgéniques racines velues a été validée à l’aide d’un vecteur binaire avec la DsRed comme un marqueur de transformation (PK7GWIWG2_II-amarante du VIB-département de biologie des systèmes végétaux à l’Universiteit Gent). Ceci a permis la distinction des racines velues transgéniques de non transgéniques par la fluorescence rouge. Selon qui, à la Figure 3 les racines velues transformés exposé fluorescence rouge éclairée avec feu vert. Le contrôle négatif à l’aide de transformée Agrobacterium ont montré aucune fluorescence rouge (Figure 3), global indiquant la pertinence du marqueur de transformation DsRed pour identifier les racines velues transgéniques (Figure 3D). Autres marqueurs de transformation telles que la résistance aux antibiotique peuvent être utilisés tel que décrit par les autres auteurs23,24; Toutefois, les antibiotiques dans les médias peuvent produire un retard de croissance chez les racines transgéniques contenant le marqueur.

Figure 3 : Fluorescent transgéniques racines velues de pomme de terre (cultivar Désirée) transformés par a. rhizogenes. Les racines poilues ont été obtenus en utilisant un non transformées a. rhizogenes (souche C58C1 : pRI1583) (A et C) et avec a. rhizogenes (souche C58C1:pRI1583) transformée avec le vecteur vide pK7GWIWG2_II-rouge-Root transportant un Marqueurs de transformation DsRed (B et D). Les racines velues sont formés dans les deux infections (A, B) mais une fluorescence rouge est seules observée dans racines velues transformées avec le a. rhizogenes contenant le vecteur binaire. Les images ont été prises avec un stéréomicroscope équipé d’une lampe et un filtre spécifique pour visualiser la fluorescence rouge. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Agrobacterium tumefaciens -médiée par la transformation de la pomme de terre
Le deuxième protocole décrit dans ce manuscrit est mis en place afin d’obtenir, étape par étape, une usine complète de pommes de terre transformée avec a. tumefaciens. La figure 2 présente un aperçu de la procédure, qui prend au total entre 15 à 18 semaines (à partir de feuilles infectionà a. tumefaciens à l’obtention de plantes complètement régénérées). La plus longue partie de la procédure est la régénération des plantes de l’organogenèse. Cette étape particulière rend cette méthode plus laborieux qu’avec a. rhizogenes. La procédure a été effectuée avec S. tuberosum SPP. tuberosum (cultivar Désirée) et S. tuberosum SSP andigena, le premier étant moins dépendant des conditions de jours courts pour induire la tubérisation.
Dans le a. tumefaciens-médiation transformation, contrairement à l' a. rhizogenes -mediated transformation, plantes régénérées sont des organismes transgéniques complètement. Toutefois, bien que les plantes transgéniques sont régénérés dans un milieux sélectifs kanamycine, pas toutes les lignes expriment efficacement le transgène. Par conséquent, la validation de l’expression du transgène est nécessaire.
Comparaison de l’activité de promoteur FHT dans les racines obtenues à l’aide A. tumefaciens et a. rhizogenes
Les procédures susmentionnées ont été appliquées pour produire des racines exprimant le gène GUS sous le promoteur du gène FHT . Le complet transformé plantes avec a. tumefaciens ont été rapportées antérieurement15, à l’aide de la pKGWFS7 de vecteur binaire contenant le promoteur FHT . Maintenant, ce vecteur binaire a été utilisé pour produire de nouvelles racines velues transformés afin de comparer les tissus où le promoteur est actif et donc de tester le système racinaire poilu comme un outil pour étudier l’activation du promoteur.
La figure 4 montre GUS coloration dans les racines des plantes transgéniques obtenues par a. tumefaciens (Figure 4 aB) et des racines velues transgéniques obtenues par a. rhizogenes (Figure 4D, E, F), respectivement. Comme peut être vu, racines transforment avec a. tumefaciens et cultivés in vitro montrent une coloration bleue dans l’endoderme (Figure 4 a), une couche de cellules entre le cortex et la stèle. En plus développé des racines, l’étiquetage bleu est irrégulière dans la couche externe correspondant à l’exoderme (Figure 4 b). En racines velues transformées cultivées en hydroponie, le marqueur de GUS a été spécifiquement situé dans l’endoderme (Figure 4E), dans l’émergence des racines latérales (Figure 4E), dans les zones blessés (Figure 4E ) et dans l’exoderme (Figure 4F). Les racines ont montré aucune tache de GUS dans les témoins négatifs qui ont été soit racines velues sans les racines de cassette ou de type sauvage de l’ADN-T PromFHT:GUS .

Figure 4 : Observation histochimique des racines de pommes de terre transgéniques exprimant le gène rapporteur GUS pilotée par le promoteur de FHT. Les racines de plantes transgéniques complets, obtenus par a. tumefaciens (S. tuberosum SSP andigena) transformation (A-B) voir la coloration au bleu de l’endoderme (A) et l’exoderme (B). Les racines velues transgéniques obtenues par a. rhizogenes (S. tuberosum SSP. tuberosum cultivar Désirée) transformation (C-F) afficher GUS coloration dans l’endoderme (C et E), à la racine latérale émergence (D et E), dans la zone de cicatrisation (E) et dans l’exoderme (F). Endoderme (fr) ; Exoderme (EX) ; Xylème (XL) ; Primordiums d’une racine latérale (LR). La flèche rouge indique la zone blessée. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Tableau S1 : Recettes de médias utilisés pour la croissance de bactéries et de in vitro plantes. S’il vous plaît cliquez ici pour télécharger ce tableau
Tableau S2 : Solution de Hoagland force la moitié pour la culture de plantes de pomme de terre en culture hydroponique. S’il vous plaît cliquez ici pour télécharger ce tableau
Discussion
Dans la pomme de terre, le système le plus commun d’obtenir des plantes transgéniques complètes stables utilise la transformation par les souches d’Agrobacterium tumefaciens nécessitant l’organogenèse en utilisant les phytohormones exogènes. Bien que les protocoles d' Agrobacterium basé a le potentiel pour intégrer le vecteur non-T-DNA sequence25, cette méthodologie est toujours le plus facile et moins chère disponible pour transformer les plantes de pomme de terre. Au cours des dernières années, l’intérêt pour a. rhizogenes-médiation transformation a obtenu l’attention des chercheurs pour permettant d’obtenir des racines transgéniques dans des périodes plus courtes qu’avec un a. tumefaciens. Le a. rhizogenes conserve encore le plasmide (Ri) induisant la racine qui transporte un ensemble de gènes codant des enzymes pour la biosynthèse de contrôle et de la cytokinine d’auxine phytohormone et encodage des opines26. Une fois l’ADN-T Ri est inséré dans l’ADN génomique de l’hôte, le nouvel équilibre hormonal déréglemente les cellules infectées, induisant la formation de racines proliférants, appelées racines velues, émergeant aux points d’infection27. Lorsqu’un vecteur binaire supplémentaire est utilisé pour l’intégration d’un ADN étranger, la préservation du plasmide Ri confère la possibilité d’obtenir des racines poilues transformées sans avoir besoin de l’organogenèse en utilisant les phytohormones exogènes appliqué28. Les racines poilues peuvent être maintenues attachée à la tige de type sauvage, générant une usine de composite ou peuvent être se propagés. Cette capacité de racines velues à se propager est exploitée pour produire dans plusieurs racines velues comme un système biologique pour la production de métabolites utiles ou des protéines étrangères, générant des intérêts en pharmacie et phytoremédiation même zones ( voir pour examen29,30). Dans la pomme de terre (var. Kufri Bahar), des plantes transgéniques complets étaient infectés par la souche a. rhizogenes type sauvage pour produire des racines velues exprimant les antigènes de surface (AgHBs) de l’hépatite B23. Alternativement, une plante transgénique complete régénérée à partir de racines velues peut être obtenue, mais plant de pomme de terre et tubercules ont montré développement distinct par rapport aux contrôles non transformés. Ces différences dans le phénotype sont en raison de l’original Ri ADN-T intégré dans le génome31,32.
Dans ce travail, les procédures détaillées pour obtenir transgéniques stables racines velues à l’aide d’a. rhizogenes , et des plantes transgéniques stables à l’aide d’a. tumefaciens sont présentés (Figure 1 et Figure 2). Les décélération racines velues transgéniques ont été obtenus en 5-6 semaines, tandis que les racines transgéniques à l’aide d’a. tumefaciens nécessaire 15-18 semaines en raison de l’exigence de l’organogenèse de cellules transformées et la sélection et la propagation des plantes transformées. Dans nos mains, la procédure de transformation d’a. tumefaciens fonctionne efficacement dans la S. tuberosum SSP andigena et SSP. tuberosum (cultivar Désirée), avec une efficacité de transformation déclarés environ 35 %22 % et 48 % 12, respectivement. Le décrit la procédure de transformation a. rhizogenes se fonde sur celui rapporté par cor7, qui a montré une élevée (80-100 %) efficacité de la transformation en cultivar Désirée et d’autres cultivars de pomme de trois terre (Albatros, Sabina et Saturna).
Des études fonctionnelles actuelles a. rhizogenes comme un système de transformation alternatives aux pommes de terre et d’indiquer que si la présence initiale d’ADN Ri T-a été préoccupant, nous avons utilisé les deux systèmes afin de transformer les racines de la pomme de terre avec le même binaire vector qui contient un ADN-T avec un promoteur d’un gène de biosynthèse de subérine (FHT) conduisant à l’expression du gène rapporteur GUS . L’analyse histochimique révèle que dans a. tumefaciens transforme les plantes, l’activité du promoteur FHT était dans les couches subérisées intérieures et extérieures des racines (endoderme et l’exoderme, respectivement) (Figure 4 a,B ) ainsi que dans les zones blessés des feuilles, la tige et tuber15. Dans a. rhizogenes transformé racines velues, l’activité a été également détectée dans l’endoderme et l’exoderme et dans les domaines racine blessés (Figure 4E). La présence simultanée de l’activité de promoteur de subérine dans les deux types de racines transformées indique que l’IR intégré l’ADN-T est sans incidence sur les processus de développement liés à la subérisation au moins dans ces tissus de la racine. Dans les racines velues transformées nous avons également découvert que l’activité du promoteur FHT dans les zones entourant l’émergence des racines latérales (Figure 4,E). Ceci est en accord avec l’activité du promoteur signalée par d’autres gènes impliqués dans le transport des monomères de subérine, tels que ABCG11 / WBC1133,34,,du3536 ou le régulateur StNAC103 19. la transformation de la pomme de terre par a. rhizogenes , pour étudier un gène de subérine a déjà été signalée récemment37 et des racines aussi dans ce cas velues ont permis de montrer l’activation du promoteur du CYP86A33, un acide gras Ω-hydroxylase. Toutefois, le GUS coloration dans les racines en vrac quantifiée à l’aide d’un dosage fluorimétrique, d'où l’expression spécifique dans les tissus subérifiées pensait seulement.
Au total, ces éléments de preuve de résultats qu’a. rhizogenes transformation est un outil alternatif plus rapide pour explorer l’activation des cellules spécifiques au type promoteur des gènes reliés à la subérine dans les racines, qui peuvent être étendues aux études basées sur l’autre processus qui se produisent dans les racines. D’accord, d’autres études génétiques fonctionnelles ont réussi à l’aide d’a. rhizogenes en pomme de terre, de tomate et d’eucalyptus pour démontrer le gène fonction6,8,7,9, afin d’étudier la réponse hormonale38,39 ou le promoteur activité40,41. Toutefois, cette stratégie peut présenter encore limites, surtout quand les étudier les processus de développement étroitement contrôlé qui peuvent être déréglementés de l’ADN-T Ri ou quand la plante entière ou les tubercules ou autres organes différents de racines veulent être étudié. Dans ces situations, le système de transformation d’a. tumefaciens est toujours préférable.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêt à divulguer.
Remerciements
Ce travail a été soutenu par le Ministerio de Innovación y Ciencia (AGL2009-13745, bourse de FPI à PB), le Ministerio de Economía y Competitividad et FEDER fonds (AGL2012-36725, AGL2015-67495-C2-1-R) et l’Université de Girona (Ph.d concession de SF et subvention SING11/1). Les auteurs sont reconnaissants envers le Dr Inge Broer (Institut d’aménagement, Université de Rostock, Rostock, Allemagne) et m. Salomé Prat (Centro Nacional de Biotecnología, Madrid, Espagne) pour fournir le a. rhizogenes et la souche d’a. tumefaciens , respectivement et Dr Marçal Soler et Dr Anna Plasencia pour l’aide et le soutien reçu en initiant les expériences de transformation a. rhizogenes (Université Toulouse III Paul Sabatier, CNRS, laboratoire de recherche plante (LRSV), Castanet Tolosan, France). Les auteurs remercient Sara Gómez (Departament de Biologia, UdG, Girona) pour son aide précieuse dans la réalisation des travaux de laboratoire et de prendre soin des plantes et de Ferran Fontdecaba et de Carla Sánchez, qui a assisté avec quelques-unes des expériences alors qu’ils faisaient leurs projets de diplôme final.
matériels
| Name | Company | Catalog Number | Comments |
|
Acetone |
Panreac |
1.310.071.21 | |
|
Acetosyringone |
Acros |
115540050 | |
|
Aquarium pump |
Prodac |
MP350 | |
|
Autoclave |
Ragpa Strelimatic | ||
|
Bacteriological agar |
Lab Conda |
1800 | |
|
BAP |
Duchefa |
B0904 | |
|
Beef extract |
Lab Conda |
1700 | |
|
Plant growing cabinet |
Nuaire | ||
|
Carbenicillin |
Duchefa |
C0109 | |
|
Cefotaxime sodium |
Duchefa |
C0111 | |
|
DMSO |
Merck |
1029310161 | |
|
Ecotron infors |
HT |
29378 | |
|
Ethanol |
Merck |
1,009,831,011 | |
|
Falcon tube |
Control tecnica |
CFT011500 | |
|
Ferricyanate |
Sigma |
101001081 | |
|
Ferrocyanate |
Sigma |
100979088 | |
|
Flask (8.06 cm diameter and 11.3 cm height) and plastic lid for in vitro culture |
Apiglass |
ref16 | |
|
GA3 |
Sigma |
G7645 | |
|
Gamborg B5 media |
Duchefa |
G0210 | |
|
Gelrite |
Duchefa |
G1101 | |
|
Glucosa |
Sigma |
G5767 | |
|
Kanamycin |
Sigma |
K1377 | |
|
Leukopor tape |
BSN Leukopor |
BDF47467 | |
|
Lupe |
Wild-Heerbrugg |
M420 | |
|
Magnetic shaker |
Agimatic |
7000243 | |
|
MES hydrate |
Sigma |
M2933-25G | |
|
MgSO4 |
Panreac |
131404 | |
|
Microscope |
Olympus | ||
|
Minufugue centrifugue 5415R |
Eppendorf | ||
|
Murashige and Skoog media |
Duchefa |
M0254.0050 | |
|
Na2HPO4 |
Panreac |
131679 | |
|
NAA |
Duchefa |
N0903 | |
|
NaCl |
Panreac |
131659 | |
|
NaH2PO4 |
Sigma |
58282 | |
|
NightSea Stereo |
SFA Moonting Adapter | ||
|
Parafilm |
Anorsa |
PRFL-001-001 | |
|
Peptone |
Lab Conda |
1616 | |
|
Petri dishes (90 x 14) |
Anorsa |
200200 | |
|
pHmetre |
Crison | ||
|
Phytotron |
Inkoa |
RFTI-R5485 | |
|
Plant Agar |
Duchefa |
P1001 | |
|
Refrigeratot |
Liebherr Medline | ||
|
Rifampicin |
Duchefa |
R0146 | |
|
Spectinomycin |
Sigma |
59007 | |
|
Spectrophotometer |
Shimadzu | ||
|
Square plates (120 x 120) |
Deltalab |
200204 | |
|
Streptomycin |
Sigma |
S6501 | |
|
Sucrose |
Panreac |
131621 | |
|
Surgical blades |
Swann-Morton |
201 | |
|
Surgical needle |
NIPRO |
015/0204 | |
|
Triptone |
Lab Conda |
1612 | |
|
Triton |
Serva |
37240 | |
|
Unimax 1010 shaker |
Heidolph | ||
|
Vacuum |
Dinko | ||
|
x-GlcA (5-Bromo-4-chloro-3-indoxyl-beta-D-glucuronic acid, sodium salt anhydrous) |
Biosynth |
B-7398 | |
|
Yeast extract |
Lab Conda |
1702.00 | |
|
Zeatin riboside |
Sigma |
1001042850 |
Références
- Gelvin, S. B. Traversing the Cell: Agrobacterium T-DNA's journey to the host genome. Frontiers in Plant Science. 3, 1-11 (2012).
- Lacroix, B., Citovsky, V. The roles of bacterial and host plant factors in Agrobacterium-mediated genetic transformation. The International Journal of Developmental Biology. 57 (6-8), 467-481 (2013).
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Ishida, Y., et al. High efficiency transformation of maize (Zea mays L.) mediated by Agrobacteriumtumefaciens. Nature Biotechnology. 14 (6), 745-750 (1996).
- White, F. F., Taylor, B. H., Huffman, G. A., Gordon, M. P., Nester, E. W. Molecular and genetic analysis of the transferred DNA regions of the root-inducing plasmid of Agrobacterium rhizogenes. Journal of Bacteriology. 164 (1), 33-44 (1985).
- Dinh, P. T. Y., Brown, C. R., Elling, A. A. RNA Interference of effector gene Mc16D10L confers resistance against Meloidogyne chitwoodi in Arabidopsis and Potato. Phytopathology. 104 (10), 1098-1106 (2014).
- Horn, P., et al. Composite potato plants with transgenic roots on non-transgenic shoots: a model system for studying gene silencing in roots. Plant Cell Reports. 33 (12), 1977-1992 (2014).
- Plasencia, A., et al. Eucalyptus hairy roots, a fast, efficient and versatile tool to explore function and expression of genes involved in wood formation. Plant Biotechnology Journal. 14 (6), 1381-1393 (2015).
- Ron, M., et al. Hairy root transformation using Agrobacteriumrhizogenes as a tool for exploring cell type-specific gene expression and function using tomato as a model. Plant Physiology. 166 (2), 455-469 (2014).
- Zhang, W., et al. Development and application of a universal and simplified multiplex RT-PCR assay to detect five potato viruses. Journal of General Plant Pathology. 83 (1), 33-45 (2017).
- Almasia, N. I., et al. Successful production of the potato antimicrobial peptide Snakin-1 in baculovirus-infected insect cells and development of specific antibodies. BMC Biotechnology. 17 (1), 1-11 (2017).
- Serra, O., et al. Silencing of StKCS6 in potato periderm leads to reduced chain lengths of suberin and wax compounds and increased peridermal transpiration. Journal of Experimental Botany. 60 (2), 697-707 (2009).
- Serra, O., et al. CYP86A33-Targeted gene silencing in potato tuber alters suberin composition, distorts suberin lamellae, and impairs the periderm's water barrier function. Plant Physiology. 149 (2), 1050-1060 (2008).
- Serra, O., et al. A feruloyl transferase involved in the biosynthesis of suberin and suberin-associated wax is required for maturation and sealing properties of potato periderm. The Plant Journal. 62 (2), 277-290 (2010).
- Boher, P., Serra, O., Soler, M., Molinas, M., Figueras, M. The potato suberin feruloyl transferase FHT which accumulates in the phellogen is induced by wounding and regulated by abscisic and salicylic acids. Journal of Experimental Botany. 64 (11), 3225-3236 (2013).
- Serra, O., Chatterjee, S., Figueras, M., Molinas, M., Stark, R. E. Deconstructing a plant macromolecular assembly: chemical architecture, molecular flexibility, and mechanical performance of natural and engineered potato suberins. Biomacromolecules. 15 (3), 799-811 (2014).
- Vulavala, V. K. R., et al. Identification of genes related to skin development in potato. Plant Molecular Biology. 94 (4-5), 481-494 (2017).
- Landgraf, R., et al. The ABC transporter ABCG1 is required for suberin formation in potato tuber periderm. The Plant Cell. 26 (8), 3403-3415 (2014).
- Verdaguer, R., et al. Silencing of the potato StNAC103 gene enhances the accumulation of suberin polyester and associated wax in tuber skin. Journal of Experimental Botany. 67 (18), 5415-5427 (2016).
- Molina, I., Li-Beisson, Y., Beisson, F., Ohlrogge, J. B., Pollard, M. Identification of an Arabidopsis feruloyl-coenzyme A transferase required for suberin synthesis. Plant Physiology. 151 (3), 1317-1328 (2009).
- Gou, J. Y., Yu, X. -. H., Liu, C. J. A hydroxycinnamoyltransferase responsible for synthesizing suberin aromatics in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 106 (44), 18855-18860 (2009).
- Banerjee, A. K., Prat, S., Hannapel, D. J. Efficient production of transgenic potato (S. tuberosum L. ssp. andigena) plants via Agrobacterium tumefaciens-mediated transformation. Plant Science. 170 (4), 732-738 (2006).
- Sunil Kumar, G. B., Ganapathi, T. R., Srinivas, L., Revathi, C. J., Bapat, V. a. Expression of hepatitis B surface antigen in potato hairy roots. Plant Science. 170 (5), 918-925 (2006).
- Schmidt, J. F., Moore, M. D., Pelcher, L. E., Covello, P. S. High efficiency Agrobacteriumrhizogenes-mediated transformation of Saponariavaccaria L. (Caryophyllaceae) using fluorescence selection. Plant Cell Reports. 26 (9), 1547-1554 (2007).
- Petti, C., Wendt, T., Meade, C., Mullins, E. Evidence of genotype dependency within Agrobacteriumtumefaciens in relation to the integration of vector backbone sequence in transgenic Phytophthorainfestans-tolerant potato. Journal of Bioscience and Bioengineering. 107 (3), 301-306 (2009).
- Gaudin, V., Vrain, T., Jouanin, L. Bacterial genes modifying hormonal balances in plants. Plant Physiology and Biochemistry. 32 (1), 11-29 (1994).
- Nemoto, K., et al. Function of the aux and rol genes of the Ri plasmid in plant cell division in vitro. Plant Signaling &. Behavior. 4 (12), 1145-1147 (2009).
- Visser, R. G. F., et al. Expression and inheritance of inserted markers in binary vector carrying Agrobacteriumrhizogenes-transformed potato (Solanumtuberosum L.). Theoretical and Applied Genetics. 78 (5), 705-714 (1989).
- Guillon, S., Trémouillaux-Guiller, J., Pati, P. K., Rideau, M., Gantet, P. Hairy root research: recent scenario and exciting prospects. Current Opinion in Plant Biology. 9 (3), 341-346 (2006).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Ooms, G., Lenton, J. R. T-DNA genes to study plant development: precocious tuberisation and enhanced cytokinins in A. tumefaciens transformed potato. Plant Molecular Biology. 5 (4), 205-212 (1985).
- de Vries-Uijtewaal, E., et al. Fate of introduced genetic markers in transformed root clones and regenerated plants of monohaploid and diploid potato genotypes. TAG. Theoretical and applied genetics. 78 (2), 185-193 (1989).
- Bird, D., et al. Characterization of Arabidopsis ABCG11/WBC11, an ATP binding cassette (ABC) transporter that is required for cuticular lipid secretion. The Plant Journal: For Cell and Molecular Biology. 52 (3), 485-498 (2007).
- Luo, B., Xue, X. Y., Hu, W. L., Wang, L. J., Chen, X. Y. An ABC transporter gene of Arabidopsis thaliana, AtWBC11, is involved in cuticle development and prevention of organ fusion. Plant and Cell Physiology. 48 (12), 1780-1802 (2007).
- Panikashvili, D., et al. The Arabidopsis DESPERADO/AtWBC11 transporter is required for cutin and wax secretion. Plant Physiology. 145 (4), 1345-1360 (2007).
- Panikashvili, D., et al. The Arabidopsis DSO/ABCG11 transporter affects cutin metabolism in reproductive organs and suberin in roots. Molecular Plant. 3 (3), 563-575 (2010).
- Bjelica, A., et al. Fatty acid ω-hydroxylases from Solanum tuberosum. Plant Cell Reports. 35 (12), 2435-2448 (2016).
- Ding, Y., et al. Abscisic acid coordinates nod factor and cytokinin signaling during the regulation of nodulation in Medicago truncatula. The Plant Cell. 20 (10), 2681-2695 (2008).
- Isayenkov, S., Mrosk, C., Stenzel, I., Strack, D., Hause, B. Suppression of allene oxide cyclase in hairy roots of Medicagotruncatula reduces jasmonate levels and the degree of mycorrhization with glomus intraradices 1[w]. Plant Physiology. 139 (3), 1401-1410 (2005).
- Dalton, D. A., et al. Physiological roles of glutathione S-Transferases in soybean root Nodules 1[C][W][OA]. Plant Physiology. 150 (1), 521-530 (2009).
- Limpens, E., et al. RNA interference in Agrobacteriumrhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55 (399), 983-992 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon