Method Article
Formazione immagine confocal di RNA Double-Stranded e Pattern Recognition Receptors in infezione Virus RNA negativo
In questo articolo
Riepilogo
RNA double-stranded prodotto durante la replicazione del virus RNA possa essere riconosciuto dai recettori di riconoscimento di pattern per indurre una risposta immunitaria innata. Per i virus del RNA negativo-senso, l'interazione tra il basso livello dsRNA e PRRs rimane poco chiaro. Abbiamo sviluppato un metodo di microscopia confocale per visualizzare arenavirus dsRNA e PRR in singole celle.
Abstract
Doppia elica (ds) RNA è prodotto come un intermedio replicativo durante l'infezione da virus a RNA. Riconoscimento di dsRNA da recettori di riconoscimento di pattern host (PRRs) come l'acido retinoico (RIG-io) come recettori (RLRs) RIG- ed il melanoma differenziazione-collegata della proteina 5 (MDA-5) conduce all'induzione della risposta immunitaria innata. La formazione e la distribuzione intracellulare di dsRNA in senso positivo l'infezione del virus del RNA è stata ben caratterizzata da microscopia. Molti virus del RNA negativo-senso, tra cui alcuni arenavirus, innescare la risposta immunitaria innata durante l'infezione. Tuttavia, virus del RNA negativo-senso sono stati pensati per produrre bassi livelli di dsRNA, che ostacola il studio di imaging del riconoscimento PRR di dsRNA virale. Inoltre, esperimenti di infezione con patogenicità arenavirus devono essere eseguiti in strutture di contenimento elevato biosicurezza livello (BSL-4). L'interazione tra RNA virale e PRRs per virus altamente patogeno del RNA è in gran parte sconosciuto a causa di ulteriori sfide tecniche che i ricercatori devono affrontare nelle strutture BSL-4. Recentemente, un anticorpo monoclonale (Mab) (clone 5 9) originariamente utilizzato per il rilevamento di pan-enterovirus è stato trovato per rilevare in modo specifico il dsRNA con una sensibilità maggiore rispetto gli anticorpi di anti-dsRNA J2 o K1 tradizionale. Nel presente documento, utilizzando il 5 9 anticorpo, descriviamo un protocollo di microscopia confocale che è stato usato con successo per visualizzare dsRNA, proteina virale e PRR contemporaneamente in singole cellule infettate da arenavirus. Il protocollo è anche adatto per studi di dsRNA e distribuzione PRR in cellule patogene arenavirus infettati in BSL4 strutture di formazione immagine.
Introduzione
Il primo passo dell'induzione della risposta immunitaria innata è riconoscimento di host di double-stranded RNA (ds) dai recettori di riconoscimento di pattern (PRRs) come l'acido retinoico (RIG-io) come recettori (RLRs) RIG-io e melanoma differenziazione-associato proteina obbligatoria 5 (MDA-5)1. Per i virus del RNA di senso positivo, dsRNA può solitamente essere facilmente individuata utilizzando anticorpi monoclonali (Mab) anti-dsRNA J2 o K12. Interazione tra dsRNA e PRRs in positivo-incagliano i virus del RNA, come picornavirus, è stata caratterizzata mediante microscopia confocale3. Tuttavia, per il negativo-senso virus a RNA, visualizzazione e caratterizzazione dell'interazione PRR e dsRNA è stato ostacolato dalla mancanza di anticorpi sensibili a dsRNA. Ibridazione in situ fluorescente (FISH) di RNA è stato applicato per la visualizzazione di virale RNA e PRRs4. Tuttavia, la metodologia di pesce richiede la conoscenza del target sequenza di RNA e potrebbe non essere compatibile con la PRR co-macchiatura. Recentemente, il 5 9 Mab, che è stato originariamente sviluppato per la diagnosi di pan-enterovirus, infezione, è stato trovato per essere più sensibile il Mab J2 e può facilmente rilevare dsRNA in negativo-senso RNA virus infezione5,6. Così, Mab 9 5 è un romanzo e strumento utile per studiare la replicazione virale e l'interazione tra PRR e RNA virale per-senso RNA virus.
Arenavirus sono una famiglia di virus del RNA singolo-incagliato, negativo-senso, che comprendono diversi patogeni umani, come virus di Lassa (LASV), Junín virus (JUNV) e virus di Machupo (MACV), che causano malattie febbre emorragica severa in esseri umani7. Dati clinici da mortali e gravi casi di argentino febbre emorragica causata dal nuovo mondo arenavirus JUNV esibiscono livelli insolitamente elevati di siero IFN-α8,9. Abbiamo dimostrato che il patogeno arenavirus NW (JUNV e MACV), ma non i patogeni vecchio mondo arenavirus, LASV, indurre un tipo ho risposta di interferone (IFN) in cellule dentritiche monocito-derivate umane10. Inoltre, RIG-I è uno dei sensori di mediare la reazione di tipo I IFN in cellule infettate JUNV11. Abbiamo anche trovato che il recettore di R (PKR) della chinasi di proteina, che è tradizionalmente conosciuto per il riconoscimento di dsRNA, è attivato in patogeni NW arenavirus infezione12. Per capire meglio il meccanismo di risposta IFN virus-specifica durante l'infezione arenavirus, abbiamo mirato a sviluppare un protocollo per visualizzare l'interazione tra dsRNA virale e la PRRs citoplasmico.
Esperimenti di infezione con patogeni JUNV, MACV e LASV devono essere eseguite in biosicurezza 4 (BSL-4) strutture di livello. Così, oltre al livello presumibilmente basso di dsRNA formata nell'infezione arenavirus, soddisfare i requisiti di biosicurezza è un'altra sfida tecnica durante l'esecuzione di studi di formazione immagine per questi virus ad alta patogenicità. Utilizzando il 5 9 anticorpo e il ceppo vaccinale Candid1 # di JUNV, un protocollo basato su microscopia confocale è descritto in questo rapporto, che è stato usato con successo per visualizzare dsRNA, proteina virale e PRR contemporaneamente in cellule infettate da arenavirus in Laboratori BSL2. Il protocollo è anche adatto per la visualizzazione della distribuzione intracellulare di dsRNA e PRR durante l'infezione patogena arenavirus in strutture BSL4.
Protocollo
1. preparazione di cellule A549 e JUNV infezione
- Cellule epiteliali di seme 2 x 105 polmonari umane A549 sulla poli-D-lisina (PDL) rivestito vetrini coprioggetti in 12 pozzetti a 24 ore prima dell'infezione.
- Preparare aliquote di 150 mL di JUNV13 a una moltiplicazione di infezione (MOI) di 1,0 placca formando unità per cella diluito in media Medium (DMEM) dell'Aquila di Dulbecco per volta completati con 2% siero bovino fetale (FBS) e 1%, penicillina e streptomicina (P/S ).
- Rimuovere supporti dalla coltura delle cellule. Inoculo di virus su ciascun vetrino coprioggetti contenenti ed incubare per 1,5 h a 37 ° C. Agitare le piastre ogni 15 min.
- Rimuovere l'inoculo di virus, aggiungere 1 mL di DMEM completate con 5% di FBS e 1% P/S. Incubare la piastra a 37 ° C per punto di tempo desiderato.
2. fissazione e immunostaining
- Aspirare i media. Sciacquare le cellule aggiungendo 1 mL di tampone fosfato salino (PBS) completata con calcio e magnesio in ciascun pozzetto.
- Rimuovere PBS. Aggiungere 1 mL di metanolo (MeOH) pre-raffreddato a-20 ° C ed incubare a-20 ° C o il ghiaccio secco per 15 min.
- Rimuovere MeOH.
- Aggiungere 1 mL di PBS in ciascun pozzetto, e campioni di lavaggio a 4 ° C con dolce dondolo per 5 min, ripetere il lavaggio per totale di 4 volte.
- Lavare le cellule fisse sulle lamelle in 1 mL di 0,2% t-octylphenoxypolyethoxyethanol per 5 min a 4 ° C, con dolce dondolio.
- Aggiungere 1 mL di PBS in ciascun pozzetto. Lavare i campioni a 4 ° C per 5 min con dolce dondolio. Ripetere la fase di lavaggio per totale di 4 volte.
- Per rilevare dsRNA e MDA5, incubare i campioni in 200 mL di anticorpi primari diluito in 3% albumina di siero bovino (BSA). Diluire l'anticorpo anti-dsRNA 9 5 ad una diluizione di 1:2 e diluire l'anticorpo anti-MDA-5 a 1: 250. Incubare con dolce dondolo a 4 ° C durante la notte.
- Rimuovere gli anticorpi primari e lavare ogni bene con 1 mL di PBS per 5 min con dolce dondolo a RT. Ripeti questo lavaggio quattro volte di più.
- Aggiungere 200 mL di anticorpi secondari (1:2, 000 diluizione) diluito in 3% BSA e incubare per 1h a RT.
- Rimuovere gli anticorpi secondari e lavare ogni bene con 1 mL di PBS per 5 min con dolce dondolo a RT. Ripeti questo lavaggio quattro volte di più.
- Per rilevare la nucleoproteina JUNV (NP) e RIG-, aggiungere 200 mL di anticorpi coniugati diluito in 3% BSA. Diluire il coniugato anti-JUNV NP (AG-12) a 1:1,000 e incubare i campioni per 2 h a RT con dolce dondolio. Diluire il coniugato anti-RIG-io anticorpo a 1: 500 e incubare a 4 ° C durante la notte con dolce dondolio.
- Rimuovere gli anticorpi coniugati e lavare ogni bene con 1 mL di PBS per 5 min con dolce dondolo a RT. Ripeti questo lavaggio quattro volte di più.
- Colorante di contrasto i coprioggetti con DAPI (1:1, 000) per 3 min con dolce dondolo a TA.
- Lavare i vetrini coprioggetti 3 volte, ogni volta per 5 min in 1 mL di 0.5% t-octylphenoxypolyethoxyethanol con dolce dondolo a TA.
- Lavare due volte in 1 mL di PBS per 5 min ogni volta con dolce dondolo a TA.
- Lavare una volta in 1 mL di ddH2O per 1 min a RT, a dondolo delicatamente.
- Montare le lamelle su vetrini utilizzando mezzi di montaggio. Lasciate che la cura durante la notte.
- Sigillare le diapositive con smalto e aria secca per 1 h.
- Immagine al microscopio confocale con la x 60 / 1.42 obiettivo ad immersione apertura numerica usando le stesse emissioni laser per ogni campione.
- Quando si analizzano i dati, se necessario, effettuare regolazioni di luminosità e contrasto utilizzando la stessa regolazione lineare per tutti i campioni.
Risultati
Questo protocollo è stato applicato per studiare la distribuzione e la colocalizzazione tra il RLRs (RIG-I e MDA-5) e dsRNA in cellule infettate da JUNV. Come illustrato nella Figura 1 e Figura 2, l'accumulo di dsRNA aumenta nel tempo come progredisce l'infezione virale. Concentrato di MDA-5 (Figura 1) e RIG-I (Figura 2) segnali sono stati trovati colocalized con le strutture punctate della NP e dsRNA.
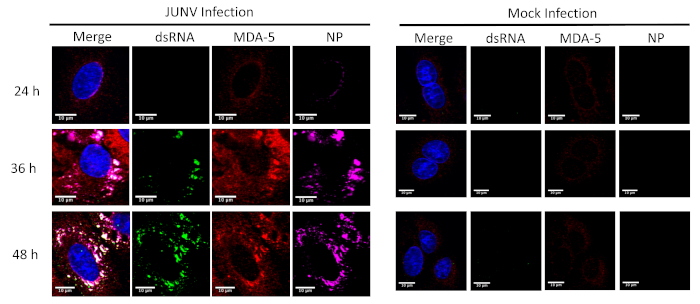
Figura 1: corso di tempo del dsRNA e formazione JUNV NP e la distribuzione di MDA-5. JUNV-infettati e mock-infettato cellule A549 erano fissi, macchiate e stampate secondo il protocollo a 24, 36 e 48 ore post infezione (HPI). Clicca qui per visualizzare una versione più grande di questa figura.
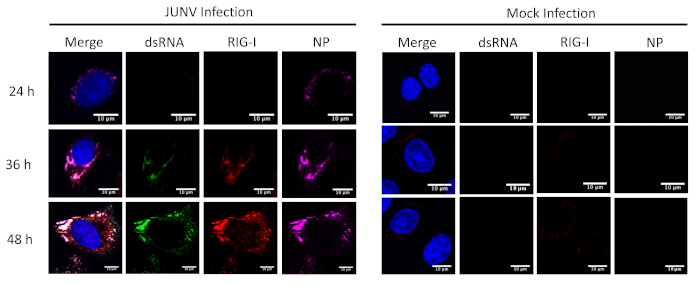
Figura 2: corso di tempo del dsRNA e formazione JUNV NP e la distribuzione di RIG-I. JUNV-infettati e mock-infettato cellule A549 erano fissi, macchiate e stampate secondo il protocollo a 24, 36 e 48 HPI. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Per senso positivo RNA virus e virus dsDNA, dsRNA è facilmente rilevato con l'anticorpo di anti-dsRNA J2 ampiamente utilizzato. Tuttavia, virus del RNA negativo-senso si ritiene che producono il dsRNA ad un livello basso o sotto il livello di rilevamento utilizzando lo stesso anticorpo2. Così, molti aspetti di interazione virale RNA e PRR sono in gran parte poco chiari per virus del RNA negativo-senso. Abbiamo tentato di macchiare per dsRNA in arenavirus infezione usando l'anticorpo J2 ma i segnali di fluorescenza sono non stati differenziabili rispetto all'infezione fittizi. Il Mab 9 5, originariamente utilizzato per il rilevamento di pan-enterovirus, è stato trovato per essere specifici per dsRNA e più sensibile rispetto al J2 anticorpo5. Questo anticorpo è stato utilizzato con successo per rilevare dsRNA virale durante l'infezione del virus del RNA, compreso il prototipo arenavirus Coriomeningite linfocitaria virus5,6,14-senso. Di conseguenza, abbiamo usato il Mab 9 5 a co-macchiare per la presenza di dsRNA, virale NP e PRRs per capire meglio la loro distribuzione e interazione in singole celle durante l'infezione arenavirus.
Esistono diversi metodi di fissaggio che possono essere utilizzati per preservare la struttura delle cellule. Fissazione con MeOH agisce da precipitazione di proteine, mentre proteine reticolazioni paraformaldeide e formalina. MeOH è più efficace di aldeidi a conservare gli acidi nucleici nelle cellule e fornisce basso fondo immunostaining. Il metanolo inoltre rimuove i lipidi dalle cellule e così permeabilizes membrane cellulari al tempo stesso15. In questo protocollo, le cellule vengono fissate mediante MeOH ghiacciata. Altri metodi di fissazione sono stati anche tentati, compreso fissaggio campioni con paraformaldeide al 4%, formalina, paraformaldeide seguita da metanolo e metanolo seguita da paraformaldeide. Tuttavia, alta colorazione aspecifica livello basale è stato osservato in cellule infettate da mock quando paraformaldeide o formalina è stato utilizzato. Il metodo di fissazione ottimale è fissazione con MeOH a-20 ° C basato sulla sensibilità e specificità dei risultati. Prima di anticorpo primario macchiatura, esempio di blocco con BSA 3%, 5% BSA e siero di capra 10% o 5% per 30 minuti a 1 ora è stato testato, ma tutti provocato non-specifici, una colorazione di fondo. I migliori risultati sono stati raggiunti senza il blocco passo e direttamente usando 3% BSA in una diluizione di anticorpo. I passaggi critici nel minimizzare i segnali di sfondo sono il PBS e t-Octylphenoxypolyethoxyethanol lava dopo la fissazione. Mentre il commercialmente disponibili 5 9 anticorpo è diluito il vender e pronto per uso diretto, una diluizione di 1:2 dell'anticorpo con 3% BSA inoltre funzionava bene. Nel caso che il segnale di dsRNA è debole, l'anticorpo può essere utilizzato senza diluizione.
Questo protocollo può essere utilizzato per studiare l'interazione tra dsRNA e PRRs in arenavirus infezione. Mentre questa metodologia è stata sviluppata in un ambiente di BSL-2, la fissazione di metanolo descritta nel presente documento consente completa inattivazione degli arenavirus. Di conseguenza, può essere applicato lo stesso protocollo di studio di formazione immagine per patogenicità arenavirus (cioè, LASV, JUNV e MACV) in una struttura di BSL-4. È anche possibile applicare questo protocollo a studi su altri virus a RNA. Per ottenere risultati ottimali, una modifica del protocollo può essere necessaria.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Vorremmo ringraziare l'UTMB imaging core strutture e Maxim Ivannikov per assistenza di microscopio.
Questo lavoro è stato supportato dal servizio sanitario pubblico concedere RO1AI093445 e RO1AI129198 assegnato a SP, UTMB impegno fondo P84373 a CH e T32 AI007526 di EM.
Materiali
| Name | Company | Catalog Number | Comments |
| APEX Alexa Fluor 647 antibody labeling kit | Invitrogen | A10475 | |
| BSA | Sigma Aldrich | A4503 | |
| DAPI | Cell Signaling | 4083 | 1:1,000 dilution |
| Donkey-anti rabbit Alexa Fluor 594 | Invitrogen | A-11058 | 1:2,000 dilution; Lot #: 1454437 |
| Dulbecco's modified Eagle's medium | Corning | 10-013-CV | |
| Fetal Bovine Serum | Atlanta Bio | S11150 | |
| Glass microscope slides | Fisher | 12-550-15 | |
| Goat-anti mouse Alexa Fluor 488 | Invitrogen | A-11029 | 1:2000 dilution; Lot #: 1874804 |
| Human lung epithelial A549 cells | ATCC | CCL-185 | |
| Methanol | Fisher | A412 | Stored at -20 °C |
| Mouse MAb anti-JUNV NP | BEI | NA05-AG12 | Conjugated to Alexa-647 at 1:1,000 dilution |
| Mouse MAb pan-Enterovirus 9D5 Reagent | Millipore Sigma | 3361 | ready for use; diluted to 1:2; Lot #: 3067445 |
| PBS supplemented with Ca and Mg | Corning | 21-030-CV | |
| PDL Coated coverslips | Neuvitro | H-12-1.5-pdl | |
| ProLong Gold antifade | Invitrogen | P10144 | |
| Rabbit MAb MDA-5 | Abcam | ab126630 | 1:250 dilution; Lot #: GR97758-7 |
| recombiant Candid#1 strain of JUNV | Lab generated | Lab generated | As previously described in reference 13. |
| RIG-I mouse MAb conjugated to Alexa-594 | Santa Cruz | sc-376845 | 1:1000 dilution; Lot #: AO218 |
| Triton X-100 | Sigma Aldrich | T8787 |
Riferimenti
- Jensen, S., Thomsen, A. R. Sensing of RNA viruses: a review of innate immune receptors involved in recognizing RNA virus invasion. Journal of Virology. 86, 2900-2910 (2012).
- Weber, F., Wagner, V., Rasmussen, S. B., Hartmann, R., Paludan, S. R. Double-stranded RNA is produced by positive-strand RNA viruses and DNA viruses but not in detectable amounts by negative-strand RNA viruses. Journal of Virology. 80, 6 (2006).
- Triantafilou, K., Vakakis, E., Kar, S., Richer, E., Evans, G. L., Triantafilou, M. Visualisation of direct interaction of MDA5 and the dsRNA replicative intermediate form of positive strand RNA viruses. Journal of Cell Science. 125, 4761-4769 (2012).
- Onomoto, K., et al. Critical role of an antiviral stress granule containing RIG-I and PKR in viral detection and innate immunity. PLoS One. 7, e43031 (2012).
- Son, K. N., Liang, Z., Lipton, H. L. Double-stranded RNA is detected by immunofluorescence analysis in RNA and DNA virus infections, including those by negative-sense RNA viruses. Journal of Virology. 89, 9383-9392 (2015).
- Mateer, E. J., Paessler, S., Huang, C. Visualization of double-stranded RNA colocalizing with pattern recognition receptors in arenavirus infected cells. Frontiers Cellular and Infection Microbiology. 8, 251 (2018).
- Buchmeier, M. J., de la Torre, J. C., Peters, C. J., Knipe, D. M., Howley, P. M. Arenavirdae: The viruses and their replication. Fields Virology. 2, (2006).
- Levis, S. C., et al. Endogenous interferon in Argentine hemorrhagic fever. The Journal of Infectious Diseases. 149, 428-433 (1984).
- Levis, S. C., et al. Correlation between endogenous interferon and the clinical evolution of patients with Argentine hemorrhagic fever. Journal of Interferon Research. 5, 383-389 (1985).
- Huang, C., et al. Highly pathogenic new world and old world human arenaviruses induce distinct interferon response in human cells. Journal of Virology. 89, 7079-7088 (2015).
- Huang, C., et al. Junin virus infection activates the type I interferon pathway in a RIG-I-dependent manner. PLoS Neglected Tropical Diseases. 6, e1659 (2012).
- Huang, C., Kolokoltsova, O. A., Mateer, E. J., Koma, T., Paessler, S. Highly pathogenic new world arenavirus infection activates the pattern recognition receptor protein kinase R without attenuating virus replication in human cells. Journal of Virology. 91, 20 (2017).
- Emonet, S. F., et al. Rescue from cloned cDNAs and in vivo characterization of recombinant pathogenic Romero and live-attenuated Candid#1 strains of Junin virus, the causative agent of Argentine hemorrhagic fever disease. Journal of Virology. 85 (4), 1473-1483 (2011).
- Child, S. J., et al. Antagonism of the protein kinase R pathway in human cells by Rhesus Cytomegalovirus. Journal of Virology. 92, 6 (2018).
- Hobro, A. J., Smith, N. I. An evaluation of fixation methods: Spatial and compositional cellular changes observed by Raman imaging. Vibrational Spectroscopy. 91, 31-45 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon