Method Article
Proyección de imagen confocal de ARN bicatenario y receptores de reconocimiento de patrón en la infección por Virus de ARN de sentido negativo
En este artículo
Resumen
RNA de doble hebra producido durante la replicación de virus de ARN puede ser reconocido por los receptores de reconocimiento de patrón para inducir una respuesta inmune innata. Virus de ARN de sentido negativo, la interacción entre el bajo nivel dsARN y PRRs sigue siendo confusa. Hemos desarrollado un método de microscopia confocal para visualizar arenavirus dsARN y PRR en células individuales.
Resumen
(Ds) RNA de doble cadena se produce como un intermediario replicativo durante la infección de virus de ARN. Reconocimiento de dsRNA por receptores de reconocimiento de patrón host (PRRs) como el ácido retinoico (RIG-I) como receptores (RLRs) RIG-I y melanoma proteína asociada a la diferenciación 5 (MDA-5) conduce a la inducción de la respuesta inmune innata. La formación y la distribución intracelular de dsARN en infección por virus de ARN de sentido positivo se ha caracterizado bien por microscopía. Muchos virus de ARN de sentido negativo, incluyendo algunos arenavirus, desencadenan la respuesta inmunitaria innata durante la infección. Sin embargo, los virus de ARN de sentido negativo pensaron para producir niveles bajos de dsRNA, que dificulta el estudio de reconocimiento de la PRR de dsRNA viral. Además, los experimentos de infección con el virus altamente patógeno deben realizarse en instalaciones de nivel de seguridad de la biotecnología de alta contención (BSL-4). La interacción entre virus ARN y PRRs para el altamente patógeno virus de ARN es desconocida debido a los desafíos técnicos adicionales que necesitan los investigadores para enfrentar en las instalaciones del BSL-4. Recientemente, un anticuerpo monoclonal (Mab) (clon 9 5) originalmente utilizado para la detección de enterovirus de pan se ha encontrado para detectar específicamente dsRNA con una sensibilidad mayor que los anticuerpos de anti-dsRNA tradicionales J2 o K1. En el presente, mediante la utilización de la 5 9 anticuerpos, se describe un protocolo de microscopía confocal que se ha utilizado con éxito para visualizar dsRNA, proteína viral y PRR simultáneamente en células individuales infectadas por arenavirus. El protocolo también es adecuado para estudios de dsARN y distribución de PRR en arenavirus patógenos infectadas células en BL4 instalaciones de imagen.
Introducción
El paso inicial de la inducción de la respuesta inmune innata es reconocimiento del hospedero de doble cadena (ds) RNA por los receptores de reconocimiento de patrón (PRRs) como el ácido retinoico (RIG-I) como receptores (RLRs) RIG-I y melanoma asociado a diferenciación proteína 5 (MDA-5)1. Para virus de ARN de sentido positivo, dsRNA puede generalmente ser detectado fácilmente utilizando el J2 o K1 dsARN anti anticuerpos monoclonales (Mab)2. Interacción entre dsARN y PRRs en virus de ARN de cadena positiva, como picornavirus, se ha caracterizado mediante microscopía confocal3. Sin embargo, para virus de ARN de sentido negativo, visualización y caracterización de la interacción PRR y dsRNA ha sido obstaculizado por la falta de anticuerpos sensibles al dsRNA. Hibridación in situ fluorescente (FISH) de RNA se ha aplicado a la visualización de viral RNA y PRRs4. Sin embargo, la metodología de peces requiere el conocimiento de la blanco de secuencia de ARN y puede no ser compatible con PRR Co la coloración. Recientemente, el 5 de 9 Mab, que originalmente fue desarrollado para el diagnóstico de la infección del enterovirus pan, fue encontrado para ser más sensible que el Mab de J2 y puede fácilmente detectar dsARN en sentido negativo RNA virus infección5,6. Así, Mab 5 9 es una novedosa y útil herramienta para estudiar la replicación viral y la interacción entre PRR y el ARN viral para virus de ARN de sentido negativo.
Arenavirus son una familia de virus de ARN monocatenario, de sentido negativo, que incluyen varios patógenos humanos, tales como virus de Lassa (LASV), virus Junín (JUNV) y el virus de Machupo (MACV), que causan enfermedades de fiebre hemorrágica severa en seres humanos7. Datos clínicos de casos graves y fatales de Argentina fiebre hemorrágica causada por el arenavirus del nuevo mundo JUNV exhiben niveles inusualmente altos de suero IFN-α8,9. Hemos demostrado que los arenavirus patógenos del NW (JUNV y MACV), pero no el patógeno viejo mundo arenavirus, LASV, inducir a un tipo respuesta al interferón (IFN) en células dendríticas derivadas de monocitos humanos10. Además, la plataforma-es uno de los sensores mediación tipo I respuesta IFN en células infectadas con JUNV11. También se encontró que la proteína quinasa R (PKR) del receptor, que es tradicionalmente conocido por reconocimiento de dsRNA, está activado en patógenos NW arenavirus infección12. Para entender aún más el mecanismo de la respuesta IFN de virus-específica durante la infección por arenavirus, el objetivo fue desarrollar un protocolo para visualizar la interacción entre el dsRNA viral y el PRRs citoplásmicos.
Experimentos de infección con patógenos JUNV, MACV y LASV tienen que realizarse en bioseguridad nivel 4 (BSL-4) instalaciones. Así, además el presumiblemente bajo nivel de dsARN en infección por arenavirus, cumpliendo con los requisitos de seguridad de la biotecnología es otro desafío de la técnica al realizar estudios por imágenes para estos virus altamente patógenos. Mediante la utilización de la 5 9 anticuerpos y la cepa vacunal Candid1 # de JUNV, un protocolo basado en la microscopía confocal se describe en este informe, que se ha utilizado con éxito para visualizar dsRNA, proteína viral y PRR simultáneamente en células infectadas por arenavirus en Laboratorios BSL2. El protocolo también es adecuado para la visualización de la distribución intracelular de dsARN y PRR durante infección por arenavirus patógenos en instalaciones BL4.
Protocolo
1. preparación de las células A549 y JUNV infección
- Semilla 2 x 105 pulmón humano A549 las células epiteliales en poly-D-lisina (PDL) habían revestido cubreobjetos de vidrio en placas de pocillos de 12 a 24 horas antes de la infección.
- Preparar alícuotas de 150 mL de JUNV13 en una multiplicación de la infección (MOI) de 1,0 placa formando unidad por elemento diluido en los medios de medio (DMEM) modificado Eagle de Dulbecco suplementados con 2% de suero bovino fetal (FBS) y 1% de penicilina y estreptomicina (P/S ).
- Retire los medios de cultivo celular. Añadir inóculo del virus en cada bien que contienen cubreobjetos e incube durante 1,5 h a 37 ° C. Agitar las placas cada 15 minutos.
- Eliminar el inóculo de virus, añadir 1 mL de DMEM suplementado con 5% FBS y 1% P/S. Incubar la placa a 37 ° C para el momento deseado.
2. la fijación y el immunostaining
- Aspire los medios de comunicación. Enjuague las células añadiendo 1 mL de tampón fosfato salino (PBS) suplementada con calcio y magnesio a cada pocillo.
- Retirar el PBS. Añadir 1 mL de metanol (MeOH) previamente enfriada a-20 ° C e incubar a-20 ° C o en hielo seco durante 15 minutos.
- Retire el MeOH.
- Añadir 1 mL de PBS a cada pocillo, y lavado de las muestras a 4 ° C con oscilación suave durante 5 minutos repiten el lavado total de 4 veces.
- Lavar las células fijas en cubreobjetos en 1 mL de t-octylphenoxypolyethoxyethanol de 0.2% por 5 min a 4 ° C, con suave balanceo.
- Añadir 1 mL de PBS a cada pocillo. Lavar las muestras a 4 ° C por 5 min con suave balanceo. Repetir el lavado total de 4 veces.
- Para la detección de dsARN y MDA5, incubar las muestras en 200 mL de anticuerpos primarios diluido en 3% albúmina de suero bovino (BSA). Diluir el anticuerpo de anti-dsRNA 5 de 9 en una dilución 1:2 y diluir el anticuerpo de anti-MDA-5 en 1: 250. Incubar con suave balanceo a 4 ° C durante la noche.
- Remover anticuerpos primarios y lave cada uno con 1 mL de PBS durante 5 minutos con suave balanceo en RT. repetir este lavado cuatro veces más.
- Añadir 200 mL de anticuerpos secundarios (1:2, 000 dilución) diluido en 3% de BSA e incube a temperatura ambiente durante 1 h.
- Quitar los anticuerpos secundarios y lavar cada uno con 1 mL de PBS durante 5 minutos con suave balanceo en RT. repetir este lavado cuatro veces más.
- Para la detección de la nucleoproteína (NP) de JUNV y RIG-, añadir 200 mL de conjugado anticuerpos diluidos en 3% de BSA. Diluir el conjugado anti-JUNV NP (AG-12) en 1:1,000 e incubar las muestras por 2 h a temperatura ambiente con el suave balanceo. Diluir el conjugado anti-RIG-I anticuerpos a 1: 500 e incube a 4 ° C durante la noche, con balanceo suave.
- Remover anticuerpos conjugados y lavar cada pozo con 1 mL de PBS durante 5 minutos con suave balanceo en RT. repetir este lavado cuatro veces más.
- Contratinción el cubreobjetos con DAPI (1:1, 000) por 3 min con suave balanceo a TA.
- Lavar los cubreobjetos 3 veces, cada vez durante 5 minutos en 1 mL de 0.5% t-octylphenoxypolyethoxyethanol con suave balanceo a TA.
- Lavar dos veces en 1 mL de PBS durante 5 min cada tiempo con suave balanceo a TA.
- Lavar una vez en 1 mL de ddH2O por 1 min a temperatura ambiente, mecer suavemente.
- Montaje de cubreobjetos en portaobjetos de vidrio utilizando medios de montaje. Permita que cure durante la noche.
- Sello de los portaobjetos con esmalte de uñas y aire seco durante 1 hora.
- Imagen de microscopio confocal con el 60 x 1.42 lentes de inmersión de aceite abertura numérica utilizando las mismas emisiones de láser para cada muestra.
- Al analizar los datos, si es necesario, hacer ajustes de brillo y contraste, utilizando el mismo ajuste lineal para todas las muestras.
Resultados
Este protocolo se aplicó para estudiar la distribución y colocalización entre el RLRs (RIG-I y MDA-5) y dsRNA en células infectadas con JUNV. Como se muestra en la figura 1 y figura 2, la acumulación de dsARN aumenta con el tiempo conforme avanza la infección viral. Concentrado MDA-5 (figura 1) y plataforma-I (figura 2) las señales encontradas colocalized con las estructuras punteadas de la NP y dsRNA.
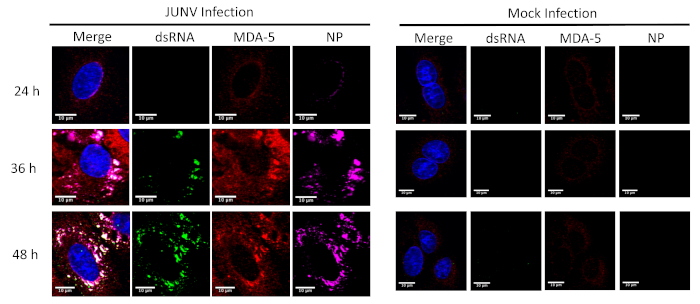
Figura 1: evolución temporal de dsARN y formación JUNV NP y la distribución de MDA-5. Infectados con JUNV y mock-infectado las células A549 fueron fijo, manchadas y reflejadas según el protocolo en 24, 36 y 48 horas post infección (HPI). Haga clic aquí para ver una versión más grande de esta figura.
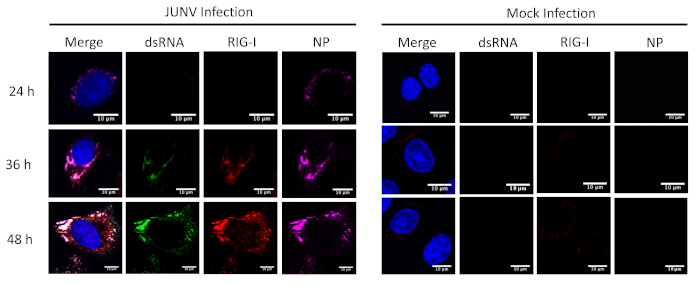
Figura 2: evolución temporal de dsARN y formación JUNV NP y la distribución de RIG-I. Infectados con JUNV y mock-infectado las células A549 fueron fijo, manchadas y reflejadas según el protocolo en 24, 36 y 48 HPI. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Virus de ARN de sentido positivo y virus dsDNA, dsRNA se detecta fácilmente con el anticuerpo de anti-dsRNA J2 ampliamente utilizado. Sin embargo, los virus de ARN de sentido negativo se creen para producir dsRNA en un bajo o por debajo del nivel de detección utilizando el mismo anticuerpo2. Así, muchos aspectos de la interacción viral de RNA y PRR son en gran parte confusos para los virus de ARN de sentido negativo. Hemos intentado manchar de dsARN en infección por arenavirus usando el anticuerpo J2 pero las señales de fluorescencia no diferenciables frente a la infección simulada. El Mab 5 9, originalmente utilizado para la detección de Cacerola-enterovirus, fue encontrado para ser específicos de dsARN y más sensible que los anticuerpos de J25. Este anticuerpo ha sido utilizado con éxito para detectar dsRNA viral durante la infección por el virus de RNA, incluyendo el prototipo arenavirus Coriomeningitis linfocítica virus5,6,14de sentido negativo. Por consiguiente, utilizamos el Mab 5 9 Co manchar para la presencia de dsARN, viral NP y PRRs para entender aún más su distribución y la interacción en las células individuales durante la infección por arenavirus.
Existen múltiples métodos de fijación que pueden utilizarse para preservar la estructura de la célula. Fijación con MeOH actúa precipitando las proteínas, mientras que proteínas de reticulaciones de paraformaldehido y formalina. MeOH es más eficaz que los aldehinos en conservar los ácidos nucleicos en las células y proporciona bajo fondo immunostaining. Metanol, también elimina los lípidos de las células y así permeabilizes las membranas celulares en el mismo tiempo15. En el presente Protocolo, las células se fijan usando MeOH helada. También se trataron de otros métodos de fijación, incluyendo la fijación de las muestras con paraformaldehído al 4%, formalina, paraformaldehido seguida de metanol y metanol seguida de paraformaldehido. Sin embargo, una tinción de nivel basal alto inespecífica fue observada en células infectadas por mofa cuando se utiliza paraformaldehido o formalina. El método de fijación óptima es fijación con MeOH a-20 ° C se basa en la sensibilidad y especificidad de los resultados. Antes de la tinción de anticuerpo primario, muestra bloqueo con BSA 3%, 5% de BSA y suero de cabra 10% o 5% durante 30 minutos a 1 hora fue probado, pero todo resultó en, fondo tinción inespecífica. Los mejores resultados fueron alcanzados sin el bloqueo de paso y directamente utilizando BSA 3% en la dilución del anticuerpo. Los pasos críticos para minimizar las señales de fondo son el PBS y t-Octylphenoxypolyethoxyethanol se lava después de la fijación. Mientras que el 5 9 disponibles comercialmente anticuerpos se diluyeron por el vendedor y listo para dirigir uso, una dilución de 1:2 del anticuerpo con BSA 3% también funcionó bien. En caso que la señal de dsRNA es débil, el anticuerpo puede usarse sin dilución.
Este protocolo puede ser utilizado para estudiar la interacción entre dsARN y PRRs en la infección por arenavirus. Si bien esta metodología se desarrolló en un ambiente de BSL-2, la fijación de metanol descrita permite completa inactivación de arenavirus. Por lo tanto, se puede aplicar el mismo protocolo para estudio de virus altamente patógenos (es decir, LASV JUNV y MACV) en una facilidad BSL-4. También es posible aplicar este protocolo a los estudios sobre otros virus ARN. Para lograr resultados óptimos, una modificación del Protocolo puede ser necesaria.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a las instalaciones de base imagen UTMB y Maxim Ivannikov ayuda de microscopio.
Este trabajo fue financiado por el servicio de salud pública concesión de RO1AI093445 y RO1AI129198 otorgado a SP, UTMB compromiso fondo P84373 CH y AI007526 T32 a EM.
Materiales
| Name | Company | Catalog Number | Comments |
| APEX Alexa Fluor 647 antibody labeling kit | Invitrogen | A10475 | |
| BSA | Sigma Aldrich | A4503 | |
| DAPI | Cell Signaling | 4083 | 1:1,000 dilution |
| Donkey-anti rabbit Alexa Fluor 594 | Invitrogen | A-11058 | 1:2,000 dilution; Lot #: 1454437 |
| Dulbecco's modified Eagle's medium | Corning | 10-013-CV | |
| Fetal Bovine Serum | Atlanta Bio | S11150 | |
| Glass microscope slides | Fisher | 12-550-15 | |
| Goat-anti mouse Alexa Fluor 488 | Invitrogen | A-11029 | 1:2000 dilution; Lot #: 1874804 |
| Human lung epithelial A549 cells | ATCC | CCL-185 | |
| Methanol | Fisher | A412 | Stored at -20 °C |
| Mouse MAb anti-JUNV NP | BEI | NA05-AG12 | Conjugated to Alexa-647 at 1:1,000 dilution |
| Mouse MAb pan-Enterovirus 9D5 Reagent | Millipore Sigma | 3361 | ready for use; diluted to 1:2; Lot #: 3067445 |
| PBS supplemented with Ca and Mg | Corning | 21-030-CV | |
| PDL Coated coverslips | Neuvitro | H-12-1.5-pdl | |
| ProLong Gold antifade | Invitrogen | P10144 | |
| Rabbit MAb MDA-5 | Abcam | ab126630 | 1:250 dilution; Lot #: GR97758-7 |
| recombiant Candid#1 strain of JUNV | Lab generated | Lab generated | As previously described in reference 13. |
| RIG-I mouse MAb conjugated to Alexa-594 | Santa Cruz | sc-376845 | 1:1000 dilution; Lot #: AO218 |
| Triton X-100 | Sigma Aldrich | T8787 |
Referencias
- Jensen, S., Thomsen, A. R. Sensing of RNA viruses: a review of innate immune receptors involved in recognizing RNA virus invasion. Journal of Virology. 86, 2900-2910 (2012).
- Weber, F., Wagner, V., Rasmussen, S. B., Hartmann, R., Paludan, S. R. Double-stranded RNA is produced by positive-strand RNA viruses and DNA viruses but not in detectable amounts by negative-strand RNA viruses. Journal of Virology. 80, 6(2006).
- Triantafilou, K., Vakakis, E., Kar, S., Richer, E., Evans, G. L., Triantafilou, M. Visualisation of direct interaction of MDA5 and the dsRNA replicative intermediate form of positive strand RNA viruses. Journal of Cell Science. 125, 4761-4769 (2012).
- Onomoto, K., et al. Critical role of an antiviral stress granule containing RIG-I and PKR in viral detection and innate immunity. PLoS One. 7, e43031(2012).
- Son, K. N., Liang, Z., Lipton, H. L. Double-stranded RNA is detected by immunofluorescence analysis in RNA and DNA virus infections, including those by negative-sense RNA viruses. Journal of Virology. 89, 9383-9392 (2015).
- Mateer, E. J., Paessler, S., Huang, C. Visualization of double-stranded RNA colocalizing with pattern recognition receptors in arenavirus infected cells. Frontiers Cellular and Infection Microbiology. 8, 251(2018).
- Buchmeier, M. J., de la Torre, J. C., Peters, C. J. Arenavirdae: The viruses and their replication. Fields Virology. Knipe, D. M., Howley, P. M. 2, Lippincott Williams & Wilkins. (2006).
- Levis, S. C., et al. Endogenous interferon in Argentine hemorrhagic fever. The Journal of Infectious Diseases. 149, 428-433 (1984).
- Levis, S. C., et al. Correlation between endogenous interferon and the clinical evolution of patients with Argentine hemorrhagic fever. Journal of Interferon Research. 5, 383-389 (1985).
- Huang, C., et al. Highly pathogenic new world and old world human arenaviruses induce distinct interferon response in human cells. Journal of Virology. 89, 7079-7088 (2015).
- Huang, C., et al. Junin virus infection activates the type I interferon pathway in a RIG-I-dependent manner. PLoS Neglected Tropical Diseases. 6, e1659(2012).
- Huang, C., Kolokoltsova, O. A., Mateer, E. J., Koma, T., Paessler, S. Highly pathogenic new world arenavirus infection activates the pattern recognition receptor protein kinase R without attenuating virus replication in human cells. Journal of Virology. 91, 20(2017).
- Emonet, S. F., et al. Rescue from cloned cDNAs and in vivo characterization of recombinant pathogenic Romero and live-attenuated Candid#1 strains of Junin virus, the causative agent of Argentine hemorrhagic fever disease. Journal of Virology. 85 (4), 1473-1483 (2011).
- Child, S. J., et al. Antagonism of the protein kinase R pathway in human cells by Rhesus Cytomegalovirus. Journal of Virology. 92, 6(2018).
- Hobro, A. J., Smith, N. I. An evaluation of fixation methods: Spatial and compositional cellular changes observed by Raman imaging. Vibrational Spectroscopy. 91, 31-45 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados