Method Article
Imagerie confocale d’ARN bicaténaire et récepteurs de reconnaissance de modèle dans l’infection par le Virus ARN de polarité négative
Dans cet article
Résumé
ARN bicaténaire produite lors de la réplication des virus à ARN sont reconnaissables par les récepteurs de reconnaissance de modèle pour induire une réponse immunitaire innée. Pour les virus à ARN sens négatif, l’interaction entre l’Arndb à basse altitude et PRRs reste floue. Nous avons développé une méthode de microscopie confocale afin de visualiser les arénavirus dsRNA et PRR dans des cellules individuelles.
Résumé
Double-brin (ds) RNA est produit comme intermédiaire réplicatif pendant l’infection de virus à ARN. Reconnaissance de dsRNA de récepteurs de reconnaissance modèle hôte (SDRP) tels que l’acide rétinoïque (RIG-je) comme des récepteurs (SRRL) RIG-I et mélanome protéine associée à la différenciation 5 (MDA-5) conduit à l’induction de la réponse immunitaire innée. La formation et la distribution intracellulaire de l’Arndb dans l’infection de virus à ARN de polarité positive a été bien caractérisées par microscopie. Plusieurs virus à ARN sens négatif, y compris certains arénavirus, déclenchent la réponse immunitaire innée au cours de l’infection. Toutefois, les virus à ARN sens négatif étaient censés produire de faibles niveaux d’Arndb, qui fait obstacle à l’étude d’imagerie de la reconnaissance de la PRR d’Arndb virale. En outre, des expériences d’infection avec arénavirus hautement pathogène doivent être effectuées dans les installations de niveau de biosécurité de confinement élevé (BSL-4). L’interaction viral RNA / EREP hautement pathogène du virus ARN ignore en grande partie en raison des défis techniques supplémentaires que les chercheurs doivent faire face dans les installations de BSL-4. Récemment, un anticorps monoclonal (ACM) (clone 9 5) initialement utilisé pour la détection de pan-entérovirus s’est avéré de détecter spécifiquement dsRNA avec une sensibilité plus élevée que les anticorps d’anti-dsRNA J2 ou K1 traditionnels. Dans les présentes, en utilisant les 5 9 anticorps, les auteurs décrivent un protocole de microscopie confocale qui a été utilisé avec succès pour visualiser l’Arndb, protéine virale et PRR simultanément dans les cellules infectées par des arénavirus. Le protocole est également adapté aux études de dsRNA et distribution de PRR dans les cellules pathogènes arénavirus infectés dans BSL4 installations d’imagerie.
Introduction
L’étape initiale de l’induction de la réponse immune innée est reconnaissance hôte de double-brin (ds) RNA par les récepteurs de reconnaissance de modèle (SDRP) tels que l’acide rétinoïque (RIG-je) comme des récepteurs (SRRL) RIG-I et mélanome associée à la différenciation protéine obligatoire 5 (MDA-5)1. Pour les virus ARN de polarité positive, dsRNA habituellement facilement repérables à l’aide de la J2 ou K1 anti-dsRNA anticorps monoclonaux (ACM)2. Interaction entre dsRNA et rer dans les virus à ARN brin positif, comme les picornavirus, a été caractérisée à l’aide de la microscopie confocale3. Toutefois, pour les virus à ARN sens négatif, visualisation et la caractérisation de l’interaction PRR et dsRNA a été entravée par l’absence d’anticorps sensibles d’Arndb. Hybridation in situ fluorescente (FISH) de RNA a été appliquée à la visualisation de viral RNA et PRRs4. Néanmoins, la méthodologie de poisson nécessite la connaissance de l’objectif de la séquence d’ARN et ne peut-être pas être compatible avec PRR conjointement la coloration. Récemment, le 5 de 9 Mab, qui a été initialement développé pour le diagnostic de l’infection à entérovirus-pan, s’est avéré être plus sensible que le Mab J2 et peut facilement détecter les Arndb en sens négatif infection de virus à ARN5,6. Ainsi, Mab 9 5 est un outil utile pour étudier la réplication virale et l’interaction entre le PRR et l’ARN viral pour les virus à ARN de polarité négative et novateur.
Arenavirus sont une famille de virus à ARN monocaténaire, polarité négative, qui comprennent plusieurs pathogènes humains, tels que les virus de Lassa (LASV), le virus Junin (JUNV) et le virus de Machupo (MACV), qui provoquent des maladies de fièvre hémorragique sévère chez les humains,7. Les données cliniques de cas graves et mortels de Argentine fièvre hémorragique causée par le nouveau monde arénavirus JUNV présentent des niveaux anormalement élevés de sérum IFN-α8,9. Nous avons montré que le pathogène arénavirus NW (JUNV et MACV), mais pas les pathogènes du vieux monde arénavirus, LASV, induisent un type j’ai réponse interféron (IFN) dans les cellules dendritiques humaines macrophages dérivés de monocytes,10. En outre, RIG-I est un des capteurs médiant de type I réponse IFN dans les cellules infectées par le JUNV11. Nous avons également constaté que le R (PKR) récepteur kinase, qui est traditionnellement connu pour la reconnaissance de l’Arndb, est activé en pathogènes NW arénavirus infection12. Pour mieux comprendre le mécanisme de réponse IFN spécifiques du virus pendant l’infection arénavirus, visait à élaborer un protocole pour visualiser l’interaction entre l’Arndb virale et le SDRP cytoplasmique.
Expériences d’infection pathogène JUNV, MACV et LASV doivent être réalisées dans la biosécurité de niveau 4 installations (BSL-4). Ainsi, en plus du niveau présumée faible d’Arndb formé en infection arénavirus, satisfaisant aux prescriptions de prévention des risques biotechnologiques est un autre défi technique lors de l’exécution des études d’imagerie pour ces virus hautement pathogènes. En utilisant les 5 9 anticorps et la souche du vaccin Candid1 # de JUNV, un protocole basé sur la microscopie confocal est décrit dans le présent rapport, qui a été utilisé avec succès pour visualiser l’Arndb, protéine virale et PRR simultanément dans les cellules infectées par arénavirus dans Laboratoires BSL2. Le protocole est également adapté pour la visualisation de la distribution intracellulaire de l’Arndb et PRR pendant l’infection pathogène arénavirus dans BSL4 installations.
Protocole
1. préparation des cellules A549 et infection JUNV
- Graine 2 x 105 cellules épithéliales pulmonaires humaines A549 sur poly-D-lysine (PDL) enduit lamelles de verre en plaques à puits 12 à 24 heures avant l’infection.
- Préparer des aliquots de 150 mL de JUNV13 à une multiplication d’infection (MOI) de 1,0 plaque formant unité par cellule dilué dans les médias de médium (DMEM) de l’aigle de la modification de Dulbecco additionnés de 2 % sérum fœtal (SVF) et 1 % la pénicilline et la streptomycine (P/S ).
- Retirez les supports de culture cellulaire. Ajouter l’inoculum de virus sur chaque lamelle bien contenant et laisser incuber pendant 1,5 h à 37 ° C. Secouez les plaques toutes les 15 min.
- Supprimer l’inoculum de virus, ajouter 1 mL de DMEM supplémenté avec 5 % de SVF et 1 % P/S. incuber les plaques à 37 ° C, pour le moment souhaité.
2. fixation et immunostaining
- Aspirer les médias. Rincer les cellules en ajoutant 1 mL de solution saline tamponnée au phosphate (PBS), additionnée de calcium et de magnésium dans chaque puits.
- Supprimer les PBS. Ajouter 1 mL de méthanol (MeOH) préalablement refroidi à-20 ° C et laisser incuber à-20 ° C ou sur la glace sèche pendant 15 min.
- Retirez le MeOH.
- Ajouter 1 mL de PBS dans chaque puits et lavage des échantillons à 4 ° C, avec un balancement doux pendant 5 min. répéter le lavage pour 4 fois au total.
- Laver les cellules fixes sur les lamelles dans 1 mL de 0,2 % t-octylphenoxypolyethoxyethanol pendant 5 min à 4 ° C, avec le doux balancement.
- Ajouter 1 mL de PBS dans chaque puits. Laver les échantillons à 4 ° C pendant 5 min avec le doux balancement. Répétez l’étape de lavage pour 4 fois au total.
- Pour détecter l’Arndb et MDA5, incuber les échantillons dans 200 mL d’anticorps primaires dilué à 3 % d’albumine sérique bovine (BSA). Diluer l’anticorps anti-dsRNA 9 5 à une dilution de 1 / 2 et diluer l’anticorps anti-MDA-5 à 1/250. Incubez avec doux balancement à 4 ° C durant la nuit.
- Ôter les anticorps primaires et laver chaque bien avec 1 mL de PBS pendant 5 min avec doux balancement à RT. répéter ce lavage quatre fois plus.
- Ajouter 200 mL d’anticorps secondaires (1:2, 000 dilution) dilué à 3 % de BSA et incuber à RT pendant 1 h.
- Ôter les anticorps secondaires et laver chaque bien avec 1 mL de PBS pendant 5 min avec doux balancement à RT. répéter ce lavage quatre fois plus.
- Pour détecter la nucléoprotéine (NP) de la JUNV et RIG-I, ajouter 200 mL d’anticorps conjugués dilué à 3 % de BSA. Diluer le conjugué anti-JUNV NP (AG-12) à 1 : 1 000 et incuber les échantillons pendant 2 h à RT avec doux balancement. Diluer les conjugués anticorps anti-RIG-j’à 1/500 et incuber à 4 ° C durant la nuit avec le doux balancement.
- Ôter les anticorps conjugués et laver chaque bien avec 1 mL de PBS pendant 5 min avec doux balancement à RT. répéter ce lavage quatre fois plus.
- Contre-coloration les lamelles au DAPI (1:1, 000) pendant 3 min avec balancement doux à température ambiante.
- Laver les lamelles 3 fois, chaque fois pendant 5 min dans 1 mL de 0,5 % t-octylphenoxypolyethoxyethanol avec balancement doux à température ambiante.
- Laver deux fois dans 1 mL de PBS pendant 5 min à chaque fois avec un balancement doux à température ambiante.
- Laver une fois dans 1 mL de ddH2O pendant 1 min à ta, berçant doucement.
- Monter des lamelles couvre-objet sur lames de verre à l’aide de supports de montage. Laisser guérir du jour au lendemain.
- Sceller les lames avec des vernis à ongles et laisser sécher pendant 1 h.
- Image sur un microscope confocal avec le x 60 / 1,42 numérique ouverture huile d’immersion de l’objectif en utilisant les mêmes émissions laser pour chaque échantillon.
- Lorsqu’on analyse les données, si nécessaire, faire des ajustements pour la luminosité et le contraste en utilisant le même ajustement linéaire pour tous les échantillons.
Résultats
Ce protocole a été appliqué à l’étude de la distribution et la colocalisation entre les SRRL (RIG-I et MDA-5) et Arndb dans les cellules infectées par le JUNV. Comme le montre la Figure 1 et Figure 2, l’accumulation de dsRNA augmente au fil du temps à mesure que progresse l’infection virale. Concentré de MDA-5 (Figure 1) et RIG-I (Figure 2) signaux trouvées colocalisé avec les structures ponctuées de la NP et l’Arndb.
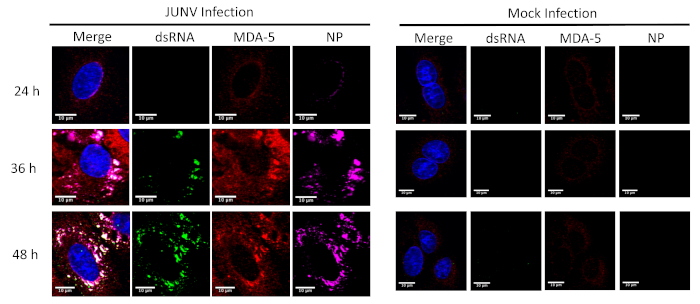
Figure 1 : évolution temporelle de l’Arndb et formation JUNV NP et la distribution de MDA-5. JUNV-infectés et infectés par le simulacre des cellules A549 étaient fixes, colorées et imagés selon le protocole à 24, 36 et 48 heures après l’infection (HPI). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
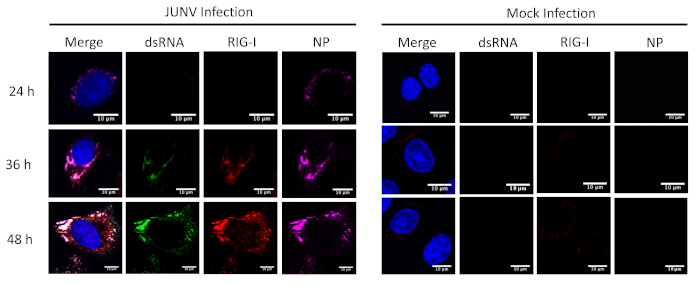
Figure 2 : évolution temporelle de l’Arndb et formation JUNV NP et la distribution de RIG-I. JUNV-infectés et infectés par le simulacre des cellules A549 étaient fixes, colorées et imagés selon le protocole à 24, 36 et 48 HPI. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Pour les virus ARN à polarité positive et virus dsDNA, dsRNA est facilement détectable avec l’anticorps d’anti-dsRNA J2 largement utilisé. Toutefois, les virus à ARN sens négatif sont censés produire dsRNA faible ou au-dessous du niveau de détection en utilisant le même anticorps2. Ainsi, beaucoup d’aspects de l’interaction ARN et PRR virale est en grande partie floue pour les virus à ARN sens négatif. Nous avons tenté de tache de dsRNA arénavirus infection à l’aide de l’anticorps J2, mais les signaux de fluorescence n’étaient pas dérivables par rapport à l’infection de simulacre. Le Mab 9 5, initialement utilisé pour la détection de pan-entérovirus, s’est avéré spécifique pour l’Arndb et plus sensible que le J2 anticorps5. Cet anticorps a été utilisé avec succès pour détecter des Arndb virale au cours de l’infection de virus à ARN, dont le prototype arénavirus chorioméningite lymphocytaire virus5,6,14sens négatif. En conséquence, nous avons utilisé le Mab 9 5 co teinter la présence d’Arndb NP virale et le SDRP afin de mieux comprendre leur répartition et leur interaction dans des cellules individuelles au cours de l’infection à arénavirus.
Il existe plusieurs méthodes de fixation qui peuvent être utilisés pour préserver la structure cellulaire. Fixation avec MeOH agit par précipitation des protéines, alors que les protéines crosslinks paraformaldéhyde et formol. MeOH est plus efficace que les aldéhydes à conserver les acides nucléiques dans des cellules et fournit immunostaining faible bruit de fond. Méthanol supprime également les lipides des cellules et donc permeabilizes des membranes cellulaires à la même heure15. Dans le présent protocole, les cellules sont fixées à l’aide de MeOH glacée. Autres méthodes de fixation essayaient également, y compris la fixation des échantillons avec 4 % paraformaldéhyde, formol, paraformaldéhyde suivie de méthanol et du méthanol suivie de paraformaldéhyde. Cependant, basale haut niveau non spécifiques coloration a été observée dans les cellules infectées par le mock quand paraformaldéhyde ou formol a été utilisé. La méthode de fixation optimale est la fixation avec le MeOH à-20 ° C basé sur la sensibilité et la spécificité des résultats. Avant coloration l’anticorps primaire, échantillon de blocage avec 3 % de BSA, BSA de 5 % et 10 % ou 5 % sérum de chèvre pendant 30 min à 1 heure a été testé, mais tous a entraîné non-spécifiques, coloration de fond. Les meilleurs résultats ont été obtenus sans l’étape de blocage et directement à l’aide de 3 % de BSA dans la dilution de l’anticorps. Les étapes essentielles pour réduire au minimum les signaux de fond sont les PBS et t-Octylphenoxypolyethoxyethanol lave après fixation. Alors que le 5 9 disponible dans le commerce, anticorps est dilué par le vendeur et prête pour utilisation directe, une dilution de 1 / 2 de l’anticorps avec 3 % de BSA aussi bien fonctionné. En cas que le signal de l’Arndb est faible, l’anticorps peut être utilisé sans dilution.
Ce protocole peut être utilisé pour étudier l’interaction entre l’Arndb et PRRs arénavirus infection. Tandis que cette méthode a été développée dans un environnement de BSL-2, la fixation de méthanol décrite ci-après permet une inactivation complète des arénavirus. Par conséquent, le même protocole peut être appliqué à une étude d’imagerie pour hautement pathogène Arenavirus (LASV, JUNV et MACV) dans un établissement de BSL-4. Il est également possible d’appliquer ce protocole aux études sur les autres virus à ARN. Pour obtenir des résultats optimaux, une modification du protocole peut être nécessaire.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier les installations d’imagerie de base UTMB et Maxim Ivannikov pour microscope.
Ce travail a été soutenu par le Public Health Service accorder RO1AI093445 et RO1AI129198 attribué à SP, UTMB engagement fonds P84373 à CH et T32 AI007526 à EM.
matériels
| Name | Company | Catalog Number | Comments |
| APEX Alexa Fluor 647 antibody labeling kit | Invitrogen | A10475 | |
| BSA | Sigma Aldrich | A4503 | |
| DAPI | Cell Signaling | 4083 | 1:1,000 dilution |
| Donkey-anti rabbit Alexa Fluor 594 | Invitrogen | A-11058 | 1:2,000 dilution; Lot #: 1454437 |
| Dulbecco's modified Eagle's medium | Corning | 10-013-CV | |
| Fetal Bovine Serum | Atlanta Bio | S11150 | |
| Glass microscope slides | Fisher | 12-550-15 | |
| Goat-anti mouse Alexa Fluor 488 | Invitrogen | A-11029 | 1:2000 dilution; Lot #: 1874804 |
| Human lung epithelial A549 cells | ATCC | CCL-185 | |
| Methanol | Fisher | A412 | Stored at -20 °C |
| Mouse MAb anti-JUNV NP | BEI | NA05-AG12 | Conjugated to Alexa-647 at 1:1,000 dilution |
| Mouse MAb pan-Enterovirus 9D5 Reagent | Millipore Sigma | 3361 | ready for use; diluted to 1:2; Lot #: 3067445 |
| PBS supplemented with Ca and Mg | Corning | 21-030-CV | |
| PDL Coated coverslips | Neuvitro | H-12-1.5-pdl | |
| ProLong Gold antifade | Invitrogen | P10144 | |
| Rabbit MAb MDA-5 | Abcam | ab126630 | 1:250 dilution; Lot #: GR97758-7 |
| recombiant Candid#1 strain of JUNV | Lab generated | Lab generated | As previously described in reference 13. |
| RIG-I mouse MAb conjugated to Alexa-594 | Santa Cruz | sc-376845 | 1:1000 dilution; Lot #: AO218 |
| Triton X-100 | Sigma Aldrich | T8787 |
Références
- Jensen, S., Thomsen, A. R. Sensing of RNA viruses: a review of innate immune receptors involved in recognizing RNA virus invasion. Journal of Virology. 86, 2900-2910 (2012).
- Weber, F., Wagner, V., Rasmussen, S. B., Hartmann, R., Paludan, S. R. Double-stranded RNA is produced by positive-strand RNA viruses and DNA viruses but not in detectable amounts by negative-strand RNA viruses. Journal of Virology. 80, 6(2006).
- Triantafilou, K., Vakakis, E., Kar, S., Richer, E., Evans, G. L., Triantafilou, M. Visualisation of direct interaction of MDA5 and the dsRNA replicative intermediate form of positive strand RNA viruses. Journal of Cell Science. 125, 4761-4769 (2012).
- Onomoto, K., et al. Critical role of an antiviral stress granule containing RIG-I and PKR in viral detection and innate immunity. PLoS One. 7, e43031(2012).
- Son, K. N., Liang, Z., Lipton, H. L. Double-stranded RNA is detected by immunofluorescence analysis in RNA and DNA virus infections, including those by negative-sense RNA viruses. Journal of Virology. 89, 9383-9392 (2015).
- Mateer, E. J., Paessler, S., Huang, C. Visualization of double-stranded RNA colocalizing with pattern recognition receptors in arenavirus infected cells. Frontiers Cellular and Infection Microbiology. 8, 251(2018).
- Buchmeier, M. J., de la Torre, J. C., Peters, C. J. Arenavirdae: The viruses and their replication. Fields Virology. Knipe, D. M., Howley, P. M. 2, Lippincott Williams & Wilkins. (2006).
- Levis, S. C., et al. Endogenous interferon in Argentine hemorrhagic fever. The Journal of Infectious Diseases. 149, 428-433 (1984).
- Levis, S. C., et al. Correlation between endogenous interferon and the clinical evolution of patients with Argentine hemorrhagic fever. Journal of Interferon Research. 5, 383-389 (1985).
- Huang, C., et al. Highly pathogenic new world and old world human arenaviruses induce distinct interferon response in human cells. Journal of Virology. 89, 7079-7088 (2015).
- Huang, C., et al. Junin virus infection activates the type I interferon pathway in a RIG-I-dependent manner. PLoS Neglected Tropical Diseases. 6, e1659(2012).
- Huang, C., Kolokoltsova, O. A., Mateer, E. J., Koma, T., Paessler, S. Highly pathogenic new world arenavirus infection activates the pattern recognition receptor protein kinase R without attenuating virus replication in human cells. Journal of Virology. 91, 20(2017).
- Emonet, S. F., et al. Rescue from cloned cDNAs and in vivo characterization of recombinant pathogenic Romero and live-attenuated Candid#1 strains of Junin virus, the causative agent of Argentine hemorrhagic fever disease. Journal of Virology. 85 (4), 1473-1483 (2011).
- Child, S. J., et al. Antagonism of the protein kinase R pathway in human cells by Rhesus Cytomegalovirus. Journal of Virology. 92, 6(2018).
- Hobro, A. J., Smith, N. I. An evaluation of fixation methods: Spatial and compositional cellular changes observed by Raman imaging. Vibrational Spectroscopy. 91, 31-45 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon