Method Article
Produzione di topi transgenici mediata lentivirali: un metodo semplice ed altamente efficiente per uno studio diretto dei fondatori
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per promuovere l'integrazione del transgene e produzione di topi transgenici fondatore con alta efficacia mediante una semplice iniezione di un vettore lentivirale nello spazio perivitellino di un ovocita fecondato.
Abstract
Per quasi 40 anni, pronuclei iniezione di DNA rappresenta il metodo standard per generare topi transgenici con integrazione casuale dei transgeni. Una procedura di routine è largamente utilizzata in tutto il mondo e il suo limite principale risiede nella scarsa efficacia di integrazione del transgene, risultante in una bassa resa di animali fondatore. Solo qualche punto percentuale di animali nati dopo l'impianto di iniezione ovociti fecondati hanno integrato il transgene. Al contrario, vettori lentivirali sono potenti strumenti per il trasferimento genico integrativa e il loro utilizzo di trasdurre ovociti fecondati permette una produzione altamente efficiente del fondatore topi transgenici con un rendimento medio superiore al 70%. Inoltre, tutto lo sforzo del mouse può essere utilizzato per la produzione di animali transgenici e la penetranza di espressione del transgene è estremamente elevata, superiore all'80% con vettori lentivirali transgenesi mediata rispetto alla microiniezione di DNA. La dimensione del frammento del DNA che può essere carico di vettore lentivirale è limitata a 10 kb e rappresenta la maggiore limitazione di questo metodo. Utilizzando un semplice e facile da eseguire la procedura di iniezione sotto la zona pellucida degli ovociti fecondati, più di 50 animali fondatore possono essere prodotto in una singola sessione di microiniezione. Tale metodo è altamente adattato per eseguire, direttamente in animali fondatore, rapido guadagno e la perdita di studi di funzione o di regioni di DNA genomiche di schermo per la loro capacità di controllare e regolare espressione genica in vivo.
Introduzione
Il lavoro pionieristico di Gordon et nel 1980 hanno mostrato che dopo l'impianto in pseudopregnant topi, l'iniezione di DNA del plasmide nel maschio pronuclei di ovociti fecondati può produrre la produzione di animali transgenici che integrano la plasmide DNA1. La dimostrazione che possono essere generati mammiferi transgenici ha avuto un enorme impatto sulle scienze della vita globale, aprendo la strada a nuovi campi di ricerca sia per le scienze di base e traslazionale scienze biomediche. Negli ultimi quattro decenni, microiniezione di DNA è diventata una pratica di routine. Anche se è stati prodotti un numero enorme di topi transgenici, il metodo standard non è pienamente utilizzabile per tutti i ceppi di topi e richiede molto tempo reincroci2,3. Sua applicazione ad altre specie rimane impegnativo4 e il rendimento generale di integrazione del transgene è limitato a qualche percentuale di animali nati5. Inoltre, l'efficacia dell'integrazione del transgene rappresenta il fattore limitante che spiega la scarsa resa dei pronuclei iniezione di DNA. A questo proposito, vettori virali integranti sono gli strumenti più efficienti per carico e integrano transgeni e così potrebbero fornire nuovi mezzi per aumentare significativamente la resa di integrazione, l'unica limitazione è che la dimensione del transgene che non può superare i 10 kb6 .
Vettori lentivirali pseudo-tipizzati con la proteina di busta del Virus della stomatite vescicolare (VSV) sono strumenti di trasferimento del gene PANTROPICO e altamente integrativa e possono essere utilizzati per trasdurre ovociti fecondati7. La zona pellucida che circonda gli ovociti è una barriera naturale virus e deve essere passato per consentire di trasduzione con i vettori lentivirali. Gli animali transgenici sono stati generati da transducing ovociti fecondati dopo micro-foratura o la rimozione della zona pellucida8,9. Tuttavia, iniezione sotto la zona pellucida nello spazio perivitellino sembra essere il metodo più semplice di trasdurre le uova fecondate come inizialmente descritto da Lois e colleghi7.
L'iniezione di perivitellino di vettori lentivirali permette rendimenti elevati nella produzione di animali transgenici che sono sopra il 70% degli animali nati. Tale rendimento è oltre 10 volte superiore rispetto al rendimento migliore che può essere raggiunto utilizzando standard pronuclei DNA iniezione7,10,11. In questo contesto, una singola sessione di iniezioni genererà almeno 50 transgenici fondatori (F0). Il gran numero di fondatori è, pertanto, compatibile con fenotipizzazione del transgene effetto possono essere effettuata direttamente su F0 topi senza la necessità di generare linee di topi transgenici. Questo vantaggio permette per screening rapido dell'effetto del transgene ed è stato adattato da eseguire in vivo guadagno e la perdita della funzione studia in settimane. Inoltre, elementi regolatori del DNA possono anche essere rapidamente schermati per mappa esaltatori e DNA motivi vincolati dalla trascrizione fattori11,12. Con iniezioni di pronuclei, transgeni integrano solitamente come più copie di un unico locus. Con vettori lentivirali, integrazione si verifica in luoghi multipli come una singola copia per locus10,13. Pertanto, la molteplicità di loci integrati è probabilmente associati alla penetranza di altissima espressione osservata nei fondatori transgenici, che rende più robusto il nuovo modello generato.
Cosa importante, quando si utilizza pronuclei iniezione del DNA, visualizzazione dei pronuclei durante la procedura è assolutamente necessaria. Questa limitazione tecnica impedisce l'utilizzo di ovociti fecondati provenienti da una grande varietà di ceppi di topi. Di conseguenza, la produzione di un modello transgenico in uno specifico ceppo per cui pronuclei sono invisibili richiede la produzione di animali in un ceppo permissivo seguita da almeno 10 successive reincroci per trasferire il transgene nel topo desiderata ceppo. Con le iniezioni di vettore lentivirale, spazio perivitellino è sempre visibile e l'iniezione non richiede competenze altamente specifiche. Ad esempio, topi transgenici NOD/SCID che non sono appropriati per l'iniezione di pronuclei sono stati ottenuti con il vettore virale iniezioni14.
Qui, un protocollo completo viene visualizzato per consentire la semplice produzione di topi transgenici con iniezioni di vettore lentivirale nello spazio perivitellino di un embrione di fase di una cella. Controllata sia con l'espressione del transgene onnipresente o promotori specifici delle cellule è descritto in dettaglio.
La spina dorsale di vettori lentivirali di ΔU3 pTrip è stata utilizzata in questo studio15. Questo vettore permette per la produzione di vettori lentivirali difettoso di replica in cui la sequenza di U3 è stato parzialmente eliminata per rimuovere l'attività del promotore U3 e generare un self-inattivazione di vettore (SIN)16. Scorte di vettore lentivirale sono state prodotte da transitori di transfezione delle cellule HEK 293T con il p8.91 incapsulamento plasmide (ΔVpr ΔVif ΔVpu ΔNef)6, pHCMV-G codifica la stomatite vescicolare (VSV) virus glicoproteina-G17e il ΔU3 di pTRIP vettore ricombinante. La procedura dettagliata di produzione viene fornita come metodi supplementari.
Produzione delle scorte di vettore lentivirale alto titolo viene eseguita in condizioni di biosicurezza livello II (BSL-2). Questo è vero per la maggior parte dei transgeni ad eccezione di oncogeni che devono essere prodotti in BSL-3. Di conseguenza, la produzione in condizioni di BSL-2 per la maggior parte dei casi è sufficiente. Inoltre, l'uso e la produzione sono solitamente disconnesso per la maggior parte delle agenzie di regolamentazione nazionale, a che fare con organismi geneticamente modificati (OGM). Quantità limitate di vettori lentivirali di peccato incompetenti di replica (sotto 2 µ g di proteina del capside p24) può essere utilizzato in condizioni di BSL-1 come descritto dall'Agenzia francese OGM in accordo con le raccomandazioni dell'Unione europea.
Protocollo
Tutte le procedure che includono lavoro animale hanno ottenuto l'approvazione etica e sono state autorizzate dal Ministero francese della ricerca e dell'istruzione sotto il numero APAFIS n. 5094-20 16032916219274 v6 e 05311.02. La struttura animale ICM PHENOPARC è stato accreditato dal Ministero francese dell'agricoltura sotto il numero di accreditamento B75 13 19. Il protocollo generale richiede l'esecuzione di ogni procedura entro un lasso di tempo preciso riepilogati nella Figura 1.
1. animale acquisto e preparazione di composti basici
- Acquisto degli animali
- Ordine di 25 maschi vasectomia B6CBAF1/JRj che sono 8 settimane di età (generazione F1 da originale attraversa tra ♀C57Bl/6JRj e ♂CBA/JRj).
Nota: Isolare i maschi all'arrivo. Vasectomia maschi possono essere riutilizzati per almeno un anno.
Cambiare le gabbie ogni 3 settimane. - Ordine di 50 B6CBAF1/JRj femmine che sono 10 settimane di età e di mantenere un pool di almeno 50 animali.
- Ordine di 10-15 C57BL/6JRj maschi fertili che sono 8 settimane di età.
- Ordinare 30 femmine C57BL/6JRj che sono 4 settimane di età.
- Ordine di 25 maschi vasectomia B6CBAF1/JRj che sono 8 settimane di età (generazione F1 da originale attraversa tra ♀C57Bl/6JRj e ♂CBA/JRj).
- L'anestesia e l'eutanasia
- L'anestesia viene eseguita utilizzando un volume di 300μL chetamina/xilazina mix, iniettato intraperitonealmente (ketamina ad una dose del peso corporeo di 150μg/g, xilazina ad una dose di 0.15μg / g di peso corporeo). Gli animali sono posti sotto il termoforo per regolare la temperatura corporea. Controllare i riflessi pizzicando la coda dell'animale prima dell'inizio della procedura.
- L'eutanasia è stata eseguita da dislocazione cervicale. Decapitazione era inclusa come un metodo secondario per confermare la morte dell'animale. L'eutanasia degli embrioni è stata eseguita per decapitazione.
Nota: All'arrivo, gli animali ammessi un minimo di 1 settimana a habituate all'alloggio (nessuna manipolazione o accoppiamento). Cosa importante, qualsiasi ceppi murini comprese linee transgeniche possono essere utilizzate come fertili maschi e femmine fertili per superovulazione. La scelta di sforzo dovrebbe essere fatto secondo i requisiti della questione scientifica.
- Preparazione dell'ormone
- Aggiungere 910 µ l di tampone PSMG (incinta Mare siero gonadotropina) in 1 fiala Liofilizzato di PMSG, rendere aliquote di 100 µ l e conservare a-20 ° C.
Nota: Ciascuna aliquota contiene 55 UI per 11 topi. Mai tenere PMSG aliquote per più di 2 settimane dopo il primo utilizzo. - Aggiungere liofilizzato 2730 µ l di tampone di hCG (gonadotropina corionica umana) in 1 flaconcino di hCG. Aliquote di 100 µ l di fare e conservare a-20 ° C.
Nota: Ciascuna aliquota contiene 55 UI per 11 topi.
- Aggiungere 910 µ l di tampone PSMG (incinta Mare siero gonadotropina) in 1 fiala Liofilizzato di PMSG, rendere aliquote di 100 µ l e conservare a-20 ° C.
- Preparazione di ialuronidasi
- 1 flaconcino di ialuronidasi con 3 mL di terreno di M2 per ottenere un 10 mg/mL soluzione di riserva e rendere aliquote di 50 µ l di ricostituire. Quindi conservare a-20 ° C.
- Preparazione all'intervento di strumenti
- Sterilizzare tutti gli strumenti di chirurgia utilizzando l'autoclave.
2. superovulazione dei donatori femminile
- In una struttura animale utilizzando 12h giorno - cicli di notte, iniettare PMSG al 14 giorno -3. Iniettare hCG alle 12 il giorno -1 e accoppiamento con i maschi fertili appena dopo l'iniezione di hCG.
- Il giorno -3, aggiungere 1 mL di soluzione sterile di NaCl 0,9% in 1 aliquota di 100 µ l di PMSG (55 UI). Iniettare 10 C57BL/6JRj femmine con 100 µ l intraperitonealmente usando una siringa senza qualsiasi volume morto.
Nota: Ogni mouse riceverà 5 UI di PMSG. - Il giorno -1, aggiungere 1 mL di soluzione sterile di NaCl 0,9% in 1 aliquota di 100 µ l di hCG (55 UI). Iniettare i topi che hanno ricevuto l'iniezione di PMSG con 100 µ l di soluzione diluita di hCG (5UI) intraperitonealmente. Utilizzare una siringa senza qualsiasi volume morto. Eseguire l'iniezione lentamente e aspettare prima di rimuovere l'ago in modo che il liquido non ci siano perdite.
Nota: Ogni mouse riceverà 5 UI di hCG. Iniezione di hCG dovrebbe essere eseguita 46 h dopo PMSG. - Posizionare ogni femmina C57BL/6JRj nella gabbia del maschio stallone direttamente dopo l'iniezione di hCG.
- Controllare spine vaginali la mattina del giorno 0 e utilizzare le femmine positive per raccogliere le uova fecondate.
3. preparare le femmine Pseudopregnant B6CBAF1/jRj
- Accoppiare un maschio vasectomia il giorno prima della raccolta delle uova (giorno -1) con 2 B6CBAF1/JRj femmine alle 17.
Nota: È molto importante per accoppiarsi con le femmine che sono provenienti da gabbie diverse per evitare la sincronizzazione dei cicli femminili. Ciò consentirà di aumentare il rendimento di ottenere spine vaginali. Inoltre, non aggiungere una femmina a una gabbia maschio che è stata modificata negli ultimi 2 giorni. Efficacia del comportamento riproduttivo nei maschi è aumentata quando la gabbia è sporca.
4. fecondati collezione
- Preparazione
- µ L 1450 di M2 per soluzione di riserva di ialuronidasi per preparare la soluzione di lavoro di ialuronidasi.
- Depositare una goccia di 100 µ l di soluzione di lavoro di ialuronidasi per femmina utilizzata per produrre le uova fecondate in un 100mm di Petri e conservare a temperatura ambiente.
- Aggiungere 500 µ l di M16 in lastre di 4 pozzi. Utilizzare 2 pozzi per ogni tipo di vettori lentivirali che verrà iniettato: uno ben conterrà le uova iniettate e l'altro quelli non-iniettato. Posizionare le piastre di bene 4 nell'incubatore a 37 ° C con un 5% CO2 ambiente.
- Preparare pipette per la raccolta ed il trattamento degli embrioni.
- Ammorbidire i capillari di vetro dell'ematocrito (75 mm/60 µ l) ruotando il centro del tubo capillare di vetro duro nella fiamma.
- Togliere i capillari dal fuoco nel minor tempo possibile e tirare per ottenere un tubo con diametro interno di circa 300 µm. Pull sul tubo raffreddato per ottenere una pausa ordinata.
- Raccogliere ovidotti.
- Eutanasia C57BL/6JRj femmine di dislocazione cervicale alle 9 il giorno 0. Morte è confermata dalla decapitazione.
Nota: Questo metodo di eutanasia è stato approvato dal IACUC e segue le raccomandazioni europee. - Eseguire una grande incisione orizzontale per aprire la cavità addominale con le forbici. Ovidotto è situato tra l'utero e l'ovaia.
- Rimuovere il Mesometrio e la membrana che trasportano vasi sanguigni prominenti con forcipe curvo.
- Separare l'ovidotto dall'ovaia con forcipe curvo.
- Utilizzare forcipe curvo come guida per tagliare l'ovidotto dall'ovaia usando forbici curve.
- Tirare l'ovidotto e tagliare dall'utero con forbici curve.
Attenzione: Non toccare il ampulla gonfio che contiene le uova fecondate. Eseguire l'intera procedura utilizzando strumenti sterili. - Posto ovidotti tutti raccolti nel terreno di M2 (piastra di coltura di 35 mm) a temperatura ambiente
- Posto 2 ovidotti nello stesso calo di 100 µ l di soluzione di lavoro di ialuronidasi (0,3 mg/mL).
- Eutanasia C57BL/6JRj femmine di dislocazione cervicale alle 9 il giorno 0. Morte è confermata dalla decapitazione.
- Rimuovere le cellule del cumulo da uova fecondate.
- Sotto un microscopio stereoscopico, utilizzare 2 siringhe da insulina: il primo a tenere l'ovidotto e quello secondo per strappare il ampulla e disperdere fecondato uova in soluzione di lavoro di ialuronidasi.
- Prendere la pipetta di vetro preparato per la raccolta uova e collegarlo al tubo e un filtro di 0,22 μm montato sul boccaglio per aspirare tutte le uova. Raccogliere tutte le uova e lavarli dal successivo passaggio in 6 diverse gocce di 100 µ l di terreno di M2.
- Posto lavato le uova fecondate in incubatrice umidificata 37 ° C con un'atmosfera di 5% CO2 nel mezzo di M16.
5. fare iniezione pipette
- Utilizzare tubazione capillare di vetro sottili (10-15 cm di lunghezza) con un diametro esterno di 1 mm e fissare questo capillare nel estrattore orizzontale micropipetta.
Nota: In pullers pipetta più orizzontale, 3 parametri possono essere regolati: potenza termica, tirando forza e tempo di ritardo tra riscaldamento e tirando. Modificare questi parametri per ottenere pipette d'iniezione simile a quello presentato nella Figura 2A. Per gli utenti che eseguono regolarmente la microiniezione di DNA, utilizzare le impostazioni standard e regolare il ritardo tra riscaldamento e tirando per modificare la forma globale della punta della pipetta.
6. fare Holding pipette
- Utilizzare una pipetta di iniezione per preparare la pipetta di supporto.
- Allegare una pipetta di iniezione per un microforge. Tagliare la pipetta con il microforge per ottenere una punta affilata simmetrica di 80-100 µm di diametro. Lucidare la punta con calore su microforge per ottenere una forma rotonda simmetrica senza siepi taglienti.
7. preparazione della pipetta di iniezione che contiene il vettore lentivirale
- Centrifugare la sospensione di vettore lentivirale a 160 x g per 2 min a pellet detriti spesso presenti negli stock di vettori lentivirali congelati.
- Recuperare il supernatante e trasferirlo in una nuova provetta 0,5 mL in una classe di sicurezza II gabinetto.
- Trasferire 1 µ l di supernatante di una pipetta di iniezione preparata come descritto nel passaggio 5 utilizzando un Micro-loader.
- Impostare la pipetta di iniezione il possessore dello strumento del micromanipolatore giusto. Collegare la pipetta che tiene il micromanipolatore di sinistra.
Nota: Il titolo di trasduzione del vettore lentivirale sarà direttamente correlato con l'efficacia della produzione del fondatore. Per alta efficienza (> 70%), utilizzare vettori virali con un titolo nella gamma di 100 ng di p24 del capsid proteina / µ l. Quando il titolo è espresso in unità di trasduzione (TU), il titolo dovrebbe essere superiore a 109 TU/mL. Scorte di vettore lentivirale devono essere prodotta mediante trasfezione transiente di cellule 293T con il plasmide encapsidation p8.91, pHCMV-G, codifica la stomatite vescicolare (VSV) virus glicoproteina-G come descritto in metodi supplementari18.
8. micro-iniezione
- Erogare 8 µ l di terreno di M2 nel centro di una diapositiva di depressione e coprire con olio di paraffina leggera (embrione testato) per evitare l'evaporazione.
- Posto 20 uova nella goccia come meno disperse come possibile.
Attenzione: Non fare bolle al momento del deposito degli embrioni. - Assicurarsi che la punta della pipetta di iniezione è aperta. In caso contrario, toccare la pipetta di iniezione con la pipetta di supporto.
- Impostare il microinjector per un tempo di iniezione di 20 s.
Nota: La viscosità della sospensione virale permette la chiara visualizzazione della dispersione del vettore virale nello spazio perivitellino. La pressione di iniezione deve essere regolata al fine di riempire tutto lo spazio all'interno di 20 s di iniezione, che rappresenta un volume di 10-100 PL. Pressione di iniezione non deve superare 600 hPa. - Aspirare un uovo fertilizzato che contiene 2 nuclei pro e 2 corpi polari con la pipetta di supporto sotto lo stereomicroscopio.
- Iniettare l'uovo con il microinjector usando le impostazioni descritte in 8.4, nello spazio perivitellino.
Attenzione: Non toccare la membrana plasmatica con pipetta di iniezione. - Iniettare tutto fecondate uova disponibili in lotti di 20 uova e sistemate le uova iniettate immediatamente in pre-riscaldato M16 medio nell'incubatrice umidificata 37 ° C con un'atmosfera di 5% CO2.
Nota: Incubare le uova iniettate per un minimo di 30 minuti dopo l'iniezione prima di trasferimenti di embrioni.
9. trasferimento di embrioni in femmine Pseudopregnant B6CBAF1/JRj
- Controllare la spina di copulazione 16 h dopo l'accoppiamento le femmine B6CBAF1/JRj con i maschi B6CBAF1/JRj vasectomia. Farlo appena prima di iniziare la raccolta delle uova.
- Prepararsi pipette l'impianto dell'embrione iniettato.
- Fare pipette di impianto degli embrioni come descritto per il prelievo e la manipolazione di embrioni (punto 4.2). Selezionare pipette con diametro interno di circa 150 µm con una parte più stretta circa 4-5 cm di lunghezza.
Nota: La punta dovrebbe essere fiamma lucidata, al fine di ridurre i possibili danni per le uova o ovidotto.- Riempire con olio di paraffina leggera (embrione testato) appena sopra la spalla di pipetta.
- Aspirare una piccola bolla d'aria, poi M2 medium, e infine una seconda bolla d'aria.
- Redige gli embrioni uno dietro l'altro per ridurre al minimo il volume totale del mezzo che verrà iniettato nell'ovidotto insieme con gli embrioni.
- Finitura caricando una molto piccola goccia di olio di paraffina leggera (embrione testato) della larghezza di circa un embrione.
Attenzione: Siate gentili mentre si maneggia la pipetta.
- Fare pipette di impianto degli embrioni come descritto per il prelievo e la manipolazione di embrioni (punto 4.2). Selezionare pipette con diametro interno di circa 150 µm con una parte più stretta circa 4-5 cm di lunghezza.
- Trasferimento dell'embrione.
- Sterilizzare tutti gli strumenti.
- Anestetizzare la femmina usando un'iniezione intraperitoneale di 300 μL di soluzione sterile di 0,9% di NaCl contenente 150 μg / g del peso corporeo di ketamina e 0,15 μg / g del peso corporeo di xilazina.
- Verificare la profondità dell'anestesia pizzicando la coda dell'animale con il forcipe e iniettare subcutaneouly 0,1 mg/kg di analgesico (buprenorfina) prima dell'inizio della procedura.
- Barba di 2 cm su entrambi i lati della parte posteriore lungo il midollo spinale al livello dell'ultima costola.
- Posizionare il mouse femmina su un rilievo di riscaldamento e di un campo sterile. Tagliare una finestra di 2 x 2 cm al centro della schiena del mouse.
- Applicare una soluzione antisettica (10% di ioduro di Povidone) sulla pelle e fare un'incisione trasversale di 1 cm con le forbici, quindi far scorrere la pelle lateralmente fino a quando l'ovario (colore arancione) è visibile attraverso la parete del corpo.
- Fare un'incisione di 5 mm nella parete del corpo appena sopra l'ovaia con le forbici bene sotto un microscopio operatorio binoculare.
- Pick up il cuscinetto di grasso con un morsetto di bulldog atraumatiche e tirare fuori l'ovaia, l'ovidotto e la parte superiore dell'utero.
- Visualizzare il ampulla e fare un hemisection con le forbici di Allerød sul segmento ovidotto che collega l'ovaio al ampulla.
- Introdurre la pipetta per l'embrione e consegnare le uova nel ampulla, fermandosi presso la bolla d'aria prima della pipetta di impianto.
- Ripetere la procedura sul secondo ovidotto.
- Chiuda la pelle con clip di ferita.
- Posto l'animale nel recupero dell'alloggiamento (39 ° C, 30-60 min) fino a quando è completamente sveglio.
- Ripetere l'iniezione di analgesici dopo 12 ore e 48 ore in caso di segni di dolore o angoscia.
- Rimuovere le graffe di ferita 7-10 giorni dopo la chirurgia.
- Verifica le femmine impiantate per gravidanza seguendo la loro curva di peso ogni 3 giorni dopo l'impianto. Un aumento di peso significativo può essere osservato da 10 a 12 giorni dopo l'impianto e sarà indicativo per la gravidanza.
Nota: Tutti gli embrioni che si svilupperanno qui volontà rappresentano presunti fondatori transgenici. Il fenotipo di questi fondatori possa essere analizzato durante le fasi di sviluppo o dopo la nascita secondo la domanda scientifica legata alla generazione di questi animali transgenici.
10. genotipizzazione transgenici fondatori
- Preparare il tampone di genotipizzazione contenente 10 mM Tris-HCl, pH 8; 5 mM EDTA, pH 8.0 con 0,2% SDS (w/v), 50 mM NaCl. Sterilizzare il buffer di genotipizzazione attraverso un filtro di 0,22 µm e conservare a temperatura ambiente per diversi mesi.
- Messa Membrane Extraembrionali (per gli embrioni) o piccolo pezzo di coda (per gli animali nati) in 500 µ l di filtrato buffer di genotipizzazione e aggiungere 15 µ l di proteinasi K (20 mg/mL). Incubare per una notte a 55 ° C.
- Centrifugare il lisato a 15.000 x g per 5 min e quindi utilizzare 1 µ l di supernatante per la reazione di PCR. Lysate può essere memorizzato a 4 ° C per diversi mesi.
- Eseguire l'amplificazione di PCR di un frammento del transgene in un 20 µ l di reazione contenente 1 x PCR buffer, 1.5 mM MgCl2, 200 µM di dNTPs, 0,2 µM ciascuna degli iniettori di PCR, 1 UI di Taq DNA polimerasi e 1 µ l di ciascun campione digerito. Come controllo negativo, usare 1 µ l di H2O. Come controllo positivo, è necessario utilizzare DNA dal plasmide vettore lentivirale contenente il transgene.
- Per il rilevamento di eGFP descritto uso:
eGFP Forward Primer: 5' GACCACATGAAGCAGCACGACTTCT 3'
eGFP Reverse Primer: 5' TTCTGCTGGTAGTGGTCGGCGAGCT 3' - Eseguire l'amplificazione di PCR in un termociclatore: 4 min a 94 ° C, seguita da 35 cicli di 1 min a 94 ° C, 1 min a 60 ° C e a 2 minuti a 72 ° C.
- Caricare il prodotto PCR su un gel di agarosio al 2% al fine di visualizzare un 300 prodotto di PCR eGFP bp come illustrato nella Figura 2B.
Nota: Tutti gli individui mostrando una band PCR bp 300 hanno integrato il transgene eGFP e possono essere considerati come transgenica. - Analizzare l'espressione del transgene in animali transgenici. Ad esempio, eseguire istologico e immunostaining come illustrato in Figura 3 e Figura 4 e descritta nei metodi supplementari.
Nota: Sia analisi di espressione del transgene e fenotipo analisi deve essere eseguite utilizzando metodi pertinenti secondo la domanda scientifica globale.
11. quantificazione del numero di copie del Transgene
- Preparare i campioni di DNA per PCR quantitativa.
- Estrarre il DNA genomico (gDNA) dalla proteinasi K lisato ottenuto nel passaggio 10.3 utilizzando un kit commerciale secondo le istruzioni del produttore.
- Quantificare gDNA mediante spettrofotometria a 260 nm.
- Diluire ogni campione gDNA a una concentrazione finale di 10 ng / µ l.
- Per ogni campione, preparare 5 diluizioni seriali (1:5) in H2O per ottenere 6 tubi alle seguenti concentrazioni: 10 ng / µ l, 2 ng / µ l, 0,4 ng / µ l, 0,08 ng / µ l, 0,016 ng / µ l e 0.0032 ng / µ l
- Preparare la miscela di reazione PCR (qPCR) quantitativa.
- Preparare il mix di primer per qPCR. Per ogni coppia di primer da utilizzare per qPCR, aggiungere 10 µ l di primer forward (soluzione di riserva di primer 100 µM), 10 µ l di primer reverse (100 µM) e 80 µ l di H2O.
Nota: Per amplificare eGFP, utilizzare primer Forward TCCAGGAGCGCACCATCTTCTTCA e Reverse TTGATGCCGTTCTTCTGCTTGTCG. Gene CDX2 viene usato come normalizzatore per qPCR (2 copie per genoma). Per Cdx2 normalizzatore utilizzare primer Forward GCCAGGGACTATTCAAACTACAGG e Reverse GACTTCGGTCAGTCCAGCTATCTT - Preparare 2 miscele di qPCR, uno con il mix di primer eGFP e uno con mix di primer Cdx2. Preparare la miscela di qPCR sufficiente per amplificare le 6 diluizioni in duplicati di ogni gDNA. Una reazione di qPCR contiene 3,8 µ l di H2O, 5 µ l di verde fluorescente 2 x mix di reazione e 0,2 µ l di miscela primer.
Nota: Per ogni animale transgenico testare, verranno eseguite 24 reazioni di qPCR. La miscela di reazione viene fornita per una macchina di qPCR ben 384. - Per ogni animale testare, distribuire: 12 pozzi con 9 µ l di miscela di qPCR eGFP e 12 pozzi con 9 µ l di miscela di qPCR Cdx2. Aggiungere 1 µ l di ciascuna diluizione gDNA a 2 pozzetti contenenti il mix di qPCR eGFP e 2 pozzetti contenenti il mix di qPCR eGFP.
- Lasciare 2 pozzetti per ogni qPCR mescolano in cui gDNA era sostituire di H2O come controllo negativo.
- Preparare il mix di primer per qPCR. Per ogni coppia di primer da utilizzare per qPCR, aggiungere 10 µ l di primer forward (soluzione di riserva di primer 100 µM), 10 µ l di primer reverse (100 µM) e 80 µ l di H2O.
- Posizionare la piastra ben 384 nella macchina qPCR e applicare il seguente protocollo di esecuzione: 10 min a 95 ° C quindi 50 cicli di 10 s a 95 ° C e 1 min a 60 ° C.
- Analizzare i dati. Per ogni gDNA testare, tracciare i valori di Ct come una funzione del Log dell'importo totale gDNA (6 punti in duplicati). Montare la curva di regressione lineare con il metodo di minimi quadrato ed estrapolare il valore Ct corrispondente l'intercetta con l'asse y. Utilizzare i valori di Ct estrapolati per eGFP e il Cdx2 normalizzato per calcolare il numero di copie di eGFP relativo Cdx2 (2 copie) utilizzando il metodo standard 2ΔdCt 11.
Risultati
Gli animali transgenici sono stati generati utilizzando il protocollo presentato qui. Rappresentante risultati sia onnipresente ed espressione del transgene specifico tipo cella sono illustrati.
Espressione costitutiva di transgeni
Onnipresenti promotori sono strumenti di ricerca di base per esprimere transgeni in maniera duratura ed efficiente. Tali promotori sono utilizzati per una grande varietà di applicazione da transfezione in vitro delle cellule di transgenesi in vivo negli animali piccoli e grandi.
Vettori lentivirali sono stati costruiti per esprimere il gene reporter fluorescente verde (eGFP) sotto il controllo del promotore del citomegalovirus (CMV) o il promotore composito che CAG basata sulla fusione del pollo actina promotore e il rinforzatore di CMV. Entrambi i vettori lentivirali sono state prodotte (metodi supplementari) e il titolo è stato determinato in cellule 293T come unità di trasduzione (TU) basato sull'espressione di eGFP. Entrambi vettore lentivirale costrutti sono stati iniettati nello spazio perivitellino di ovociti fecondati ad una concentrazione di 109 TU/mL e impiantati in topi femminili pseudo-incinto. Embrioni impiantati erano successivamente raccolte appena prima della nascita e genotipizzati mediante PCR a seguire eGFP integrazione. 73% (n = 22) e l'83% (n = 32) degli embrioni raccolti aveva integrato il transgene per il CMV e il costrutto lentivirale di CAG, rispettivamente (tabella 1). Embrioni transgenici sono stati poi sezionato e immuno-macchiato per eGFP. Come illustrato nella Figura 3, solo le cellule positive di eGFP sparsi sono osservate con il promotore CMV (Figura 3, pannello superiore) considerando che tutte le cellule hanno espresso GFP quando il promotore CAG è stato utilizzato (Figura 3, pannelli centro e in basso).
Con il promotore CAG, 96% degli embrioni transgenici raccolti espressa ubiquitariamente il transgene eGFP (tabella 1). Sebbene entrambi i promotori sono onnipresenti, solo il promotore CAG è in grado di espressione robusta unità del transgene in tutte le cellule. Promotori onnipresenti alternativi sono stati utilizzati come chinasi di phosphoglycerate (PGK) e promotori ubiquitina-C e dato simili risultati come quelli ottenuti con il promotore CAG con più bassi livelli di espressione di eGFP (dati non mostrati).
In vivo mappatura delle regioni genomiche normative per testare gli elementi di controllo specifico tessuto.
Per un gran numero di applicazioni, è necessaria l'espressione dei transgeni in modo specifico delle cellule in animali transgenici. Inoltre, la generazione di animali transgenici può essere altamente strumentale allo schermo la capacità di frammenti di DNA genomici regolamentazione putativi di controllare l'espressione specifica delle cellule di un dato gene. Ad esempio, lentivirali mediata produzione di animali transgenici è stato utilizzato per mappare specifici rinforzatori di cellule che controllano neurogenina 3 (Neurog3) espressione11. Neurog3 è un fattore di trascrizione dell'elica-ciclo-elica (bHLH) di base che controlla l'impegno dei progenitori del pancreas verso il destino endocrino. In topi mutanti privi di Neurog3 , nessun cellule endocrine del pancreas possono differenziare19. Un frammento di DNA di 2,2 kb localizzato tra le posizioni-5284 e-3061 relativa trascrizione Neurog3 avviare il sito è stato clonato in un vettore lentivirale a Monte che un promotore minimo di beta globina all'espressione di unità di un gene reporter eGFP come descritto in precedenza 11. un costrutto di controllo allo stesso modo è stato generato mediante la clonazione di un frammento intergenica 2.4 kb localizzato sul cromosoma mouse 6 (chr6: 14237279-14239685 relativo assembly di genoma del mouse mm9) nella spina dorsale lentivirale stessa. Questa regione genomica è localizzata all'interno di un 1 mega-base gene lungo il deserto fra i geni Gpr85 e Ppp1r3a . Vettori lentivirali di alto titolo successiva sono state prodotte utilizzando costrutti e denominati Neurog3- enh-eGFP e Chr6-eGFP.
Entrambi i vettori lentivirali sono stati costruiti e prodotto (metodi supplementari). Poiché nessun cellule che esprimono Neurog3 erano attualmente disponibili, non è possibile determinare il titolo TU. In alternativa, il titolo è stato misurato come concentrazione della proteina del capside p24. I 2 vettori sono stati iniettati nello spazio perivitellino di ovociti fecondati e impiantati in topi femminili pseudo-incinto. Gli embrioni impiantati sono stati raccolti a giorno embrionale 14,5 (e 14.5) come questo stadio di sviluppo corrisponde all'espressione massima di Neurog3 nel pancreas. Embrioni successiva sono stati genotipizzati per seguire eGFP integrazione. 84% (n = 47) e il 71% (n = 48) degli embrioni raccolti aveva integrato il transgene per Neurog3- enh-eGFP e costrutti lentivirali Chr6-eGFP rispettivamente (tabella 1). Per ciascun embrione, il germoglio pancreatico è stato dissecato e poi sezionato per eseguire immunostaining. 92% di Neurog3- enh-eGFP embrioni transgenici espresso eGFP nel pancreas come illustrato nella Figura 4 pannello superiore (rappresentante immunostaining). D'importanza, la stragrande maggioranza di eGFP positivo cellule erano inoltre le cellule esprimenti Neurog3 (Figura 4) che indica che il 2.2 kb Neurog3 enhancer è in grado di limitare l'espressione di eGFP all'interno della popolazione di cellule Neurog3 . Dall'opposizione, nessuno degli embrioni Chr6-eGFP espresso eGFP (pannello inferioreFigura 4 e tabella 1) nel pancreas o di fuori del pancreas. Inoltre, nessuna espressione ectopica di eGFP è stata osservata di fuori del pancreas in Neurog3- enh-eGFP embrioni11.
Per i 4 esperimenti presentati sopra, una precisa descrizione quantitativa di ogni passaggio della procedura è presentata nella tabella 1. Ciò illustra l'efficacia globale della procedura. Infatti, quando si confrontano i numeri degli animali raccolti integrato il transgene con il numero uova fecondate iniettate, il rendimento globale della procedura è 44% in media. La stessa resa con un'iniezione di DNA pronuclei di un costrutto contenente il rinforzatore di Neurog3 fuso per il reporter di beta-galattosidasi non superi il 3,1%.
Trasduzione di ovociti fecondati con un vettore lentivirale conduce all'integrazione del transgene che possa verificarsi in più siti10,13. Il numero relativo di siti di integrazione del transgene sono stato valutato mediante PCR quantitativa su DNA genomico (Figura 5). Quantificazione di eGFP integrazione è stato determinato mediante PCR quantitativa (qPCR) e normalizzato al gene Cdx2 che è presente in 2 copie per genoma come descritto in precedenza11. Il numero medio dei siti di integrazione era 19.36 ± 2.468 (s.e.m.) e ± 9.537 1,186 (s.e.m.) in embrioni generati da Neurog3- enh-eGFP e costrutto Chr6-eGFP, rispettivamente. È interessante notare che, i due vettori lentivirali utilizzati per produrre questi animali ha presentato diversi titoli virali. La concentrazione di proteina del capside p24 erano di 124 ng / µ l per Neurog3- enh-eGFP vettoriale e di 52 ng / µ l per il controllo vettoriale Chr6-eGFP. È più probabile che tale differenza di titolo rappresenteranno la differenza significativa osservata in numeri del sito di integrazione in entrambi la popolazione di embrioni transgenici (Figura 5). Ciò suggerisce che il numero medio dei siti di integrazione ottenuti in un batch di topi transgenici fondatore potrebbe essere modulato tramite stock virali con titoli diversi.
D'importanza, è stata osservata alcuna correlazione diretta tra l'espressione di eGFP in Neurog3- enh-eGFP embrioni transgenici e il numero di copie del transgene che sono stati integrati. In altre parole, gli embrioni che integrato singole o più copie del transgene - enh-eGFP Neurog3allo stesso modo sono stati trovati per eGFP espressa in cellule positive Neurog3.

Figura 1: diagramma di flusso della procedura generale Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Preparare la microiniezione pipette e genotipizzazione.
(A) disegni schematici di microiniezione pipette per evidenziare le principali differenze tra pipette usate per DNA o iniezioni di vettore lentivirale. Pannello sinistro: viene disegnata la forma complessiva di entrambi i tipi di pipetta. Il cerchio con tratteggio evidenzia l'area allargata della punta della pipetta. Foto delle punte di pipetta inoltre è presentati. Si noti che per iniezione lentivirali la punta deve essere rotto come indicato con la linea tratteggiata e l'immagine corrispondente. Pannello di destra: esempio di iniezione uovo impostazione con la pipetta della holding sulla sinistra, l'ovulo fecondato e pipetta di iniezione sia in un pronucleo o nello spazio perivitellino. Scala bar = 50 µm. (B) visualizzazione su gel di agarosio di prodotto di PCR di eGFP amplificati da DNA genomico Estratto da 8 diversi embrioni (corsie 1 e 8). Solo gli embrioni 1, 2, 3, 5, 6 e 8 avevano integrato il transgene eGFP. Il DNA del plasmide pTrip PGK-eGFP utilizzati per la produzione del vettore lentivirale è stato utilizzato come controllo positivo di PCR. Per il controllo negativo, H2O sostituito il DNA nella reazione di PCR. MWM: marcatore di peso molecolare. BP = coppia di basi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Promotori onnipresenti guidare espressione del reporter eGFP in embrioni transgenici.
10 µm cryo-sezioni di embrioni transgenici sono stati macchiati per visualizzare espressione di eGFP (verde) e nuclei (blu). Costruire gli embrioni generati con il promotore CMV lentivirale (parte superiore sinistra dell'etichetta) sono stati raccolti presso E11.5. Gli embrioni generati con il costrutto CAG promotore lentivirale (etichetta inferiore sinistra) sono stati raccolti a E18.5. PB: germoglio pancreatico, VSC: ventrale del midollo spinale, Vt: vertebra, Li: fegato, Ms: muscoli della cintura addominale. Scala bar = 50 µm Clicca qui per visualizzare una versione più grande di questa figura.
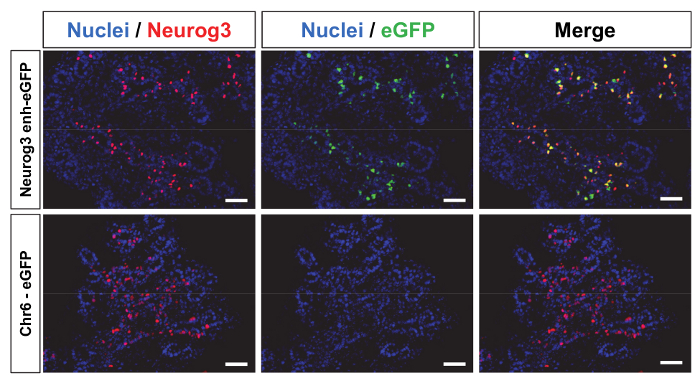
Figura 4: Espressione specifico delle cellule del gene del reporter in embrioni transgenici è guidato dall'enhancer Neurog3 . 10 µm cryo-sezioni di gemme pancreatici e 14.5 degli embrioni transgenici sono stati macchiati per visualizzare l'espressione di Neurog3 (rosso), eGFP (verde) e nuclei (blu) come descritto in metodi supplementari). Neurog3 espressione è sparsi nel pancreas. Embrioni transgenici che integrato il Neurog3- enh-eGFP costruire eGFP espressa e la maggior parte delle cellule positive eGFP Neurog3 positivo (pannello superiore). Gli embrioni generati con il costrutto Chr6-eGFP non erano che esprimono eGFP (pannello inferiore). Scala bar = 50 µm Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: numero di copia relativa di transgeni integrato. Quantificazione dei siti di integrazione di eGFP rispetto al gene CDX2 come descritto nella sezione protocollo. Box-plot da 25th al 75° percentile superiore. I punti rappresentano diversi embrioni transgenici sono stati generati. Il confronto dei siti di transgeni integrato tra i due costrutti lentivirali è significativamente diverso (t-test parametrico spaiati, p = 0,001). Clicca qui per visualizzare una versione più grande di questa figura.

Tabella 1: relazione quantitativa passo dopo passo durante la procedura completa. Nel corso della procedura, il numero totale di uova o embrioni sono stato contato. La prima colonna rappresenta il numero totale di uova che sono stati recuperati da ovidotti delle femmine superovulated. Deselezionare solo uova con 2 corpi polari e/o visibile pronuclei sono stati iniettati e sono segnalati. Dopo l'iniezione e un paio d'ore nella cultura sono stati impiantati solo l'iniettato uova che non sono state fatte l'elettrolisi e aveva una morfologia normale. Successivamente il numero totale di embrioni che sono stati raccolti dalle femmine pseudopregnant è contato. Infine, gli embrioni che avevano integrato il transgene ed esprime il reporter sono elencati nelle ultime due colonne. Le stesse caratteristiche sono anche dato per confronto con un esperimento che utilizza l'iniezione di DNA standard pronuclei. Qui il transgene conteneva il rinforzatore di Neurog3 espressione di un gene del reporter beta-galattosidasi (Neurog3- enh-LacZ) di guida. Per favore clicca qui per scaricare questo file.
Discussione
L'iniezione di perivitellino di vettori lentivirali in ovociti fecondati qui descritti ha provocato la produzione di embrioni transgenici che ha reso più del 70% degli embrioni transgenici rispetto al numero totale di embrioni raccolti. Questo risultato è coerenza con i rapporti precedenti ed esemplifica la specificità della procedura2,7,10,11,12. Quando si confrontano tutti i dati presentati nella tabella 1, caratteristiche importanti possono essere evidenziati. In primo luogo, il numero di uova impiantate ha corrisposto a tutte le uova iniettate che avevano una morfologia normale o non sono state lisate dopo poche ore nella cultura. 93% delle uova iniettate sono stati impiantati suggerendo un'assenza quasi completa di tossicità rapida a causa dell'iniezione del vettore lentivirale nello spazio perivitellino. La situazione è drammaticamente diversa quando si considera iniezione di DNA, dal momento che solo il 44% delle uova iniettate erano sopravvissuti e sono stati impiantati. Inoltre, il rapporto degli embrioni raccolti rispetto uova impiantate è identico tra le due procedure, non suggerendo nessuna tossicità a lungo termine esacerbata di vettori lentivirali. In secondo luogo, quando è necessario esprimere il numero di embrioni che integrato il transgene rispetto al numero di uova iniettate il rendimento globale è più di 10 volte superiore con iniezione di vettore lentivirale rispetto all'iniezione di DNA. Una 86-fold differenza è trovata anche quando si confrontano i numeri degli embrioni che esprimono il transgene fra le due procedure utilizzando lo stesso costrutto di rinforzatore di Neurog3.
Cosa importante, resa di produzione transgenica sembra essere dipendente del titolo trasduzione dei vettori lentivirali usati. In altre parole, i vettori lentivirali prodotta con un titolo superiore a 109 TU/mL sono sufficienti per ottenere tale ad alto rendimento. Come descritto nella sezione protocollo, il volume iniettato nello spazio perivitellino è nell'intervallo tra 10 e 100 PL. Questo volume rappresenterà 10 a 100 particelle lentivirali attive. Rispetto alle iniezioni di DNA standard pronuclei , il numero totale di animali fondatore generato con la stessa quantità di animali nati è almeno 10 volte superiore quando si utilizza vettori lentivirali. Inoltre, la penetranza di espressione del transgene è estremamente elevata con questo protocollo ed è stata osservata sia con onnipresente e promotori specifici con l'eccezione del promotore CMV di cella. Dall'opposizione ai promotori onnipresenti cellulari, il promotore di CMV è attivamente arrestare di metilazione di DNA20 e ha dimostrato di essere in grado di mantenere a lungo termine espressione sulla trasduzione di cellule staminali pluripotenti21. Questo potrebbe spiegare il numero molto limitato di cellule osservate negli embrioni transgenici che esprimono eGFP. Di conseguenza, vettori lentivirali sono ben adattati per la produzione di animali transgenici in cui espressione di un transgene è controllata da un enhancer specifico delle cellule. D'importanza, il protocollo può essere utilizzato per lo screening del rinforzatore attività in vivo e per trovare mappa trascrizione siti di legame del fattore all'interno di regioni regolative11,12. Questo approccio di screening può difficilmente essere eseguito utilizzando standard transgenesi. Il numero totale di animali fondatore necessari per testare tutti i costrutti diversi e raggiunto la significatività statistica richiederebbe decine di sessioni di iniezione considerando che può essere ottenuto rapidamente con vettori lentivirali transgenesi mediata.
Una delle differenze principali tra la procedura standard e il metodo di base lentivirale risiede nell'integrazione del transgene. Mediante l'inserimento di pronuclei, transgeni integrano in modo casuale come copie multiple in un unico luogo. Utilizzo di vettori lentivirali, integrazione può verificarsi più loci (una copia per ciascun locus) senza essere rigorosamente casuale. Mediante la clonazione di siti di integrazione utilizzando lineare amplificazione mediata PCR (LAM-PCR), il gruppo di D. Trono ha dimostrato che transgeni integrano preferenzialmente nelle regioni di cromatina aperta delle uova fecondate13. Il bias di integrazione non deve interferire o contribuire all'espressione del transgene nei topi transgenici. Integrazione durante la trasduzione lentivirale in un embrione di fase di una cella si verifica nella cromatina aperta che potrebbe non essere ancora nella configurazione aperta più tardi durante lo sviluppo o nell'adulto.
Inoltre, quando si analizza il numero di copie di transgeni integrato negli animali di prima generazione (F0) o embrioni, si osserva una grande variazione nel numero di transgene integrato. In questo studio, è stata trovata una media di 19 copie integrate con il costrutto Neurog3-enh-eGFP. Questo numero grande copia potrebbe riflettere alti livelli di mosaicismo. Sauvain et al hanno effettuato un vasto studio di loci integrati negli animali F0 generati con il metodo mediato lentivirale descritto qui13. Seguivano le 70 siti di integrazione individuale in 11 F0 animali e ha esaminato i tassi di trasmissione per ogni sito da topi transgenici F0 alla loro progenie F1. Il tasso globale di trasmissione del 44% per singolo transgene integrato suggerisce che più spesso sono stati stabiliti dopo la fase di S di embrioni di una cella o prima della fase di S nella fase due-cellula. Infatti, integrazione prima della fase S potrebbe trasmettere il transgene integrato a due cellule della figlia, mentre integrazione dopo la fase S sarebbe trasmetterlo ai solo una cellula figlia. Pertanto, il grado di mosaicism per singoli transgeni integrato è minimo in topi transgenici ottenuti attraverso questa tecnica. Questo ulteriore indica che integrazione maggior parte verificherà entro le prime 12 h corrispondente al tempo medio di produzione della prima scissione nelle condizioni di coltura usati. Questa integrazione cinetica è coerenza con quella descritta per lentivirus in T-linfoide cellule22.
Cosa importante, con un elevato numero di loci che scopre transgeni integrato, stabilire linee di mouse non sarebbe ragionevole. Il numero di incroci per segregare tutti questi loci sarebbe notevolmente elevato. Questo rappresenta una limitazione importante di questo metodo che deve essere utilizzato per screening rapido di transgene effetti o per l'analisi simultanea di transgeni multipli. Tuttavia, linee del mouse possono essere stabilite ancora selezionando dall'animale F0 quelli con il numero di copia più bassa del transgene integrato.
Dalla prima descrizione del metodo pronuclei DNA iniezione1, sono stati apportati miglioramenti che eludere molti degli svantaggi della procedura iniziale. La prima serie di miglioramenti è stata basata sull'integrazione mirata di un locus preciso usando una strategia di cambio cassetta. Pronuclei iniezione viene eseguita utilizzando entrambi CRE, ricombinasi Flip o PhiC31 insieme a un frammento di DNA integrativo affiancata con loxP, FRT o attB siti, rispettivamente. In questo caso, il DNA integrativo viene scambiato con un frammento integrato affiancato con la stessa ricombinasi sito specifico23,24. Anche fino al 60% degli animali di prima generazione possa essere transgenici23 utilizzando tale metodo, le limitazioni legate alla tecnologia di iniezione pronuclei ancora valide. Il secondo set di miglioramento si basa su iniezioni citoplasmiche di due DNA circolare, uno che trasportano il frammento di integrare e un'espressione che consenta di entrambi i Tol225, Sleeping Beauty26 o piggyBac27 transposases. Utilizzando questi metodi, si ottengono rendimenti elevati (> 30%), ma ancora più importante, l'iniezione citoplasmatica è facile da eseguire e aggira le restrizioni a causa di pronuclei iniezione come il protocollo di base vettori lentivirale. Inoltre, frammenti di DNA molto grandi, quali cromosomi artificiali batterici, possono essere integrati.
È chiaro che lentivirali transgenesi mediata non sostituirà lo standard né il miglioramento delle procedure. Ancora questo metodo rappresenta un potente strumento per la rapida modello animale produzione e caratterizzazione come riduce notevolmente il tempo necessario per generare il corretto numero di animali con la variabilità genetica almeno. Inoltre, questa tecnologia può essere applicata direttamente a tutti i ceppi di topi, comprese eventuali linee transgeniche. Inoltre, è fondamentale ricordare che il panorama globale della generazione di nuovi modelli animali è destinato a cambiare con il recente sviluppo della tecnologia CRISPR/Cas9. Oggi, pronuclei iniezioni di proteina Cas9 con guida RNA permette produzione di genoma modificato modelli animali con un'efficacia di 40%28. Questo approccio potrebbe beneficiare in gran parte dall'uso di vettori lentivirali transgenesi mediata. Infatti, l'uso di vettori lentivirali non integrativa29 transitoriamente esprimere entrambi Cas9 e guida RNAs ha potuto provocare rendimenti ancora più elevati di produzione. La combinazione delle più recenti tecnologie per produrre modelli animali pertinenti e robusti gioverebbe più internazionale gruppi di ricerca coinvolti nello studio della patogenesi della malattia e approcci terapeutici.
Divulgazioni
Gli autori non hanno alcun conflitto di interessi di divulgare.
Riconoscimenti
Ringraziamo Magali Dumont e Rolando Meloni per lettura critica del manoscritto e la iVector e Phenoparc ICM core per l'assistenza tecnica nella produzione del vettore lentivirale e animale alloggiamento rispettivamente. Questo lavoro è stato supportato dal Translationnelles Institut Hospitalo-Universitaire de neuroscienze de Parigi, IHU-A-ICM, Investissements d'Avenir ANR-10-IAIHU-06. P.R. ha ricevuto finanziamenti per l'associazione de Langue Française pour l'Etude du Diabète et des Maladies Métaboliques (ALFEDIAM) e un comune JDRF / INSERM grant.
Materiali
| Name | Company | Catalog Number | Comments |
| PMSG 50UI | Sigma | G4527 | |
| hCG 5000UI | Sigma | CG5-1VL | |
| NaCl | Sigma | 7982 | |
| 100 mm petri dish | Dutsher | 353003 | |
| 4 wells Nunc dish | Dutsher | 56469 | IVF dish |
| M2 medium | Sigma | M7167 | |
| M16 medium | Sigma | M7292 | |
| 0,22 µm Syringe filter | Dutsher | 146611 | |
| Hyaluronidase Enzyme 30mg | Sigma | H4272 | mouse embryo tested |
| Insulin serynge | VWR | 613-3867 | Terumo Myjector |
| Curved forceps | Moria | 2183 | |
| Curved scissors | Moria | MC26 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| Borosilicate glass capillaries | Harvard apparatus | GC 100-10 | |
| Horizontal micropipette puller | Narishige | PN-30 | |
| Microforge | Narishige | MF-900 | |
| Inverted microscope | Nikon | Transferman NK2 5188 | Hoffman modulation contrast illumination is required |
| Micromanipulator | Eppendorf | Celltram air | |
| Controler of holding pipet | Eppendorf | Femtojet | |
| Mineral oil | Sigma | M8410 | mouse embryo tested |
| Microinjector | Eppendorf | Femtojet | Can be used to inject DNA or viral vectors |
| Dumont # 5 forceps | Moria | MC 40 | |
| vannas micro scissors | Moria | 9600 | |
| Isoflurane | centravet | ISO005 | ISO-VET 100% 250ml |
| ocrygel | centravet | OCR002 | |
| Povidone iodure | centravet | VET001 | vetedine 120ml |
| Buprenorphine | centravet | BUP002 | Buprecare 0,3Mg/ml 10ml |
| Tris-HCl | Sigma | T5941 | Trizma hydrochloride |
| EDTA | Sigma | E9884 | |
| SDS | Sigma | 436143 | |
| NaCl | Sigma | S7653 | powder |
| proteinase K | Sigma | P2308 | |
| oneTaq kit | NEB | M0480L | |
| Primers | Eurogentec | ||
| Strip of 8 PCR tube | 4titude | 4ti-0781 | |
| 96 well thermal cycler | Applied Biosystems | 4375786 | Veriti |
| Genomic DNA mini kit | invitrogen | K1820-02 | |
| Nanodrop 2000 | Thermo Scientific | ND-2000C | |
| qPCR Master mix | Roche | 4887352001 | SYBR Green |
| Multiwell plate 384 | Roche | 5217555001 | |
| qPCR instrument 384 well | Roche | 5015243001 | LightCycler 480 |
Riferimenti
- Gordon, J. W., Scangos, G. A., Plotkin, D. J., Barbosa, J. A., Ruddle, F. H. Genetic transformation of mouse embryos by microinjection of purified DNA. Proceedings of the National Academy of Science USA. 77 (12), 7380-7384 (1980).
- Bock, T. A., Orlic, D., Dunbar, C. E., Broxmeyer, H. E., Bodine, D. M. Improved engraftment of human hematopoietic cells in severe combined immunodeficient (SCID) mice carrying human cytokine transgenes. Journal of Experimental Medicine. 182 (6), 2037-2043 (1995).
- Miyakawa, Y., et al. Establishment of human granulocyte-macrophage colony stimulating factor producing transgenic SCID mice. British Journal of Haematology. 95 (3), 437-442 (1996).
- Hirabayashi, M., et al. A comparative study on the integration of exogenous DNA into mouse, rat, rabbit, and pig genomes. Experimental Animals. 50 (2), 125-131 (2001).
- Isola, L. M., Gordon, J. W. Transgenic animals: a new era in developmental biology and medicine. Biotechnology. 16, 3-20 (1991).
- Zufferey, R., Nagy, D., Mandel, R. J., Naldini, L., Trono, D. Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo. Nature Biotechnology. 15 (9), 871-875 (1997).
- Lois, C., Hong, E. J., Pease, S., Brown, E. J., Baltimore, D. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science. 295 (5556), 868-872 (2002).
- Ewerling, S., et al. Evaluation of laser-assisted lentiviral transgenesis in bovine. Transgenic Research. 15 (4), 447-454 (2006).
- Ritchie, W. A., Neil, C., King, T., Whitelaw, C. B. Transgenic embryos and mice produced from low titre lentiviral vectors. Transgenic Research. 16 (5), 661-664 (2007).
- Park, F. Lentiviral vectors: are they the future of animal transgenesis. Physiological Genomics. 31 (2), 159-173 (2007).
- van Arensbergen, J., et al. A distal intergenic region controls pancreatic endocrine differentiation by acting as a transcriptional enhancer and as a polycomb response element. PLoS One. 12 (2), e0171508 (2017).
- Friedli, M., et al. A systematic enhancer screen using lentivector transgenesis identifies conserved and non-conserved functional elements at the Olig1 and Olig2 locus. PLoS One. 5 (12), e15741 (2010).
- Sauvain, M. O., et al. Genotypic features of lentivirus transgenic mice. Journal of Virology. 82 (14), 7111-7119 (2008).
- Punzon, I., Criado, L. M., Serrano, A., Serrano, F., Bernad, A. Highly efficient lentiviral-mediated human cytokine transgenesis on the NOD/scid background. Blood. 103 (2), 580-582 (2004).
- Zennou, V., et al. The HIV-1 DNA flap stimulates HIV vector-mediated cell transduction in the brain. Nature Biotechnology. 19 (5), 446-450 (2001).
- Miyoshi, H., Blomer, U., Takahashi, M., Gage, F. H., Verma, I. M. Development of a self-inactivating lentivirus vector. Journal of Virology. 72 (10), 8150-8157 (1998).
- Yee, J. K., et al. A general method for the generation of high-titer, pantropic retroviral vectors: highly efficient infection of primary hepatocytes. Proceedings of the National Academy of Science USA. 91 (20), 9564-9568 (1994).
- Castaing, M., et al. Efficient restricted gene expression in beta cells by lentivirus-mediated gene transfer into pancreatic stem/progenitor cells. Diabetologia. 48 (4), 709-719 (2005).
- Gradwohl, G., Dierich, A., LeMeur, M., Guillemot, F. neurogenin3 is required for the development of the four endocrine cell lineages of the pancreas. Proceedings of the National Academy of Science USA. 97 (4), 1607-1611 (2000).
- Scharfmann, R., Axelrod, J. H., Verma, I. M. Long-term in vivo expression of retrovirus-mediated gene transfer in mouse fibroblast implants. Proceedings of the National Academy of Science USA. 88 (11), 4626-4630 (1991).
- Norrman, K., et al. Quantitative comparison of constitutive promoters in human ES cells. PLoS One. 5 (8), e12413 (2010).
- Vandegraaff, N., Kumar, R., Burrell, C. J., Li, P. Kinetics of human immunodeficiency virus type 1 (HIV) DNA integration in acutely infected cells as determined using a novel assay for detection of integrated HIV DNA. Journal of Virology. 75 (22), 11253-11260 (2001).
- Ohtsuka, M., et al. One-step generation of multiple transgenic mouse lines using an improved Pronuclear Injection-based Targeted Transgenesis (i-PITT). BMC Genomics. 16, 274 (2015).
- Tasic, B., et al. Site-specific integrase-mediated transgenesis in mice via pronuclear injection. Proceedings of the National Academy of Science USA. 108 (19), 7902-7907 (2011).
- Sumiyama, K., Kawakami, K., Yagita, K. A simple and highly efficient transgenesis method in mice with the Tol2 transposon system and cytoplasmic microinjection. Genomics. 95 (5), 306-311 (2010).
- Garrels, W., et al. Cytoplasmic injection of murine zygotes with Sleeping Beauty transposon plasmids and minicircles results in the efficient generation of germline transgenic mice. Biotechnology Journal. 11 (1), 178-184 (2016).
- Ding, S., et al. Efficient transposition of the piggyBac (PB) transposon in mammalian cells and mice. Cell. 122 (3), 473-483 (2005).
- Aida, T., et al. Cloning-free CRISPR/Cas system facilitates functional cassette knock-in in mice. Genome Biology. 16, (2015).
- Philippe, S., et al. Lentiviral vectors with a defective integrase allow efficient and sustained transgene expression in vitro and in vivo. Proceedings of the National Academy of Science USA. 103 (47), 17684-17689 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon