Method Article
Lentivirales mediación producción de ratones transgénicos: un método Simple y altamente eficiente para el estudio directo de los fundadores
En este artículo
Resumen
Aquí, presentamos un protocolo para promover la integración del transgén y la producción de ratones transgénicos fundador con alta eficacia por una simple inyección de lentivirales vector en el espacio perivitelino de un ovocito fertilizado.
Resumen
Durante casi 40 años, inyección pronuclear de ADN representa el método estándar para generar ratones transgénicos con la integración aleatoria de transgenes. Un procedimiento de rutina se utiliza extensamente en todo el mundo y su principal limitación reside en la pobre eficacia de la integración del transgén, resultando en un bajo rendimiento de los animales del fundador. Sólo pequeño porcentaje de animales nacidos después de la implantación de óvulos fertilizados inyectados ha integrado el transgén. Por el contrario, vectores lentivirales son poderosas herramientas para la transferencia de genes integradora y su uso para transducir ovocitos fertilizados permite producción altamente eficiente del fundador de ratones transgénicos con un rendimiento promedio superior al 70%. Además, cualquier cepa de ratón se puede utilizar para producir animales transgénicos y la penetrancia de la expresión del transgén es extremadamente alto, por encima del 80% con transgénesis mediada lentivirales comparado con microinyección de DNA. El tamaño del fragmento de ADN que puede ser carga por el vector lentivirales se limita a 10 kb y representa la principal limitación de este método. Usando un simple y fácil de realizar el procedimiento de inyección debajo de la zona pelúcida de ovocitos fertilizados, pueden producir más de 50 animales del fundador en una sola sesión de microinyección. Dicho método está altamente adaptado para llevar a cabo, directamente en los animales de fundador, rápida ganancia y pérdida de estudios de la función o a regiones de ADN genómicas de pantalla por su capacidad para controlar y regular la expresión génica en vivo.
Introducción
El trabajo pionero de Gordon et al. en 1980 demostró que después de la implantación en ratones seudopreñadas, la inyección de DNA de plásmido en la masculina pronúcleos de ovocitos fertilizados puede rendir la producción de animales transgénicos que integran el plásmido de ADN1. La demostración que mamíferos transgénicos pueden ser generados tuvo un enorme impacto en Ciencias de la vida mundiales, abriendo el camino a nuevos campos de investigación tanto en ciencias básicas y ciencias biomédicas traslacionales. En las últimas cuatro décadas, microinyección de ADN se ha convertido en una práctica habitual. Aunque se han producido un número enorme de ratones transgénicos, el método estándar no es plenamente utilizable para todas las cepas de ratón y requiere mucho tiempo retrocruzamientos2,3. Su aplicación a otras especies sigue siendo un reto4 y el rendimiento general de integración del transgén se limita a unos porcentaje de animales nacidos5. Además, la eficacia de la integración del transgen representa el factor limitante que explica el pobre rendimiento general de la inyección de ADN pronuclear. En este sentido, integrantes vectores virales son las más eficientes herramientas para carga e integran los transgenes y así podrían proporcionar nuevos medios para incrementar significativamente el rendimiento de la integración, la única limitación es que el tamaño del transgén que no puede superar los 10 kb6 .
Vectores lentivirales pseudo-mecanografiados con la proteína de la envoltura de los Virus de la Estomatitis Vesicular (VSV) son herramientas de transferencia de gen pantropic y altamente integrador y pueden utilizarse para transducir ovocitos fertilizados7. La zona pelúcida que rodea los ovocitos es una barrera natural virus y necesita ser pasado para permitir la transducción de los vectores lentivirales. Animales transgénicos han sido generados por transductoras ovocitos fertilizados después de micro perforación o extracción de la zona pelúcida8,9. Sin embargo, la inyección debajo de la zona pelúcida en el espacio perivitelino parece ser el método más simple para transducir los huevos fecundados como descrito inicialmente por Lois y colegas7.
La inyección de perivitelino de vectores lentivirales permite altos rendimientos en la producción de animales transgénicos que están sobre el 70% de los animales nacidos. Tal producción es más de 10 veces superior a la mejor producción que puede lograrse utilizando estándar pronúcleos ADN inyección7,10,11. En este contexto, una sola sesión de inyecciones generará a por lo menos 50 fundadores transgénicos (F0). Por lo tanto, el gran número de fundadores es compatible con fenotipo del transgen efecto directamente realizado sobre ratones F0 sin la necesidad de generar líneas de ratón transgénico. Esta ventaja permite la rápida detección de los efectos del transgen y está adaptada para realizar en vivo la ganancia y la pérdida de estudios de la función dentro de las semanas. Además, elementos reguladores del ADN pueden también rápidamente proyectará para asignar potenciadores y motivos de ADN por transcripción factores11,12. Con inyección pronuclear, los transgenes generalmente integrar copias múltiples en un único locus. Con vectores lentivirales, integración ocurre en loci múltiples como una sola copia por locus10,13. Por lo tanto, la multiplicidad de loci integrados es probablemente asociado a la penetrancia muy alta expresión observada en los transgénicos fundadores, que hace el nuevo modelo generando más robusto.
Lo importante, al utilizar inyección pronuclear de DNA, visualización de los pronúcleos durante el procedimiento es absolutamente necesario. Esta limitación técnica evita el uso de ovocitos fertilizados procedentes de una gran variedad de cepas de ratón. Por lo tanto, la producción de un modelo transgénico en un específico de la cepa para que pronúcleos son invisibles requiere la producción de animales en una cepa permisiva seguido por al menos 10 sucesivas retrocruzas para transferir el transgen en el ratón deseado cepa. Con las inyecciones de vectores lentivirales, espacio perivitelino siempre está visible y la inyección no requiere de habilidades muy específicas. Por ejemplo, se han obtenido ratones transgénicos NOD/SCID que no son apropiados para la inyección de pronúcleos con los vectores virales inyecciones14.
Aquí, se presenta un protocolo integral para permitir la simple producción de ratones transgénicos usando inyecciones lentivirales vector en el espacio perivitelino de un embrión de la etapa de una célula. Expresión del transgén controlada ya sea con ubicua o promotores específicos de la célula se describe en detalle.
El backbone lentivirales pTrip ΔU3 fue utilizado en este estudio15. Este vector permite la producción de vectores lentivirales defectuoso de replicación en la que la secuencia de U3 se ha eliminado parcialmente para eliminar la actividad de promotor de U3 y generar una uno mismo-inactivador de vector (pecado)16. Las poblaciones de vectores lentivirales fueron producidas por transitorios de la transfección de células HEK-293T con el p8.91 encapsulación plásmido (ΔVpr ΔVif ΔVpu ΔNef)6, pHCMV-G codificación de la estomatitis vesicular (VSV) virus de la glicoproteína G17y el ΔU3 pTRIP vector recombinante. El procedimiento de producción detallada se proporciona como métodos suplementarios.
Producción de las poblaciones de vectores lentivirales de alto título se realiza en condiciones de nivel II de bioseguridad (BSL-2). Esto es cierto para la mayoría de los transgenes excepto oncogenes que tienen que ser producido en el BSL-3. Por lo tanto, la producción en condiciones BSL-2 para la mayoría de los casos es suficiente. Además, el uso y la producción generalmente se desconectan para la mayoría las agencias reguladoras nacionales con organismos modificados genéticamente (OMG). Cantidades limitadas de vectores lentivirales incompetentes de pecado la replicación (por debajo de 2 μg de la proteína de cápside p24) pueden utilizarse en condiciones BSL-1 según lo descrito por la agencia francesa OGM de acuerdo con las recomendaciones de la Unión Europea.
Protocolo
Todos los procedimientos que incluyen trabajo animal han obtenido aprobación ética y han sido autorizados por el Ministerio francés de investigación y educación bajo el número APAFIS #5094-20 v6 16032916219274 y 05311.02. El Animalario ICM PHENOPARC ha sido acreditado por el Ministerio francés de agricultura bajo el número de acreditación B75 13 19. El protocolo general requiere realizar cada procedimiento dentro de un marco de tiempo exacto que se resume en la figura 1.
1. animal compra y preparación de compuestos básicos
- Compra de animales
- Ordenar 25 machos vasectomizados B6CBAF1/JRj que son 8 semanas de edad (generación F1 original cruza entre ♀C57Bl/6JRj y ♂CBA/JRj).
Nota: Aislar a los hombres a su llegada. Machos vasectomizados pueden ser reutilizados por al menos un año.
Cambiar las jaulas cada 3 semanas. - Orden 50 hembras de B6CBAF1/JRj que son 10 semanas de edad y mantienen una piscina de por lo menos 50 animales.
- Orden de 10-15 C57BL/6JRj machos fértiles que son 8 semanas de edad.
- Orden 30 hembras C57BL/6JRj que son 4 semanas de edad.
- Ordenar 25 machos vasectomizados B6CBAF1/JRj que son 8 semanas de edad (generación F1 original cruza entre ♀C57Bl/6JRj y ♂CBA/JRj).
- Anestesia y eutanasia
- La anestesia se realiza con un volumen de la mezcla de ketamina/xilacina 300μL, inyectada por vía intraperitoneal (ketamina a una dosis de 150μg/g de peso corporal, xilacina a dosis de 0.15μg / g de peso corporal). Animales se colocan bajo calefacción pad para ajustar la temperatura del cuerpo. Revise los reflejos pellizcando la cola del animal antes de iniciar el procedimiento.
- Eutanasia se realizó mediante dislocación cervical. Degollación fue incluido como un método secundario para confirmar la muerte del animal. Eutanasia de embriones fue realizado por decapitación.
Nota: A su llegada, permiten animales un mínimo de 1 semana para habituarse a la instalación (sin manipulación o apareamiento). Lo importante, cualquier cepas de ratón incluyendo líneas transgénicas pueden ser utilizadas como machos fértiles y hembras fértiles para superovulación. La elección de la cepa debe hacerse según los requisitos de la pregunta científica.
- Preparación de la hormona
- Agregar 910 μl de tampón de la PSMG (gonadotropina de suero de yegua embarazada) en 1 frasco liofilizado de PMSG, tomar alícuotas μl 100 y almacenar a-20 ° C.
Nota: Cada alícuota contiene 55 UI para 11 ratones. Nunca mantenga PMSG alícuotas durante más de dos semanas después del primer uso. - Añadir 2730 μl de tampón de hCG (gonadotropina coriónica) en 1 liofilizada frasco de hCG. Hacer alícuotas μl 100 y almacenar a-20 ° C.
Nota: Cada alícuota contiene 55 UI para 11 ratones.
- Agregar 910 μl de tampón de la PSMG (gonadotropina de suero de yegua embarazada) en 1 frasco liofilizado de PMSG, tomar alícuotas μl 100 y almacenar a-20 ° C.
- Preparación de hialuronidasa
- Reconstituir 1 vial de hialuronidasa con 3 mL de medio de M2 para obtener un 10 mg/mL solución stock y hacer alícuotas de μl 50. Luego almacenar a-20 ° C.
- Preparación de herramientas de cirugía
- Esterilizar todas las herramientas de cirugía utilizando el autoclave.
2. superovulación de donantes
- En un centro de animales utilizando 12 h día - ciclos de la noche, inyectar PMSG en 14:00 en el día -3. Inyectar el hCG a las 12 h día -1 y mate con machos fértiles justo después de la inyección de hCG.
- Día -3, añadir 1 mL de solución estéril de NaCl 0,9% en 1 alícuota de 100 μl de PMSG (55 UI). Inyectar 10 hembras C57BL/6JRj con 100 μl por vía intraperitoneal utilizando una jeringa sin ningún volumen muerto.
Nota: Cada ratón recibirá 5 UI de PMSG. - Día -1, agregar 1 mL de solución de NaCl al 0,9% estéril a 1 alícuota de 100 μl de hCG (55 UI). Inyectar a los ratones que recibieron la inyección de PMSG con 100 μl de solución diluida de hCG (5UI) por vía intraperitoneal. Utilice una jeringa sin ningún volumen muerto. Realizar la inyección lentamente y espere antes de retirar la aguja para que no escape el líquido.
Nota: Cada ratón recibirá 5 UI de hCG. La inyección de hCG se debe realizar 46 h después de PMSG. - Coloque cada hembra C57BL/6JRj en la jaula del macho semental directamente después de la inyección de hCG.
- Ver tapones vaginales en la mañana del día 0 y las hembras positivas para recoger huevos fertilizados.
3. prepare las hembras seudopreñadas B6CBAF1/jRj
- Mate un hombre vasectomía el día antes de huevo (día -1) con 2 hembras de B6CBAF1/JRj en 17:00.
Nota: Es muy importante aparearse con las hembras que son originarios de diferentes jaulas para evitar la sincronización de los ciclos femeninos. Esto aumentará el rendimiento de obtención de tapones vaginales. Además, no agregue una hembra a una jaula macho que ha cambiado en los últimos 2 días. Eficacia de comportamiento reproductivo en el hombre aumenta cuando la jaula está sucia.
4. fertilizado huevos colección
- Preparación
- Añadir μl de 1450 m2 a solución para preparar la solución de trabajo de hialuronidasa hialuronidasa.
- Coloque una gota de 100 μl de solución de trabajo de hialuronidasa por hembra utiliza para producir huevos fertilizados en una placa de Petri de 100 mm y mantener a temperatura ambiente.
- Añadir 500 μl de M16 en placas de 4 pozos. Utilizar 2 pozos por tipo de vectores lentivirales que será inyectada: uno bien contendrá los huevos inyectados y el otro los que no. Colocar las 4 placas bien en la incubadora a 37 ° C con una atmósfera de 5% CO2 .
- Preparar Pipetas para recolección y manejo de embriones.
- Suavizar los capilares de hematocrito de vidrio (75 mm/60 μL) girando el centro del tubo capilar de vidrio duro en la llama.
- Retirar los tubos capilares del fuego tan pronto como sea posible y tire de él para obtener un tubo con un diámetro interno de aproximadamente 300 μm. Tire del tubo enfriado para obtener una rotura limpia de.
- Recoger los oviductos.
- Eutanasia a las hembras C57BL/6JRj por dislocación cervical en 9:00 en el día 0. Se confirma la muerte por decapitación.
Nota: Este método de eutanasia fue aprobado por el IACUC y sigue las recomendaciones europeas. - Realizar una incisión horizontal grande para abrir la cavidad abdominal con las tijeras. El oviducto se encuentra entre el útero y el ovario.
- Retire el mesometrium y la membrana que lleva vasos sanguíneos prominentes con fórceps curvado.
- Separar el oviducto del ovario con fórceps curvado.
- Utilice fórceps curvado como una guía para cortar el oviducto del ovario con tijeras curvas.
- Tire el oviducto y corte del útero con unas tijeras curvas.
PRECAUCIÓN: No toque la ampolla inflamada que contiene los huevos fertilizados. Realizar todo el procedimiento con instrumentos estériles. - Lugar de oviductos todos recogidos en M2 medio (placa de cultivo de 35 mm) a temperatura ambiente
- Coloque 2 oviductos en la misma gota de 100 μl de solución de trabajo de hialuronidasa (0,3 mg/mL).
- Eutanasia a las hembras C57BL/6JRj por dislocación cervical en 9:00 en el día 0. Se confirma la muerte por decapitación.
- Eliminar las células de cúmulos de huevos fertilizados.
- Bajo un estereomicroscopio, utilice 2 jeringas de insulina: la primera de ellas para sostener el oviducto y la segunda para romper la ampolla y dispersar huevos fertilizan en la solución de trabajo de hialuronidasa.
- Tomar la pipeta de cristal preparado para recoger huevos y conectar el tubo y un filtro de 0,22 μm, montado en la boquilla para aspirar todos los huevos. Recoger todos los huevos y lávelos por sucesivos paso en 6 diferentes gotas de 100 μl de medio de M2.
- Lugar lavarse los huevos fertilizados en incubadora humidificada 37 ° C con una atmósfera de 5% CO2 en medio de la M16.
5. hacer inyección de pipetas
- Uso de tubo capilar de vidrio de paredes delgadas (10-15 cm de largo) con un diámetro exterior de 1 mm y sujete este capilar en tirador de la micropipeta horizontal.
Nota: En el tirador más horizontal de la pipeta, 3 ajustar parámetros: energía del calor, tirando de fuerza y tiempo de retraso entre calefacción y tirando. Ajuste estos parámetros para obtener la pipeta de inyección que se asemeja a la que se presenta en la figura 2A. Para los usuarios que realizan rutinariamente la microinyección de ADN, usar la configuración estándar y ajuste el retardo de calentamiento y tracción para cambiar la forma mundial de punta de la pipeta.
6. hacer explotación pipetas
- Use una pipeta de inyección para preparar la pipeta holding.
- Coloque una pipeta de inyección en un microforge. Cortar la pipeta con el microforge para obtener una punta muy afilada simétrica de 80 a 100 μm de diámetro. Luego pulir la punta con calor en el microforge para obtener una forma redonda simétrica sin setos sharp.
7. preparación de la pipeta de inyección que contiene los vectores lentivirales
- Centrifugue la suspensión de vectores lentivirales a 160 x g durante 2 minutos para que sedimenten residuos a menudo presentan en acciones lentivirales congeladas.
- Recuperar el sobrenadante y transferir a un nuevo tubo de 0,5 mL en una clase de seguridad II gabinete.
- Transferir 1 μl del sobrenadante a una pipeta de inyección preparada como se describe en el paso 5 utilizando un cargador de Micro.
- Coloque la pipeta de inyección sobre el soporte del instrumento de la razón instrumental quirúrgico. Conectar la pipeta holding a la izquierda micromanipulador.
Nota: El título del transduction del vector lentivirales va ser directamente relacionado con la eficacia de la producción del fundador. De alta eficacia (> 70%), uso de vectores virales con un título en el rango de 100 ng de p24 capsid proteína/μl. Cuando el título se expresa como unidades de transducción (TU), el título debe estar por encima de 109 TU/mL. Las poblaciones de vectores lentivirales deben ser producidas por transitorios de la transfección de células 293T con el plásmido de encapsidation p8.91, pHCMV-G, codificación de la estomatitis vesicular (VSV) virus de la glicoproteína-G como se describe en métodos suplementarios18.
8. micro-Injection
- Dispensar 8 μl de medio de M2 en el centro de una diapositiva de la depresión y la cubierta con aceite de parafina luz (embrión probado) para evitar la evaporación.
- Lugar 20 huevos en la caída como dispersos lo menos posible.
PRECAUCIÓN: No haga burbujas al depositar los embriones. - Asegúrese de que la punta de la pipeta de inyección está abierta. Si no es así, golpee la pipeta de inyección con la pipeta de sujeción.
- Establecer la microinyectora para un tiempo de inyección de 20 s.
Nota: La viscosidad de la suspensión viral permite la clara visualización de la dispersión de los vectores virales en el espacio perivitelino. La presión de inyección debe ajustarse para llenar todo el espacio dentro de 20 s de inyección, lo que representa un volumen de 10 a 100 pL. Presión de inyección no debe exceder 600 hPa. - Aspirar un huevo fertilizado que contiene núcleos profesionales 2 y 2 cuerpos polares con la pipeta holding bajo el estereomicroscopio.
- Inyectar el huevo con el microinyector mediante ajustes descritos en 8.4, en el espacio perivitelino.
PRECAUCIÓN: No toque la membrana plasmática con la pipeta de inyección. - Inyectar todo fertilizados huevos disponibles en lotes de 20 huevos y coloque los huevos inyectados inmediatamente en medio M16 precalentar la incubadora humidificada 37 ° C con una atmósfera de 5% CO2.
Nota: Incubar los huevos inyectados por un mínimo de 30 minutos después de la inyección antes de las transferencias de embriones.
9. transferencia de embriones en hembras seudopreñadas B6CBAF1/JRj
- Revise la cópula clavija 16 h después de aparearse las hembras B6CBAF1/JRj con machos de vasectomía B6CBAF1/JRj. Hacer esto justo antes de comenzar la colección de huevos.
- Preparar pipetas de implantación por embrión inyectado.
- Hacer pipetas de implantación de embriones como se describe para la recogida y manipulación de embriones (paso 4.2). Seleccione pipetas con un diámetro interno de unos 150 μm con una parte estrecha alrededor de 4-5 cm de longitud.
Nota: La punta debe estar pulida, con el fin de reducir posibles daños a los huevos o el oviducto la llama.- Llene con aceite de parafina luz (embrión probado) justo por encima del hombro de la pipeta.
- Aspire una burbuja de aire pequeño, entonces medio de M2 y finalmente una segunda burbuja de aire.
- Elaboración de embriones uno detrás de otros para minimizar el volumen total del medio que se inyectará en el oviducto y los embriones.
- Acabado por la carga de una gota muy pequeña de aceite de parafina luz (embrión probado) de la anchura de un embrión.
PRECAUCIÓN: Ser suave durante la manipulación de la pipeta.
- Hacer pipetas de implantación de embriones como se describe para la recogida y manipulación de embriones (paso 4.2). Seleccione pipetas con un diámetro interno de unos 150 μm con una parte estrecha alrededor de 4-5 cm de longitud.
- Transferencia de embriones.
- Esterilizar todos los instrumentos.
- Anestesiar la hembra mediante una inyección intraperitoneal de 300 μL de solución estéril de 0.9% de NaCl que contiene 150 μg por g de peso corporal de la ketamina y 0.15 μg / g de peso corporal de xilacina.
- Verificar la profundidad de la anestesia por pellizcar la cola del animal con pinzas e inyecte subcutaneouly 0,1 mg/kg de analgésicos (buprenorfina) antes de iniciar el procedimiento.
- Afeitado 2 cm a ambos lados de la espalda a lo largo de la médula espinal a nivel de la última costilla.
- Coloque el ratón hembra sobre una almohada y en un campo estéril. Cortar una ventana de 2 x 2 cm en el centro de la parte trasera del ratón.
- Aplicar una solución antiséptica (yodo de povidona 10%) sobre la piel y hacer una incisión transversal de 1 cm con las tijeras, luego deslice la piel lateralmente hasta el ovario (color naranja) es visible a través de la pared del cuerpo.
- Haga una incisión de 5 mm en la pared del cuerpo por encima del ovario con las tijeras finas bajo el microscopio quirúrgico binocular.
- Levante la almohadilla de grasa con una pinza de bulldog atraumática y extraer el ovario, oviducto y la parte superior del útero.
- Visualizar la ampolla y realizar una Hemisección con tijeras de vannas en el segmento del oviducto que une el ovario con la ampolla.
- Introducir la pipeta de embrión y entregar huevos en la ampolla, en la primera burbuja de aire en la pipeta de implantación.
- Repita el procedimiento en el oviducto de segunda.
- Cierre la piel con los clips de la herida.
- Lugar el animal en la recuperación del compartimiento (39 ° C, 30-60 min) hasta totalmente despierto.
- Repetir la inyección analgésica después de 12 h y 48 h en caso de dolor o angustia.
- Eliminar clips de herida 7-10 días después de la cirugía.
- Compruebe las hembras implantadas para el embarazo siguiendo su curva de peso cada 3 días después de la implantación. Un aumento de peso importante puede observarse de 10 a 12 días después de la implantación y será indicativo de embarazo.
Nota: Todos los embriones que se desarrollan aquí voluntad representan a supuestos transgénicos fundadores. El fenotipo de estos fundadores puede analizarse en cualquier etapas de desarrollo o después de nacimiento según la pregunta científica vinculada a la generación de estos animales transgénicos.
10. genotipificación transgénicos fundadores
- Preparar el tampón de genotipificación que contiene 10 mM Tris-HCl, pH 8; 5 mM EDTA, pH 8,0 con SDS 0,2% (p/v), 50 mM NaCl. Esterilizar el búfer de genotipado mediante filtro 0,22 μm y almacenar a temperatura ambiente durante varios meses.
- Poner las membranas extraembrionarias (para embriones) o pedacito de cola (para los animales nacidos) en 500 μl de filtrado buffer de genotipado y añadir 15 μl de proteinasa K (20 mg/mL). Incubar durante una noche a 55 º C.
- Centrifugue el lisado a 15.000 x g durante 5 min y luego use 1 μl de sobrenadante para la reacción de PCR. Lisado puede guardarse a 4 ° C durante varios meses.
- Realizar la amplificación por PCR de un fragmento del transgén en un volumen de reacción de 20 μl que contiene tampón x PCR 1, 1.5 mM MgCl2, 200 μm de dNTPs, 0.2 μm de cada iniciadores PCR, 1 interfaz de usuario de Taq ADN polimerasa y 1 μl de cada muestra digerida. Como control negativo, use 1 μl de H2O. Como control positivo, usar ADN de plásmido vector lentivirales que contiene el transgén.
- Para la detección de eGFP describe el uso:
eGFP adelante Primer: 5' GACCACATGAAGCAGCACGACTTCT 3'
eGFP Primer revés: 5' TTCTGCTGGTAGTGGTCGGCGAGCT 3' - Realizar la amplificación por PCR en un termociclador: 4 min a 94 ° C, seguido de 35 ciclos de 1 min a 94 ° C, 1 min a 60 ° C y 2 min a 72 ° C.
- Cargar el producto PCR en gel de agarosa al 2% para poder visualizar un 300 bp eGFP producto de PCR como se ilustra en la figura 2B.
Nota: Todos los individuos que muestran una banda PCR 300 bp han incorporado el transgén de eGFP y pueden considerarse como transgénicos. - Analizar la expresión de transgenes en animales transgénicos. Por ejemplo, realizar histológica e inmunotinción como ilustrado en la figura 3 y figura 4 y se describe en métodos suplementarios.
Nota: Ambos análisis de expresión del transgén y fenotipo deben realizarse con métodos pertinentes según la pregunta científica global.
11. cuantificación del número de copias del transgen
- Preparar muestras de ADN para la PCR cuantitativa.
- Extraer el DNA genómico (gDNA) de la proteinasa K lisado obtenida en el paso 10.3 utilizando un kit comercial según las instrucciones del fabricante.
- Cuantificar gDNA por espectrofotometría a 260 nm.
- Diluir cada muestra gDNA a una concentración final de 10 ng/μl.
- Para cada muestra, preparar 5 diluciones seriadas (1:5) en H2O para obtener 6 tubos en las siguientes concentraciones: 10 ng/μl, 2 ng/μl, 0,4 ng/μl, 0.08 ng/μl, 0.016 ng/μl y 0.0032 ng/μl
- Preparar la mezcla de reacción de PCR (qPCR) cuantitativa.
- Preparar la mezcla de cartilla para qPCR. Para que cada pareja de cartilla para qPCR, añadir 10 μl del primer avance (100 μm cartilla solución), 10 μl de cebador reverso (100 μm) y 80 μl de H2O.
Nota: Para amplificar eGFP, utilizar primers TCCAGGAGCGCACCATCTTCTTCA hacia adelante y reversa TTGATGCCGTTCTTCTGCTTGTCG. Cdx2 gen se utiliza como estabilizador para qPCR (2 copias por genoma). Para Cdx2 normalizador utilizar primers GCCAGGGACTATTCAAACTACAGG hacia adelante y reversa GACTTCGGTCAGTCCAGCTATCTT - Preparar mezclas de qPCR 2, uno con la mezcla de la cartilla de eGFP y uno con mezcla de cartilla Cdx2. Preparar suficiente mezcla de qPCR para amplificar las 6 diluciones por duplicado de cada gDNA. Una reacción de la qPCR contiene 3.8 μl de H2O, 5 μl de 2 fluorescentes verde x la mezcla de reacción y 0.2 μl de mezcla de cartilla.
Nota: Para que cada animal transgénico para poner a prueba, se realizará 24 reacciones de qPCR. La mezcla de reacción se proporciona para una máquina de qPCR bien 384. - Para que cada animal probar, distribuir: 12 pozos con 9 μl de mezcla de qPCR de eGFP y 12 pozos con 9 μl de mezcla de qPCR Cdx2. Añadir 1 μl de cada dilución del gDNA a 2 pozos que contiene la mezcla de qPCR de eGFP y 2 pozos que contiene la mezcla de qPCR de eGFP.
- Licencia 2 pozos para cada qPCR mezclan que gDNA fue reemplazar por H2O como control negativo.
- Preparar la mezcla de cartilla para qPCR. Para que cada pareja de cartilla para qPCR, añadir 10 μl del primer avance (100 μm cartilla solución), 10 μl de cebador reverso (100 μm) y 80 μl de H2O.
- Coloque la placa de la pozo 384 en la máquina de qPCR y aplicar el siguiente protocolo de funcionamiento: 10 minutos a 95 ° C después de 50 ciclos de 10 s a 95 ° C y 1 min a 60 ° C.
- Analizar los datos. Para que cada gDNA probar, trazar los valores de Ct en función de los registros del gDNA total importe (6 puntos por duplicado). Ajuste de la curva usando regresión lineal con el método menos cuadrado y extrapolar el valor de Ct correspondiente a la intersección con el eje y. Utilizar los valores de Ct extrapolados de eGFP y Cdx2 normalizado para calcular el número de copia de eGFP respecto Cdx2 (2 copias) usando el método de estándar 2ΔdCt 11.
Resultados
Animales transgénicos fueron generados usando el protocolo presentado aquí. Representante resultados tanto ubicua y expresión de transgenes específicos tipo de célula se ilustran.
Expresión constitutiva de transgenes
Promotores ubicuos son herramientas de investigación básica para expresar transgenes en forma sostenida y eficaz. Estos promotores se utilizan para una variedad muy grande de aplicación de en vitro la transfección de la célula a en vivo transgénesis en animales pequeños y grandes.
Se construyeron vectores lentivirales para expresar el gen verde reportero fluorescente (eGFP) bajo el control del promotor de citomegalovirus (CMV) o el compuesto promotor que CAG basado en la fusión de pollo actinia promotor y potenciador de la CMV. Ambos vectores lentivirales fueron producidos (métodos suplementarios) y el título fue determinado en células 293T como unidades de transducción (TU) basadas en la expresión de eGFP. Ambos constructos de vectores lentivirales fueron inyectados en el espacio perivitelino de ovocitos fertilizados en una concentración de 109 TU/mL e implantados en ratones femeninos pseudo-embarazadas. Embriones implantados fueron luego recogidos justo antes del nacimiento y genotipo por PCR para seguir integración de eGFP. 73% (n = 22) y 83% (n = 32) de embriones recolectados había integrado el transgén para el CMV y el constructo lentivirales de CAG, respectivamente (tabla 1). Embriones transgénicos eran seccionada e inmuno-tinción para eGFP. Como se ilustra en la figura 3, solamente eGFP dispersos de células positivas se observan con el promotor del CMV (figura 3, panel superior) mientras que todas las células expresan GFP cuando el promotor CAG fue utilizado (figura 3, medio e inferior de los paneles).
Con el promotor CAG, 96% de los embriones transgénicos recolectados ubicuo expresan el transgén de la eGFP (tabla 1). Aunque ambos promotores son omnipresentes, sólo el promotor CAG es capaz de expresión sólida unidad del transgén en todas las células. Promotores omnipresentes alternativos fueron utilizados como promotores de la ubiquitina C y fosfoglicerato quinasa (PGK) y rindió resultados similares como los obtenidos con el promotor CAG con bajos niveles de expresión de eGFP (datos no mostrados).
En vivo mapeo de regiones genómicas reglamentarias para probar elementos de control específicos de tejido.
Para un gran número de aplicaciones, expresión de los transgenes en una manera específica de células en animales transgénicos se requiere. Además, generación de animales transgénicos puede ser altamente instrumental para la capacidad de putativo reguladoras fragmentos genomic de la DNA para controlar la expresión específica de la célula de un gen determinado. Por ejemplo, lentivirales mediado producción de animales transgénicos se utilizó para mapa reforzadores específicos de la célula que el control de la expresión de Neurogenin 3 (Neurog3)11. Neurog3 es un factor de transcripción de hélice-bucle-hélice (bHLH) base que controla el compromiso de progenitores pancreáticos hacia el destino endocrino. En ratones mutantes nulos Neurog3 , no células endocrinas en el páncreas pueden distinguir19. Un fragmento de ADN de 2,2 kb localizado entre las posiciones-5284 y-3061 en relación con la transcripción Neurog3 iniciar sitio fue clonado en un vector lentivirales aguas arriba un promotor mínimo de beta globina a la expresión de la unidad de un gen reportero de eGFP como se describió anteriormente 11. un constructo de control igualmente se generó mediante la clonación de un fragmento intergénico de 2,4 kb localizado en el cromosoma de ratón 6 (chr6: 14237279-14239685 en relación con la Asamblea de genoma de ratón mm9) en la misma columna vertebral lentivirales. Esta región genómica se localiza dentro de un desierto de mega base largo gen 1 entre genes Gpr85 y Ppp1r3a . Vectores lentivirales de alto título a continuación fueron producidos usando construcciones y llamado Neurog3- enh-eGFP y Chr6-eGFP.
Ambos vectores lentivirales fueron construidos y producción (métodos suplementarios). Puesto que no hay células expresando Neurog3 eran disponibles en la actualidad, no se pudo determinar la concentración TU. Alternativamente, el título fue medido como la concentración de la proteína de cápside p24. Los 2 vectores fueron inyectados en el espacio perivitelino de ovocitos fertilizados e implantados en ratones femeninos pseudo-embarazadas. Los embriones implantados fueron recogidos en el día embrionario 14.5 (E14.5) ya que esta etapa de desarrollo corresponde a la máxima expresión de Neurog3 en el páncreas. Embriones a continuación fueron genotipados a seguir integración de eGFP. 84% (n = 47) y el 71% (n = 48) de embriones recolectados había integrado el transgén para Neurog3- enh-eGFP y construcciones lentivirales eGFP Chr6 respectivamente (tabla 1). Para cada embrión, el brote pancreático fue disecado y seccionado luego realizar immunostaining. 92% de los embriones transgénicos de Neurog3- enh-eGFP expresa eGFP en el páncreas como se muestra en el panel superior de la figura 4 (representante de inmunotinción). Lo importante, la gran mayoría de eGFP positiva las células estaban también Neurog3 expresando las células (figura 4) que indica que el 2,2 kb Neurog3 enhancer es capaz de restringir la expresión de eGFP dentro de la población de células Neurog3 . Por oposición, ninguno de los embriones Chr6-eGFP expresa eGFP (panel inferior defigura 4 y tabla 1) en el páncreas o fuera del páncreas. Además, ninguna expresión ectópica de eGFP se observó fuera del páncreas en Neurog3- enh-eGFP embriones11.
Para los 4 experimentos presentados arriba, una precisa descripción cuantitativa de cada paso del procedimiento se presenta en la tabla 1. Esto ilustra la eficacia global del procedimiento. De hecho, al comparar el número de animales recogidos que integran el transgén con el número huevos fertilizados inyectados, el rendimiento global del procedimiento es 44% en promedio. El mismo rendimiento con una inyección de ADN pronuclear de una construcción que contiene el reforzador Neurog3 fusionados con el reportero de la beta-galactosidasa no supera el 3,1%.
Transducción de ovocitos fertilizados con un vector lentivirales conduce a la integración del transgén que se puede presentar en múltiples sitios10,13. El número relativo de sitios de integración del transgén se evaluaron mediante PCR cuantitativa en la DNA genomic (figura 5). Cuantificación de integración eGFP fue determinada por PCR cuantitativa (qPCR) y normalizada para Cdx2 gen que está presente en 2 copias por genoma como se describió anteriormente11. El número promedio de sitios de integración fue 19.36 ± 2,468 (SEM) y ± 9.537 1.186 (SEM) en embriones generados por Neurog3- enh-eGFP y construcción Chr6-eGFP, respectivamente. Curiosamente, los dos vectores lentivirales utilizados para producir estos animales presentaron títulos virales diferentes. La concentración de proteína de cápside p24 eran de 124 ng/μL para Neurog3- enh-eGFP vector y de 52 ng/μL para el control vector Chr6-eGFP. Es más probable que tal diferencia de título representará la diferencia significativa observada en números del sitio de integración en tanto población de embriones transgénicos (figura 5). Esto sugiere que el número promedio de sitios de integración obtenidos en un lote de ratones transgénicos fundador podría ser modulado mediante la acción viral con títulos diferentes.
Lo importante, no hay correlación directa fue observada entre la expresión de eGFP en embriones transgénicos de Neurog3- enh-eGFP y el número de copias del transgén que se integraron. En otras palabras, embriones que integran simples o múltiples copias del transgén - enh-eGFP Neurog3encontraron semejantemente a expresa eGFP en Neurog3 las células positivas.

Figura 1: Diagrama de flujo del procedimiento general de Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Preparación de la inyección micro pipetas y genotipificación.
(A) dibujos esquemáticos de microinyección Pipetas para resaltar las principales diferencias entre la pipeta usada para DNA o inyecciones de vectores lentivirales. Panel de la izquierda: se dibuja la forma general de dos tipos de pipeta. El círculo puntos destaca el área ampliada de la punta de la pipeta. También se presentan imágenes de las puntas de pipeta. Tenga en cuenta que para inyección lentivirales la punta tiene que ser roto como se indica con la línea de puntos y la imagen correspondiente. Panel de la derecha: ejemplo de inyección de huevo ajuste con la pipeta de sujeción a la izquierda, el óvulo fertilizado y la pipeta de inyección ya sea en un pronúcleo o en el espacio perivitelino. Barras de escala = 50 μm. (B) visualización en gel de agarosa eGFP del producto de PCR amplificados de la DNA genomic extraída de 8 embriones diferentes (carril 1 y 8). Sólo embriones 1, 2, 3, 5, 6 y 8 habían integrado el transgén de eGFP. El ADN plásmido pTrip PGK-eGFP utilizado para la producción de vectores lentivirales se utilizó como control positivo de PCR. Para el control negativo, H2O reemplazar el ADN en la reacción de PCR. MWM: marcador de peso molecular. BP = base par. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Promotores ubicuas expresión de eGFP reporter en coche embriones transgénicos.
cryo-secciones de 10 μm de embriones transgénicos fueron manchadas para visualizar la expresión de eGFP (verde) y de los núcleos (azul). Construcción de embriones generados con el promotor del CMV lentivirales (etiqueta superior izquierda) se recolectaron en E11.5. Se colectaron los embriones generados con la construcción de lentivirales promotor CAG (parte inferior izquierda la etiqueta) en E18.5. PB: brote pancreático, VSC: ventral medular, Vt: vértebra, Li: hígado, Ms: músculo de la correa abdominal. Barras de escala = 50 μm haga clic aquí para ver una versión más grande de esta figura.
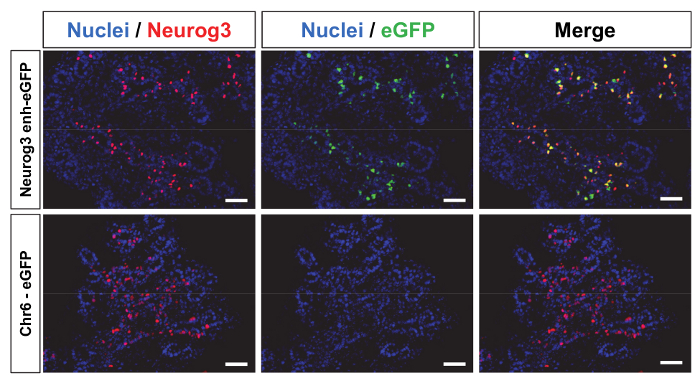
Figura 4: Expresión concreta de la célula del gene del reportero en embriones transgénicos es conducida por el reforzador Neurog3 . 10 μm cryo-secciones de yemas pancreáticas E14.5 de embriones transgénicos fueron manchadas para visualizar la expresión de Neurog3 (rojo), eGFP (verde) y de los núcleos (azul) como se describe en métodos suplementarios). Expresión Neurog3 se dispersa en el páncreas. Embriones transgénicos que integraron la Neurog3- enh-eGFP construcción expresa eGFP y la mayoría de las células positivas de eGFP Neurog3 positivo (panel superior). Embriones generados con la construcción de la Chr6-eGFP no expresan eGFP (panel inferior). Barras de escala = 50 μm haga clic aquí para ver una versión más grande de esta figura.

Figura 5: número de copias relativo de transgenes integrados. Cuantificación de eGFP sitios de integración relativa CDX2 gene tal como se describe en la sección de protocolo. Diagrama de caja de 25th aPercentil 75 . Puntos representan los diferentes embriones transgénicos que se generaron. La comparación de los sitios de los transgenes integrados entre las dos construcciones lentivirales es significativamente diferente (paramétrica prueba t, p = 0,001). Haga clic aquí para ver una versión más grande de esta figura.

Tabla 1: informe paso a paso cuantitativo durante el procedimiento completo. Durante el curso del procedimiento, se contaron el número total de huevos o embriones. La primera columna representa el número total de huevos que fueron recuperados de los oviductos de las hembras superovuladas. Sólo huevos con claro 2 cuerpos polares o pronúcleos visibles fueron inyectados y se divulgan. Después de la inyección y unas horas en cultura fueron implantados sólo los huevos inyectados que no fueron sometidas a lisis y tenían una morfología normal. A continuación se cuenta el número total de embriones que se recolectaron de las hembras seudopreñadas. Finalmente, embriones que habían integrado el transgén y expresó el reportero figuran en las dos últimas columnas. También se dan las mismas características para la comparación con un experimento usando inyección de ADN estándar pronúcleos. Aquí el transgén contuvo el reforzador Neurog3 conduce la expresión de un gen reportero de beta-galactosidasa (Neurog3- enh-LacZ). Haga clic aquí para descargar este archivo.
Discusión
La inyección perivitelino de vectores lentivirales en ovocitos fertilizados descritos aquí dio lugar a la producción de embriones transgénicos que rindió más del 70% de los embriones transgénicos en relación con el número total de embriones colectados. Este resultado es consistente con informes anteriores y ejemplifica la especificidad del procedimiento2,7,10,11,12. Al comparar todos los datos presentados en la tabla 1, se pueden destacar características importantes. En primer lugar, el número de huevos implantados correspondió a todos los huevos inyectados que tenían una morfología normal o que no fueron sometidas a lisis después de pocas horas en la cultura. 93% de los óvulos inyectados se implantaron sugiriendo una ausencia casi completa de la toxicidad rápida debido a la inyección de vectores lentivirales en el espacio perivitelino. La situación es dramáticamente diferente al considerar la inyección de ADN puesto que sólo el 44% de los huevos inyectados habían sobrevivido y fueron implantado. Además, la proporción de embriones colectados en relación con huevos implantados es idéntica entre los dos procedimientos, no sugiriendo ninguna toxicidad a largo plazo exacerbada de vectores lentivirales. En segundo lugar, al expresar el número de embriones que integra el transgén en relación con el número de huevos inyectados el rendimiento global es más de 10 veces mayor con la inyección de vectores lentivirales comparados con la inyección de ADN. Una diferencia de 86-fold se encuentra incluso al comparar el número de embriones que expresan transgenes entre los dos procedimientos utilizando el mismo constructo de enhancer Neurog3.
Lo importante, rendimiento de producción transgénica parece ser dependiente de la concentración de transducción de los vectores lentivirales usados. En otras palabras, los vectores lentivirales producción con un título por encima de 109 TU/mL son suficientes para obtener tal alto rendimiento. Como se describe en la sección de protocolo, es el volumen inyectado en el espacio perivitelino en el rango de 10 a 100 pL. Este volumen representa 10 a 100 partículas lentivirales activas. En comparación con las inyecciones de ADN estándar pronúcleos , el número total de animales del fundador generado con la misma cantidad de animales nacidos es por lo menos 10 veces mayor al usar vectores lentivirales. Además, la penetrancia de la expresión del transgén es extremadamente alta con este protocolo se observó ambos con ubicua y promotores específicos con excepción del promotor del CMV de la célula. Por oposición a celulares promotores ubicuos, el promotor del CMV se apaga activamente por metilación de ADN20 y ha demostrado ser incapaz de mantener la expresión a largo plazo sobre la transducción de señales en las células de vástago de pluripotent21. Esto podría explicar el número muy limitado de eGFP expresar las células en los embriones transgénicos. Por lo tanto, vectores lentivirales están bien adaptados para producir animales transgénicos que expresión de un transgen es controlado por un potenciador específico de célula. Lo importante, el protocolo puede utilizarse para detectar actividad de reforzador en vivo y a encontrar mapa transcripción sitios de unión del factor dentro de las regiones reguladoras11,12. Este enfoque de la proyección apenas se puede realizar mediante transgénesis estándar. El número total de animales del fundador es necesario probar todos los diferentes constructos y alcanzó significación estadística requeriría docenas de sesiones de inyección que se puede obtener rápidamente con transgénesis mediada lentivirales.
Una de las principales diferencias entre el procedimiento estándar y el método basado lentivirales reside en la integración del transgén. Mediante inyección pronuclear, los transgenes integrar al azar como copias múltiples en un único locus. Uso de vectores lentivirales, integración puede ocurrir en múltiples loci (una copia por locus) sin ser estrictamente aleatoria. Clonando sitios de integración utilizando la amplificación mediada por PCR lineal (LAM-PCR), el grupo de D. Trono ha demostrado que los transgenes integrar preferentemente en regiones de la cromatina abierta de los huevos fertilizados13. El sesgo de la integración no debe interferir o contribuir a la expresión del transgen en los ratones transgénicos. Integración durante la transducción lentivirales en un embrión de una célula escenario ocurre en cromatina abierta que no puede ser en la configuración abierta más tarde durante el desarrollo o en el adulto.
Además, al analizar el número de copia de transgenes integrados en animales de primera generación (F0) o de embriones, se observa una gran variación en el número de transgen integrado. En este estudio, se encontró un promedio de 19 copias integradas con el constructo Neurog3-enh-eGFP. Este número de la copia grande podría reflejar altos niveles de mosaicismo. Sauvain et al han realizado un extenso estudio de lugares geométricos integrados en animales F0 generados con el método mediado lentivirales descrito aquí13. Había seguido de 70 sitios de integración individual de 11 animales de F0 y examinó las tasas de transmisión para cada sitio de ratones transgénicos F0 a su progenie de la F1. La tasa global de transmisión de 44% para el transgen integrado individual sugiere que más a menudo fueron establecidos ya sea después de la fase S antes de la fase S en la etapa de dos células o embriones de una célula. De hecho, integración antes de la fase S transmitirá el transgén integrado a ambas células hijas, mientras que la integración después de la fase S transmita a una única célula de la hija. Así, el grado de mosaicismo de los transgenes integrados individuales es mínimo en ratones transgénicos obtenidos mediante esta técnica. Además indica que mayoría de integración se produzca en las primeras 12 h correspondiente al tiempo promedio de producción de la primera división en las condiciones de cultivo utilizadas. Esta integración cinética es consistente con el descrito por lentivirus en células T-linfoides22.
Lo importante, con un alto número de loci desnudar los transgenes integrados, establecer líneas de ratón no sería razonable. El número de cruces para segregar estos loci sería considerablemente alto. Esto representa una limitación importante de este método que debe utilizarse para la detección rápida de los efectos del transgen o para análisis simultáneo de múltiples transgenes. Sin embargo, todavía pueden establecerse líneas de ratón seleccionando del animal F0 los con el número de copia menor transgen integrado.
Desde la primera descripción del ADN pronuclear inyección método1, han realizado mejoras evadir muchos de los inconvenientes del procedimiento inicial. El primer conjunto de mejoras se basó en la integración específica en un locus preciso mediante una estrategia de intercambio de cassettes. Inyección pronuclear se realiza utilizando cualquiera de los dos CRE, recombinasas Flip o PhiC31 junto con un fragmento de ADN integradora flanqueado con loxP, FRT o attB sitios, respectivamente. En esta situación, el ADN integrativo se intercambia con un fragmento integrado flanqueado por el mismo sitio específico recombinase23,24. Aunque hasta el 60% de los animales de primera generación puede ser transgénicos23 usando este método, siguen aplican las limitaciones vinculadas a la tecnología de la inyección pronuclear. El segundo grupo de mejora se basa en inyecciones citoplásmicas de dos ADN circular, uno lleva el fragmento para integrar y una expresión que permite sea el Tol225, la bella durmiente26 o piggyBac transposases de27 . Utilizando estos métodos, se obtienen rendimientos altos (> 30%), pero más importante aún, la inyección citoplasmática es fácil de realizar y evita las restricciones debido a la inyección pronuclear como el protocolo base lentivirales. Además, los fragmentos de ADN muy grandes, como los cromosomas artificiales bacterianos, pueden ser integrados.
Está claro que lentivirales transgénesis mediada no reemplazará la norma ni la mejora de los procedimientos. Todavía este método representa una poderosa herramienta para la producción del modelo animal rápida y caracterización ya que reduce considerablemente el tiempo requerido para generar un número adecuado de animales con la variabilidad genética menos. Además, esta tecnología puede aplicarse directamente a todas las cepas de ratón, incluyendo las líneas transgénicas. Además, es crucial mencionar que el paisaje global de generación de nuevos modelos animales está a punto de cambiar con el desarrollo reciente de la tecnología CRISPR/Cas9. Hoy en día, inyección pronuclear de Cas9 proteína junto con la guía del RNA permite producción de genoma editado modelos animales con una eficacia del 40%28. Este enfoque podría beneficiarse en gran medida el uso de transgénesis mediada lentivirales. De hecho, el uso de vectores lentivirales no integradora29 transitorio expresar ambos Cas9 y guía RNAs podría resultar en aún mayores rendimientos de producción. La combinación de las nuevas tecnologías para producir modelos animales relevantes y robustos beneficiaría más internacionales grupos de investigación involucrados en el estudio de la patogénesis de la enfermedad y enfoques terapéuticos.
Divulgaciones
Los autores no tienen ningún conflicto de interés que revelar.
Agradecimientos
Agradecemos a Magali Dumont y Rolando Meloni para lectura crítica del manuscrito y iVector y Phenoparc ICM corazones para asistencia técnica en la producción de vectores lentivirales y animal vivienda respectivamente. Este trabajo fue financiado por el Instituto Hospitalo-Universitaire de Neurociencias Translationnelles de París, IHU-A-ICM, Avenir Investissements ANR-10-IAIHU-06. P.R. recibidas fondos para la Asociación de Langue Française pour l ' Etude du diabetes et des Maladies Métaboliques (ALFEDIAM) y un conjunto JDRF / INSERM conceder.
Materiales
| Name | Company | Catalog Number | Comments |
| PMSG 50UI | Sigma | G4527 | |
| hCG 5000UI | Sigma | CG5-1VL | |
| NaCl | Sigma | 7982 | |
| 100 mm petri dish | Dutsher | 353003 | |
| 4 wells Nunc dish | Dutsher | 56469 | IVF dish |
| M2 medium | Sigma | M7167 | |
| M16 medium | Sigma | M7292 | |
| 0,22 µm Syringe filter | Dutsher | 146611 | |
| Hyaluronidase Enzyme 30mg | Sigma | H4272 | mouse embryo tested |
| Insulin serynge | VWR | 613-3867 | Terumo Myjector |
| Curved forceps | Moria | 2183 | |
| Curved scissors | Moria | MC26 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| Borosilicate glass capillaries | Harvard apparatus | GC 100-10 | |
| Horizontal micropipette puller | Narishige | PN-30 | |
| Microforge | Narishige | MF-900 | |
| Inverted microscope | Nikon | Transferman NK2 5188 | Hoffman modulation contrast illumination is required |
| Micromanipulator | Eppendorf | Celltram air | |
| Controler of holding pipet | Eppendorf | Femtojet | |
| Mineral oil | Sigma | M8410 | mouse embryo tested |
| Microinjector | Eppendorf | Femtojet | Can be used to inject DNA or viral vectors |
| Dumont # 5 forceps | Moria | MC 40 | |
| vannas micro scissors | Moria | 9600 | |
| Isoflurane | centravet | ISO005 | ISO-VET 100% 250ml |
| ocrygel | centravet | OCR002 | |
| Povidone iodure | centravet | VET001 | vetedine 120ml |
| Buprenorphine | centravet | BUP002 | Buprecare 0,3Mg/ml 10ml |
| Tris-HCl | Sigma | T5941 | Trizma hydrochloride |
| EDTA | Sigma | E9884 | |
| SDS | Sigma | 436143 | |
| NaCl | Sigma | S7653 | powder |
| proteinase K | Sigma | P2308 | |
| oneTaq kit | NEB | M0480L | |
| Primers | Eurogentec | ||
| Strip of 8 PCR tube | 4titude | 4ti-0781 | |
| 96 well thermal cycler | Applied Biosystems | 4375786 | Veriti |
| Genomic DNA mini kit | invitrogen | K1820-02 | |
| Nanodrop 2000 | Thermo Scientific | ND-2000C | |
| qPCR Master mix | Roche | 4887352001 | SYBR Green |
| Multiwell plate 384 | Roche | 5217555001 | |
| qPCR instrument 384 well | Roche | 5015243001 | LightCycler 480 |
Referencias
- Gordon, J. W., Scangos, G. A., Plotkin, D. J., Barbosa, J. A., Ruddle, F. H. Genetic transformation of mouse embryos by microinjection of purified DNA. Proceedings of the National Academy of Science USA. 77 (12), 7380-7384 (1980).
- Bock, T. A., Orlic, D., Dunbar, C. E., Broxmeyer, H. E., Bodine, D. M. Improved engraftment of human hematopoietic cells in severe combined immunodeficient (SCID) mice carrying human cytokine transgenes. Journal of Experimental Medicine. 182 (6), 2037-2043 (1995).
- Miyakawa, Y., et al. Establishment of human granulocyte-macrophage colony stimulating factor producing transgenic SCID mice. British Journal of Haematology. 95 (3), 437-442 (1996).
- Hirabayashi, M., et al. A comparative study on the integration of exogenous DNA into mouse, rat, rabbit, and pig genomes. Experimental Animals. 50 (2), 125-131 (2001).
- Isola, L. M., Gordon, J. W. Transgenic animals: a new era in developmental biology and medicine. Biotechnology. 16, 3-20 (1991).
- Zufferey, R., Nagy, D., Mandel, R. J., Naldini, L., Trono, D. Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo. Nature Biotechnology. 15 (9), 871-875 (1997).
- Lois, C., Hong, E. J., Pease, S., Brown, E. J., Baltimore, D. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science. 295 (5556), 868-872 (2002).
- Ewerling, S., et al. Evaluation of laser-assisted lentiviral transgenesis in bovine. Transgenic Research. 15 (4), 447-454 (2006).
- Ritchie, W. A., Neil, C., King, T., Whitelaw, C. B. Transgenic embryos and mice produced from low titre lentiviral vectors. Transgenic Research. 16 (5), 661-664 (2007).
- Park, F. Lentiviral vectors: are they the future of animal transgenesis. Physiological Genomics. 31 (2), 159-173 (2007).
- van Arensbergen, J., et al. A distal intergenic region controls pancreatic endocrine differentiation by acting as a transcriptional enhancer and as a polycomb response element. PLoS One. 12 (2), e0171508 (2017).
- Friedli, M., et al. A systematic enhancer screen using lentivector transgenesis identifies conserved and non-conserved functional elements at the Olig1 and Olig2 locus. PLoS One. 5 (12), e15741 (2010).
- Sauvain, M. O., et al. Genotypic features of lentivirus transgenic mice. Journal of Virology. 82 (14), 7111-7119 (2008).
- Punzon, I., Criado, L. M., Serrano, A., Serrano, F., Bernad, A. Highly efficient lentiviral-mediated human cytokine transgenesis on the NOD/scid background. Blood. 103 (2), 580-582 (2004).
- Zennou, V., et al. The HIV-1 DNA flap stimulates HIV vector-mediated cell transduction in the brain. Nature Biotechnology. 19 (5), 446-450 (2001).
- Miyoshi, H., Blomer, U., Takahashi, M., Gage, F. H., Verma, I. M. Development of a self-inactivating lentivirus vector. Journal of Virology. 72 (10), 8150-8157 (1998).
- Yee, J. K., et al. A general method for the generation of high-titer, pantropic retroviral vectors: highly efficient infection of primary hepatocytes. Proceedings of the National Academy of Science USA. 91 (20), 9564-9568 (1994).
- Castaing, M., et al. Efficient restricted gene expression in beta cells by lentivirus-mediated gene transfer into pancreatic stem/progenitor cells. Diabetologia. 48 (4), 709-719 (2005).
- Gradwohl, G., Dierich, A., LeMeur, M., Guillemot, F. neurogenin3 is required for the development of the four endocrine cell lineages of the pancreas. Proceedings of the National Academy of Science USA. 97 (4), 1607-1611 (2000).
- Scharfmann, R., Axelrod, J. H., Verma, I. M. Long-term in vivo expression of retrovirus-mediated gene transfer in mouse fibroblast implants. Proceedings of the National Academy of Science USA. 88 (11), 4626-4630 (1991).
- Norrman, K., et al. Quantitative comparison of constitutive promoters in human ES cells. PLoS One. 5 (8), e12413 (2010).
- Vandegraaff, N., Kumar, R., Burrell, C. J., Li, P. Kinetics of human immunodeficiency virus type 1 (HIV) DNA integration in acutely infected cells as determined using a novel assay for detection of integrated HIV DNA. Journal of Virology. 75 (22), 11253-11260 (2001).
- Ohtsuka, M., et al. One-step generation of multiple transgenic mouse lines using an improved Pronuclear Injection-based Targeted Transgenesis (i-PITT). BMC Genomics. 16, 274 (2015).
- Tasic, B., et al. Site-specific integrase-mediated transgenesis in mice via pronuclear injection. Proceedings of the National Academy of Science USA. 108 (19), 7902-7907 (2011).
- Sumiyama, K., Kawakami, K., Yagita, K. A simple and highly efficient transgenesis method in mice with the Tol2 transposon system and cytoplasmic microinjection. Genomics. 95 (5), 306-311 (2010).
- Garrels, W., et al. Cytoplasmic injection of murine zygotes with Sleeping Beauty transposon plasmids and minicircles results in the efficient generation of germline transgenic mice. Biotechnology Journal. 11 (1), 178-184 (2016).
- Ding, S., et al. Efficient transposition of the piggyBac (PB) transposon in mammalian cells and mice. Cell. 122 (3), 473-483 (2005).
- Aida, T., et al. Cloning-free CRISPR/Cas system facilitates functional cassette knock-in in mice. Genome Biology. 16, (2015).
- Philippe, S., et al. Lentiviral vectors with a defective integrase allow efficient and sustained transgene expression in vitro and in vivo. Proceedings of the National Academy of Science USA. 103 (47), 17684-17689 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados