Method Article
Lentivirale vermittelte Produktion von transgenen Mäusen: eine einfache und hocheffiziente Methode für die direkte Untersuchung der Gründer
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen ein Protokoll zur Förderung der Transgen-Integration und Herstellung von Gründer Transgene Mäuse mit hoher Wirksamkeit durch eine einfache Injektion eines Lentivirale Vektors in den Perivitelline Raum einer befruchteten Eizelle.
Zusammenfassung
Seit fast 40 Jahren stellt man DNA-Injektion der standard Methode zur Erzeugung transgener Mäuse mit zufälligen Integration der Transgene. Solch ein Routineverfahren ist weit verbreitet in der ganzen Welt genutzt und seine wichtigste Einschränkung befindet sich in der schlechten Wirksamkeit von Transgen-Integration, was zu einer geringen Ausbeute von Gründer Tiere. Nur wenige Prozent der Tiere geboren nach der Implantation der befruchteten Eizellen injiziert haben das Transgen integriert. Im Gegensatz dazu Lentivirale Vektoren sind leistungsfähige Werkzeuge für integrative Gentransfer und deren Einsatz zur befruchtete Eizellen transduzieren ermöglicht hocheffiziente Produktion des Gründers transgener Mäuse mit einem Durchschnittsertrag über 70 %. Darüber hinaus jede Maus Belastung kann verwendet werden, um Transgene Tiere zu erzeugen und die Penetranz des Transgens Ausdruck ist extrem hoch, über 80 % mit Lentivirale vermittelten Transgenese im Vergleich zu DNA-Mikroinjektion. Die Größe des DNA-Fragments, die Ladung durch den Lentivirale Vektor sein können beschränkt sich auf 10 kb und die große Einschränkung dieser Methode darstellt. Mit einer einfachen und leicht durchzuführen Injektion unter die Zona Pellucida der befruchteten Eizellen, sind mehr als 50 Gründer Tiere in einer einzigen Sitzung der Mikroinjektion herstellbar. Diese Methode eignet sich sehr direkt in Gründer Tiere, schnellen Gewinn und Verlust von Funktionsstudien oder Bildschirm genomische DNA-Regionen für ihre Fähigkeit zur Kontrolle und Regulierung Gen Ausdruck in Vivodurchführen.
Einleitung
Die Pionierarbeit von Gordon Et Al. 1980 zeigte, dass die Plasmid DNA-Injektion in die männliche Vorkerne von befruchteten Eizellen nach der Implantation bei pseudopregnant Mäusen die Erzeugung transgener Tiere hervorbringen kann, die integriert die Plasmid DNA-1. Die Demonstration, dass transgene Säugetiere generiert werden können hatte einen enormen Einfluss auf global Life-Sciences, öffnet den Weg zu neuen Feldern der Forschung sowohl für Grundlagenwissenschaften und Translationale Biomedizin. In den vergangenen vier Jahrzehnten ist DNA Mikroinjektion Routinepraxis geworden. Obwohl eine enorme Anzahl von transgenen Mäuse hergestellt wurden, die standard-Methode ist nicht voll einsatzfähig für alle Maus-Stämmen und erfordert zeitaufwendig Rückkreuzungen2,3. Seine Anwendung auf andere Arten bleibt herausfordernd4 und der Gesamtertrag der Transgen-Integration beschränkt sich auf wenige Prozentsatz der geborenen Tiere5. Darüber hinaus stellt die Wirksamkeit der Transgen-Integration den limitierenden Faktor, der die Armen Gesamtausbeute von man DNA-Injektion erklärt. In dieser Hinsicht integrative virale Vektoren sind die effizientesten Tools zum Fracht und transgene zu integrieren und so könnten neue Mittel, um deutlich erhöhen Integration Ausbeute, die einzige Einschränkung ist, dass die Transgen-Größe, die6 10 kb nicht überschreiten darf .
Mit dem Briefumschlag-Protein von vesikuläre Stomatitis Virus (VSV) Pseudo-typisierte Lentivirale Vektoren sind pantropic und hoch integrative gen-Transfer-Tools und können verwendet werden, um die befruchteten Eizellen7transduzieren. Die Zona Pellucida rund um die Eizellen ist eine natürliche Virus Barrier und damit Transduktion mit Lentivirale Vektoren können übergeben werden muss. Transgene Tiere wurden durch 3D-Steuerung befruchtete Eizellen nach dem Mikro-Bohren oder Entfernen der Zona Pellucida8,9generiert. Injektion unter die Zona Pellucida in den Perivitelline Raum scheint jedoch die einfachste Methode, um die befruchteten Eier wie anfangs beschrieben von Lois und Kollegen7transduzieren.
Die Perivitelline Injektion von Lentivirale Vektoren kann hohe Erträge bei der Herstellung transgener Tiere, die mehr als 70 % der geborenen Tiere sind. Dieser Ertrag ist mehr als 10-fach höher als die beste Ausbeute, die mit standard Vorkerne DNA Injektion7,10,11erreicht werden kann. In diesem Zusammenhang wird eine Einzelsitzung der Injektionen mindestens 50 transgenen Gründer (F0) generieren. Die große Zahl der Gründer ist daher kompatibel mit Phänotypisierung des Effekts Transgens direkt auf F0 Mäuse ohne die Notwendigkeit zu erzeugen transgene Mauslinien durchgeführt. Dieser Vorteil ermöglicht schnelle Screening des Effekts Transgens und ist speziell auf in Vivo -Gewinn und Verlust der Funktionsstudien innerhalb von Wochen durchführen. Darüber hinaus können regulatorische DNA-Elemente auch rasch untersucht werden, um Karte Enhancer und DNA-Motive, die durch Transkription Faktoren11,12gebunden. Transgene Integration mit man Injektionen in der Regel als mehrere Kopien in einen einzigartigen Ort. Mit Lentivirale Vektoren kommt Integration in mehrere Loci als eine einzelne Kopie pro Locus10,13. Daher ist die Vielzahl der integrierten Loci am ehesten, die sehr hohe Expression Penetranz beobachtet in transgenen Gründer, wodurch das neue generierte Modell robuster zugeordnet.
Wichtig ist, wenn man Injektion von DNA, ist Visualisierung der Vorkerne während des Verfahrens zwingend notwendig. Diese technische Einschränkung verhindert die Verwendung von befruchteten Eizellen, die aus einer Vielzahl von Maus-Stämmen. Daher die Produktion eines transgenen Modells in einem bestimmten Stamm für die Vorkerne sind unsichtbar die Produktion von Tieren in einem freizügigen Stamm erfordert, gefolgt von mindestens 10 aufeinander folgenden Rückkreuzungen das Transgen in der gewünschten Maus übertragen Zuchtlinie Mit der Lentivirale Vektor-Injektionen Perivitelline Raum ist immer sichtbar und die Injektion erfordert keine hochspezifische Fähigkeiten. Als Beispiel wurden NOD/SCID transgenen Mäusen, die nicht geeignet für die Vorkerne Injektion sind mit dem viralen Vektoren Injektionen14gewonnen.
Hier ist ein umfassendes Protokoll präsentiert, um einfache Herstellung von transgenen Mäusen mit Lentivirale Vektor-Injektionen in den Perivitelline Raum des Embryos Bühne einer Zelle zu ermöglichen. Transgene Ausdruck gesteuert entweder mit allgegenwärtigen oder Zelle spezifische Promotoren wird ausführlich beschrieben.
PTrip ΔU3 Lentivirale Rückgrat wurde in dieser Studie15verwendet. Dieser Vektor kann für die Herstellung von Replikation defekt Lentivirale Vektoren in denen U3-Sequenz teilweise gelöscht wurde zum Entfernen U3 promotoraktivität und generieren eine Self inactivating Vektor (SIN)16. Lentivirale Vektor Bestände wurden durch Transiente Transfektion von Zellen der HEK-293T mit dem p8.91 Kapselung Plasmid (ΔVpr ΔVif ΔVpu ΔNef)6, pHCMV-G, Codierung die vesikuläre Stomatitis-Virus (VSV) Glykoprotein-G17und pTRIP ΔU3 produziert. rekombinanten Vektor. Die produktionsfeinplanung Verfahren wird als ergänzende Methoden bereitgestellt.
Produktion von hohen Titer Lentivirale Vektor Aktien erfolgt unter Biosafety Level II Bedingungen (BSL-2). Dies gilt auch für die meisten transgene außer Onkogene, die in BSL-3 hergestellt werden. Daher ist die Produktion in BSL-2 Bedingungen in den meisten Fällen ausreichend. Darüber hinaus werden der Einsatz und die Produktion in der Regel für die meisten nationalen Regulierungsbehörden Umgang mit gentechnisch veränderten Organismen (GVO) getrennt. Begrenzte Mengen an Replikation inkompetent SIN Lentivirale Vektoren (unter 2 µg Protein p24 Kapsid) können unter BSL-1 Bedingungen wie die französischen GVO-Agentur in Übereinstimmung mit den Empfehlungen der Europäischen Union beschrieben verwendet werden.
Protokoll
Alle Prozeduren, die tierische Arbeit beinhalten ethische Genehmigung erhalten haben und sind durch das französische Ministerium für Forschung und Bildung unter der Nummer APAFIS #5094-20 16032916219274 v6 und 05311.02 autorisiert worden. Die ICM Tierhaus PHENOPARC hat durch das französische Landwirtschaftsministerium unter der Akkreditierungsnummer B75 akkreditiert 13 19. Das gesamte Protokoll erfordert Durchführung jedes Verfahren innerhalb eines präzisen Zeitrahmens, das in zusammengefasst werden in Abbildung 1.
1. Tier Kauf und Vorbereitung der basischen Verbindungen
- Tierische Kauf
- Bestellen Sie 25 vasektomierten Männer B6CBAF1/JRj, die 8 Wochen alt sind (F1-Generation von Original Kreuze zwischen ♀C57Bl/6JRj und ♂CBA/JRj).
Hinweis: Isolieren Sie Männchen bei der Ankunft. Vasektomierten Männer können für mindestens ein Jahr wieder verwendet werden.
Ändern Sie die Käfige alle 3 Wochen. - Bestellen Sie 50 B6CBAF1/JRj-Weibchen, die 10 Wochen alt und halten Sie einen Pool von mindestens 50 Tiere.
- Bestellen Sie 10-15 C57BL/6JRj fruchtbaren Männchen, die 8 Wochen alt sind.
- Bestellen Sie 30 C57BL/6JRj-Weibchen, die 4 Wochen alt sind.
- Bestellen Sie 25 vasektomierten Männer B6CBAF1/JRj, die 8 Wochen alt sind (F1-Generation von Original Kreuze zwischen ♀C57Bl/6JRj und ♂CBA/JRj).
- Anästhesie und Euthanasie
- Betäubung erfolgt mit einem Volumen von 300μL Ketamin/Xylazin-Mix, intraperitoneal injiziert (Ketamin in einer Dosis von 150μg/g Körpergewicht, Xylazin bei einer Dosis von 0.15μg / g Körpergewicht). Tiere sind unterstellt Heizkissen um Körpertemperatur anzupassen. Reflexe durch Kneifen der Schweif des Tieres vor Beginn des Verfahrens zu überprüfen.
- Euthanasie erfolgte durch zervikale Dislokation. Enthauptung wurde als eine sekundäre Methode zum Tod des Tieres zu bestätigen. Euthanasie von Embryonen erfolgte durch Enthauptung.
Hinweis: Bei der Ankunft, können Sie Tiere mindestens 1 Woche bis zur Anlage (ohne Behandlung oder Paarung) gewöhnen. Wichtig ist, können jede Mausstämme einschließlich der Transgene Linien als fruchtbare Männchen und fruchtbaren Weibchen für Superovulation genutzt werden. Die Wahl der Sorte sollte entsprechend den Anforderungen der wissenschaftlichen Fragestellung erfolgen.
- Hormon-Vorbereitung
- 910 µL PSMG (Schwangere Stute Serum Gonadotropin) Puffer in 1 lyophilisierten PMSG Durchstechflasche einfügen, machen 100 µL-Aliquots und Lagerung bei-20 ° C.
Hinweis: Jedes aliquoten enthält 55 UI für 11 Mäuse. Niemals halten PMSG Aliquote für mehr als 2 Wochen nach der ersten Anwendung. - Fügen Sie 2730 hCG (humanes Choriongonadotropin) Puffer in 1 µL hCG Fläschchen lyophilisiert. 100 µL-Aliquots, erstellen und speichern bei-20 ° C.
Hinweis: Jedes aliquoten enthält 55 UI für 11 Mäuse.
- 910 µL PSMG (Schwangere Stute Serum Gonadotropin) Puffer in 1 lyophilisierten PMSG Durchstechflasche einfügen, machen 100 µL-Aliquots und Lagerung bei-20 ° C.
- Hyaluronidase-Vorbereitung
- Wiederherzustellen Sie 1 Durchstechflasche mit Hyaluronidase mit 3 mL M2 Medium zu erhalten eine 10 mg/mL Stammlösung 50 µL-Aliquots. Dann speichern Sie bei-20 ° C.
- Chirurgie-Instrumente-Vorbereitung
- Sterilisieren Sie alle Operation-Tools mit dem Autoklaven.
(2) Superovulation weibliche Spender
- In einem Tierhaus mit 12 h Tag - Nacht-Zyklen, injizieren PMSG um 14:00 am Tag-3. Injizieren Sie hCG um 12 Uhr am Tag-1 und Mate mit fruchtbaren Männchen kurz nach hCG-Injektion.
- Am Tag-3, fügen Sie 1 mL steriler 0,9 % NaCl-Lösung in 1 aliquoten von 100 µL der PMSG (55 UI). Injizieren Sie 10 C57BL/6JRj Weibchen mit 100 µL intraperitoneal mit einer Spritze ohne jede Totvolumen.
Hinweis: Jede Maus erhalten 5 UI der PMSG. - Am Tag-1, fügen Sie 1 mL steriler 0,9 % NaCl-Lösung in 1 aliquoten von 100 µL von hCG (55 UI). Spritzen Sie die Mäuse, die die PMSG-Injektion mit 100 µL verdünnter hCG-Lösung (5UI) intraperitoneal erhielten. Verwenden Sie eine Spritze ohne jede Totvolumen. Führen Sie die Injektion langsam und warten Sie vor dem Entfernen der Nadelöhrs, so dass die Flüssigkeit nicht leckt.
Hinweis: Jede Maus erhalten 5 UI von hCG. Injektion von hCG sollte 46 h nach PMSG durchgeführt werden. - Platzieren Sie jedes C57BL/6JRj-Weibchen in den Käfig des Männchens Stud direkt nach der hCG-Injektion.
- Überprüfen Sie vaginalen Stecker am Morgen der Tag 0 und nutzen Sie die positiven Weibchen befruchtete Eier zu sammeln.
3. bereiten Sie die B6CBAF1/jRj Pseudopregnant Weibchen
- Paaren Sie ein vasektomierten Mann am Vortag Eiersammlung (Tag-1) mit 2 B6CBAF1/JRj Weibchen um 17:00.
Hinweis: Es ist sehr wichtig zur Paarung mit Weibchen, die stammen aus verschiedenen Käfigen, Synchronisation von weiblichen Zyklen zu vermeiden. Dadurch erhöht sich die Ausbeute an vaginalen Stecker zu erhalten. Darüber hinaus fügen Sie ein Weibchen nicht zu einem männlichen Käfig, der in den letzten 2 Tagen geändert wurde. Wirksamkeit des reproduktiven Verhaltens bei den Männchen wird erhöht, wenn der Käfig schmutzig ist.
4. die befruchteten Eier Sammlung
- Vorbereitung
- Hyaluronidase-Stammlösung, die Hyaluronidase Arbeitslösung vorzubereiten fügen Sie 1450 µL M2 hinzu.
- Geben Sie einen Tropfen von 100 µL Arbeitslösung Hyaluronidase pro Weibchen verwendet, um die befruchteten Eier in einem 100 mm Petrischale zu produzieren und bei Zimmertemperatur aufbewahren.
- Fügen Sie 500 µL M16 in 4 Brunnen Platten. Verwenden Sie 2 Brunnen je nach Art der Lentivirale Vektoren, die injiziert werden: eines enthält auch die injizierten Eizellen und andererseits die, die nicht gespritzt. Platzieren Sie die 4-well-Platten im Inkubator bei 37 ° C mit 5 % CO2 Atmosphäre.
- Erhebung und Verarbeitung von Embryonen Pipetten vorbereiten.
- Die Glas-Hämatokrit-Kapillaren (75 mm/60 µL) durch das Zentrum des Hartglas Kapillare Schläuche in der Flamme drehen zu erweichen.
- Nehmen Sie die Kapillaren so schnell wie möglich und ziehen Sie einen Schlauch mit einem Innendurchmesser von ca. 300 µm. ziehen auf den gekühlten Schläuche, eine nette Pause zu erhalten erhalten vom Herd.
- Sammeln Sie röhrenförmig.
- Einschläfern Sie C57BL/6JRj Weibchen durch zervikale Dislokation um 09:00 am Tag 0. Tod wird durch Enthauptung bestätigt.
Hinweis: Diese Sterbehilfe-Methode wurde von der IACUC genehmigt und Europäische Empfehlungen folgt. - Führen Sie einen großen horizontalen Schnitt um die Bauchhöhle mit einer Schere zu öffnen. Die Eileiter befindet sich zwischen der Gebärmutter und der Eierstöcke.
- Entfernen Sie die handelt und die Membran mit prominenten Blutgefäße mit gebogenen Pinzette.
- Trennen Sie die Eileiter aus dem Eierstock mit gebogenen Pinzette.
- Orientieren Sie gebogene Pinzetten, um die Eileiter aus dem Eierstock mit gebogenen Schere zu schneiden.
- Ziehen Sie die Eileiter und aus der Gebärmutter mit einer gebogenen Schere geschnitten.
Vorsicht: Berühren Sie nicht der geschwollenen Ampulle, die die befruchteten Eier enthält. Führen Sie die gesamte Prozedur mit sterilen Instrumenten. - Legen Sie alle gesammelten röhrenförmig in M2 Medium (35 mm Kulturschale) bei Raumtemperatur
- Legen Sie 2 röhrenförmig in den gleichen 100 µL Tropfen Hyaluronidase Arbeitslösung (0,3 mg/mL).
- Einschläfern Sie C57BL/6JRj Weibchen durch zervikale Dislokation um 09:00 am Tag 0. Tod wird durch Enthauptung bestätigt.
- Entfernen Sie kumuluszellen aus befruchteten Eiern.
- Unter einem Stereomikroskop verwenden 2 Insulinspritzen: erstens um die Eileiter zu halten und die zweite zu zerreißen der Ampulle und zerstreuen befruchtet Eier in die Hyaluronidase Arbeitslösung.
- Nehmen Sie die vorbereitete Glas pipettieren für das Sammeln von Eiern und verbinden Sie es mit Schlauch und ein 0,22 μm-Filter montiert auf das Mundstück zu Aspirieren Sie die Eier. Sammeln Sie alle Eier und waschen Sie sie durch aufeinander folgende Passage in 6 verschiedenen Tropfen 100 µL M2 Medium.
- Legen Sie gewaschene befruchtete Eier in befeuchteten 37 ° C Inkubator mit einer Atmosphäre von 5 % CO2 M16 Medium.
5. Herstellung Injektion Pipetten
- Dünnwandige Kapillaren Glasröhren (10-15 cm lang) mit einem Außendurchmesser von 1 mm verwenden Sie und Klemmen Sie diese Kapillare in horizontalen Mikropipette Puller.
Hinweis: In die horizontale Pipette Abzieher 3 Parameter einstellbar: Hitze macht, Kraft und Zeit-Verzögerung zwischen Heizung und ziehen ziehen. Passen Sie diese Parameter zu injizierenden mehrkanalpipette, die die in Abbildung 2Apräsentiert ähnelt. Verwenden Sie für Benutzer, die routinemäßig DNA Mikroinjektion ausführen die standard-Einstellungen und passen Sie die Verzögerung zwischen Heizung und ziehen um die globale Form der Pipettenspitze ändern.
6. machen Holding Pipetten
- Verwenden Sie eine Injektion Pipette, um der haltepipette vorzubereiten.
- Legen Sie eine Injektion Pipette auf eine Microforge. Schneiden Sie die Pipette mit der Microforge eine symmetrische Spitze von 80 bis 100 µm Durchmesser zu erhalten. Dann Polieren Sie die Spitze mit Wärme auf die Microforge um eine symmetrische Runde Form ohne scharfe Hecken zu erhalten.
7. Vorbereitung der Injektion Pipette mit der Lentivirale Vektor
- Zentrifugieren der Lentivirale Vektor-Aufhängung an 160 X g für 2 min, pellet-Ablagerungen oft in gefrorenen Lentivirale Bestände vorhanden.
- Den überstand zu erholen und in eine neue 0,5 mL Tube in einer Klasse II Sicherheitsschrank übertragen.
- Übertragen Sie 1 µL überstand auf eine Injektion Pipette wie in Schritt 5 mit einem Micro-Loader beschrieben.
- Die Injektion Pipette auf dem Instrument-Halter von der richtigen Mikromanipulator festgelegt. Verbinden Sie die Holding Pipettieren mit der linken Mikromanipulator.
Hinweis: Die Transduktion Titer des Lentivirale Vektors werden direkt mit der Wirksamkeit der Gründer Produktion in Verbindung gebracht. Für hohe Wirksamkeit (> 70 %), virale Vektoren verwenden, mit einem Titer im Bereich von 100 ng von p24 Kapsid Protein/µL. Wenn der Titer als Transduktion Einheiten (TU) zum Ausdruck kommt, sollte die Titer über 109 TU/mL. Lentivirale Vektor Bestände müssen hergestellt werden, durch Transiente Transfektion von Zellen der 293T mit dem p8.91 Encapsidation Plasmid, pHCMV-G, Kodierung der vesikuläre Stomatitis-Virus (VSV) Glykoprotein-G wie in ergänzenden Methoden18beschrieben.
(8) Mikro-Injektion
- 8 µL M2 Medium in der Mitte einer Depression Folie und Deckel mit leichten Paraffinöl (Embryo getestet) zu verzichten um Verdunstung zu vermeiden.
- Platz 20 Eier in den Tropfen wie zuletzt wie möglich verteilt.
Achtung: Machen Sie keine Luftblasen, bei der Hinterlegung der Embryonen. - Stellen Sie sicher, dass die Injektion PIPETTENSPITZE geöffnet ist. Ist dies nicht der Fall, tippen Sie auf die Injektion-Pipette mit der haltepipette.
- Festlegen der Microinjector für eine Einspritzzeit 20 s.
Hinweis: Die Viskosität der viralen Aufhängung ermöglicht klare Visualisierung der Dispersion von viralen Vektoren im Perivitelline Raum. Der Einspritzdruck sollte angepasst werden, um füllen den gesamten Raum innerhalb von 20 s der Injektion, entspricht einem Volumen von 10 bis 100 pl. Einspritzdruck sollte 600 hPa nicht überschreiten. - Aspirieren Sie ein befruchtetes Ei, das pro 2 Kernen und 2 Polkörper mit der haltepipette unter dem Stereomikroskop enthält.
- Injizieren Sie das Ei mit der Microinjector in 8,4 im Bereich Perivitelline beschriebene Einstellungen verwenden.
Vorsicht: Berühren Sie nicht die Plasmamembran mit Einspritzung pipettieren. - Injizieren Sie alle befruchteten Eier in Chargen von 20 Eiern zur Verfügung und die eingespritzte Eier sofort in vorgewärmte M16-Medium in den Brutkasten befeuchtete 37 ° C mit einer Atmosphäre von 5 % CO2.
Hinweis: Brüten Sie die injizierten Eier für ein Minimum von 30 min nach der Injektion vor Embryonentransfers.
9. Übertragung der Embryonen in B6CBAF1/JRj Pseudopregnant Weibchen
- Überprüfen Sie nach der Paarung B6CBAF1/JRj Weibchen mit B6CBAF1/JRj Vasektomie Männchen Kopulation Stecker 16 h. Hierzu kurz vor Beginn der Ei-Sammlung.
- Die injizierten Embryo Implantation Pipetten vorbereiten.
- Implantation Pipetten für Embryonen wie beschrieben für das Sammeln und den Umgang mit Embryonen (Schritt 4.2) zu machen. Wählen Sie Pipetten mit einem Innendurchmesser von ca. 150 µm mit einem schmalen Teil ca. 4-5 cm in der Länge.
Hinweis: Die Spitze sollte Flamme poliert, um mögliche Schäden für die Eier oder die Eileiter zu verringern.- Füllen Sie mit leichten Paraffinöl (Embryo getestet) oberhalb der Pipette Schulter.
- Aspirieren Sie eine kleine Luftblase, dann M2 Medium, und schließlich eine zweite Luftblase.
- Aufstellen Sie, Embryonen ein hinter einander das Gesamtvolumen des Mediums zu minimieren, die im Eileiter zusammen mit den Embryonen injiziert wird.
- Abschließend laden einen sehr kleinen Tropfen leicht Paraffinöl (Embryo getestet) über einen Embryo Breite.
Achtung: Seien Sie beim Umgang mit der Pipette sanft.
- Implantation Pipetten für Embryonen wie beschrieben für das Sammeln und den Umgang mit Embryonen (Schritt 4.2) zu machen. Wählen Sie Pipetten mit einem Innendurchmesser von ca. 150 µm mit einem schmalen Teil ca. 4-5 cm in der Länge.
- Embryo-Transfer.
- Sterilisieren Sie alle Instrumente.
- Das Weibchen mit einer intraperitonealen Injektion von 300 μL sterile NaCl 0,9 % Lösung mit 150 μg pro g Körpergewicht von Ketamin und 0,15 µg pro Gramm Körpergewicht von Xylazin zu betäuben.
- Überprüfen Sie die Tiefe der Narkose durch den Schweif des Tieres mit Zangen Kneifen und injizieren Sie Subcutaneouly 0,1 mg/kg Analgetikum (Buprenorphin) vor Beginn des Verfahrens zu.
- Rasieren Sie 2 cm auf beiden Seiten des Rückens entlang des Rückenmarks auf der Ebene der letzten Rippe.
- Platzieren Sie die weibliche Maus auf ein Heizkissen und in einem sterilen Bereich. Schneiden Sie einen 2 x 2 cm-Fenster in der Mitte der Maus zurück.
- Tragen Sie eine antiseptische Lösung (10 % Povidon-Jod auf) auf die Haut und machen Sie einen 1 cm quer Schnitt mit der Schere zu, dann schieben Sie die Haut seitlich, bis der Fruchtknoten (Farbe orange) durch die Körperwand sichtbar ist.
- Machen Sie einen 5 mm-Schnitt in der Körperwand oberhalb der Eierstock mit der feinen Schere unter chirurgischen Binokular.
- Holen Sie die Fettpolster mit einer atraumatischen Bulldog-Klemme und herausziehen Sie des Eierstocks, der Eileiter und der Spitze des Uterus.
- Visualisieren Sie der Ampulle und machen Sie eine Hemisektion mit Vannas Schere auf das Segment der Eileiter, das Eierstöcke mit der Ampulle verbindet.
- Einführen der transferpipette Embryo und Eier in der Ampulle, Halt an die erste Luftblase in der Implantation Pipette zu liefern.
- Wiederholen Sie den Vorgang auf der zweite Eileiter.
- Die Haut mit Wunde Clips hautnah.
- Ort des Tieres bei der Beitreibung Kammer (39 ° C, 30-60 min) bis ganz wach.
- Wiederholen Sie schmerzstillende Injektion nach 12 h und 48 h bei Anzeichen von Schmerzen oder Stress.
- Wunde Clips ca. 7-10 Tage nach der Operation zu entfernen.
- Überprüfen Sie implantierte Weibchen für Schwangerschaft indem Sie ihre Gewichtskurve alle 3 Tage nach der Implantation. Eine signifikante Gewichtszunahme beobachtet werden 10 bis 12 Tage nach der Implantation und werden Richtwerte für die Schwangerschaft.
Hinweis: Alle Embryonen, die hier Willen entwickeln werden stellen vermeintliche transgenen Gründer. Der Phänotyp der diese Gründer kann analysiert werden, in alle Entwicklungsphasen oder nach der Geburt nach wissenschaftlichen Fragestellung an die Generation dieser transgenen Tiere verbunden.
10. die Genotypisierung transgenen Gründer
- Bereiten Sie Genotypisierung Puffer mit 10 mM Tris-HCl, pH 8 vor; 5 mM EDTA, pH 8.0 mit 0,2 % SDS (w/V), 50 mM NaCl. Die Genotypisierung Puffer durch einen 0,22 µm-Filter zu sterilisieren und für mehrere Monate bei Raumtemperatur lagern.
- Put extraembryonic Membranen (für Embryonen) oder kleines Stück Schwanz (für geborene Tiere) in 500 µL Genotypisierung Puffer gefiltert und fügen 15 µL Proteinase K (20 mg/mL). Inkubation über Nacht bei 55 ° C.
- Zentrifugieren Sie lysate 15.000 x g für 5 min und dann mit 1 µL des Überstandes für die PCR-Reaktion. Lysate kann bei 4 ° C mehrere Monate aufbewahrt werden.
- Durchführen Sie die PCR-Amplifikation eines Fragments des Transgens in einem 20 µL Reaktionsvolumen mit 1 X PCR-Puffer, 1,5 mM MgCl2, 200 µM dNTPs, 0,2 µM jeder PCR-Primer, 1 UI Taq DNA-Polymerase und 1 µL jeder verdauten Probe. Als Negativkontrolle verwenden Sie 1 µL H2O. Als Positivkontrolle verwenden Sie DNA aus der Lentivirale Vektor-Plasmid enthält das Transgen.
- Für die Erkennung von eGFP beschrieben verwenden:
eGFP Forward Primer: 5' GACCACATGAAGCAGCACGACTTCT 3'
eGFP Reverse Primer: 5' TTCTGCTGGTAGTGGTCGGCGAGCT 3' - PCR-Amplifikation in einem Thermocycler durchführen: 4 min bei 94 ° C, gefolgt von 35 Zyklen 1 min bei 94 ° C, 1 min bei 60 ° C und 2 min bei 72 ° C.
- Laden Sie das PCR-Produkt auf einem 2 % Agarose-Gel, um ein 300 bp eGFP PCR-Produkt wie in Abbildung 2 bdargestellt zu visualisieren.
Hinweis: Alle Personen mit einer 300 bp PCR Band eGFP Transgen integriert haben und als Transgenik angesehen werden können. - Transgene Ausdruck bei transgenen Tieren zu analysieren. Führen Sie beispielsweise histologischen und Immunostaining wie in Abbildung 3 und Abbildung 4 dargestellten und beschriebenen ergänzenden Methoden.
Hinweis: Beide Transgene Ausdruck und Phänotyp-Analyse sollte mit entsprechenden Methoden nach globalen wissenschaftlichen Fragestellung durchgeführt werden.
11. die Quantifizierung des Transgens Exemplarzahl
- Quantitative PCR DNA-Proben vorbereiten.
- Genomischen DNA (gDNA) von der Proteinase K lysate erwarb Schritt 10.3 mithilfe eines kommerziellen Kits nach Anweisungen des Herstellers zu extrahieren.
- Quantifizieren Sie gDNA durch Spektralphotometrie bei 260 nm.
- Verdünnen Sie jede gDNA Probe, eine Endkonzentration von 10 ng/µL.
- Für jede Probe vorbereiten 5 serielle Verdünnungen (1:5) in H2O, 6 Rohre in den folgenden Konzentrationen zu erhalten: 10 ng/µL, 2 ng/µL, 0,4 ng/µL, 0,08 ng/µL, 0,016 ng/µL und 0.0032 ng/µL
- Die quantitative PCR (qPCR) Reaktion Mischung vorbereiten.
- Bereiten Sie den Primer-Mix für qPCR. Für jedes Paar der Grundierung für qPCR verwenden, fügen Sie 10 µL vorwärts Grundierung (100 µM Grundierung Stammlösung), 10 µL des rückwärts-Primer (100 µM) und 80 µL H2O.
Hinweis: Um eGFP verstärken, verwenden Sie nach vorne TCCAGGAGCGCACCATCTTCTTCA und Reverse TTGATGCCGTTCTTCTGCTTGTCG Primer. Cdx2 gen dient als Normalizer für qPCR (2 Exemplare pro Genom). Verwenden Sie für Cdx2 Normalizer vorwärts GCCAGGGACTATTCAAACTACAGG und Reverse GACTTCGGTCAGTCCAGCTATCTT Primern - Bereiten Sie 2 qPCR-Mixe, eine mit dem eGFP-Grundierung-Mix und eine mit Cdx2 Grundierung Mix. Bereiten Sie ausreichend qPCR-Mischung, die 6 Verdünnungen Duplikate von jeder gDNA zu verstärken. Eine qPCR Reaktion enthält 3,8 µL H2O, 5 µL fluoreszierend grün 2 x Reaktion Mischung und 0,2 µL Grundierung-Mix.
Hinweis: Für jedes transgenen Tier zu testen, werden 24 qPCR Reaktionen durchgeführt werden. Die Reaktion Mischung sorgt für eine 384 auch qPCR-Maschine. - Für jedes Tier zu testen, zu verteilen: 12 Brunnen mit 9 µL eGFP qPCR Mix und 12 Brunnen mit 9 µL Cdx2 qPCR-Mix. 2 Brunnen mit den eGFP qPCR Mix 1 µL jeder gDNA Verdünnung hinzu und mischen Sie 2 Brunnen mit eGFP qPCR.
- Urlaub 2 Brunnen für jeden qPCR mischen in welche gDNA wurde durch H2O als Negativkontrolle ersetzen.
- Bereiten Sie den Primer-Mix für qPCR. Für jedes Paar der Grundierung für qPCR verwenden, fügen Sie 10 µL vorwärts Grundierung (100 µM Grundierung Stammlösung), 10 µL des rückwärts-Primer (100 µM) und 80 µL H2O.
- 384-well-Platte in der qPCR-Maschine und die folgende laufenden Protokoll anwenden: 10 min bei 95 ° C dann 50 Zyklen von 10 s bei 95 ° C und 1 min bei 60 ° C.
- Analysieren von Daten. Zeichnen Sie für jedes gDNA testen die Ct-Werte als Funktion des Protokolls von insgesamt gDNA Betrag (6 Punkte in der Duplikate). Passen Sie die Kurve über lineare Regression mit der zuletzt Quadrat-Methode und extrapolieren Sie den Ct-Wert entspricht der Schnittpunkt mit der y-Achse zu. Die hochgerechneten Ct-Werte für eGFP und normalisierten Cdx2 verwenden, um die Kopienzahl eGFP relativ Cdx2 berechnen (2 Exemplare) mit den standard 2ΔdCt Methode11.
Ergebnisse
Transgene Tiere wurden mit dem hier vorgestellten Protokoll generiert. Vertreter führt beide allgegenwärtig und Zelle Art spezifische Transgene Ausdruck dargestellt.
Konstitutive Expression von transgenen
Allgegenwärtige Promotoren sind Grundlagenforschung Werkzeuge transgene in eine nachhaltige und effiziente Weise zum Ausdruck zu bringen. Diese Promotoren sind für eine sehr große Vielzahl von Anwendung von in-vitro- Zelle Transfektion auf in Vivo Transgenese in kleinen und großen Tiere verwendet.
Lentivirale Vektoren wurden errichtet, um auszudrücken das grün fluoreszierende Reportergen (eGFP) unter der Kontrolle der Projektträger Cytomegalovirus (CMV) oder die composite-Promoter, die CAG auf der Verschmelzung von der Huhn-Aktin-Promoter und der CMV-Enhancer basiert. Beide Lentivirale Vektoren wurden produziert (ergänzende Methoden) und der Titer wurde als Transduktion Einheiten (TU) basierend auf eGFP Ausdruck in den 293T Zellen bestimmt. Beide Lentivirale Vektor-Konstrukte wurden in den Perivitelline Raum der befruchteten Eizellen in einer Konzentration von 109 TU/mL und implantierten in Pseudo-schwangeren weiblichen Mäusen injiziert. Implantierte Embryonen wurden als nächstes kurz vor der Geburt gesammelt und genotypisiert mittels PCR, eGFP Integration zu folgen. 73 % (n = 22) und 83 % (n = 32) gesammelten Embryonen hatten das Transgen für die CMV und integriert das CAG Lentivirale Konstrukt, bzw. (Tabelle 1). Transgene Embryonen wurden dann geschnitten und Immuno-gebeizt für eGFP. Wie in Abbildung 3dargestellt, nur vereinzelte eGFP positive Zellen beobachtet mit dem CMV-Promotor (Abbildung 3, oben) alle Zellen GFP geäußert, wenn der CAG-Promoter verwendet wurde (Abbildung 3, mittleren und unteren Platten).
Mit der CAG-Promoter ausgedrückt 96 % der gesammelten transgenen Embryonen ubiquitär eGFP Transgen (Tabelle 1). Obwohl beide Promotoren allgegenwärtig sind, kann nur der CAG-Promoter Laufwerk robust Expression des Transgens in allen Zellen. Alternative allgegenwärtige Promotoren wurden wie Phosphoglycerate Kinase (PGK) und Ubiquitin-C Promotoren verwendet und brachte ähnliche Ergebnisse wie die, die mit der CAG-Veranstalter mit geringerer Ausdruck eGFP (Daten nicht gezeigt) erhalten.
In vivo mapping von regulatorischen genomische Regionen Gewebe spezifische Bedienelemente testen.
Für eine große Anzahl von Anwendungen ist Ausdruck von transgenen Zellen gezielt bei transgenen Tieren erforderlich. Darüber hinaus kann Erzeugung transgener Tiere sehr maßgeblich die Fähigkeit der vermeintlichen regulatorischen genomische DNA-Fragmente, Zelle Konkretisierung eines bestimmten Gens auf den Bildschirm. Als Beispiel diente Lentivirale vermittelten Erzeugung transgener Tiere Zelle spezifische Enhancer, dass Kontrolle Neurogenin-3 (Neurog3) Ausdruck11Karte. Neurog3 ist ein Transkriptionsfaktor Grundlage Helix-Loop-Helix (bHLH), der das Engagement der pankreatischen Stammväter gegenüber der endokrinen Schicksal steuert. In Neurog3 null mutierten Mäusen können keine endokrinen Zellen in der Bauchspeicheldrüse19unterscheiden. Ein 2,2 kb-DNA-Fragment lokalisiert zwischen den Positionen-5284 und-3061 im Vergleich zu Neurog3 Transkription Site gestartet wurde in einen Lentivirale Vektor stromaufwärts geklont, die Beta-Globin minimal Förderer auf Laufwerk Ausdruck einer eGFP Reportergen wie oben beschrieben 11. ein Konstrukt wurde in ähnlicher Weise generiert durch Klonen ein 2,4 kb intergenetischer Fragment auf Maus Chromosom 6 lokalisiert (chr6: 14237279-14239685 im Vergleich zu mm9 Maus Genom Versammlung) im gleichen Lentivirale Backbone. Diese genomische Region ist innerhalb einer 1 Mega-Base lange gen Wüste zwischen Gpr85 und Ppp1r3a gen lokalisiert. Hohe Titer Lentivirale Vektoren wurden weiter mit beide Konstrukte und benannte Neurog3- Enh-eGFP und Chr6-eGFP hergestellt.
Beide Lentivirale Vektoren wurden konstruiert und produziert (ergänzende Methoden). Da keine Zellen mit dem Ausdruck Neurog3 derzeit verfügbar waren, konnte die TU-Titer nicht ermittelt werden. Alternativ wurde der Titer als Konzentration des p24 Kapsid Proteins gemessen. 2 Vektoren wurden in den Perivitelline Raum der befruchteten Eizellen injiziert und Pseudo-schwangeren weiblichen Mäusen implantiert. Die implantierten Embryonen wurden an embryonalen Tag 14,5 (E14.5) gesammelt, wie diese Entwicklungsstufe der maximalen Ausdruck des Neurog3 in der Bauchspeicheldrüse entspricht. Embryonen wurden als nächstes genotypisiert, eGFP Integration zu folgen. 84 % (n = 47) und 71 % (n = 48) gesammelten Embryonen hatten das Transgen für Neurog3- Enh-eGFP und Chr6-eGFP Lentivirale Konstrukte bzw. integriert (Tabelle 1). Für jedes Embryo war die Pankreatische Knospe seziert und dann geschnitten um Immunostaining durchzuführen. 92 % der Neurog3- Enh-eGFP transgenen Embryonen ausgedrückt eGFP in der Bauchspeicheldrüse, wie in Abbildung 4 Oberseite (repräsentative Immunostaining) dargestellt. Wichtig ist, ist die überwiegende Mehrheit der eGFP positive Zellen waren auch Neurog3 mit dem Ausdruck ihrer Zellen (Abbildung 4) darauf hinweist, dass die 2,2 kb Neurog3 Enhancer eGFP Ausdruck innerhalb der Neurog3 -Zell-Population zu beschränken. Durch Opposition ausgedrückt keiner der Chr6-eGFP Embryonen eGFP (Abbildung 4 Bodenplatte und Tabelle 1) in der Bauchspeicheldrüse oder außerhalb der Bauchspeicheldrüse. Darüber hinaus wurde keine ektopische Expression von eGFP außerhalb der Bauchspeicheldrüse in Neurog3- Enh-eGFP Embryonen11beobachtet.
Für die 4 Experimente, die oben dargestellt ist eine genaue quantitative Beschreibung der einzelnen Schritte des Verfahrens in Tabelle 1dargestellt. Dies zeigt die globale Wirksamkeit des Verfahrens. In der Tat ergibt sich eine vergleicht die Anzahl der gesammelten Tiere ein, die das Transgen mit der Nummer injizierten befruchteten Eiern integriert, globale des Verfahrens 44 % im Durchschnitt. Die gleiche Rendite mit einer man DNA-Injektion eines Konstrukts, enthält die Neurog3-Enhancer verschmolzen zu Beta-Galaktosidase Reporter übersteigt 3,1 % nicht.
Transduktion von befruchteten Eizellen mit einem Lentivirale Vektor führt zu Transgen-Integration, die auf mehreren Seiten10,13auftreten kann. Die relative Anzahl der Transgen-Integration-Websites wurden anhand quantitativen PCR, auf genomischer DNA (Abbildung 5). Quantifizierung der eGFP Integration wurde bestimmt durch quantitative PCR (qPCR) und normiert auf Cdx2 -gen, das bei 2 Exemplaren pro Genom wie oben beschrieben11vorhanden ist. Die durchschnittliche Anzahl der Integration Websites war 19.36 ± 2,468 (SEM) und 9.537 ± 1.186 (SEM) in Embryonen bzw. aus Neurog3- Enh-eGFP und Chr6-eGFP Konstrukt generiert. Interessanterweise stellte die beiden Lentivirale Vektoren verwendet, um diese Tiere zu produzieren verschiedene virale Titer. Die Konzentration der p24 Kapsid Protein wurden 124 ng/µL für Neurog3- Enh-eGFP Vektor und 52 ng/µL für das Steuerelement Chr6-eGFP Vektor. Es ist sehr wahrscheinlich, dass der wesentliche Unterschied in Integration Website Zahlen in beiden Bevölkerung von transgenen Embryonen (Abbildung 5) beobachtet wie Titer Unterschied ausmachen werden. Dies deutet darauf hin, dass die durchschnittliche Anzahl der Integration Websites erhalten in einem Stapel von Gründer transgenen Mäusen mit viralen Aktien mit verschiedenen Titer moduliert werden konnte.
Wichtig ist, war keine direkte Korrelation zwischen der Ausdruck eGFP in Neurog3- Enh-eGFP transgenen Embryonen und die Anzahl der Transgen-Kopien, die integriert wurden beobachtet. Das heißt, waren Embryonen, die entweder einzelne oder mehrere Kopien der Neurog3- Enh-eGFP Transgen integriert ebenso ausdrückliche eGFP in Neurog3 positive Zellen gefunden.

Abbildung 1: Flussdiagramm des Gesamtverfahrens Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Vorbereitung der Mikro-Injektion Pipetten und Genotypisierung.
(A) schematische Zeichnungen der Mikroinjektion Pipetten Hauptunterschiede zwischen mehrkanalpipette für DNA oder Lentivirale Vektor Injektionen verwendet hervorheben. Links Panel: die Gesamtform der beiden Arten der Pipette wird gezeichnet. Der gestrichelte Kreis zeigt den erweiterten Bereich der pipettieren Spitze. Bilder der pipettieren Tipps werden ebenfalls vorgestellt. Beachten Sie, dass für Lentivirale Injektion die Spitze gebrochen, wie mit der gepunkteten Linie und das entsprechende Bild angegeben werden muss. Rechts: Beispiel der Ei-Injektion, die Einstellung mit der Abhaltung pipettieren auf der linken Seite, die befruchtete Eizelle und Injektion pipettieren entweder in einem Pronukleus oder im Perivitelline Raum. Skalieren von Balken = 50 µm. (B) Visualisierung auf Agarosegel eGFP PCR-Produktes verstärkt aus genomischer DNA extrahiert aus 8 verschiedenen Embryonen (Bahn 1 bis 8). Nur Embryonen 1, 2, 3, 5, 6 und 8 hatte das eGFP Transgen integriert. Die DNA Plasmid pTrip PGK-eGFP verwendet für die Produktion der Lentivirale Vektor diente als PCR-positiv-Kontrolle. Für die negativ-Kontrolle ersetzt H2O DNA in der PCR-Reaktion. MWM: Molekulargewicht Marker. BP = Basenpaar. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Allgegenwärtige Promotoren fahren Ausdruck des Reporters eGFP in transgenen Embryonen.
10 µm Cryo-Sektionen von transgenen Embryonen wurden gefärbt, um eGFP Ausdruck (grün) und Zellkerne (blau) zu visualisieren. Embryonen erzeugt mit dem CMV Projektträger Lentivirale konstruieren (Top Links-Label) an E11.5 gesammelt wurden. Embryonen erzeugt mit dem CAG Projektträger Lentivirale Konstrukt (linke Bodenmarke) wurden im E18.5 gesammelt. PB: Pankreas Knospe, VSC: ventrale Rückenmark, Vt: Wirbel, Li: Leber, Ms: Muskel von den Bauchgurt. Skalieren von Balken = 50 µm Klicken Sie bitte hier, um eine größere Version dieser Figur.
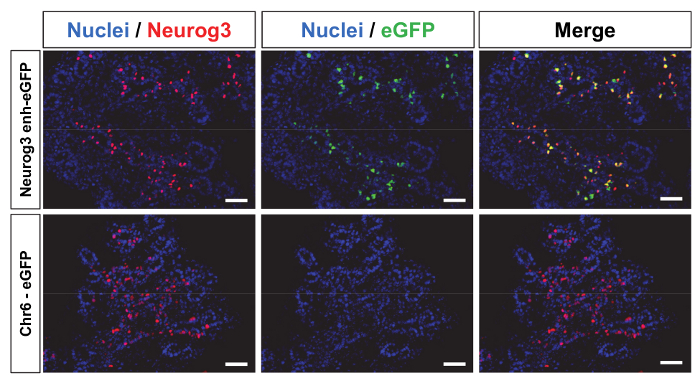
Abbildung 4: Zelle Konkretisierung der Reporter-gen in transgenen Embryonen wird angetrieben durch die Neurog3 -Enhancer. 10 µm Cryo-Profile aus E14.5 pankreatischen Knospen von transgenen Embryonen wurden gefärbt, um den Ausdruck des Neurog3 (rot), eGFP (grün) und Zellkerne (blau) als ergänzende Methoden beschrieben visualisieren). Neurog3 Ausdruck wird in der Bauchspeicheldrüse verstreut. Transgene Embryonen, die die Neurog3- Enh-eGFP integriert konstruieren ausdrückliche eGFP und die meisten eGFP positive Zellen sind Neurog3 positiv (Oberseite). Embryonen, die mit dem Chr6-eGFP-Konstrukt generiert wurden nicht eGFP (Bodenplatte) auszudrücken. Skalieren von Balken = 50 µm Klicken Sie bitte hier, um eine größere Version dieser Figur.

Abbildung 5: Relative Kopienzahl des integrierten transgene. Quantifizierung von eGFP Integration Websites im Vergleich zu CDX2 gen wie im Protokoll Abschnitt beschrieben. Box-Plot von 25th zu75 Perzentil . Punkte stehen für die verschiedenen transgenen Embryonen, die erzeugt wurden. Der Vergleich der Transgene integriert stellen zwischen den beiden Lentivirale Konstrukte unterscheidet sich deutlich (ungepaarte parametrischen t-Test, p = 0,001). Bitte klicken Sie hier für eine größere Version dieser Figur.

Tabelle 1: Schritt für Schritt quantitative Bericht während der kompletten Prozedur. Im Laufe des Verfahrens wurden die Gesamtzahl der Eizellen oder Embryonen gezählt. Die erste Spalte gibt die Gesamtzahl der Eier, die von den Eileiter superovulated Weibchen abgerufen wurden. Nur Eier mit klar 2 Polkörper und/oder sichtbar Vorkerne injiziert wurden und werden gemeldet. Nach der Injektion und ein paar Stunden in der Kultur wurden nur die eingespritzte Eier, die waren nicht lysiert und hatte eine normale Morphologie implantiert. Als nächstes werden die Gesamtzahl der Embryonen, die von den pseudopregnant Weibchen gesammelt wurden gezählt. Schließlich sind Embryonen, die hatte das Transgen integriert und zum Ausdruck der Reporters in den letzten beiden Spalten aufgeführt. Die gleichen Funktionen sind auch für den Vergleich mit einem Experiment mit standard Vorkerne DNA Injektion gegeben. Hier enthalten das Transgen die Neurog3 Enhancer Ausdruck eines Beta-Galaktosidase-Reporter-Gens (Neurog3- Enh-LacZ) fahren. Bitte klicken Sie hier, um diese Datei herunterladen.
Diskussion
Die Perivitelline Injektion von Lentivirale Vektoren in befruchteten Eizellen, die hier beschriebenen führte zu die Herstellung von transgenen Embryonen, die mehr als 70 % der transgenen Embryonen bezogen auf die Gesamtzahl der gesammelten Embryonen ergab. Dieses Ergebnis steht im Einklang mit früheren Berichten und beispielhaft für die Besonderheit des Verfahrens2,7,10,11,12. Vergleicht man die Daten, die in Tabelle 1dargestellt, können wichtige Merkmale hervorgehoben werden. Erstens entspricht die Anzahl der implantierten Eier alle injizierten Eizellen, die hatte einer normale Morphologie oder waren nach wenigen Stunden in Kultur nicht lysiert. 93 % der injizierten Eizellen wurden implantiert vorschlagen eine fast völlige Fehlen von rapid Toxizität durch die Injektion von Lentivirale Vektor im Perivitelline Raum. Die Situation unterscheidet sich dramatisch, wenn DNA-Injektion in Betracht, da nur 44 % der injizierten Eizellen überlebt hatte und implantiert wurden. Darüber hinaus ist das Verhältnis der gesammelten Embryonen relativ implantierten Eier zwischen den beiden Verfahren vorschlagen keine verschärften Langzeittoxizität Lentivirale Vektoren identisch. Zweitens ergibt sich wenn die Anzahl der Embryonen zum Ausdruck zu bringen, die das Transgen im Verhältnis zur Anzahl der injizierten Eizellen integriert global mehr als 10mal höher mit Lentivirale Vektor Injektion im Vergleich zu DNA-Injektion. Ein 86-fold Unterschied ist sogar vergleicht man die Anzahl der Embryonen, die mit dem Ausdruck Transgen zwischen den beiden Verfahren unter Verwendung der gleichen Neurog3 Enhancer Konstrukt gefunden.
Transgene Produktionsertrag scheint vor allem abhängig von der Transduktion Titer der verwendeten Lentivirale Vektoren sein. Das heißt, Lentivirale Vektoren produziert mit einem Titer über 109 TU/mL sind ausreichend, um solch hohe Ausbeute zu erhalten. Wie im Abschnitt Protokoll beschrieben, ist das injizierte Volumen im Bereich Perivitelline im Bereich von 10 bis 100 pl. Dieses Volumen wird 10 bis 100 aktiven Lentivirale Partikel vertreten. Im Vergleich zu standard Vorkerne DNA-Injektionen ist die Gesamtzahl der Gründer Tiere mit der gleichen Menge von geborenen Tieren erzeugt mindestens 10-fach höher, wenn Lentivirale Vektoren verwenden. Darüber hinaus die Penetranz der Expression des Transgens ist extrem hoch mit diesem Protokoll wurde beobachtet, dass beide mit allgegenwärtigen und Zell-spezifische Promotoren mit Ausnahme der CMV-Promoter. Durch Opposition zu zellulären allgegenwärtigen Promotoren die CMV-Promotor aktiv heruntergefahren wird durch DNA-Methylierung20 und hat gezeigt, dass keine langfristige Ausdruck bei der Transduktion in pluripotente Stammzellen21gewährleistet werden. Dies könnte erklären, der sehr begrenzte Anzahl von eGFP Zellen beobachtet in den transgenen Embryonen zum Ausdruck zu bringen. Lentivirale Vektoren eignen sich daher gut für Transgene Tiere zu erzeugen, in denen Ausdruck ein Transgen durch eine Zelle spezifische Enhancer gesteuert wird. Wichtig ist, kann das Protokoll für den Enhancer Aktivität in Vivo auf den Bildschirm und Karte Transkription Faktor Bindungsstellen in regulatorischen Regionen11,12zu finden verwendet werden. Dieses Screening-Ansatz kann kaum mit standard Transgenese durchgeführt werden. Die Gesamtzahl der Gründer Tiere mussten die verschiedenen Konstrukte zu testen und statistischen Signifikanz zu erreichen würden Dutzende von Injektion Sitzungen erfordern, während sie schnell mit Lentivirale vermittelten Transgenese abgerufen werden kann.
Einer der Hauptunterschiede zwischen dem standard-Verfahren und der Lentivirale basierte Methode befindet sich in der Transgen-Integration. Mit man Injektion, transgene zufällig als mehrere Kopien in einen einzigartigen Ort integrieren. Mit Lentivirale Vektoren, kann Integration an mehrere Loci (ein Exemplar pro Locus) auftreten, ohne streng zufällig zu sein. Durch Klonen Integration Websites mit Linear Amplification Mediated PCR (LAM-PCR), hat die Gruppe von D. Trono gezeigt, dass transgene bevorzugt in offenen Chromatin Regionen der befruchteten Eier13zu integrieren. Die Integration Vorspannung sollte nicht stören oder dazu beitragen, die Transgene Ausdruck in den transgenen Mäusen. Integration bei Lentivirale Transduktion in einem Embryo eine Zelle Stadium tritt in offenen Chromatin, die möglicherweise nicht immer noch in der offenen Konfiguration später während der Entwicklung oder beim Erwachsenen.
Darüber hinaus wird bei der Analyse der heftnummern integrierte Transgene Tiere der ersten Generation (F0) oder Embryonen eine große Variation in der Anzahl der integrierten Transgen beobachtet. In dieser Studie wurde durchschnittlich 19 integrierte Exemplaren gefunden mit dem Neurog3-Enh-eGFP-Konstrukt. Diese große Kopienzahl könnte hohe Mosaikbildung widerspiegeln. Sauvain Et Al. durchgeführt haben eine umfangreiche Studie der integrierten Loci in F0 Tiere erzeugt mit der Lentivirale vermittelte Methode beschrieben hier13. Sie folgten 70 individuelle Integration Standorte in 11 F0 Tiere und die Rate der Übertragung für jeden Standort von transgenen Mäusen F0, F1-Nachkommen untersucht. Die Gesamtrate der Transmission von 44 % für einzelne integrierte Transgen deutet darauf hin, dass sie in den meisten Fällen entweder nach der S-Phase von einer Zelle Embryonen oder vor der S-Phase im zwei-Zell-Stadium errichtet wurden. In der Tat würde Integration vor der S-Phase übertragen das integrierte Transgen an beide Tochterzellen während der Integration nach die S-Phase nur eine tochterzelle übermitteln würde. So ist der Grad der Mosaikbildung für einzelne integrierte transgene in transgenen Mäusen erhalten durch diese Technik minimal. Dies bedeutet weiter, dass die meisten Integration innerhalb der ersten 12 h entsprechend der durchschnittlichen Zeit der Produktion der ersten Spaltung in die verwendeten Kulturbedingungen auftreten wird. Diese Integration kinetische entspricht für Lentiviren in T-lymphoiden Zellen22beschrieben.
Wichtig ist, würde mit einer hohen Anzahl an Loci baring integrierte transgene Mauslinien Einrichtung nicht zumutbar. Die Anzahl der Kreuzungen dieser Loci zu trennen wäre sehr hoch. Dies stellt eine wichtige Einschränkung dieser Methode, die für schnelle Screening des Transgens Effekte oder für simultane Analyse von mehreren transgenen verwendet werden soll. Dennoch können Mauslinien noch hergestellt werden, indem aus F0 Tier diejenigen mit die niedrigsten integrierte Transgen Kopienzahl.
Seit der Erstbeschreibung der man DNA-Injektion Methode1wurden Verbesserungen, die viele der Nachteile des ursprünglichen Verfahrens zu umgehen vorgenommen. Der erste Satz von Verbesserungen stützte sich auf die gezielte Integration in eine präzise Lokus mit einer Kassette-Austausch-Strategie. Man Injektion erfolgt mittels entweder CRE, Flip oder PhiC31 rekombinasen zusammen mit einer integrativen DNA-Fragment flankiert mit LoxP, FRT oder AttB Websites, beziehungsweise. In diesem Fall wird die integrative DNA mit einem integrierten Fragment flankiert mit dem gleichen Rekombinase bestimmte Website23,24ausgetauscht. Obwohl bis zu 60 % der ersten Generation Tiere transgenen23 mit solchen Methode sein kann, gelten die Einschränkungen verbunden mit der Technologie von man Injektion noch. Der zweite Satz von Verbesserung basiert auf zytoplasmatischen Injektionen von zwei kreisförmigen DNA, man trägt das Fragment zu integrieren und damit Ausdruck der beiden Tol225, Sleeping Beauty26 oder PiggyBac27 transposasen. Mit diesen Methoden werden hohe Erträge erzielt (> 30 %), aber noch wichtiger ist, die zytoplasmatischen Injektion ist einfach durchzuführen und umgeht die Einschränkungen aufgrund man Injektion als Lentivirale basierte Protokoll. Darüber hinaus können sehr große DNA-Fragmente, z. B. bakterielle künstliche Chromosomen integriert werden.
Es ist klar, dass Lentivirale vermittelten Transgenese nicht der Standard noch die verbesserte Verfahren ersetzen wird. Noch stellt diese Methode ein leistungsfähiges Werkzeug für schnelle Tiermodell Herstellung und Charakterisierung dar, da es erheblich die erforderliche Zeit reduziert, richtige Anzahl von Tieren mit den wenigsten genetische Variabilität zu generieren. Darüber hinaus kann diese Technologie direkt auf alle Mausstämme einschließlich einer transgenen Linien angewendet werden. Darüber hinaus ist es wichtig zu erwähnen, dass die globalen Landschaft der Generation von neuartigen Tiermodellen wird sich mit der jüngsten Entwicklung der CRISPR/Cas9 Technologie ändern. Heute, man Injektionen von Cas9 Protein zusammen mit Guide RNA ermöglicht, dass die Produktion des Genoms Tiermodellen mit einer Wirksamkeit von 40 %28bearbeitet. Dieser Ansatz könnte weitgehend durch die Verwendung von Lentivirale vermittelten Transgenese zugute. In der Tat könnte die Verwendung von nicht-integrative Lentivirale Vektoren29 vorübergehend zum Ausdruck bringen beide Cas9 und RNAs führen sogar höhere Erträge der Produktion führen. Die Kombination aus neuesten Technologien, relevante und robuste Tiermodellen zu produzieren würden die meisten internationalen Forschungsgruppen beteiligt Studium der Pathogenese der Krankheit und therapeutische Ansätze profitieren.
Offenlegungen
Die Autoren haben keinen Interessenkonflikt, offen zu legen.
Danksagungen
Wir danken Magali Dumont und Rolando Meloni für kritische Lektüre des Manuskripts und iVector und Phenoparc ICM Kerne für technische Unterstützung bei Lentivirale Vektor Produktion und Tier bzw. Gehäuse. Diese Arbeit wurde unterstützt durch das Institut Hospitalo Universitaire de Neurowissenschaften Translationnelles de Paris, IHU-A-ICM, Investissements Avenir ANR-10-IAIHU-06. P.r. erhielt die Mittel für die Association de Langue Française pour l'Etude du Diabète et des Maladies Métaboliques (ALFEDIAM) und eine gemeinsame JDRF / INSERM gewähren.
Materialien
| Name | Company | Catalog Number | Comments |
| PMSG 50UI | Sigma | G4527 | |
| hCG 5000UI | Sigma | CG5-1VL | |
| NaCl | Sigma | 7982 | |
| 100 mm petri dish | Dutsher | 353003 | |
| 4 wells Nunc dish | Dutsher | 56469 | IVF dish |
| M2 medium | Sigma | M7167 | |
| M16 medium | Sigma | M7292 | |
| 0,22 µm Syringe filter | Dutsher | 146611 | |
| Hyaluronidase Enzyme 30mg | Sigma | H4272 | mouse embryo tested |
| Insulin serynge | VWR | 613-3867 | Terumo Myjector |
| Curved forceps | Moria | 2183 | |
| Curved scissors | Moria | MC26 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| Borosilicate glass capillaries | Harvard apparatus | GC 100-10 | |
| Horizontal micropipette puller | Narishige | PN-30 | |
| Microforge | Narishige | MF-900 | |
| Inverted microscope | Nikon | Transferman NK2 5188 | Hoffman modulation contrast illumination is required |
| Micromanipulator | Eppendorf | Celltram air | |
| Controler of holding pipet | Eppendorf | Femtojet | |
| Mineral oil | Sigma | M8410 | mouse embryo tested |
| Microinjector | Eppendorf | Femtojet | Can be used to inject DNA or viral vectors |
| Dumont # 5 forceps | Moria | MC 40 | |
| vannas micro scissors | Moria | 9600 | |
| Isoflurane | centravet | ISO005 | ISO-VET 100% 250ml |
| ocrygel | centravet | OCR002 | |
| Povidone iodure | centravet | VET001 | vetedine 120ml |
| Buprenorphine | centravet | BUP002 | Buprecare 0,3Mg/ml 10ml |
| Tris-HCl | Sigma | T5941 | Trizma hydrochloride |
| EDTA | Sigma | E9884 | |
| SDS | Sigma | 436143 | |
| NaCl | Sigma | S7653 | powder |
| proteinase K | Sigma | P2308 | |
| oneTaq kit | NEB | M0480L | |
| Primers | Eurogentec | ||
| Strip of 8 PCR tube | 4titude | 4ti-0781 | |
| 96 well thermal cycler | Applied Biosystems | 4375786 | Veriti |
| Genomic DNA mini kit | invitrogen | K1820-02 | |
| Nanodrop 2000 | Thermo Scientific | ND-2000C | |
| qPCR Master mix | Roche | 4887352001 | SYBR Green |
| Multiwell plate 384 | Roche | 5217555001 | |
| qPCR instrument 384 well | Roche | 5015243001 | LightCycler 480 |
Referenzen
- Gordon, J. W., Scangos, G. A., Plotkin, D. J., Barbosa, J. A., Ruddle, F. H. Genetic transformation of mouse embryos by microinjection of purified DNA. Proceedings of the National Academy of Science USA. 77 (12), 7380-7384 (1980).
- Bock, T. A., Orlic, D., Dunbar, C. E., Broxmeyer, H. E., Bodine, D. M. Improved engraftment of human hematopoietic cells in severe combined immunodeficient (SCID) mice carrying human cytokine transgenes. Journal of Experimental Medicine. 182 (6), 2037-2043 (1995).
- Miyakawa, Y., et al. Establishment of human granulocyte-macrophage colony stimulating factor producing transgenic SCID mice. British Journal of Haematology. 95 (3), 437-442 (1996).
- Hirabayashi, M., et al. A comparative study on the integration of exogenous DNA into mouse, rat, rabbit, and pig genomes. Experimental Animals. 50 (2), 125-131 (2001).
- Isola, L. M., Gordon, J. W. Transgenic animals: a new era in developmental biology and medicine. Biotechnology. 16, 3-20 (1991).
- Zufferey, R., Nagy, D., Mandel, R. J., Naldini, L., Trono, D. Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo. Nature Biotechnology. 15 (9), 871-875 (1997).
- Lois, C., Hong, E. J., Pease, S., Brown, E. J., Baltimore, D. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science. 295 (5556), 868-872 (2002).
- Ewerling, S., et al. Evaluation of laser-assisted lentiviral transgenesis in bovine. Transgenic Research. 15 (4), 447-454 (2006).
- Ritchie, W. A., Neil, C., King, T., Whitelaw, C. B. Transgenic embryos and mice produced from low titre lentiviral vectors. Transgenic Research. 16 (5), 661-664 (2007).
- Park, F. Lentiviral vectors: are they the future of animal transgenesis. Physiological Genomics. 31 (2), 159-173 (2007).
- van Arensbergen, J., et al. A distal intergenic region controls pancreatic endocrine differentiation by acting as a transcriptional enhancer and as a polycomb response element. PLoS One. 12 (2), e0171508 (2017).
- Friedli, M., et al. A systematic enhancer screen using lentivector transgenesis identifies conserved and non-conserved functional elements at the Olig1 and Olig2 locus. PLoS One. 5 (12), e15741 (2010).
- Sauvain, M. O., et al. Genotypic features of lentivirus transgenic mice. Journal of Virology. 82 (14), 7111-7119 (2008).
- Punzon, I., Criado, L. M., Serrano, A., Serrano, F., Bernad, A. Highly efficient lentiviral-mediated human cytokine transgenesis on the NOD/scid background. Blood. 103 (2), 580-582 (2004).
- Zennou, V., et al. The HIV-1 DNA flap stimulates HIV vector-mediated cell transduction in the brain. Nature Biotechnology. 19 (5), 446-450 (2001).
- Miyoshi, H., Blomer, U., Takahashi, M., Gage, F. H., Verma, I. M. Development of a self-inactivating lentivirus vector. Journal of Virology. 72 (10), 8150-8157 (1998).
- Yee, J. K., et al. A general method for the generation of high-titer, pantropic retroviral vectors: highly efficient infection of primary hepatocytes. Proceedings of the National Academy of Science USA. 91 (20), 9564-9568 (1994).
- Castaing, M., et al. Efficient restricted gene expression in beta cells by lentivirus-mediated gene transfer into pancreatic stem/progenitor cells. Diabetologia. 48 (4), 709-719 (2005).
- Gradwohl, G., Dierich, A., LeMeur, M., Guillemot, F. neurogenin3 is required for the development of the four endocrine cell lineages of the pancreas. Proceedings of the National Academy of Science USA. 97 (4), 1607-1611 (2000).
- Scharfmann, R., Axelrod, J. H., Verma, I. M. Long-term in vivo expression of retrovirus-mediated gene transfer in mouse fibroblast implants. Proceedings of the National Academy of Science USA. 88 (11), 4626-4630 (1991).
- Norrman, K., et al. Quantitative comparison of constitutive promoters in human ES cells. PLoS One. 5 (8), e12413 (2010).
- Vandegraaff, N., Kumar, R., Burrell, C. J., Li, P. Kinetics of human immunodeficiency virus type 1 (HIV) DNA integration in acutely infected cells as determined using a novel assay for detection of integrated HIV DNA. Journal of Virology. 75 (22), 11253-11260 (2001).
- Ohtsuka, M., et al. One-step generation of multiple transgenic mouse lines using an improved Pronuclear Injection-based Targeted Transgenesis (i-PITT). BMC Genomics. 16, 274 (2015).
- Tasic, B., et al. Site-specific integrase-mediated transgenesis in mice via pronuclear injection. Proceedings of the National Academy of Science USA. 108 (19), 7902-7907 (2011).
- Sumiyama, K., Kawakami, K., Yagita, K. A simple and highly efficient transgenesis method in mice with the Tol2 transposon system and cytoplasmic microinjection. Genomics. 95 (5), 306-311 (2010).
- Garrels, W., et al. Cytoplasmic injection of murine zygotes with Sleeping Beauty transposon plasmids and minicircles results in the efficient generation of germline transgenic mice. Biotechnology Journal. 11 (1), 178-184 (2016).
- Ding, S., et al. Efficient transposition of the piggyBac (PB) transposon in mammalian cells and mice. Cell. 122 (3), 473-483 (2005).
- Aida, T., et al. Cloning-free CRISPR/Cas system facilitates functional cassette knock-in in mice. Genome Biology. 16, (2015).
- Philippe, S., et al. Lentiviral vectors with a defective integrase allow efficient and sustained transgene expression in vitro and in vivo. Proceedings of the National Academy of Science USA. 103 (47), 17684-17689 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten