Method Article
Seconda generazione di armoniche segnali coniglio sclera come strumento per la valutazione del tessuto terapeutico reticolazione (TXL) per la miopia
In questo articolo
Riepilogo
Questo protocollo descrive le tecniche per la valutazione di reticolazione chimica dello sclera coniglio mediante generazione di seconda armonica imaging e Calorimetria a scansione differenziale.
Abstract
Metodi per rinforzare il tessuto introducendo legami chimici (cross-linking non enzimatica) in proteine strutturali (collageni fibrillari) per la terapia includono cross-linking fotochimico e cross-linking metodi (TXL) del tessuto. Tali metodi per indurre i cambiamenti di proprietà meccaniche del tessuto sono essere impiegati per la cornea nei disordini di assottigliamento corneale (meccanicamente indebolito) come cheratocono, nonché la sclera in miopia progressiva, dove diradamento e indebolimento del posteriore sclera si verifica e probabilmente contribuisce all'allungamento assiale. Le proteine bersaglio primario per tale rafforzamento del tessuto sono collageni fibrillari che costituiscono la grande maggioranza delle proteine di peso a secco nella cornea e sclera. Fortuitamente, collageni fibrillari sono la principale fonte di seconda generazione armonica segnali nello spazio extracellulare dei tessuti. Pertanto, modificazioni delle proteine del collagene, quali quelli indotti tramite cross-linking terapie, potenzialmente potrebbero essere rilevate e quantificate attraverso l'uso di microscopia di seconda generazione di armoniche (SHGM). Monitoraggio SHGM segnali attraverso l'uso di un sistema di microscopia accoppiato con un'eccitazione a infrarossi luce di scansione laser di origine è un metodo di imaging moderno emozionante che sta godendo l'uso diffuso nelle scienze biomediche. Così, lo studio presente è stato intrapreso per valutare l'uso di microscopia SHGM come un mezzo per misurare indotta cross-linking effetti ex vivo la sclera di coniglio, segue un'iniezione di una sostanza chimica agente reticolante nello spazio di sub-Tenon (sT), un iniezione di approccio che è pratica standard per causare anestesia oculare durante le procedure cliniche oftalmologiche. La chimica agente reticolante, sodio hydroxymethylglycinate (SMG), è da una classe di conservanti cosmetici conosciuto come formaldeide distaccanti (FARs). Cambiamenti scleral dopo reazione con SMG provocato gli aumenti in SHG segnali e correlati con i cambiamenti nella temperatura di denaturazione termica, un metodo standard per valutare indotta cross-linking effetti del tessuto.
Introduzione
Miopia progressiva è postulata per essere curabile attraverso reticolazione scleral non enzimatici (fotochimica e/o chimica), che ha un senso dato che bloccando la reticolazione del collagene enzimatica può aumentare la privazione di forma sperimentale (FD)-indotta miopia1. ElSheikh e Phillips2 recentemente discusso la fattibilità e il potenziale di utilizzo standard irradiazione ultravioletta-A (UVA)-riboflavina mediata reticolazione fotochimica (noto anche come il protocollo di Dresda), abbreviato qui come (riboflavina CXL) per stabilizzazione scleral posteriore fermare allungamento assiale nella miopia. Questo metodo fotochimico è stato utilizzato con successo per il trattamento di destabilizzazione della superficie anteriore del globo (cioè, la cornea sporgente) vista in keratectasia cheratocono e alberino-LASIK. Tuttavia, applicazione del presente protocollo CXL per la sclera è ostacolata da questioni legate alla difficoltà di accesso alla sclera posteriore con una sorgente di luce ultravioletta (UV), come pure la necessità di modificare una molto tessuto superficie maggiore. Che essendo detto, l'approccio CXL è stato utilizzato per fermare allungamento assiale visivamente modulo privato conigli (da tarsorrhaphy), anche se le regioni multiple di sclera posteriore richiesto più zone di irradiazione separati in quello Studio3. Al contrario, l'iniezione di un agente chimico di stabilizzazione (cioè, agente reticolante) tramite lo spazio di sT potrebbe rappresentare un modo più semplice per modificare la sclera posteriore, evitando la necessità di introdurre una fonte di luce UV. Questa tecnica di iniezione è ben nota come un modo utile di indurre anestesia oculare durante le procedure oftalmologiche ad esempio cataratta chirurgia4,5,6. WOLLENSAK7 ha descritto in precedenza l'uso di un'iniezione di sT utilizzando gliceraldeide (un cross-linking agente chimico simile nel concetto alla formaldeide distaccanti (FARs) descritti in questo studio) per irrigidire il coniglio sclera e Genipina ha dimostrato di limitare la lunghezza assiale in FD cavie8,9. Questi ricercatori hanno dimostrato un chiaro vantaggio dell'utilizzo di un agente chimico solubile rispetto la tecnica CXL fotochimica. Così, scleral reticolazione utilizzando un agente chimico iniettabile di qualche tipo, tra cui la FARs (cioè, TXL)10, potrebbe fornire un metodo di trattamento fattibile per arrestare la progressione dell'allungamento scleral visto nella miopia.
Nei protocolli presentati qui, usiamo una soluzione reticolazione chimica di sodio hydroxymethylglycinate (SMG), consegnata tramite iniezione sT allo sclera degli occhi di coniglio cadaverico. Abbiamo implementato protocolli simili precedentemente per la reticolazione chimica d'attualità nella cornea. In particolare in quegli studi precedentemente segnalati, concentrazione-dipendente di cross-linking effetti poteva essere ottenuta utilizzando SMG, con un intervallo di effetto che si estende ben superiore a quella ottenibile con CXL fotochimica, come determinato mediante analisi di denaturazione termica11 .
Qui descriviamo protocolli per valutare l'effetto di cross-linking di SMG consegnati tramite iniezioni di sT al tessuto sclerale, denaturazione termica mediante calorimetria a scansione differenziale (DSC) e la seconda armonica generazione microscopia (SHGM).
Mediante calorimetria a scansione differenziale (DSC), noto anche come analisi termica, una transizione di denaturazione termica è misurata, che per il tessuto sclerale è prevalentemente guidato dalle proprietà di collageni fibrillari, poiché essi costituiscono la maggioranza di massa della proteina. Questo metodo consente di valutare la stabilità della struttura molecolare del collagene e i legami cross-linked che stabilizzano le fibrille di collagene, la struttura principale e terziaria della proteina. Durante il riscaldamento nel DSC, si raggiunge una temperatura di transizione critica che provoca la denaturazione della molecola del collagene, con conseguente srotolamento della tripla elica, un processo che forma ciò che è comunemente noto come gelatina. La denaturazione termica interrompe legami idrogeno lungo la molecola di collagene e può essere spostata a temperature più elevate attraverso indotta cross-linking metodi12,13. Questo metodo è stato utilizzato per molti decenni, in particolare nel settore dei biomateriali e per i processi che includono cuoio-fare. Tuttavia, questo metodo richiede l'estrazione del tessuto sclera e pertanto può essere solo utile come tecnica di ex vivo .
Microscopia di generazione di seconda armonica (SHGM) si basa sulle proprietà ottiche non lineari di materiali particolari, con ambienti molecolare non-centrosimmetrici. In tale materiale, luce intensa, ad esempio luce prodotta dai laser, genera segnali SHG, in cui la luce incidente è raddoppiata in frequenza. Materiali biologici che sono noti per creare segnali SHG sono collagene, microtubuli e miosina muscolare. Ad esempio, collagene eccitato con una luce infrarossa di lunghezza d'onda di 860 nm emette un segnale SHG nel campo visibile con lunghezza d'onda di 430 nm. Seconda generazione armonica (SHG) segnale imaging è un promettente metodo per valutare la reticolazione del collagene terapeutico. Esso è stato conosciuto per più di 30 anni che le fibrille di collagene nei tessuti emettono SHG segnali14. Tuttavia, solo recentemente immagini ad alta risoluzione si otteneva15 in una varietà di tessuti, compreso il tendine16, pelle, cartilagine17, vasi sanguigni18e in collagene gel19.
Basati su questa conoscenza, questo studio valuta i cambiamenti del segnale SHG indotti nella sclera attraverso SMG chimicamente indotta cross-linking del collagene. I risultati indicano che SMG modifica dello sclera aumenta i segnali SHG prodotti da fasci di fibre collagene del tessuto (il più alto ordine struttura quaternaria composta da fibrille collagene) e produce anche un cambiamento morfologico strutturale del collagene rete in fibra ottica, riflessa in fibra bundle "raddrizzare".
Protocollo
Tutte le procedure sono state effettuate utilizzando gli occhi dei conigli cadaverico all'interno di teste di coniglio nazionali intatto. Sono state seguite tutti istituzionale e nazionale le linee guida per la cura e l'uso degli animali da laboratorio.
1. preparazione delle soluzioni
- Preparazione di SMG per TXL:
- Preparare 1 mL di concentrazione di 0,2 M di soluzione di bicarbonato di sodio soluzione (NaHCO3) utilizzando 0,0165 g di NaHCO3 polvere disciolta in 1 mL di acqua distillata.
- Sciogliere 0,1016 mg di sodio in polvere hydroxymethylglycinate (SMG) in 1 mL di acqua distillata per ottenere una concentrazione finale di 800 mM SMG. Regolare la soluzione di bicarbonato di sodio ad una concentrazione finale di 0.1 M NaHCO3 e 400mm SMG. Concentrazioni di SMG secondo l'effetto di cross-linking desiderato. Nel protocollo descritto qui abbiamo usato 40, 100 e 400 mM SMG.
2. iniezione di del subTenon per TXL utilizzando SMG
- Riempire due siringhe da insulina 1 mL (aghi 25g) con 400 µ l controllo e soluzione SMG, rispettivamente.
- Posizionare testa del coniglio su un piano di profilo con l'aiuto di un cuscino. Schiuma di stirolo o una pila di carta può essere utilizzata per fissare la testa in una posizione ottimale.
- Ritirare le palpebre con uno speculum oculare pediatrica.
- Misurare l'iniziale pressione intraoculare (IOP) utilizzando un dispositivo di tonometria ad applanazione.
- Segnare il sito di iniezione desiderato nella parte centrale superiore del limbus con un indicatore del tessuto.
- Ritrarre la congiuntiva che circondano il sito di iniezione con un forcipe congiuntiva (o qualsiasi pinza con punta tonda seghettata) e inserire l'ago attraverso la congiuntiva, entrando la capsula di tenone solo leggermente oltre il sito di limbal contrassegnato (cioè, 2-3 mm dal limbus). Una piccola incisione nel conjunctiva può essere fatta anche con forbici iris al fine di facilitare il passaggio dell'ago attraverso la capsula di tenone.
- Una volta all'interno della capsula di tenone, assicurarsi che l'ago sia liberamente mobile spostandolo laterale. Durante questo tempo, il mondo non deve muoversi. Questo conferma il corretto posizionamento dell'ago sopra la sclera nel sub-Tenon (sT) spazio.
- Iniettare la soluzione dalla siringa e gettare l'ago. Immediatamente dopo l'iniezione, il fluido si accumula nello spazio sT creando un rigonfiamento anteriore visto attraverso la congiuntiva (cioè, la chemosi).
- Ripetere la misura dello IOP al fine di confermare che non è cambiato a causa di una perforazione eventuale del globo.
- Rimuovere lo speculum coperchio ed eseguire massaggio digitale attraverso le palpebre chiuse per circa 2-3 min.
- Lasciare la testa per un periodo di incubazione di 3,5 h (temperatura = 18 ° C), prima di passare al passaggio successivo.
3. tessuto preparazione
- Ritirare le palpebre utilizzando lo speculum palpebra al fine di ottimizzare l'accesso al globo. Selezionare lo speculum in modo ottimale dimensione secondo la dimensione dell'occhio.
- Separare la congiuntiva che circondano il limbus. Se è già stata incisa nei pressi del sito di iniezione, lungo la circonferenza di espandere i confini in modo conterrebbe una dimensione di inoculo di circa 1 x 1 cm.
- Tagliare i muscoli extra-oculari presso i loro siti d'inserzione sclerale.
- Elevare il bulbo oculare con il forcipe, spingendola dal lato posteriore. Questo fornisce l'accesso a globo posteriore e faciliterà il taglio del nervo ottico con arteria oftalmica e la vena che si trova vicino al polo posteriore del globo.
- Ritagliare il corneoscleral complesse, con il bordo esterno, compreso il sito di iniezione contrassegnato. La macchia dovrebbe essere ancora visibile sulla parte restante della sclera.
- Rimuovere il corpus vitreus e tutti gli strati attaccati al lato interno della sclera applicando trazione con pinze.
Nota: Ulteriori passi dipendono le seguenti procedure in corso: 4. - analisi DSC, 5. - microscopia SHG.
4. per analisi DSC regionale
-
Per occhio trattato: tagliato quattro settori scleral dalla tazza scleral rimanente con le forbici, affinché il sito di iniezione è situato nel settore superiore e allineato centralmente. Tagliare i rimanenti 3 settori da entrambi i lati (cioè, nasale e temporale) e il fondo.
Nota: la numerazione dei settori (1-4) che sono ulteriormente divisi in squadre (1-16) è illustrata nella Figura 1A. - I settori sclerali (1-4) tagliate a quadrati più piccoli (1-16) di circa 4 x 4 mm. Settore 1 dovrebbe essere diviso in 9 quadrati (rendere il luogo esatto dell'iniezione un'individuale dalla piazza [2]). Dividere i settori 2 e 3 in 2 quadrati ciascuno (piazze 10-11 e 12-13) e 4 in 3 piazze (quadrati 14-16).
- Assegnare un numero a ogni quadrato, come mostrato in Figura 1A, allo scopo di localizzare la distanza del tessuto analizzato dalla posizione del sito di inoculo.
- Per l'occhio di controllo: dopo dividere il tessuto in quattro settori scleral (simile al tessuto trattato) tagliato a pezzi quadrati di tessuto dai seguenti percorsi: 3 piazze dal top del settore (settore 1), 1 da ogni lato (settori 2 e 3) e 1 dalla settore di fondo (settore 4).
- Raschiare i restanti strati della retina e della coroide e lavare due volte con PBS fresco ogni volta, lasciando i pezzi immersi nella soluzione per circa 10 s alla volta.
5. per l'Imaging di SHG
- Tagliare la parte superiore della sclera con le forbici per creare un'area di 1 x 1 cm con il sito di iniezione allineate centralmente.
- Raschiare i restanti strati della retina e coroidico e lavare due volte con PBS fresco ogni volta lasciando i pezzi nella soluzione per circa 10 s.
- Posizionare il tessuto in provette da 1 mL riempite con soluzione di PBS per il trasporto al centro di imaging. Tutte le procedure, seguendo il tempo di incubazione e cominciando con la dissezione del bulbo oculare devono essere eseguite entro un'ora.
6. microscopia protocollo
Nota: Questo protocollo per imaging segnale SHG retro-sparsi da collagene del tessuto di sclera è su misura per il microscopio a scansione laser.
-
Impostare la microscopia
- Per massimizzare il segnale e risoluzione quando eseguire la microscopia SHG utilizza una lente obiettiva ottimizzare per trasmettere all'infrarosso, leggera e con un'apertura numerica elevata (NA). Il nostro obiettivo è Nikon Apo LWD 25 x / NA1.1 acqua immersione.
- Regolare il collare di correzione della lente per abbinare la profondità del campione, in questo caso che è lo spessore del vetrino coprioggetto, 0,17 millimetri.
- Montare la lente dell'obiettivo 25X e aggiungere una generosa quantità di gel a base acquosa per coprire la superficie di imaging prima di montare il campione di lubrificazione. Il gel a base acquosa non evapora durante l'esperimento e quindi manterrà la qualità dell'immagine.
- Posizionare il tessuto sclerale da una provetta 1 mL con PBS senza seccare tra due lamelle rotondo 25 mm (lato episcleral giù) fornendo massima di contatto tra l'episclera e la superficie del vetrino coprioggetti.
Nota: Il tessuto posizionabile anche scoperto il coprivetrino. Una buona quantità di PBS dovrebbe mantenere i tessuti idratati durante la formazione immagine. In questo caso, aggiungere il pezzo di tessuto e il PBS dopo il montaggio del cellchamber. - Assemblare la camera cellulare inserendo un coprioggetto rotondo 25 mm, singolo o in una tecnica sandwich, sulla parte inferiore dell'alloggiamento e avvitare la parte superiore al fine di creare un contenitore sigillato tondo camera. Non avvitare strettamente quando una lamella superiore è usata, per evitare l'appiattimento artificialmente e danneggiare il tessuto.
- Montare la camera di cella con il campione di tessuto sul tavolino del microscopio.
- Impostare il microscopio per la vista con luce trasmessa.
- Posizionare il tavolino e regolare l'altezza dell'obiettivo in modo che la superficie inferiore del campione è a fuoco, come determinato dalla ispezione in campo luminoso attraverso l'oculare.
- Spegnere tutte le luci tranne il monitor del computer e blocco quanta più luce dal monitor possibile con fogli di lamina di alluminio drappeggiati sul tavolino del microscopio. Riducendo al minimo qualsiasi luce parassita raggiungendo i rivelatori garantirà acquisizione basso rumore, come i rilevatori di GaAsP NDD hanno alta sensibilità.
- Nel pannello Ti Pad del software, controllare che la definizione di lente è corretta.
- Nel pannello A1 Compact GUI, scegliere il laser IR per l'imaging, selezionare i rilevatori NDD e scegliete il canale DAPI che è dotato di un filtro passa-banda di 400-450 nm.
- Nel pannello A1 MP GUI, impostare la lunghezza d'onda del laser infrarosso a 860 nm e aprire l'otturatore.
- Impostare come segue le condizioni nel pannello A1 Compact GUI di scansione laser. Selezionare: (a) Galvano scanner, scansione (b) unidirezionale, (c) Pixel dwell tempo 6.2 µs, (d) struttura dimensioni 1.024 x 1.024 pixel, (e) linea una media di 2 x
Nota: Lo scanner di Galvano e scansione unidirezionale assicura un allineamento preciso punto per punto. Una dimensione pari a 1.024 x 1.024 per tutto il campo visivo si traduce in una dimensione di pixel di 0,5 μm /pixel. Con una media di linea ridurrà il rumore shot nell'immagine. - Condizioni impostate imaging nel pannello A1 Compact GUI regolando la potenza del laser e rilevatore di guadagno. Aprire il pannello di Look Up Table (LUT) che visualizza un istogramma dei valori di intensità di pixel nell'immagine corrente. Girare su formazione immagine dal vivo in modalità "Trovare" e massimizzare la gamma rilevata dei valori dei pixel regolando il guadagno di potenza e rilevatore laser. Evitare la saturazione. I valori tipici sono 2,5% potenza del laser, da un totale di 2,35 W a 860 nm e 100 HV (rivelatore guadagno).
- Nota: Per questa configurazione, la potenza del laser misurata con un misuratore di potenza interno è di 5,2 mW. Ogni volta che viene eseguito un esperimento, ri-regolare la percentuale di laser tale che la misura di alimentazione interna è costante a 5.2 mW tra le sessioni di formazione immagine. Deve prestare attenzione quando si imposta la potenza del laser. Il laser di camaleonte II è un laser 3 W a 800 nm e un 10% o maggiore potenza potrebbe potenzialmente indurre danni ai tessuti.
-
Acquisizione di immagini
- In modalità anteprima, scan l'area di tessuto utilizzando lo strumento Panoramica XYZ.
- Impostare la formazione immagine a bassa risoluzione (256 x 256 pixel e non in linea media) per accelerare l'acquisizione di immagini in questa modalità.
- Cattura 5 x 5, 3x3 o singoli campi di vista per coprire tutta la superficie del tessuto. In ogni località, prima della cattura di panoramica, attivare la modalità "Scan" dal vivo e mettere il tessuto a fuoco. Si noti che diverse regioni del tessuto avranno posizioni leggermente diverse in direzione assiale.
- Trovare una zona pianeggiante, dove le fibre di collagene sono visti nell'intero campo visivo e fare doppio clic su tale posizione nello strumento per spostare il palco in quella particolare posizione panoramica.
- Attivare la modalità "Scan" live, regolare la posizione Z dell'obiettivo in modo che il piano inferiore è a fuoco e, nel riquadro Ti, è necessario utilizzare unità Z per spostare il piano ottico 10-15 μm sopra questo strato di fondo.
- Acquisire un'immagine ad alta risoluzione con 1.024 x 1.024 pixel e 2 x linea, in media, utilizzando il pulsante "Cattura".
- Salvare la posizione nella panoramica XYZ utilizzando il pulsante "+". Questo assicura che la stessa area del tessuto non è riconquistata.
- Per ogni pezzo di tessuto catturare 10 immagini non sovrapposte campi di vista.
7. DSC protocollo
Nota: Procedere a questo passo come preparazione dei tessuti è completa, per analisi DSC regionale, o dopo tessuto imaging quando SHGM viene eseguita.
- Preparare padelle DSC, pesati ed etichettati.
Nota: Questo passaggio deve essere effettuato prima della dissezione del tessuto al fine di minimizzare il loro disseccamento dei tessuti. - Asciugare ogni quadrato scleral con un panno assorbente e adagiarlo piatta sul fondo di una padella di DSC utilizzando forcipe dentato.
- Pesare la padella con il tessuto all'interno e il coperchio aggraffato e coperto per ottenere il tessuto bagnato peso (massa dei campioni dovrebbe essere nella gamma di mg 5 a 11).
Nota: Ogni guarnizione vaschetta utilizzando il piegatore prima di procedere con il prossimo campione di tessuto. Le pentole sono ermeticamente sigillate, per prevenire ogni perdita di acqua prima dell'analisi termica. - Una volta che il campione è aggraffato, collocarlo sulla sua sede indicata sul vassoio DSC. Ci dovrebbe essere 6 campioni per il controllo e 16 per occhio trattato.
- Creare un metodo utilizzando strumento software di gestione, specificando il peso del tessuto, ed eseguire l'analisi termica utilizzando i seguenti parametri: gamma di Temperature di 40-80 ° C, velocità di riscaldamento: 1 ° C/min, flusso di calore: 17,37 mW, il flusso di Gas (N2): 19,8 mL/min, Pressione del gas: 2,2 bar.
- Una volta completato, è possibile analizzare i dati per ciascun campione estraendo il picco di temperatura di transizione a cui denaturazione termica si verifica utilizzando lo strumento di gestione del software.
8. image Analysis
-
Segnale SHG
- Selezionare almeno 5-10 delle immagini più rappresentative di ogni trattamento e relativo controllo, tale che l'area dell'immagine è occupata da principalmente fibre di collagene.
- Caricare ogni immagine nel software ImageJ e misurare l'intensità di pixel medi selezionando Analyze > misura per l'immagine attiva.
- I valori estratti vengono segnalati come l'intensità media pixel e possono essere mostrati anche tracciando l'istogramma dell'intensità selezionando dal menu Analyze > istogramma.
- Utilizzando un foglio di Excel, creare una tabella per documentare tutti i dati misurati in conseguenza all'ID del campione.
- Calcolare la media e la deviazione standard di intensità di pixel per ogni condizione di trattamento e controllo.
- Utilizzo dello studente t-test, confrontare le differenze per tutti i confronti a coppie delle concentrazioni (cioè, 40 millimetri SMG contro 0 e 400 mM SMG vs 0). [P ≤ 0,05].
-
Ondulazione
- Selezionare un'immagine che visualizza le fibre di collagene. Almeno 10 immagini al campione devono essere analizzati (compreso un campione di controllo per ciascuna concentrazione - almeno 40 in totale).
- Aperto ImageJ > Plugins > NeuronJ. NeuronJ richiede l'installazione preventiva.
- Caricare tutti i imagesby trascinando in una finestra aperta di NeuronJ .
- Creare linee di tracciatura lungo le fibre, seguendo il profilo della fibrilla con il mouse (penna tavolette grafiche potrebbe essere utilizzata), fare clic su M per misurare la distanza della lunghezza totale della fibra.
- Selezionare "Opzione" per disegnare una linea retta tangente e collegare l'inizio e la fine del contorno della fibra precedentemente disegnato. Ora fare clic su M per misurare la lunghezza di end-to-end.
- Ripetere la stessa procedura su almeno 10 fibrille per immagine.
- Raccogliere quei due misurazioni da ciascuno dei 10 fibrille e inserire i dati in un foglio di calcolo excel, esprimendo la lunghezza totale della fibra (contorno) ed end-to-end (rette di connessione linea) come lunghezza [curva] e [lineare], rispettivamente.
- Calcolare l'indice di ondulazione (W) utilizzando la formula: W = Lunghezza [curva] / Lunghezza [lineare].
- Calcolare la % di ondulazione confrontando dati dalle immagini di samples(SMG) trattata con le immagini da campioni di controllo utilizzando la formula: (W [SMG] - 1) / (W [controllo] - 1)
- Eseguire un test t pairwise per indice di ondulazione (W) al fine di determinare le differenze statistiche (valori di p) della morfologia delle fibre collagene tra diverse condizioni di trattamento e controllo.
Risultati
Temperatura di denaturazione termica (Tm) come un metodo di dosaggio per valutare TXL cross-linking effetto: Un totale di 16 paia di occhi di coniglio sono stati utilizzati in questi esperimenti per la procedura TXL. Come una parte iniziale di questo studio, è stata valutata la localizzazione di cross-linking effetto indotto tramite una singola iniezione di agente reticolante SMG via sT spazio alla testa di coniglio cadaverico. Questo tipo di esperimento ha rilevanza per il trattamento clinico dei pazienti, poiché le iniezioni in più di una località potrebbero essere necessarie per stabilizzare un'area desiderata dello sclera.
Come sarebbe preveduto basato sui principi di base di diffusività, l'effetto era più grande nel sito di iniezione con effetti indotti in regioni adiacenti nonché, a seconda della concentrazione delle soluzioni. Figura 1A rappresenta il percorso schematico dei settori scleral (1-4 con carattere numero cavo rosso) (ulteriormente diviso in quadrati (1-16 nel carattere numero sottile nero)) che hanno subito l'analisi di denaturazione termica separata dopo un'iniezione singola sT con Indice di mapping di colore. La tabella 1 Mostra il cambiamento nei valori di Tm per ogni settore numerato rispetto al controllo corrispondente. I valori sono inclusi per iniezioni sia 40 mM e 400 mM e includono l'errore standard della media calcolata per un minimo di tre determinazioni indipendenti.
Figure 1B-C rappresentano i risultati utilizzando due diverse concentrazioni di SMG, 40 mM (Figura 1B) e 400 mM (Figura 1). In Figura 1B, il campione di 40 mM di concentrazione inferiore ha mostrato un lieve spostamento in Tm che è stato notato in Piazza 2 (il sito di iniezione). Simili cambiamenti sono stati veduti nelle piazze adiacenti 1 e 3 (blu più chiaro). Cambiamenti marginali sono visti nelle piazze 4 a 6 e da 7 a 9 senza differenze statisticamente significative dalla Piazza iniettata. Nessun spostamento di Tm è stato visto nelle piazze inferiore 14-16, che ha rappresentato il settore più lontano lontano dal sito di iniezione.
Come illustrato nella Figura 1, la più alta concentrazione (400 mM) ha avuto un effetto di cross-linking statisticamente altamente significativo (indicato come tonalità di arancione). Un grande cambiamento nel Tm con associata piccola deviazione standard e p < 0,05 sono stati osservati, che riflette una grande differenza nell'effetto di 400 millimetri rispetto alla concentrazione più bassa di 40 mM. Gli effetti più drammatici sono stati notati nel settore 1 nel globo superiore. Per quanto riguarda i restanti settori, un minore effetto è stato osservato nelle piazze 10 e 14 (che potrebbe essere stato dovuto alcuni rilevamento del cross-linking fluido posteriormente) e nessun effetto è stato osservato nelle piazze 11, 12, 13, 15 e 16. Nel complesso, gli effetti di cross-linking erano marginali nei settori 2 e 3 con nessun effetto osservato nel settore 4 (vale a dire, la posizione più distante dal sito di iniezione), simile all'esempio di 40 mM. Questi risultati hanno indicato che c'era una 'zona di effetto ' e che questo tipo di modello potrebbe essere previsto dopo un'iniezione di sT di agente reticolante. Questo potrebbe indicare la necessità per l'iniezione in diverse località al fine di indurre gli effetti su una vasta area di tessuto.
Studio degli effetti cross-linking indotti in occhi intatti valutando TXL con due concentrazioni di SMG inoltre è stata effettuata. Analisi di denaturazione termica del tessuto che ha subito tale scleral di cross-linking è stata eseguita. Cross-linking tempo era 3,5 h per TXL utilizzando tre differenti concentrazioni, 40 (Tm = 1,11 + /-1.2), 100 (Tm = 5.12 + /-2,9) e 400 (Tm = 14,34 + /-1,1) mM SMG. I risultati hanno mostrato che c'è un effetto di concentrazione dipendente visto nel tessuto reticolato SMG.
Seconda generazione di armonica (SHG) imaging come un metodo per valutare l'effetto di cross-linking TXL:
Microscopia SHG immagini sono stati analizzati sia per intensità di pixel dell'ondulazione bundle SHG segnale e fibra. Un ampio arco di cross-linking concentrazioni (da 40 a 400 mM) è stato utilizzato al fine di esplorare i cambiamenti del segnale SHG che possono verificarsi nel corso di una vasta gamma di effetti di cross-linking. Utilizzando la funzionalità di analisi Istogramma inclusa nel programma20di elaborazione delle immagini di Figi, fosse possibile quantificare il segnale SHG prodotto nel tessuto sclerale mediante iniezione di sT, confrontando gli effetti a 40mm a quelli indotti con 400 mM. La differenza media in media pixel intesities a 40 millimetri erano 66,3 ± 27.7 rispetto al 361.4 ± 28.3 per gli esempi di 400 mM, un aumento di quasi 6 volte. Questo corrisponde con un aumento del tessuto cross-linking, poiché aumenti corrispondenti in Tm inoltre sono stati notati in queste condizioni. La figura 2 Mostra immagini rappresentative di SHG dello sclera prelevati dal controllo (Figura 2A), 40 mM (Figura 2B) e 400 mM (Figura 2). Viene mostrata anche l'accompagnamento analisi Istogramma, tra cui luminosità media (o intensità di pixel). Il numero totale di immagini analizzati era: fino a 120 mM 40 e 98 per il suo controllo; 121 per 400 mM e 94 per il suo controllo. La profondità di formazione immagine del tessuto era 10-15 µm dalla superficie episcleral. I risultati delle analisi Istogramma, che ha coinvolto la media di numerosi campi di immagine, ha indicato che le più alte concentrazioni di cross-linking effetto (Figura 3) prodotto una maggiore intensità di pixel.
Come illustrato nella Figura 4, un'analisi dell'immagine inoltre è stata effettuata con metodi adottati dalla letteratura cardiovascolare del vaso sanguigno, utilizzando il plugin di ImageJ 'Neurone J'21. Abbiamo stimato che il fattore di ondulazione W = Lunghezza [curva] / Lunghezza [lineare] e abbiamo osservato che il cross-linking provocato raddrizzamento di fasci di fibre, come indicato da un'ondulazione in diminuzione % 40 mM e 400 mM reticolato sclera contro sclera di controllo non trattato (W % = (W [ SMG]-1)/(W[Control]-1), tabella 2). La differenza di ondulazione tra 40 e 400 millimetri SMG trattati campioni non era statisticamente significativa.
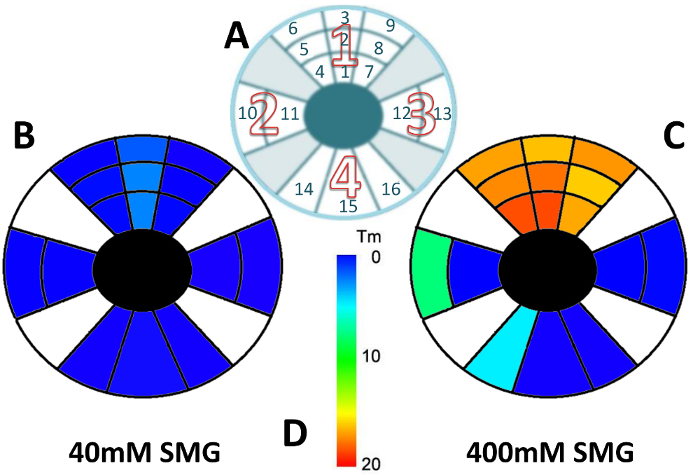
Figura 1 : Localizzazione dell'effetto TXL via sT iniezione utilizzando 40 e 400 mM SMG.
(A) rappresentazione schematica dei 4 settori scleral (numeri 1-4 con grande carattere cavo rosso), con sclera diviso in quadrati [numeri 1-16 in carattere sottile nero più piccolo] (non disegnata in scala) che hanno subito l'analisi termica. Il sito di iniezione ha corrisposto per la centrale Piazza (2) nel settore 1. La denaturazione termica, cross-linking effetto di TXL con (1B) 40 mM SMG e (1 C) 400 mM SMG. (D) colore codificato leggenda di scala di temperatura per (B) e (C). Questa figura è stata modificata da Zyablitskaya et al. con autorizzazione22. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Immagini rappresentative di concentrazione dipendente aumenta in SHG livelli di luminosità prodotti in seguito TXL usando SMG via sT iniezione dello sclera del segnale ex vivo . Le concentrazioni di SMG sono indicate come (B) 40 mM e (C) 400 mM. Ogni immagine contiene un 50 µm scala bar (angolo in basso a destra) e il valore di intensità media pixel (angolo superiore destro) - valori assoluti. Questa figura è stata modificata da Zyablitskaya et al. con autorizzazione22. Clicca qui per visualizzare una versione più grande di questa figura.
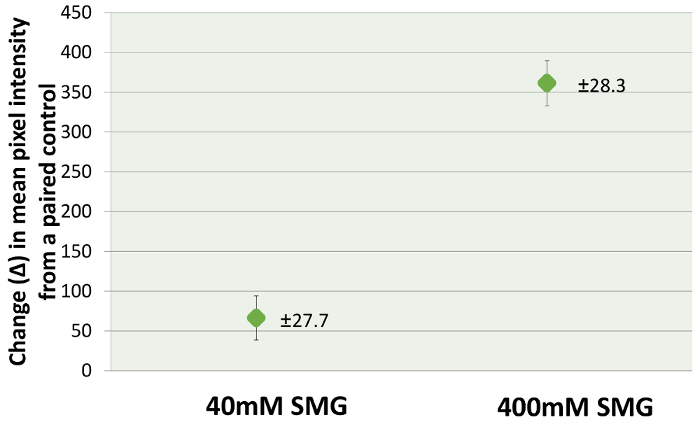
Figura 3 : Grafico a barre del cambiamento nell'intensità di pixel del segnale SHG (rispetto a un controllo associato dalla stessa testa di coniglio) in globi intatti scleral reticolato mediante iniezione di sT (TXL) con soluzioni SMG mM 40 e 400 (Δ). Valori medi con errore standard della media erano: 66 ± 27,7 per 40 mM e ± 361 28.3 per 400 mM. Questa figura è stata modificata da Zyablitskaya et al. con autorizzazione22. Clicca qui per visualizzare una versione più grande di questa figura.
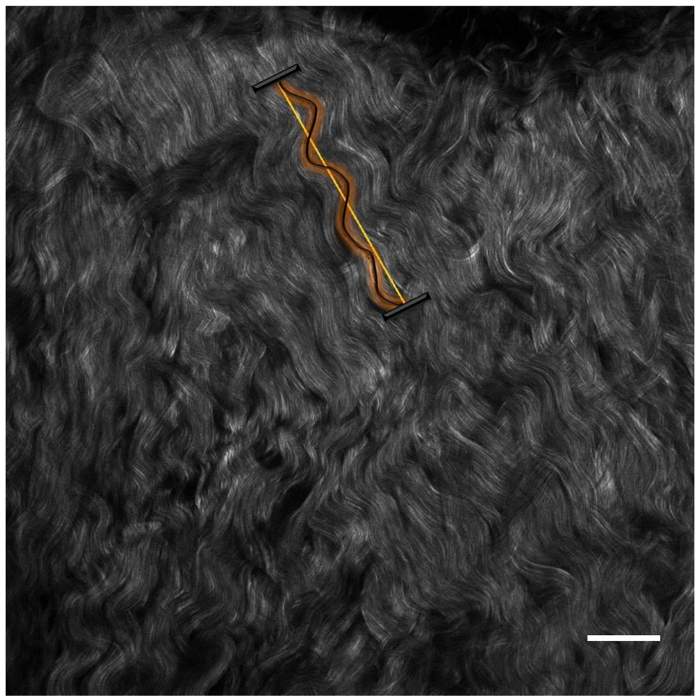
Figura 4 : Esempio di analisi di ondulazione della fibra (come espresso da una linearità). Immagine di esempio di controllo per la concentrazione di SMG 40 mM con una scala di 50 µm bar (angolo in basso a destra). Questa figura è stata modificata da Zyablitskaya et al. con autorizzazione22. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5 : Rappresentazione schematica dell'iniezione di sT. Numerati da 1 a 3 zone corrispondono alle aree rappresentate in Figura 1A. Clicca qui per visualizzare una versione più grande di questa figura.
| ±Δ Tm | ||
| zona | 40mM | 400mM |
| 1 | ±2.8 3,4 | 20,5 ± 0,6 |
| 2 | ±0.53 3,4 | 19.58 ± 1,5 |
| 3 | 2,5 ±2.47 | 17.99 ±3.06 |
| 4 | ±0.9 0.72 | 20,36 ±0.19 |
| 5 | ±0.55 0,85 | ±1.33 19.11 |
| 6 | ±1.35 0,52 | ±4.1 18.66 |
| 7 | 0,78 ± 1,6 | 18.44 ±2.8 |
| 8 | ±0.9 0.56 | ±2.69 17.77 |
| 9 | 0.22 ± 0,6 | 18.92 ±2.6 |
| 10 | 0.46 ± 0 | ±10.56 8.75 |
| 11 | 0.47 ±0.18 | 0.63 ±1.84 |
| 12 | 0,11 ± 0.08 | 0.66 ±1.52 |
| 13 | ± 0,05 0,08 | ±2.17 0.71 |
| 14 | 0.22 ± 0.7 | ±0.29 5,71 |
| 15 | 0.32 ± 0,2 | 0,29 ± 0.7 |
| 16 | 0,24 ±0.73 | ±0.79 0,26 |
Tabella 1: Risultati DSC per la localizzazione di studio effetto TXL. Variazione termiche temperature di fusione (ΔTm) con errori standard per ciascun settore campionata è raffigurata in Figura 1A. Ogni valore è espresso come differenza in Tm ascompared al relativo controllo appaiato e è mediamente di un minimo di 3 determinazioni indipendenti.
| SMG, mM | Ondulazione | Ondulazione-% | t-test contro [0 millimetri SMG] |
| 0 | 1.106 ± 0,044 | 100 | |
| 40 | 1.067 ± 0,017 | 63 | p < 0,02 |
| 400 | 1,059 ± 0.009 | 55 | p < 0,003 |
| Fibre di lineare | 1.000 | 0 | |
| (Teorico) |
Tabella 2. Risultati di analisi di ondulazione della fibra. Immagini SHG dalla zona di iniezione TXL sono stati analizzati per grado di ondulazione fibra utilizzando software di neurone J. Fibre di dieci sono stati selezionati da ogni immagine e un totale di circa 100 fibre sono stati analizzati per grado di ondulazione. Valori medi con errore standard della media sono inclusi.
Discussione
Esperimenti condotti hanno dimostrato la prova sostiene l'uso di microscopia SHG segnale come un metodo per la valutazione di cross-linking effetti sclera, sollevando la possibilità futura di usare questa tecnica come strumento di monitoraggio per trattamenti di cross-linking del collagene che destinazione proteine del collagene. Della nota, uno strumento è già in uso clinico che potenzialmente in grado di catturare questo segnale SHG. Anche se questo strumento è stato progettato principalmente per imaging derma di pelle umana, è stato utilizzato con successo a immagine cornea e sclera23.
È necessario mantenere identici di scansione e di condizioni di imaging quando si confrontano controllo e trattati campioni. Generazione di seconda armonica microscopia di collagene nel tessuto sclera richiede un microscopio a fluorescenza compatibile con immagini multi-fotone, un infrarosso pulsato laser sintonizzabile nel range di lunghezza d'onda di 800-900 nm e un rivelatore altamente sensibile quali il GaAsP non descanned rivelatori (NDD). Linee guida descritte in questo manoscritto sono un punto di partenza. Le condizioni dovrebbero essere determinate specificamente per i nuovi esperimenti o per i diversi sistemi.
La cornea e la sclera inoltre sono stati valutati contemporaneamente negli studi utilizzando questa tecnica24,25,26,27. Sapendo che il segnale SHG si propaga in direzioni avanti e indietro, parecchi studi hanno esaminato il tessuto corneale in modo indipendente nel suo stato nativo28,29,30,31, 32,33,34 e nel cheratocono35,36 , nonché in seguito CXL (come discusso di seguito). I risultati di questi studi indicano che il segnale cornea è ottimizzato in avanti sparsi, che ha un senso dato trasparenza della cornea e il fatto che la luce passa attraverso il tessuto per colpire un monitor in avanti sistemi dispersi. In genere, il segnale SHG è nella gamma visibile blu e sarà notevolmente ridotto quando si passa attraverso un tessuto altamente dispersione come la sclera dell'occhio. Di conseguenza, rilevamento di SHG sparsi in avanti richiederebbe una sezione sottile di tessuto di 50 μm o meno di spessore, come pure una speciale messa a punto ottico. Al contrario, il segnale di retro-sparsi possa essere acquisito tramite il percorso della luce normale di un microscopio a fluorescenza senza tessuto sezionare e pertanto questa modalità è comodo quando la formazione immagine di collagene nel tessuto intatto sclera a una profondità di 30-40 μm. In questo studio, abbiamo notato un aumento dipendente dalla concentrazione nella densità del segnale. È abbastanza possibile, tuttavia, che il TXL potrebbe avere effetti aggiuntivi e simili su strati più profondi della sclera, e che l'effetto potrebbe essere più pronunciati e si estendono a strati più profondi, particolarmente con la più alta concentrazione. Tuttavia, a causa della limitata penetrazione di segnale SHG nella sclera e per le finalità di questo studio iniziale, abbiamo scelto di lavorare con immagini della migliore qualità, che sono state ottenute da sclera più superficiale (profondità 15 µm). In futuro gli studi, considereremo profondità dipendenti effetti seguendo metodi TXL come questo può fornire ulteriori informazioni importanti per quanto riguarda perché anche maggiori differenze non erano osservati tra 40 e 400 campioni mM trattati.
Inoltre, per quanto riguarda l'uso di SHG per valutare il cross-linking di riboflavina CXL indotta del tessuto, riboflavina SHG microscopia imaging seguente CXL della cornea sono stati segnalati da diversi gruppi37,38,39 , 40 , 41. in uno studio condotto da Steven et al. 37, stabilizzazione corneale utilizzando la tecnica CXL ha provocato una 'omogeneizzazione ' del segnale e perdita di tessuto 'pieghe ' o ' ondulazioni ' vista in campioni non-cross-linked. Questi tipi di modifiche, tuttavia, inoltre sono stati notati in uno studio che valuta gli effetti delle modifiche della IOP sui segnali SHG corneale, sollevando la possibilità di artefatti tecnici. Organizzativamente dalla fibrilla così come il più alto ordine fibra bundle/lamellare organizzazione punto di vista, la sclera e della cornea sono molto diverse e si conoscono tali differenze dagli studi di microscopia elettronica. I due tessuti differiscono per quanto riguarda fibrilla dell'imballaggio, che comprende fibrilla diametro distribuzione (piccole fibrille uniforme per le fibrille di diametro cornea e variabile per la sclera) e Inter-fibrilla spaziatura (uniforme per cornea e variabile per la sclera). Pure, l'organizzazione di ordine superiore in lamellare fogli (cornea) contro fasci di fibre (sclera) è molto diverso. Tali differenze strutturali si riflettono nei segnali SHG prodotti da questi due tessuti. Così, i cambiamenti indotti da cross-linking possono alterare il segnale SHG in modi differenti ma paralleli. In altre parole, il 'raddrizzamento ' delle fibre nella sclera osservata in questo studio e l'omogeneizzazione del ' ' del segnale nella cornea segnalata nella letteratura, sono stati sia il risultato della modificazione di cross-linking del collagene. Così, l'effetto ' omogeneizzazione ' nella cornea potrebbe in qualche modo essere analoga per l'effetto ' raddrizzamento ' della sclera che è stato segnalato qui.
I meccanismi che provocano questo effetto raddrizzamento prodotto da TXL sono poco chiari sulla base dello studio corrente. Una possibilità potrebbe essere che il tessuto è stato in qualche modo 'fisso ' in una posizione meccanicamente 'caricata '. Questo sarebbe sostengono la nozione che ha indotto ' stabilizzazione della fibrilla e fibra ' aveva accaduto. Cambiamenti nella pressione intraoculare probabile non hanno contribuito a questo effetto poiché lo IOP era monitorato prima e dopo l'iniezione di sT ed è rimasto stabile. Nel complesso, il significato di queste osservazioni non sono chiare e ulteriori studi saranno necessari. Della nota, separata imaging tecniche quali la microscopia di Brillouin42, che ha dimostrato di fornire misure quantitative di cross-linking (come determinato dal modulo di taglio) seguendo fotochimica CXL può essere utile nella conferma i risultati con SHG in questo studio di imaging. Tuttavia, dovrebbe essere notato che il relativo uso con i tessuti, altamente dispersione come la sclera43, richiede modifiche tecniche e non è stato convalidato con il reticolato tessuto sclerale.
Polarizzazione del laser e microscopia SHG è una questione importante. La luce laser è polarizzata linearmente e orientato perpendicolarmente alla direzione di propagazione del segnale SHG e qualche angolo nel piano xy per ogni fibra del collagene. Così, fibre nel piano xy che sono ben allineati ed esattamente perpendicolare alla luce polarizzata laser produrrà un segnale SHG maggiore rispetto a quelli ad altri angoli, comprese quelle parallele a luce incidente (cioè, z-plane), che produce il segnale SHG più basso (a causa di interferenza distruttiva). Rispetto al tessuto di sclera, collagene fibre sono orientate a vari angoli a livello microscopico, anche se gli orientamenti preferito fibra anatomico sono conosciuti per esistere basato sulla posizione del globo. Così, poiché il segnale SHG prodotto variano a seconda dell'angolo del piano xy di ogni fibra, il segnale complessivo sarà inferiore a quello che sarebbe stato prodotto se tutte le fibre di collagene sono stati state allineate esattamente con lo stesso angolo (in un tessuto come un tendine ad esempio). Così, in questo studio, a causa della natura del campione viene ripreso, la direzione di polarizzazione non è stato intenzionalmente determinata ma è stata mantenuta costante in tutto lo studio. Inoltre, ci siamo presi cura di ottenere tessuti globi da identiche regioni sclerale, riducendo al minimo eventuali differenze di orientamento delle fibre tra i campioni di controllo e dal trattato. Infine, abbiamo analizzato oltre 100 immagini al campione al fine di ottenere i valori di intensità. Questa vasta valutazione dovrebbe avere normalizzato eventuali segnali SHG aberranti che potrebbero essere stati registrati. Detto questo, è possibile che a seguito di "fibra raddrizzamento" che abbiamo osservato nei campioni reticolati (descritti sopra), una percentuale maggiore di "nel piano focale" fibre potrebbero aver contribuito all'aumento di SHG segnale così come un aumento SHG segnali da maggiore allineamento del piano xy. Entrambe queste possibilità sarebbe manifestazioni di effetti indotti di cross-linking.
È stata eseguita un'analisi regionale di cross-linking modifiche (da Tm) indotta da un'iniezione di sT di SMG. Come previsto, il livello di cross-linking effetto era concentrato nella zona dell'iniezione. Poco o nessun effetto di cross-linking è stato notato nella regione proprio di fronte (più lontana) ad iniezione, coerenza con quello che è conosciuto per quanto riguarda la localizzazione dell'effetto dopo l'iniezione di sT come mostrato da ultrasuono localizzazione44, 45 e computato tomografia46.
Infine, per quanto riguarda la terapia di cross-linking e la miopia, la reticolazione del collagene della cornea sta trovando impiego diffuso nel trattamento di destabilizzazione corneale compreso cheratocono, post LASIK keratectasias, la degenerazione marginale pellucida (PMD) e come un aggiunta alla rifrazione procedure chirurgiche47. Il successo di trattamento della malattia cornea con cross-linking ha portato all'esplorazione dell'applicazione di questo approccio terapeutico alla parte posteriore dell'occhio e, in particolare, la sclera, per limitare l'allungamento assiale nella miopia elevata2, un concetto che va indietro per il primissime fasi del cross-linking terapeutico concetto48,49.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori ringraziano Tongalp Tezel, MD, per la consultazione per quanto riguarda sT iniezione; Theresa Swayne, PhD, di consultazione in proposito SHG microscopia; e Jimmy Duong dal Design e Biostatistica risorsa e la funzione di memoria di biostatistica dell'Irving Institute presso la Columbia University Medical Center.
Supportato in parte dalla ricerca per prevenire la cecità e da istituti nazionali di salute sovvenzioni NCRR UL1RR024156, nia P30 EY019007, NCI P30 CA013696 e NEI R01EY020495 (DCP). Columbia University possiede proprietà intellettuale correlati: US rilasciati brevetti no: 8.466.203 e no: 9.125.856. In attesa di brevetto internazionale: PCT/US2015/020276.
Immagini sono state raccolte nel confocale e specializzata di microscopia Shared Resource di Herbert Irving Comprehensive Cancer Center presso la Columbia University, supportato da NIH concedere #P30 CA013696 (National Cancer Institute). Il microscopio confocale è stato acquistato con NIH concedere #S10 RR025686.
Materiali
| Name | Company | Catalog Number | Comments |
| MILLI-Q SYNTHESIS A10 120V | EMD Millipore, Massachusetts, USA | Double distilled, deionized water. - protocol step 1.1.1 | |
| Sodium hydroxymethylglycinate | Tyger Chemicals Scientific, Inc. Ewing, NJ, USA | Crosslinking reagent - protocol step 1.1.2 | |
| Injection needle with luer-lock syringe | BD Eclipse, NJ, USA | Syringe for sub tenon injection. - protocol step 2.1 | |
| Rabbit head | La Granja poultry | Outbred | Rabbit head separated and delivered within 1 hour postmortem. - protocol step 2.2 |
| Tono-pen | Reichter Technologies Depew, NY | IOP measurements - protocol step 2.4 | |
| DSC 6000 Autosampler | Perkin-Elmer Waltham, MA, USA | Thermal denaturation analyzer - protocol step 7.4 | |
| Pyris software | Perkin-Elmer, Waltham, MA, USA | Ver 11.0 | protocol step 7.5 |
| CFI75 Apochromat LWD 25X/1.10 W MP | Nikon Instruments, Melville, NY, USA | A water immersionn objective with high IR transmittance with a working distance of 2.0 mm - protocol step 8.1.1. | |
| GenTeal | Alcon, Fort Worth, TX | B000URVDQ8 | Water-based gel used as objective immersion medium instead of water to prevent evaporation - 8.1.1 |
| Chameleon Vision II | Coherent, Santa Clara,CA, USA | Ti:Sapphire pulsed laser with a 140 fs pulse width at 80 MHz and a tunable range from 680 nm to 1080 nm. - protocol step 8.1.11 | |
| AttoFluor cell chamber | Thermo Fisher Scientific Inc | A7816 | Fixation of the cover slip - protocol step 8.1.3 |
| 25-mm round coverslips, #1.5 | Neuvitro Corporation, Vancouver, WA, USA | GG-25-1.5 | protocol step 8.1.3 |
| Eclipse Ti-E | Nikon Instruments, Melville, NY, USA | protocol step 8.1.4. | |
| Non-descanned (NDD) GaAsP detector | Nikon Instruments, Melville, NY, USA | Equipped with a 400-450 nm band pass filter - protocol step 8.1.7 | |
| A1R-MP laser scanning system | Nikon Instruments, Melville, NY, USA | Compatible with infrared (IR) multi-photon excitation. - protocol step 8.1.8 | |
| NIS Elements software | Nikon Instruments, Melville, NY, USA | Ver 4.3 | refered to as "software" in the text - protocol step 8.1.9 |
| Fiji/ImageJ | National Institute of Health | protocol step 9.1.2 | |
| NeuronJ | Eric Meijering, Erasmus University Medical Center, Rotterdam, The Netherlands | https://imagescience.org/meijering/software/neuronj/, for protocol step 9.2.2 | |
| Microsoft Excel | Microsoft Corporation, Redmond, WA, USA | Ver 14 | protocol step 9.2.8 |
Riferimenti
- McBrien, N. A., Norton, T. T. Prevention of collagen crosslinking increases form-deprivation myopia in tree shrew. Exp Eye Res. 59 (4), 475-486 (1994).
- Elsheikh, A., Phillips, J. R. Is scleral cross-linking a feasible treatment for myopia control?. Ophthalmic Physiol Opt. 33 (3), 385-389 (2013).
- Dotan, A., et al. Scleral cross-linking using riboflavin and ultraviolet-a radiation for prevention of progressive myopia in a rabbit model. Exp Eye Res. 127, 190-195 (2014).
- Canavan, K. S., Dark, A., Garrioch, M. A. Sub-Tenon's administration of local anaesthetic: a review of the technique. Br J Anaesth. 90 (6), 787-793 (2003).
- Guise, P. Sub-Tenon's anesthesia: an update. Local Reg Anesth. 5, 35-46 (2012).
- Ahn, J. S., et al. A sub-Tenon's capsule injection of lidocaine induces extraocular muscle akinesia and mydriasis in dogs. Vet J. 196 (1), 103-108 (2013).
- Wollensak, G., Redl, B. Gel electrophoretic analysis of corneal collagen after photodynamic cross-linking treatment. Cornea. 27 (3), 353-356 (2008).
- Liu, T. X., Wang, Z. Collagen crosslinking of porcine sclera using genipin. Acta Ophthalmol. 91 (4), e253-e257 (2013).
- Wang, M., Corpuz, C. C. Effects of scleral cross-linking using genipin on the process of form-deprivation myopia in the guinea pig: a randomized controlled experimental study. BMC Ophthalmol. 15, 89 (2015).
- Babar, N., et al. Cosmetic preservatives as therapeutic corneal and scleral tissue cross-linking agents. Invest Ophthalmol Vis Sci. 56 (2), 1274-1282 (2015).
- Kim, S. Y., et al. Evaluating the Toxicity/Fixation Balance for Corneal Cross-Linking With Sodium Hydroxymethylglycinate (SMG) and Riboflavin-UVA (CXL) in an Ex Vivo Rabbit Model Using Confocal Laser Scanning Fluorescence Microscopy. Cornea. 35 (4), 550-556 (2016).
- da Cruz, L. G., Moraes, G. D. A., Nogueira, R. F., Morandim-Giannetti, A. D. A., Bersanetti, P. A. DSC characterization of rabbit corneas treated with Stryphnodendron adstringens (Mart.) Coville extracts. Journal of Thermal Analysis and Calorimetry. , (2017).
- Bersanetti, P. A., et al. Characterization of Rabbit Corneas Subjected to Stromal Stiffening by the Acai Extract (Euterpe oleracea). Curr Eye Res. 42 (4), 528-533 (2017).
- Freund, I., Deutsch, M. Second-harmonic microscopy of biological tissue. Opt Lett. 11 (2), 94 (1986).
- Campagnola, P. J., Loew, L. M. Second-harmonic imaging microscopy for visualizing biomolecular arrays in cells, tissues and organisms. Nat Biotechnol. 21 (11), 1356-1360 (2003).
- Williams, R. M., Zipfel, W. R., Webb, W. W. Interpreting second-harmonic generation images of collagen I fibrils. Biophys J. 88 (2), 1377-1386 (2005).
- Mansfield, J., et al. The elastin network: its relationship with collagen and cells in articular cartilage as visualized by multiphoton microscopy. J Anat. 215 (6), 682-691 (2009).
- Tsamis, A., Krawiec, J. T., Vorp, D. A. Elastin and collagen fibre microstructure of the human aorta in ageing and disease: a review. J R Soc Interface. 10 (83), 20121004 (2013).
- Raub, C. B., et al. Noninvasive assessment of collagen gel microstructure and mechanics using multiphoton microscopy. Biophys J. 92 (6), 2212-2222 (2007).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Meijering, E., et al. Design and validation of a tool for neurite tracing and analysis in fluorescence microscopy images. Cytometry A. 58 (2), 167-176 (2004).
- Zyablitskaya, M., et al. Evaluation of Therapeutic Tissue Crosslinking (TXL) for Myopia Using Second Harmonic Generation Signal Microscopy in Rabbit Sclera. Invest Ophthalmol Vis Sci. 58 (1), 21-29 (2017).
- Steven, P., Muller, M., Koop, N., Rose, C., Huttmann, G. Comparison of Cornea Module and DermaInspect for noninvasive imaging of ocular surface pathologies. J Biomed Opt. 14 (6), 064040 (2009).
- Han, M., Giese, G., Bille, J. F. Second harmonic generation imaging of collagen fibrils in cornea and sclera. Optics Express. 13 (15), 5791-5797 (2005).
- Wang, B. G., Konig, K., Halbhuber, K. J. Two-photon microscopy of deep intravital tissues and its merits in clinical research. J Microsc. 238 (1), 1-20 (2010).
- Teng, S. W., et al. Multiphoton autofluorescence and second-harmonic generation imaging of the ex vivo porcine eye. Invest Ophthalmol Vis Sci. 47 (3), 1216-1224 (2006).
- Rao, R. A., Mehta, M. R., Leithem, S., Toussaint, K. C. Quantitative analysis of forward and backward second-harmonic images of collagen fibers using Fourier transform second-harmonic-generation microscopy. Opt Lett. 34 (24), 3779-3781 (2009).
- Morishige, N., Petroll, W. M., Nishida, T., Kenney, M. C., Jester, J. V. Noninvasive corneal stromal collagen imaging using two-photon-generated second-harmonic signals. J Cataract Refract Surg. 32 (11), 1784-1791 (2006).
- Aptel, F., et al. Multimodal nonlinear imaging of the human cornea. Invest Ophthalmol Vis Sci. 51 (5), 2459-2465 (2010).
- Winkler, M., et al. Nonlinear optical macroscopic assessment of 3-D corneal collagen organization and axial biomechanics. Invest Ophthalmol Vis Sci. 52 (12), 8818-8827 (2011).
- Morishige, N., Takagi, Y., Chikama, T., Takahara, A., Nishida, T. Three-dimensional analysis of collagen lamellae in the anterior stroma of the human cornea visualized by second harmonic generation imaging microscopy. Invest Ophthalmol Vis Sci. 52 (2), 911-915 (2011).
- Gore, D. M., et al. Two-photon fluorescence microscopy of corneal riboflavin absorption. Invest Ophthalmol Vis Sci. 55 (4), 2476-2481 (2014).
- Park, C. Y., Lee, J. K., Chuck, R. S. Second Harmonic Generation Imaging Analysis of Collagen Arrangement in Human Cornea. Invest Ophthalmol Vis Sci. 56 (9), 5622-5629 (2015).
- Quantock, A. J., et al. From nano to macro: studying the hierarchical structure of the corneal extracellular matrix. Exp Eye Res. 133, 81-99 (2015).
- Morishige, N., et al. Quantitative analysis of collagen lamellae in the normal and keratoconic human cornea by second harmonic generation imaging microscopy. Invest Ophthalmol Vis Sci. 55 (12), 8377-8385 (2014).
- Morishige, N., et al. Second-harmonic imaging microscopy of normal human and keratoconus cornea. Invest Ophthalmol Vis Sci. 48 (3), 1087-1094 (2007).
- Steven, P., Hovakimyan, M., Guthoff, R. F., Huttmann, G., Stachs, O. Imaging corneal crosslinking by autofluorescence 2-photon microscopy, second harmonic generation, and fluorescence lifetime measurements. J Cataract Refract Surg. 36 (12), 2150-2159 (2010).
- Bueno, J. M., et al. Multiphoton microscopy of ex vivo corneas after collagen cross-linking. Invest Ophthalmol Vis Sci. 52 (8), 5325-5331 (2011).
- McQuaid, R., Li, J. J., Cummings, A., Mrochen, M., Vohnsen, B. Second-Harmonic Reflection Imaging of Normal and Accelerated Corneal Crosslinking Using Porcine Corneas and the Role of Intraocular Pressure. Cornea. 33 (2), 125-130 (2014).
- Laggner, M., et al. Correlation Between Multimodal Microscopy, Tissue Morphology, and Enzymatic Resistance in Riboflavin-UVA Cross-Linked Human Corneas. Invest Ophthalmol Vis Sci. 56 (6), 3584-3592 (2015).
- Chai, D., et al. Quantitative assessment of UVA-riboflavin corneal cross-linking using nonlinear optical microscopy. Invest Ophthalmol Vis Sci. 52 (7), 4231-4238 (2011).
- Scarcelli, G., et al. Brillouin microscopy of collagen crosslinking: noncontact depth-dependent analysis of corneal elastic modulus. Invest Ophthalmol Vis Sci. 54 (2), 1418-1425 (2013).
- Shao, P., Besner, S., Zhang, J., Scarcelli, G., Yun, S. H. Etalon filters for Brillouin microscopy of highly scattering tissues. Opt Express. 24 (19), 22232-22238 (2016).
- Kumar, C. M., McNeela, B. J. Ultrasonic localization of anaesthetic fluid using sub-Tenon's cannulae of three different lengths. Eye (Lond). 17 (9), 1003-1007 (2003).
- Winder, S., Walker, S. B., Atta, H. R. Ultrasonic localization of anesthetic fluid in sub-Tenon's, peribulbar, and retrobulbar techniques. J Cataract Refract Surg. 25 (1), 56-59 (1999).
- Ripart, J., Eledjam, J. J. [Locoregional anesthesia for ophthalmic surgery: unique episcleral injection (sub-tenon) in the internal canthus]. Ann Fr Anesth Reanim. 17 (4), Fi72-Fi74 (1998).
- Meek, K. M., Hayes, S. Corneal cross-linking--a review. Ophthalmic Physiol Opt. 33 (2), 78-93 (2013).
- Wollensak, G., Spoerl, E. Collagen crosslinking of human and porcine sclera. J Cataract Refract Surg. 30 (3), 689-695 (2004).
- Paik, D. C., Wen, Q., Airiani, S., Braunstein, R. E., Trokel, S. L. Aliphatic beta-nitro alcohols for non-enzymatic collagen cross-linking of scleral tissue. Exp Eye Res. 87 (3), 279-285 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon