Method Article
A High Yield e Cost-efficient Sistema Espressione di granzimi umane in cellule di mammifero
In questo articolo
Riepilogo
We describe here a cost-efficient granzyme expression system using HEK293T cells that produces high yields of pure, fully glycosylated and enzymatically active protease.
Abstract
When cytotoxic T lymphocytes (CTL) or natural killer (NK) cells recognize tumor cells or cells infected with intracellular pathogens, they release their cytotoxic granule content to eliminate the target cells and the intracellular pathogen. Death of the host cells and intracellular pathogens is triggered by the granule serine proteases, granzymes (Gzms), delivered into the host cell cytosol by the pore forming protein perforin (PFN) and into bacterial pathogens by the prokaryotic membrane disrupting protein granulysin (GNLY). To investigate the molecular mechanisms of target cell death mediated by the Gzms in experimental in-vitro settings, protein expression and purification systems that produce high amounts of active enzymes are necessary. Mammalian secreted protein expression systems imply the potential to produce correctly folded, fully functional protein that bears posttranslational modification, such as glycosylation. Therefore, we used a cost-efficient calcium precipitation method for transient transfection of HEK293T cells with human Gzms cloned into the expression plasmid pHLsec. Gzm purification from the culture supernatant was achieved by immobilized nickel affinity chromatography using the C-terminal polyhistidine tag provided by the vector. The insertion of an enterokinase site at the N-terminus of the protein allowed the generation of active protease that was finally purified by cation exchange chromatography. The system was tested by producing high levels of cytotoxic human Gzm A, B and M and should be capable to produce virtually every enzyme in the human body in high yields.
Introduzione
I Gzms sono una famiglia di serina proteasi altamente omologhi localizzate nei lisosomi specializzati di CTL e cellule NK 1. I granuli citotossici di queste cellule killer contengono anche i-membrana interrompere proteine PFN e GNLY che vengono rilasciati contemporaneamente alle Gzms accreditato in una cella di destinazione destinata per l'eliminazione 2,3. Ci sono cinque Gzms nell'uomo (GzmA, B, H, K e M), e 10 Gzms nei topi (GzmA - G, K, M e N). GzmA e GzmB sono i più abbondanti e ampiamente studiati sugli esseri umani e nei topi 1. Tuttavia, studi più recenti hanno cominciato a studiare le vie di morte cellulare e gli effetti biologici supplementari mediati dalle altre, cosiddette Gzms orfani in materia di salute e di malattia 4.
La funzione più nota delle Gzms, in particolare di GzmA e GzmB, è l'induzione della morte cellulare programmata in cellule di mammifero quando espresso nelle cellule bersaglio da parte PFN 5,6. Tuttavia, Studi più recenti hanno anche dimostrato effetti extracellulari dei Gzms con profondo impatto sulla regolazione immunitaria e infiammazione, indipendentemente dalla consegna citosolica da PFN 7,8. Lo spettro di cellule che vengono uccisi in modo efficace dopo l'entrata citosolico dei Gzms è stato recentemente ampliato da cellule di mammifero a batteri 9,10 e anche alcuni parassiti 11. Queste scoperte recenti aperto un campo completamente nuovo per i ricercatori GZM. Pertanto, un alto rendimento del sistema di espressione mammifero economicamente efficiente faciliterà notevolmente la strada a tali studi futuri.
Umani, topi e ratti Gzms nativi sono stati purificati con successo dalla frazione granello di CTL e NK cellule linee 12-14. Tuttavia, nelle nostre mani il rendimento di tali tecniche di purificazione è nella gamma di cultura inferiore a 0,1 mg / L cella (osservazioni non pubblicate e 12). Inoltre, la risoluzione cromatografica di un singolo GZM senza contaminazione da other Gzms e / o proteine che sono presenti anche nei granuli è impegnativo (dati inediti e 12,14). Gzms ricombinanti sono state prodotte in batteri, lieviti 15 16, cellule di insetto 17 e in anche in cellule di mammifero, come HEK 293 18,19. Solo i sistemi di espressione di mammifero portano il potenziale di produrre enzimi ricombinanti con modificazioni post-identico alla proteina citotossica nativo. Modificazioni post-traduzionali sono stati implicati con l'assorbimento specifico per endocitosi e la localizzazione intracellulare della proteasi all'interno delle cellule bersaglio 20-22. Pertanto, utilizzando pHLsec 23 (un gentile dono di Radu Aricescu e Yvonne Jones, dell'Università di Oxford, Regno Unito) come spina dorsale plasmide per l'espressione GZM, abbiamo istituito un sistema semplice, tempo e conveniente per alto rendimento produzione di proteine in HEK293T cellule. pHLsec combina un esaltatore di CMV con un pollo Β-actina promotore; insieme, questi elementi dimoted il più forte promotore attività in varie linee cellulari 24. Inoltre, il plasmide contiene un coniglio Β-globina introne, segnali Kozak e secrezione ottimizzati, a-6xHis-tag Lys e un poli-A segnale. Gli inserti possono essere clonate convenientemente tra il segnale di secrezione e Lys-6xHis-tag (Figura 1) assicurando espressione ottimale e efficienza secrezione di proteine prive appropriate domini N-terminali. Per l'espressione delle Gzms, abbiamo sostituito la sequenza segnale di secrezione endogena con il segnale di secrezione fornito dal vettore seguito da un enterokinase (EK) sito (DDDDK) in modo che il trattamento EK attivato il Gzms secrete (Gzms attivi iniziare con N-terminale sequenza aminoacidica IIGG 25). Inoltre, a favore di questo metodo, le cellule HEK293T crescono rapidamente in basso prezzo medio, come Dulbecco Modified mezzo di Eagle (DMEM), e sono adatti per il calcio-fosfato metodo trasfezione conveniente.
Protocollo
1. Produzione del plasmide espressione pHLsec-GZM
- Preparare RNA totale da cellule NK umane (cellule primarie preparato come al 26 o la linea delle cellule NK NK-92 che esprimono tutte le cinque Gzms umane), utilizzando un metodo di isolamento RNA adatto e invertire trascrivere con un primo filamento kit cDNA sintetizzare, a seguito della manufacturer` raccomandazioni s. Amplificare GZM cDNA usando la PCR e clonazione in pHLsec come descritto in 23 (gentile dono di Radu Aricescu e Yvonne Jones, dell'Università di Oxford, Regno Unito) utilizzando i siti AGEI e KpnI (Figura 1).
NOTA: Utilizzare i seguenti primer indicati nella tabella 1. - Confermare inserti corretti di sequenziamento. Espandere i plasmidi di espressione nelle cellule DH5α e purificare utilizzando un kit di isolamento plasmide privo di endotossine e seguire le istruzioni del produttore.
- Risospendere i plasmidi purificati in privo di endotossine, acqua sterile ad una concentrazione di 2 mg / ml e conservare a -20 ° C untiuso l.
2. Espressione dei Gzms nelle cellule HEK293T
- Preparazione dei reagenti
- Preparare terreno di coltura standard. Per di Dulbecco modificato (DMEM) contenente alte concentrazioni di glucosio (25 mm), Glutamax (4 mm), piruvato di sodio (1 mm) aggiungere il 10% di siero standard fetale bovino (FCS), la penicillina (100 unità / ml), streptomicina ( 100 mg / ml).
- Preparare medio trasfezione. Per mezzo di coltura senza penicillina streptomicina aggiungere 25 mg / ml clorochina (aggiungere appena il giorno della trasfezione da 1,000x scorte in PBS, conservati a -20 ° C).
- Preparare mezzo privo di siero cultura: per mezzo privo di siero per HEK293 cellule aggiungono glutamina (4 mm), la penicillina (100 unità / ml), streptomicina (100 mg / ml), e di 2,5 mg / L amfotericina B.
- Preparare le soluzioni descritte in Tabella 2 e filtro con un filtro da 0,45 micron prima dell'uso:
- Espansione cellule HEK293T
- Crescere HEK293T cellule in 20 ml di cultomedio ure con 150 x 25 millimetri piatti di coltura dei tessuti.
- Cellule Split a 80% di confluenza (split-rapporto di 1: 4, di solito ogni giorno 3 °). Cellule liberamente allegare, possono essere staccati meccanicamente senza tripsinizzazione rigorosamente pipettando su e giù.
- Cellule piastra la sera prima trasfezione per dare il 60-70% di confluenza al giorno di trasfezione (densità di semina ~ 2 x 10 5 cellule / ml). Una dimensione di preparazione al solito composto da 20-25 piatti della cultura.
- Fosfato di calcio trasfezione
- 1 ora prima della trasfezione, cambiare il terreno di coltura standard per 20 ml di mezzo di trasfezione. Vicino alla fine di questo step 1 ora di incubazione, miscelare 400 mg di DNA plasmidico con 10,95 ml DDH 2 0 e 1,55 ml di 2M CaCl 2 in provette da 50 ml (1 tubo / 5 piatti).
- 1 a 2 minuti prima della trasfezione, aggiungere 12,5 ml 2x HBS a 12,5 ml della soluzione di DNA-Calcium, mescolare per inversione dei tubi e incubare per 30 secondi a temperatura ambiente.
- Aggiungi the composto preparato in 2.3.2 direttamente alle cellule (5 ml per piatto), goccia a goccia nel mezzo. Spruzzare uniformemente su tutta la superficie, girando il mezzo per un colore leggermente arancione.
- Incubare le piastre di coltura per 7 a 11 h in un incubatore di coltura tissutale (37 ° C, 5% CO 2 in aria umidificata). Dopo l'incubazione, un bel precipitato è visibile. Rimuovere il supporto transfezione, lavare accuratamente con PBS preriscaldata e aggiungere 20 ml di terreno di coltura senza siero preparati a 2.1.3. Incubare per 72 ore in un tessuto culturale incubatore.
- Analizzare l'efficienza di trasfezione ed espressione eseguendo un campione (~ 20 ml) del surnatante cellulare su SDS-PAGE e colorazione con Coomassie Brilliant Blue per visualizzare una banda granzyme.
- Purificazione di Gzms dalla cultura surnatante da Nickel-IMAC
- Dopo l'incubazione, decantare il surnatante di colture cellulari in 250 mL e chiaro per centrifugazione. Effettuare un primo giro (400 xg, 10 min, 4 °C) che cancellerà il mezzo da cellule indipendenti. Trasferire il surnatante in freschi 250 ml provette e centrifugare a 4000 xg, 30 min a 4 ° C per rimuovere i detriti rimanenti.
- Aggiungere 5 ml di 5 M NaCl, 6,25 ml di 2 M Tris-Base (pH 8) e 1 ml di 0,25 M Niso 4 per 250 ml di surnatante eliminato. Filtrare il surnatante con un gruppo filtro di vuoto 500 ml (0,45 mm).
- Equilibrare una colonna Nichel-IMAC con la Sua vincolante tampone A (10 volumi di colonna, CV) utilizzando un sistema FPLC adeguato.
- Applicare il surnatante eliminato alla colonna equilibrata ad un flusso di 0,5 ml / min a 4 ° C.
- Dopo che è stato applicato il surnatante, lavare colonna con la sua impegnativa buffer finché assorbimento UV linea di base viene raggiunto (di solito 10 CV).
- Eluire Gzms con lineare 20 ml gradiente (Da 0 a 250 mM imidazolo) ad una portata di 0,5 ml / min, mentre la raccolta 2 ml-frazioni. Analizzare le frazioni di eluizione di SDS-PAGE e colorazione Coomassie.
- Enterokinase (EK)trattamento e pulizia finale mediante cromatografia a scambio cationico
- Pool GZM contenenti frazioni in un tubo dialisi con ≤10 MWCO. Conservare un piccolo campione a -20 ° C, come il controllo pre-EK.
- Aggiungere EK a 0,02 unità / 50 ml di surnatante iniziale direttamente alla frazione pool nel tubo di dialisi e dializza O / N (almeno 16 ore) a temperatura ambiente in EK-buffer (4 L, cambiamento tampone volta).
- Il giorno dopo, analizzare EK trattata Gzms rispetto al pre-EK controllo da SDS-PAGE e colorazione Coomassie.
- Quando l'elaborazione N-terminale è completo, cambiare tampone di dialisi a S tampone A (4 L) e dializza per altri 4 ore a RT. Dializzato filtro (0,45 micron).
- Equilibrare un S-colonna con tampone A. S Caricare il campione nella colonna ad una velocità di flusso di 0,5 ml / min a 4 ° C.
- Dopo il caricamento del campione, lavare la colonna con tampone S A fino UV basale assorbanza viene raggiunta (circa 10 CV). Eluire le Gzms con un gradiente lineare di 30 ml (150 a 1,000 mM NaCl). GzmA eliuti a ~ 650 mM NaCl, GzmB a ~ NaCl 700 mm e GzmM a ~ NaCl 750 mm.
- Analizzare le frazioni di eluizione di SDS-PAGE e test colorimetrici (vedi sotto). Pool frazioni contenenti Gzms e concentrato (circa 30 volte, ad una concentrazione di circa 100 mM) in filtri di spin (15 ml, 10 MWCO). Aliquota i preparativi GZM concentrate e conservare a -80 ° C.
Attività 3. Test GZM
- Preparazione dei reagenti
- Preparare colorimetrico tampone: 50 mm Tris-Base, pH 7.
- Per la misura di GzmA, aggiungere Na-CBZ-L-lisina thiobenzyl estere (S-Bzl) (BLT) al tampone ad una concentrazione finale di 0,2 mM e 5,5'-ditio-bis (acido 2-nitrobenzoico) (DTNB) ad una concentrazione di 0,22 mM. Per GzmB, includere 0,2 mm DTNB mM Boc-Ala-Ala-Asp-S-Bzl (DAA) e 0,22. Per GzmM, includere 0,2 mm Suc-Ala-Ala-Pro-Leu-p-nitroanilide (PNA) (AAPL). Peptidi sintetici sono aggiunti da adeguate soluzioni madre (in DMSO, stored a -20 ° C) al buffer appena prima del dosaggio.
- Preparare tampone clivaggio: NaCl 100 mM, 50 mM Tris-Base, pH 7.5
- Preparare colorimetrico tampone: 50 mm Tris-Base, pH 7.
- Test colorimetrici
- Distribuire piccoli campioni GZM (<5 ml) da frazioni di eluizione o stock concentrati nelle piastre a 96 pozzetti a fondo piatto. Includere un controllo positivo (preparati GZM testate o greggio lisati cellulari NK) e un controllo negativo (tampone solo).
- Aggiungere 100 ml di tampone a ciascun pozzetto (utilizzando una pipetta multicanale). Incubare per 10 minuti a 37 ° C. Misurare OD a 405 nm in un lettore per micropiastre.
- Test Decolleté
- Per i saggi scissione utilizzando substrati purificati, co-incubare un substrato proteico (nativa o ricombinante, 100-400 nM; alcuni esempi di substrati GZM efficienti sono presentati nella sezione risultato e nella nota alla fine di questa sezione) con diluizioni seriali di un GZM (a partire da 400 nM) in tampone per varie volte.Analizzare mediante SDS-PAGE e Coomassie o macchie d'argento; o mediante Western blotting utilizzando anticorpi specifici.
- Per i saggi scissione utilizzando lisati cellulari, sospendere 10 6 cellule HeLa (o qualsiasi linea cellulare tumorale disponibile) in 1 ml di tampone di saggio e lyse congelando in un / bagno di ghiaccio secco etanolo e scongelamento a 37 ° C per tre volte. Rimuovere detriti cellulari mediante centrifugazione (15.000 xg per 10 min a 4 ° C).
- Co-incubare il lisato liquidati con Gzms a diverse concentrazioni e tempi di cui sopra. Cleavage viene rilevata mediante immunoblotting utilizzando anticorpi appropriati.
NOTA: Alcuni esempi di substrati in buona fede per la quale gli anticorpi commerciali sono disponibili: Offerta (BH3-interagente agonisti morte di dominio) e caspasi 3 spaccati da GzmB 27,28; più ribonucleoproteins nucleari eterogenei (hnRNPA1, A2 e U) spaccati da GzmA 29; citomegalovirus phosphoprotein 71 da GzmM 30.
Risultati
Nella seguente sezione presenteremo una documentazione completa di un preparato GzmA per illuminare il metodo. Abbiamo anche con successo purificati GzmB e GzmM, producendo risultati simili in materia di efficienza e l'attività di depurazione. Tuttavia, da tali preparati più tardi mostreremo solo pochi pezzi selezionati di dati. Preparazioni GzmB dalle cellule 293T seguenti l'attuale protocollo sono stati utilizzati in diversi studi pubblicati, mettendo in evidenza la loro attività in diversi sistemi di dosaggio biologici 9,29,31-34.
Un tipico purificazione GzmA è mostrato in Figura 2A. Trasfezione efficiente ed espressione dopo 72 ore è stato indicato da una fascia GZM rilevabili su un Coomassie macchiato gel SDS-PAGE senza ulteriore concentrazione del surnatante cultura (~ 37 kDa per GzmB e GzmM in condizioni riducenti; ~ 60/34 kDa per GzmA sotto non riducente / condizioni riducenti). Dopo la purificazione IMAC i campioni sono stati trattati con enterokinase (EK). Uno spostamento visibile della EK trattato campione (post-EK) è stata osservata rispetto al controllo pre-EK. La purificazione finale sul S-colonna provocato preparati GZM elevata purezza (GzmA in figura 2A; GzmB e GzmM in Figura 2B) con un singolo aspetto di banda su gel di proteine Coomassie-macchiati. Le frazioni riuniti sono stati concentrati ad una concentrazione finale di 100 mM ~. Tipicamente, abbiamo ottenuto rese di circa 0,5 a 1 mg per 100 ml Gzms supernatante di coltura. Per dimostrare glicosilazione efficiente, alcuni preparativi iniziali sono stati trattati con endoglicosidasi (Endo) H, che rimuove alti oligosaccaridi mannosio da glicoproteine N-linked. Native GzmA ha un sito glicosilazione N-linked a Asn-142, a cui un alto oligosaccaride mannosio è legato 35. Trattamento Endoh indotto uno spostamento evidente mobilità nel GZM A, così come GzmB, preparati da cellule HEK293T ma non in bacterially generato GzmA come analizzato mediante SDS-PAGE e Coomassiecolorazione (Figura 2C).
Di routine, ogni lotto GZM è stato testato per l'attività enzimatica in test colorimetrici. Questo test rapido e affidabile dimostra attività proteolitica dei Gzms dal clivaggio di piccoli peptidi sintetici che è indicato spettrofotometricamente da un cambiamento di colore del tampone. A causa di diverse preferenze riguardanti i residui amminoacidici (posizione P1) dopo di che queste proteasi solcano, la scelta di un peptide specifico varia tra i Gzms. GzmA ha attività tripsina-like, fende dopo i residui basici arginina (Arg, R) e lisina (Lys, K). Unirà GzmB preferenzialmente dopo residui di acido aspartico (Asp, D), e si unirà GzmM dopo leucina (Leu, L) e metionina (Met, M) 1. La nostra scelta peptide preferenziale è BLT -S-Bzl per misurare l'attività GzmA, AAD -S-Bzl per GzmB e AAPL -pNA per GzmM.
La principale differenza tra il thiobsubstrati enzylester (AAD e BLT) e il substrato p-nitroanilide (AAPL) è la chimica specifica, in quanto GZM media scissione del thiobenzylester substrati rilascia benzil-mercaptano, che innesca solo una reazione cromogenica nella sua reazione a valle con la DTNB cromoforo. Pertanto, nel buffer di reazione di thiobenzylester substrati DTNB deve essere presente, mentre è sufficiente per il rilevamento colorimetrico rilascio GZM-mediata di p-nitroanilide. Il metodo dettagliato dei test colorimetrici stato recentemente pubblicato 36. La figura 3A mostra il BLT rappresentante e l'attività esterasi AAPL nelle frazioni di eluizione dalla S-colonna di un preparato GzmA e GzmM rispettivamente. Test colorimetrici è stato utilizzato anche per confrontare l'attività di ricombinante alle preparazioni GzmB nativi. Come mostrato nella Figura 3B, ricombinante 293T GzmB scisso il substrato cromogenico con efficienza simile rispetto a GzmB nativa purificata da un cel NK umaneLinea l, come recentemente descritto 12.
Per verificare in particolare l'attività GZM, sono indicati GZM saggi scissione utilizzando substrati proteici noti. Questi test scissione possono essere eseguite con proteina ricombinante o nativa purificata (se disponibile), con lisati cellulari o più fisiologico di cellule intatte. Se un substrato proteico è disponibile, l'attività proteolitica può essere analizzato in semplici esperimenti di co-incubazione con le preparazioni GZM come è dimostrato con il noto GzmA batterica e GzmB substrati nuoCD e nuof 9, così come con il romanzo umana GzmM mitocondriale substrato NDUFAF3 (Figura 4A).
Lisati cellulari rappresentano un'altra fonte evidente di substrati multipli GZM. Gli anticorpi commerciali sono disponibili contro molti dei substrati. Un metodo semplice e veloce per generare lisati cellulari è applicando più cicli di congelamento / scongelamento come precedentemente dimostrato 33. L'uso di detergenti is non è raccomandato in quanto possono interferire con l'attività GZM. Nella Figura 4B, GzmA mediata scissione hnRNPA1 in un lisato cellulare HeLa è dimostrato in un immunoblot usando un anticorpo anti-hnRNPA1, così come un anticorpo anti-Β-actina come controllo di caricamento.
Per i saggi della scissione (o saggi di citotossicità) nelle cellule intatte, la disponibilità di una molecola consegna aggiuntivo è necessario (PFN o streptolisina O, SLO, per le cellule di mammifero, GNLY o altri peptidi antimicrobici per cellule procariote). Saggi Cleavage in cellule intatte sono più impegnativo come la concentrazione delle molecole di consegna è critica e deve vasta sintonizzazione. L'introduzione di questi protocolli complessi di analisi apoptosi va oltre gli scopi di questo lavoro. Qui, si può indicare solo la vasta letteratura, come esempi 12,13.

Tabella 1: GZM Clonazione Primer sequenze.
Le sequenze dei primer che sono stati utilizzati per clonare GzmA, GzmB e GzmM sono indicati. Primer Forward sono stati progettati per introdurre un sito EK prima del N-terminale della proteasi attiva (vedi Figura 1)

Tabella 2: Soluzioni Stock e Buffer composizioni.
Sono indicate le ricette dei più importanti soluzioni madre e tamponi.
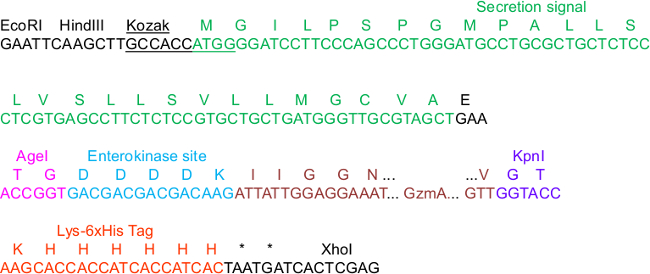
Figura 1. Sequenza pHLsec critico per Construct clonazione.
Nella sequenza, alcuni elementi nel vettore sonoevidenziato che sono importanti per la clonazione, la secrezione, IMAC purificazione e attivazione delle proteasi: Le Kozak consenso e sequenze segnale di secrezione, i siti di restrizione AGEI e KpnI, così come il tag Lys_6xHis C-terminale. Noi esemplificato GzmA come l'inserto che è N-terminale fuso ad una enterokinase (EK) sito. Per la mappa completa del vettore backbone completo, ci riferiamo alla informazioni supplementari 23.

Figura 2. Espressione, purificazione e attivazione di Fully glicosilata Gzms umani da HEK 293 cellule T.
A) mostra una serie di Coomassie macchiati, non riducente gel SDS-PAGE dimostrano l'intero processo di produzione GzmA dalla sua secrezione nel supernatante alla prima purificazione Nickel-IMAC, trattamento EK e fina l lucidatura tramite cromatografia a scambio cationico. Il supernatante di coltura è stato eseguito su SDS-PAGE in condizioni riducenti (rosso) e le condizioni (non rosso) non riducenti. GzmA è un omodimero (ssGzmA) che viene stabilizzato da un legame disolfuro. Il omodimero GzmA (~ 60 kDa) corre vicino alla contaminazione BSA (~ 66 kDa). In condizioni riducenti il monomero GzmA (shGzmA) appare come una banda di ~ 34 kDa. Gel Per dimostrare la purezza del GzmB finale e preparazioni GzmM, rappresentante Coomassie-tinto in condizioni non riducenti sono mostrati in B. batteri (E. coli) generata GzmA nonché GzmA e GzmB prodotti in cellule HEK293T stati trattati con Endoh e analizzato da non riducente SDS-PAGE e colorazione Coomassie. La glicosilazione delle Gzms prodotte in cellule HEK293T è dimostrato da uno spostamento di mobilità dopo il trattamento Endoh rispetto ai GzmA non glicosilata prodotta in batteri (C).
ig3.jpg "/>
Figura 3. Ricombinante Gzms Hydrolyze peptidi sintetici.
A), piccoli campioni delle frazioni di eluizione dalla colonna finale S sono stati testati per l'attività GzmA e GzmM in saggi cromogenici utilizzando BLT e AAPL rispettivamente, come substrati. I grafici mostrano peptide fenditura che è stato indicato come un aumento OD a 405 nm. Le frazioni di picco di attività correlate con il picco proteina nel eluizione come indicato in assorbanza UV e SDS-PAGE analisi (Figura 2A e B). B), 293T ricombinante e GzmB nativa (preparato come descritto 12) a concentrazioni indicate sono state incubate in presenza del substrato cromogenico AAD. Attività GzmB stato indicato come un cambiamento OD a 405 nm. Il grafico mostra la media ± SEM dei nostri più recenti preparati GZM che sono stati testati in triplicato.
52911 / 52911fig4.jpg "/>
Figura 4. ricombinante Gzms Cleave substrati proteici.
A) ricombinanti GST-tag, batteriche proteine della catena respiratoria nuoCD e nuof, nonché il mammiferi proteine catena respiratoria NDUFAF3, sono stati trattati con indicata concentrazione indicati Gzms per 15 min a 37 ° C. 1 mg di proteine purificate in 20 microlitri reazione sono stati utilizzati. Cleavage è stata analizzata mediante SDS-PAGE e colorazione Coomassie. B) lisato cellulare HeLa (ad una concentrazione proteica di circa 1 mg / ml) è stato incubato con concentrazioni indicate di GzmA ricombinante per 30 min e analizzato mediante immunoblotting utilizzando anticorpi anti hnRNPA1 ed anticorpi Β-actina.
Discussione
Il ruolo classico e ampiamente studiato di GzmA e GzmB è l'induzione di apoptosi nelle cellule di mammifero dopo la loro consegna citosolico dal formano pori proteine PFN 1. Recentemente, lo spettro citotossica delle Gzms stato ampliato significativamente da cellule di mammifero ai batteri 9,10, così come a certi parassiti 11. Inoltre, i non classici, funzioni extracellulari di GzmA e GzmB nonché il significato biologico dei vari Gzms orfani sono ancora oscuri. Pertanto, l'espressione e la purificazione del sistema tempo e costo-efficiente robusta delle Gzms, secondo quanto previsto dal presente protocollo, sarà di grande aiuto per questi studi futuri.
La forza di questo metodo è particolarmente basa sul vettore di espressione, pHLsec 23, che viene utilizzato in questo sistema. Questo plasmide ha un alto numero di copie in E. coli, consentendo in tal modo la produzione di DNA efficiente. I suoi elementi enhancer / promoter forniscono laforte attività in varie linee cellulari 24. Esso contiene un introne all'interno dell'unità di trascrizione. Introni sono stati trovati per migliorare l'espressione genica in cellule di mammifero fino a 100 volte 37. Inoltre, il plasmide fornisce un consenso Kozak e un segnale di secrezione ottimizzato, a-6xHis-tag Lys e un poli-A segnale (Figura 1). Gli inserti possono essere clonati utilizzando i siti AGEI e KpnI tra il segnale di secrezione e il tag Lys-6xHis. Utilizzando AGEI e XhoI eviterà il tag polyHis. Per i Gzms, era necessario inserire un sito enterokinase all'estremità N-terminale delle proteasi che consentono l'attivazione delle proteasi dopo espressione e purificazione IMAC. Per l'espressione di altri enzimi questo potrebbe non essere necessaria. Il plasmide di espressione è stato testato con successo per più costrutti di varie lunghezze, stati glicosilazione, e numeri di legami disolfuro, così come per le proteine che contenevano più domini con differenti pieghe 23.
HEK293T cellule crescono rapidamente in un mezzo a basso costo e sono molto adatti per la trasfezione calcio-fosfato conveniente. Per questo protocollo, si sconsiglia di oltre-passaggio delle cellule HEK293T. Scorte congelate di basso-passaggio-cellule dovrebbero essere preparati. Espansione decollo le cellule di solito ha circa 8 a 9 giorni (3 split) per ottenere la quantità desiderata di cellule. La densità delle cellule al giorno di trasfezione (dal 60 al 70% di confluenza) era critica per la trasfezione efficiente e di conseguenza espressione. Inoltre, evitando antibiotici ma aggiungendo clorochina (che inibisce la degradazione lisosomiale DNA) al mezzo migliorato significativamente l'efficienza 38. Abbiamo trovato che l'efficienza di trasfezione è linearmente dipendente dell'importo DNA saturando solo a circa 80 mg per un piatto da 15 cm (osservazioni non pubblicate). Pertanto, si consiglia di utilizzare fino al 80 μ g di DNA plasmidico / piatto in questo protocollo per la massima efficienza. Questo sarà pari a circa 2 mg di DNA per la preparazione (corresponding per 2 colonne MaxiPrep). L'efficienza di trasfezione è stata più facilmente monitorato eseguendo un campione della cultura surnatante (circa 20 μ l) su SDS-PAGE dopo il periodo di incubazione 72 ore. Una banda proteica della proteasi secreta dovrebbe essere visibile Coomassie colorazione. Se la band GZM era debole e le cellule non si sia staccata e sembrava praticabile, le colture sono state incubate per un altro 24 ore prima di IMAC purificazione.
Un'altra fase più critica era il trattamento enterokinase (EK) che attiva l'enzima. Attività EK è calcio-dipendente e viene inibita da alte concentrazioni di NaCl 39 o imidazolo (osservazioni non pubblicate). Pertanto, era fondamentale dializza l'eluato dalla IMAC contro un volume sufficiente (20 ml eluato per 2 L di tampone di dialisi) di tampone contenente EK abbastanza calcio e non più di 50 mM di NaCl a pH neutro. Trattamento EK è raccomandato per 16 ore a temperatura ambiente e deve essere controllata mediante SDS-PAGE che ha rivelato un cambiamento o la mobilitàf proteasi trattata se la scissione era completa. EK Fresco è stata aggiunta e l'incubazione in acqua dolce EK dialisi tampone è stato continuato se il turno era incompleta. Solo se la scissione era completa, la dialisi contro tampone S A è stato iniziato e purificazione continuato. La catena leggera catalitica di EK ha un valore pi di 5,2, consentendo la completa separazione EK dalle Gzms nella cromatografia finale scambio cationico.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was supported by grants from the Novartis Foundation for Medical-Biological Research and from the Research Pool of the University of Fribourg (to MW). We thank Li Zhao, Zhan Xu, and Solange Kharoubi Hess for technical support, as well as Radu Aricescu and Yvonne Jones (Oxford University, UK) for providing the pHLsec plasmid, and Thomas Schürpf (Harvard Medical School) for helpful discussions.
Materiali
| Name | Company | Catalog Number | Comments |
| TRIzol Reagent | Invitrogen | 15596-026 | Total RNA isolation kit |
| SuperScript II Reverse Transcriptase | Invitrogen | 18064-014 | |
| Phusion High-Fidelity DNA Polymerase | NEB | M0530L | |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| EX-CELL 293 Serum-Free Medium for HEK 293 Cells | Sigma | 14571C | |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 31966-021 | |
| SnakeSkin Dialysis Tubing, 10K MWCO | Thermo Scientific | 68100 | |
| Enterokinase from bovine intestine | Sigma | E4906 | recombinant, ≥20 units/mg protein |
| HisTrap Excel 5 ml column | GE Healthcare | 17-3712-06 | Nickel IMAC |
| HiTrap SP HP 5 ml column | GE Healthcare | 17-1152-01 | S column |
| N-α-Cbz-L-lysine thiobenzylester (BLT) | Sigma | C3647 | GzmA substrate |
| Boc-Ala-Ala-Asp-S-Bzl (AAD) | MP Biomedicals | 2193608 _10mg | GzmB substrate |
| Suc-Ala-Ala-Pro-Leu-p-nitroanilide (AAPL) | Bachem | GzmM substrate | |
| 5,5′-dithio-bis(2-nitrobenzoic acid) (DTNB) | Sigma | D8130 | Ellman`s reagent |
Riferimenti
- Chowdhury, D., Lieberman, J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol. 26, 389-420 (2008).
- Thiery, J., Lieberman, J. Perforin: a key pore-forming protein for immune control of viruses and cancer. Subcell Biochem. 80, 197-220 (2014).
- Krensky, A. M., Clayberger, C. Biology and clinical relevance of granulysin. Tissue Antigens. 73, 193-198 (2009).
- Bovenschen, N., Kummer, J. A. Orphan granzymes find a home. Immunol Rev. 235, 117-127 (2010).
- Lieberman, J. Granzyme A activates another way to die. Immunol Rev. 235, 93-104 (2010).
- Ewen, C. L., Kane, K. P., Bleackley, R. C. A quarter century of granzymes. Cell death and differentiation. 19, 28-35 (2012).
- Hiebert, P. R., Granville, D. J. Granzyme B in injury, inflammation, and repair. Trends Mol Med. 18, 732-741 (2012).
- Afonina, I. S., Cullen, S. P., Martin, S. J. Cytotoxic and non-cytotoxic roles of the CTL/NK protease granzyme. B. Immunol Rev. 235, 105-116 (2010).
- Walch, M., et al. Cytotoxic cells kill intracellular bacteria through granulysin-mediated delivery of granzymes. Cell. 157, 1309-1323 (2014).
- Lee, W. Y., et al. Invariant natural killer T cells act as an extravascular cytotoxic barrier for joint-invading Lyme Borrelia. Proc Natl Acad Sci U S A. , (2014).
- Kapelski, S., de Almeida, M., Fischer, R., Barth, S., Fendel, R. Antimalarial activity of granzyme B and its targeted delivery by a granzyme B-scFv fusion protein. Antimicrob Agents Chemother. , (2014).
- Thiery, J., Walch, M., Jensen, D. K., Martinvalet, D., Lieberman, J. Isolation of cytotoxic T cell and NK granules and purification of their effector proteins. Curr Protoc Cell Biol. Chapter 3 (Unit3 37), (2010).
- Shi, L., Yang, X., Froelich, C. J., Greenberg, A. H. Purification and use of granzyme B. Methods Enzymol. 322, 125-143 (2000).
- Masson, D., Tschopp, J. A family of serine esterases in lytic granules of cytolytic T lymphocytes. Cell. 49, 679-685 (1987).
- Lorentsen, R. H., Fynbo, C. H., Thogersen, H. C., Etzerodt, M., Holtet, T. L. Expression, refolding, and purification of recombinant human granzyme B. Protein Expr Purif. 39, 18-26 (2005).
- Sun, J., et al. Expression and purification of recombinant human granzyme B from Pichia pastoris. Biochem Biophys Res Commun. 261, 251-255 (1999).
- Xia, Z., et al. Expression and purification of enzymatically active recombinant granzyme B in a baculovirus system. Biochem Biophys Res Commun. 243, 384-389 (1998).
- Stahnke, B., et al. Granzyme B-H22(scFv), a human immunotoxin targeting CD64 in acute myeloid leukemia of monocytic subtypes. Mol Cancer Ther. 7, 2924-2932 (2008).
- Gehrmann, M., et al. A novel expression and purification system for the production of enzymatic and biologically active human granzyme. B. J Immunol Methods. 371, 8-17 (2011).
- Metkar, S. S., et al. Cytotoxic cell granule-mediated apoptosis: perforin delivers granzyme B-serglycin complexes into target cells without plasma membrane pore formation. Immunity. 16, 417-428 (2002).
- Motyka, B., et al. Mannose 6-phosphate/insulin-like growth factor II receptor is a death receptor for granzyme B during cytotoxic T cell-induced apoptosis. Cell. 103, 491-500 (2000).
- Pinkoski, M. J., et al. Entry and trafficking of granzyme B in target cells during granzyme B-perforin-mediated apoptosis. Blood. 92, 1044-1054 (1998).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr D Biol Crystallogr. 62, 1243-1250 (2006).
- Fukuchi, K., et al. Activity assays of nine heterogeneous promoters in neural and other cultured cells. In Vitro Cell Dev Biol Anim. 30 A, 300-305 (1994).
- Tran, T. V., Ellis, K. A., Kam, C. M., Hudig, D., Powers, J. C. Dipeptidyl peptidase I: importance of progranzyme activation sequences, other dipeptide sequences, and the N-terminal amino group of synthetic substrates for enzyme activity. Arch Biochem Biophys. 403, 160-170 (2002).
- Somanchi, S. S., Senyukov, V. V., Denman, C. J., Lee, D. A. Expansion, purification, and functional assessment of human peripheral blood NK cells. Journal of visualized experiments : JoVE. , (2011).
- Barry, M., et al. Granzyme B short-circuits the need for caspase 8 activity during granule-mediated cytotoxic T-lymphocyte killing by directly cleaving Bid. Mol Cell Biol. 20, 3781-3794 (2000).
- Darmon, A. J., Nicholson, D. W., Bleackley, R. C. Activation of the apoptotic protease CPP32 by cytotoxic T-cell-derived granzyme B. . Nature. 377, 446-448 (1995).
- Rajani, D. K., Walch, M., Martinvalet, D., Thomas, M. P., Lieberman, J. Alterations in RNA processing during immune-mediated programmed cell death. Proc Natl Acad Sci U S A. 109, 8688-8693 (2012).
- Domselaar, R., et al. Noncytotoxic inhibition of cytomegalovirus replication through NK cell protease granzyme M-mediated cleavage of viral phosphoprotein 71. J Immunol. 185, 7605-7613 (2010).
- Thiery, J., et al. Perforin activates clathrin- and dynamin-dependent endocytosis, which is required for plasma membrane repair and delivery of granzyme B for granzyme-mediated apoptosis. Blood. 115, 1582-1593 (2010).
- Thiery, J., et al. Perforin pores in the endosomal membrane trigger the release of endocytosed granzyme B into the cytosol of target cells. Nat Immunol. 12, 770-777 (2011).
- Thomas, M. P., et al. Leukocyte protease binding to nucleic acids promotes nuclear localization and cleavage of nucleic acid binding proteins. J Immunol. 192, 5390-5397 (2014).
- Jacquemin, G., et al. Granzyme B-induced mitochondrial ROS are required for apoptosis. Cell death and differentiation. , (2014).
- Kummer, J. A., Kamp, A. M., Citarella, F., Horrevoets, A. J., Hack, C. E. Expression of human recombinant granzyme A zymogen and its activation by the cysteine proteinase cathepsin C. The Journal of biological chemistry. 271, 9281-9286 (1996).
- Hagn, M., Sutton, V. R., Trapani, J. A. A colorimetric assay that specifically measures Granzyme B proteolytic activity: hydrolysis of Boc-Ala-Ala-Asp-S-Bzl. Journal of visualized experiments : JoVE. , e52419 (2014).
- Huang, M. T., Gorman, C. M. Intervening sequences increase efficiency of RNA 3' processing and accumulation of cytoplasmic RNA. Nucleic Acids Res. 18, 937-947 (1990).
- Luthman, H., Magnusson, G. High efficiency polyoma DNA transfection of chloroquine treated cells. Nucleic Acids Res. 11, 1295-1308 (1983).
- Magee, A. I., Grant, D. A., Hermon-Taylor, J., Offord, R. E. Specific one-stage method for assay of enterokinase activity by release of radiolabelled activation peptides from alpha-N-[3H]acetyl-trypsinogen and the effect of calcium ions on the enzyme activity. Biochem J. 197, 239-244 (1981).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon