Method Article
תשואה גבוהה ומערכת ביטוי עלות-יעילה של Granzymes האדם בתאי יונקים
In This Article
Summary
We describe here a cost-efficient granzyme expression system using HEK293T cells that produces high yields of pure, fully glycosylated and enzymatically active protease.
Abstract
When cytotoxic T lymphocytes (CTL) or natural killer (NK) cells recognize tumor cells or cells infected with intracellular pathogens, they release their cytotoxic granule content to eliminate the target cells and the intracellular pathogen. Death of the host cells and intracellular pathogens is triggered by the granule serine proteases, granzymes (Gzms), delivered into the host cell cytosol by the pore forming protein perforin (PFN) and into bacterial pathogens by the prokaryotic membrane disrupting protein granulysin (GNLY). To investigate the molecular mechanisms of target cell death mediated by the Gzms in experimental in-vitro settings, protein expression and purification systems that produce high amounts of active enzymes are necessary. Mammalian secreted protein expression systems imply the potential to produce correctly folded, fully functional protein that bears posttranslational modification, such as glycosylation. Therefore, we used a cost-efficient calcium precipitation method for transient transfection of HEK293T cells with human Gzms cloned into the expression plasmid pHLsec. Gzm purification from the culture supernatant was achieved by immobilized nickel affinity chromatography using the C-terminal polyhistidine tag provided by the vector. The insertion of an enterokinase site at the N-terminus of the protein allowed the generation of active protease that was finally purified by cation exchange chromatography. The system was tested by producing high levels of cytotoxic human Gzm A, B and M and should be capable to produce virtually every enzyme in the human body in high yields.
Introduction
Gzms היא משפחה של פרוטאזות סרין ההומולוגית מאוד מקומי בlysosomes מיוחד של CTL ותאי NK 1. הגרגרים הרעילים לתאים של תאי רוצח אלה מכילים גם חלבוני שיבוש-קרום PFN וGNLY שפורסמו בו זמנית עם Gzms על הכרת תא מטרה המיועד לחיסול 2,3. ישנם חמש Gzms בבני אדם (GzmA, B, H, K ו- M), ו -10 Gzms בעכברים (GzmA - G, K, M ו- N). GzmA וGzmB הם נפוצים ביותר ונחקר בהרחבה בבני אדם ועכברים 1. עם זאת, מחקרים שנעשה לאחרונה יותר החלו לחקור את מסלולי תא-מוות, כמו גם את ההשפעות ביולוגיות נוספות בתיווך Gzms האחר, שנקרא היתום בבריאות ובחוליים 4.
הפונקציה הידועה ביותר של Gzms, בפרט של GzmA וGzmB, היא האינדוקציה של מות תאים מתוכנת בתאי יונקים, כאשר נמסרו לתאי המטרה על ידי PFN 5,6. עם זאת, יותר מחקרים שנעשה לאחרונה הראו גם השפעות תאית של Gzms עם השפעה עמוקה על רגולציה ודלקת חיסוניות, באופן בלתי תלויים על ידי משלוח cytosolic PFN 7,8. הספקטרום של תאים שנהרגו ביעילות לאחר כניסת cytosolic של Gzms גם התרחב לאחרונה מתאי יונקים לחיידקי 9,10 ואפילו טפילים מסוימים 11. הגילויים האחרונים אלה נפתחו שדה חדש לגמרי לחוקרי Gzm. לכן,, מערכת יונקים ביטוי תשואה גבוהה יעילה וחסכונית באופן משמעותי להקל את הדרך למחקרים עתידיים אלה.
Gzms האנושי, עכבר והחולדה ילידים כבר מטוהר בהצלחה מחלק גרגיר של קווי תאי CTL וNK 12-14. עם זאת, בידיים שלנו התשואה של טכניקות טיהור כזה היא בטווח של תרבות פחות מ -0.1 מ"ג / L תא (תצפית לא פורסם ו -12). יתר על כן, החלטת chromatographic של Gzm יחיד ללא זיהום על ידי טיהורGzms ו / או חלבונים שנמצאים גם בגרגרים r מאתגר (נתונים שלא פורסם ו12,14). Gzms רקומביננטי הופק בחיידקי 15, שמרי 16, תאי חרקים 17 ובאפילו בתאי יונקים כגון 293 HEK 18,19. רק מערכות ביטוי היונקים לשאת הפוטנציאל לייצר אנזימי רקומביננטי עם שינויי posttranslational זהים לחלבון הרעיל לתאים המקומי. שינויי Posttranslational היו מעורבים עם הספיגה הספציפית על ידי אנדוציטוזה והלוקליזציה תאית של פרוטאז בתוך תאי יעד 20-22. לכן, על ידי השימוש בpHLsec 23 (מתנת סוג של ראדו Aricescu והאיבון ג'ונס, אוניברסיטת אוקספורד, בריטניה) כעמוד שדרת פלסמיד ביטוי Gzm, הקמנו מערכת פשוטה, זמן ועלות-יעילה לייצור חלבון תשואה גבוהה ב תאי HEK293T. pHLsec משלב משפר CMV עם אמרגן Β אקטין עוף; יחד, מרכיבים אלה demonstraטד פעילות האמרגן החזק ביותר בשורות תאים שונות 24. בנוסף, מכיל פלסמיד אינטרון ארנב Β-גלובין, אותות קוזאק והפרשה מותאמים, ליס-6xHis-תג ופולי-אות. ניתן לשכפל מוסיף נוחות בין אות ההפרשה ויס-6xHis התג (איור 1) להבטיח ביטוי אופטימלי ויעילות הפרשה לחלבונים חסרי תחומים N-מסוף מתאימים. לביטוי של Gzms, החלפנו את רצף אות הפרשת אנדוגני עם אות ההפרשה הניתנת על ידי הווקטור אחרי enterokinase אתר (EK) (DDDDK), כך שטיפול EK הופעל Gzms המופרש (Gzms הפעיל להתחיל עם N-המסוף רצף חומצות אמינו IIGG 25). בנוסף לטובת לשיטה זו, תאי HEK293T לצמוח במהירות בינוני במחיר נמוך, כגון בינוני של הנשר (DMEM) השתנה Dulbecco, ומתאימים גם לשיטת transfection סידן-פוספט עלות-יעילה.
Protocol
1. הפקה של פלסמיד הביטוי pHLsec-Gzm
- הכן רנ"א הכל מתאי NK אנושיים (תאים ראשוניים שהוכנו כב -26 או שורת תאי NK NK-92 המבטא את כל חמש Gzms האנושי) בשיטת בידוד RNA מתאימה ולהפוך לתמלל באמצעות ערכה לסנתז cDNA ראשונה גדיל, הבאים manufacturer` המלצות של. להגביר Gzm cDNA באמצעות PCR ושיבוט לpHLsec כפי שתואר ב -23 (מתנת סוג של ראדו Aricescu והאיבון ג'ונס, אוניברסיטת אוקספורד, בריטניה), תוך שימוש באתרי AgeI וKpnI (איור 1).
הערה: השתמש בפריימרים הבאים שצוינו בטבלה 1. - אשר מוסיף נכון על ידי רצף. הרחב את פלסמידים ביטוי בתאי DH5α ולטהר באמצעות ערכת בידוד פלסמיד ללא רעלן פנימי ולעקוב אחר ההוראות של היצרן.
- Resuspend פלסמידים המטוהרים ב, מים סטריליים ללא רעלן פנימי בריכוז של 2 מ"ג / מ"ל ולאחסן ב -20 ° C untiשימוש l.
2. ביטוי של Gzms בתאי HEK293T
- הכנה של חומרים כימיים
- להכין מדיום תרבות סטנדרטי. לנשר בינוני השתנה Dulbecco (DMEM) גלוקוז המכיל גבוה (25 מ"מ), Glutamax (4 מ"מ), פירובט נתרן (1 מ"מ) להוסיף 10% מסרום סטנדרטי עגל עוברי (FCS), פניצילין (100 יחידות / מיליליטר), סטרפטומיצין ( 100 מיקרוגרם / מיליליטר).
- הכן בינוני transfection. למדיום תרבות ללא פניצילין, סטרפטומיצין להוסיף 25 מיקרוגרם / מיליליטר chloroquine (להוסיף טרי ביום transfection מ1,000x מניות בPBS, מאוחסנות ב -20 ° C).
- הכן בינוני תרבות סרום ללא: עד בינוני סרום ללא לHEK293 תאים להוסיף גלוטמין (4 מ"מ), פניצילין (100 יחידות / מיליליטר), סטרפטומיצין (100 מיקרוגרם / מיליליטר), ו2.5mg / ב amphotericin L
- הכן את הפתרונות שמתוארים בטבלה 2 ומסנן עם מסנן 0.45 מיקרומטר לפני שימוש:
- הרחבת תאי HEK293T
- לגדל תאי HEK293T ב 20 מיליליטר כתבינוני יור באמצעות 150 x 25 מנות בתרבית רקמת מ"מ.
- פיצול תאים ב 80% confluency (מפוצל ביחס של 1: 4, בדרך כלל בכל יום 3 rd). תאים באופן רופף לצרף, הם יכולים להיות מכניים מנותקים ללא trypsinization ידי קפדנות pipetting למעלה ולמטה.
- תאי צלחת בלילה שלפני transfection לתת confluency 60-70% ביום transfection (צפיפות זריעה ~ 2 x 10 5 תאים / מיליליטר). גודל הכנה רגיל מורכב של 20 עד 25 מנות תרבות.
- transfection סידן פוספט
- 1 שעה לפני transfection, לשנות את התרבות בינונית הסטנדרטי למדיום transfection 20 מיליליטר. לקראת סוף שלב דגירה שעה 1 זה, לערבב 400 מיקרוגרם של ה- DNA פלסמיד עם 10.95 DDH מיליליטר 2 0 ו1.55 מיליליטר של 2M CaCl 2 בצינורות 50 מיליליטר (צינור 1/5 מנות).
- 1 עד 2 דקות לפני transfection, להוסיף 12.5 מיליליטר 2x HBS ל12.5 מיליליטר של פתרון ה- DNA-סידן, לערבב על ידי היפוך של הצינורות ודגירה במשך 30 שניות בRT.
- להוסיף התערובת מוכנה בדואר 2.3.2 ישירות לתאים (5 מ"ל לכל צלחת), ירידה מבחינת לתוך המדיום. מפזרים באופן שווה על פני כל השטח, הופכים את המדיום לצבע כתום מעט.
- דגירה תרבות המנות ל7-11 שעות בתרבית רקמת חממה (37 מעלות צלזיוס, 5% CO 2 באוויר humidified). לאחר הדגירה, משקע בסדר גלוי. הסר את מדיום transfection, לשטוף בזהירות עם PBS מראש חימם ולהוסיף בינוני תרבות סרום ללא 20 מיליליטר מוכן ב2.1.3. דגירה של 72 שעות בתרבית רקמת חממה.
- לנתח את יעילות transfection וביטוי על ידי הפעלת מדגם (~ 20 μl) של supernatant התא על SDS-PAGE וצביעה עם כחול מבריק Coomassie לדמיין להקת granzyme.
- טיהור של Gzms מsupernatant התרבות על ידי ניקל-IMAC
- לאחר הדגירה, למזוג את supernatants תרבית תאים למ"ל 250 צינורות וברורים על ידי צנטריפוגה. לבצע ספין ראשון (400 XG, 10 דקות, 4 °ג) שינקה את המדיום מהתאים מנותקים. מעבירים את supernatant ב 250 מיליליטר צינורות וספין טריים ב 4000 XG, 30 דקות ב 4 ° C כדי להסיר כל פסולת תא שנותרה.
- הוסף 5 מיליליטר של 5 M NaCl, 6.25 מיליליטר של 2 מ 'טריס-בסיס (pH 8) ו 1 מיליליטר של 0.25 מ' 4 Niso ל250 מיליליטר של supernatant פינה. סנן את supernatant באמצעות יחידת 500 מיליליטר מסנן אבק (0.45 מ"מ).
- לאזן טור ניקל-iMac עימו מחייב חיץ (כרכי טור 10, CV) באמצעות מערכת FPLC מתאימה.
- החל supernatant פינה לעמודת equilibrated בקצב זרימה של 0.5 מיליליטר / דקה על 4 מעלות צלזיוס.
- לאחר supernatant יושם, לשטוף טור עם החיץ-מחייב עד לנקודת התחלת ספיגת UV (בדרך כלל 10 קורות חיים).
- Gzms Elute עם 20 מ"ל שיפוע ליניארית (0 עד 250 מ"מ imidazole) בקצב זרימה של 0.5 מיליליטר / דקה בעת איסוף 2 מ"ל שברים. לנתח את השברים elution על ידי SDS-עמוד וצביעת Coomassie.
- Enterokinase (EK)טיפול וניקוי סופי על ידי כרומטוגרפיה החלפת קטיון
- בריכת Gzm מכיל שברים בצינור dialyzing עם ≤10 MWCO. אחסן מדגם קטן ב -20 ° C כשליטה מראש EK.
- להוסיף EK ביחידת 0.02 / 50 מיליליטר של supernatant הראשוני ישירות לשבריר נקווה בצינור הדיאליזה ודיאליזת O / N (לפחות 16 שעות) ב RT בEK-חיץ (4 L, שינוי חיץ פעם אחת).
- למחרת, לנתח EK טופל Gzms בהשוואה לEK מראש השליטה על ידי SDS-עמוד וצביעת Coomassie.
- כאשר עיבוד N-מסוף הוא מלא, לשנות חיץ דיאליזה לS חיץ (4 ליטר) ודיאליזה במשך 4 שעות נוספות בRT. dialysate מסנן (0.45 מיקרומטר).
- לאזן S-טור עם א 'חיץ S טען את המדגם על העמודה עם בקצב זרימה של 0.5 מיליליטר / דקה על 4 מעלות צלזיוס.
- לאחר טעינת מדגם, לשטוף את העמודה עם חיץ S עד לנקודת התחלת ספיגת UV (כ -10 קורות חיים). Elute Gzms עם שיפוע 30 מיליליטר ליניארי (150 ל -1,000 מ"מ NaCl). דואר GzmAלאוטות ב ~ 650 מ"מ NaCl, GzmB ב ~ 700 מ"מ NaCl וGzmM ב ~ 750 מ"מ NaCl.
- לנתח שברי elution ידי SDS-עמוד ומבחני colorimetric (ראה להלן). שברים בריכה המכילים Gzms ולהתרכז (על פי 30, לריכוז של כ -100 מיקרומטר) במסנני ספין (15 מיליליטר, 10 MWCO). Aliquot ההכנות מרוכזות Gzm ולאחסן ב -80 ° C.
פעילות 3. הבדיקה Gzm
- הכנה של חומרים כימיים
- הכן חיץ assay colorimetric: 50 מ"מ טריס-בסיס, pH 7.
- למדידה GzmA, להוסיף Na-CBZ-L ליזין thiobenzyl אסתר (S-Bzl) (BLT) למאגר assay לריכוז סופי של 0.2 מ"מ ו5,5'-dithio-bis (חומצה 2-nitrobenzoic) (DTNB) לריכוז של 0.22 מ"מ. לGzmB, כולל 0.2 מ"מ בוק-עלא-עלא-Asp-S-Bzl (AAD) ו0.22 מ"מ DTNB. לGzmM, כולל 0.2 מ"מ SUC-עלא-עלא-Pro Leu-P-nitroanilide (PNA) (AAPL). פפטידים סינטטיים מתווספים מפתרונות מניות מתאימים (בDMSO, Storאד ב -20 ° C) למאגר טרי לפני assay.
- הכן חיץ assay מחשוף: 100 מ"מ NaCl, 50 מ"מ טריס-בסיס, pH 7.5
- הכן חיץ assay colorimetric: 50 מ"מ טריס-בסיס, pH 7.
- מבחני colorimetric
- להפיץ דגימות קטנות Gzm (<μl 5) משברי elution או מניות מרוכזות בצלחות 96 היטב שטוח תחתון. כולל בקרה חיובית (הכנות Gzm נבדקו או גולמי lysates תא NK) ובקרה שלילית (חיץ בלבד).
- להוסיף של חיץ assay 100 μl היטב כל אחד (בעזרת פיפטה רב-ערוצים). דגירה של 10 דקות על 37 מעלות צלזיוס. למדוד OD ב 405 ננומטר בקורא microplate.
- assay המחשוף
- עבור מבחני מחשוף באמצעות מצעים מטוהרים, שיתוף דגירה מצע חלבון (יליד רקומביננטי או, 100-400 ננומטר; כמה דוגמאות של מצעי Gzm יעילים מוצגות בסעיף התוצאה ובהערה בסוף הסעיף זה) עם דילולים סידוריים של Gzm (החל מ -400 ננומטר) במאגר assay לזמנים שונים.ניתוח על ידי SDS-עמוד וCoomassie או צביעת כסף; או על ידי מערבי סופג באמצעות נוגדנים ספציפיים.
- עבור מבחני מחשוף באמצעות lysates תא, להשעות 10 6 תאי הלה (או כל קו תאים סרטני זמין) ב 1 מיליליטר של חיץ assay וlyse על ידי הקפאה באתנול / אמבט קרח יבש והפשרה על 37 מעלות צלזיוס פעמים שלוש. הסר פסולת תא על ידי צנטריפוגה (15,000 XG במשך 10 דקות ב 4 ° C).
- שיתוף דגירה lysate פינה עם Gzms בריכוזים ובזמנים שונים כאמור לעיל. מחשוף הוא זוהה על ידי immunoblotting באמצעות נוגדנים מתאימים.
הערה: כמה דוגמאות של מצעים בתום לב שלנוגדנים מסחריים זמינות: הצעה (BH3 אינטראקצית אגוניסט מות תחום) וcaspase 3 ביקע ידי GzmB 27,28; ribonucleoproteins מרובה הטרוגנית הגרעיני (hnRNPA1, A2 ו- U) ביקע ידי GzmA 29; phosphoprotein ציטומגלווירוס 71 על ידי 30 GzmM.
תוצאות
בסעיף הבא נציג תיעוד של הכנת GzmA שלם כדי להאיר את השיטה. אנחנו גם מטוהרים בהצלחה GzmB וGzmM, הפקת תוצאות דומות בכל קשור ליעילות טיהור ופעילות. עם זאת, מהכנות מאוחר יותר אלה שרק מראים כמה חתיכות נבחרות של נתונים. הכנות GzmB מתאי 293T הבאים הפרוטוקול הנוכחי שמשו במספר מחקרים שפורסמו, המדגישות את פעילותם במערכות ביולוגיות שונות assay 9,29,31-34.
טיהור GzmA טיפוסית מוצגת באיור 2 א. transfection וביטוי יעילים לאחר 72 שעות היו מצויינים על ידי להקת Gzm לזיהוי על ג'ל SDS-עמוד הצבעוני Coomassie ללא ריכוז נוסף של supernatant התרבות (~ 37 kDa לGzmB וGzmM בתנאי צמצום; ~ 60/34 kDa לGzmA תחת ללא הפחתה / הפחתת תנאים). לאחר טיהור IMAC טופלו הדגימות עם להיכנסokinase (EK). שינוי נראה של EK טופל מדגם (פוסט-EK) בהשוואה לשליטה מראש EK נצפה. הטיהור הסופית על S-הטור הביאה הכנות Gzm טהורות ביותר (GzmA באיור 2 א; GzmB וGzmM באיור 2) עם הופעת להקה אחת על ג'לי חלבון מוכתם-Coomassie. השברים אספו רוכזו לריכוז סופי של ~ 100 מיקרומטר. בדרך כלל, השגנו תשואות של כ 0.5-1 Gzms מ"ג לsupernatant תרבות 100 מיליליטר. כדי להדגים glycosylation היעילה, טופלו כמה הכנות ראשוניות עם Endoglycosidase (Endo) H, אשר מסיר אוליגוסכרידים מנוז גבוהים מגליקופרוטאינים N צמודים. יש ילידי GzmA אתר N צמוד glycosylation בASN-142, שלoligosaccharide מנוז גבוה קשור 35. טיפול EndoH מושרה משמרת ברורה ניידות בGzm, כמו גם GzmB, הכנות מתאי HEK293T אבל לא בנוצר bacterially GzmA כפי שנותח על ידי SDS-עמוד וCoomassieהכתמה (איור 2 ג).
באופן שיגרתי, כל אצווה Gzm נבדק לפעילות האנזימטית במבחני colorimetric. בדיקה מהירה ואמינה זה מדגימה פעילות מפרקי חלבונים של Gzms על ידי המחשוף של פפטידים סינטטיים קטנים שהצביע spectrophotometrically על ידי שינוי צבע של חיץ assay. בשל העדפות שונות בנוגע לשאריות חומצת אמינו (מיקום P1) לאחר שפרוטאזות אלה לדבוק, הבחירה של פפטיד ספציפי משתנה בין Gzms. יש GzmA פעילות כמו טריפסין-, ביקוע אחרי השאריות הבסיסיות ארגינין (ARG, R) וליזין (ליס, K). דבק GzmB המועדף לאחר שאריות חומצה אספרטית (ASP, ד), ודבק GzmM לאחר אוצין (Leu, L) ומתיונין (Met, M) 1. הבחירה מועדפת שלנו היא פפטיד BLT -S-Bzl למדידת פעילות GzmA, AAD -S-Bzl לGzmB וAAPL -pNA לGzmM.
ההבדל העיקרי בין thiobמצעי enzylester (AAD וBLT) ומצע p-nitroanilide (AAPL) הוא כימיה מסוימת, שבGzm מתווך מחשוף של thiobenzylester מצעים משחרר נזיל-mercaptan, שרק מעורר תגובת chromogenic בתגובה במורד הזרם שלה עם DTNB chromophore. לכן, במאגרי התגובה של thiobenzylester מצעי DTNB יש להיות נוכח, ואילו שחרור תיווך Gzm של p-nitroanilide מספיק לגילוי colorimetric. השיטה מפורטת של מבחני colorimetric פורסמה לאחרונה 36. איור 3 א מציג את BLT הנציג ופעילות אסטראז AAPL בשברי elution מS-הטור של הכנת GzmA וGzmM, בהתאמה. assay colorimetric שימש גם להשוות את הפעילות של רקומביננטי להכנות GzmB ילידים. כפי שניתן לראות באיור 3, רקומביננטי 293T GzmB ביקע את מצע chromogenic עם יעילות דומה בהשוואה לילידי GzmB מטוהרת מcel NK אדםקו l, כתאר לאחרונה את 12.
כדי לבחון את פעילות Gzm אופן ספציפי יותר, מבחני מחשוף Gzm באמצעות מצעי חלבון ידועים מצוינים. ניתן לבצע מבחני מחשוף אלה עם חלבון רקומביננטי או ילידים מטוהרים (אם קיימים), עם lysates תא או פיסיולוגי ביותר עם תאים שלמים. אם מצע חלבון זמין, פעילות מפרקי חלבונים ניתן לנתח בניסויי שיתוף דגירה פשוטים עם הכנות Gzm כמו זה בא לידי הביטוי בGzmA החיידקים הידוע וGzmB מצעי nuoCD ו -9 nuoF, כמו גם עם NDUFAF3 מצע הרומן האנושי GzmM המיטוכונדריה (איור 4 א).
lysates התא מייצג מקור ברור נוסף של מצעי Gzm מרובים. נוגדנים מסחריים זמינים נגד רב של מצעים. שיטה מהירה ופשוטה כדי ליצור lysates תא היא על ידי יישום הקפאה / הפשרה מחזורים מרובים כפי שהודגם בעבר 33. השימוש בחומרי ניקוי ששעות לא מומלץ כפי שהם יכולים להפריע לפעילות Gzm. באיור 4, GzmA תיווך מחשוף של hnRNPA1 בlysate תא הלה בא לידי הביטוי בimmunoblot באמצעות נוגדן אנטי-hnRNPA1, כמו גם נוגדן אנטי Β אקטין כביקורת טעינה.
עבור מבחני מחשוף (או מבחני רעילים) בתאים שלמים, את הזמינות של מולקולת משלוח נוספת היא הכרחית (PFN או Streptolysin O, SLO, לתאי יונקים; GNLY או פפטידים מיקרוביאלית אחרים לתאי פרוקריוטים). מבחני מחשוף בתאים שלמים הם מאתגרים ביותר כריכוז של מולקולות המשלוח הוא קריטי וצריך כוונון עדין נרחב. היכרות עם פרוטוקולים מורכבים אלה של מבחני אפופטוזיס היא מעבר להיקף של מאמר זה. כאן, אנו יכולים רק להתייחס לגוף העצום של ספרות, כמו 12,13 דוגמאות.

טבלת 1: Gzm רצפי פריימר שיבוט.
רצפי פריימר ששמשו לשבט GzmA, GzmB וGzmM מצוינים. פריימרים קדימה נועדו להציג את אתר EK לפני N-הסופי של פרוטאז הפעיל (ראה איור 1)

טבלה 2: פתרונות מניות ויצירות מאגר.
המתכונים של פתרונות המניות החשובים ביותר ומאגרים מצוינים.
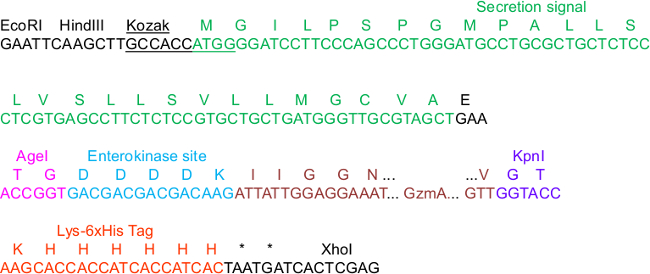
איור 1. רצף pHLsec קריטי לשיבוט Construct.
ברצף, כמה אלמנטים בווקטור הםהדגיש כי חשובים לשיבוט, הפרשה, טיהור IMAC והפעלה של פרוטאזות: רצפי קונסנסוס קוזאק ואות הפרשה, אתרי הגבלת AgeI וKpnI, כמו גם את תג Lys_6xHis C-מסוף. אנו הודגם GzmA כלהוסיף שהוא N-סופני התמזגו אתר enterokinase (EK). למפה המלאה של עמוד השדרה וקטור המלא, אנו מתייחסים למידע המשלים ב -23.

איור 2. ביטוי, טיהור והפעלה של מלא Gzms האדם המסוכר מHEK 293 תאי T.
) מציג סדרה של מוכתם-Coomassie, ג'לי SDS-PAGE מפגין את כל תהליך ייצור GzmA מהפרשתו בsupernatant לטיהור ראשונה ניקל-IMAC, טיפול EK וFINA צמצום אי- ליטוש l באמצעות כרומטוגרפיה החלפת קטיון. Supernatant התרבות נוהל על SDS-PAGE תחת צמצום (אדום) ותנאים להפחתת שאינן (לא אדומים). GzmA הוא homodimer (ssGzmA) שהוא התייצב בקשר דיסולפיד. Homodimer GzmA (~ 60 KDA) פועל קרוב לזיהום BSA (~ 66 KDA). תחת צמצום תנאי מונומר GzmA (shGzmA) מופיע כלהקת kDa ~ 34. ג'לי כדי להדגים את טוהר של GzmB הסופי והכנות GzmM, הצבעוני Coomassie נציג בתנאי צמצום שאינו מוצג בב bacterially (E. coli) נוצר GzmA כמו גם GzmA וGzmB מיוצרים בתאי HEK293T טופלו בEndoH ונותח על ידי לא-הפחתת SDS-PAGE וצביעת Coomassie. Glycosylation של Gzms מיוצר בתאי HEK293T באה לידי ביטוי בשינוי ניידות לאחר טיפול EndoH לעומת GzmA שאינו מסוכר מיוצר בחיידקים (C).
ig3.jpg "/>
איור 3. פפטידים סינטטיים רקומביננטי Gzms Hydrolyze.
), דגימות קטנות של שברי elution מעמודת S הסופית נבדקו לפעילות GzmA וGzmM במבחני chromogenic באמצעות BLT וAAPL, בהתאמה, כמו מצעים. גרפים מראים מחשוף פפטיד שצוין כגידול OD ב 405 ננומטר. שברי שיא הפעילות מתואמים עם שיא החלבון בelution כפי שצוין בספיגת UV וניתוח SDS-עמוד (איור 2 א 'וב'). B), 293T רקומביננטי וGzmB ילידים (שהוכן כמתואר 12) בריכוזים המצוין הודגרו בנוכחות של AAD מצע chromogenic. פעילות GzmB צוינה כשינוי OD ב 405 ננומטר. גרף מראה את הממוצע ± SEM של הכנות Gzm העדכנית ביותר שנבדקו בtriplicates.
52,911 / 52911fig4.jpg "/>
איור 4. מצעי חלבון רקומביננטי Gzms קליב.
), חלבוני רקומביננטי GST מתויג חיידקי שרשרת הנשימה nuoCD וnuoF, כמו גם את חלבון שרשרת הנשימה היונקים NDUFAF3, טופלו בריכוז המצוין של Gzms מצויינים במשך 15 דקות על 37 מעלות צלזיוס. 1 מיקרוגרם של חלבונים מטוהרים ב 20 תגובות μl היו בשימוש. המחשוף נותח על ידי SDS-PAGE וצביעת Coomassie. B) lysate תא הלה (בריכוז חלבון של ~ 1 מ"ג / מיליליטר) הודגר עם ריכוזים המצוינות של GzmA רקומביננטי למשך 30 דקות ונותח על ידי immunoblotting באמצעות hnRNPA1 אנטי ונוגדנים Β אקטין.
Discussion
התפקיד הקלאסי ונחקר בהרחבה של GzmA וGzmB הוא האינדוקציה של אפופטוזיס בתאי יונקים לאחר לידת cytosolic על ידי חלבון יוצרים הנקבובית 1 PFN. לאחרונה, הספקטרום ציטוטוקסיות של Gzms הורחב באופן משמעותי מתאי יונקים לחיידקים 9,10, כמו גם לטפילים מסוימים 11. יתר על כן, הפונקציות שאינן קלאסיות, תאית של GzmA וGzmB כמו גם את המשמעות הביולוגית של Gzms היתום השונים עדיין מעורפלות. לכן, מערכת ביטוי והטיהור חזקה זמן ועלות-היעילה של Gzms, כפי שנקבע בפרוטוקול זה, תהיה לעזר רב למחקרים העתידיים אלה.
כוחה של שיטה זו מבוסס בעיקר על וקטור הביטוי, pHLsec 23, המשמש במערכת זו. יש פלסמיד זה מספר גבוה עותק בE. coli, ובכך לאפשר ייצור DNA יעיל. האלמנטים משפר / האמרגן שלה לספק את הפעילות החזקה ביותר בשורות תאים שונות 24. הוא מכיל אינטרון בתוך יחידת השעתוק. אינטרונים נמצאו כדי לשפר את ביטוי גנים בתאי יונקים עד 100 פי 37. בנוסף, פלסמיד מספק קונסנסוס קוזאק ואות הפרשה מותאמת, ליס-6xHis-תג ופולי-אות (איור 1). ניתן לשכפל מוסיף באמצעות אתרי AgeI וKpnI בין אות ההפרשה והתג ליס-6xHis. באמצעות AgeI וXhoI יימנע תג polyHis. לGzms, היה צורך להכניס אתר enterokinase בN-הסופי של פרוטאזות המאפשרות הפעלה של פרוטאזות לאחר ביטוי וטיהור IMAC. לביטוי של אנזימים אחרים זה אולי לא יהיה צורך. פלסמיד הביטוי נוסה בהצלחה לבונה מרובה באורכים שונים, מדינות glycosylation, ומספרים של אג"ח דיסולפיד, כמו גם לחלבונים שהכילו מספר תחומים עם קפלים שונים 23.
s = "jove_content"> תאי HEK293T לצמוח במהירות בינוני בעלות נמוכה והם מאוד מתאימים גם לtransfection סידן-פוספט עלות-יעילה. לפרוטוקול זה, אנו ממליצים שלא תאי HEK293T על-חלוף. מניות קפוא של נמוך מעבר תאים צריכים להיות מוכנות. הרחבת ההמראה התאים בדרך כלל לקחה על 8-9 ימים (3 פיצולים) כדי להשיג את הכמות הרצויה של תאים. צפיפות התאים ביום transfection (60 עד 70% confluency) הייתה קריטית עבור transfection יעיל וכתוצאה מכך ביטוי. כמו כן, הימנעות אנטיביוטיקה אך הוספת chloroquine (שמעכב השפלה DNA lysosomal) למדיום המשופר יעילות 38 באופן משמעותי. מצאנו שיעילות transfection הייתה ליניארי תלוי של כמות ה- DNA להרוות רק בכ -80 מיקרוגרם למנה 15 ס"מ (תצפית לא פורסם). לכן, אנו ממליצים על שימוש בעד 80 μ גרם של פלסמיד דנ"א / מנה בפרוטוקול זה ליעילות מקסימלי. זה יסתכם בכ 2 מ"ג של ה- DNA להכנה (correspondinז 2 עמודות MaxiPrep). יעילות transfection הייתה פיקוח בקלות על ידי הפעלת מדגם של supernatant התרבות (כ -20 μ L) על SDS-PAGE לאחר תקופת הדגירה 72 שעות. להקת חלבון של פרוטאז המופרש צריכה להיות גלויה על ידי מכתים Coomassie. אם להקת Gzm הייתה חלשה והתאים לא לנתק והופיעו קיימא, התרבויות הודגרו במשך שעה נוספת 24 לפני טיהור IMAC.
עוד צעד הקריטי ביותר היה טיפול enterokinase (EK) שמפעיל את האנזים. פעילות EK היא סידן תלוי ומעוכבת על ידי ריכוזים גבוהים של NaCl 39 או imidazole (תצפית לא פורסם). לכן, זה היה חיוני לדיאליזת eluate מIMAC נגד נפח מספיק (20 מיליליטר eluate לכל 2 ליטר של חיץ דיאליזה) של חיץ EK מכיל מספיק סידן ולא יותר מ -50 מ"מ של NaCl ב- pH הניטרלי. טיפול EK מומלץ לשעה 16 בRT וצריך להיות במעקב על ידי SDS-עמוד שחשף o משמרת ניידותו פרוטאז טופל אם המחשוף היה מלא. EK טרי נוספה והדגירה בEK הטרי דיאליזה החיץ נמשכה אם השינוי לא היה שלם. רק אם המחשוף היה מלא, דיאליזה נגד מאגר S החלה והטיהור המשיכה. שרשרת האור הקטליטית של EK יש ערך לצרכן של 5.2, המאפשרת הפרדה המוחלטת של EK מGzms בכרומטוגרפיה החלפת קטיון הסופית.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by grants from the Novartis Foundation for Medical-Biological Research and from the Research Pool of the University of Fribourg (to MW). We thank Li Zhao, Zhan Xu, and Solange Kharoubi Hess for technical support, as well as Radu Aricescu and Yvonne Jones (Oxford University, UK) for providing the pHLsec plasmid, and Thomas Schürpf (Harvard Medical School) for helpful discussions.
Materials
| Name | Company | Catalog Number | Comments |
| TRIzol Reagent | Invitrogen | 15596-026 | Total RNA isolation kit |
| SuperScript II Reverse Transcriptase | Invitrogen | 18064-014 | |
| Phusion High-Fidelity DNA Polymerase | NEB | M0530L | |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| EX-CELL 293 Serum-Free Medium for HEK 293 Cells | Sigma | 14571C | |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 31966-021 | |
| SnakeSkin Dialysis Tubing, 10K MWCO | Thermo Scientific | 68100 | |
| Enterokinase from bovine intestine | Sigma | E4906 | recombinant, ≥20 units/mg protein |
| HisTrap Excel 5 ml column | GE Healthcare | 17-3712-06 | Nickel IMAC |
| HiTrap SP HP 5 ml column | GE Healthcare | 17-1152-01 | S column |
| N-α-Cbz-L-lysine thiobenzylester (BLT) | Sigma | C3647 | GzmA substrate |
| Boc-Ala-Ala-Asp-S-Bzl (AAD) | MP Biomedicals | 2193608 _10mg | GzmB substrate |
| Suc-Ala-Ala-Pro-Leu-p-nitroanilide (AAPL) | Bachem | GzmM substrate | |
| 5,5′-dithio-bis(2-nitrobenzoic acid) (DTNB) | Sigma | D8130 | Ellman`s reagent |
References
- Chowdhury, D., Lieberman, J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol. 26, 389-420 (2008).
- Thiery, J., Lieberman, J. Perforin: a key pore-forming protein for immune control of viruses and cancer. Subcell Biochem. 80, 197-220 (2014).
- Krensky, A. M., Clayberger, C. Biology and clinical relevance of granulysin. Tissue Antigens. 73, 193-198 (2009).
- Bovenschen, N., Kummer, J. A. Orphan granzymes find a home. Immunol Rev. 235, 117-127 (2010).
- Lieberman, J. Granzyme A activates another way to die. Immunol Rev. 235, 93-104 (2010).
- Ewen, C. L., Kane, K. P., Bleackley, R. C. A quarter century of granzymes. Cell death and differentiation. 19, 28-35 (2012).
- Hiebert, P. R., Granville, D. J. Granzyme B in injury, inflammation, and repair. Trends Mol Med. 18, 732-741 (2012).
- Afonina, I. S., Cullen, S. P., Martin, S. J. Cytotoxic and non-cytotoxic roles of the CTL/NK protease granzyme. B. Immunol Rev. 235, 105-116 (2010).
- Walch, M., et al. Cytotoxic cells kill intracellular bacteria through granulysin-mediated delivery of granzymes. Cell. 157, 1309-1323 (2014).
- Lee, W. Y., et al. Invariant natural killer T cells act as an extravascular cytotoxic barrier for joint-invading Lyme Borrelia. Proc Natl Acad Sci U S A. , (2014).
- Kapelski, S., de Almeida, M., Fischer, R., Barth, S., Fendel, R. Antimalarial activity of granzyme B and its targeted delivery by a granzyme B-scFv fusion protein. Antimicrob Agents Chemother. , (2014).
- Thiery, J., Walch, M., Jensen, D. K., Martinvalet, D., Lieberman, J. Isolation of cytotoxic T cell and NK granules and purification of their effector proteins. Curr Protoc Cell Biol. Chapter 3 (Unit3 37), (2010).
- Shi, L., Yang, X., Froelich, C. J., Greenberg, A. H. Purification and use of granzyme B. Methods Enzymol. 322, 125-143 (2000).
- Masson, D., Tschopp, J. A family of serine esterases in lytic granules of cytolytic T lymphocytes. Cell. 49, 679-685 (1987).
- Lorentsen, R. H., Fynbo, C. H., Thogersen, H. C., Etzerodt, M., Holtet, T. L. Expression, refolding, and purification of recombinant human granzyme B. Protein Expr Purif. 39, 18-26 (2005).
- Sun, J., et al. Expression and purification of recombinant human granzyme B from Pichia pastoris. Biochem Biophys Res Commun. 261, 251-255 (1999).
- Xia, Z., et al. Expression and purification of enzymatically active recombinant granzyme B in a baculovirus system. Biochem Biophys Res Commun. 243, 384-389 (1998).
- Stahnke, B., et al. Granzyme B-H22(scFv), a human immunotoxin targeting CD64 in acute myeloid leukemia of monocytic subtypes. Mol Cancer Ther. 7, 2924-2932 (2008).
- Gehrmann, M., et al. A novel expression and purification system for the production of enzymatic and biologically active human granzyme. B. J Immunol Methods. 371, 8-17 (2011).
- Metkar, S. S., et al. Cytotoxic cell granule-mediated apoptosis: perforin delivers granzyme B-serglycin complexes into target cells without plasma membrane pore formation. Immunity. 16, 417-428 (2002).
- Motyka, B., et al. Mannose 6-phosphate/insulin-like growth factor II receptor is a death receptor for granzyme B during cytotoxic T cell-induced apoptosis. Cell. 103, 491-500 (2000).
- Pinkoski, M. J., et al. Entry and trafficking of granzyme B in target cells during granzyme B-perforin-mediated apoptosis. Blood. 92, 1044-1054 (1998).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr D Biol Crystallogr. 62, 1243-1250 (2006).
- Fukuchi, K., et al. Activity assays of nine heterogeneous promoters in neural and other cultured cells. In Vitro Cell Dev Biol Anim. 30 A, 300-305 (1994).
- Tran, T. V., Ellis, K. A., Kam, C. M., Hudig, D., Powers, J. C. Dipeptidyl peptidase I: importance of progranzyme activation sequences, other dipeptide sequences, and the N-terminal amino group of synthetic substrates for enzyme activity. Arch Biochem Biophys. 403, 160-170 (2002).
- Somanchi, S. S., Senyukov, V. V., Denman, C. J., Lee, D. A. Expansion, purification, and functional assessment of human peripheral blood NK cells. Journal of visualized experiments : JoVE. , (2011).
- Barry, M., et al. Granzyme B short-circuits the need for caspase 8 activity during granule-mediated cytotoxic T-lymphocyte killing by directly cleaving Bid. Mol Cell Biol. 20, 3781-3794 (2000).
- Darmon, A. J., Nicholson, D. W., Bleackley, R. C. Activation of the apoptotic protease CPP32 by cytotoxic T-cell-derived granzyme B. Nature. 377, 446-448 (1995).
- Rajani, D. K., Walch, M., Martinvalet, D., Thomas, M. P., Lieberman, J. Alterations in RNA processing during immune-mediated programmed cell death. Proc Natl Acad Sci U S A. 109, 8688-8693 (2012).
- Domselaar, R., et al. Noncytotoxic inhibition of cytomegalovirus replication through NK cell protease granzyme M-mediated cleavage of viral phosphoprotein 71. J Immunol. 185, 7605-7613 (2010).
- Thiery, J., et al. Perforin activates clathrin- and dynamin-dependent endocytosis, which is required for plasma membrane repair and delivery of granzyme B for granzyme-mediated apoptosis. Blood. 115, 1582-1593 (2010).
- Thiery, J., et al. Perforin pores in the endosomal membrane trigger the release of endocytosed granzyme B into the cytosol of target cells. Nat Immunol. 12, 770-777 (2011).
- Thomas, M. P., et al. Leukocyte protease binding to nucleic acids promotes nuclear localization and cleavage of nucleic acid binding proteins. J Immunol. 192, 5390-5397 (2014).
- Jacquemin, G., et al. Granzyme B-induced mitochondrial ROS are required for apoptosis. Cell death and differentiation. , (2014).
- Kummer, J. A., Kamp, A. M., Citarella, F., Horrevoets, A. J., Hack, C. E. Expression of human recombinant granzyme A zymogen and its activation by the cysteine proteinase cathepsin C. The Journal of biological chemistry. 271, 9281-9286 (1996).
- Hagn, M., Sutton, V. R., Trapani, J. A. A colorimetric assay that specifically measures Granzyme B proteolytic activity: hydrolysis of Boc-Ala-Ala-Asp-S-Bzl. Journal of visualized experiments : JoVE. , e52419(2014).
- Huang, M. T., Gorman, C. M. Intervening sequences increase efficiency of RNA 3' processing and accumulation of cytoplasmic RNA. Nucleic Acids Res. 18, 937-947 (1990).
- Luthman, H., Magnusson, G. High efficiency polyoma DNA transfection of chloroquine treated cells. Nucleic Acids Res. 11, 1295-1308 (1983).
- Magee, A. I., Grant, D. A., Hermon-Taylor, J., Offord, R. E. Specific one-stage method for assay of enterokinase activity by release of radiolabelled activation peptides from alpha-N-[3H]acetyl-trypsinogen and the effect of calcium ions on the enzyme activity. Biochem J. 197, 239-244 (1981).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved