Method Article
ارتفاع العائد ونظام التعبير التكلفة ذات كفاءة من Granzymes الإنسان في خلايا الثدييات
In This Article
Summary
We describe here a cost-efficient granzyme expression system using HEK293T cells that produces high yields of pure, fully glycosylated and enzymatically active protease.
Abstract
When cytotoxic T lymphocytes (CTL) or natural killer (NK) cells recognize tumor cells or cells infected with intracellular pathogens, they release their cytotoxic granule content to eliminate the target cells and the intracellular pathogen. Death of the host cells and intracellular pathogens is triggered by the granule serine proteases, granzymes (Gzms), delivered into the host cell cytosol by the pore forming protein perforin (PFN) and into bacterial pathogens by the prokaryotic membrane disrupting protein granulysin (GNLY). To investigate the molecular mechanisms of target cell death mediated by the Gzms in experimental in-vitro settings, protein expression and purification systems that produce high amounts of active enzymes are necessary. Mammalian secreted protein expression systems imply the potential to produce correctly folded, fully functional protein that bears posttranslational modification, such as glycosylation. Therefore, we used a cost-efficient calcium precipitation method for transient transfection of HEK293T cells with human Gzms cloned into the expression plasmid pHLsec. Gzm purification from the culture supernatant was achieved by immobilized nickel affinity chromatography using the C-terminal polyhistidine tag provided by the vector. The insertion of an enterokinase site at the N-terminus of the protein allowed the generation of active protease that was finally purified by cation exchange chromatography. The system was tested by producing high levels of cytotoxic human Gzm A, B and M and should be capable to produce virtually every enzyme in the human body in high yields.
Introduction
وGzms أسرة مكونة من البروتياز سيرين مثلي غاية موضعية في الجسيمات الحالة المتخصصة CTL وخلايا NK 1. تحتوي على حبيبات السامة للخلايا من هذه الخلايا القاتلة أيضا البروتينات تعطيل غشاء PFN وGNLY التي تم إصدارها في وقت واحد مع Gzms على الاعتراف الخلية المستهدفة الموجهة للقضاء 2،3. هناك خمسة Gzms في البشر (GzmA، B، H، K و M)، و 10 Gzms في الفئران (GzmA - G، K، M و N). GzmA وGzmB هي الأكثر وفرة، ودرس على نطاق واسع في البشر والفئران 1. ومع ذلك، فقد بدأت دراسات أكثر حداثة للتحقيق في مسارات الخلايا من الموت، فضلا عن الآثار البيولوجية إضافية بوساطة من قبل الطرف الآخر، ما يسمى Gzms اليتيم في الصحة والمرض (4).
وظيفة الأكثر شهرة من بين Gzms، ولا سيما من GzmA وGzmB، هو تحريض موت الخلايا المبرمج في خلايا الثدييات عندما سلمت إلى الخلايا المستهدفة من قبل PFN 5،6. لكنأظهر المزيد من الدراسات الحديثة أيضا آثار خارج الخلية من Gzms مع تأثير عميق على تنظيم جهاز المناعة والالتهابات، بصرف النظر عن تسليم عصاري خلوي من قبل PFN 7،8. كما تم توسيع نطاق من الخلايا التي يتم قتل بكفاءة بعد دخول عصاري خلوي من Gzms مؤخرا من خلايا الثدييات للبكتيريا 9،10 وحتى بعض الطفيليات 11. هذه الاكتشافات الحديثة فتحت حقل جديد كليا للباحثين Gzm. ولذلك، فإن لذلك، عالية الغلة نظام التعبير الثدييات فعالة من حيث التكلفة يخفف إلى حد كبير من الطريق لتلك الدراسات المستقبلية.
تم تخصيبه الإنسان، والماوس والفئران مواليد Gzms بنجاح من جزء الحبيبية من CTL والخلايا القاتلة الطبيعية خطوط 12-14. ومع ذلك، في أيدينا العائد من هذه التقنيات تنقية هو في حدود الثقافة أقل من 0.1 ملغم / لتر الخلية (المراقبة غير منشورة و 12). وعلاوة على ذلك، فإن القرار الكروماتوغرافي من Gzm واحد دون التلوث آلات موسيقية أخرىص Gzms و / أو البروتينات التي هي أيضا موجودة في حبيبات يتحدى (بيانات غير منشورة و12،14). أنتجت Gzms المؤتلف في البكتيريا 15، 16 الخميرة، وخلايا الحشرات 17 وحتى في خلايا الثدييات مثل HEK 293 18،19. فقط الأنظمة التعبير الثدييات تحمل القدرة على إنتاج الإنزيمات المؤتلف مع التعديلات posttranslational متطابقة إلى البروتين السامة للخلايا الأم. قد تورطت التعديلات Posttranslational مع امتصاص محددة من قبل الإلتقام وتوطين الخلايا من البروتيني داخل الخلايا المستهدفة 20-22. ولذلك، باستخدام pHLsec 23 (هدية كريمة من رادو Aricescu وايفون جونز، جامعة أوكسفورد، المملكة المتحدة) باعتبارها العمود الفقري البلازميد لGzm التعبير، أنشأنا نظام بسيط زمني وفعالة من حيث التكلفة لإنتاج بروتين عالية الغلة في خلايا HEK293T. pHLsec يجمع بين محسن CMV مع الدجاج Β أكتين المروج. معا، وهذه العناصر demonstraتيد أقوى نشاط المروج في مختلف خطوط الخلايا 24. بالإضافة إلى ذلك، البلازميد يحتوي على أرنب Β-غلوبين إنترون، إلى أقصى حد كوزاك وإفراز الإشارات، واليس-6xHis العلامة وبولي-A إشارة. إدراج يمكن استنساخ مريح بين إشارة إفراز واليس-6xHis العلامة (الشكل 1) ضمان التعبير الأمثل وكفاءة إفراز البروتينات التي تفتقر إلى المجالات N-المحطة المناسبة. للتعبير عن Gzms، استبدلنا الذاتية تسلسل إشارة إفراز مع إشارة إفراز المقدمة من ناقلات يعقبه إنتيروكيناز (EK) الموقع (DDDDK) بحيث العلاج EK تنشيط Gzms يفرز (Gzms نشاطا تبدأ مع N-محطة تسلسل الأحماض الأمينية IIGG 25). بالإضافة إلى ذلك لصالح لهذا الأسلوب، وخلايا HEK293T تنمو بسرعة في البلدان المنخفضة المتوسطة الثمن، مثل Dulbecco لتعديل متوسطة النسر (DMEM)، وهي مناسبة تماما للفعالة من حيث التكلفة الكالسيوم فوسفات طريقة ترنسفكأيشن.
Protocol
1. إنتاج البلازميد التعبير pHLsec-Gzm
- تحضير الحمض النووي الريبي مجموع من خلايا NK الإنسان (الخلايا الأولية التي أعدت كما في 26 أو خط الخلايا القاتلة الطبيعية NK-92 معربا عن Gzms الإنسان خمسة) باستخدام طريقة مناسبة عزل الحمض النووي الريبي وتدوين عكس باستخدام طقم كدنا] توليف الأولى المنطلق، بعد manufacturer` الصورة التوصيات. تضخيم Gzm كدنا] باستخدام PCR واستنساخ إلى pHLsec كما هو موضح في 23 (هدية كريمة من رادو Aricescu وايفون جونز، جامعة أوكسفورد، المملكة المتحدة) باستخدام مواقع AgeI وKpnI (الشكل 1).
ملاحظة: استخدام البادئات التالية مبين في الجدول 1. - تأكيد إدراج الصحيحة بواسطة التسلسل. توسيع البلازميدات التعبير في الخلايا DH5α وتنقية باستخدام البلازميد العزلة عدة خالية من الذيفان الداخلي واتباع تعليمات الشركة الصانعة.
- Resuspend والبلازميدات النقاء في خالية من الذيفان الداخلي، الماء المعقم بتركيز 2 ملغ / مل وتخزينها في -20 ° C أونتيل الاستخدام.
2. التعبير عن Gzms في الخلايا HEK293T
- إعداد الكواشف
- إعداد معيار مستنبت. لDulbecco لتعديل النسر المتوسطة (DMEM) التي تحتوي على ارتفاع نسبة الجلوكوز (25 ملم)، GlutaMax (4 ملم)، البيروفات الصوديوم (1 ملم) تضيف 10٪ من معيار مصل العجل الجنين (FCS)، البنسلين (100 وحدة / مل)، الستربتومايسين ( 100 ميكروغرام / مل).
- إعداد ترنسفكأيشن المتوسطة. إلى مستنبت دون البنسلين، الستربتومايسين إضافة 25 ميكروغرام / مل الكلوروكين (إضافة الطازج في اليوم ترنسفكأيشن من 1،000x الأسهم في برنامج تلفزيوني، وتخزينها في -20 ° C).
- إعداد المصل خالية مستنبت: لمصل خالية المتوسطة للHEK293 الخلايا تضيف الجلوتامين (4 ملم)، البنسلين (100 وحدة / مل)، الستربتومايسين (100 ميكروغرام / مل)، و2.5mg / L الأمفوتريسين B.
- إعداد الحلول هو موضح في الجدول (2) وفلتر مع 0.45 ميكرون التصفية قبل الاستخدام:
- توسيع الخلايا HEK293T
- زراعة خلايا HEK293T في 20 مل عبادةلدى عودتهم المتوسطة باستخدام 150 × 25 ملم أطباق زراعة الأنسجة.
- تقسيم الخلايا في 80٪ confluency (تقسيم نسبة 1: 4، وعادة كل يوم 3 الثالثة). خلايا إرفاق فضفاضة، فإنها يمكن أن تكون منفصلة ميكانيكيا دون trypsinization من قبل pipetting بصرامة صعودا وهبوطا.
- خلايا لوحة ليلة قبل ترنسفكأيشن لإعطاء 60-70٪ confluency في يوم من ترنسفكأيشن (كثافة البذر ~ 2 × 10 5 خلية / مل). A حجم إعداد المعتاد يتكون من 20-25 أطباق الثقافة.
- ترنسفكأيشن الكالسيوم الفوسفات
- 1 ساعة قبل ترنسفكأيشن، وتغيير ثقافة المتوسط القياسي إلى 20 مل ترنسفكأيشن المتوسطة. قرب نهاية هذه الخطوة حضانة 1 ساعة، مزيج 400 ميكروغرام من DNA البلازميد مع 10.95 مل ده 2 0 و 1.55 مل من 2M CaCl 2 في 50 مل أنابيب (1 أنبوب / 5 أطباق).
- 1-2 دقيقة قبل ترنسفكأيشن، إضافة 12.5 مل 2X HBS إلى 12.5 مل من محلول الحمض النووي الكالسيوم، مزيج من قبل انعكاس للأنابيب واحتضان لمدة 30 ثانية في RT.
- إضافة عشرخليط ه أعدت في 2.3.2 مباشرة إلى الخلايا (5 مل لكل طبق)، وانخفاض الحكيم في المتوسط. يرش بالتساوي على المنطقة بأكملها، وتحول المتوسطة إلى اللون البرتقالي قليلا.
- احتضان الأطباق ثقافة 7-11 ساعة في حاضنة زراعة الأنسجة (37 ° C، 5٪ CO 2 في الهواء مرطب). بعد الحضانة، وراسب غرامة مرئيا. إزالة المتوسطة ترنسفكأيشن، شطف بعناية مع برنامج تلفزيوني قبل تحسنت وإضافة 20 مل مستنبت المصل خالية أعدت في 2.1.3. احتضان لمدة 72 ساعة في حاضنة زراعة الأنسجة.
- تحليل ترنسفكأيشن والتعبير الكفاءة عن طريق تشغيل العينة (~ 20 ميكرولتر) من طاف الخلية على SDS-PAGE وتلطيخ مع Coomassie بريليانت الأزرق لتصور الفرقة granzyme.
- تنقية Gzms من ثقافة طاف بواسطة النيكل IMAC
- بعد الحضانة، صب supernatants ثقافة الخلية إلى 250 مل أنابيب واضحة عن طريق الطرد المركزي. تنفيذ تدور الأول (400 x ج، 10 دقيقة، 4 درجاتC) من شأنها أن مسح المتوسطة من خلايا منفصلة. نقل طاف في طازجة 250 مل أنابيب وتدور في 4000 x ج، 30 دقيقة على 4 درجات مئوية لإزالة أي حطام الخلايا المتبقية.
- إضافة 5 مل من 5 M كلوريد الصوديوم، 6.25 مل من 2 M تريس قاعدة (درجة الحموضة 8) و 1 مل من 0،25 M NISO 4 في 250 مل من طاف تطهيرها. تصفية طاف باستخدام وحدة تصفية فراغ 500 مل (0.45 ملم).
- تتوازن عمود النيكل IMAC مع صاحب ملزم عازلة A (10 مجلدات العمود، CV) باستخدام نظام FPLC مناسبة.
- تطبيق طاف مسح إلى العمود معايرتها بمعدل تدفق 0.5 مل / دقيقة عند 4 درجات مئوية.
- بعد تطبيق طاف، ويغسل العمود مع صاحب ملزم مخزن مؤقت حتى يتم التوصل إلى امتصاص الأشعة فوق البنفسجية الأساس (عادة 10 CV).
- أزل Gzms مع خطي 20 مل التدرج (0-250 ملم إميدازول) بمعدل تدفق 0.5 مل / دقيقة في حين جمع 2 مل-الكسور. تحليل الكسور شطف بواسطة SDS-PAGE وCoomassie تلطيخ.
- إنتيروكيناز (EK)العلاج والنهائي تنظيف كتبها الموجبة تبادل اللوني
- تجمع Gzm تحتوي على كسور في أنبوب dialyzing مع ≤10 MWCO. تخزين عينة صغيرة في -20 ° C عن السيطرة قبل EK.
- إضافة EK عند 0.02 وحدة / 50 مل من طاف الأولي مباشرة إلى جزء المجمعة في الأنبوب غسيل الكلى وdialyze O / N (لا يقل عن 16 ساعة) في RT في EK-عازلة (4 L، تغيير عازلة مرة واحدة).
- في اليوم التالي، وتحليل EK تعامل Gzms بالمقارنة مع ما قبل EK سيطرة SDS-PAGE وCoomassie تلطيخ.
- عندما تجهيز N-محطة كاملة، تغيير غسيل الكلى عازلة لS العازلة A (4 L) وdialyze للساعة 4 أخرى في RT. مرشح ديالة (0.45 ميكرون).
- تتوازن لS-عمود مع S عازلة A. تحميل العينة على العمود مع بمعدل تدفق 0.5 مل / دقيقة عند 4 درجات مئوية.
- بعد تحميل عينة، وغسل العمود مع S عازلة A حتى يتم التوصل إلى الأشعة فوق البنفسجية الأساس الامتصاصية (حوالي 10 CV). أزل Gzms مع 30 مل الانحدار الخطي (150 إلى 1000 ملي كلوريد الصوديوم). GzmA هالعود في ~ 650 ملي كلوريد الصوديوم، GzmB في ~ 700 ملي كلوريد الصوديوم وGZMM في ~ 750 ملي كلوريد الصوديوم.
- تحليل الكسور شطف بواسطة SDS-PAGE والمقايسات اللونية (انظر أدناه). كسور بركة تحتوي على Gzms والتركيز (حوالي 30 أضعاف، إلى تركيز من حوالي 100 ميكرومتر) في المرشحات تدور (15 مل، 10 MWCO). قسامة الاستعدادات Gzm يتركز وتخزينها في -80 ° C.
النشاط 3. اختبار Gzm
- إعداد الكواشف
- إعداد اللونية العازلة مقايسة: 50 ملي تريس، قاعدة، ودرجة الحموضة 7.
- لقياس GzmA، إضافة نا CBZ-L-ليسين thiobenzyl استر (S-BZL) (BLT) إلى المخزن المؤقت مقايسة إلى التركيز النهائي من 0.2 ملم و5،5'-ثنائي ثيو؛ ديثيو مكرر (حمض 2-nitrobenzoic) (DTNB) إلى تركيز 0.22 ملم. لGzmB، وتشمل 0.2 ملي بوك علاء علاء-ASP-S-BZL (AAD) و 0.22 ملي DTNB. لGZMM، وتشمل 0.2 ملي يمث علاء علاء-PRO-لوي-P-nitroanilide (السلطة الوطنية الفلسطينية) (AAPL). وأضاف الببتيدات الاصطناعية من الحلول الأسهم المناسبة (في DMSO، ستورإد في -20 ° C) إلى المخزن المؤقت الطازج قبل الفحص.
- يعد انشقاق فحص العازلة: 100 ملي كلوريد الصوديوم، و 50 ملي تريس، قاعدة، ودرجة الحموضة 7.5
- إعداد اللونية العازلة مقايسة: 50 ملي تريس، قاعدة، ودرجة الحموضة 7.
- المقايسات اللونية
- توزيع عينات Gzm الصغيرة (<5 ميكرولتر) من الكسور شطف أو الأسهم تتركز في ال 96 جيدا مسطحة القاع لوحات. تشمل مراقبة إيجابية (مستحضرات Gzm اختبار أو الخام لست] خلية NK) والسيطرة السلبية (العازلة فقط).
- إضافة 100 ميكرولتر من العازلة الفحص إلى كل بئر (باستخدام ماصة متعدد القنوات). احتضان لمدة 10 دقيقة عند 37 ° C. قياس OD في 405 نانومتر في قارئ صفيحة ميكروسكوبية.
- انشقاق فحص
- لفحوصات انشقاق باستخدام ركائز النقاء، وشارك في احتضان ركيزة البروتين (اللغة الأم أو المؤتلف، 100-400 نانومتر؛ يتم عرض بعض الأمثلة من ركائز Gzm كفاءة في القسم نتيجة والملاحظة في نهاية هذا القسم) مع التخفيفات المسلسل من Gzm (ابتداء من 400 نانومتر) في المخزن فحص لأوقات مختلفة.تحليل بواسطة SDS-PAGE وCoomassie أو الفضة تلطيخ. أو عن طريق ويسترن النشاف باستخدام أجسام مضادة محددة.
- لفحوصات انشقاق باستخدام الخلية لست]، تعليق 10 6 خلايا هيلا (أو أي خط الخلايا السرطانية متوفرة) في 1 مل من العازلة الفحص وليز من خلال تجميد في الإيثانول / الجاف حمام الجليد وذوبان الجليد عند 37 درجة مئوية ثلاث مرات. إزالة الحطام الخلية بواسطة الطرد المركزي (15000 x ج لمدة 10 دقيقة في 4 درجة مئوية).
- شارك في احتضان المحللة تطهيرها مع Gzms في تركيزات مختلفة ومرات على النحو الوارد أعلاه. تم الكشف عن انشقاق من قبل immunoblotting باستخدام الأجسام المضادة المناسبة.
ملاحظة: وهناك أمثلة قليلة من ركائز الحسنة النية التي هي الأجسام المضادة التجارية المتاحة: المزايدة (BH3-التفاعل ناهض الموت المجال) وكاسباس 3 المشقوق من قبل GzmB 27،28. متعددة ribonucleoproteins النووية غير متجانسة (hnRNPA1، A2 وU) المشقوق من قبل GzmA 29؛ الفيروس المضخم للخلايا بروتين فسفوري؛ فسوبروتين 71 بواسطة GZMM 30.
النتائج
في القسم التالي سنعرض وثائق كاملة لإعداد GzmA لإلقاء الضوء على الأسلوب. نحن أيضا تنقية بنجاح GzmB وGZMM، وتنتج نتائج مماثلة فيما يتعلق كفاءة تنقية والنشاط. ومع ذلك، من تلك التحضيرات في وقت لاحق سوف نظهر فقط بضع قطع مختارة من البيانات. استخدمت الاستعدادات GzmB من خلايا 293T بعد بروتوكول الحالي في العديد من الدراسات المنشورة، تسليط الضوء على نشاطها في مختلف النظم فحص البيولوجية 9،29،31-34.
ويرد تنقية GzmA نموذجية في الشكل 2A. ترنسفكأيشن كفاءة والتعبير بعد أن أشار 72 ساعة من قبل عصابة Gzm للكشف على Coomassie الملون جل SDS-PAGE دون مزيد من تركيز طاف الثقافة (~ 37 كيلو دالتون لGzmB وGZMM في ظل ظروف الحد؛ ~ 60/34 كيلو دالتون لGzmA تحت غير الحد / الحد من الشروط). بعد تنقية IMAC يعاملون العينات مع دخولokinase (EK). وهناك تحول واضح من EK تعامل عينة لوحظ (EK آخر) مقارنة بالمجموعة الضابطة قبل EK. أسفرت تنقية النهائية على S-عمود في الأعمال التحضيرية Gzm نقية للغاية (GzmA في الشكل 2A، GzmB وGZMM في الشكل 2B) مع ظهور فرقة واحدة على المواد الهلامية البروتين Coomassie الملطخة. وتركزت الكسور المجمعة لتركيز النهائي من ~ 100 ميكرومتر. عادة، حصلنا على غلة حوالي 0،5-1 Gzms مجم لكل 100 ملليتر ثقافة طاف. لإثبات بالغليكوزيل كفاءة، وعولج عدد قليل من التحضيرات الأولية مع Endoglycosidase (إندو) H، الذي يزيل يغوساكاريدس المانوز عالية من بروتينات سكرية N-المرتبط. مواطن GzmA لها موقع بالغليكوزيل N-ترتبط في الأسباراجين-142، والتي وقليل السكاريد المانوز عالية لا بد 35. يسببها العلاج EndoH تحولا واضحا التنقل في Gzm A، وكذلك GzmB، والأعمال التحضيرية من الخلايا HEK293T ولكن ليس في ولدت البكتريا GzmA حسب تحليل SDS-PAGE وCoomassieتلطيخ (الشكل 2C).
بشكل روتيني، وقد تم اختبار كل دفعة Gzm عن النشاط الأنزيمي في المقايسات اللونية. يوضح هذا الاختبار السريع وموثوق بها النشاط بروتين من Gzms من قبل انشقاق من الببتيدات الاصطناعية الصغيرة التي يشار طيفيا عن تغيير لون المنطقة العازلة الفحص. بسبب تفضيلات مختلفة فيما يتعلق بقايا الأحماض الأمينية (موقف P1) وبعد ذلك يشق هذه البروتياز، واختيار من الببتيد معين يختلف بين Gzms. GzmA ديه نشاط مثل التربسين، الشق بعد مخلفات الأساسية أرجينين (الارجنتين، R) ويسين (ليز، K). يشق GzmB تفضيلي بعد بقايا حمض الأسبارتيك (آسيا والمحيط الهادئ، D)، ويشق GZMM بعد يسين (لوي، L) والميثيونين (الأرصاد الجوية، M) 1. لدينا خيار تفضيلي الببتيد هو BLT -S-BZL لقياس النشاط GzmA، AAD -S-BZL لGzmB وAAPL -pNA لGZMM.
الفرق كبير بين thiobركائز enzylester (AAD والتأجير ونقل الملكية)، والركيزة ف nitroanilide (AAPL) هي الكيمياء محددة، في هذا Gzm يتوسط الانقسام من thiobenzylester ركائز النشرات البنزيل، مركب، والتي يطلق سوى رد فعل مولد اللون في رد فعل المتلقين لها مع DTNB حامل اللون. لذلك، في مخازن رد فعل thiobenzylester ركائز DTNB أن تكون موجودة، في حين أن الإفراج Gzm بوساطة من ف nitroanilide كافية للكشف اللونية. طريقة مفصل لفحوصات اللونية نشرت مؤخرا (36). ويبين الشكل 3A وBLT تمثيلا وAAPL النشاط استريز في الكسور شطف من S-عمود من إعداد GzmA وGZMM، على التوالي. واستخدمت مقايسة اللونية أيضا للمقارنة بين النشاط المؤتلف إلى الاستعدادات GzmB الأم. كما هو مبين في الشكل 3B، المشقوق المؤتلف 293T GzmB الركيزة اللونية بكفاءة مماثلة مقارنة GzmB مواليد تنقيته من سل NK البشريخط لتر، كما هو موضح في الآونة الأخيرة 12.
لاختبار أكثر تحديدا النشاط Gzm، يشار إلى Gzm المقايسات انشقاق باستخدام ركائز بروتين يعرف. لا يمكن أن يؤديها هذه المقايسات الانقسام مع تنقية البروتين المؤتلف أو الأصلي (إن وجد)، ولست] خلية أو أكثر الفسيولوجية مع خلايا سليمة. إذا كان الركيزة البروتين هو متاح، النشاط بروتين يمكن تحليلها في تجارب بسيطة المشارك الحضانة مع الاستعدادات Gzm لأن هذا يتجلى مع GzmA بكتيريا المعروفة وGzmB ركائز nuoCD وnuoF 9، وكذلك مع الرواية البشرية GZMM الميتوكوندريا الركيزة NDUFAF3 (الشكل 4A).
وتمثل الخلية لست] مصدر واضح آخر من ركائز Gzm متعددة. تتوفر على العديد من ركائز الأجسام المضادة التجارية. وهناك طريقة سريعة وبسيطة لتوليد لست] الخلية من خلال تطبيق عدة دورات تجميد / الذوبان كما هو موضح سابقا 33. استخدام المنظفات طق لا ينصح لأنها يمكن أن تتداخل مع النشاط Gzm. في الشكل 4B، GzmA بوساطة الانقسام من hnRNPA1 في المحللة الخلية هيلا يتجلى في طخة مناعية باستخدام الأجسام المضادة لمكافحة hnRNPA1، فضلا عن الأجسام المضادة لمكافحة Β الأكتين كما تحكم التحميل.
لفحوصات الانقسام (أو فحوصات السمية الخلوية) في خلايا سليمة، وتوافر جزيء تسليم إضافي ضروري (PFN أو ستربتوليزين O، سلوفاكيا، لخلايا الثدييات؛ GNLY أو الببتيدات المضادة للميكروبات أخرى لخلايا بدائية النواة). المقايسات الانقسام في خلايا سليمة هي الأكثر تحديا كما تركيز الجزيئات تسليم أمر بالغ الأهمية ويحتاج ضبط واسعة النطاق. إدخال هذه البروتوكولات المعقدة للفحوصات موت الخلايا المبرمج هو أبعد من نطاق هذه الورقة. هنا، يمكننا أن نشير فقط إلى المجموعة الكبيرة من المؤلفات، كأمثلة 12،13.

<قوي> الجدول 1: Gzm الاستنساخ التمهيدي متواليات.
يشار إلى تسلسل التمهيدي التي استخدمت لاستنساخ GzmA، GzmB وGZMM. وقد صممت الاشعال إلى الأمام لإدخال موقع EK قبل N-محطة من البروتيني النشط (انظر الشكل 1)

الجدول 2: حلول المالية والواق التراكيب.
وأشار وصفات من الحلول الأسهم الأكثر أهمية ومخازن.
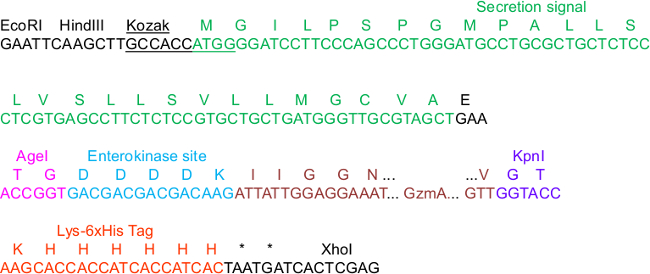
الشكل 1. pHLsec تسلسل ضروري لتعبيد الاستنساخ.
في التسلسل، بعض العناصر في ناقلات هيسلط الضوء التي تعتبر مهمة للاستنساخ، إفراز، IMAC تنقية وتفعيل البروتياز: الإجماع كوزاك وإشارة إفراز متواليات، وتقييد مواقع AgeI وKpnI، فضلا عن Lys_6xHis العلامة C-المحطة. نحن يتمثل GzmA كما إدراج هذا هو N-عضال تنصهر إلى إنتيروكيناز (EK) الموقع. لخريطة كاملة للناقلات العمود الفقري كاملا، فإننا نشير إلى المعلومات التكميلية في 23.

الرقم 2. التعبير، تنقية وتفعيل بالكامل الغليكوزيلاتي Gzms الإنسان من كلوة 293 T الخلايا.
A) يدل على سلسلة من Coomassie الملطخة، غير خفض المواد الهلامية SDS-PAGE مما يدل على عملية الإنتاج GzmA كلها من إفراز في طاف لأول تنقية النيكل IMAC والعلاج EK والاتحاد الدولي للسباحة ل تلميع عن طريق تبادل الأيونات الموجبة اللوني. تم تشغيل طاف الثقافة على SDS-PAGE تحت الحد (أحمر) و (غير الحمراء) شروط عدم الحد. GzmA هو homodimer (ssGzmA) التي استقرت السندات ثاني كبريتيد. وhomodimer GzmA (~ 60 كيلو دالتون) يعمل على مقربة من تلويث BSA (~ 66 كيلو دالتون). تحت الحد ظروف مونومر GzmA (shGzmA) يظهر ك ~ 34 كيلو دالتون الفرقة. يتم عرض المواد الهلامية للتدليل على نقاء GzmB النهائية والاستعدادات GZMM، ممثل Coomassie الملون في ظل ظروف غير الحد في B. البكتريا (إي كولاي) التي تم إنشاؤها GzmA وكذلك تنتج GzmA وGzmB في الخلايا HEK293T عولجوا EndoH وتحليلها بواسطة غير الحد SDS-PAGE وCoomassie تلطيخ. ويتجلى بالغليكوزيل من Gzms التي تنتج في الخلايا HEK293T من خلال تحول الحراك بعد العلاج EndoH بالمقارنة مع GzmA غير الغليكوزيلاتي المنتجة في البكتيريا (C).
ig3.jpg "/>
الرقم 3. المؤتلف Gzms يتحلل الببتيدات الاصطناعية.
A)، تم اختبار عينات صغيرة من الكسور شطف من العمود S النهائي لGzmA وGZMM النشاط في المقايسات اللونية باستخدام BLT وAAPL، على التوالي، بمثابة ركائز. وتشير الرسوم البيانية الببتيد الانقسام الذي أشار كزيادة OD في 405 نانومتر. الكسور ذروة النشاط المترابطة مع ذروة البروتين في شطف كما هو مبين في امتصاص الأشعة فوق البنفسجية وتحليل SDS-PAGE (الشكل 2A و B). B)، 293T المؤتلف وGzmB مواليد (أعد كما هو موضح 12) بتركيزات المشار حضنت في وجود الركيزة AAD مولد اللون. وأشير النشاط GzmB بمثابة تغيير OD في 405 نانومتر. ويظهر الرسم البياني يعني ± SEM لدينا الاستعدادات Gzm الأخيرة التي تم اختبارها في يثلث.
52911 / 52911fig4.jpg "/>
الرقم 4. المؤتلف Gzms كليف ركائز البروتين.
A) المؤتلف-GST الموسومة، البكتيرية في الجهاز التنفسي سلسلة البروتينات nuoCD وnuoF، فضلا عن الثدييات التنفسي سلسلة البروتين NDUFAF3، تم علاج مع التركيز المشار إليه من Gzms أشار لمدة 15 دقيقة عند 37 ° C. استخدمت 1 ميكروغرام من تنقية البروتينات في 20 ميكرولتر ردود الفعل. تم تحليل الانقسام التي كتبها SDS-PAGE وCoomassie تلطيخ. B) وحضنت المحللة الخلية هيلا (في تركيز البروتين من ~ 1 ملغ / مل) مع تركيزات المشار إليها من GzmA المؤتلف لمدة 30 دقيقة وتحليلها بواسطة immunoblotting استخدام الألغام المضادة hnRNPA1 والأجسام المضادة Β-أكتين.
Discussion
الدور الكلاسيكي، ودرس على نطاق واسع من GzmA وGzmB هو استحثاث موت الخلايا المبرمج في خلايا الثدييات بعد الولادة عصاري خلوي من خلال البروتين تشكيل المسام PFN 1. مؤخرا، تم توسيع نطاق السامة للخلايا من Gzms كبير من خلايا الثدييات للبكتيريا 9،10، فضلا عن بعض الطفيليات 11. وعلاوة على ذلك، وغير التقليدية، وظائف خارج الخلية من GzmA وGzmB فضلا عن الأهمية البيولوجية من مختلف Gzms اليتيم لا تزال غامضة. ولذلك، فإن التعبير وتنقية النظام الزمني وفعالة من حيث التكلفة القوي للGzms، على النحو المنصوص عليه هذا البروتوكول، ستكون عونا كبيرا لهذه الدراسات في المستقبل.
ويستند على قوة هذه الطريقة بشكل خاص على ناقلات التعبير، pHLsec 23، التي يتم استخدامها في هذا النظام. هذا البلازميد لديها عدد نسخة عالية في E. القولونية، مما يتيح إنتاج DNA كفاءة. توفر لها عناصر محسن / المروج لل أقوى النشاط في مختلف خطوط الخلايا 24. أنه يحتوي على إنترون داخل وحدة النسخ. تم العثور على إنترونات لتعزيز التعبير الجيني في خلايا الثدييات تصل إلى 100 أضعاف 37. بالإضافة إلى ذلك، يوفر البلازميد إجماع كوزاك وإشارة إفراز الأمثل، واليس-6xHis العلامة و-A بولي إشارة (الشكل 1). إدراج يمكن استنساخ باستخدام مواقع AgeI وKpnI بين إشارة إفراز والعلامة ليز-6xHis. وذلك باستخدام AgeI وXhoI تجنب العلامة polyHis. لGzms، كان من الضروري إدراج موقع إنتيروكيناز في N-محطة من البروتياز تمكين تفعيل البروتياز بعد التعبير وتنقية IMAC. للتعبير عن الإنزيمات الأخرى وهذا قد لا يكون ضروريا. تم اختبار التعبير البلازميد بنجاح لبنيات متعددة من مختلف الأطوال والدول بالغليكوزيل، وعدد السندات ثاني كبريتيد، فضلا عن البروتينات التي تحتوي على مجالات متعددة مع طيات مختلفة 23.
الصورة = "jove_content"> خلايا HEK293T تنمو بسرعة في انخفاض متوسط التكلفة وهي جدا مناسبة تماما لترنسفكأيشن الكالسيوم الفوسفات فعالة من حيث التكلفة. لهذا البروتوكول، ونحن ننصح بعدم الإفراط مرور الخلايا HEK293T. يجب أن تكون على استعداد الأسهم المجمدة من الخلايا المنخفض مرور. توسيع الاقلاع الخلايا عادة أخذت حوالي 8-9 أيام (3 انشقاقات) للحصول على المبلغ المطلوب من الخلايا. كانت كثافة الخلية في يوم من ترنسفكأيشن (60-70٪ confluency) حاسمة لترنسفكأيشن كفاءة وبالتالي التعبير. أيضا، وتجنب المضادات الحيوية لكنه اضاف الكلوروكين (الذي يمنع تدهور الليزوزومية DNA) إلى وسيلة تعزز إلى حد كبير كفاءة 38. وجدنا أن كفاءة ترنسفكأيشن كانت تعتمد خطيا من المبلغ DNA تشبع فقط في حوالي 80 ميكروغرام لصحن 15 سم (المراقبة غير منشورة). ولذلك، فإننا نوصي باستخدام ما يصل إلى 80 μ ز البلازميد الحمض النووي / طبق في هذا البروتوكول لتحقيق الكفاءة القصوى. هذا وسوف تصل إلى حوالي 2 ملغ من الحمض النووي في إعداد (correspondinز إلى 2 الأعمدة MaxiPrep). وقد رصدت الكفاءة ترنسفكأيشن أكثر سهولة عن طريق تشغيل عينة من طاف الثقافة (حوالي 20 μ ل) على SDS-PAGE بعد فترة الحضانة 72 ساعة. وينبغي أن تكون فرقة البروتين من البروتياز يفرز مرئية بواسطة Coomassie تلطيخ. إذا كانت الفرقة Gzm ضعيفة ولم الخلايا لا تنفصل وظهرت قابلة للحياة، وحضنت الثقافات لمدة 24 ساعة أخرى قبل تنقية IMAC.
كانت الخطوة الأكثر أهمية للأخرى إنتيروكيناز (EK) العلاج الذي ينشط الانزيم. النشاط EK هو الكالسيوم تعتمد ومستعمل من تركيزات عالية من كلوريد الصوديوم 39 أو إميدازول (المراقبة غير منشورة). وبالتالي، فإنه من المهم للغاية dialyze شطافة من IMAC ضد حجم كاف (20 مل شطافة في 2 L العازلة غسيل الكلى) من EK العازلة التي تحتوي على ما يكفي من الكالسيوم وليس أكثر من 50 ملم من كلوريد الصوديوم في الرقم الهيدروجيني محايدة. يوصى بالعلاج EK لمدة 16 ساعة على RT ويجب أن تتم مراقبتها من قبل SDS-PAGE التي كشفت عن وجود حراك التحول سو البروتيني المعالجة إذا كان الانقسام الكامل. وأضاف EK الطازجة واستمر حضانة في EK جديدة لغسيل الكلى عازلة إذا كان التحول غير مكتمل. إلا إذا كان الانقسام كاملة، وقد بدأ غسيل الكلى ضد العازلة S A واستمر تنقية. سلسلة ضوء الحفاز EK لها قيمة متزمت 5.2، مما يتيح الفصل التام من EK من Gzms في النهائي اللوني تبادل الأيونات الموجبة.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by grants from the Novartis Foundation for Medical-Biological Research and from the Research Pool of the University of Fribourg (to MW). We thank Li Zhao, Zhan Xu, and Solange Kharoubi Hess for technical support, as well as Radu Aricescu and Yvonne Jones (Oxford University, UK) for providing the pHLsec plasmid, and Thomas Schürpf (Harvard Medical School) for helpful discussions.
Materials
| Name | Company | Catalog Number | Comments |
| TRIzol Reagent | Invitrogen | 15596-026 | Total RNA isolation kit |
| SuperScript II Reverse Transcriptase | Invitrogen | 18064-014 | |
| Phusion High-Fidelity DNA Polymerase | NEB | M0530L | |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| EX-CELL 293 Serum-Free Medium for HEK 293 Cells | Sigma | 14571C | |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 31966-021 | |
| SnakeSkin Dialysis Tubing, 10K MWCO | Thermo Scientific | 68100 | |
| Enterokinase from bovine intestine | Sigma | E4906 | recombinant, ≥20 units/mg protein |
| HisTrap Excel 5 ml column | GE Healthcare | 17-3712-06 | Nickel IMAC |
| HiTrap SP HP 5 ml column | GE Healthcare | 17-1152-01 | S column |
| N-α-Cbz-L-lysine thiobenzylester (BLT) | Sigma | C3647 | GzmA substrate |
| Boc-Ala-Ala-Asp-S-Bzl (AAD) | MP Biomedicals | 2193608 _10mg | GzmB substrate |
| Suc-Ala-Ala-Pro-Leu-p-nitroanilide (AAPL) | Bachem | GzmM substrate | |
| 5,5′-dithio-bis(2-nitrobenzoic acid) (DTNB) | Sigma | D8130 | Ellman`s reagent |
References
- Chowdhury, D., Lieberman, J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol. 26, 389-420 (2008).
- Thiery, J., Lieberman, J. Perforin: a key pore-forming protein for immune control of viruses and cancer. Subcell Biochem. 80, 197-220 (2014).
- Krensky, A. M., Clayberger, C. Biology and clinical relevance of granulysin. Tissue Antigens. 73, 193-198 (2009).
- Bovenschen, N., Kummer, J. A. Orphan granzymes find a home. Immunol Rev. 235, 117-127 (2010).
- Lieberman, J. Granzyme A activates another way to die. Immunol Rev. 235, 93-104 (2010).
- Ewen, C. L., Kane, K. P., Bleackley, R. C. A quarter century of granzymes. Cell death and differentiation. 19, 28-35 (2012).
- Hiebert, P. R., Granville, D. J. Granzyme B in injury, inflammation, and repair. Trends Mol Med. 18, 732-741 (2012).
- Afonina, I. S., Cullen, S. P., Martin, S. J. Cytotoxic and non-cytotoxic roles of the CTL/NK protease granzyme. B. Immunol Rev. 235, 105-116 (2010).
- Walch, M., et al. Cytotoxic cells kill intracellular bacteria through granulysin-mediated delivery of granzymes. Cell. 157, 1309-1323 (2014).
- Lee, W. Y., et al. Invariant natural killer T cells act as an extravascular cytotoxic barrier for joint-invading Lyme Borrelia. Proc Natl Acad Sci U S A. , (2014).
- Kapelski, S., de Almeida, M., Fischer, R., Barth, S., Fendel, R. Antimalarial activity of granzyme B and its targeted delivery by a granzyme B-scFv fusion protein. Antimicrob Agents Chemother. , (2014).
- Thiery, J., Walch, M., Jensen, D. K., Martinvalet, D., Lieberman, J. Isolation of cytotoxic T cell and NK granules and purification of their effector proteins. Curr Protoc Cell Biol. Chapter 3 (Unit3 37), (2010).
- Shi, L., Yang, X., Froelich, C. J., Greenberg, A. H. Purification and use of granzyme B. Methods Enzymol. 322, 125-143 (2000).
- Masson, D., Tschopp, J. A family of serine esterases in lytic granules of cytolytic T lymphocytes. Cell. 49, 679-685 (1987).
- Lorentsen, R. H., Fynbo, C. H., Thogersen, H. C., Etzerodt, M., Holtet, T. L. Expression, refolding, and purification of recombinant human granzyme B. Protein Expr Purif. 39, 18-26 (2005).
- Sun, J., et al. Expression and purification of recombinant human granzyme B from Pichia pastoris. Biochem Biophys Res Commun. 261, 251-255 (1999).
- Xia, Z., et al. Expression and purification of enzymatically active recombinant granzyme B in a baculovirus system. Biochem Biophys Res Commun. 243, 384-389 (1998).
- Stahnke, B., et al. Granzyme B-H22(scFv), a human immunotoxin targeting CD64 in acute myeloid leukemia of monocytic subtypes. Mol Cancer Ther. 7, 2924-2932 (2008).
- Gehrmann, M., et al. A novel expression and purification system for the production of enzymatic and biologically active human granzyme. B. J Immunol Methods. 371, 8-17 (2011).
- Metkar, S. S., et al. Cytotoxic cell granule-mediated apoptosis: perforin delivers granzyme B-serglycin complexes into target cells without plasma membrane pore formation. Immunity. 16, 417-428 (2002).
- Motyka, B., et al. Mannose 6-phosphate/insulin-like growth factor II receptor is a death receptor for granzyme B during cytotoxic T cell-induced apoptosis. Cell. 103, 491-500 (2000).
- Pinkoski, M. J., et al. Entry and trafficking of granzyme B in target cells during granzyme B-perforin-mediated apoptosis. Blood. 92, 1044-1054 (1998).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr D Biol Crystallogr. 62, 1243-1250 (2006).
- Fukuchi, K., et al. Activity assays of nine heterogeneous promoters in neural and other cultured cells. In Vitro Cell Dev Biol Anim. 30 A, 300-305 (1994).
- Tran, T. V., Ellis, K. A., Kam, C. M., Hudig, D., Powers, J. C. Dipeptidyl peptidase I: importance of progranzyme activation sequences, other dipeptide sequences, and the N-terminal amino group of synthetic substrates for enzyme activity. Arch Biochem Biophys. 403, 160-170 (2002).
- Somanchi, S. S., Senyukov, V. V., Denman, C. J., Lee, D. A. Expansion, purification, and functional assessment of human peripheral blood NK cells. Journal of visualized experiments : JoVE. , (2011).
- Barry, M., et al. Granzyme B short-circuits the need for caspase 8 activity during granule-mediated cytotoxic T-lymphocyte killing by directly cleaving Bid. Mol Cell Biol. 20, 3781-3794 (2000).
- Darmon, A. J., Nicholson, D. W., Bleackley, R. C. Activation of the apoptotic protease CPP32 by cytotoxic T-cell-derived granzyme B. Nature. 377, 446-448 (1995).
- Rajani, D. K., Walch, M., Martinvalet, D., Thomas, M. P., Lieberman, J. Alterations in RNA processing during immune-mediated programmed cell death. Proc Natl Acad Sci U S A. 109, 8688-8693 (2012).
- Domselaar, R., et al. Noncytotoxic inhibition of cytomegalovirus replication through NK cell protease granzyme M-mediated cleavage of viral phosphoprotein 71. J Immunol. 185, 7605-7613 (2010).
- Thiery, J., et al. Perforin activates clathrin- and dynamin-dependent endocytosis, which is required for plasma membrane repair and delivery of granzyme B for granzyme-mediated apoptosis. Blood. 115, 1582-1593 (2010).
- Thiery, J., et al. Perforin pores in the endosomal membrane trigger the release of endocytosed granzyme B into the cytosol of target cells. Nat Immunol. 12, 770-777 (2011).
- Thomas, M. P., et al. Leukocyte protease binding to nucleic acids promotes nuclear localization and cleavage of nucleic acid binding proteins. J Immunol. 192, 5390-5397 (2014).
- Jacquemin, G., et al. Granzyme B-induced mitochondrial ROS are required for apoptosis. Cell death and differentiation. , (2014).
- Kummer, J. A., Kamp, A. M., Citarella, F., Horrevoets, A. J., Hack, C. E. Expression of human recombinant granzyme A zymogen and its activation by the cysteine proteinase cathepsin C. The Journal of biological chemistry. 271, 9281-9286 (1996).
- Hagn, M., Sutton, V. R., Trapani, J. A. A colorimetric assay that specifically measures Granzyme B proteolytic activity: hydrolysis of Boc-Ala-Ala-Asp-S-Bzl. Journal of visualized experiments : JoVE. , e52419(2014).
- Huang, M. T., Gorman, C. M. Intervening sequences increase efficiency of RNA 3' processing and accumulation of cytoplasmic RNA. Nucleic Acids Res. 18, 937-947 (1990).
- Luthman, H., Magnusson, G. High efficiency polyoma DNA transfection of chloroquine treated cells. Nucleic Acids Res. 11, 1295-1308 (1983).
- Magee, A. I., Grant, D. A., Hermon-Taylor, J., Offord, R. E. Specific one-stage method for assay of enterokinase activity by release of radiolabelled activation peptides from alpha-N-[3H]acetyl-trypsinogen and the effect of calcium ions on the enzyme activity. Biochem J. 197, 239-244 (1981).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved