Method Article
Un alto rendimiento y sistema de expresión de costo-eficiente de granzimas humanos en células de mamífero
En este artículo
Resumen
We describe here a cost-efficient granzyme expression system using HEK293T cells that produces high yields of pure, fully glycosylated and enzymatically active protease.
Resumen
When cytotoxic T lymphocytes (CTL) or natural killer (NK) cells recognize tumor cells or cells infected with intracellular pathogens, they release their cytotoxic granule content to eliminate the target cells and the intracellular pathogen. Death of the host cells and intracellular pathogens is triggered by the granule serine proteases, granzymes (Gzms), delivered into the host cell cytosol by the pore forming protein perforin (PFN) and into bacterial pathogens by the prokaryotic membrane disrupting protein granulysin (GNLY). To investigate the molecular mechanisms of target cell death mediated by the Gzms in experimental in-vitro settings, protein expression and purification systems that produce high amounts of active enzymes are necessary. Mammalian secreted protein expression systems imply the potential to produce correctly folded, fully functional protein that bears posttranslational modification, such as glycosylation. Therefore, we used a cost-efficient calcium precipitation method for transient transfection of HEK293T cells with human Gzms cloned into the expression plasmid pHLsec. Gzm purification from the culture supernatant was achieved by immobilized nickel affinity chromatography using the C-terminal polyhistidine tag provided by the vector. The insertion of an enterokinase site at the N-terminus of the protein allowed the generation of active protease that was finally purified by cation exchange chromatography. The system was tested by producing high levels of cytotoxic human Gzm A, B and M and should be capable to produce virtually every enzyme in the human body in high yields.
Introducción
Los Gzms son una familia de serina proteasas altamente homólogas localizadas en los lisosomas especializados de CTL y células NK 1. Los gránulos citotóxicos de estas células asesinas también contienen las proteínas de la membrana de alteración PFN y GNLY que se liberan simultáneamente con los Gzms en el reconocimiento de una célula diana destinada para la eliminación de 2,3. Hay cinco Gzms en humanos (GzmA, B, H, K y M), y 10 Gzms en ratones (GzmA - G, K, M y N). GzmA y GzmB son los más abundantes y ampliamente estudiado en seres humanos y ratones 1. Sin embargo, estudios más recientes han comenzado a investigar las vías de muerte celular, así como los efectos biológicos adicionales mediadas por los otros llamados Gzms, huérfanos en la salud y la enfermedad 4.
La función mejor conocida de las Gzms, en particular de GzmA y GzmB, es la inducción de la muerte celular programada en células de mamíferos cuando se entrega en las células diana por PFN 5,6. Sin embargo, Estudios más recientes también demostraron efectos extracelulares de los Gzms con profundo impacto en la regulación inmune y la inflamación, independientemente de la entrega citosólica por PFN 7,8. El espectro de las células que mueren de manera eficiente después de la entrada citosólica de las Gzms también fue recientemente se amplió a partir de células de mamíferos a las bacterias 9,10 e incluso ciertos parásitos 11. Estos recientes descubrimientos abrieron un campo completamente nuevo para los investigadores GZM. Por lo tanto, un sistema de expresión de mamíferos de alto rendimiento rentable aliviará significativamente el camino para los estudios futuros.
Humanos, de ratón y de rata Gzms nativos se han purificado con éxito de la fracción de gránulos de CTL y NK células líneas 12-14. Sin embargo, en nuestras manos el rendimiento de tales técnicas de purificación está en el intervalo de menos de 0,1 mg / L de cultivo celular (observación no publicada y 12). Además, la resolución cromatográfica de un solo Gzm sin contaminación por other Gzms y / o proteínas que también están presentes en los gránulos es un reto (datos no publicados y 12,14). Gzms recombinantes se producen en bacterias, levaduras 15 16, células de insecto y en 17 incluso en las células de mamífero tales como HEK 293 18,19. Sólo los sistemas de expresión de mamífero tienen el potencial de producir enzimas recombinantes con modificaciones postraduccionales idéntica a la proteína citotóxica nativo. Modificaciones postraduccionales han sido implicados con la captación específica por endocitosis y la localización intracelular de la proteasa dentro de las células diana 20-22. Por lo tanto, mediante el uso de pHLsec 23 (una especie de regalo de Radu Aricescu e Yvonne Jones, de la Universidad de Oxford, Reino Unido) como la columna vertebral plásmido para la expresión Gzm, establecimos un sistema simple, tiempo y costo eficiente para la producción de proteínas de alto rendimiento en células HEK293T. pHLsec combina un promotor de CMV con un promotor-Β-actina de pollo; En conjunto, estos elementos demostrated el más fuerte promotor de la actividad en diversas líneas celulares 24. Además, el plásmido contiene un intrón de conejo Β-globina, señales de secreción y Kozak optimizada, una Lys-6xHis-tag y un poli-A de la señal. Los insertos se pueden clonar convenientemente entre la señal de secreción y la 6xHis-Lys-tag (Figura 1) asegurar la expresión óptima y eficacia de secreción para proteínas que carecen de dominios N-terminales apropiados. Para la expresión de los Gzms, que sustituye la secuencia señal de secreción endógena con la señal de secreción proporcionada por el vector seguido por una enteroquinasa (EK) sitio (DDDDK), de modo que el tratamiento EK activado el Gzms secretadas (Gzms activos comenzar con el N-terminal secuencia de aminoácidos IIGG 25). Adicionalmente a favor de este método, las células HEK293T crecen rápidamente en un medio de bajo precio, como medio de Eagle modificado por Dulbecco (DMEM), y son muy adecuadas para el método de transfección de fosfato de calcio rentable.
Protocolo
1. Producción del plásmido de expresión pHLsec-Gzm
- Preparar el ARN total de las células NK humanas (células primarias preparadas como en el 26 o la línea de células NK NK-92 que expresa los cinco Gzms humanos) utilizando un método de aislamiento de ARN adecuado y transcribir inversa utilizando un kit de primera cadena sintetizar ADNc, siguiendo el manufacturer` recomendaciones s. Amplificar ADNc Gzm usando PCR y el clon en pHLsec como se describe en 23 (especie de regalo de Radu Aricescu e Yvonne Jones, de la Universidad de Oxford, Reino Unido), utilizando los sitios AgeI y KpnI (Figura 1).
NOTA: Utilice los siguientes cebadores indicados en la Tabla 1. - Confirmar inserciones correctas por secuenciación. Expandir los plásmidos de expresión en células DH5a y purificar utilizando un kit de aislamiento de plásmido libre de endotoxinas y siga las instrucciones del fabricante.
- Resuspender los plásmidos purificados en libre de endotoxina, agua estéril a una concentración de 2 mg / ml y se almacena a -20 ° C until uso.
2. Expresión de Gzms en células HEK293T
- Preparación de los reactivos
- Preparar medio de cultivo estándar. Para Medio Eagle Modificado de Dulbecco (DMEM) que contenía alta glucosa (25 mM), glutamax (4 mM), piruvato de sodio (1 mM) añadir 10% de suero estándar de ternera fetal (FCS), penicilina (100 unidades / ml), estreptomicina ( 100 g / ml).
- Preparar medio de transfección. Para medio de cultivo sin penicilina-estreptomicina añadir 25 g / ml de cloroquina (añadir recién en el día de la transfección de las existencias 1,000x en PBS, almacenado a -20 ° C).
- Preparar medio de cultivo libre de suero: Para medio libre de suero para células HEK293 añadir glutamina (4 mM), penicilina (100 unidades / ml), estreptomicina (100 g / ml), y 2,5 mg / L anfotericina B.
- Preparar las soluciones descritas en la Tabla 2 y el filtro con un filtro de 0,45 micras antes de su uso:
- Ampliando las células HEK293T
- Crecer células HEK293T en 20 ml de cultomedio ure utilizando 150 x 25 mm placas de cultivo de tejidos.
- Dividir celdas a 80% de confluencia (split-relación de 1: 4, por lo general cada día 3º). Las células se adhieren libremente, que pueden separarse mecánicamente sin tripsinización por rigurosamente pipeteando arriba y abajo.
- Células de la placa la noche antes de la transfección para dar 60-70% de confluencia en el día de la transfección (densidad de siembra ~ 2 x 10 5 células / ml). Un tamaño habitual preparación consiste en 20 a 25 placas de cultivo.
- Transfección de fosfato de calcio
- 1 hr antes de la transfección, cambiar el medio de cultivo estándar a 20 ml de medio de transfección. Cerca del final de esta etapa de incubación 1 h, la mezcla 400 g de ADN plásmido con 10,95 ml ddH 2 0 y 1,55 ml de 2M CaCl 2 en tubos de 50 ml (1 tubo / 5 platos).
- 1 a 2 min antes de la transfección, añadir 12,5 ml de 2x HBS a 12,5 ml de la solución de ADN-calcio, mezclar por inversión de los tubos y se incuba durante 30 segundos a RT.
- Añadir ªmezcla e prepara en 2.3.2 directamente a las células (5 ml por placa), gota a gota en el medio. Espolvorear uniformemente sobre toda el área, convirtiendo el medio a un color ligeramente anaranjado.
- Incubar las placas de cultivo de 7 a 11 horas en una incubadora de cultivo de tejidos (37 ° C, 5% de CO2 en aire humidificado). Después de la incubación, un precipitado fino es visible. Retire el medio de transfección, enjuagar cuidadosamente con PBS precalentado y añadir 20 ml de medio de cultivo libre de suero preparado en 2.1.3. Incubar durante 72 horas en una incubadora de cultivo de tejidos.
- Analizar la eficacia de transfección y expresión mediante la ejecución de una muestra (~ 20 l) del sobrenadante celular en SDS-PAGE y tinción con azul brillante de Coomassie para visualizar una banda de granzima.
- Purificación de Gzms del sobrenadante del cultivo por Nickel-IMAC
- Después de la incubación, decantar los sobrenadantes de cultivo de células en tubos de 250 ml y clara por centrifugación. Llevar a cabo una primera vuelta (400 xg, 10 min, 4 °C) que despejará el medio de células separadas. Transferir el sobrenadante en fresco 250 ml tubos y centrifugado a 4000 xg, 30 min a 4 ° C para eliminar cualquier residuo de células restante.
- Añadir 5 ml de NaCl 5 M, 6,25 ml de 2 M Tris-Base (pH 8) y 1 ml de 0,25 M NiSO4 por 250 ml de sobrenadante clarificado. Filtrar el sobrenadante usando una unidad de filtro de vacío 500 ml (0,45 mm).
- Equilibrar una columna de níquel-IMAC con Su-tampón de unión A (10 volúmenes de columna, CV) utilizando un sistema de FPLC adecuado.
- Aplicar el sobrenadante aclarado a la columna equilibrada a un caudal de 0,5 ml / min a 4 ° C.
- Después se aplicó el sobrenadante, lavar la columna con Su-tampón de unión hasta la línea base de absorbancia UV se alcanza (por lo general 10 CV).
- Eluir Gzms con un 20 ml-gradiente lineal (0 a 250 mM imidazol) a una velocidad de flujo de 0,5 ml / min mientras que la recogida de 2 ml fracciones. Analizar las fracciones de elución por SDS-PAGE y tinción de Coomassie.
- Enteroquinasa (EK)el tratamiento y la limpieza final por cromatografía de intercambio catiónico
- Piscina Gzm contiene fracciones en un tubo de diálisis con ≤10 MWCO. Guarde una pequeña muestra a -20 ° C como control pre-EK.
- Añadir EK en 0,02 unidades / 50 ml de sobrenadante inicial directamente a la fracción reunida en el tubo de diálisis y diálisis O / N (al menos 16 horas) a temperatura ambiente en EK-buffer (4 L, el cambio búfer una vez).
- El día siguiente, analizar EK tratada Gzms en comparación con el control pre-EK por SDS-PAGE y tinción de Coomassie.
- Cuando el procesamiento N-terminal es completa, cambiar tampón de diálisis a S tampón A (4 L) y se dializa durante otras 4 horas a RT. Dializado filtro (0,45 m).
- Equilibrar un S-columna con tampón S A. Cargar la muestra en la columna con un caudal de 0,5 ml / min a 4 ° C.
- Después de cargar la muestra, lavar la columna con tampón A hasta S UV absorbancia se alcanza la línea de base (sobre 10 CV). Eluir los Gzms con un gradiente lineal de 30 ml (150 a 1000 mM de NaCl). GzmA correolaúdes en ~ 650 mM NaCl, GzmB en ~ 700 mM NaCl y GzmM en ~ 750 mM NaCl.
- Analizar las fracciones de elución por SDS-PAGE y ensayos colorimétricos (véase más adelante). Fracciones que contienen Gzms piscina y concentrado (aproximadamente 30 veces, a una concentración de aproximadamente 100 mM) en filtros de giro (15 ml, 10 MWCO). Alícuota los preparativos GZM concentrados y almacenar a -80 ° C.
Actividad 3. Prueba Gzm
- Preparación de los reactivos
- Preparar tampón de ensayo colorimétrico: 50 mM Tris-Base, pH 7.
- Para la medición de GzmA, añadir Na-CBZ-L-lisina tiobencilo éster (S-Bzl) (BLT) para el tampón de ensayo a una concentración final de 0,2 mM y 5,5'-ditio-bis (ácido 2-nitrobenzoico) (DTNB) a una concentración de 0,22 mM. Para GzmB, incluir 0,2 mM Boc-Ala-Ala-Asp-S-Bzl mM DTNB (AAD) y 0.22. Para GzmM, incluir 0,2 mM Suc-Ala-Ala-Pro-Leu-p-nitroanilida (pNA) (AAPL). Los péptidos sintéticos se añaden de soluciones de reserva adecuadas (en DMSO, stored a -20 ° C) a la memoria intermedia recién antes del ensayo.
- Preparar tampón de ensayo de escisión: NaCl 100 mM, 50 mM Tris-Base, pH 7,5
- Preparar tampón de ensayo colorimétrico: 50 mM Tris-Base, pH 7.
- Ensayos colorimétricos
- Distribuir muestras pequeñas gzm (<5 l) de fracciones de elución o poblaciones concentradas en las placas de 96 pocillos de fondo plano. Incluya un control positivo (preparaciones GZM probados o crudo lisados de células NK) y un control negativo (tampón solamente).
- Añadir 100 l de tampón de ensayo a cada pocillo (usando una pipeta multicanal). Incubar durante 10 minutos a 37 ° C. Medir la DO a 405 nm en un lector de microplacas.
- Ensayo de escisión
- Para los ensayos de escisión utilizando sustratos purificados, co-incubar un sustrato de proteína (nativo o recombinante, 100-400 nM; algunos ejemplos de sustratos gzm eficientes se presentan en la sección de resultados y en la nota al final de esta sección) con diluciones en serie de un Gzm (a partir de 400 nM) en tampón de ensayo durante diversos tiempos.Analizar mediante SDS-PAGE y tinción con plata o Coomassie; o mediante transferencia Western usando anticuerpos específicos.
- Para los ensayos de escisión utilizando lisados de células, suspender 10 6 células HeLa (o cualquier línea de células tumorales disponible) en 1 ml de tampón de ensayo y se lisan por congelación en un / baño de hielo seco de etanol y descongelación a 37 ° C tres veces. Eliminar los restos celulares por centrifugación (15.000 xg durante 10 min a 4 ° C).
- Co-incubar el lisado aclarado con Gzms en diferentes concentraciones y tiempos que el anterior. La escisión se detecta por inmunotransferencia utilizando anticuerpos apropiados.
NOTA: Algunos ejemplos de sustratos de buena fe para que los anticuerpos comerciales están disponibles: Oferta (BH3-interacción agonista muerte de dominio) y la caspasa 3 escindida por GzmB 27,28; múltiples ribonucleoproteínas nucleares heterogéneas (hnRNPA1, A2 y U) escindidas por GzmA 29; citomegalovirus fosfoproteína 71 por GzmM 30.
Resultados
En la siguiente sección vamos a presentar una documentación completa de un preparado GzmA para iluminar el método. También nos purificamos éxito GzmB y GzmM, produciendo resultados similares en cuanto a la eficiencia y la actividad de la purificación. Sin embargo, a partir de las preparaciones posteriores sólo mostraremos algunas piezas seleccionadas de datos. Preparaciones GzmB a partir de células 293T siguiendo el protocolo actual se utilizaron en varios estudios publicados, destacando su actividad en diversos sistemas de ensayo biológico 9,29,31-34.
Una purificación típica GzmA se muestra en la Figura 2A. Transfección y expresión eficiente después de 72 hr fue indicada por una banda Gzm detectable en un gel de SDS-PAGE teñido con Coomassie sin más la concentración del sobrenadante del cultivo (~ 37 kDa para GzmB y GzmM en condiciones reductoras; ~ 60/34 kDa para GzmA bajo no reductor / condiciones reductoras). Después de la purificación IMAC las muestras se trataron con enterokinase (EK). Un cambio visible de la muestra tratada con EK (post-EK) en comparación con el control pre-EK se observó. La purificación final sobre S-columna resultó en preparaciones GZM de alta pureza (GzmA en la figura 2A; GzmB y GzmM en la figura 2B) con una sola aparición banda en geles de proteínas teñidas con Coomassie. Las fracciones reunidas se concentraron hasta una concentración final de 100 ~ mM. Típicamente, se obtuvieron rendimientos de aproximadamente 0,5 a 1 mg Gzms por 100 ml de sobrenadante de cultivo. Para demostrar la glicosilación eficaz, unos preparativos iniciales fueron tratados con endoglicosidasa (Endo) H, que elimina los oligosacáridos de alta manosa de glicoproteínas N-ligados. Nativo GzmA tiene un sitio de glicosilación ligada a N en Asn-142, a la que un oligosacárido de alta manosa está enlazado 35. EndoH tratamiento indujo un cambio obvio movilidad en el Gzm A, así como GzmB, las preparaciones de células HEK293T pero no en bacterias generada GzmA como se analizó mediante SDS-PAGE y Coomassietinción (Figura 2C).
Rutinariamente, cada lote Gzm fue probado para la actividad enzimática en ensayos colorimétricos. Esta prueba rápida y fiable pone de manifiesto la actividad proteolítica de las Gzms por la escisión de péptidos sintéticos pequeños que se indica espectrofotométricamente por un cambio de color del tampón de ensayo. Debido a las diferentes preferencias relativas a los residuos de aminoácidos (posición P1) después de lo cual estas proteasas escinden, la elección de un péptido específico varía entre los Gzms. GzmA tiene actividad similar a la tripsina, después de la escisión de los residuos básicos arginina (Arg, R) y lisina (Lys, K). Escinde GzmB preferentemente después de residuos de ácido aspártico (Asp, D), y se unirá GzmM después de leucina (Leu, L) y la metionina (Met, M) 1. Nuestra elección péptido preferencial BLT -S-Bzl para medir la actividad GzmA, AAD -S-Bzl para GzmB y AAPL -PNA para GzmM.
La principal diferencia entre la thiobsustratos enzylester (AAD y BLT) y el sustrato p-nitroanilida (AAPL) es la química específica, en que Gzm media la escisión de sustratos thiobenzylester libera bencil-mercaptano, que sólo desencadena una reacción cromogénica en su reacción aguas abajo con el DTNB cromóforo. Por lo tanto, en los tampones de reacción de thiobenzylester sustratos DTNB tiene que estar presente, mientras que la liberación mediada por Gzm de p-nitroanilida es suficiente para la detección colorimétrica. El método detallado de los ensayos colorimétricos fue publicado recientemente 36. Figura 3A muestra el BLT representante y la actividad esterasa AAPL en las fracciones de elución de S-columna de una preparación GzmA y la GzmM, respectivamente. Ensayo colorimétrico también se utilizó para comparar la actividad de recombinante para preparaciones GzmB nativas. Como se muestra en la Figura 3B, recombinante 293T GzmB escinde el sustrato cromogénico con eficiencia similar en comparación con GzmB nativa purificada a partir de un cel NK humanal línea, como se describió recientemente 12.
Para probar más específicamente la actividad Gzm, división ensayos GZM utilizando sustratos proteicos conocidos se indican. Estos ensayos de escisión se pueden realizar con proteína recombinante o nativa purificada (si está disponible), con lisados celulares o más fisiológica con células intactas. Si un sustrato de proteína está disponible, la actividad proteolítica puede ser analizada en experimentos de co-incubación simples con las preparaciones gzm como esto se demuestra con el GzmA bacteriana conocida y GzmB sustratos nuoCD y NuoF 9, así como con la novela NDUFAF3 sustrato GzmM mitocondrial humano (Figura 4A).
Los lisados celulares representan otra fuente obvia de múltiples sustratos GZM. Anticuerpos comerciales están disponibles contra muchos de los sustratos. Un método rápido y simple para generar lisados de células es mediante la aplicación de múltiples ciclos de congelación / descongelación como se ha demostrado previamente 33. El uso de detergentes is no se recomienda ya que puede interferir con la actividad Gzm. En la Figura 4B, GzmA mediada por la escisión de hnRNPA1 en un lisado de células HeLa se demuestra en una inmunotransferencia usando un anticuerpo anti-hnRNPA1, así como un anticuerpo anti-Β-actina como control de carga.
Para los ensayos de escisión (o ensayos de citotoxicidad) en las células intactas, es necesario la disponibilidad de una molécula de entrega adicional (PFN o estreptolisina O, SLO, para células de mamífero; GNLY u otros péptidos antimicrobianos para células procariotas). Ensayos de escisión en células intactas son más desafiante como la concentración de las moléculas de entrega es crítica y necesita extensa ajuste fino. La introducción de estos complejos protocolos de ensayos de apoptosis está más allá del alcance de este documento. Aquí, sólo podemos hacer referencia a la gran cantidad de literatura, como ejemplos 12,13.

Tabla 1: GZM Clonación Primer secuencias.
El primer secuencias que se utilizaron para clonar GzmA, GzmB y GzmM se indican. Adelante primers fueron diseñados para introducir un sitio EK antes de que el N-terminal de la proteasa activa (véase la Figura 1)

Tabla 2: Soluciones de archivo e Buffer composiciones.
Las recetas de las soluciones y tampones de valores más importantes se indican.
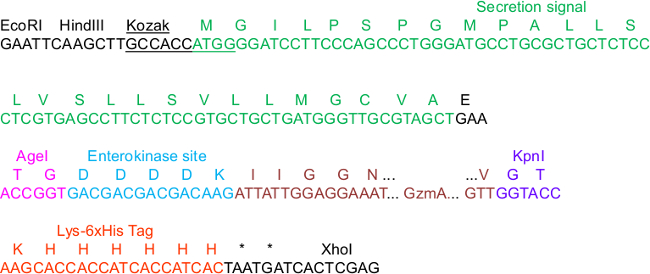
Figura 1. Secuencia pHLsec crítica para Clonación Construir.
En la secuencia, un par de elementos en el vector sonpuesto de manifiesto que son importantes para la clonación, la secreción, la purificación IMAC y la activación de las proteasas: Las secuencias de Kozak de consenso y de señal de secreción, los sitios de restricción AgeI y KpnI, así como el C-terminal etiqueta Lys_6xHis. Nos ejemplificado GzmA como el inserto que es N-terminalmente fusionada a un sitio (EK) enteroquinasa. Para el mapa completo del esqueleto del vector completo, nos referimos a la información suplementaria de 23.

Figura 2. Expresión, Purificación y activación de glicosiladas Totalmente Gzms Humanos de HEK 293 células T.
A) muestra una serie de teñido con Coomassie, no reductor geles de SDS-PAGE que demuestran todo el proceso de producción GzmA de su secreción en el sobrenadante a primera purificación de níquel-IMAC, el tratamiento EK y fina l pulido mediante cromatografía de intercambio catiónico. El sobrenadante del cultivo se llevó a cabo en SDS-PAGE en condiciones reductoras no reductoras (no-rojo) (rojo) y. GzmA es un homodímero (ssGzmA) que se estabiliza por un enlace disulfuro. El homodímero GzmA (~ 60 kDa) se ejecuta cerca de contaminar BSA (~ 66 kDa). Bajo condiciones de reducción del monómero GzmA (shGzmA) aparece como una banda de ~ 34 kDa. Geles Para demostrar la pureza de la GzmB final y preparaciones GzmM, teñidos con Coomassie representante en condiciones no reductoras se muestran en B. en bacterias (E. coli) generado GzmA así como GzmA y GzmB producen en células HEK293T fueron tratados con EndoH y analizado por no reductor SDS-PAGE y tinción de Coomassie. La glicosilación de los Gzms producidas en células HEK293T se demuestra por un cambio de movilidad después del tratamiento en comparación con EndoH GzmA no glicosilada producida en bacterias (C).
ig3.jpg "/>
Figura 3. Recombinante Gzms hidrolizar péptidos sintéticos.
A), pequeñas muestras de las fracciones de elución de la columna final S se ensayaron para la actividad GzmA y GzmM en ensayos cromogénicos utilizando BLT y AAPL, respectivamente, como sustratos. Los gráficos muestran la escisión del péptido que se indicó como un aumento de la DO a 405 nm. Las fracciones pico de actividad se correlacionó con el pico de proteína en la elución como se indica en la absorbancia UV y el análisis SDS-PAGE (Figura 2A y B). B), 293T recombinante y GzmB nativo (preparado como se describe 12) a las concentraciones indicadas se incubaron en presencia del sustrato cromogénico AAD. Actividad GzmB se indicó como un cambio de DO a 405 nm. El gráfico muestra la media ± SEM de nuestros más recientes preparados GZM que fueron probados por triplicado.
52911 / 52911fig4.jpg "/>
Figura 4. recombinante Gzms Cleave proteínas sustratos.
A), proteínas recombinantes GST-etiquetados bacterianas cadena respiratoria nuoCD y NuoF, así como la proteína de cadena respiratoria de mamíferos NDUFAF3, fueron tratadas con la concentración indicada de Gzms indicados durante 15 min a 37 ° C. 1 g de proteínas purificadas en 20 reacciones mu l se utilizaron. La escisión se analizó mediante SDS-PAGE y tinción de Coomassie. B) lisado de células HeLa (a una concentración de proteína de ~ 1 mg / ml) se incubó con concentraciones indicadas de GzmA recombinante para 30 min y se analizó mediante inmunotransferencia utilizando anticuerpos anti Β-actina y hnRNPA1.
Discusión
El papel clásico y ampliamente estudiado de GzmA y GzmB es la inducción de apoptosis en células de mamífero después de su entrega citosólica por la proteína formadora de poros PFN 1. Recientemente, el espectro citotóxica de los Gzms se amplió de manera significativa a partir de células de mamíferos a las bacterias 9,10, así como a ciertos parásitos 11. Además, las funciones no clásicos, extracelulares de GzmA y GzmB así como la importancia biológica de los diversos Gzms huérfanos son todavía oscuros. Por lo tanto, un sistema de expresión y purificación en tiempo y costo-eficiente robusta de los Gzms, según lo dispuesto por el presente protocolo, será de gran ayuda para estos futuros estudios.
La fuerza de este método se basa particularmente en el vector de expresión, pHLsec 23, que se utiliza en este sistema. Este plásmido tiene un alto número de copias en E. coli, permitiendo así la producción de ADN eficiente. Sus elementos potenciador / promotor proporcionan lala actividad más fuerte en diversas líneas celulares 24. Contiene un intrón dentro de la unidad de transcripción. Los intrones se han encontrado para mejorar la expresión génica en células de mamífero hasta 100 veces 37. Además, el plásmido proporciona un consenso Kozak y una señal de secreción optimizado, una Lys-6xHis-tag y una señal de poli-A (Figura 1). Los insertos se pueden clonar mediante el uso de los sitios AgeI y KpnI entre la señal de secreción y la etiqueta de Lys-6xHis. Usando AgeI y XhoI evitará la etiqueta poliHis. Para los Gzms, era necesario para insertar un sitio de enteroquinasa en el N-terminal de las proteasas que permiten la activación de las proteasas después de la expresión y purificación IMAC. Para la expresión de otras enzimas que esto podría no ser necesario. El plásmido de expresión fue probado con éxito para múltiples construcciones de varias longitudes, estados de glicosilación, y el número de enlaces disulfuro, así como para las proteínas que contenían varios dominios con diferentes pliegues 23.
células HEK293T crecen rápidamente en un medio de bajo costo y son muy adecuadas para la transfección con fosfato de calcio costo eficiente. Para este protocolo, recomendamos no sobre-paso las células HEK293T. Stocks congelados de bajo pasaje células deben estar preparados. Expansión despegue las células por lo general tomó aproximadamente 8 a 9 días (3 Splits) para obtener la cantidad deseada de células. La densidad celular en el día de la transfección (60 a 70% de confluencia) era crítico para la transfección eficiente y, en consecuencia expresión. También, evitando los antibióticos pero la adición de cloroquina (que inhibe la degradación lisosomal de ADN) para el medio mejorado significativamente la eficiencia 38. Encontramos que la eficiencia de la transfección fue linealmente dependiente de la cantidad de ADN saturar solamente en alrededor de 80 g para un plato de 15-cm (observación no publicada). Por lo tanto, se recomienda el uso de hasta 80 μ g de ADN plásmido / plato en este protocolo para la eficiencia máxima. Esto ascenderá a alrededor de 2 mg de ADN por la preparación (corresponding a 2 columnas maxiprep). La eficiencia de transfección se controló más fácilmente mediante la ejecución de una muestra de sobrenadante de cultivo (aproximadamente 20 μ l) en SDS-PAGE después del período de incubación de 72 hr. Una banda de proteína de la proteasa secretada debe ser visible por tinción de Coomassie. Si la banda Gzm era débil y las células no desprenda y apareció viable, los cultivos se incubaron durante otras 24 horas antes de la purificación IMAC.
Otro paso más crítico fue el tratamiento de la enteroquinasa (EK) que activa la enzima. EK actividad es dependiente de calcio y se inhibe por altas concentraciones de NaCl 39 o imidazol (observación no publicada). Por lo tanto, era crucial para dializar el eluato de la IMAC contra un volumen suficiente (20 ml eluato por 2 L de tampón de diálisis) de tampón EK contiene suficiente calcio y no más de 50 mM de NaCl a pH neutro. Se recomienda el tratamiento EK durante 16 horas a temperatura ambiente y debe ser supervisado por SDS-PAGE que reveló una movilidad o desplazamientof la proteasa tratado si el escote era completa. Se añadió EK Fresco y la incubación en fresco EK tampón de diálisis se continuó si el cambio era incompleta. Sólo si la escisión fue completa, se inició la diálisis frente a tampón A y S purificación continuó. La cadena ligera catalítica de EK tiene un valor pI de 5,2, lo que permite la separación completa de EK de los Gzms en la cromatografía de intercambio catiónico final.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was supported by grants from the Novartis Foundation for Medical-Biological Research and from the Research Pool of the University of Fribourg (to MW). We thank Li Zhao, Zhan Xu, and Solange Kharoubi Hess for technical support, as well as Radu Aricescu and Yvonne Jones (Oxford University, UK) for providing the pHLsec plasmid, and Thomas Schürpf (Harvard Medical School) for helpful discussions.
Materiales
| Name | Company | Catalog Number | Comments |
| TRIzol Reagent | Invitrogen | 15596-026 | Total RNA isolation kit |
| SuperScript II Reverse Transcriptase | Invitrogen | 18064-014 | |
| Phusion High-Fidelity DNA Polymerase | NEB | M0530L | |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| EX-CELL 293 Serum-Free Medium for HEK 293 Cells | Sigma | 14571C | |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 31966-021 | |
| SnakeSkin Dialysis Tubing, 10K MWCO | Thermo Scientific | 68100 | |
| Enterokinase from bovine intestine | Sigma | E4906 | recombinant, ≥20 units/mg protein |
| HisTrap Excel 5 ml column | GE Healthcare | 17-3712-06 | Nickel IMAC |
| HiTrap SP HP 5 ml column | GE Healthcare | 17-1152-01 | S column |
| N-α-Cbz-L-lysine thiobenzylester (BLT) | Sigma | C3647 | GzmA substrate |
| Boc-Ala-Ala-Asp-S-Bzl (AAD) | MP Biomedicals | 2193608 _10mg | GzmB substrate |
| Suc-Ala-Ala-Pro-Leu-p-nitroanilide (AAPL) | Bachem | GzmM substrate | |
| 5,5′-dithio-bis(2-nitrobenzoic acid) (DTNB) | Sigma | D8130 | Ellman`s reagent |
Referencias
- Chowdhury, D., Lieberman, J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol. 26, 389-420 (2008).
- Thiery, J., Lieberman, J. Perforin: a key pore-forming protein for immune control of viruses and cancer. Subcell Biochem. 80, 197-220 (2014).
- Krensky, A. M., Clayberger, C. Biology and clinical relevance of granulysin. Tissue Antigens. 73, 193-198 (2009).
- Bovenschen, N., Kummer, J. A. Orphan granzymes find a home. Immunol Rev. 235, 117-127 (2010).
- Lieberman, J. Granzyme A activates another way to die. Immunol Rev. 235, 93-104 (2010).
- Ewen, C. L., Kane, K. P., Bleackley, R. C. A quarter century of granzymes. Cell death and differentiation. 19, 28-35 (2012).
- Hiebert, P. R., Granville, D. J. Granzyme B in injury, inflammation, and repair. Trends Mol Med. 18, 732-741 (2012).
- Afonina, I. S., Cullen, S. P., Martin, S. J. Cytotoxic and non-cytotoxic roles of the CTL/NK protease granzyme. B. Immunol Rev. 235, 105-116 (2010).
- Walch, M., et al. Cytotoxic cells kill intracellular bacteria through granulysin-mediated delivery of granzymes. Cell. 157, 1309-1323 (2014).
- Lee, W. Y., et al. Invariant natural killer T cells act as an extravascular cytotoxic barrier for joint-invading Lyme Borrelia. Proc Natl Acad Sci U S A. , (2014).
- Kapelski, S., de Almeida, M., Fischer, R., Barth, S., Fendel, R. Antimalarial activity of granzyme B and its targeted delivery by a granzyme B-scFv fusion protein. Antimicrob Agents Chemother. , (2014).
- Thiery, J., Walch, M., Jensen, D. K., Martinvalet, D., Lieberman, J. Isolation of cytotoxic T cell and NK granules and purification of their effector proteins. Curr Protoc Cell Biol. Chapter 3 (Unit3 37), (2010).
- Shi, L., Yang, X., Froelich, C. J., Greenberg, A. H. Purification and use of granzyme B. Methods Enzymol. 322, 125-143 (2000).
- Masson, D., Tschopp, J. A family of serine esterases in lytic granules of cytolytic T lymphocytes. Cell. 49, 679-685 (1987).
- Lorentsen, R. H., Fynbo, C. H., Thogersen, H. C., Etzerodt, M., Holtet, T. L. Expression, refolding, and purification of recombinant human granzyme B. Protein Expr Purif. 39, 18-26 (2005).
- Sun, J., et al. Expression and purification of recombinant human granzyme B from Pichia pastoris. Biochem Biophys Res Commun. 261, 251-255 (1999).
- Xia, Z., et al. Expression and purification of enzymatically active recombinant granzyme B in a baculovirus system. Biochem Biophys Res Commun. 243, 384-389 (1998).
- Stahnke, B., et al. Granzyme B-H22(scFv), a human immunotoxin targeting CD64 in acute myeloid leukemia of monocytic subtypes. Mol Cancer Ther. 7, 2924-2932 (2008).
- Gehrmann, M., et al. A novel expression and purification system for the production of enzymatic and biologically active human granzyme. B. J Immunol Methods. 371, 8-17 (2011).
- Metkar, S. S., et al. Cytotoxic cell granule-mediated apoptosis: perforin delivers granzyme B-serglycin complexes into target cells without plasma membrane pore formation. Immunity. 16, 417-428 (2002).
- Motyka, B., et al. Mannose 6-phosphate/insulin-like growth factor II receptor is a death receptor for granzyme B during cytotoxic T cell-induced apoptosis. Cell. 103, 491-500 (2000).
- Pinkoski, M. J., et al. Entry and trafficking of granzyme B in target cells during granzyme B-perforin-mediated apoptosis. Blood. 92, 1044-1054 (1998).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr D Biol Crystallogr. 62, 1243-1250 (2006).
- Fukuchi, K., et al. Activity assays of nine heterogeneous promoters in neural and other cultured cells. In Vitro Cell Dev Biol Anim. 30 A, 300-305 (1994).
- Tran, T. V., Ellis, K. A., Kam, C. M., Hudig, D., Powers, J. C. Dipeptidyl peptidase I: importance of progranzyme activation sequences, other dipeptide sequences, and the N-terminal amino group of synthetic substrates for enzyme activity. Arch Biochem Biophys. 403, 160-170 (2002).
- Somanchi, S. S., Senyukov, V. V., Denman, C. J., Lee, D. A. Expansion, purification, and functional assessment of human peripheral blood NK cells. Journal of visualized experiments : JoVE. , (2011).
- Barry, M., et al. Granzyme B short-circuits the need for caspase 8 activity during granule-mediated cytotoxic T-lymphocyte killing by directly cleaving Bid. Mol Cell Biol. 20, 3781-3794 (2000).
- Darmon, A. J., Nicholson, D. W., Bleackley, R. C. Activation of the apoptotic protease CPP32 by cytotoxic T-cell-derived granzyme B. . Nature. 377, 446-448 (1995).
- Rajani, D. K., Walch, M., Martinvalet, D., Thomas, M. P., Lieberman, J. Alterations in RNA processing during immune-mediated programmed cell death. Proc Natl Acad Sci U S A. 109, 8688-8693 (2012).
- Domselaar, R., et al. Noncytotoxic inhibition of cytomegalovirus replication through NK cell protease granzyme M-mediated cleavage of viral phosphoprotein 71. J Immunol. 185, 7605-7613 (2010).
- Thiery, J., et al. Perforin activates clathrin- and dynamin-dependent endocytosis, which is required for plasma membrane repair and delivery of granzyme B for granzyme-mediated apoptosis. Blood. 115, 1582-1593 (2010).
- Thiery, J., et al. Perforin pores in the endosomal membrane trigger the release of endocytosed granzyme B into the cytosol of target cells. Nat Immunol. 12, 770-777 (2011).
- Thomas, M. P., et al. Leukocyte protease binding to nucleic acids promotes nuclear localization and cleavage of nucleic acid binding proteins. J Immunol. 192, 5390-5397 (2014).
- Jacquemin, G., et al. Granzyme B-induced mitochondrial ROS are required for apoptosis. Cell death and differentiation. , (2014).
- Kummer, J. A., Kamp, A. M., Citarella, F., Horrevoets, A. J., Hack, C. E. Expression of human recombinant granzyme A zymogen and its activation by the cysteine proteinase cathepsin C. The Journal of biological chemistry. 271, 9281-9286 (1996).
- Hagn, M., Sutton, V. R., Trapani, J. A. A colorimetric assay that specifically measures Granzyme B proteolytic activity: hydrolysis of Boc-Ala-Ala-Asp-S-Bzl. Journal of visualized experiments : JoVE. , e52419 (2014).
- Huang, M. T., Gorman, C. M. Intervening sequences increase efficiency of RNA 3' processing and accumulation of cytoplasmic RNA. Nucleic Acids Res. 18, 937-947 (1990).
- Luthman, H., Magnusson, G. High efficiency polyoma DNA transfection of chloroquine treated cells. Nucleic Acids Res. 11, 1295-1308 (1983).
- Magee, A. I., Grant, D. A., Hermon-Taylor, J., Offord, R. E. Specific one-stage method for assay of enterokinase activity by release of radiolabelled activation peptides from alpha-N-[3H]acetyl-trypsinogen and the effect of calcium ions on the enzyme activity. Biochem J. 197, 239-244 (1981).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados