Method Article
Un rendement élevé et Expression System coût-efficace de granzymes humain dans des cellules de mammifères
Dans cet article
Résumé
We describe here a cost-efficient granzyme expression system using HEK293T cells that produces high yields of pure, fully glycosylated and enzymatically active protease.
Résumé
When cytotoxic T lymphocytes (CTL) or natural killer (NK) cells recognize tumor cells or cells infected with intracellular pathogens, they release their cytotoxic granule content to eliminate the target cells and the intracellular pathogen. Death of the host cells and intracellular pathogens is triggered by the granule serine proteases, granzymes (Gzms), delivered into the host cell cytosol by the pore forming protein perforin (PFN) and into bacterial pathogens by the prokaryotic membrane disrupting protein granulysin (GNLY). To investigate the molecular mechanisms of target cell death mediated by the Gzms in experimental in-vitro settings, protein expression and purification systems that produce high amounts of active enzymes are necessary. Mammalian secreted protein expression systems imply the potential to produce correctly folded, fully functional protein that bears posttranslational modification, such as glycosylation. Therefore, we used a cost-efficient calcium precipitation method for transient transfection of HEK293T cells with human Gzms cloned into the expression plasmid pHLsec. Gzm purification from the culture supernatant was achieved by immobilized nickel affinity chromatography using the C-terminal polyhistidine tag provided by the vector. The insertion of an enterokinase site at the N-terminus of the protein allowed the generation of active protease that was finally purified by cation exchange chromatography. The system was tested by producing high levels of cytotoxic human Gzm A, B and M and should be capable to produce virtually every enzyme in the human body in high yields.
Introduction
Les Gzms sont une famille de serine proteases homologues fortement localisées dans les lysosomes spécialisées des CTL et les cellules NK 1. Les granules cytotoxiques de ces cellules tueuses contiennent également des protéines de la membrane perturbateurs PFN et GNLY qui sont libérés simultanément avec les Gzms lors de la reconnaissance d'une cellule cible destiné à l'élimination 2,3. Il existe cinq Gzms chez l'homme (GZMA, B, H, K et M), et 10 chez des souris (Gzms GZMA - G, K, M et N). GZMA et GZMB sont les plus abondants et largement étudiés chez l'homme et la souris 1. Cependant, des études plus récentes ont commencé à enquêter sur les voies de mort cellulaire ainsi que les effets biologiques supplémentaires induits par les autres, soi-disant Gzms orphelins de la santé et de la maladie 4.
La fonction la plus connue des Gzms, en particulier de GZMA et GZMB, est l'induction de la mort cellulaire programmée dans des cellules de mammifère lorsqu'elle est remise dans les cellules cibles par PFN 5,6. Pourtant, Des études plus récentes ont également démontré des effets extracellulaires des Gzms avec un impact profond sur la réglementation et l'inflammation immunitaire, indépendamment de livraison cytosolique par PFN 7,8. Le spectre de cellules qui sont tuées efficacement cytosolique après l'entrée des Gzms a également été récemment élargie à partir de cellules de mammifères à des bactéries et même 9,10 11 certains parasites. Ces découvertes récentes ont ouvert un nouveau champ pour les chercheurs GZM. Par conséquent, un, à haut rendement système d'expression mammalien rentable solution va considérablement faciliter la voie à ces études futures.
Gzms natives humaines, de souris et de rat ont été purifiés avec succès à partir de la fraction de granulés de CTL et NK lignées cellulaires 14/12. Cependant, dans les mains, le rendement de ces techniques de purification est dans la gamme de culture inférieure à 0,1 mg / L de cellules (observation non publiée et 12). En outre, la résolution chromatographique d'un seul GZM sans contamination par other Gzms et / ou des protéines qui sont également présentes dans les granules contestent (données non publiées et 12,14). Gzms recombinants ont été produites dans des bactéries, des levures 15 16, des cellules d'insectes 17 et même dans des cellules de mammifères telles que HEK 293 18,19. Seuls les systèmes d'expression de mammifères portent le potentiel de produire des enzymes recombinantes avec des modifications post-traductionnelles identiques à la protéine native cytotoxique. Modifications post-traductionnelles ont été impliqués avec l'absorption spécifique par endocytose et la localisation intracellulaire de la protease dans les cellules cibles de 20 à 22. Par conséquent, en utilisant pHLsec 23 (un cadeau genre de Radu Aricescu et Yvonne Jones, Université d'Oxford, Royaume-Uni) comme l'épine dorsale de plasmide pour l'expression GZM, nous avons établi un système simple, rapide et économique efficace pour la production de protéines à haut rendement dans des cellules HEK293T. pHLsec combine un activateur de CMV avec un promoteur de poulet Β-actine; Ensemble, ces éléments démonstrationsted la plus forte activité de promoteur dans diverses lignées cellulaires 24. En outre, le plasmide contient un Β-globine de lapin intron, des signaux de sécrétion et de Kozak optimisée, une 6xHis-tag-Lys et un signal poly-A. Les inserts peuvent être clonées idéalement entre le signal de sécrétion et la-6xHis-tag Lys (Figure 1) assurer une expression optimale et l'efficacité de la sécrétion de protéines dépourvues appropriées domaines N-terminaux. Pour l'expression des Gzms, nous avons remplacé la séquence signal de sécrétion endogène avec le signal de sécrétion fournie par le vecteur suivie par une entérokinase (EK) place (DDDDK) afin que le traitement EK activé le Gzms sécrétées (Gzms actifs commencer par la N-terminal séquence d'acides aminés IIGG 25). De plus en faveur de cette méthode, les cellules HEK293T se développent rapidement en basse à prix moyen, comme milieu de Eagle modifié par Dulbecco (DMEM), et sont bien adaptés pour la méthode de transfection au phosphate de calcium rentable.
Protocole
1. Production du plasmide d'expression pHLsec-GZM
- Préparation de l'ARN total à partir de cellules NK humaines (cellules primaires préparées comme dans 26 ou la lignée de cellules NK NK-92 exprimant les cinq Gzms humaines) en utilisant un procédé d'isolement d'ARN appropriée et transcription inverse en utilisant un premier brin kit ADNc de synthétiser la suite de la manufacturer` s recommandations. Amplifier GZM ADNc par PCR et clone dans pHLsec comme décrit dans 23 (don genre de Radu Aricescu et Yvonne Jones, Université d'Oxford, Royaume-Uni) en utilisant les sites Agel et Kpnl (Figure 1).
REMARQUE: Utilisez les amorces suivantes indiquées dans le tableau 1. - Confirmez inserts correctes par séquençage. Développez les plasmides d'expression dans des cellules DH5a et purifier en utilisant un kit d'isolement de plasmide libre endotoxine et suivez les instructions du fabricant.
- Reprendre les plasmides purifiés dans de l'eau stérile sans endotoxine à une concentration de 2 mg / ml et conserver à -20 ° C until utilisation.
2. Expression de Gzms dans des cellules HEK293T
- Préparation des réactifs
- Préparer le milieu de culture standard. Pour milieu Eagle modifié de Dulbecco (DMEM) contenant taux élevé de glucose (25 mM), Glutamax (4 mM), du pyruvate de sodium (1 mM) ajouter 10% de sérum standard de veau foetal (FCS), la pénicilline (100 unités / ml), la streptomycine ( 100 ug / ml).
- Préparer milieu de transfection. Pour milieu de culture sans pénicilline-streptomycine ajouter 25 pg / ml chloroquine (ajouter fraîchement sur le jour de la transfection de 1,000x stocks dans PBS, stockés à -20 ° C).
- Préparer un milieu de culture exempt de sérum: A un milieu sans sérum pour cellules HEK293 ajouter de la glutamine (4 mM), de la pénicilline (100 unités / ml), streptomycine (100 ug / ml), et 2,5 mg / L de l'amphotéricine B.
- Préparer les solutions décrites dans le tableau 2 et le filtre avec un filtre de 0,45 um avant utilisation:
- Expansion des cellules HEK293T
- Cultiver les cellules HEK293T dans 20 ml culteSupport d'ure utilisant 150 x 25 mm boîtes de culture de tissu.
- Cellules Split à 80% de confluence (split-ratio de 1: 4, généralement tous les 3 ème jour). Cellules attachent vaguement, ils peuvent être détachés mécaniquement sans traitement à la trypsine par pipetage rigoureusement haut et en bas.
- cellules de la plaque avant la transfection nuit pour donner 60 à 70% de confluence au jour de la transfection (densité d'ensemencement ~ 2 x 10 5 cellules / ml). Une taille de la préparation habituelle consiste de 20 à 25 boîtes de culture.
- La transfection au phosphate de calcium
- 1 h avant la transfection, remplacer le milieu de culture standard à 20 ml de milieu de transfection. Près de la fin de cette étape d'incubation de 1 heure, mélanger 400 ug d'ADN plasmidique avec 10,95 ml ddH 2 0 et 1,55 ml de 2M CaCl2 en tubes de 50 ml (1 tube / 5 plats).
- 1 à 2 min avant la transfection, ajouter 12,5 ml 2x HBS à 12,5 ml de la solution ADN-Calcium, mélanger par inversion des tubes et incuber pendant 30 secondes à la température ambiante.
- Ajouter èmee mélange préparé en 2.3.2 directement aux cellules (5 ml par boîte), goutte à goutte dans le milieu. Saupoudrer uniformément sur toute la surface, en tournant le support à une couleur légèrement orangée.
- Incuber les boîtes de culture de 7 à 11 h dans un incubateur de culture de tissu (37 ° C, 5% de CO2 dans de l'air humidifié). Après l'incubation, une amende précipité est visible. Retirez le milieu de transfection, rincer soigneusement préchauffé PBS et ajouter 20 ml de milieu de culture sans sérum préparé à 2.1.3. Incuber pendant 72 heures dans un incubateur de culture de tissu.
- Analyser l'efficacité de transfection et l'expression par l'exécution d'un échantillon (~ 20 ul) du surnageant de cellule sur SDS-PAGE et coloration avec du bleu brillant de Coomassie pour visualiser une bande de granzyme.
- Purification de Gzms de surnageant de culture par Nickel-IMAC
- Après l'incubation, décanter le surnageant de culture de cellules dans 250 ml tubes et claire par centrifugation. Effectuer une première rotation (400 xg, 10 min, 4 °C) qui va effacer le milieu à partir des cellules individuelles. Transférer le surnageant dans fraîches 250 ml tubes et tournent à 4000 g, 30 min à 4 ° C pour éliminer les débris de cellules restant.
- Ajouter 5 ml de NaCl 5 M, 6,25 ml de 2 M de Tris-Base (pH 8) et 1 ml de 0,25 M NiSO 4 par 250 ml de surnageant clarifié. Filtrer le surnageant à l'aide d'une unité de filtration sous vide de 500 ml (0,45 mm).
- Equilibrer une colonne nickel-IMAC avec Sa liaison tampon A (10 volumes de colonne, CV) en utilisant un système FPLC approprié.
- Appliquer le surnageant clarifié à la colonne équilibrée à un débit de 0,5 ml / min à 4 ° C.
- Après le surnageant a été appliqué, colonne de lavage avec Sa liaison tampon jusqu'à ce que l'absorbance UV de référence est atteint (généralement 10 CV).
- Gzms éluées avec un gradient de 20 ml-linéaire (0 à 250 mM imidazole) à un débit de 0,5 ml / min tout en recueillant des fractions de 2 ml. Analyser les fractions d'élution par SDS-PAGE et coloration au bleu de Coomassie.
- Enterokinase (EK)le traitement et le nettoyage final par Chromatographie d'échange de cations
- Piscine GZM fractions contenant dans un tube de dialyse MWCO avec ≤10. Stocker un petit échantillon à -20 ° C que le contrôle pré-EK.
- Ajouter EK à 0,02 unité / ml de 50 surnageant initial directement à la fraction groupée dans le tube de dialyse et dialyse O / N (au moins 16 heures) à la température ambiante dans EK-tampon (4 L, le changement tampon une fois).
- Le lendemain, analyser EK Gzms traitée par rapport à la pré-EK contrôle par SDS-PAGE et coloration au bleu de Coomassie.
- Lorsque le traitement N-terminal est terminée, modifier un tampon de dialyse à tampon A S (4 L) et on dialyse pendant 4 heures à température ambiante. Filtre dialysat (0,45 um).
- Équilibrer une colonne S-S avec du tampon de l'échantillon A. charger sur la colonne avec à un débit de 0,5 ml / min à 4 ° C.
- Après chargement de l'échantillon, laver la colonne avec le tampon de S A jusqu'à ce que la ligne de base UV absorbance est atteint (environ 10 CV). Éluer les Gzms avec un gradient linéaire de 30 ml (150 à 1 000 mM de NaCl). GZMA eluths à ~ 650 mM de NaCl, GZMB à ~ 700 mM de NaCl et GzmM à ~ 750 mM de NaCl.
- Analyser élution fractions par SDS-PAGE et essais colorimétriques (voir ci-dessous). Piscine fractions contenant Gzms et concentré (environ 30 fois, à une concentration d'environ 100 pM) dans les filtres de rotation (15 ml, 10 MWCO). Aliquoter les préparatifs GZM concentrés et conserver à -80 ° C.
3. Test de l'activité GZM
- Préparation des réactifs
- Préparer le tampon de dosage colorimétrique: 50 mM de Tris-Base, pH 7.
- Pour la mesure de GZMA, ajouter Na-CBZ-L-Lysine thiobenzyle ester (S-Bzl) (BLT) pour le tampon d'essai à une concentration finale de 0,2 mM et 5,5'-dithio-bis (acide 2-nitrobenzoïque) (DTNB) à une concentration de 0,22 mM. Pour GZMB, inclure 0,2 mM Boc-Ala-Ala-Asp-S-Bzl (AAD) et 0,22 mM DTNB. Pour GzmM, y compris 0,2 mM de Suc-Ala-Ala-Pro-Leu-p-nitroanilide (pNA) (AAPL). Les peptides synthétiques sont ajoutés à partir de solutions d'achat d'actions appropriées (dans le DMSO, stored à -20 ° C) dans la mémoire tampon fraîchement avant l'essai.
- Préparer le tampon de dosage de clivage: 100 mM de NaCl, 50 mM de Tris-Base, pH 7,5
- Préparer le tampon de dosage colorimétrique: 50 mM de Tris-Base, pH 7.
- Dosages colorimétriques
- Distribuez de petits échantillons GZM (<5 pi) de fractions d'élution ou des stocks concentrés dans les plaques à 96 puits à fond plat. Inclure un contrôle positif (GZM préparations testées ou brut lysats de cellules NK) et un contrôle négatif (tampon seulement).
- Ajouter 100 ul de tampon de dosage à chaque puits (à l'aide d'une pipette multi-canaux). Incuber pendant 10 min à 37 ° C. Mesurer la DO à 405 nm dans un lecteur de microplaques.
- Dosage Décolleté
- Pour les essais de clivage à l'aide de substrats purifiés, co-incuber un substrat protéique (native ou recombinante, de 100 à 400 nM; quelques exemples de substrats de GZM efficaces sont présentés dans la section de résultat et à la note à la fin de cette section) avec des dilutions en série d'un GZM (à partir de 400 nM) dans du tampon analytique pour différents moments.Analyse par SDS-PAGE et coloration à l'argent ou au bleu de Coomassie; ou par Western blot en utilisant des anticorps spécifiques.
- Pour les essais de clivage à l'aide de lysats de cellules, de suspendre 10 6 cellules HeLa (ou toute lignée cellulaire de tumeur disponible) dans 1 ml de tampon de dosage et lyse par congélation dans un / bain de glace sèche de l'éthanol et décongélation à 37 ° C trois fois. Éliminer les débris cellulaires par centrifugation (15 000 xg pendant 10 min à 4 ° C).
- Co-incuber le lysat clarifié avec Gzms à diverses concentrations et heures ci-dessus. Le clivage est détecté par immunotransfert en utilisant des anticorps appropriés.
NOTE: Quelques exemples de substrats de bonne foi pour laquelle les anticorps commerciaux sont disponibles: Offre (BH3-interaction agoniste domaine de mort) et de la caspase 3 clivée par GZMB 27,28; plusieurs ribonucléoprotéines nucléaires hétérogènes (hnRNPA1, A2 et U) clivées par GZMA 29; cytomégalovirus phosphoprotéine 71 par GzmM 30.
Résultats
Dans la section suivante, nous allons présenter une documentation complète d'une préparation GZMA pour éclairer la méthode. Nous avons également purifié succès GZMB et GzmM, produisant des résultats similaires en ce qui concerne l'efficacité et l'activité purification. Cependant, à partir de ces préparations plus tard nous ne montrer quelques morceaux choisis de données. Préparations GZMB à partir de cellules 293T en suivant le protocole actuel ont été utilisés dans plusieurs études publiées, mettant en évidence leur activité dans différents systèmes d'analyse biologique 9,29,31-34.
Une purification typique GZMA est représenté sur la figure 2A. Transfection efficace et l'expression après 72 h a été indiqué par une bande de GZM détectable sur un gel SDS-PAGE au bleu de Coomassie teinté sans autre concentration du surnageant de la culture (~ 37 kDa pour GZMB et GzmM dans des conditions réductrices; ~ 60/34 kDa pour GZMA sous non réducteur / conditions réductrices). Après la purification IMAC les échantillons ont été traités avec enterokinase (EK). Un changement visible de l'EK échantillon traité (post-EK) par rapport au contrôle pré-EK a été observée. La purification finale sur le S-colonne a donné lieu à des préparations très pures GZM (GZMA sur la figure 2A; GZMB GzmM et sur la figure 2B) avec une apparence de bande unique sur des gels protéiques colorés au bleu de Coomassie. Les fractions réunies ont été concentrées jusqu'à une concentration finale de 100 uM ~. En général, nous avons obtenu des rendements de l'ordre de 0,5 à 1 mg par Gzms 100 ml de surnageant de culture. Pour démontrer glycosylation efficace, quelques premiers préparatifs ont été traités avec l'endoglycosidase (Endo) H, qui supprime élevés oligosaccharides de mannose de glycoprotéines N-liés. Natif GZMA dispose d'un site de N-glycosylation à Asn-142, à laquelle un oligosaccharide mannose élevée est liée 35. EndoH traitement induit un changement évident de la mobilité dans la GZM A, ainsi que GZMB, préparations de cellules HEK293T mais pas dans généré bactéries GZMA analysé par SDS-PAGE et Coomassiela coloration (figure 2C).
En routine, chaque lot GZM a été testé pour l'activité enzymatique dans des essais colorimétriques. Ce test rapide et fiable démontre une activité protéolytique des Gzms par le clivage de petits peptides synthétiques qui est indiqué par spectrophotométrie par un changement de couleur du tampon d'essai. En raison des différentes préférences concernant les résidus d'acide aminé (position P1), après quoi ces proteases clivent, le choix d'un peptide spécifique varie entre les Gzms. GZMA a une activité de type trypsine, le clivage après les résidus basiques arginine (Arg, R) et la lysine (Lys, K). Clive GZMB préférentiellement après résidus d'acide aspartique (Asp, D), et clive GzmM après leucine (Leu, L) et la méthionine (Met, M) 1. Notre choix de peptide préférentiel est BLT -S-Bzl pour mesurer l'activité GZMA, AAD -S-Bzl pour GZMB et AAPL -pNA pour GzmM.
La différence majeure entre le thiobsubstrats enzylester (AAD et BLT) et le substrat de p-nitroanilide (AAPL) est la chimie spécifique, en ce que GZM médie le clivage de thiobenzylester substrats presse benzyl-mercaptan, ce qui ne déclenche une réaction chromogène dans sa réaction en aval avec le DTNB chromophore. Par conséquent, dans les tampons de réaction des substrats thiobenzylester DTNB doit être présent, tandis que la libération à médiation par GZM de p-nitroanilide est suffisant pour la détection colorimétrique. La méthode détaillée des dosages colorimétriques a été publiée récemment 36. La figure 3A montre le BLT et représentant l'activité d'estérase AAPL dans les fractions d'élution de la colonne de S-GZMA et une préparation GzmM, respectivement. Dosage colorimétrique a également été utilisé pour comparer l'activité des recombinant à des préparations de GZMB indigènes. Comme le montre la figure 3B, 293T recombinant GZMB clivé le substrat chromogène avec une efficacité similaire par rapport à GZMB native purifiée à partir d'une cel NK humainesl en ligne, comme l'a récemment décrit 12.
Pour tester plus spécifiquement l'activité GZM, GZM essais de clivage utilisant des substrats protéiques connues sont indiqués. Ces dosages de clivage peuvent être effectuées avec une protéine recombinante ou native purifiée (le cas échéant), avec des lysats de cellules ou plus physiologique avec des cellules intactes. Si un substrat protéique est disponible, l'activité protéolytique peut être analysée dans des expériences de co-incubation simples avec les préparatifs GZM comme cela est démontré avec le GZMA bactérienne connue et GZMB substrats nuoCD et nuoF 9, ainsi qu'avec le roman GzmM mitochondrial substrat NDUFAF3 humaine (figure 4A).
Les lysats cellulaires représentent une autre source évidente de multiples substrats de GZM. Anticorps commerciaux sont disponibles contre un grand nombre de substrats. Une méthode rapide et simple pour générer des lysats cellulaires est en appliquant de multiples cycles de gel / dégel comme démontré précédemment 33. L'utilisation de détergents is pas recommandés car ils peuvent interférer avec l'activité GZM. Sur la figure 4B, GZMA clivage à médiation de hnRNPA1 dans un lysat de cellules HeLa est démontré dans un immunoblot en utilisant un anticorps anti-hnRNPA1, ainsi qu'un anticorps anti-Β-actine comme contrôle de charge.
Pour les essais de clivage (ou essais de cytotoxicité) dans des cellules intactes, la disponibilité d'une molécule de livraison supplémentaire est nécessaire (PFN ou streptolysine O, SLO, pour des cellules de mammifères; GNLY ou d'autres peptides antimicrobiens pour des cellules procaryotes). des dosages de clivage dans des cellules intactes sont plus difficile que la concentration des molécules de livraison est critique et doit extensif réglage fin. Présentation de ces protocoles complexes de dosages d'apoptose est au-delà de la portée de ce document. Ici, nous ne pouvons reporter à la vaste corps de la littérature, à titre d'exemples 12,13.

Tableau 1: GZM clonage Séquences d'amorces.
Les séquences d'amorces qui ont été utilisées pour cloner GZMA, GZMB et GzmM sont indiqués. Amorces sens ont été conçus pour introduire un site de EK avant l'extrémité N-terminale de la protéase active (voir la figure 1)

Tableau 2: Solutions d'achat d'actions et des tampons compositions.
Les recettes de solutions tampons et les actions les plus importantes sont indiquées.
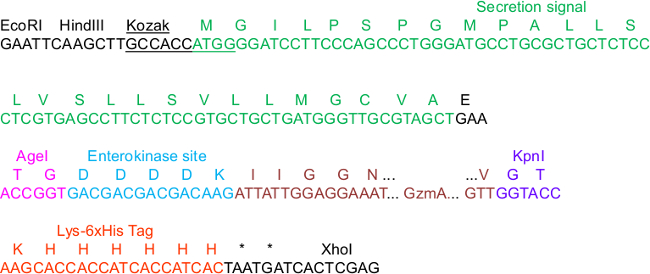
Figure 1. pHLsec séquence critique de Construct clonage.
Dans la séquence, quelques éléments du vecteur sontmis en évidence qui sont importants pour le clonage, la sécrétion, la purification IMAC et l'activation des protéases: Les consensus Kozak et des séquences signal de sécrétion, les sites de restriction Agel et Kpnl, ainsi que la Lys_6xHis tag C-terminal. Nous illustré GZMA que l'insert qui est N-terminale fusionnée à un (EK) site entérokinase. Pour la carte complète du squelette du vecteur complet, nous nous référons à l'information complémentaire 23.

Figure 2. Expression, purification et activation de Fully glycosylées Gzms droits de HEK 293 cellules T.
A) montre une série de Coomassie teinté, non réducteur gels SDS-PAGE montrant l'ensemble du processus de production de son GZMA sécrétion dans le surnageant de la première purification Nickel-IMAC, le traitement et EK fina l polissage par l'intermédiaire d'une Chromatographie d'échange de cations. Le surnageant de culture a été passé sur une SDS-PAGE dans des conditions réductrices (en rouge) et des conditions non réductrices (non-rouges). GZMA est un homodimère (ssGzmA) qui est stabilisé par une liaison disulfure. Le homodimère GZMA (~ 60 kDa) passe à proximité de contaminer BSA (~ 66 kDa). Dans des conditions réductrices le monomère GZMA (shGzmA) apparaît comme une bande ~ 34 kDa. Gels Pour démontrer la pureté de la préparation finale et GZMB GzmM, représentant teinté au bleu de Coomassie dans des conditions non réductrices sont présentés dans B. manière bactérienne (E. coli) généré GZMA ainsi que GZMA et GZMB produites dans des cellules HEK293T ont été traités et analysés avec EndoH non réductrices par SDS-PAGE et coloration au bleu de Coomassie. La glycosylation des Gzms produites dans des cellules HEK293T est mise en évidence par un décalage de mobilité après traitement par rapport à EndoH GZMA non glycosylée produite dans des bactéries (C).
ig3.jpg "/>
Figure 3. Recombinant Gzms Hydrolyze peptides synthétiques.
A), de petits échantillons des fractions d'élution à partir de la dernière colonne S ont été testés pour l'activité GZMA GzmM et dans des dosages chromogéniques et BLT en utilisant AAPL, respectivement, en tant que substrats. Les graphiques montrent que le clivage du peptide a été indiquée comme une augmentation de la DO à 405 nm. Les fractions des pics d'activité en corrélation avec le pic de protéine dans l'élution comme indiqué dans l'absorbance UV et l'analyse SDS-PAGE (Figure 2A et B). B), 293T recombinante et native GZMB (préparé comme décrit 12) aux concentrations indiquées ont été incubées en présence du substrat chromogène AAD. GZMB activité a été indiquée comme une variation de DO à 405 nm. Le graphique montre la moyenne ± SEM de nos préparations GZM plus récents qui ont été testés en triple.
52911 / 52911fig4.jpg "/>
Figure 4. recombinant Gzms Cleave substrats protéiques.
A) recombinantes GST marqué bactériennes, les protéines de la chaîne respiratoire et nuoCD nuoF, ainsi que la protéine de mammifère de la chaîne respiratoire NDUFAF3, ont été traitées avec une concentration de Gzms indiquées pendant 15 minutes indiqué à 37 ° C. 1 pg de protéines purifiées à des réactions 20 ul ont été utilisés. Le clivage a été analysé par SDS-PAGE et coloration au bleu de Coomassie. B) lysat de cellules HeLa (à une concentration de protéine de ~ 1 mg / ml) a été incubée avec des concentrations indiquées de GZMA recombinant pendant 30 min et on l'analyse par immunoblot en utilisant des anticorps anti- hnRNPA1 et Β-actine.
Discussion
Le rôle classique et d'études approfondies et de GZMA GZMB est l'induction de l'apoptose dans des cellules de mammifères après leur livraison cytosolique de la protéine formant des pores PFN 1. Récemment, le spectre des Gzms cytotoxique a été élargi de façon significative à partir de cellules de mammifères à 9,10 bactéries, ainsi qu'à 11 certains parasites. En outre, les fonctions, extracellulaires non-classiques de GZMA et GZMB ainsi que la signification biologique des différents Gzms orphelins sont encore obscures. Par conséquent, une expression et la purification du système de temps et de coût-efficacité robuste des Gzms, tel que prévu par ce protocole, sera d'une grande aide pour ces études futures.
La force de ce procédé est en particulier basée sur le vecteur d'expression, pHLsec 23, qui est utilisé dans ce système. Ce plasmide a un nombre élevé de copies dans E. coli, permettant ainsi une production efficace de l'ADN. Ses éléments enhancer / promoteur fournissent lal'activité la plus forte dans diverses lignées cellulaires 24. Il contient un intron à l'intérieur de l'unité de transcription. Les introns ont été trouvées pour amplifier l'expression génique dans des cellules de mammifère jusqu'à 37 100 fois. En outre, le plasmide fournit un consensus Kozak et un signal de sécrétion optimisé, un 6xHis-tag-Lys-A et d'un poly signal (figure 1). Les inserts peuvent être clonées en utilisant les sites de Agel et Kpnl entre le signal de sécrétion et la balise Lys-6xHis. Utilisation Agel et Xhol permettra d'éviter l'étiquette de polyHis. Pour les Gzms, il est nécessaire d'insérer un site entérokinase à l'extrémité N-terminale de l'activation des protéases des protéases après expression et purification IMAC permettant. Pour l'expression d'autres enzymes cela peut ne pas être nécessaire. Le plasmide d'expression a été testé avec succès pour de multiples constructions de différentes longueurs, les états de glycosylation, et le nombre de liaisons disulfure, ainsi que pour des protéines contenant des domaines multiples avec différents plis 23.
cellules HEK293T croître rapidement dans un milieu à faible coût et sont très bien adaptés pour la transfection de phosphate de calcium rentable. Pour ce protocole, nous recommandons de ne pas plus de passage les cellules HEK293T. Stocks congelés de cellules à faible passage devraient être préparés. Expansion des cellules décollage a eu généralement d'environ 8 à 9 jours (trois fentes) pour obtenir la quantité souhaitée de cellules. La densité cellulaire au jour de la transfection (60 à 70% de confluence) est critique pour la transfection efficace et par conséquent l'expression. En outre, en évitant les antibiotiques, mais en ajoutant la chloroquine (lysosomale qui inhibe la dégradation de l'ADN) dans le milieu sensiblement 38 plus grande efficacité. Nous avons constaté que l'efficacité de transfection est linéairement dépendant de la quantité d'ADN saturer seulement à environ 80 pg pour un plat de 15 cm (observation non publiée). Par conséquent, nous recommandons d'utiliser jusqu'à 80 μ g d'ADN plasmidique / plat dans ce protocole pour une efficacité maximale. Cela équivaudra à environ 2 mg d'ADN par la préparation (corresponding à 2 colonnes Maxiprep). L'efficacité de transfection a été plus aisément contrôlée par l'exécution d'un échantillon de surnageant de culture (environ 20 μ l) sur SDS-PAGE après la période d'incubation de 72 h. Une bande de protéine de la protease sécrétée doit être visible par la coloration au bleu de Coomassie. Si la bande GZM était faible et les cellules n'a pas détacher et semblait viable, les cultures ont été incubées pendant 24 h avant la purification IMAC.
Une autre étape la plus critique était le traitement entérokinase (EK) qui active l'enzyme. EK activité est dépendante du calcium et est inhibée par des concentrations élevées de NaCl 39 ou imidazole (observation non publiée). Par conséquent, il était essentiel de dialyser l'éluat de la IMAC contre un volume suffisant (20 ml d'éluat par 2 L de tampon de dialyse) de tampon EK contenant suffisamment de calcium et pas plus de 50 mM de NaCl à pH neutre. EK traitement est recommandé pendant 16 heures à température ambiante et doit être surveillée par SDS-PAGE qui a révélé un décalage de mobilité of la protéase traité si le clivage était complète. EK frais a été ajouté et l'incubation dans un tampon de dialyse frais EK a été poursuivie si le changement était incomplète. Seulement si la coupure est achevée, dialyse contre un tampon de S A a été démarré et la purification est poursuivie. La chaîne légère de EK catalytique a une valeur de pI de 5,2, ce qui permet la séparation complète de EK des Gzms dans la Chromatographie d'échange de cations final.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by grants from the Novartis Foundation for Medical-Biological Research and from the Research Pool of the University of Fribourg (to MW). We thank Li Zhao, Zhan Xu, and Solange Kharoubi Hess for technical support, as well as Radu Aricescu and Yvonne Jones (Oxford University, UK) for providing the pHLsec plasmid, and Thomas Schürpf (Harvard Medical School) for helpful discussions.
matériels
| Name | Company | Catalog Number | Comments |
| TRIzol Reagent | Invitrogen | 15596-026 | Total RNA isolation kit |
| SuperScript II Reverse Transcriptase | Invitrogen | 18064-014 | |
| Phusion High-Fidelity DNA Polymerase | NEB | M0530L | |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| EX-CELL 293 Serum-Free Medium for HEK 293 Cells | Sigma | 14571C | |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 31966-021 | |
| SnakeSkin Dialysis Tubing, 10K MWCO | Thermo Scientific | 68100 | |
| Enterokinase from bovine intestine | Sigma | E4906 | recombinant, ≥20 units/mg protein |
| HisTrap Excel 5 ml column | GE Healthcare | 17-3712-06 | Nickel IMAC |
| HiTrap SP HP 5 ml column | GE Healthcare | 17-1152-01 | S column |
| N-α-Cbz-L-lysine thiobenzylester (BLT) | Sigma | C3647 | GzmA substrate |
| Boc-Ala-Ala-Asp-S-Bzl (AAD) | MP Biomedicals | 2193608 _10mg | GzmB substrate |
| Suc-Ala-Ala-Pro-Leu-p-nitroanilide (AAPL) | Bachem | GzmM substrate | |
| 5,5′-dithio-bis(2-nitrobenzoic acid) (DTNB) | Sigma | D8130 | Ellman`s reagent |
Références
- Chowdhury, D., Lieberman, J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol. 26, 389-420 (2008).
- Thiery, J., Lieberman, J. Perforin: a key pore-forming protein for immune control of viruses and cancer. Subcell Biochem. 80, 197-220 (2014).
- Krensky, A. M., Clayberger, C. Biology and clinical relevance of granulysin. Tissue Antigens. 73, 193-198 (2009).
- Bovenschen, N., Kummer, J. A. Orphan granzymes find a home. Immunol Rev. 235, 117-127 (2010).
- Lieberman, J. Granzyme A activates another way to die. Immunol Rev. 235, 93-104 (2010).
- Ewen, C. L., Kane, K. P., Bleackley, R. C. A quarter century of granzymes. Cell death and differentiation. 19, 28-35 (2012).
- Hiebert, P. R., Granville, D. J. Granzyme B in injury, inflammation, and repair. Trends Mol Med. 18, 732-741 (2012).
- Afonina, I. S., Cullen, S. P., Martin, S. J. Cytotoxic and non-cytotoxic roles of the CTL/NK protease granzyme. B. Immunol Rev. 235, 105-116 (2010).
- Walch, M., et al. Cytotoxic cells kill intracellular bacteria through granulysin-mediated delivery of granzymes. Cell. 157, 1309-1323 (2014).
- Lee, W. Y., et al. Invariant natural killer T cells act as an extravascular cytotoxic barrier for joint-invading Lyme Borrelia. Proc Natl Acad Sci U S A. , (2014).
- Kapelski, S., de Almeida, M., Fischer, R., Barth, S., Fendel, R. Antimalarial activity of granzyme B and its targeted delivery by a granzyme B-scFv fusion protein. Antimicrob Agents Chemother. , (2014).
- Thiery, J., Walch, M., Jensen, D. K., Martinvalet, D., Lieberman, J. Isolation of cytotoxic T cell and NK granules and purification of their effector proteins. Curr Protoc Cell Biol. Chapter 3 (Unit3 37), (2010).
- Shi, L., Yang, X., Froelich, C. J., Greenberg, A. H. Purification and use of granzyme B. Methods Enzymol. 322, 125-143 (2000).
- Masson, D., Tschopp, J. A family of serine esterases in lytic granules of cytolytic T lymphocytes. Cell. 49, 679-685 (1987).
- Lorentsen, R. H., Fynbo, C. H., Thogersen, H. C., Etzerodt, M., Holtet, T. L. Expression, refolding, and purification of recombinant human granzyme B. Protein Expr Purif. 39, 18-26 (2005).
- Sun, J., et al. Expression and purification of recombinant human granzyme B from Pichia pastoris. Biochem Biophys Res Commun. 261, 251-255 (1999).
- Xia, Z., et al. Expression and purification of enzymatically active recombinant granzyme B in a baculovirus system. Biochem Biophys Res Commun. 243, 384-389 (1998).
- Stahnke, B., et al. Granzyme B-H22(scFv), a human immunotoxin targeting CD64 in acute myeloid leukemia of monocytic subtypes. Mol Cancer Ther. 7, 2924-2932 (2008).
- Gehrmann, M., et al. A novel expression and purification system for the production of enzymatic and biologically active human granzyme. B. J Immunol Methods. 371, 8-17 (2011).
- Metkar, S. S., et al. Cytotoxic cell granule-mediated apoptosis: perforin delivers granzyme B-serglycin complexes into target cells without plasma membrane pore formation. Immunity. 16, 417-428 (2002).
- Motyka, B., et al. Mannose 6-phosphate/insulin-like growth factor II receptor is a death receptor for granzyme B during cytotoxic T cell-induced apoptosis. Cell. 103, 491-500 (2000).
- Pinkoski, M. J., et al. Entry and trafficking of granzyme B in target cells during granzyme B-perforin-mediated apoptosis. Blood. 92, 1044-1054 (1998).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr D Biol Crystallogr. 62, 1243-1250 (2006).
- Fukuchi, K., et al. Activity assays of nine heterogeneous promoters in neural and other cultured cells. In Vitro Cell Dev Biol Anim. 30 A, 300-305 (1994).
- Tran, T. V., Ellis, K. A., Kam, C. M., Hudig, D., Powers, J. C. Dipeptidyl peptidase I: importance of progranzyme activation sequences, other dipeptide sequences, and the N-terminal amino group of synthetic substrates for enzyme activity. Arch Biochem Biophys. 403, 160-170 (2002).
- Somanchi, S. S., Senyukov, V. V., Denman, C. J., Lee, D. A. Expansion, purification, and functional assessment of human peripheral blood NK cells. Journal of visualized experiments : JoVE. , (2011).
- Barry, M., et al. Granzyme B short-circuits the need for caspase 8 activity during granule-mediated cytotoxic T-lymphocyte killing by directly cleaving Bid. Mol Cell Biol. 20, 3781-3794 (2000).
- Darmon, A. J., Nicholson, D. W., Bleackley, R. C. Activation of the apoptotic protease CPP32 by cytotoxic T-cell-derived granzyme B. Nature. 377, 446-448 (1995).
- Rajani, D. K., Walch, M., Martinvalet, D., Thomas, M. P., Lieberman, J. Alterations in RNA processing during immune-mediated programmed cell death. Proc Natl Acad Sci U S A. 109, 8688-8693 (2012).
- Domselaar, R., et al. Noncytotoxic inhibition of cytomegalovirus replication through NK cell protease granzyme M-mediated cleavage of viral phosphoprotein 71. J Immunol. 185, 7605-7613 (2010).
- Thiery, J., et al. Perforin activates clathrin- and dynamin-dependent endocytosis, which is required for plasma membrane repair and delivery of granzyme B for granzyme-mediated apoptosis. Blood. 115, 1582-1593 (2010).
- Thiery, J., et al. Perforin pores in the endosomal membrane trigger the release of endocytosed granzyme B into the cytosol of target cells. Nat Immunol. 12, 770-777 (2011).
- Thomas, M. P., et al. Leukocyte protease binding to nucleic acids promotes nuclear localization and cleavage of nucleic acid binding proteins. J Immunol. 192, 5390-5397 (2014).
- Jacquemin, G., et al. Granzyme B-induced mitochondrial ROS are required for apoptosis. Cell death and differentiation. , (2014).
- Kummer, J. A., Kamp, A. M., Citarella, F., Horrevoets, A. J., Hack, C. E. Expression of human recombinant granzyme A zymogen and its activation by the cysteine proteinase cathepsin C. The Journal of biological chemistry. 271, 9281-9286 (1996).
- Hagn, M., Sutton, V. R., Trapani, J. A. A colorimetric assay that specifically measures Granzyme B proteolytic activity: hydrolysis of Boc-Ala-Ala-Asp-S-Bzl. Journal of visualized experiments : JoVE. , e52419(2014).
- Huang, M. T., Gorman, C. M. Intervening sequences increase efficiency of RNA 3' processing and accumulation of cytoplasmic RNA. Nucleic Acids Res. 18, 937-947 (1990).
- Luthman, H., Magnusson, G. High efficiency polyoma DNA transfection of chloroquine treated cells. Nucleic Acids Res. 11, 1295-1308 (1983).
- Magee, A. I., Grant, D. A., Hermon-Taylor, J., Offord, R. E. Specific one-stage method for assay of enterokinase activity by release of radiolabelled activation peptides from alpha-N-[3H]acetyl-trypsinogen and the effect of calcium ions on the enzyme activity. Biochem J. 197, 239-244 (1981).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon