Method Article
Osmotica Drug Delivery per arti posteriori ischemico e la perfusione dei vasi con Microfil per Micro-Tomografia Computerizzata Imaging
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Mostriamo qui il In vivo Inserimento di una pompa osmotica per la consegna locale di droga costante e la creazione di ischemia degli arti posteriori in un modello di topo. Inoltre, il sistema vascolare degli arti posteriori è perfuso con Microfil, un agente radiopaco silicone, per preparare la tomografia micro-computerizzata (micro-CT), l'imaging.
Abstract
Ricerca preclinica in modelli animali di malattia arteriosa periferica svolge un ruolo fondamentale nel testare l'efficacia di agenti terapeutici studiati per stimolare la microcircolazione. La scelta del metodo di consegna per questi agenti è importante perché la via di somministrazione colpisce profondamente la bioattività e l'efficacia di questi agenti 1,2. In questo articolo, abbiamo dimostrato come amministrare localmente una sostanza in arti posteriori ischemico utilizzando una pompa osmotica cateterizzazione. Questa pompa può erogare un volume fisso di soluzione acquosa continuamente per un periodo di tempo assegnato. Abbiamo inoltre presentiamo il nostro modello murino di ischemia degli arti posteriori unilaterale indotta mediante legatura dell'arteria femorale comune prossimale all'origine della femorale profunda e epigastrica arterie degli arti posteriori del sinistro. Infine, si descrive la cannulazione in vivo e legatura dell'aorta addominale sottorenale e perfusione della vascolarizzazione hindlimb con Microfil, un agente radiopaco colata silicone. Microfil può perfusione e riempire l'intero letto vascolare (arterioso e venoso), e perché abbiamo ligato il principale canale vascolare per l'uscita, l'agente può essere conservato nel sistema vascolare per il futuro dell'imaging ex vivo con l'utilizzo di piccoli campioni di micro-CT 3 .
Introduzione
Malattia arteriosa periferica (PAD) è una malattia aterosclerotica che provoca insufficiente apporto di sangue nelle gambe 4. Colpisce 8-12.000.000 americani, e trattamenti in corso offre solo limitato sollievo 5,6. Agenti terapeutici innovativi che migliorano la circolazione del sangue nelle gambe non solo frenare la progressione della malattia, ma anche migliorare la qualità della vita. L'incidenza di PAD è maggiore nelle persone di età superiore ai 50 anni, la terapia farmacologica in modo locale è una modalità di trattamento più auspicabile in quanto l'renale ridotta funzionalità epatica e spesso osservata nei pazienti più anziani possono diminuire il metabolismo dei farmaci e aumentare gli effetti collaterali con la somministrazione sistemica.
Così, abbiamo creato un modello murino di PAD per esaminare se gli agenti amministrati localmente alleviare l'ischemia degli arti posteriori, promuovendo l'angiogenesi e rimodellamento microvascolare. Specificamente, abbiamo utilizzato una pompa osmotica cateterizzati per fornire continuamente l'agente terapeutico per ilischemica muscolo della coscia di topo. Usando il nostro sistema di consegna, siamo riusciti a mantenere le concentrazioni ottimali del farmaco per l'ambiente locale, questo approccio consente di adeguata bioattività della droga, evita gli effetti collaterali sistemici, e supera lo svantaggio di limitato accesso locale di droga associata a somministrazione sistemica. Inoltre, per valutare se gli agenti amministrati localmente promuovere la rivascolarizzazione, abbiamo utilizzato fusione avanzata e tecniche di imaging ad alta definizione che consentono la quantificazione delle variazioni del microcircolo. Collettivamente, la combinazione di metodologie utilizzato in questo articolo il video è utile negli studi preclinici per aiutare nella comprensione di rivascolarizzazione farmacologicamente indotto in pazienti con PAD 7-9.
Protocollo
1. Adescamento della pompa osmotica
- Utilizzare tecniche sterili (es. guanti, cappa a flusso laminare) durante la preparazione delle pompe. Rimuovere la pompa e il flusso moderatore dalla confezione. Pesare la pompa vuota e registrare il peso (mg).
- Riempire la pompa lentamente, per evitare di creare bolle d'aria, utilizzando una piccola siringa 1cc e punta smussata 27G tubo di riempimento. Quando la soluzione raggiunge la parte superiore della pompa, stop riempimento.
- Pulire l'eccesso di soluzione e pesare la pompa riempita. Per la maggior parte delle soluzioni acquose, il peso in mg è lo stesso del volume in microlitri. La differenza di peso vuoto contro riempita deve essere superiore al 90% del volume medio di riempimento specificato. Se non, evacuare la pompa con la siringa e riempire. In caso di problemi tecnici si prega di fare riferimento alla sezione di risoluzione dei problemi delle istruzioni della pompa a http://www.alzet.com/products/guide_to_use/filling.html
- Utilizzare un paio di pinze per rompere la flangia bianca dal Moderat flussooppure, fare attenzione a non piegare o schiacciare il tubo. Collegare un P50 catetere a una delle estremità del moderatore, che copre circa 3-4 mm. Utilizzare una siringa per riempire il catetere e attaccato moderatore e lasciare la siringa attaccata alla parte distale del catetere.
- Inserire il moderatore flusso nella pompa finché il catetere è a filo con la superficie della pompa. Quindi, rimuovere la siringa dall'estremità distale del catetere. Collocare la pompa in una sterile 0,9% soluzione salina o soluzione di PBS a 37 ° C incubatore per un minimo di 6 ore (preferibilmente O / N) per adescare la pompa prima di impiantarlo nel mouse. La portata della pompa varia a seconda del numero di modello (es. Modello 1002 = 0,25 ml / ora per 14 giorni).
2. Creazione unilaterale Ischemia degli arti posteriori del mouse
- Anestetizzare i topi con isoflurano insieme tra 2-4% a 100% O 2 ad una portata di 0,4 L / min e rimuovere i capelli (preferibilmente il giorno prima dell'intervento) sull'area hindlimb e indietro con un depilatory crema.
- Sterilizzare tutti gli strumenti chirurgici prima di un intervento chirurgico. Posizionare il mouse nella camera di induzione dell'anestesia. Utilizzare le stesse impostazioni di anestesia descritte nella sezione 2.1.
- Attendere fino a quando il mouse è non risponde agli stimoli esterni e poi metterlo in posizione prona sul tavolo operatorio con un cono di naso attrezzata che offre un flusso continuo di isoflurano (1,5-2,0%).
- Iniettare la dose raccomandata di anestetico (Bupivacaine; 0,25% (<1 ml / kg)) presso il sito di incisione, curare la pelle con una soluzione di iodio-povidone seguito dal 70% di etanolo. Fare una incisione 4-6 mm sul retro (a lato della colonna vertebrale, nella regione scapole). Separare la membrana sottocutanea con una pinza sottile, quindi accendere il mouse nella posizione supina trattare la pelle con una soluzione di iodio-povidone seguito dal 70% di etanolo e rendere 0,8-1 cm un'incisione con le forbici micro-chirurgiche sopra il ginocchio verso il mediale della coscia, seguendo il percorso dell'arteria femorale.
- Tunnel illato del tronco con piccolo tubo guaina (6-francese) dal mediale della coscia per l'incisione sul retro.
- Posizionare il mouse in posizione prona. Rimuovere la pompa osmotica adescata / catetere dalla soluzione PBS e guidare il catetere, attraverso il tubo guaina, alla coscia.
- Posizionare la pompa all'interno della parte posteriore e chiudere l'incisione posteriore con 6-0 prolene sutura (trattare la pelle con una soluzione di iodio-povidone seguito dal 70% di etanolo). Posizionare il retro del mouse in posizione supina; rimuovere il tubo guaina, lasciando il catetere esposta attraverso l'incisione sulla coscia. Fissare la gamba con nastro adesivo chirurgico.
- Separare il grasso sottocutaneo del tessuto per rivelare la vascolarizzazione. Per visualizzare meglio la vascolarizzazione, utilizzare un riavvolgitore per aprire l'incisione.
- Pierce la guaina femorale membranosa delicatamente utilizzando pinze a punta fine per accedere al fascio vascolare. Sezionare e separare l'arteria femorale dalla vena femorale e del nervo vicino all'inguine, avendo cura di non provocare exemorragia eccessiva.
- Posizionare due 8-0 prolene suture adiacenti per interrompere l'arteria femorale 2-3 mm prossimalmente alla biforcazione femorale (l'origine della femorale profonda e epigastrica arterie).
- Tagliare il catetere alla lunghezza appropriata e posizionare la punta alla regione antero-laterale della coscia, fissandolo con un prolene sutura 6-0 per la fascia superficiale per garantire la somministrazione mirata di sostanza. Chiudere l'incisione gamba con una sutura continua 6-0. Amministrare una iniezione sottocutanea finale di analgesico (buprenorfina, 0,1 mg / kg), trattare la pelle con una soluzione di iodio-povidone seguito dal 70% di etanolo e restituire il mouse per la gabbia. Utilizza una lampada di riscaldamento durante il recupero.
- Dopo un periodo di recupero di 30 minuti, preparare il mouse per il laser Doppler per confermare la creazione di ischemia degli arti posteriori.
- Monitorare l'animale due volte al giorno per 5 giorni dopo l'intervento. Mobilità dell'animale sarà osservato per analizzare dolore; rifiuti nella gabbia servirà come una indicator di mangiare. Inoltre, durante il periodo di monitor di determinare se l'animale prova dolore o disagio e dare una iniezione sottocutanea di Buprenorfina (0.1mg/kg) due volte al giorno.
3. Imaging Preparazione del campione
- Anestetizzare il mouse come indicato nella Sezione 2.1. Trasferire il mouse sul tavolo operatorio in posizione supina. Iniettare 1.000 UI di eparina per via sottocutanea per prevenire la coagulazione nel sistema vascolare. Mentre il mouse è attaccato al musetto, fare un'incisione abbastanza grande per esporre la cavità toracica e l'addome inferiore. Spostare gli organi addominali al lato sinistro dell'animale per esporre l'aorta addominale sottorenale (IAA). Separare con attenzione l'aorta dalla vena cava inferiore.
- Legare la IAA prossimale per ridurre il sanguinamento durante l'inserimento del catetere. Poi, fare una piccola incisione sulla IAA. Inserire un 27 ½ G smussato ago (collegato a un catetere P10) nella IAA e fissarlo con un 6-0 sutura.
- Riempire dueSiringhe 20cc con soluzione fisiologica con eparina e il 10% formalina tamponata neutra (NBF). Riempire una siringa da 5 cc con una mescola di gomma di silicone radiopaco contrasto. Mescolare i tre ingredienti di MV-composto: MV-diluente: agente MV-polimerizzazione in rapporti di lavoro dei 1:1.25:0.5. Dal momento che la miscela (Microfil) ha solo un tempo di lavoro di 20 minuti prima che l'agente polimerizza, si raccomanda di non aggiungere l'agente MV-indurimento fino a poco prima dell'iniezione nel sistema vascolare.
- Fare un taglio in atrio destro e somministrare una dose eccessiva di isoflurano per indurre l'eutanasia e per consentire il drenaggio dei liquidi in eccesso. Collegare la siringa soluzione salina per la punta dell'ago e cominciare a lavare il sistema vascolare per 5 min. Assicurarsi che tutto il sangue viene lavata fuori dei vasi; spegnere l'isoflurano e scollegare il nosecone una volta inizia il lavaggio. Quindi, collegare la siringa formalina-riempita per il catetere di cui in (3.2) e profumato pressione per un ulteriore 5 min. Infine, l'ultimo perfusione siringa, con il contrastoagente, lentamente nel mouse per 5 min.
- Opzionale: Fotografia del Microfil nel sistema vascolare con una fotocamera per garantire che solo la struttura arteriosa è perfuso.
- Posizionare il mouse in un contenitore riempito con il 10% NBF e conservare a 4 ° CO / N per il contrasto polimerizzazione agente. Dopo 24 ore, togliere la pelle sulla metà inferiore del tronco (distale alla legatura dell'aorta addominale inferiore) utilizzando strumenti di dissezione, aggiornare la NBF 10%, e posizionare il mouse nel contenitore per altri 4 giorni a RT.
- Sezionare le arti posteriori controlaterale e ischemico, e posizionare i campioni in una soluzione di acido formico (Cal-Ex II) per 48 ore per facilitare decalcificazione delle ossa. Poi, lavare i campioni con acqua corrente per 1 ora e tornare al 10% NBF e procedere con Faxitron (sistema a raggi X utilizzato per garantire l'osso è decalcificata) e micro-CT.
Risultati
L'animazione mostra l'inserimento della pompa osmotica e chirurgia ischemia degli arti posteriori dettagliati nel protocollo. Figura 1 mostra le immagini laser Doppler della perfusione della arti posteriori, che conferma l'ischemia. Dopo la fusione vascolare con Microfil, un'immagine 3D micro-CT della rete vascolare mostra che Microfil può riempire efficacemente i vasi (Figura 2A), ma può verificarsi che le discontinuità (Figura 2B) a causa di vari fattori procedurali (, bolle d'aria, mancanza di pressione, viscosità del Microfil).
Animazione Leggenda
- Posizionare il mouse nella posizione prona e fare un'incisione sul dorso a lato della colonna vertebrale.
- Esporre la piccola incisione dietro.
- Posizionare il mouse in posizione supina e fare una piccola incisione sopra il ginocchio mediale della coscia.
- Separare la pelle, esporre il sistema vascolare, ed inserire il tubo guaina il torso lato del mouse per l'incisione posteriore.
- Prendere la pompa osmotica e inserire il catetere nel tubo guaina.
- Posizionare il mouse in posizione supina e guidare il catetere verso il basso attraverso il tubo per l'incisione nella coscia.
- Posizionare il mouse in posizione prona e posizionare la pompa sul dorso e chiudere l'incisione.
- Posizionare il mouse nella posizione supina e rimuovere il tubo guaina.
- Tirare indietro la pelle con un divaricatore e utilizzare strumenti di microchirurgia per separare la vena dall'arteria. Raddoppiare legare l'arteria femorale sopra della biforcazione femorale con sutura.
- Fissare il catetere al tessuto superficiale della coscia.
- Chiudere l'incisione gamba con sutura.
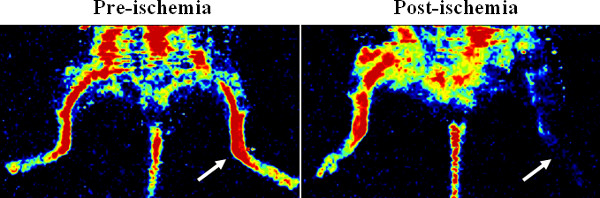
Figura 1. Conferma di ischemia degli arti posteriori tramite laser Doppler imager perfusione. L'rappresentante Doppler immagini show la perfusione del sangue prima e dopo legatura chirurgica dell'arteria femorale nel hindlimb mouse. L'ischemia è stato creato nel hindlimb sinistra (vedi frecce).

Figura 2. Immagine 3D Micro-CT della vascolarizzazione degli arti posteriori. Fusione vascolare con Microfil rivelano una rete di vene e arterie in tutto il arti posteriori (A). Discontinuità del Microfil può verificarsi anche (B), disabilitando la visualizzazione di una rete vascolare dettagliato (vedi frecce).
Discussione
Qui vi presentiamo un metodo per farmaco / sostanza consegna osmotica in un modello murino di ischemia degli arti posteriori. Inoltre, si descrive una tecnica di fusione nei quali abbiamo utilizzato Microfil per produrre una ricostruzione 3D per analisi della rete vascolare.
Il livello o la gravità di ischemia varia a seconda di dove è presentata la legatura arteriosa / escissione. Abbiamo creato una doppia legatura dell'arteria femorale comune prossimale all'origine femorale profonda e epigastrica arterie; questo approccio può produrre una ischemia più grave nella hindlimb distale. Assicuratevi di controllare gli animali dopo l'intervento chirurgico e fornire sollievo dal dolore con la somministrazione locale di analgesici. Inoltre, il Microfil non sempre completamente perfusione vascolare dell'arto. Quindi, è importante garantire che tutto il sangue è sciacquato della vascolarizzazione dopo la perfusione della soluzione salina eparinizzata. Motivi per perfusione incompleta del Microfil comprendono la mancanza di unapressione pplied o viscosità improprio della Microfil, entrambi i quali devono essere tali da garantire la Microfil raggiunge le regioni più distali del hindlimb e riempie così l'intero sistema vascolare. Per affrontare questi problemi, applicare una pressione costante a 100 mmHg e sperimentare con il composto: rapporti di diluente per l'applicazione particolare animale.
Per studiare arteriogenesis (crescita dell'arteria collaterale preesistente), l'approccio è ideale per legare l'arteria femorale immediatamente distale all'origine del ramo femorale profonda per reindirizzare il flusso di sangue ai vasi collaterali. Tuttavia, la risposta a questa procedura varia ampiamente tra ceppi di topi, e il grado di ischemia può essere insufficiente in alcuni ceppi di topi (es., C57BL / 6). Un modello meno grave ischemico può non fornire una finestra di tempo prolungato per indagare effetti terapeutici in pesantemente vascolarizzati ceppi di topi come C57BL / 6. Per evitare questi problemi, abbiamo creato degli arti posteriori ischemia by legatura dell'arteria femorale prossimale, che ha creato una ischemia più severa per dimostrare meglio gli effetti rilascio di farmaco, tuttavia, questo approccio preclude analisi arteriogenesis nei vasi collaterali ramo profondo prossimali. Pertanto, gli effetti terapeutici sono tratti principalmente dalla regione ischemica distale, che è coerente con la posizione anatomica (anterolaterale della coscia) in cui si rilascia il farmaco / sostanza. Durante l'intervento chirurgico, è fondamentale per non ferire la vena femorale fragile perché il sanguinamento locale può portare a infiammazione ed edema, che colpiscono sia arteriogenesi e l'angiogenesi. Si consiglia di utilizzare 8-0 punti di sutura prolene per legare l'arteria femorale con un nodo di cravatta adeguati per evitare l'allungamento, tensione, o rottura dell'arteria. Inoltre, Microfil deve essere utilizzato immediatamente (entro 20 min) dopo la miscelazione dei tre ingredienti (composto, diluente, e induritore) in quanto polimerizza rapidamente, il che crea difficoltà tecniche per iniezione. Come già stated, Microfil non sempre con successo la perfusione vascolare più piccolo, ma la pratica e l'uso di tecniche appropriate può aiutare a superare questa limitazione.
Il volume di riempimento della pompa deve essere superiore al 90% del volume di riempimento medio, se no, aria supplementare può rimanere intrappolato all'interno della pompa. Ulteriori informazioni tecniche si trova a www.alzet.com . Inoltre, l'agente Microfil deve essere alla viscosità preferita per una particolare applicazione, per cui il rapporto di diluente composto può essere necessario modificare.
Il modello di ischemia degli arti posteriori è altamente riproducibile ed è applicabile al PAD 10,11. La fornitura stabile di agenti terapeutici in questo modello è necessario ottenere risultati informativi 2. In conclusione, la tecnica di imaging 3D che abbiamo usato per visualizzare le strutture morfologiche è un ottimo strumento per l'esame della vascolarizzazione del mouse e fornisce un potente sistema per studyipatologie vascolari ng.
Divulgazioni
Gli autori dichiarano assenza di conflitto di interessi. Tutte le procedure di animali sono stati condotti in conformità con le Linee Guida per la cura e l'uso di animali da laboratorio e sono stati approvati dalla cura degli animali e del Comitato Istituzionale Usa (IACUC) presso l'Università del Texas Health Science Center a Houston.
Riconoscimenti
Gli autori desiderano ringraziare Keith Michel del MD Anderson Small Animal Imaging strumento per la sua assistenza tecnica con micro-CT, Edward TH Yeh, MD, per l'assistenza chirurgica, e Rebecca Bartow, dottorato di ricerca, per l'assistenza editoriale. Questo lavoro è stato sostenuto in parte dalla American Heart Association.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| Surgical tools | Fine Science Tools | Type: Tool | |
| Puritan sterile cotton swabs | Fisher Scientific | 22-029-499 | Type: Tool |
| Betadine (povidone-iodine) | Fisher Scientific | 19-065534 | Type: Reagent |
| 70% Alcohol pads | Fisher Scientific | NC9926371 | Type: Reagent |
| Phosphate buffered saline | Lonza | 17-516F | Type: Reagent |
| 6-0 prolene suture | Cardinal Health | 8709 | Type: Tool |
| 8-0 prolene suture | Cardinal Health | 2775 | Type: Tool |
| Depilatory cream | Nair | Type: Tool | |
| Osmotic pump |  ALZET ALZET | 1002 | Type: Tool, 14 day release |
| Vinyl catheter |  ALZET ALZET | 7760 | Type: Tool |
| Heparinized saline (0.9%) | Baxter | 2B0944 | Type: Reagent |
| Neutral buffered formalin | Richard-Allan Scientific | 5705 | Type: Reagent |
| Microfil (silicone rubber contrast agent) | Flowtech | MV-112 | Type Reagent, Microfil White |
| Cal-Ex II (formic acid solution) | Fisher Scientific | CS511-1D | Type: Reagent |
| Buprenex | CIII | 7571 | Type: Analgesic |
| Bupivicaine | Hospira, Inc. | 381 | Type: Analgesic |
| Equipment | |||
| Dissecting microscope | Carl Zeiss Microimaging | Zeiss Stemi 2000-C | Type:Equipment |
| Laser Doppler perfusion imager | Perimed Inc. | Periscan PIM3 | Type:Equipment |
| Micro-CT imaging system | GE Healthcare | Explore Locus SP | Type:Equipment |
Riferimenti
- Epstein, S. E., Fuchs, S., Zhou, Y. F., Baffour, R., Kornowski, R. Therapeutic interventions for enhancing collateral development by administration of growth factors: basic principles, early results and potential hazards. Cardiovasc. Res. 49, 532-542 (2001).
- Esaki, J., Marui, A., Tabata, Y., Komeda, M. Controlled release systems of angiogenic growth factors for cardiovascular diseases. Expert Opin. Drug Deliv. 4, 635-649 (2007).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, 1267-1279 (2002).
- Golomb, B. A., Dang, T. T., Criqui, M. H. Peripheral arterial disease: morbidity and mortality implications. Circulation. 114, 688-699 (2006).
- Hiatt, W. R. Pharmacologic therapy for peripheral arterial disease and claudication. J. Vasc. Surg. 36, 1283-1291 (2002).
- Hirsch, A. T., et al. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA. 286, 1317-1324 (2001).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat. Med. 9, 713-725 (2003).
- Hirsch, A. T., et al. ACC/AHA Guidelines for the Management of Patients with Peripheral Arterial Disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Associations for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (writing committee to develop guidelines for the management of patients with peripheral arterial disease)--summary of recommendations. J. Vasc. Interv. Radiol. 17, 1383-1397 (2006).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Losordo, D. W., Dimmeler, S. Therapeutic angiogenesis and vasculogenesis for ischemic disease. Part I: angiogenic cytokines. Circulation. 109, 2487-2491 (2004).
- Waters, R. E., Terjung, R. L., Peters, K. G., Annex, B. H. Preclinical models of human peripheral arterial occlusive disease: implications for investigation of therapeutic agents. J. Appl. Physiol. 97, 773-780 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon