Method Article
משלוח סמים האוסמוטי לhindlimbs איסכמי וטפטוף של כלי דם עם Microfil למייקרו-טומוגרפיה ממוחשבת הדמיה
* These authors contributed equally
In This Article
Summary
אנחנו מראים כאן In vivo כניסה של משאבה האוסמוטי עבור משלוח סמים מקומי מתמיד ויצירת איסכמיה hindlimb במודל של עכברים. יתר על כן, כלי דם hindlimb הוא perfused עם Microfil, סוכן radiopaque סיליקון, כדי להתכונן למייקרו טומוגרפיה ממוחשבת (CT מיקרו) הדמיה.
Abstract
מחקר קליני במודלים של בעלי חיים של מחלת עורקים היקפית ממלא תפקיד חיוני בבדיקת יעילותם של סוכנים טיפוליים שנועדו לעורר את זרימת דם. בחירת שיטת משלוח עבור הסוכנים האלה חשובה כי התוואי של ממשל עמוק משפיע על הפעילות ביולוגית והיעילות של אלה 1,2 הסוכנים. במאמר זה, אנו מדגימים כיצד לנהל את החומר באופן מקומי על ידי hindlimbs איסכמי באמצעות משאבה האוסמוטי צינתור. משאבה זו יכולה לספק נפח קבוע של תמיסה מימית ברציפות במשך תקופה מוקצב של זמן. כמו כן, אנו מציגים מודל העכבר שלנו של איסכמיה hindlimb חד צדדית הנגרם על ידי קשירה של עורק הירך המשותף הפרוקסימלי למקורו של femoris profunda ועורקים epigastrica בhindlimb השמאל. לבסוף, אנו מתארים בcannulation vivo וקשירה של אב העורקים והטפטוף של כלי דם hindlimb infrarenal בטן עם Microfil, סוכן ליהוק radiopaque סיליקון. Microfil יכול perfuse ולמלא את המיטה כולה כלי הדם (עורקי ורידים), ובגלל שיש לנו ligated צינור כלי הדם העיקרי ליציאה, ניתן להיעזר בסוכן בכלי הדם להדמית vivo לשעבר עתיד עם השימוש בדגימה קטנה מיקרו-CT 3 .
Introduction
מחלת עורקים היקפית (PAD) היא מחלה שגורמת לטרשת עורקת אספקת דם מספיקה ברגליים 4. זה משפיע 8-12,000,000 אמריקאים, וטיפולים רפואיים הנוכחיים מציעים רק הקלה מוגבלת 5,6. סוכנים טיפוליים חדשניים המשפרים את זרימת דם ברגליים לא רק לרסן את התקדמות מחלה, אלא גם לשפר את איכות החיים. ההיארעות של PAD היא גבוהה יותר בקרב אנשים מעל גיל 50 שנים, ולכן טיפול תרופתי מקומי הוא שיטת טיפול רצויה יותר, כי הכליות מופחתת ותפקוד כבד נראים לעתים קרובות בחולים מבוגרים יותר יכולים להקטין את חילוף החומרים של תרופה ולהגדיל את תופעות לוואי עם מנהל מערכתי.
לפיכך, יצרנו מודל עכבר של PAD לבחון האם סוכנים המנוהלים באופן מקומי להקל איסכמיה hindlimb על ידי קידום אנגיוגנזה ושיפוץ כלי הדם. באופן ספציפי, השתמשנו במשאבה האוסמוטי צינתור, כדי לספק את הסוכן הטיפולי ברציפותשריר ירך איסכמי של עכברים. באמצעות מערכת האספקה שלנו, הצלחנו לשמור על ריכוז אופטימלי של התרופה בסביבה המקומית; גישה זו מאפשרת לbioactivity התרופה המתאים, נמנעת תופעות לוואי מערכתיות אפשריות, ומתגברת על החסרון של הגישה סמים המקומי המוגבל קשורה למנהל מערכתי. בנוסף, כדי להעריך האם סוכנים המנוהלים באופן מקומי לקדם revascularization, השתמשנו ליהוק מתקדם ושיטות הדמיה בחדות גבוהה המאפשרות כימות של שינויים בmicrovasculature. באופן קולקטיבי, השילוב של מתודולוגיות בשימוש במאמר זה וידאו שימושי במחקרים פרה כדי לסייע בהבנת revascularization המושרה פרמקולוגית בחולי PAD 7-9.
Protocol
1. תחול משאבת אוסמוטי
- השתמש בטכניקות סטריליות כפפות (למשל, מכסה המנוע זרימה למינרית) בעת עריכת המשאבות. הסר את המשאבה ומנחת זרימה מהאריזה. שוקל המשאבה הריקה ולהקליט את המשקל (מ"ג).
- מלא את המשאבה באיטיות, כדי להימנע מיצירת בועות אוויר, על ידי שימוש במזרק 1cc קטן וצינור מילוי 27G הקהה שקצהו. כאשר הפתרון מגיע לחלק עליון של המשאבה, להפסיק מילוי.
- נגב את הפתרון העודף ולשקול את המשאבה מלאה. עבור רוב התמיסות מימיות, במשקל במ"ג הוא אותו הדבר כמו בנפח μl. ההבדל במשקל ריק לעומת מלא צריך להיות יותר מ -90% מהיקף המילוי הממוצע שצוין. אם לא, לפנות את המשאבה עם המזרק ולמלא. אם אתם חווים קושי טכני עיין בסעיף פתרון הבעיות של הוראות המשאבה בhttp://www.alzet.com/products/guide_to_use/filling.html
- השתמש זוג מלקחיים כדי לשבור את מקורבות לבנה מmoderat הזרימהאו; להיזהר שלא להתכופף או למעוך את הצינור. צרף קטטר P50 לכל צד של המנחה, המשתרע על 3-4 מ"מ. השתמש במזרק כדי למלא את הקטטר ומצורף המנחה ולהשאיר את המזרק המצורף לחלק הדיסטלי של קטטר.
- הכנס את המנחה לזרום לתוך המשאבה עד לקטטר הוא מיושר עם משטח המשאבה. לאחר מכן, הוצא את המזרק מהקצה הדיסטלי של קטטר. הנח את המשאבה בתמיסת מלח סטרילית 0.9% או פתרון PBS ב37 מעלות צלזיוס חממה למינימום של 6 שעות (רצוי O / N) לראש המשאבה לפני השתלתו לתוך העכבר. שיעור אספקת המשאבה משתנה עם מספר הדגם (כלומר דגם 1002 = 0.25 μl / שעה במשך 14 ימים).
2. יצירת איסכמיה hindlimb חד צדדית בעכבר
- הרדימי העכברים עם סט isoflurane בין 2-4% ב 100% O 2 בקצב זרימה של 0.4 ליטר / דקה ולהסיר את השיער (רצוי היום לפני הניתוח) באזור hindlimb וחוזר עם depilatoקרם ר"י.
- לעקר את כל הכלים כירורגיים לפני הניתוח. מניחים את העכבר בתא ההרדמה האינדוקציה. השתמש באותן הגדרות ההרדמה המתוארות בסעיף 2.1.
- חכה עד שהעכבר הוא שאינם מגיב לגירויים חיצוניים ולאחר מכן למקם אותו בעמדה נוטה על שולחן הניתוחים עם חרטום מצויד המספק זרימה רציפה של isoflurane (1.5-2.0%).
- הזרק את המינון המומלץ של חומר הרדמה (Bupivacaine; 0.25% (<מ"ל 1 ק"ג /)) באתר החתך; טיפול בעור עם פתרון povidone-יוד ואחריו 70% אתנול. ביצוע חתך 4-6 מ"מ בחלק האחורי (בצד של עמוד השדרה, באזור ההשכמות). להפריד את הקרום תת עורית עם מלקחיים עדינים ואז הפעל את העכבר למצב שכיבה טיפול בעור עם פתרון povidone-יוד ואחריו 70% אתנול ולעשות חתך עם מספריים 0.8-1 ס"מ מיקרו כירורגיות מעל הברך לכיוון הירך המדיאלי, בעקבות הנתיב של עורק הירך.
- מנהרה עדצד של פלג גוף עליון עם צינורות נדן קטנים (6 הצרפתי) מהירך המדיאלי לחתך בגב.
- מניחים את העכבר בעמדה פגיע. הסר את המשאבה / קטטר דרוכים האוסמוטי מפתרון PBS ולהנחות את הצנתר, דרך צינורות הנדן, לירך.
- מקם את המשאבה בתוך קדימה ולסגור את החתך חזרה עם 6-0 תפר prolene (טיפול בעור עם פתרון povidone-יוד ואחריו אתנול 70%). מניחים את העכבר אחורה במצב שכיבה, להסיר את צינור הנדן, והשאיר את הקטטר נחשף דרך החתך על הירך. אבטח את הרגל עם פלסטר.
- הפרד את רקמת השומן תת עורי כדי לחשוף את כלי הדם. כדי להמחיש טוב יותר בכלי הדם, יש להשתמש במפשק כדי לפתוח את החתך.
- פירס נדן הירך הקרומי בעדינות באמצעות מלקחיים עדינים מחודדים לגשת צרור כלי הדם. לנתח ולהפריד את עורק הירך מעורק הירך ואת העצב ליד המפשעה, נזהר שלא לגרום לשעברדימום cessive.
- שני תפרי מקום 8-0 Prolene סמוך לקטוע את עורק הירך 2-3 מ"מ הפרוקסימלי להסתעפות הירך (מקורו של femoris profunda ועורקי epigastrica).
- חותכים את הצנתר לאורך המתאים ומקום הקצה לאזור anterolateral של הירך, לקבע אותו עם תפר 6-0 prolene לfascia השטחי כדי להבטיח אספקה ממוקדת של החומר. סגירה החתך ברגל עם תפר ריצה 6-0. לנהל הזרקה תת עורית של משכך כאבים סופית (עצירות; 0.1 מ"ג / ק"ג), לטיפול בעור עם פתרון povidone-יוד ואחריו 70% אתנול ולהחזיר את העכבר לכלוב. השתמש במנורת חימום במהלך התאוששות.
- לאחר תקופת החלמה של 30 דקות, להכין לעכבר לייזר דופלר הדמיה כדי לאשר את הקמתה של איסכמיה hindlimb.
- לפקח על בעלי החיים, פעמים ביום במשך 5 ימים לאחר ניתוח. ניידות של החיה יקויימו לנתח כאב; פסולת בכלוב תשמש כהודיator של אכילה. כמו כן, במהלך התקופה לפקח לקבוע אם החיה היא חוותה כאב או אי נוחות ונותן זריקה תת עורית של עצירות (0.1mg/kg) פעמיים ביום.
3. הכנת דגימת הדמיה
- להרדים את העכבר כאמור בסעיף 2.1. העבר את העכבר על שולחן הניתוחים במצב שכיבה. הזרק 1,000 IU של הפרין תת עורי למניעת קרישה בכלי הדם. בעוד העכבר מחובר לnosecone, עושה חתך גדול מספיק כדי לחשוף את חלל בית החזה ובטן התחתונה. להזיז את אברי הבטן לצד השמאל של בעלי החיים כדי לחשוף את אב העורקים הבטני (רש"ת). להפריד בזהירות את אב העורקים מהווריד הנבוב הנחות.
- ולקשור את רשות העתיקות הפרוקסימלי כדי להפחית דימום במהלך החדרת קטטר. ואז, לעשות חתך קטן ברשות העתיקות. הכנס 27 ½ G בוטה מחט (שמחובר לקטטר P10) לרשות העתיקות ולאבטח אותו עם תפר 6-0.
- מלאו שתייםהמזרקים 20cc עם מלח heparinized ו -10% ניטראלי שנאגרו פורמלין (NBF). ממלאי מזרק 5cc עם תרכובת גומי סיליקון radiopaque ניגוד. מערבבים את שלושה מרכיבים של MV-מתחם: סוכן MV-ריפוי ביחסי עבודה של 1:1.25:0.5: MV-diluent. מאז את התערובת (Microfil) יש זמן עבודה של 20 דקות בלבד לפני שסוכן polymerizes, מומלץ שלא להוסיף את סוכן MV-הריפוי עד ממש לפני ההזרקה לתוך כלי הדם.
- ביצוע חתך בעלייה הימנית ולנהל ממנת יתר של isoflurane לגרום להמתת חסד, ולאפשר לניקוז נוזלים עודפים. צרף את המזרק מלא בתמיסת מלח לקצה המחט ומתחיל לשטוף כלי הדם במשך 5 דקות. ודא שכל הדם סמוק החוצה מכלי; לכבות את isoflurane ונתק את nosecone פעם השטיפה מתחילה. בשלב הבא, לצרף את המזרק המלא בפורמלין לקטטר שפורט לעיל (3.2) וperfuse לחץ ל5 דקות נוספות. לבסוף, perfuse המזרק שעבר, עם הניגודסוכן, לאט לתוך העכבר למשך 5 דקות.
- אופציונלי: צילום Microfil בכלי הדם עם מצלמה על מנת להבטיח כי רק את המבנה העורק הוא perfused.
- מניחים את העכבר במכל מלא בNBF 10% ולאחסן ב 4 ° CO / N לפילמור חומר הניגוד. לאחר 24 שעות, להסיר את העור על חיצו התחתון של הטורסו (דיסטלי לקשירת אב העורקים בבטן תחתונה) על ידי שימוש בכלים לנתיחה, לרענן 10% NBF, והנח את העכבר בחזרה לתוך המכל למשך 4 ימים נוספים ב RT.
- לנתח את hindlimbs הנגדי ואיסכמי, ולמקם את הדגימות בפתרון חומצה פורמית (קאל-EX II) עבור 48 שעות כדי להקל decalcification של העצם. לאחר מכן, יש לשטוף את הדגימות תחת מים זורמים במשך שעה 1 ולחזור ל10% NBF ולהמשיך עם Faxitron (מערכת רנטגן משמשת כדי להבטיח את עצם decalcified) ומיקרו-CT הדמיה.
תוצאות
האנימציה מדגימה את החדרת המשאבה האוסמוטי וניתוח איסכמיה hindlimb המפורט בפרוטוקול. איור 1 מציג תמונות לייזר דופלר של זלוף של hindlimb, המאשר איסכמיה. אחרי ליהוק כלי דם עם Microfil, תמונת 3D מיקרו CT של רשת כלי הדם מראה כי Microfil יכול למלא ביעילות את כלי (איור 2 א), אלא ששיבושים יכולים להתרחש (איור 2) בשל גורמים פרוצדורליים שונים (למשל, בועות אוויר, חוסר לחץ, צמיגות של Microfil).
אנימציה מקרא
- מניחים את העכבר בעמדה פגיע ועושה חתך בגבו בצד של עמוד השדרה.
- לחשוף את החתך האחורי הקטן.
- מניחים את העכבר במצב שכיבה ולעשות חתך קטן מעל הברך בירך המדיאלי.
- הפרד את העור, לחשוף את כלי הדם, והכנס את צינור הנדן עד פלג הגוף העליון הצד של mousדואר לחתך בחזרה.
- קח את המשאבה האוסמוטי ולהכניס את הצנתר לתוך צינורות הנדן.
- מניחים את העכבר במצב שכיבה ולהנחות את הצנתר דרך הצנרת לחתך בירכיים.
- מניחים את העכבר בעמדה פגיע ולמקם את המשאבה על הגב שלו ולסגור את החתך.
- מניחים את העכבר במצב שכיבה ולהסיר את צינור הנדן.
- למשוך בחזרה את העור עם מפשק ולהשתמש בכלי microsurgical להפריד את הווריד בעורק. פעמיים לקשור את עורק הירך מעל הסתעפות הירך עם תפר.
- Secure את הקטטר לרקמות שטחיות של הירך.
- סגירה החתך ברגל עם תפר.
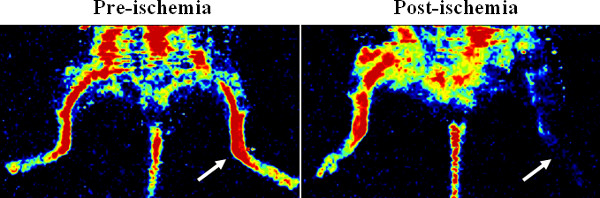
איור 1. אישור על איסכמיה hindlimb דרך imager זלוף דופלר לייזר. נציג דופלר תמונות show זלוף הדם לפני ואחרי ניתוח לקשירת עורק הירך בhindlimb העכבר. איסכמיה נוצרה בhindlimb השמאל (ראה חיצים).

איור 2. תמונת 3D Micro-CT של כלי דם hindlimb ליהוק כלי דם. עם Microfil לחשוף רשת של ורידים ועורקים לאורך hindlimb (). חוסר המשכיות של Microfil יכול להתרחש גם (ב '), השבתת ההדמיה של רשת כלי דם מפורטת (ראה חיצים).
Discussion
כאן אנו מציגים שיטה להעברת תרופות / חומר אוסמוטי במודל עכבר של איסכמיה hindlimb. בנוסף, אנו מתארים טכניקת יציקה שביש לנו להשתמש Microfil לייצר שחזור 3D לניתוח של רשת כלי הדם.
הרמה או חומרת איסכמיה משתנה בהתאם למקום שבי קשירה / הכריתה העורק מורכבת. יצרנו קשירה כפולה בעורק הירך המשותף הפרוקסימלי למקורו של femoris profunda ועורקי epigastrica; גישה זו יכולה לייצר איסכמיה חמורה יותר בhindlimb הדיסטלי. הקפד לעקוב אחר בעלי החיים לאחר ניתוח ולספק הקלה בכאב על ידי ממשל המקומי של משככי כאבים. בנוסף, ייתכן שלא תמיד Microfil perfuse כלי דם גפיים לחלוטין. לכן, חשוב לוודא שכל הדם הוא שטף החוצה מכלי הדם לאחר טפטוף של תמיסת מלח heparinized. סיבות לזלוף שלם של Microfil כוללות חוסרלחץ pplied או צמיגות לא תקינה של Microfil, אשר שניהם חייב להיות מספיק כדי להבטיח את Microfil מגיע לאזורים המרוחקים ביותר של hindlimb ובכך ממלא את כל כלי הדם. כדי לטפל בבעיות אלה, להפעיל לחץ עקבי על 100 מ"מ כספית, ולהתנסות במתחם: יחסי diluent לבקשת בעלי החיים מסוימים.
ללמוד arteriogenesis (צמיחת עורק טחונות קיימת מראש), הגישה האידיאלית היא לקשור עורק הירך הדיסטלי מייד למקורו של סניף הירך העמוק להפנות את זרימת דם אל כלי הטחונות. עם זאת, התגובה להליך זה משתנית מאוד בין זני עכבר, והיקף איסכמיה עשוי להיות לא מספק בכמה זני עכבר (למשל, C57BL / 6). מודל איסכמי פחות חמור לא יכול לספק חלון ממושך של זמן כדי לחקור השפעות טיפוליות בכבדות זני עכבר vascularized כגון C57BL / 6. כדי להימנע מבעיות אלה, שיצרנו ב איסכמיה hindlimby ligating עורק הירך הפרוקסימלי, שנוצר איסכמיה חמורה יותר טובים כדי להדגים את השפעות שחרור סמים המקומיות, עם זאת, גישה זו מונעת ניתוח arteriogenesis בכלי טחונות הסניף העמוק הפרוקסימלי. לפיכך, ההשפעות הטיפוליות נמשכות בעיקר מאזור איסכמי הדיסטלי, אשר עולה בקנה אחד עם המיקום האנטומי (ירך anterolateral) שבו התרופה / החומר הוא שוחרר. במהלך ניתוח, חשוב לא לפגוע בעורק הירך השביר בגלל דימום מקומי יכול להוביל לדלקת ובצקת, מה שמשפיע הן arteriogenesis ואנגיוגנזה. אנו ממליצים להשתמש ב8-0 תפרי Prolene ולקשור את עורק הירך עם עניבת קשר מתאימה, כדי למנוע מתיחה, מתח, או קרע של העורק. בנוסף, Microfil יש להשתמש באופן מיידי (בתוך 20 דקות) לאחר ערבוב את 3 המרכיבים (תרכובת, מדלל, וסוכן ריפוי) כי זה polymerizes במהירות, אשר יוצר קשיים טכניים להזרקה. כמו בעבר staטד, Microfil לא תמיד בהצלחה perfuse כלי הדם הקטן יותר, אבל בפועל, ושימוש בטכניקות נכונות יכולים לעזור להתגבר על מגבלה זו.
נפח מילוי המשאבה חייב להיות מעל 90% מהיקף המילוי הממוצע, אם לא, אוויר נוסף עלול להילכד בתוך המשאבה. מידע טכני נוסף ממוקם בwww.alzet.com. בנוסף, סוכן Microfil חייב להיות בצמיגות המועדפת עבור יישום מסוים, ולכן היחס בין המדלל למתחם ייתכן שיהיה הצורך לשנות.
מודל איסכמיה hindlimb הוא לשעתקו מאוד והוא ישים PAD 10,11. האספקה היציבה של סוכנים טיפוליים במודל זה היא הכרחית כדי להשיג תוצאות אינפורמטיבי 2. לסיכום, טכניקת ההדמיה 3D השתמשנו כדי להמחיש את המבנים המורפולוגיים היא כלי מצוין לבדיקת כלי הדם והעכבר מספקת מערכת רב עוצמה לstudyiפתולוגיות כלי דם נג.
Disclosures
המחברים מצהירים שאין ניגוד העניינים. נהלי כל החיה שנערך בהתאם להנחיות לטיפול ושימוש בחי מעבדה ואושרו על ידי הטיפול בבעלי החיים מוסדיים ועדת שימוש (IACUC) באוניברסיטת טקסס למדעי בריאות המרכז ביוסטון.
Acknowledgements
המחברים מבקשים להודות למישל קית של מתקן MD Anderson הקטן בעלי חי ההדמיה לסיוע הטכני שלו עם מיקרו-CT, אדוארד TH יה, MD, לקבלת סיוע כירורגית, ורבקה Bartow, PhD, לסיוע מערכת. עבודה זו נתמכה בחלקו על ידי איגוד הלב האמריקאי.
Materials
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| Surgical tools | Fine Science Tools | Type: Tool | |
| Puritan sterile cotton swabs | Fisher Scientific | 22-029-499 | Type: Tool |
| Betadine (povidone-iodine) | Fisher Scientific | 19-065534 | Type: Reagent |
| 70% Alcohol pads | Fisher Scientific | NC9926371 | Type: Reagent |
| Phosphate buffered saline | Lonza | 17-516F | Type: Reagent |
| 6-0 prolene suture | Cardinal Health | 8709 | Type: Tool |
| 8-0 prolene suture | Cardinal Health | 2775 | Type: Tool |
| Depilatory cream | Nair | Type: Tool | |
| Osmotic pump |  ALZET ALZET | 1002 | Type: Tool, 14 day release |
| Vinyl catheter |  ALZET ALZET | 7760 | Type: Tool |
| Heparinized saline (0.9%) | Baxter | 2B0944 | Type: Reagent |
| Neutral buffered formalin | Richard-Allan Scientific | 5705 | Type: Reagent |
| Microfil (silicone rubber contrast agent) | Flowtech | MV-112 | Type Reagent, Microfil White |
| Cal-Ex II (formic acid solution) | Fisher Scientific | CS511-1D | Type: Reagent |
| Buprenex | CIII | 7571 | Type: Analgesic |
| Bupivicaine | Hospira, Inc. | 381 | Type: Analgesic |
| Equipment | |||
| Dissecting microscope | Carl Zeiss Microimaging | Zeiss Stemi 2000-C | Type:Equipment |
| Laser Doppler perfusion imager | Perimed Inc. | Periscan PIM3 | Type:Equipment |
| Micro-CT imaging system | GE Healthcare | Explore Locus SP | Type:Equipment |
References
- Epstein, S. E., Fuchs, S., Zhou, Y. F., Baffour, R., Kornowski, R. Therapeutic interventions for enhancing collateral development by administration of growth factors: basic principles, early results and potential hazards. Cardiovasc. Res. 49, 532-542 (2001).
- Esaki, J., Marui, A., Tabata, Y., Komeda, M. Controlled release systems of angiogenic growth factors for cardiovascular diseases. Expert Opin. Drug Deliv. 4, 635-649 (2007).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, 1267-1279 (2002).
- Golomb, B. A., Dang, T. T., Criqui, M. H. Peripheral arterial disease: morbidity and mortality implications. Circulation. 114, 688-699 (2006).
- Hiatt, W. R. Pharmacologic therapy for peripheral arterial disease and claudication. J. Vasc. Surg. 36, 1283-1291 (2002).
- Hirsch, A. T., et al. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA. 286, 1317-1324 (2001).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat. Med. 9, 713-725 (2003).
- Hirsch, A. T., et al. ACC/AHA Guidelines for the Management of Patients with Peripheral Arterial Disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Associations for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (writing committee to develop guidelines for the management of patients with peripheral arterial disease)--summary of recommendations. J. Vasc. Interv. Radiol. 17, 1383-1397 (2006).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Losordo, D. W., Dimmeler, S. Therapeutic angiogenesis and vasculogenesis for ischemic disease. Part I: angiogenic cytokines. Circulation. 109, 2487-2491 (2004).
- Waters, R. E., Terjung, R. L., Peters, K. G., Annex, B. H. Preclinical models of human peripheral arterial occlusive disease: implications for investigation of therapeutic agents. J. Appl. Physiol. 97, 773-780 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved