Method Article
药物输送到微型计算机断层扫描成像缺血后肢血管灌注与微滤渗透
摘要
我们在这里展示的在体内插入渗透泵恒定的局部给药和后肢缺血小鼠模型中创建。此外,后肢血管灌流微滤,硅不透X线剂,准备为微型计算机断层扫描(微CT)成像。
摘要
外周动脉疾病的动物模型的临床前研究,在测试旨在刺激微循环的治疗药物的疗效起着至关重要的作用。发送方法的选择对这些药物的给药途径是非常重要的,因为这些药物的1,2深刻地影响着生物活性和疗效。在这篇文章中,我们将演示如何在本地使用插管的渗透泵服用一种物质,在缺血后肢。此泵可输送的配发的时间内将固定体积的水溶液,连续。我们也提出我们的普通股动脉,股深的起源和腹壁动脉,左后肢近端结扎单侧肢体缺血诱导的小鼠模型。最后,我们描述了在体内的插管和微滤,不透射线的聚硅氧烷铸件剂的腹主动脉和灌注的后肢血管结扎。微滤灌注填满整个血管床(动脉和静脉),因为我们已经退出结扎大血管导管,代理可以保留在血管未来体外成像小标本采用显微CT 3 。
引言
外周动脉疾病(PAD)是动脉粥样硬化的疾病,它引起在腿部4供血不足。它影响到8万至12万美国人,目前的医疗只能提供有限的救济5,6。改善腿部血液循环的新的治疗药物,不仅会抑制疾病的进展,但也提高生活质量。 PAD的发病率较高,50岁以上的人,所以当地的药物治疗是一种较为理想的治疗方式,因为减少的肾脏和肝功能经常出现在老年患者,可降低全身用药的药物代谢和增加副作用。
因此,我们创建了一个鼠标垫检查是否减轻局部给药制剂通过促进血管生成和血管重塑后肢缺血模型。具体而言,我们使用一个插管的渗透泵连续提供的治疗剂缺血小鼠大腿肌肉。使用我们的输送系统,我们可以在本地环境中,以保持最佳的药物浓度,这种方法允许适当的药物活性,避免了可能出现的全身性副作用,克服有限的局部药物接入与全身用药的缺点。此外,评估局部给药制剂是否促进血运重建,我们采用先进的铸造和高清晰度成像技术,使微血管变化的定量分析。总的来说,使用相结合的方法,在这个视频文章是有用的临床前研究,以帮助了解药物诱导的心肌血运重建术在PAD患者7-9。
研究方案
1。渗透泵灌注
- 准备泵时使用无菌技术( 如手套,层流罩)。从包装中取出泵和流量调节剂。称量空泵和记录的重量(mg)。
- 慢慢地注入泵,避免产生气泡,1cc的注射器用一个小钝头27G填充管。当溶液达到泵的顶部,停止填充。
- 擦去多余的解决方案和权衡填充泵。适合于大多数水溶液,重量以mg微升的体积相同。在空对填充重量的差异应该是90%以上的规定的平均填充量。如果没有,疏散用注射器泵和笔芯。如果您遇到技术困难,请参阅泵说明故障排除部分http://www.alzet.com/products/guide_to_use/filling.html
- 使用一双镊子打破白色法兰流moderat从的小心,不要弯曲或粉碎管。附加P50导管主持人任一端,占地约3-4毫米。用注射器填充的导管和连接的调节剂,留下的注射器安装在导管的末端部分。
- 将进入泵的流量调节剂,,直到导管与泵的表面齐平。然后,取出注射器从导管的前端。将泵在无菌的0.9%的生理盐水或PBS溶液,在37℃的培养箱至少6小时(最好是O / N)黄金植入到老鼠的前级泵。泵输送率随型号(型号1002 = 0.25微升/小时为14天)。
2。创建单侧肢体缺血的鼠标
- 麻醉小鼠用异氟醚集在2-4%之间,在100%O 2,流速为0.4升/分钟,并除去毛(最好是在手术前一天)上的后肢和背部区域与depilatoRY霜。
- 手术前,所有的外科手术工具消毒。鼠标放置在感应麻醉室。使用相同的麻醉第2.1节中描述的设置。
- 等待,直到鼠标是对外界刺激无反应,然后将其放置在一个配备提供了源源不断的异氟醚(1.5-2.0%)的鼻锥,俯卧位走上手术台。
- 切口部位注入麻药(布比卡因,0.25%(<1毫升/公斤))的推荐剂量为治疗皮肤用聚维酮碘溶液,然后用70%乙醇。做一个4-6毫米的切口的背面(上面侧的脊柱,在肩胛区域)。用细镊子分离皮下膜,然后转动鼠标仰卧位治疗皮肤用聚维酮碘溶液,然后用70%乙醇和0.8-1厘米的切口,用显微手术剪刀向大腿内侧膝盖以上,后股动脉路径。
- 隧道了躯干的小的鞘管(6 - 法国)从大腿内侧切口的背面侧。
- 鼠标放置在俯卧位。删除引物的渗透泵/从PBS溶液中的导管和引导导管,通过鞘管,在大腿上。
- 泵内部的背面的位置,并关闭后切口用6-0 prolene线缝合(治疗皮肤用聚维酮碘的溶液,然后用70%乙醇)。在仰卧位将鼠标背部;除去鞘管,离开导管通过切口暴露在大腿上。用外科手术胶带固定腿。
- 分离皮下脂肪组织揭示了血管。为了更好的可视化的血管,用牵开器打开切口。
- 皮尔斯股骨膜轻轻地用细尖头镊子访问维管束鞘。从股静脉和神经腹股沟附近的股动脉解剖和分离,照顾不造成前逐次出血。
- 放置两个8-0 prolene线相邻的缝合线中断股动脉近端股骨分叉(股深腹壁动脉起源)2-3毫米。
- 切导管到适当的长度,将尖到大腿前外侧区域,确保用6-0 prolene线缝合的浅筋膜,以确保靶向的物质。关闭腿切口缝合用6-0运行。管理最终皮下注射镇痛(丁丙诺啡0.1毫克/千克),治疗皮肤用聚维酮碘溶液,然后用70%乙醇和鼠标回到笼子里。在恢复过程中使用的加热灯。
- 经过30分钟的恢复期,准备鼠标激光多普勒成像技术确认创建后肢缺血。
- 术后第5天,每天两次监测动物。将观察到的动物的流动性来分析疼痛;在笼子里的废弃物将作为印度语ATOR吃。此外,在监视期间确定如果动物经历疼痛或不适,并给予丁丙诺啡(为0.1mg/kg),皮下注射,每天两次。
3。成像试样制备
- 在2.1节所列麻醉鼠标。鼠标传输走上手术台,在仰卧位。注入1,000 IU的肝素皮下注射,以防止在血管凝血。当鼠标被安装到鼻锥,大到足以暴露的胸腔和下腹部做一个切口。腹部器官移动的动物的左侧以暴露腹主动脉(IAA)。小心地分离主动脉,下腔静脉。
- 结扎近端IAA,导管插入过程中,以减少出血。然后,在IAA上做一个小切口。插入一个27½克钝针(附到P10导管)的IAA用6-0缝线固定。
- 填补两个20cc的注射器用肝素化生理盐水,10%中性福尔马林缓冲液中(NBF)。对比不透X线的硅橡胶复合填写一个5毫升的注射器。混合三种成分MV化合物:MV-MV稀释剂:固化剂比例为1:1.25:0.5工作。由于混合物(微滤)只有20分钟的工作时间代理聚合之前,值得推荐,直到正确的不添加的MV固化剂,注射到血管之前。
- 在右心房和管理作出削减了过量的异氟醚诱导安乐死和多余的液体,以便排水。将生理盐水充式注射器的针尖,并开始冲洗5分钟脉管。确保所有的血液会被冲出来的船只,关闭异氟醚和断开的nosecone开始冲洗一次。接下来,将在福尔马林充式注射器上文详述的(3.2)的导管和压力灌注5分钟。最后,灌注注射器,与对照剂,慢慢进入鼠标5分钟。
- 可选的脉管用照相机拍摄的微滤,以确保只有动脉结构灌注。
- 鼠标放置在一个容器充满10%NBF和储存于4°CO / N为造影剂聚合。 24小时后,去除皮肤上躯干的下半部分(低级腹主动脉结扎远端)通过使用清扫工具,更新10%NBF,鼠标放置到容器4天以上,在RT。
- 解剖对侧缺血后肢,并将标本中甲酸溶液(加州EX II)的48小时便利脱钙骨。然后,在流水下冲洗标本1小时,返回到10%的NBF进行Faxitron(X射线检测系统使用,以确保骨脱钙)和显微CT成像。
结果
动画演示渗透泵插入和后肢缺血手术在协议中详细说明。 图1显示了激光多普勒图像后肢灌注,缺血确认。与微滤血管铸型后,一个三维显微CT图像的血管网显示,微滤可以有效地填补船舶( 图2A),但不连续性可能会发生( 图2B)由于各种程序的因素( 例如 ,气泡,缺乏压力,粘度,微滤)。
动画传奇
- 鼠标放置在俯卧位,并在其背面侧的脊柱做一个切口。
- 揭露背面切口小。
- 鼠标放置在仰卧的姿势,膝盖以上的大腿内侧做一个小切口。
- 分离皮肤,暴露的血管,插入鞘管向上侧躯干的谅解备忘录E背部切口。
- 渗透泵,将导管插入鞘管。
- 鼠标放置在仰卧位和引导导管通过油管的切口在大腿。
- 鼠标放置在俯卧位和泵放置在它的后面,关闭切口。
- 鼠标放置在仰卧位,取出护套管。
- 皮肤与牵开器向后拉,并用显微外科工具,从动脉静脉分离。双击缝合结扎股动脉股分叉以上。
- 固定导管的浅表组织的大腿。
- 关闭腿切口的缝合。
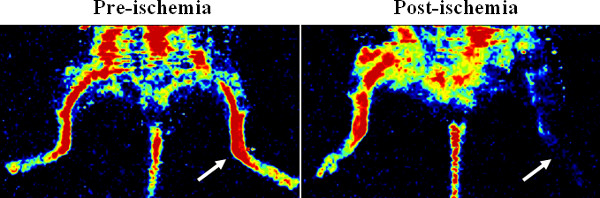
图1。代表多普勒图像笑确认通过激光多普勒血流灌注成像的下肢缺血。W在小鼠后肢股动脉结扎手术前后的血液灌注。创建于左后肢缺血(见箭头)。

图2。后肢血管的三维显微CT图像。揭示了网络的静脉和动脉血管铸造与微滤整个后肢(A)。也可能发生不连续的微滤(B)中 ,禁用了详细的血管网的可视化(见箭头)。
讨论
在这里,我们提出了一个方法渗透药物/物质后肢缺血小鼠模型的交付。此外,我们描述了一个铸造技术,其中我们已经使用微滤产生三维重建血管网的分析。
的水平或缺血严重程度不同,根据由动脉结扎/切除。我们创建了一个双重结扎股动脉近端股深和腹壁动脉的起源,这种方法可以产生更严重的缺血后肢远端。手术后一定要留意动物,并提供由当地镇痛药缓解疼痛。此外,微滤可能并不总是灌注肢体血管完全。因此,它是重要的,以确保所有的血液冲洗肝素生理盐水灌注后的血管。微滤灌注不全的原因包括缺乏pplied压力或不当粘度的微滤,这两者必须是足够的,以确保的微滤达到的最前端区域的后肢和从而填满整个血管。为了解决这些问题,应用一致的压力在100毫米汞柱和实验化合物:为特定的动物应用的稀释剂比例。
为了研究小动脉(预先存在的侧支血管生长),理想的方法是结扎股动脉,股深分支的起源侧支血管的血流量重定向立即远端。然而,这个程序的响应不同小鼠品系之间的广泛,缺血的程度可能不足以在某些小鼠品系( 如 C57BL / 6)。一个不太严重的缺血模型可能无法提供一个长期的时间窗口,大量血管C57BL / 6小鼠品系,如治疗效果调查。为了避免这些问题,我们创建了后肢缺血bŸ股骨近端动脉结扎,创建了一个更严重的缺血,以更好地展示了当地的药物释放的影响,但是,这种方法排除分析中的小动脉近端深支侧支血管。因此,绘制的治疗效果主要是从前端的缺血部位,释放药物/物质的解剖部位(大腿前外侧)是一致的。手术过程中,关键是不损害脆弱的股静脉,因为局部出血可导致炎症和水肿,影响小动脉和血管生成。我们建议使用8-0普理灵缝线结扎股动脉,用一个合适的结领带,以避免拉伸,应变,或动脉破裂。此外,微滤,必须立即使用,混合后的3成分(化合物,稀释剂,固化剂),因为它快速聚合,创建用于注射的技术困难(在20分钟之内)。正如前面站特德,微滤并不总是成功灌注血管较小,但实践和使用适当的技术可以帮助克服这个限制。
泵填充体积必须是超过90%的平均填充量,若否,多余的空气可能会被困在泵内。额外的技术信息位于www.alzet.com的 。此外,必须在微滤剂的优选的粘度为一个特定的应用程序,所以可能需要进行修改,稀释剂化合物的比例。
后肢缺血模型是高度可重复性和是适用于PAD 10,11的 。在这个模型中的治疗剂的稳定的交是必要的取得信息的结果2。总之,我们用可视化的形态结构的三维成像技术检查鼠标血管,是一个极好的工具,提供了强大的系统studyi纳克血管病症。
披露声明
作者宣称没有利益冲突。所有动物的程序进行,按照实验动物的护理和使用指引,并获批准的机构动物护理和使用委员会(IACUC)在得克萨斯大学健康科学中心在休斯敦大学。
致谢
笔者想感谢他的技术援助与显微CT成像,爱德华TH叶MD,手术援助,丽贝卡·巴托博士MD安德森小动物成像设备的基思·米歇尔,社论援助。部分支持这项工作是由美国心脏协会。
材料
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| Surgical tools | Fine Science Tools | Type: Tool | |
| Puritan sterile cotton swabs | Fisher Scientific | 22-029-499 | Type: Tool |
| Betadine (povidone-iodine) | Fisher Scientific | 19-065534 | Type: Reagent |
| 70% Alcohol pads | Fisher Scientific | NC9926371 | Type: Reagent |
| Phosphate buffered saline | Lonza | 17-516F | Type: Reagent |
| 6-0 prolene suture | Cardinal Health | 8709 | Type: Tool |
| 8-0 prolene suture | Cardinal Health | 2775 | Type: Tool |
| Depilatory cream | Nair | Type: Tool | |
| Osmotic pump |  ALZET ALZET | 1002 | Type: Tool, 14 day release |
| Vinyl catheter |  ALZET ALZET | 7760 | Type: Tool |
| Heparinized saline (0.9%) | Baxter | 2B0944 | Type: Reagent |
| Neutral buffered formalin | Richard-Allan Scientific | 5705 | Type: Reagent |
| Microfil (silicone rubber contrast agent) | Flowtech | MV-112 | Type Reagent, Microfil White |
| Cal-Ex II (formic acid solution) | Fisher Scientific | CS511-1D | Type: Reagent |
| Buprenex | CIII | 7571 | Type: Analgesic |
| Bupivicaine | Hospira, Inc. | 381 | Type: Analgesic |
| Equipment | |||
| Dissecting microscope | Carl Zeiss Microimaging | Zeiss Stemi 2000-C | Type:Equipment |
| Laser Doppler perfusion imager | Perimed Inc. | Periscan PIM3 | Type:Equipment |
| Micro-CT imaging system | GE Healthcare | Explore Locus SP | Type:Equipment |
参考文献
- Epstein, S. E., Fuchs, S., Zhou, Y. F., Baffour, R., Kornowski, R. Therapeutic interventions for enhancing collateral development by administration of growth factors: basic principles, early results and potential hazards. Cardiovasc. Res. 49, 532-542 (2001).
- Esaki, J., Marui, A., Tabata, Y., Komeda, M. Controlled release systems of angiogenic growth factors for cardiovascular diseases. Expert Opin. Drug Deliv. 4, 635-649 (2007).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, 1267-1279 (2002).
- Golomb, B. A., Dang, T. T., Criqui, M. H. Peripheral arterial disease: morbidity and mortality implications. Circulation. 114, 688-699 (2006).
- Hiatt, W. R. Pharmacologic therapy for peripheral arterial disease and claudication. J. Vasc. Surg. 36, 1283-1291 (2002).
- Hirsch, A. T., et al. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA. 286, 1317-1324 (2001).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat. Med. 9, 713-725 (2003).
- Hirsch, A. T., et al. ACC/AHA Guidelines for the Management of Patients with Peripheral Arterial Disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Associations for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (writing committee to develop guidelines for the management of patients with peripheral arterial disease)--summary of recommendations. J. Vasc. Interv. Radiol. 17, 1383-1397 (2006).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Losordo, D. W., Dimmeler, S. Therapeutic angiogenesis and vasculogenesis for ischemic disease. Part I: angiogenic cytokines. Circulation. 109, 2487-2491 (2004).
- Waters, R. E., Terjung, R. L., Peters, K. G., Annex, B. H. Preclinical models of human peripheral arterial occlusive disease: implications for investigation of therapeutic agents. J. Appl. Physiol. 97, 773-780 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。