Method Article
Osmótica Drug Delivery de miembros posteriores isquémicos y la perfusión de la vasculatura con Microfil para Micro-tomografía computarizada
* Estos autores han contribuido por igual
En este artículo
Resumen
Mostramos aquí la In vivo Inserción de una bomba osmótica para la administración local de fármacos constante y la creación de isquemia de extremidad posterior en un modelo de ratón. Por otra parte, la vasculatura miembro posterior se perfunde con Microfil, un agente radiopaco de silicona, para prepararse para la tomografía micro-computarizada (micro-TC).
Resumen
La investigación preclínica en modelos animales de enfermedad arterial periférica juega un papel vital en la prueba de la eficacia de los agentes terapéuticos diseñados para estimular la microcirculación. La elección del método de entrega para estos agentes es importante porque la vía de administración afecta profundamente a la bioactividad y la eficacia de estos agentes de 1,2. En este artículo se demuestra cómo administrar localmente una sustancia en miembros posteriores isquémicas mediante una bomba osmótica sondaje. Esta bomba puede suministrar un volumen fijo de solución acuosa de forma continua durante un período de tiempo asignado. También presentamos nuestro modelo de ratón de isquemia de extremidad posterior unilateral inducida por la ligadura de la arteria femoral común proximal al origen de la femoral profunda y arterias epigástrica en la pata trasera izquierda. Por último, se describe en la canulación in vivo y la ligadura de la aorta abdominal infrarrenal y la perfusión de la vasculatura del miembro posterior con Microfil, un agente radiopaco de fundición de silicona. Microfil puede perfundir y llenar todo el lecho vascular (arterial y venoso), y porque hemos ligó el conducto vascular mayor para la salida, el agente puede ser retenido en la vasculatura para el futuro de formación de imágenes ex vivo con el uso de la pequeña muestra de micro-CT 3 .
Introducción
La enfermedad arterial periférica (PAD) es una enfermedad aterosclerótica que causa suministro insuficiente de sangre en las piernas 4. Afecta 8-12000000 estadounidenses, y los tratamientos médicos actuales sólo ofrecen un alivio limitado 5,6. Nuevos agentes terapéuticos que mejoran la circulación sanguínea en las piernas no sólo se frene la progresión de la enfermedad, sino también mejorar la calidad de vida. La incidencia de la PAD es mayor en personas mayores de 50 años, la terapia farmacológica tan local es una modalidad de tratamiento más deseable debido a que la reducción de la función hepática y renal a menudo en pacientes de mayor edad pueden disminuir el metabolismo de drogas y aumentar los efectos secundarios con la administración sistémica.
Por lo tanto, hemos creado un modelo de ratón de la EAP para examinar si los agentes administrados localmente aliviar la isquemia miembro posterior al promover la angiogénesis y el remodelado microvascular. Específicamente, se utilizó una bomba osmótica sondaje para suministrar continuamente el agente terapéutico a laisquémica del músculo del muslo de ratones. Utilizando el sistema de entrega, hemos sido capaces de mantener concentraciones óptimas de la droga en el entorno local; este enfoque permite una bioactividad medicamento apropiado, evita los efectos secundarios sistémicos, y supera la desventaja de acceso limitado local de drogas asociados con la administración sistémica. Además, para evaluar si los agentes administrados localmente promueven la revascularización, se utilizó fundición avanzada y las técnicas de imagen de alta definición que permiten la cuantificación de los cambios en la microvasculatura. En conjunto, la combinación de las metodologías utilizadas en este artículo de vídeo es útil en estudios preclínicos para ayudar en la comprensión de revascularización inducida farmacológicamente en los pacientes con PAD 7-9.
Protocolo
1. Cebado de la bomba osmótica
- Utilizar técnicas estériles (por ejemplo, guantes, campana de flujo laminar) en la preparación de las bombas. Retire la bomba y el moderador de flujo del embalaje. Pesar la bomba de vacío y registre el peso (mg).
- Llene la bomba lentamente, para evitar la creación de burbujas de aire, mediante el uso de una jeringa pequeña de 1 cc y de punta roma tubo de llenado 27G. Cuando la solución alcanza la parte superior de la bomba, pare de llenado.
- Limpie el exceso de solución y pesar la bomba de llenado. Para la mayoría de soluciones acuosas, el peso en mg es el mismo que el volumen en l. La diferencia en el peso en vacío frente llena debe ser más de 90% del volumen de llenado media especificada. Si no, evacuar la bomba con la jeringa y volver a llenar. Si tiene algún problema técnico, por favor consulte la sección de solución de problemas de las instrucciones de la bomba en http://www.alzet.com/products/guide_to_use/filling.html
- Use un par de pinzas para romper el ala blanca de la moderat flujoo, tenga cuidado de no doblar o aplastar el tubo. Adjuntar un catéter P50 a cualquiera de los extremos del moderador, que abarca alrededor de 3-4 mm. Usar una jeringa para llenar el catéter y adjunta moderador y salir de la jeringa unida a la parte distal del catéter.
- Insertar el moderador de flujo en la bomba hasta que el catéter esté a ras con la superficie de la bomba. A continuación, retirar la jeringa desde el extremo distal del catéter. Coloque la bomba en un 0,9% de solución salina estéril o solución de PBS en una incubadora de 37 ° C durante un mínimo de 6 horas (preferiblemente O / N) para cebar la bomba antes de implantarlo en el ratón. El caudal de la bomba varía con el número de modelo (por ejemplo, Modelo 1002 = 0,25 l / h durante 14 días).
2. Creación de isquemia del miembro posterior unilateral en el ratón
- Se anestesia a los ratones con isoflurano conjunto entre 2-4% en 100% de O 2 a una velocidad de flujo de 0,4 L / min y eliminar el vello (preferentemente el día antes de la cirugía) en la zona de extremidad posterior y la parte posterior con un depilatocrema ry.
- Esterilice todos los instrumentos quirúrgicos antes de la cirugía. Coloque el ratón en la cámara de la inducción anestésica. Usar la misma configuración de la anestesia en la Sección 2.1.
- Espere hasta que el ratón no responde a los estímulos externos y luego se coloca en decúbito prono sobre la mesa de operaciones con un cono de nariz amueblada que ofrece un flujo continuo de isoflurano (1,5 a 2,0%).
- Inyectar la dosis recomendada de anestésico (bupivacaína; 0,25% (<1 ml / kg)) en el sitio de la incisión; tratar la piel con una solución de povidona-yodo seguido por etanol al 70%. Hacer una incisión de 4-6 mm en la parte posterior (en el lado de la columna vertebral, en la región de la escápula). Separe la membrana subcutánea con unas pinzas finas, luego gire el ratón a la posición supina tratar la piel con una solución de yodo-povidona seguido de etanol al 70% y hacer 0.8-1 cm incisión con tijeras micro-quirúrgica sobre la rodilla hacia el muslo, siguiendo el camino de la arteria femoral.
- Túnel de lalado del torso con un tubo de vaina pequeña (6-francés) de la parte media del muslo a la incisión en la parte posterior.
- Coloque el ratón en la posición prona. Retire la bomba / catéter osmótica cebado de la solución de PBS y guiar el catéter, a través de la tubería de revestimiento, para el muslo.
- Coloque la bomba en el interior de la parte trasera y cerrar la incisión de vuelta con 6-0 sutura de prolene (tratamiento de la piel con una solución de yodo-povidona seguido de etanol al 70%). Coloque la parte posterior del ratón en la posición de decúbito supino; quitar el tubo de vaina, dejando el catéter expuesto a través de la incisión en el muslo. Asegure la pierna con cinta quirúrgica.
- Separe el tejido subcutáneo de grasa para revelar la vasculatura. Para visualizar mejor la vasculatura, utilizar un retractor para abrir la incisión.
- Pierce la vaina femoral membranosa suavemente con unas pinzas de punta fina para acceder al paquete vascular. Diseccionar y separar la arteria femoral de la vena femoral y el nervio cerca de la ingle, con cuidado de no causar exsangrado excesivo.
- Coloque dos 8-0 suturas de prolene adyacentes para interrumpir la arteria femoral 2-3 mm proximal a la bifurcación femoral (el origen de la femoral profunda y arterias epigástrica).
- Cortar el catéter a la longitud adecuada y coloque la punta a la región anterolateral del muslo, fijándolo con una sutura de prolene 6-0 a la fascia superficial para asegurar la entrega específica de la sustancia. Cierre la incisión de la pierna con una sutura continua 6-0. Administrar una última inyección subcutánea de analgésico (buprenorfina, 0,1 mg / kg), el tratamiento de la piel con una solución de povidona yodada seguido de etanol al 70% y devolver el ratón a la jaula. Utilice una lámpara de calentamiento durante la recuperación.
- Después de un período de recuperación de 30 minutos, prepare el ratón por láser Doppler para confirmar la creación de la isquemia de extremidades posteriores.
- Controle el animal dos veces al día durante 5 días después de la cirugía. La movilidad del animal se observó para analizar el dolor; residuos en la jaula servirá como un Indicdor de comer. Además, durante el período de monitor de determinar si el animal está experimentando dolor o malestar y dar una inyección subcutánea de buprenorfina (0.1mg/kg) dos veces al día.
3. Imágenes Preparación de Muestras
- Anestesiar el ratón como se indica en el apartado 2.1. Transferir el ratón sobre la mesa de operaciones en posición supina. Inyectar 1.000 UI de heparina por vía subcutánea para prevenir la coagulación en la vasculatura. Mientras que el ratón está unido a la ojiva, hacer una incisión lo suficientemente grande como para exponer la cavidad torácica y la parte inferior del abdomen. Mover los órganos abdominales hacia el lado izquierdo del animal para exponer la aorta abdominal infrarrenal (IAA). Separe cuidadosamente la aorta de la vena cava inferior.
- Ligar el IAA proximal para reducir la hemorragia durante la inserción del catéter. A continuación, hacer una pequeña incisión en el IAA. Inserte un 27 ½ T contundente aguja (unido a un catéter P10) en el IAA y fijarlo con una sutura de 6-0.
- Llenar dosJeringas de 20 cc con solución salina heparinizada y 10% neutros formalina tamponada (MNB). Llene una jeringa de 5 cc con un compuesto de caucho de silicona radiopaca contraste. Mezclar los tres ingredientes de MV-compuesto: MV-disolvente: MV agente de curado de los ratios de trabajo de 1:1.25:0.5. Dado que la mezcla (Microfil) sólo tiene un tiempo de trabajo de 20 minutos antes de la polimeriza el agente, se recomienda no agregar el agente MV-curado hasta justo antes de la inyección en el sistema vascular.
- Haga un corte en la aurícula derecha y administrar una sobredosis de isoflurano para inducir la eutanasia y para permitir el drenaje del exceso de líquido. Conecte la jeringa llena de solución salina a la punta de la aguja y comenzar a limpiar los vasos durante 5 min. Asegúrese de que toda la sangre se inunda de los vasos; apagar el isoflurano y desconecte la ojiva, una vez que comience el lavado. A continuación, conecte la jeringa llena de formol al catéter detallado anteriormente (3.2) y perfuse presión durante otros 5 min. Por último, la perfusión de la última jeringuilla, con el contrasteagente, poco a poco en el ratón durante 5 min.
- Opcional: Fotografía del Microfil en la vasculatura con una cámara para asegurarse de que sólo la estructura arterial es perfundido.
- Coloque el ratón en un recipiente lleno con NBF al 10% y se almacena a 4 ° CO / N para la polimerización de agente de contraste. Después de 24 horas, quitar la piel en la mitad inferior del torso (distal a la ligadura de la aorta abdominal inferior) mediante el uso de herramientas de disección, actualizar la NBF 10%, y colocar el ratón en el contenedor durante 4 días más a TA.
- Diseccionar las extremidades posteriores y contralateral isquémica, y colocar las muestras en una solución de ácido fórmico (Cal-Ex II) durante 48 horas para facilitar la descalcificación del hueso. A continuación, lavar las muestras con agua corriente durante 1 hora y volver al 10% NBF y proceder con Faxitron (sistema de rayos x utiliza para asegurarse que el hueso está descalcificada) y micro-TC.
Resultados
La animación demuestra la inserción de la bomba osmótica y la cirugía isquemia miembro posterior se detalla en el protocolo. Figura 1 muestra imágenes de láser Doppler de la perfusión de la extremidad posterior, lo que confirma la isquemia. Después de la colada vascular con Microfil, una imagen micro-CT 3D de la red vascular muestra que Microfil puede llenar los vasos efectivamente (Figura 2A), pero puede ocurrir que las discontinuidades (Figura 2B) debido a diversos factores de procedimiento (por ejemplo, burbujas de aire, la falta de la presión, la viscosidad de la Microfil).
Animación Leyenda
- Coloque el ratón en la posición de decúbito prono y hacer una incisión en la espalda en el lado de la columna vertebral.
- Exponer la pequeña incisión posterior.
- Coloque el ratón en la posición supina y hacer una pequeña incisión por encima de la rodilla al muslo.
- Separar la piel, exponer el sistema vascular, e insertar el tubo de la vaina hasta el tronco lateral del mouse para la incisión posterior.
- Tome la bomba osmótica e inserte el catéter en el tubo de vaina.
- Coloque el ratón en la posición supina y guiar el catéter hacia abajo a través de la tubería a la incisión en el muslo.
- Coloque el ratón en la posición boca abajo y colocar la bomba en la espalda y cerrar la incisión.
- Coloque el ratón en la posición supina y retire el tubo vaina.
- Tire hacia atrás de la piel con un retractor y el uso de herramientas de microcirugía para separar la vena de la arteria. Doble ligar la arteria femoral por encima de la bifurcación femoral con sutura.
- Asegure el catéter hasta el tejido superficial del muslo.
- Cierre la incisión de la pierna con suturas.
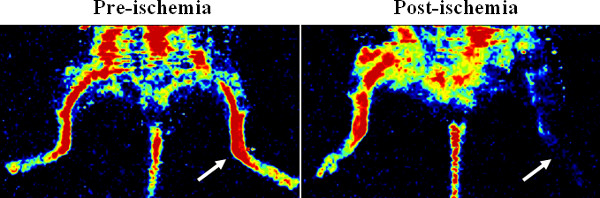
Figura 1. Confirmación de la isquemia de extremidad posterior a través de imágenes de perfusión de láser Doppler. El representante Doppler imágenes show la perfusión de la sangre antes y después de la ligadura quirúrgica de la arteria femoral en la extremidad posterior del ratón. La isquemia se creó en el miembro posterior izquierdo (ver las flechas).

Figura 2. Imagen micro-CT 3D de la extremidad posterior vasculatura. Fundición vascular con Microfil revela una red de venas y arterias a lo largo de la extremidad posterior (A). La discontinuidad de la Microfil también puede ocurrir (B), la desactivación de la visualización de una red vascular detallada (véase las flechas).
Discusión
Aquí presentamos un método para la administración de fármacos / sustancias osmótica en un modelo murino de isquemia de extremidad posterior. Además, se describe una técnica de colada en el que hemos utilizado Microfil para producir una reconstrucción 3D para el análisis de la red vascular.
El nivel o la gravedad de la isquemia varía según el lugar donde se realiza la ligadura / resección arterial. Hemos creado una doble ligadura en la arteria femoral común proximal al origen de la femoral profunda y arterias epigástrica; este enfoque puede producir una isquemia más severa en el miembro posterior distal. Asegúrese de controlar a los animales después de la cirugía y aliviar el dolor mediante la administración local de los analgésicos. Además, la Microfil no puede siempre perfundir vasculatura extremidad completamente. Por lo tanto, es importante asegurarse de que toda la sangre se enjuaga fuera de la vasculatura después de la perfusión de la solución salina heparinizada. Razones para la perfusión incompleta de la Microfil incluyen la falta de unpresión pplied o viscosidad inadecuada de la Microfil, ambos de los cuales deben ser adecuados para garantizar la Microfil alcanza las regiones más distales de la extremidad posterior y por lo tanto llena toda la vasculatura. Para abordar estas cuestiones, aplicar una presión constante a 100 mmHg y experimentar con el compuesto: relaciones diluyentes para la aplicación animal en particular.
Para estudiar arteriogénesis (crecimiento arterial colateral pre-existente), el enfoque ideal es para ligar la arteria femoral inmediatamente distal al origen de la rama femoral profunda para redirigir el flujo de sangre a los vasos colaterales. Sin embargo, la respuesta a este procedimiento varía ampliamente entre las cepas de ratón, y la extensión de la isquemia puede ser insuficiente en algunas cepas de ratón (por ejemplo, ratones C57BL / 6). Un modelo de isquemia menos severa puede no proporcionar una ventana de tiempo prolongado para investigar los efectos terapéuticos en las cepas de ratón fuertemente vascularizados tales como C57BL / 6. Para evitar estos problemas, hemos creado extremidad posterior isquemia by ligación de la arteria femoral proximal, que creó una isquemia más severa para demostrar mejor los efectos locales de liberación del fármaco, sin embargo, este enfoque impide el análisis de la arteriogénesis en los profundos vasos colaterales rama proximal. Por lo tanto, los efectos terapéuticos se elaboran principalmente de la región isquémica distal, lo cual es consistente con la localización anatómica (cara anterolateral del muslo) donde se libera el fármaco / sustancia. Durante la cirugía, es fundamental no lesionar la vena femoral frágil debido a la hemorragia local puede llevar a la inflamación y el edema, que afectan tanto arteriogénesis y la angiogénesis. Recomendamos el uso de suturas de prolene 8-0 para ligar la arteria femoral con un lazo nudo adecuado para evitar estiramiento, deformación o rotura de la arteria. Además, Microfil debe ser utilizado inmediatamente (dentro de 20 min) después de mezclar los ingredientes (compuesto 3, diluyente, y el agente de curado), ya que polimeriza rápidamente, lo que crea dificultades técnicas para la inyección. Como ya staTed, Microfil no siempre perfundir con éxito la vasculatura más pequeño, pero la práctica y el uso de las técnicas adecuadas puede ayudar a superar esta limitación.
El volumen de llenado de la bomba debe ser más del 90% de la media del volumen de llenado, y si no, el aire adicional puede quedar atrapado dentro de la bomba. La información técnica adicional se encuentra en www.alzet.com . Además, el agente Microfil debe estar en la viscosidad preferida para una aplicación particular, por lo que puede necesitar la relación de diluyente a compuesto que ser modificado.
El modelo de isquemia de extremidad posterior es altamente reproducible y es aplicable a PAD 10,11. Es necesario para obtener resultados informativos 2 La entrega estable de agentes terapéuticos en este modelo. En conclusión, la técnica de imagen en 3D se utilizó para visualizar las estructuras morfológicas es una excelente herramienta para examinar la vasculatura del ratón y proporciona un potente sistema de studyipatologías vasculares NG.
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses. Todos los procedimientos con animales se realizaron de conformidad con las Directrices para el Cuidado y Uso de Animales de Laboratorio y fueron aprobados por el Cuidado de Animales institucional y el empleo Comisión (IACUC) de la Universidad de Texas Health Science Center en Houston.
Agradecimientos
Los autores desean agradecer a Keith Michel del Anderson Pequeño Fondo imágenes Animal MD por su asistencia técnica a micro-TC, Edward TH Yeh, MD, para la asistencia quirúrgica y Rebecca Bartow, PhD, por su asistencia editorial. Este trabajo fue apoyado en parte por la Asociación Americana del Corazón.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| Surgical tools | Fine Science Tools | Type: Tool | |
| Puritan sterile cotton swabs | Fisher Scientific | 22-029-499 | Type: Tool |
| Betadine (povidone-iodine) | Fisher Scientific | 19-065534 | Type: Reagent |
| 70% Alcohol pads | Fisher Scientific | NC9926371 | Type: Reagent |
| Phosphate buffered saline | Lonza | 17-516F | Type: Reagent |
| 6-0 prolene suture | Cardinal Health | 8709 | Type: Tool |
| 8-0 prolene suture | Cardinal Health | 2775 | Type: Tool |
| Depilatory cream | Nair | Type: Tool | |
| Osmotic pump |  ALZET ALZET | 1002 | Type: Tool, 14 day release |
| Vinyl catheter |  ALZET ALZET | 7760 | Type: Tool |
| Heparinized saline (0.9%) | Baxter | 2B0944 | Type: Reagent |
| Neutral buffered formalin | Richard-Allan Scientific | 5705 | Type: Reagent |
| Microfil (silicone rubber contrast agent) | Flowtech | MV-112 | Type Reagent, Microfil White |
| Cal-Ex II (formic acid solution) | Fisher Scientific | CS511-1D | Type: Reagent |
| Buprenex | CIII | 7571 | Type: Analgesic |
| Bupivicaine | Hospira, Inc. | 381 | Type: Analgesic |
| Equipment | |||
| Dissecting microscope | Carl Zeiss Microimaging | Zeiss Stemi 2000-C | Type:Equipment |
| Laser Doppler perfusion imager | Perimed Inc. | Periscan PIM3 | Type:Equipment |
| Micro-CT imaging system | GE Healthcare | Explore Locus SP | Type:Equipment |
Referencias
- Epstein, S. E., Fuchs, S., Zhou, Y. F., Baffour, R., Kornowski, R. Therapeutic interventions for enhancing collateral development by administration of growth factors: basic principles, early results and potential hazards. Cardiovasc. Res. 49, 532-542 (2001).
- Esaki, J., Marui, A., Tabata, Y., Komeda, M. Controlled release systems of angiogenic growth factors for cardiovascular diseases. Expert Opin. Drug Deliv. 4, 635-649 (2007).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, 1267-1279 (2002).
- Golomb, B. A., Dang, T. T., Criqui, M. H. Peripheral arterial disease: morbidity and mortality implications. Circulation. 114, 688-699 (2006).
- Hiatt, W. R. Pharmacologic therapy for peripheral arterial disease and claudication. J. Vasc. Surg. 36, 1283-1291 (2002).
- Hirsch, A. T., et al. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA. 286, 1317-1324 (2001).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat. Med. 9, 713-725 (2003).
- Hirsch, A. T., et al. ACC/AHA Guidelines for the Management of Patients with Peripheral Arterial Disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Associations for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (writing committee to develop guidelines for the management of patients with peripheral arterial disease)--summary of recommendations. J. Vasc. Interv. Radiol. 17, 1383-1397 (2006).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Losordo, D. W., Dimmeler, S. Therapeutic angiogenesis and vasculogenesis for ischemic disease. Part I: angiogenic cytokines. Circulation. 109, 2487-2491 (2004).
- Waters, R. E., Terjung, R. L., Peters, K. G., Annex, B. H. Preclinical models of human peripheral arterial occlusive disease: implications for investigation of therapeutic agents. J. Appl. Physiol. 97, 773-780 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados