Method Article
Osmotique Drug Delivery à hindlimbs ischémiques et la perfusion de la vascularisation avec Microfil pour Micro-en tomodensitométrie
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous montrons ici l' In vivo Insertion d'une pompe osmotique pour la livraison locale de médicament constant et la création d'ischémie des membres postérieurs dans un modèle de souris. En outre, le système vasculaire des membres postérieurs est perfusé avec Microfil, un agent radio-opaque de silicone, pour se préparer à micro-tomographie par ordinateur (micro-TDM).
Résumé
La recherche préclinique dans des modèles animaux de la maladie artérielle périphérique joue un rôle vital à tester l'efficacité des agents thérapeutiques visant à stimuler la microcirculation. Le choix de la méthode de prestation de ces agents est importante parce que la voie d'administration affecte profondément la bioactivité et l'efficacité de ces agents 1,2. Dans cet article, nous démontrons comment administrer localement une substance dans les membres postérieurs ischémiques en utilisant une pompe osmotique cathétérisé. Cette pompe peut délivrer un volume fixe de solution aqueuse continue pendant un temps donné. Nous vous présentons également notre modèle murin d'ischémie des membres postérieurs unilatérale induite par la ligature de l'artère fémorale commune proximale à l'origine de la fémorale profonde et les artères epigastrica dans la patte arrière gauche. Enfin, nous décrivons la canule dans vivo et la ligature de l'aorte abdominale sous-rénale et la perfusion de la vascularisation des membres postérieurs avec Microfil, un agent de casting radio-opaque de silicone. Microfil peut perfuser et remplir la totalité du lit vasculaire (artériel et veineux), et parce que nous avons ligaturé le conduit vasculaire majeur pour la sortie, l'agent peut être conservé dans le système vasculaire pour l'avenir imagerie ex vivo avec l'utilisation de petit spécimen micro-CT 3 .
Introduction
La maladie artérielle périphérique (MAP) est une maladie athéroscléreuse qui provoque un apport sanguin insuffisant dans les jambes 4. Elle affecte de 8 à 12 millions d'Américains, et les traitements médicaux actuels offrent seulement un soulagement limité de 5,6. Agents thérapeutiques novateurs qui améliorent la circulation sanguine dans les jambes ne seraient pas seulement contenir la progression de la maladie, mais aussi d'améliorer la qualité de vie. L'incidence de la PAD est plus élevé chez les personnes âgées de plus de 50 ans, la pharmacothérapie afin local est une modalité de traitement plus souhaitable parce que l'insuffisance rénale et hépatique souvent observée chez les patients plus âgés peuvent diminuer le métabolisme des médicaments et augmenter les effets secondaires de l'administration systémique.
Ainsi, nous avons créé un modèle murin de la PAD pour examiner si les agents administrés localement soulager l'ischémie des membres postérieurs en favorisant l'angiogenèse et le remodelage microvasculaire. Plus précisément, nous avons utilisé une pompe osmotique cathétérisé à délivrer en permanence l'agent thérapeutique à l'muscle de la cuisse de la souris ischémique. Grâce à notre système de livraison, nous avons pu maintenir les concentrations optimales de la drogue dans l'environnement local, cette approche permet de bioactivité de médicament approprié, permet d'éviter les effets secondaires possibles systémiques, et de surmonter l'inconvénient d'accès local de drogue limitée associée à l'administration systémique. En outre, afin de déterminer si des agents administrés localement promouvoir revascularisation, nous avons utilisé coulée de pointe et des techniques d'imagerie haute définition qui permettent la quantification des changements dans le système microvasculaire. Collectivement, la combinaison des méthodes utilisées dans cet article de vidéo est utile dans des études précliniques afin d'aider à la compréhension de revascularisation pharmacologiquement induite chez les patients PAD 7-9.
Protocole
1. Amorçage de la pompe osmotique
- Utiliser des techniques stériles (gants, hotte à flux laminaire) lors de la préparation des pompes. Retirer la pompe et modérateur de la circulation de l'emballage. Peser la pompe vide et noter le poids (mg).
- Remplir la pompe lentement, pour éviter de créer des bulles d'air, à l'aide d'une petite seringue 1cc et bout arrondi tube de remplissage 27G. Lorsque la solution atteint la partie supérieure de la pompe, arrêter le remplissage.
- Essuyez l'excès de solution et peser la pompe remplie. Pour la plupart des solutions aqueuses, le poids en mg est le même que le volume en pi. La différence par rapport à vide remplie de poids doit être supérieur à 90% du volume de remplissage du moyen spécifié. Si non, évacuer la pompe avec la seringue et recharge. Si vous éprouvez des difficultés techniques s'il vous plaît se référer à la section de dépannage des instructions de la pompe à http://www.alzet.com/products/guide_to_use/filling.html
- Utilisez une paire de pinces pour briser la bride blanc de la Moderat de débitou en prenant soin de ne pas plier ou écraser le tube. Joindre un P50 cathéter à chaque extrémité de l'animateur, qui couvre environ 3-4 mm. Utilisation d'une seringue pour remplir le cathéter et jointe modérateur et laisser la seringue fixée à la partie distale du cathéter.
- Insérer le modérateur d'écoulement dans la pompe jusqu'à ce que le cathéter est en affleurement avec la surface de la pompe. Ensuite, retirer la seringue de l'extrémité distale du cathéter. Placer la pompe dans une saline à 0,9% stérile ou une solution PBS dans un incubateur à 37 ° C pendant un minimum de 6 heures (de préférence O / N) pour amorcer la pompe avant de l'implanter dans la souris. Le débit de la pompe varie avec le numéro de modèle (c.-modèle 1002 = 0,25 ul / h pendant 14 jours).
2. Création d'ischémie unilatérale membres postérieurs chez la souris
- Anesthésier les souris avec ensemble isoflurane entre 2-4% dans 100% d'O 2 à un débit de 0,4 L / min et enlever les poils (de préférence la veille de l'intervention) sur la zone des pattes arrière et le dos avec un depilatocrème ry.
- Stériliser tous les instruments chirurgicaux avant la chirurgie. Placez la souris dans la chambre de l'anesthésie par induction. Utilisez les mêmes paramètres d'anesthésie décrites à la section 2.1.
- Attendez jusqu'à ce que la souris n'est pas sensible aux stimuli extérieurs, puis le placer dans la position couchée sur la table d'opération avec un cône de nez équipée qui fournit un flux continu d'isoflurane (1,5-2,0%).
- Injecter la dose recommandée d'anesthésique (bupivacaïne; 0,25% (<1 ml / kg)) sur le site de l'incision; traiter la peau avec une solution de povidone-iode, suivie par l'éthanol à 70%. Faire une incision mm à l'arrière (au niveau du côté de la colonne vertébrale, dans la région des omoplates) 4-6. Séparer la membrane sous-cutanée avec une pince fine, puis remettez la souris à la position couchée traiter la peau avec une solution de povidone-iode suivie par 70% d'éthanol et de faire 0,8-1 cm incision avec des ciseaux micro-chirurgie-dessus du genou vers la cuisse médiale, suivant le trajet de l'artère fémorale.
- Tunnel jusqu'à l'côté du torse avec un tube de gaine petites (6-français) de la cuisse médiale de l'incision sur le dos.
- Placez la souris dans la position couchée. Retirer la pompe / cathéter osmotique amorcée à partir de la solution de PBS et guider le cathéter, à travers le tube de gaine, de la cuisse.
- Placez la pompe à l'intérieur du dos et fermer l'incision de retour avec 6-0 prolène suture (traiter la peau avec une solution de povidone-iode suivie par 70% d'éthanol). Placez le dos de la souris en position couchée; enlever le tube de gaine, laissant le cathéter exposés par l'incision sur la cuisse. Fixer la jambe avec du sparadrap.
- Séparer la graisse sous-cutanée des tissus de révéler le système vasculaire. Pour mieux visualiser la vascularisation, utiliser un écarteur pour ouvrir l'incision.
- Pierce la gaine fémorale membraneuse doucement à l'aide de pinces fines branches d'accéder au paquet vasculaire. Disséquer et séparer l'artère fémorale de la veine fémorale et le nerf près de l'aine, en prenant soin de ne pas causer exsaignement excessif.
- Placez deux 8-0 sutures adjacentes prolène pour interrompre l'artère fémorale 2-3 mm proximité de la bifurcation fémorale (à l'origine de la fémorale profonde et artères epigastrica).
- Couper le cathéter à la longueur appropriée et le placer à la pointe de la région antérolatérale de la cuisse, en le fixant avec un prolène suture à l'aponévrose superficielle pour assurer la livraison ciblée de la substance 6-0. Fermer l'incision à la jambe avec une suture de fonctionnement 6-0. Administrer une injection sous-cutanée de finale analgésique (Buprénorphine; 0,1 mg / kg), de traiter la peau avec une solution de povidone-iode suivie par 70% d'éthanol et de retourner la souris vers la cage. Utilisation d'une lampe de chauffage au cours de la reprise.
- Après une période de récupération de 30 min, préparer la souris pour l'imagerie laser à effet Doppler pour confirmer la création de l'ischémie des membres postérieurs.
- Surveiller l'animal deux fois par jour pendant 5 jours après la chirurgie. La mobilité de l'animal sera observée pour analyser la douleur; déchets dans la cage sera un indicteur de manger. En outre, pendant la période de surveillance de déterminer si l'animal éprouve de la douleur ou de l'inconfort et de donner une injection sous-cutanée de la buprénorphine (0.1mg/kg) deux fois par jour.
3. Préparation de l'échantillon d'imagerie
- Anesthésier la souris comme indiqué à la section 2.1. Transférer la souris sur la table d'opération en position couchée. Injecter 1000 UI d'héparine sous-cutanée pour empêcher la coagulation dans le système vasculaire. Alors que la souris est fixé à la coiffe, faire une incision suffisamment grande pour exposer la cavité thoracique et de l'abdomen inférieur. Déplacez les organes abdominaux sur le côté gauche de l'animal afin d'exposer l'aorte abdominale sous-rénale (IAA). Séparez délicatement l'aorte de la veine cave inférieure.
- Ligaturer les IAA proximale à réduire les saignements lors de l'insertion du cathéter. Ensuite, faire une petite incision sur l'IAA. Insérez un 27 ½ G émoussé aiguille (attaché à un cathéter P10) dans l'IAA et le fixer avec une suture 6-0.
- Remplir deuxSeringues 20cc avec du sérum physiologique hépariné et 10% du formol tamponné (FBN). Remplir une seringue 5cc avec un composé de caoutchouc de silicone radio-opaque de contraste. Mélanger les trois ingrédients de MV-composé: MV-diluant: Agent MV-durcissement des ratios de travail de 1:1.25:0.5. Depuis le mélange (Microfil) ne dispose que d'un temps de travail de 20 minutes avant que l'agent se polymérise, il est recommandé de ne pas ajouter l'agent MV-cuisson jusqu'à ce que juste avant injection dans le système vasculaire.
- Faites une entaille dans l'oreillette droite et administrer une surdose d'isoflurane pour induire l'euthanasie et pour permettre le drainage de l'excès de liquide. Fixer la seringue rempli de solution saline à la pointe de l'aiguille et de commencer à purger le système vasculaire pendant 5 min. Assurez-vous tout le sang est rincé des navires; éteindre l'isoflurane et débranchez la coiffe une fois la chasse commence. Ensuite, fixez la seringue remplie de formol au cathéter détaillé ci-dessus (3.2) et perfuse de pression pour encore 5 min. Enfin, perfuser la dernière seringue, avec le contrasteagent lentement dans la souris pendant 5 min.
- En option: Photographier la Microfil dans le système vasculaire avec une caméra afin de s'assurer que seule la structure artérielle est perfusé.
- Placez la souris dans un récipient rempli avec 10% FBN et conserver à 4 ° CO / N pour la polymérisation de l'agent de contraste. Après 24 h, enlever la peau sur la partie inférieure du torse (en aval de la ligature de l'aorte abdominale basse) en utilisant des outils de dissection, actualisez la FBN 10%, et placer la souris dans le récipient pour 4 jours de plus à la température ambiante.
- Disséquer les membres postérieurs controlatéral et ischémiques, et de placer les échantillons dans une solution d'acide formique (Cal-Ex II) pendant 48 heures afin de faciliter la décalcification de l'os. Ensuite, rincer les échantillons à l'eau courante pendant 1 h et retour à 10% FBN et de procéder à Faxitron (système à rayons X utilisé pour assurer l'os décalcifié) et l'imagerie micro-CT.
Résultats
L'animation montre l'insertion de la pompe osmotique et la chirurgie de l'ischémie des membres postérieurs détaillés dans le protocole. Figure 1 montre laser Doppler images de perfusion du membre postérieur, confirmant une ischémie. Après la coulée vasculaire avec Microfil, une image 3D micro-CT du réseau vasculaire montre que Microfil peut remplir efficacement les vaisseaux (figure 2A), mais que les discontinuités peuvent se produire (figure 2B) en raison de divers facteurs de procédure (par exemple, les bulles d'air, le manque de la pression, la viscosité de la Microfil).
Animations Legend
- Placer la souris dans la position couchée et faire une incision sur sa face arrière au niveau du côté de la colonne vertébrale.
- Exposer la petite incision au dos.
- Placez la souris en position couchée et faire une petite incision au-dessus du genou à la cuisse médiale.
- Séparer la peau, exposer le système vasculaire, et insérer le tube de la gaine vers le haut du torse du côté de la mouse de l'incision en arrière.
- Prendre la pompe osmotique et insérer le cathéter dans le tuyau de gaine.
- Placez la souris en position couchée et guider le cathéter à travers le tube de l'incision à la cuisse.
- Placez la souris sur le ventre et placez la pompe sur son dos et fermer l'incision.
- Placez la souris en position couchée et retirer le tuyau de la gaine.
- Tirez la peau avec un écarteur et utiliser des outils de microchirurgie de séparer la veine de l'artère. Double ligaturer l'artère fémorale au-dessus de la bifurcation fémorale avec suture.
- Fixer le cathéter au tissu superficielle de la cuisse.
- Fermer l'incision à la jambe avec suture.
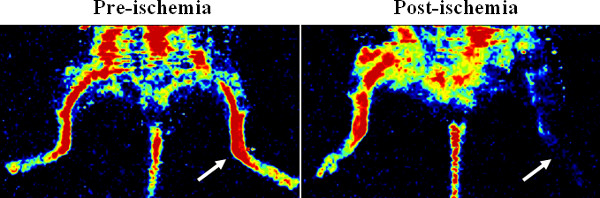
Figure 1. Confirmation de l'ischémie des membres postérieurs par laser Doppler perfusion imageur. Le représentant Doppler images show la perfusion de sang avant et après la ligature chirurgicale de l'artère fémorale dans la patte arrière de la souris. L'ischémie a été créé dans le membre postérieur gauche (voir les flèches).

Figure 2. Image 3D Micro-CT des membres postérieurs vasculaire. Coulée vasculaire avec Microfil révéler un réseau de veines et d'artères dans tout le membre postérieur (A). Discontinuité de la Microfil peut également se produire (B), la désactivation de la visualisation d'un réseau vasculaire détaillée (voir les flèches).
Discussion
Nous présentons ici une méthode pour la livraison de drogue / substance osmotique dans un modèle murin d'ischémie des membres postérieurs. En outre, nous décrivons une technique de moulage dans lequel nous avons utilisé Microfil pour produire une reconstruction 3D pour l'analyse du réseau vasculaire.
Le niveau ou la gravité de l'ischémie varie selon l'endroit où la ligature / excision artérielle est faite. Nous avons créé une double ligature de l'artère fémorale commune proximale à l'origine de la fémorale profonde et artères epigastrica; cette approche peut produire une ischémie plus sévère dans le membre postérieur distal. Assurez-vous de surveiller les animaux après la chirurgie et apportent un soulagement de la douleur par l'administration locale d'analgésiques. En outre, le Microfil peut pas toujours perfuser vascularisation des membres inférieurs complètement. Ainsi, il est important de veiller à ce que tout le sang est rincé de la vascularisation après la perfusion du sérum physiologique hépariné. Raisons pour perfusion incomplète de la Microfil comprennent l'absence d'unpplied pression ou de viscosité incorrecte du Microfil, qui tous deux doivent être suffisantes pour assurer la Microfil atteint les régions les plus distales des membres postérieurs et remplit ainsi l'ensemble du système vasculaire. Pour résoudre ces problèmes, appliquer une pression constante à 100 mmHg et expérimenter avec le composé: ratios de diluant pour l'application animal particulier.
Pour étudier artériogenèse (croissance de l'artère collatérale préexistante), l'approche idéale consiste à ligaturer l'artère fémorale immédiatement en aval de l'origine de la branche fémorale profonde pour rediriger le flux sanguin dans les vaisseaux collatéraux. Cependant, la réponse à cette procédure varie considérablement entre les souches de souris, et l'étendue de l'ischémie peut être insuffisant dans certaines souches de souris (par exemple, C57BL / 6). Un modèle ischémique moins sévère ne peut pas fournir une fenêtre de temps prolongée pour étudier les effets thérapeutiques dans lourdement souches de souris vascularisés comme C57BL / 6. Pour éviter ces problèmes, nous avons créé une ischémie des membres postérieurs by ligature de l'artère fémorale, qui a créé une ischémie plus sévère afin de mieux démontrer les effets locaux de libération de médicaments, mais cette approche exclut l'analyse des artériogenèse dans la profondeur des vaisseaux collatéraux de la branche proximale. Ainsi, les effets thérapeutiques sont tirées principalement de la région ischémique distale, ce qui est cohérent avec la localisation anatomique (antérolatérale de la cuisse) où le médicament / substance est libérée. Pendant la chirurgie, il est essentiel de ne pas blesser la veine fémorale fragile parce que le saignement local peut entraîner une inflammation et un oedème, qui affectent à la fois artériogenèse et l'angiogenèse. Nous vous recommandons d'utiliser 8-0 sutures prolène pour ligaturer l'artère fémorale avec une cravate nœud approprié pour éviter l'étiolement, la souche, ou une rupture de l'artère. En outre, Microfil doit être utilisé immédiatement (dans les 20 min) après le mélange des 3 ingrédients (composé, diluant et durcisseur) car il polymérise rapidement, ce qui crée des difficultés techniques pour l'injection. Comme précédemment staTed, Microfil n'a pas toujours réussi à perfuser le système vasculaire petit, mais pratique et l'utilisation de techniques appropriées peut aider à surmonter cette limitation.
Le volume de remplissage de la pompe doit être supérieure à 90% du volume de remplissage moyen, sinon air supplémentaire peut se retrouvent piégés à l'intérieur de la pompe. Des informations techniques complémentaires est situé à www.alzet.com . En outre, l'agent Microfil doit être à la viscosité préférée pour une application particulière, de sorte que le ratio de diluant composé peut avoir besoin d'être modifié.
Le modèle d'ischémie des membres postérieurs est hautement reproductible et est applicable à 10,11 PAD. La livraison stable d'agents thérapeutiques dans ce modèle est nécessaire pour obtenir des résultats instructifs 2. En conclusion, la technique d'imagerie 3D nous permet de visualiser les structures morphologiques est un excellent outil pour examiner la vascularisation de la souris et fournit un système puissant pour studyipathologies vasculaires ng.
Déclarations de divulgation
Les auteurs déclarent aucun conflit d'intérêt. Toutes les procédures d'animaux ont été effectuées en conformité avec les lignes directrices pour le soin et l'utilisation des animaux de laboratoire et ont été approuvés par le soin des animaux et du Comité institutionnel d'utilisation (IACUC) à l'Université du Texas Health Science Center à Houston.
Remerciements
Les auteurs tiennent à remercier Keith Anderson Michel de la petite installation d'imagerie animale MD pour son aide technique avec micro-imagerie CT, Edward TH Yeh, MD, de l'assistance chirurgicale et Rebecca Bartow, PhD, de l'assistance éditoriale. Ce travail a été financé en partie par l'American Heart Association.
matériels
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| Surgical tools | Fine Science Tools | Type: Tool | |
| Puritan sterile cotton swabs | Fisher Scientific | 22-029-499 | Type: Tool |
| Betadine (povidone-iodine) | Fisher Scientific | 19-065534 | Type: Reagent |
| 70% Alcohol pads | Fisher Scientific | NC9926371 | Type: Reagent |
| Phosphate buffered saline | Lonza | 17-516F | Type: Reagent |
| 6-0 prolene suture | Cardinal Health | 8709 | Type: Tool |
| 8-0 prolene suture | Cardinal Health | 2775 | Type: Tool |
| Depilatory cream | Nair | Type: Tool | |
| Osmotic pump |  ALZET ALZET | 1002 | Type: Tool, 14 day release |
| Vinyl catheter |  ALZET ALZET | 7760 | Type: Tool |
| Heparinized saline (0.9%) | Baxter | 2B0944 | Type: Reagent |
| Neutral buffered formalin | Richard-Allan Scientific | 5705 | Type: Reagent |
| Microfil (silicone rubber contrast agent) | Flowtech | MV-112 | Type Reagent, Microfil White |
| Cal-Ex II (formic acid solution) | Fisher Scientific | CS511-1D | Type: Reagent |
| Buprenex | CIII | 7571 | Type: Analgesic |
| Bupivicaine | Hospira, Inc. | 381 | Type: Analgesic |
| Equipment | |||
| Dissecting microscope | Carl Zeiss Microimaging | Zeiss Stemi 2000-C | Type:Equipment |
| Laser Doppler perfusion imager | Perimed Inc. | Periscan PIM3 | Type:Equipment |
| Micro-CT imaging system | GE Healthcare | Explore Locus SP | Type:Equipment |
Références
- Epstein, S. E., Fuchs, S., Zhou, Y. F., Baffour, R., Kornowski, R. Therapeutic interventions for enhancing collateral development by administration of growth factors: basic principles, early results and potential hazards. Cardiovasc. Res. 49, 532-542 (2001).
- Esaki, J., Marui, A., Tabata, Y., Komeda, M. Controlled release systems of angiogenic growth factors for cardiovascular diseases. Expert Opin. Drug Deliv. 4, 635-649 (2007).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, 1267-1279 (2002).
- Golomb, B. A., Dang, T. T., Criqui, M. H. Peripheral arterial disease: morbidity and mortality implications. Circulation. 114, 688-699 (2006).
- Hiatt, W. R. Pharmacologic therapy for peripheral arterial disease and claudication. J. Vasc. Surg. 36, 1283-1291 (2002).
- Hirsch, A. T., et al. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA. 286, 1317-1324 (2001).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat. Med. 9, 713-725 (2003).
- Hirsch, A. T., et al. ACC/AHA Guidelines for the Management of Patients with Peripheral Arterial Disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Associations for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (writing committee to develop guidelines for the management of patients with peripheral arterial disease)--summary of recommendations. J. Vasc. Interv. Radiol. 17, 1383-1397 (2006).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Losordo, D. W., Dimmeler, S. Therapeutic angiogenesis and vasculogenesis for ischemic disease. Part I: angiogenic cytokines. Circulation. 109, 2487-2491 (2004).
- Waters, R. E., Terjung, R. L., Peters, K. G., Annex, B. H. Preclinical models of human peripheral arterial occlusive disease: implications for investigation of therapeutic agents. J. Appl. Physiol. 97, 773-780 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon