אנטרופיה
Overview
מקור: קטרון מיטשל-ווין, PhD, אסנטה קוריי, PhD, המחלקה לפיזיקה ואסטרונומיה, בית הספר למדעי הפיזיקה, אוניברסיטת קליפורניה, אירווין, קליפורניה
החוק השני של התרמודינמיקה הוא חוק יסוד הטבע. הוא קובע כי האנטרופיה של מערכת תמיד גדלה עם הזמן או נשארת קבועה במקרים אידיאליים כאשר מערכת נמצאת במצב יציב או עוברת "תהליך הפיך". אם המערכת עוברת תהליך בלתי הפיך, האנטרופיה של המערכת תמיד תגדל. משמעות הדבר היא שהשינוי באנטרופיה, ΔS, תמיד גדול או שווה לאפס. האנטרופיה של מערכת היא מדד למספר התצורות המיקרוסקופיות שהמערכת יכולה להשיג. לדוגמה, גז במיכל עם נפח, לחץ וטמפרטורה ידועים יכול להיות מספר עצום של תצורות אפשריות של מולקולות הגז הבודדות. אם המיכל נפתח, מולקולות הגז בורחות ומספר התצורות גדל באופן דרמטי, ובעצם מתקרב לאינסוף. כאשר המיכל נפתח, האנטרופיה אמורה לגדול. לכן, אנטרופיה יכולה להיחשב מידה של "הפרעה" של מערכת.
Principles
אנטרופי היא "נכס מדינה", שהוא כמות התלויה רק במצב הנוכחי של המערכת. כמויות שהן מאפייני מצב אינן תלויות בנתיב שבאמצעותו הגיעה המערכת למצבה הנוכחי. לכן, הדרך השימושית ביותר לכמת מאפיין מדינה היא למדוד את השינוישלו .
השינוי באנטרופיה S מוגדר כ:
ΔS = Q / T, (משוואה 1)
כאשר Q הוא החום המסופק למערכת ו- T היא הטמפרטורה של המערכת. בהקשר של תרמודינמיקה, חום, כמו עבודה, מוגדר כהעברת אנרגיה. חום הוא אנרגיה המועברת מאובייקט אחד למשנהו בגלל הבדל בטמפרטורה. שקול אמבטיה של קרח ומים ב 0 °C (50 °F). אם מספקים חום לאמבט הקרח/מים, חלק מהקרח יימס, ומספר המדינות הזמינות למולקולות המים יגדל בכמות גדולה, ביחס לכמות החום שנוספה למערכת. האנטרופיה תגדל באופן פרופורציונלי לסכום זה. הקשר בין שני עצמים בטמפרטורות שונות תואר לראשונה על ידי ניוטון.
חוק הקירור של ניוטון קובע כי קצב השינוי בטמפרטורה של אובייקט כלשהו הוא פרופורציונלי להבדל בין הטמפרטורה שלו לבין הטמפרטורה של סביבתו. עבור אובייקט בטמפרטורה T ממוקם במערכת סגורה בטמפרטורה Tf, שינוי זה בטמפרטורה כפונקציה של זמן t מתואר על-ידי המשוואה הדיפרנציאלית:
dT/dt = -k(T - Tf ), (משוואה 2)
כאשר k הוא קבוע התלוי במאפייני האובייקט וסביבתו. משוואה 1 נכתבת באופן שווה כ:
-k dt = dT / (T - Tf ). (משוואה 3)
שילוב שני הצדדים נותן:
-k t = log(T - Tf ) + יומן C. (משוואה 4)
החלת הפונקציה המעריכית על שני צידי המשוואה ולאחר מכן סידור מחדש מעניקה:
T - Tf = C e-kt . (משוואה 5)
אם האובייקט המדובר נמצא בטמפרטורה התחלתית Ti בזמן t = 0:
Ti- Tf = C. (משוואה 6)
המסקנה היא כי הטמפרטורה כפונקציה של זמן היא:
T(t) = Tf + (Ti- Tf ) e-kt . (משוואה 7)
לכן, כאשר אובייקט חם ממוקם במערכת סגורה קרירה יותר, הטמפרטורה שלו תרד בקצב מעריכי. במערכת סגורה זו, החום מהעצם החם Q יגביר את הטמפרטורה של הסביבה הקרירה יותר ובכך יגדיל את מספר המדינות הזמינות. לכן, השינוי באנטרופיה, ΔS, הוא חיובי ולא נצר.
Procedure
1. התקנה.
- להשיג גוף חימום ומעמד, מדחום, סטופר, כמה מגבות נייר, מים, וכוס גדולה.
- מלא את הכיס עם מספיק מים, כך המדגם לא להתקרר מהר מדי(כלומר, לפחות 500 מ"ל).
- מניחים את הכיס מלאה במים על הדוכן מתחת לגוף החימום ומדליקים אותו.
- ברגע המים מגיע לרתיחה, להכניס את המדחום ולכבה את גוף החימום.
- הסר בזהירות את הכיס מעמדת החימום והנח אותו על השולחן, על גבי מגבות הנייר. אלה ישמשו בידוד מהשולחן.
2. הקלטת נתונים.
- התחל את שעון העצר ורשום את הטמפרטורה והזמן.
- במשך 20 הדקות הראשונות, לקחת מדידה על כל 1 דקות.
- במשך 20 הדקות הבאות, לקחת מדידה על כל 3-5 דקות.
- רשום ערכים אלה בטבלה 1.
- התווה את נקודות הנתונים שנאספו בטבלה 1 בגרף של טמפרטורה לעומת זמן.
- באמצעות הטמפרטורה הראשונית של המים וכל שתי נקודות נתונים לזמן וטמפרטורה, לפתור משוואה 7 עבור קבוע קירור k.
- באמצעות ערך זה עבור k, התווה משוואה 7 כפונקציה רציפה של t. השווה את הפונקציה לנקודות הנתונים שנאספו.
Results
תוצאות מייצגות עבור 680 מ"ל של מים מוצגים בטבלה 1. קבוע הקירור k נמצא באמצעות נקודות הנתונים בטבלה ופתרון משוואה 7. לאחר 35 דקות, T(35) = 50.6. הטמפרטורה הראשונית הייתה 100 °C (50 °F), ואיסוף הנתונים נפסק ב 28 °C (5 °F). שימוש במשתנים אלה מעניק את המשוואה הבאה כדי להשיג k:
50.6 = 28.5 + (100 - 28.5) e-k 35. (משוואה 8)
פתרון עבור k מעניק ערך k = 0.034. העקומה עם קבוע הקירור הזה מוצגת כקו אפור מקווקו באיור 1, יחד עם נקודות הנתונים מהניסוי. הצורה התפקודית של משוואה 6 תואמת את תוצאות הניסוי מאוד.
ככל שהמים מתקררים, האנטרופיה פוחתת, שכן מספר המדינות הזמינות למולקולות המים פוחת. האנטרופיה של אוויר הסביבה בחדר גדלה מכיוון שמכוס המים מעביר חום למולקולות האוויר המקיפות אותו; האנטרופיה הכוללת של מערכת המים + האוויר עולה. מספר המדינות שמולקולות האוויר החמות יותר יכולות לכבוש גבוה בהרבה מאשר לפני שהמים החמים הוכנסו לחדר.
בצורה דיפרנציאלית, החום dQ הוסיף או הוסר מהמים ניתן לחשב באמצעות הקשר בין מסה, חום ספציפי c, ושינוי טמפרטורה:
dQ = mc dT, (משוואה 9)
כאשר c ידוע להיות 4.18 J / (gK) עבור מים. השינוי באנטרופיה של המים הוא אז:
מים Δ S =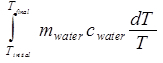
= מים cמים ln (Tסופי / Tראשוני). (משוואה 10)
באמצעות ההמרה לקלווין כ- K = °C + 273.15, השינוי באנטרופיה של המים מחושב כ:
Δ S מים = 680 גרם * 4.18 J / (g K) * ln[(28.5 + 273.15)/(100 + 273.15)]
= -604 J /K.
טמפרטורת אוויר הסביבה קבועה ב 20 °C (50 °F), אז זה תהליך איזותרמי. שינוי האנטרופיה של האוויר הוא אז:
אוויר ΔS = 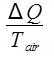 ,
,
כאשר Q הוא החום ששוחרר על ידי המים, אשר ניתן על ידי משוואה 9. השינוי באנטרופיה של האוויר מחושב לאחר מכן כ:
אוויר ΔS =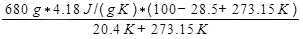
= 3337 J /K.
השינוי הכולל באנטרופיה של מערכת המים + האוויר, ΔStot, הוא סכום השינויים הבודדים באנטרופיה של המים ואוויר הסביבה:
ΔSטוט =מים ΔS+אוויר ΔS(משוואה 11)
= -604 J/k + 3337 J/K
= 2733 J / K.
טבלה 1. הטמפרטורות שנרשמו במהלך הניסוי.
| זמן (דקות) | טמפרטורת המים (°C) |
| 0 0 | 99.6 |
| 1 10 | 97.1 |
| 1 50 | 94.2 |
| 2 30 | 91.8 |
| 3 22 | 89 |
| 4 05 | 87.2 |
| 5 08 | 82.7 |
| 6 05 | 82.4 |
| 8 25 | 78 |
| 9 15 | 76.5 |
| 10 15 | 74.6 |
| 11 38 | 72.7 |
| 12 58 | 70.7 |
| 13 58 | 69.2 |
| 15 15 | 67.7 |
| 16 55 | 65.8 |
| 18 38 | 64 |
| 20 25 | 62.3 |
| 24 02 | 58.8 |
| 25 45 | 57.3 |
| 34 45 | 50.6 |
| 40 50 | 47.4 |
| 44 30 | 45.9 |
| 49 59 | 43.6 |
| 53 42 | 42.4 |
| 60 01 | 40.2 |
| 64 20 | 39.5 |
| 76 37 | 37 |
| 103 50 | 32.1 |
| 116 41 | 30.3 |
| 122 46 | 29.6 |
| 134 11 | 28.5 |

איור 1. חלקת טמפרטורה לעומת זמן. הנקודות הכחולות מצביעות על הנתונים הניסיוניים, והקו המקווקו מייצג נתונים תיאורטיים המבוססים על חוק הקירור של ניוטון.
Application and Summary
זוג אוזניות שנשמרות בשקית תמיד נוטה להיות קשורות - זוהי עלייה באנטרופיה הנגרמת על ידי נשיאת התיק מסביב. יש צורך לעשות עבודה על האוזניות כדי לבטל את הקשר אותם ולהקטין את האנטרופיה (זה יכול להיחשב "תהליך הפיך"). מחזור מנוע החום היעיל ביותר המותר על ידי חוקים פיזיים הוא מחזור קרנו. החוק השני קובע כי לא כל החום המסופק למנוע חום יכול לשמש לעבודה. היעילות של Carnot קובעת את הערך המגביל על שבר החום שניתן להשתמש בו. המחזור מורכב משני תהליכים איזותרמיים ואחריו שני תהליכים אדיאבטיים. מקרר, שהוא בעצם רק משאבת חום, הוא גם דוגמה קלאסית לחוק השני. מקררים מעבירים חום ממיקום אחד בטמפרטורה נמוכה יותר ("המקור") למיקום אחר בטמפרטורה גבוהה יותר ("כיור החום") באמצעות עבודה מכנית. על פי החוק השני, חום לא יכול לזרום באופן ספונטני ממקום קר יותר לאחד חם יותר; לכן, עבודה (אנרגיה) נדרשת לקירור.
חוק הקירור של ניוטון הודגם על ידי מלאה במים ב-100 מעלות צלזיוס שהתקררו לטמפרטורת החדר, מה שהוביל לעלייה באנטרופיה של מערכת אוויר המים. על ידי מדידת טמפרטורת המים כפונקציה של זמן על פני תקופה של 135 דקות, ניתן היה לאשר כי קירור המים היה מעריכי בצורתו. קבוע הקירור של דגימת המים נמצא על ידי פתרון משוואת הקירור באמצעות נתונים שנאספו.
Skip to...
Videos from this collection:

Now Playing
אנטרופיה
Physics I
17.6K Views

חוקי התנועה של ניוטון
Physics I
75.7K Views

כוח ותאוצה
Physics I
79.1K Views

וקטורים בכיוונים מרובים
Physics I
182.3K Views

קינמטיקה ותנועת קליעים
Physics I
72.6K Views

חוק הכבידה האוניברסלית של ניוטון
Physics I
191.0K Views

שימור המומנטום
Physics I
43.3K Views

חיכוך
Physics I
52.9K Views

חוק הוק ותנועה הרמונית פשוטה
Physics I
61.3K Views

שיווי משקל ודיאגרמות גוף חופשי
Physics I
37.3K Views

מומנט
Physics I
24.4K Views

אינרציה סיבובית
Physics I
43.5K Views

מומנטום זוויתי
Physics I
36.2K Views

אנרגיה ועבודה
Physics I
49.7K Views

אנטלפיה
Physics I
60.4K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved