Method Article
חקר מוות תאי מתוכנת המושרה על ידי ננו-חלקיקי נחושת בחיידקים
In This Article
Summary
ננו-חלקיקי נחושת פועלים כחומרים אנטי-מיקרוביאליים על ידי יצירת מיני חמצן תגובתיים. כאן, מוצגים נהלים המדגימים כי ננו-חלקיקי נחושת יעילים כנגד שלושה פתוגנים רלוונטיים מבחינה קלינית וכי מסלולי מוות תאי מתוכנתים מסוימים מעורבים בתהליך קוטל חיידקים זה.
Abstract
לאחרונה, החששות מפני פתוגנים עמידים לתרופות מרובות וזיהומים חשוכי מרפא גברו עקב שימוש יתר ושימוש לרעה באנטיביוטיקה. ננו-חומרים, כגון ננו-חלקיקי תחמוצת מתכתיים ומתכתיים, צברו פופולריות בתחום הביו-רפואי כאסטרטגיות חדשות פוטנציאליות למאבק בפתוגנים עמידים לתרופות מרובות. מחקר זה חקר את השימוש בננו-חלקיקי נחושת (CuNPs) כקוטל חיידקים כנגד שלושה פתוגנים אופורטוניסטיים נפוצים שנרכשו בבתי חולים - Escherichia coli (E. coli), Acinetobacter baumannii (A. baumannii) ו-Staphylococcus aureus (S. aureus) - המפתחים יותר ויותר עמידות לתרופות. מוצגים פרוטוקולים מפורטים לסינתזה של CuNPs בשני גדלים (20 ננומטר ו-60 ננומטר) ולהערכת יעילותם קוטל החיידקים באמצעות מבחני מושבה. מנגנוני הפעולה האנטי-מיקרוביאלית העומדים בבסיס CuNPs נחקרו על ידי הערכת שינויים בייצור מיני חמצן תגובתיים. בנוסף, ארבעה מודולטורים המעכבים את תפקודי החלבון האנושי יושמו כדי לחקור את המעורבות הפוטנציאלית של מסלולי מוות תאי מתוכנת (PCD) בהרג חיידקים. באמצעות גישה זו, מוצעת הופעתם הפוטנציאלית של זנים עמידים לנחושת, תוך התבססות על מחקר על חלבוני הומאוסטזיס נחושת, כולל מווסתי שעתוק תלויי נחושת. ממצאים אלה מספקים מתודולוגיה מקיפה לחקר ההשפעות החיידקיות של CuNPs ותפקידם הפוטנציאלי בהתמודדות עם עמידות לאנטיביוטיקה.
Introduction
חיידקים עמידים לתרופות הם סיבה רצינית לדאגה ברפואה. הופעתם המהירה הפחיתה את היעילות של אנטיביוטיקה קונבנציונלית, וכתוצאה מכך סיבוכים קליניים נוספים. הם מהווים איום גדול על בריאות הציבור ויוצרים צורך דחוף בתרופות אנטי-מיקרוביאליות חדשות. אחד מאפיקי המחקר הוא ננו-חומרים. לננו-חומרים יש תכונות פיזיקו-כימיות ייחודיות המאפשרות להם לקיים אינטראקציה עם חיידקים בדרכים הפוגעות בכדאיותם. לדוגמה, ננו-חלקיקי כסף (AgNPs) גורמים למתח חמצוני בחיידקים, וכתוצאה מכך לתפקוד לקוי של חלבונים, הפרעה בקרום, נזק ל-DNA ובסופו של דבר מוות של תאים1. ננו-חלקיקי זהב (AuNPs), לעומת זאת, ידועים בתכונותיהם האנטי-פטרייתיות ויכולים לשפר את ההשפעה החיידקית של אנטיביוטיקה על ידי שימוש כנשאים2.
בנוסף, ננו-חלקיקי נחושת (CuNPs) משכו גם הם תשומת לב רבה בשל השפעתם האנטי-מיקרוביאלית החזקה ועלות הייצור הנמוכה שלהם. מחקרים מצביעים על כך ש-CuNPs מציגים פעילות חיידקית רחבת טווח על ידי שיבוש הפעילות האנזימטית ויצירת מיני חמצן תגובתיים (ROS)3. המטען החיובי של CuNPs מקל על חדירתם לחיידקים, ומשפר את ספיגתם התאית4. מנגנון זה הופך את CuNPs לאופציה מבטיחה לציפוי פני השטח, כגון על שתלים, למניעת זיהומים3. עם זאת, ממצא מעניין אחד הוא שההשפעה החיידקית של CuNPs נראית תלויה בגודל. כמה מחקרים מצאו ש-CuNPs קטנים יותר מציגים פעילות אנטיבקטריאלית גבוהה יותר, כנראה בשל יחס שטח הפנים לנפח המעולה שלהם5.
יצירת ROS גורמת לנזק נרחב לתאים ולחיידקים, כולל חמצון שומנים, תפקוד לקוי של חלבונים, פיצול DNA ועיכוב גלוקונאוגנזה/גליקוגנוליזה, ומעורב בנמק או מוות תאי מתוכנת (PCD)6,7,8. מחקרים אחרונים גילו כי מערכות PCD קיימות בחיידקים, עם מצבי פעולה ואפקטורים דומים לאלה במערכות איקריוטיות9. קהילות חיידקים יכולות לגרום ל-PCD בתגובה ללחץ, כולל מתח חמצוני, באמצעות מערכת רעלן-אנטי-רעלן (TA)10. במילים פשוטות, מערכת הרעלנים-אנטי-רעלנים מורכבת מרעלנים שיכולים לשבש תהליכים תאיים חיוניים ואנטי-רעלנים שיכולים ליצור קומפלקסים יציבים עם הרעלים כדי לעכב את רעילותם בתנאי גידול רגילים. רוב החיידקים והארכאות מכילים מיקומי TA בגנום שלהם, הנמצאים לעתים קרובות בעותקים מרובים של DNA חוץ-כרומוזומלי וכרומוזומי. ישנם מספר סוגים של מערכות TA, כאשר TA מסוג II (המכונה מודול MazE/MazF) מעניין במיוחד. בתנאי עקה, נוגדי רעלנים מתפרקים, מה שמאפשר לרעלנים לעכב את המטרות התאיות שלהם. ב-E. coli ו-S. aureus, הרעלן MazF מופעל בתגובה למצבי עקה כגון מתח חמצוני, טמפרטורה גבוהה ורעב של חומצות אמינו. כתוצאה מכך, הביטוי של נוגד הרעלן MazE מצטמצם, ומשחרר את הרעלן MazF10. מחקרים מצאו כי MazF מאפשר סינתזה של חלבונים המאפשרים לתת-אוכלוסייה קטנה לשרוד בתנאים קשים, בעוד שרוב האוכלוסייה עוברת מוות תאי בתיווך mazEF. מוות תאים זה יכול להיות תלוי ROS, כאשר ROS גורם לעיכוב שעתוק או תרגום, או בלתי תלוי ב-ROS, כאשר נזק ל-DNA מפעיל את מסלולי המוות11.
מחקר זה בוחן את המנגנונים שבאמצעותם CuNPs גורמים למוות חיידקי. במקום להתמקד אך ורק במערכת TA, נעשה שימוש בארבעה מאפנני PCD, ששימשו בעבר במחקר שלנו 7,12, כדי לחקור מסלולי PCD פוטנציאליים בחיידקים.
על ידי בחינת ההשפעות החיידקיות של CuNPs בשני גדלים שונים (20 ו-60 ננומטר) בריכוזים משתנים, ושימוש בשיטות כגון מבחני מושבה, זיהוי ROS ומודולטורים של PCD (SBI, Z-VAD, NSA ו-Wortmannin), מחקר זה מדגיש כי PCD אינו בלעדי לאורגניזמים רב-תאיים אלא מתרחש גם בקהילות חיידקים תחת לחץ. על ידי מתן פרוטוקולים מפורטים, עבודה זו נועדה לאפשר לחוקרים להעריך את יעילות CuNP ומנגנוני קוטלי חיידקים במערכות שלהם. יתר על כן, ממצאים אלה מקדמים את ההבנה של PCD חיידקי ותומכים בפיתוח טיפולים מבוססי CuNP למאבק בחיידקים עמידים לאנטיביוטיקה.
Protocol
הריאגנטים והציוד המשמשים במחקר זה מפורטים בטבלת החומרים.
1. הכנת ננו-חלקיקי נחושת
- השג ננו-אבקות נחושת מסחריות (25 ננומטר ו-60-80 ננומטר) ממקור מסחרי.
- השתמש ב-1.0 מ"מ נתרן דודציל סולפט (SDS) כחומר מפזר לשני גדלים של ננו-חלקיקים של 1 מ"ג/מ"ל.
- פזרו את הננו-חלקיקים באמצעות אמבט קולי למשך 30 דקות לפחות בטמפרטורת החדר. הננו-חלקיקים המפוזרים במלואם מוכנים לשימוש בניסויים הבאים.
2. הכנת חיידקים
- השג E . coli (Migula) Castellani and Chalmers strain 25922 ו-A. baumannii Bouvet ו-Grimont מאוסף תרבות הטיפוס האמריקאי. השיגו את S. aureus ממרכז האיסוף והמחקר של המשאבים הביולוגיים.
- תרבית החיידקים במרק לוריא-ברטאני (LB) בתנאים אירוביים בטמפרטורה של 37 מעלות צלזיוס.
- לדלל את תרביות החיידקים במדיום LB לצפיפות אופטית ב-600 ננומטר (OD600) של כ-0.5.
3. הערכת כדאיות התאים
- מבחן מושבה
- השתמש בתמיסות CuNP מלאי (1 מ"ג/מ"ל) כדי להכין ריכוזים שונים של שני גדלים של CuNPs, כולל 0 מיקרוגרם/מ"ל, 1 מיקרוגרם/מ"ל, 5 מיקרוגרם/מ"ל, 10 מיקרוגרם/מ"ל, 50 מיקרוגרם/מ"ל ו-100 מיקרוגרם/מ"ל.
- מפצלים את תרביות החיידקים שהוכנו בשלב 2.3 לצינורות מיקרו-צנטריפוגה וצנטריפוגה בטמפרטורה של 3300 × גרם למשך 10 דקות בטמפרטורת החדר.
- שמור על כדורי החיידקים והוסף ריכוזים שונים של שני גדלים של CuNPs, בהתאמה, עם פיפטינג עדין.
- טפל בכדורי חיידקים עם PBS ו-70% אלכוהול כבקרות שליליות וחיוביות, בהתאמה.
- דגרו על כל החיידקים המטופלים בניעור ב-200 סל"ד ב-37 מעלות צלזיוס למשך 24 שעות.
- לאחר הדגירה יש לשטוף את כל החיידקים המטופלים עם PBS ולפזר אותם על צלחות אגר LB. מניחים את הצלחות באינקובטור של 37 מעלות צלזיוס למשך 24 שעות.
- ספרו את מספרי המושבות בכל קבוצת טיפול למחרת ובצעו ניתוח סטטיסטי. מומלץ לבצע זאת בשלוש עותקים לדיוק סטטיסטי.
- מחקר מנגנון קוטל חיידקים
- הכן חיידקים כמתואר בשלב 3.1.2 וטפל בהם ב-5 מיקרומטר של SBI-0206965 (SBI) למשך שעתיים, 0.5 מיקרומטר של נקרוסולפונמיד (NSA) למשך שעה, 100 ננומטר של וורטמנין (וורט) למשך 30 דקות, או 100 ננומטר של Z-VAD-FMK (Z-VAD) למשך 30 דקות.
- לטפל בחיידקים בריכוזים שונים של שני גדלים של תמיסות CuNP, כמתואר בשלב 3.1.1, בנוכחות או היעדר 5 מיקרומטר של SBI, 0.5 מיקרומטר של NSA, 100 ננומטר של וורט ו-100 ננומטר של Z-VAD.
- צנטריפוגה של החיידקים לאחר טיפולי מודולטור (שלב 3.2.1) והסר את הסופרנטנטים.
- השעו מחדש את כדורי החיידקים בתמיסות שהוכנו בשלב 3.2.2 ודגרו אותם בניעור ב-200 סל"ד ב-37 מעלות צלזיוס למשך 24 שעות.
- טפל בחיידקים עם 70% אתנול ו-PBS כבקרות חיוביות ושליליות, בהתאמה. השתמש בפתרון ללא CuNPs כפקד הריק של CuNP (0 μg/mL; מדומה) תחת אותם תנאי מעכב עבור כל קבוצה. דגרו על כל הדגימות למשך 24 שעות נוספות.
- לאחר הדגירה, הוסף מגיב כדאיות תאים לתרבויות ביחס נפח של 1:10. דגרו על התרביות למשך שעתיים נוספות עם טלטול בטמפרטורה של 37 מעלות צלזיוס.
- צנטריפוגה את התרבויות (שלב 3.1.2) לאחר הדגירה של שעתיים. העבירו את הסופרנטנטים הפלואורסצנטיים לצלחות של 96 בארות. מדוד פלואורסצנטיות באמצעות אורך גל עירור של 560 ננומטר ואורך גל פליטה של 590 ננומטר עם קורא מיקרו-פלטות.
- מדללים את הסופרנטנט הנותר ל-10-5 ו-10-4 ומורחים אותו על צלחות אגר LB לצורך תרבית.
- ספרו מושבות בודדות למחרת.
4. איתור מיני חמצן תגובתיים
- הכינו תרביות חיידקים כמתואר בשלב 2.3 ופצלו אותן לצינורות מיקרו-צנטריפוגה.
- טפל בחיידקים עם מצבי עקה שונים כקבוצות ביקורת חיוביות הגורמות ל-ROS (נתונים אינם מוצגים בתוצאות). הטיפולים מתוארים בשלבים 4.2.1-4.2.4.
- חשוף את החיידקים לאור UV של 405 ננומטר למשך 3 שעות. דגרו על חיידקים בטמפרטורה של 45 מעלות צלזיוס למשך שעתיים.
- לאחר מכן, דגרו על חיידקים בטמפרטורה של 4 מעלות צלזיוס למשך שעתיים.
- טפל בחיידקים עם 3% H2O2 למשך 30 דקות.
- שמור על החיידקים בטמפרטורה של 37 מעלות צלזיוס במרק LB כבקרה שלילית.
- הכינו ריכוזים שונים של CuNPs כמתואר בשלב 3.1.1, וטפלו בחיידקים עם CuNPs של 20 ננומטר או 60 ננומטר בריכוזים של 1 מיקרוגרם/מ"ל, 5 מיקרוגרם/מ"ל, 10 מיקרוגרם/מ"ל ו-100 מיקרוגרם/מ"ל למשך 24 שעות.
- שטפו את החיידקים המודגרים פעמיים עם PBS כדי להסיר את כל הננו-חלקיקים שנותרו.
- הכן צבע 2′,7′-dichlorodihydrofluorescein diacetate (H2DCFDA) ב-PBS בריכוז סופי של 5 מיקרומטר.
- השעו מחדש את כדורי החיידקים ב-5 מיקרומטר של H2DCFDA ומדדו את עוצמת הקרינה בפליטה של 520/30 ננומטר באמצעות ציטומטר זרימה.
הערה: עוצמת הקרינה הירוקה FL1 נמצאת בקורלציה עם רמת ה-ROS בתרבית המטופלת. מומלץ לבצע זאת בשלוש עותקים לדיוק סטטיסטי.
תוצאות
פעילויות אנטי-מיקרוביאליות של CuNPs בשני גדלים בשלושה פתוגנים
שלושה פתוגנים אופורטוניסטיים (E. coli, S. aureus ו-A. baumannii) שימשו לבדיקת הפעילות החיידקית של CuNPs. החיידקים טופלו ב-0 מיקרוגרם/מ"ל, 1 מיקרוגרם/מ"ל, 5 מיקרוגרם/מ"ל, 10 מיקרוגרם/מ"ל, 50 מיקרוגרם/מ"ל ו-100 מיקרוגרם/מ"ל של 20 ננומטר או 60 ננומטר CuNPs, והפעילויות קוטלי החיידקים נקבעו באמצעות ריכוז החיידקים המינימלי (MBC) שנגזר מספירת המושבות. התוצאות שלנו הראו השפעות חיידקיות חיוביות בשני הגדלים של CuNPs (איור 1) עבור כל שלושת הזנים. ב-E. coli, נצפו ירידות משמעותיות במספר המושבות החל מ-1 מיקרוגרם/מ"ל ו-5 מיקרוגרם/מ"ל עבור טיפולי CuNP של 20 ננומטר ו-60 ננומטר, בהתאמה (איור 1A). לעומת זאת, הפחתה ניכרת בספירת המושבות של S. aureus הוצגה בכל הריכוזים של שני הגדלים של CuNPs (איור 1B). עבור A. baumannii, ריכוזים גבוהים יותר של CuNPs (5 מיקרוגרם/מ"ל ב-20 ננומטר CuNPs ו-10 מיקרוגרם/מ"ל ב-60 ננומטר CuNPs) נדרשו כדי להשיג הפחתה בספירת המושבות (איור 1C).
המחקרים הקודמים שלנו הצביעו על כך ש-CuNPs קטנים יותר (20 ננומטר) מציגים יכולת קוטלת חיידקים יוצאת דופן יותר בהשוואה לגדולים יותר (60 ננומטר)7,12. כאן הוצגו מגמות דומות, המצביעות על תוצאות עקביות. יתר על כן, ממצאים אלה מצביעים על כך שחיידקים גראם-חיוביים (במקרה זה, S. aureus) רגישים יותר ל-CuNPs מאשר החיידקים הגראם-שליליים שנבדקו (E. coli ו-A. baumannii).
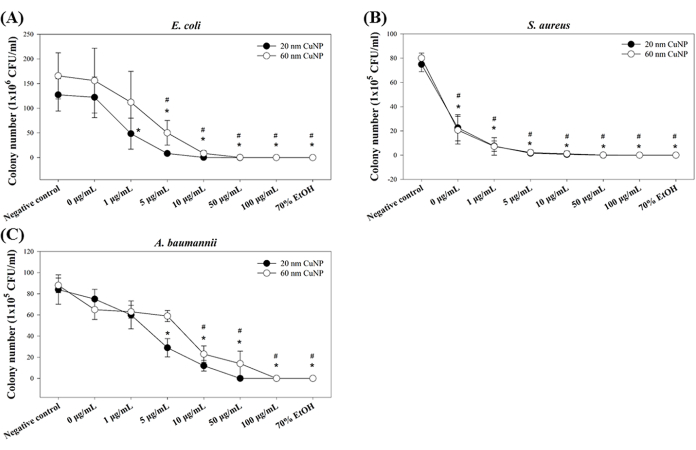
איור 1: פעילות חיידקים של CuNPs בשני גדלים שונים בשלושה מיני חיידקים. E. coli (A), S. aureus (B) ו-A. baumannii (C) טופלו בריכוזים משתנים של 20 ננומטר או 60 ננומטר CuNPs, ונקבעו ספירות מושבות חיידקים. PBS ו-70% חיידקים שטופלו באלכוהול שימשו כבקרות שליליות וחיוביות, בהתאמה. הנתונים מבוטאים כממוצע ± סטיית תקן (SD) מארבעה ניסויים בלתי תלויים, שכל אחד מהם בוצע בשלושה ניסויים. חריגים זוהו באמצעות בדיקה ויזואלית. מבחן שפירו-וילק שימש להערכת נורמליות הנתונים. השוואות סטטיסטיות בוצעו באמצעות מבחן t של סטודנט. כוכביות (*) וסימני פאונד (#) מצביעים על P < 0.05 עבור טיפולי CuNP של 20 ננומטר ו-60 ננומטר ביחס לביקורת השלילית, בהתאמה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
נזק קטלני לחיידקים באמצעות יצירת ROS המושרה על ידי CuNP
המנגנונים המוצעים שבאמצעותם CuNPs הורגים חיידקים משתנים. שתי תיאוריות עיקריות נדונות: החלפת חלבוני אשכול ברזל-גופרית בנחושת המשתחררת מננו-חלקיקים, וייצור ROS המושרה על ידי CuNP13,14. ייצור ROS הוערך בשלושה חיידקים שטופלו ב-CuNP כדי לחקור את המנגנונים (איור 2). E. coli, S. aureus ו-A. baumannii טופלו בריכוזים שונים של 20 ננומטר או 60 ננומטר CuNPs, ואחריהם יישום של H2DCFDA לזיהוי ROS. חלקים גבוהים של אוכלוסיות פלואורסצנטיות ירוקות נמדדו על ידי זרימה ציטומטרית בכל הריכוזים של טיפולי CuNP של 20 ננומטר ו-60 ננומטר (איור 2). מעניין שאוכלוסיות התאים החיוביים בטיפולי CuNP של 20 ננומטר היו בלתי תלויות בריכוז (איור 2A). יש לציין כי ריכוזים נמוכים יותר של 20 ננומטר CuNPs גרמו לייצור ROS גבוה יותר, בעוד שריכוזים גבוהים יותר הציגו חלק נמוך יותר של תאים חיוביים. אולם התופעה הזו לא נצפתה בתאים שטופלו ב-60 ננומטר (איור 2B). לא נצפו הבדלים משמעותיים בין שלושת החיידקים שטופלו ב-CuNPs של 20 ננומטר או 60 ננומטר (איור 2). עליות קלות של אוכלוסיות חיוביות זוהו ב-0 מיקרוגרם/מ"ל, שניתן לייחס למפזרים וללחץ אוסמוזה (איור 2).
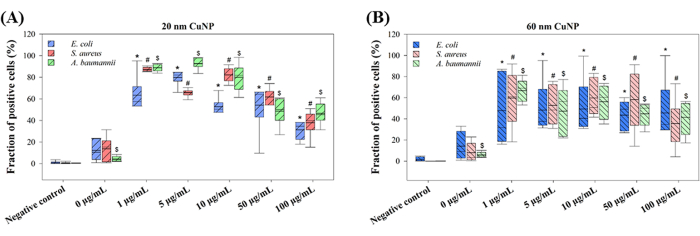
איור 2: יצירת ROS לאחר טיפול ב-CuNPs בשני גדלים שונים בשלושה מיני חיידקים. E. coli, S. aureus ו-A. baumannii נחשפו לריכוזים שונים של 20 ננומטר (A) או 60 ננומטר (B) CuNPs. ייצור ה-ROS הוערך באמצעות צביעת H2DCFDA לאחר טיפול ב-CuNP, וחלק התאים הפלואורסצנטיים החיוביים נותח על ידי ציטומטריית זרימה. הנתונים מוצגים כממוצע ± SD מחמישה ניסויים עצמאיים, שכל אחד מהם בוצע בשלושה עותקים. חריגים זוהו באמצעות בדיקה ויזואלית. מבחן שפירו-וילק שימש להערכת נורמליות הנתונים. השוואות סטטיסטיות נערכו באמצעות ניתוח חד כיווני של Kruskal-Wallis. סמלים (*, # ו-$) מציינים P < 0.05 עבור טיפולי CuNP של 20 ננומטר ו-60 ננומטר ביחס לבקרה השלילית, בהתאמה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
ארבעה מאפנני PCD חשפו את מנגנוני המוות החיידקיים של CuNPs
ארבעה מאפנני PCD שימשו בניסויים הבאים כדי לחקור עוד יותר את מנגנוני המוות התאי הנגרמים על ידי טיפולי CuNP בשלושה פתוגנים. מודולטורים אלה - SBI, Z-VAD, NSA ו- Wort - היו ידועים כחוסמים את מסלולי העברת האותות הקשורים לאפופטוזיס (Z-VAD), אוטופגיה (SBI ו-Wort) ונקרופטוזיס (NSA) בתאי יונקים15-17. מחקרים הציעו כי PCD אינו מוגבל לאורגניזמים רב-תאיים; צורות שונות של PCD נצפו במושבות חיידקים בתגובה לתנאים קשים, מועילים למושבה כולה ומקלים על אסטרטגיות הסתגלות כגון טרנספורמציה גנטית והיווצרות ביופילם10. בהתבסס על הבנה זו, בדקנו אם מסלולים הקשורים ל-PCD תורמים למוות תאים הנגרם על ידי CuNP בחיידקים. שלושת החיידקים, E. coli, S. aureus ו-A. baumannii, טופלו מראש בארבעת המודולטורים, ולאחר מכן טיפול משותף עם שני גדלים של CuNPs והמודולטורים (איור 3).
כדאיות התאים הראתה ירידה תלוית ריכוז בשני הגדלים של טיפולי CuNP בשלושה חיידקים (איור 3), בהתאם לתוצאות המוצגות באיור 1. ב-E. coli, נצפתה הישרדות מוגברת בקבוצת Z-VAD בטיפול של 1 מיקרוגרם/מ"ל ו-5 מיקרוגרם/מ"ל של 20 ננומטר CuNPs, כמו גם בקבוצת ה-NSA שטופלה ב-10 מיקרוגרם/מ"ל של 20 ננומטר CuNPs (איור 3A). עם זאת, Z-VAD היה יעיל בהצלת הישרדות ב-E. coli בכל הריכוזים של טיפולי 60 ננומטר-CuNP, אך לא ב-100 מיקרוגרם/מ"ל (איור 3B). תוצאות כדאיות שונות ב-S. aureus מצביעות על מסלולים קוטלי חיידקים מסוימים בטיפולי CuNP של 20 ננומטר (איור 3C). NSA מילאה תפקיד קריטי בכל הריכוזים של טיפולי CuNP של 20 ננומטר, בעוד ש-Z-VAD היה יעיל רק ב-1 מיקרוגרם/מ"ל של 20 ננומטר CuNPs. S. aureus לא הראה תגובה למאפנן בריכוז כלשהו, למעט Z-VAD ב-10 מיקרוגרם/מ"ל של טיפולי CuNP של 60 ננומטר (איור 3D). מגמות דומות בשיעורי הישרדות התאים לאלו שנצפו ב-E. coli נצפו ב-A. baumannii שטופלו ב-20 ננומטר CuNPs (איור 3E). Z-VAD היה יעיל בהצלה ב-1 מיקרוגרם/מ"ל, 5 מיקרוגרם/מ"ל ו-10 מיקרוגרם/מ"ל בטיפולי CuNP של 20 ננומטר ו-60 ננומטר, בעוד ש-NAS הגדיל את הכדאיות רק ב-10 מיקרוגרם/מ"ל של 20 ננומטר CuNPs. SBI הראה את השפעותיו רק ב-A. baumannii שטופל ב-60 ננומטר CuNPs בריכוזים של 1 מיקרוגרם/מ"ל ו-5 מיקרוגרם/מ"ל (איור 3F).

איור 3: השפעת מאפנני PCD על הישרדות חיידקים לאחר טיפול ב-CuNPs בשני גדלים שונים. E. coli (A,B), S. aureus (C,D) ו-A. baumannii (E,F) טופלו ב-PBS (ביקורת שלילית) ובריכוזים משתנים (0 מיקרוגרם/מ"ל, 1 מיקרוגרם/מ"ל, 5 מיקרוגרם/מ"ל, 10 מיקרוגרם/מ"ל, 50 מיקרוגרם/מ"ל ו-100 מיקרוגרם/מ"ל) של 20 ננומטר או 60 ננומטר CuNPs בהיעדר (מדומה) או נוכחות של מאפנני PCD SBI, Z-VAD, NSA ו-Wort. חיידקים שטופלו ב-70% אלכוהול שימשו כביקורת חיובית. כדאיות התא הוערכה באמצעות בדיקת כדאיות זמינה מסחרית. הנתונים מוצגים כממוצע ± SD משלושה ניסויים עצמאיים לפחות, שכל אחד מהם בוצע בשלושה עותקים. חריגים זוהו באמצעות בדיקה ויזואלית. מבחן שפירו-וילק שימש להערכת נורמליות הנתונים. השוואות סטטיסטיות נערכו באמצעות ANOVA ומבחן t של סטודנט. כוכבית (*) מציינת P < 0.05 עבור טיפולי CuNP בהשוואה לביקורת השלילית, בעוד שצלב כפול (‡) מציין P < 0.05 עבור השוואות בין המדומה לבין מודולטורים אחרים בכל ריכוז. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
השפעות סינרגטיות של קוטל החיידקים נצפו גם עם המפזרים וה-CuNPs (איור 3). SBI, Wort ו-NSA שיפרו את כדאיות החיידקים ב-S. aureus כאשר נחשפו ל-SDS ב-0 מיקרוגרם/מ"ל של 60 ננומטר CuNPs (איור 3F). וורט הגדיל את שיעורי ההישרדות ב-A. baumannii שטופלו ב-CuNPs של 20 ננומטר ו-60 ננומטר בקבוצות מדומות (איור 3E,F). ה-NSA גם הגדילה את הכדאיות של A. baumannii בטיפול המדומה עם CuNPs של 60 ננומטר (איור 3F). לעומת זאת, SBI הפחית את הכדאיות ב-E. coli שטופל ב-60 ננומטר CuNPs (איור 3B), בעוד ש-Z-VAD ו-NSA הפחיתו את שיעורי ההישרדות ב-A. baumannii שטופלו ב-20 ננומטר CuNPs (איור 3E). תוצאות אלה מצביעות על כך שהמנגנונים קוטלי החיידקים בשלושת החיידקים הללו, כאשר הם מטופלים במפזרים, עשויים להיות שונים מאלה המעורבים בננו-חלקיקים.
נחושת היא יסוד קורט חיוני לתהליכים ביולוגיים שונים, וחיוני לשמור על איזון יוני הנחושת בתוך חיידקים. המרכיבים החשובים המצויים במערכת ההומאוסטזיס של נחושת בחיידקים מווסתים את הספיגה, ההפצה וההפרשה של נחושת באמצעות ATPases מייצאי נחושת, חלבוני צ'פרון נחושת ומווסתי שעתוק המגיבים לנחושת (איור 4). רכיבים אלה מווסתים את הביטוי של חלבוני קשירת נחושת והובלה בתגובה לרמות נחושת תוך תאיות, ומבטיחים ריכוז מתאים לתהליכים חיוניים תוך מניעת רעילות18.
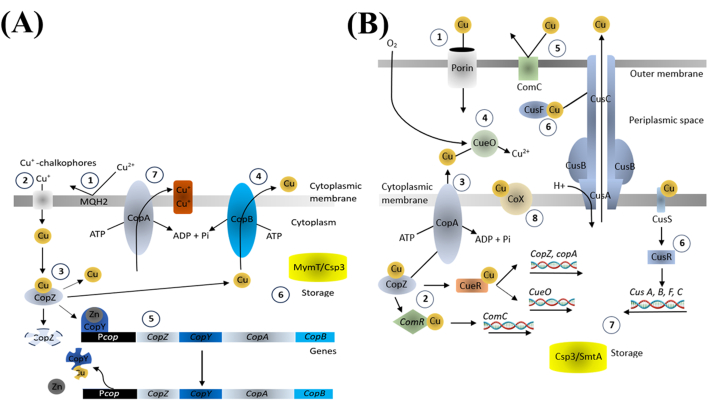
איור 4: הומאוסטזיס נחושת בחיידקים גראם-חיוביים (A) וגראם-שליליים (B). אנא לחצו כאן לצפייה בגרסה גדולה יותר של איור זה.
אנו מניחים כי ההשפעה החיידקית של CuNPs קשורה קשר הדוק לשיבוש מנגנוני הומאוסטזיס נחושת. כאשר חיידקים מוצפים על ידי עודף נחושת, תהליך הוויסות הרגיל אינו יכול לעמוד בקצב, מה שמוביל למתח חמצוני באמצעות יצירת ROS והפעלת מערכת ה-PCD החיידקית. זה, בתורו, מפחית את סינתזת החלבון החשובה ומקדם ייצור חלבונים הקשורים למוות. היישום של המודולטורים מדגים כיצד חומרים אלה יכולים לשפר את שרידות החיידקים, מה שמצביע על כך שהרג חיידקים המושרה על ידי CuNP מפריע גם לתהליכים כמו אוטופגיה ופרוטאוליזה, ובסופו של דבר גורם למוות חיידקים. תוצאות אלו מדגישות את החשיבות של מסלולי PCD במוות חיידקי הנגרם על ידי CuNP.
Discussion
מחקר זה חקר את ההשפעות והמנגנונים האנטי-מיקרוביאליים של CuNPs בשני גדלים וריכוזים שונים כנגד E. coli, S. aureus ו-A. baumannii. באמצעות הפרוטוקולים שנקבעו, נצפה כי השפעות חיידקיות הנגרמות על ידי CuNP כוללות מתח חמצוני והפעלת PCD פוטנציאלית. עם זאת, יחסי הגומלין בין הומאוסטזיס מתכתי לתגובות עקה חיידקיות נותרו ברובם לא נחקרים. מחקרים קודמים זיהו אסטרטגיות עמידות חיידקים, כגון משאבות פליטת נחושת וחלבונים קושרי מתכת, שעשויות להשפיע על רגישות CuNP19. יתר על כן, הציטוטוקסיות הפוטנציאלית של יוני נחושת נותרה דאגה ליישומים טיפוליים, מה שמדגיש את הצורך באופטימיזציה זהירה של המינון20. הבנה מעמיקה יותר של המנגנונים קוטלי החיידקים של CuNPs חיונית לקידום השימוש הבטוח והיעיל בהם.
הדיון כאן ידגיש את ההיבטים הפרוצדורליים של שיטה זו ואת השלכותיהם. השלבים הקריטיים של הפרוטוקול כוללים הכנה ופיזור נאותים של CuNP, הבטחת תרביות חיידקים אחידות בצפיפות אופטית של 600 ננומטר (OD600) של 0.5 לתוצאות הניתנות לשחזור, והשעיה מדויקת של כדורי חיידקים בתמיסות CuNP למניעת צבירה. הרצף הנכון של הוספת מודולטורים, במיוחד ביחס לחשיפה ל-CuNP, הוא חיוני לתוצאות ניסוי יעילות. טיפולי בקרה, כולל בקרות שליליות (PBS) וחיוביות (70% אלכוהול), כמו גם בקרה ריקה של CuNP, חיוניים לביסוס כדאיות בסיסית והבטחת ההשפעות הנצפות קשורות ישירות לטיפול ב-CuNP.
השיטה כוללת גם מדידות כמותיות של כדאיות תאים, המשלבות ספירת מושבות עם מבחן PrestoBlue להערכה מדויקת של פעילות חיידקים. בנוסף, זיהוי ROS באמצעות צבע H2DCFDA וציטומטריית זרימה הוא צעד אנליטי מרכזי להבנת הלחץ החמצוני הנגרם על ידי CuNPs, המבסס את ייצור ה-ROS כגורם תורם למוות של תאי חיידקים. שינויים ופתרון בעיות של השיטה מתמקדים בהתאמת ריכוזי המאפנן על סמך הרגישות של כל זן חיידקים, אופטימיזציה של זמני הדגירה והבטחת הגדרות ציטומטריית זרימה נאותות לזיהוי ROS במדויק. עם זאת, המחקר מוגבל על ידי התמקדותו בשלושה זני חיידקים בלבד והשונות הפוטנציאלית בהשפעות של מאפנני PCD על פני מיני חיידקים שונים. נצפתה השפעה תלוית גודל, כאשר CuNPs קטנים יותר הראו פעילות חיידקית גדולה יותר, אך יש צורך בחקירה נוספת של שינויים בגודל ובריכוז כדי להבין את השפעתם.
שיטה זו מספקת גישה מקיפה להערכת CuNPs כחומרים אנטי-מיקרוביאליים פוטנציאליים. שילוב של מבחני מושבה, בדיקות כדאיות תאים, זיהוי ROS ומחקרי אפנון PCD מציע הבנה רב-צדדית של מנגנוני קוטלי חיידקים של CuNP. מחקר זה מדגיש את הפוטנציאל של CuNPs במאבק בחיידקים עמידים לתרופות ומציג הזדמנויות לפיתוח טיפולים אנטי-מיקרוביאליים ממוקדים המתמרנים מסלולי PCD חיידקיים. יתר על כן, יישומי השיטה משתרעים על פיתוח ציפויים ביו-חומריים מבוססי CuNP למכשירים רפואיים למניעת זיהומים. ככלי בסיסי להבנת PCD חיידקי, פרוטוקול זה הוא משאב רב ערך לקידום המחקר בביולוגיה חיידקית ואסטרטגיות אנטי-מיקרוביאליות.
Disclosures
המחבר אינו מצהיר על ניגוד עניינים, כספי או אחר.
Acknowledgements
אנו אסירי תודה על התמיכה ממרכז מתקני הליבה, אוניברסיטת צו צ'י, טייוואן.
Materials
| Name | Company | Catalog Number | Comments |
| Acinetobacter baumannii Bouvet and Grimont strain | American Type Culture Collection (ATCC), Manassas, VA, USA | 17978 | Bacteria for CuNP toxocity experiment |
| Bio-Rad iMark Microplate Reader | Bio-Rad Laboratories, Hercules, CA, USA | 168-1130 | Used to measure absorbance in bacterial viability assays. |
| cell-permeant 2’,7’-dichlorodihydrofluorescein diacetate (H2DCFDA) | Sigma-Aldrich, Saint Louis, MO, USA | D6883 | Used for detecting reactive oxygen species (ROS) in treated bacterial cells. |
| Copper nanoparticles (CuNPs) 25 nm | Sigma-Aldrich, St. Louis, MO, USA | 774081 | Used to prepare CuNP stock solution |
| Copper nanoparticles (CuNPs) 60-80 nm | Sigma-Aldrich, St. Louis, MO, USA | 774103 | Used to prepare CuNP stock solution |
| Escherichia coli (Migula) Castellani and Chalmers | American Type Culture Collection (ATCC), Manassas, VA, USA | 25922 | Bacteria for CuNP toxocity experiment |
| Gallios flow cytometer | Beckman Coulter, Brea, CA, USA | Used for flow cytometric analysis in multiple experiments, including reactive oxygen species detection. | |
| LB agar | FocusBio, Miaoli, Taiwan | LBA500 | Used for culturing bacteria |
| Luria-Bertani (LB) broth | Becton, Dickinson and Company, Sparks, MD, USA | 244620 | Used for culturing bacteria |
| Necrosulfonamide (NSA) | Sigma-Aldrich, St. Louis, MO, USA | 480073 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| PrestoBlue Cell Viability Reagent | Invitrogen, Carlsbad, CA, USA | P50200 | Used for assessing cell viability via fluorescence. |
| SBI-0206965 (SBI) | BioVision, Milpitas, CA, USA | 9580 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich, St. Louis, MO, USA | L4509 | Used as a dispersant for copper nanoparticles to reduce aggregation. |
| Staphylococcus aureus | American Type Culture Collection (ATCC), Manassas, VA, USA Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 13567 | Bacteria for CuNP toxocity experiment |
| Varioskan LUX multimode microplate reader | Thermo Fisher Scientific, Waltham, MA, USA | VLBLATGD2 | Used for measuring fluorescence in cell viability assays |
| Wortmannin (Wort) | Abcam, MA, USA | ab120148 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Z-VAD-FMK (Z-VAD) | Sigma-Aldrich, St. Louis, MO, USA | V116 | Used as a modulator for pretreatment in bacterial death pathway studies. |
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved