Method Article
Étude de la mort cellulaire programmée induite par les nanoparticules de cuivre chez les bactéries
Dans cet article
Résumé
Les nanoparticules de cuivre agissent comme des agents antimicrobiens en générant des espèces réactives de l’oxygène. Ici, des procédures sont présentées démontrant que les nanoparticules de cuivre sont efficaces contre trois agents pathogènes cliniquement pertinents et que certaines voies de mort cellulaire programmées sont impliquées dans ce processus bactéricide.
Résumé
Récemment, les préoccupations concernant les agents pathogènes multirésistants et les infections incurables ont augmenté en raison de la surutilisation et de la mauvaise utilisation des antibiotiques. Les nanomatériaux, tels que les nanoparticules métalliques et d’oxyde métallique, ont gagné en popularité dans le domaine biomédical en tant que nouvelles stratégies potentielles pour lutter contre les agents pathogènes multirésistants. Cette étude a examiné l’utilisation de nanoparticules de cuivre (CuNPs) comme bactéricide contre trois agents pathogènes opportunistes courants contractés en milieu hospitalier - Escherichia coli (E. coli), Acinetobacter baumannii (A. baumannii) et Staphylococcus aureus (S. aureus) - qui développent de plus en plus de résistance aux médicaments. Des protocoles détaillés sont présentés pour synthétiser des CuNP de deux tailles (20 nm et 60 nm) et évaluer leur efficacité bactéricide par des essais en colonie. Les mécanismes d’action antimicrobienne sous-jacents aux CuNP ont été explorés en évaluant les changements dans la production d’espèces réactives de l’oxygène. De plus, quatre modulateurs qui inhibent les fonctions des protéines humaines ont été appliqués pour étudier l’implication potentielle des voies de mort cellulaire programmée (PCD) dans la destruction bactérienne. Grâce à cette approche, l’émergence potentielle de souches résistantes au cuivre est suggérée, en s’appuyant sur la recherche sur les protéines d’homéostasie du cuivre, y compris les régulateurs transcriptionnels dépendants du cuivre. Ces résultats fournissent une méthodologie complète pour étudier les effets bactéricides des CuNP et leur rôle potentiel dans la lutte contre la résistance aux antibiotiques.
Introduction
Les bactéries résistantes aux médicaments sont une grave source de préoccupation en médecine. Leur émergence rapide a réduit l’efficacité des antibiotiques conventionnels, entraînant davantage de complications cliniques. Ils représentent une menace majeure pour la santé publique et créent un besoin urgent de nouveaux agents antimicrobiens. Les nanomatériaux sont une piste de recherche. Les nanomatériaux possèdent des propriétés physicochimiques uniques qui leur permettent d’interagir avec les microbes d’une manière qui compromet leur viabilité. Par exemple, les nanoparticules d’argent (AgNPs) induisent un stress oxydatif chez les bactéries, entraînant un dysfonctionnement des protéines, une rupture membranaire, des dommages à l’ADN et, finalement, la mort cellulaire1. Les nanoparticules d’or (AuNP), quant à elles, sont connues pour leurs propriétés antifongiques et peuvent renforcer l’effet bactéricide des antibiotiques en servant de vecteurs2.
De plus, les nanoparticules de cuivre (CuNP) ont également attiré beaucoup d’attention en raison de leur puissant effet antimicrobien et de leur faible coût de production. Des études suggèrent que les CuNP présentent une activité bactéricide à large spectre par perturbation de l’activité enzymatique et génération d’espèces réactives de l’oxygène (ROS)3. La charge positive des CuNPs facilite leur pénétration dans les bactéries, améliorant ainsi leur absorption cellulaire4. Ce mécanisme fait des CuNPs une option prometteuse pour le revêtement de surface, par exemple sur les implants, afin de prévenir les infections3. Une découverte intéressante, cependant, est que l’effet bactéricide des CuNP semble dépendre de la taille. Certaines études ont montré que les CuNP plus petits présentent une activité antibactérienne plus élevée, probablement en raison de leur rapport surface/volume supérieur5.
La génération de ROS cause des dommages généralisés aux cellules et aux bactéries, notamment la peroxydation des lipides, le dysfonctionnement des protéines, la fragmentation de l’ADN et l’inhibition de la gluconéogenèse/glycogénolyse, et est impliquée dans la nécrose ou la mort cellulaire programmée (PCD)6,7,8. Des études récentes ont révélé que les systèmes PCD existent chez les bactéries, avec des modes d’action et des effecteurs similaires à ceux des systèmes eucaryotes9. Les communautés bactériennes peuvent induire la PCD en réponse au stress, y compris le stress oxydatif, par le biais d’un système toxine-antitoxine (TA)10. En termes simples, le système toxine-antitoxine se compose de toxines qui peuvent perturber les processus cellulaires essentiels et d’antitoxines qui peuvent former des complexes stables avec les toxines pour inhiber leur toxicité dans des conditions de croissance normales. La plupart des bactéries et des archées contiennent des loci TA dans leurs génomes, souvent présents dans plusieurs copies d’ADN extrachromosomique et chromosomique. Il existe plusieurs types de systèmes TA, le TA de type II (connu sous le nom de module MazE/MazF) étant particulièrement intéressant. Dans des conditions de stress, les antitoxines sont dégradées, ce qui permet aux toxines d’inhiber leurs cibles cellulaires. Chez E. coli et S. aureus, la toxine MazF est activée en réponse à des conditions de stress telles que le stress oxydatif, les températures élevées et la privation d’acides aminés. Par conséquent, l’expression de l’antitoxine MazE est réduite, libérant la toxine MazF10. Des études ont montré que MazF permet la synthèse de protéines qui permettent à une petite sous-population de survivre dans des conditions défavorables, tandis que la majeure partie de la population subit la mort cellulaire médiée par mazEF. Cette mort cellulaire peut être soit dépendante des ROS, où les ROS induisent une inhibition transcriptionnelle ou traductionnelle, soit indépendante des ROS, où les dommages à l’ADN déclenchent les voies de mort11.
Cette étude explore les mécanismes par lesquels les CuNPs induisent la mort bactérienne. Plutôt que de se concentrer uniquement sur le système TA, quatre modulateurs PCD, précédemment utilisés dans notre recherche 7,12, ont été utilisés pour étudier les voies potentielles des PCD chez les bactéries.
En examinant les effets bactéricides des CuNP de deux tailles différentes (20 et 60 nm) à des concentrations variables, et en utilisant des méthodes telles que les essais de colonie, la détection des ROS et les modulateurs de la PCD (SBI, Z-VAD, NSA et Wortmannin), cette recherche souligne que la PCD n’est pas exclusive aux organismes multicellulaires, mais qu’elle est également présente dans les communautés bactériennes soumises à un stress. En fournissant des protocoles détaillés, ce travail vise à permettre aux chercheurs d’évaluer l’efficacité de CuNP et les mécanismes bactéricides dans leurs propres systèmes. De plus, ces résultats font progresser la compréhension de la DCP bactérienne et soutiennent le développement de thérapies à base de CuNP pour lutter contre les bactéries résistantes aux antibiotiques.
Protocole
Les réactifs et l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Préparation de nanoparticules de cuivre
- Obtenir des nanopoudres de cuivre commerciales (25 nm et 60-80 nm) à partir d’une source commerciale.
- Utilisez du dodécylsulfate de sodium (SDS) de 1,0 mM comme dispersant pour deux tailles de nanoparticules de 1 mg/mL.
- Dispersez les nanoparticules à l’aide d’un bain à ultrasons pendant au moins 30 min à température ambiante. Les nanoparticules entièrement dispersées sont ensuite prêtes à être utilisées dans des expériences ultérieures.
2. Préparation des bactéries
- Procurez-vous E . coli (Migula) de la souche 25922 de Castellani et Chalmers et de la souche Bouvet et Grimont d’A . baumannii de l’American Type Culture Collection. Obtenez S. aureus du Centre de recherche et de collecte de bioressources.
- Cultivez les bactéries dans un bouillon Luria-Bertani (LB) dans des conditions aérobies à 37 °C.
- Diluer les cultures bactériennes dans le milieu LB jusqu’à une densité optique à 600 nm (OD600) d’environ 0,5.
3. Évaluation de la viabilité cellulaire
- Essai de colonie
- Utiliser des solutions mères de CuNP (1 mg/mL) pour préparer diverses concentrations de deux tailles de CuNP, soit 0 μg/mL, 1 μg/mL, 5 μg/mL, 10 μg/mL, 50 μg/mL et 100 μg/mL.
- Divisez les cultures bactériennes préparées à l’étape 2.3 en tubes de microcentrifugation et centrifugez à 3300 × g pendant 10 min à température ambiante.
- Conservez les pastilles bactériennes et ajoutez différentes concentrations de deux tailles de CuNP, respectivement, avec un pipetage doux.
- Traitez les granulés bactériens avec du PBS et de l’alcool à 70 % comme témoins négatifs et positifs, respectivement.
- Incuber toutes les bactéries traitées en agitant à 200 tr/min à 37 °C pendant 24 h.
- Après l’incubation, laver toutes les bactéries traitées avec du PBS et les étaler sur des plaques de gélose LB. Placez les plaques dans un incubateur à 37 °C pendant 24 h.
- Comptez le nombre de colonies dans chaque groupe de traitement le lendemain et effectuez une analyse statistique. Il est recommandé d’effectuer cette opération en trois exemplaires pour des raisons d’exactitude statistique.
- Etude du mécanisme bactéricide
- Préparez les bactéries comme décrit à l’étape 3.1.2 et traitez-les avec soit 5 μM de SBI-0206965 (SBI) pendant 2 h, 0,5 μM de nécrosulfamide (NSA) pendant 1 h, 100 nM de wortmannin (Wort) pendant 30 min, ou 100 nM de Z-VAD-FMK (Z-VAD) pendant 30 min.
- Cotraiter les bactéries avec des concentrations différentes de deux tailles de solutions de CuNP, comme décrit à l’étape 3.1.1, en présence ou en l’absence de 5 μM de SBI, 0,5 μM de NSA, 100 nM de moût et 100 nM de Z-VAD.
- Centrifuger les bactéries après les traitements modulateurs (étape 3.2.1) et éliminer les surnageants.
- Remettre les granulés bactériens en suspension dans les solutions préparées à l’étape 3.2.2 et les incuber en agitant à 200 tr/min à 37 °C pendant 24 h.
- Traitez les bactéries avec de l’éthanol à 70 % et du PBS comme témoins positifs et négatifs, respectivement. Utiliser une solution sans CuNP comme témoin à blanc de CuNP (0 μg/mL ; simulacre) dans les mêmes conditions d’inhibiteur pour chaque groupe. Incuber tous les échantillons pendant 24 heures supplémentaires.
- Après l’incubation, ajouter le réactif de viabilité cellulaire aux cultures à un rapport de volume de 1:10. Incuber les cultures pendant encore 2 h en agitant à 37 °C.
- Centrifuger les cultures (étape 3.1.2) après les 2 h d’incubation. Transférez les surnageants fluorescents dans des plaques à 96 puits. Mesurez la fluorescence à l’aide d’une longueur d’onde d’excitation de 560 nm et d’une longueur d’onde d’émission de 590 nm avec un lecteur de microplaques.
- Diluez le surnageant restant à 10-5 et 10-4 et étalez-le sur des plaques de gélose LB pour la culture.
- Comptez les colonies individuelles le lendemain.
4. Détection des espèces réactives de l’oxygène
- Préparez les cultures bactériennes comme décrit à l’étape 2.3 et divisez-les en tubes de microcentrifugation.
- Traiter les bactéries présentant diverses conditions de stress en tant que groupes témoins positifs induisant des ROS (données non présentées dans les résultats). Les traitements sont décrits aux étapes 4.2.1 à 4.2.4.
- Exposez les bactéries à une lumière UV de 405 nm pendant 3 h. Incuber les bactéries à 45 °C pendant 2 h.
- Ensuite, incubez les bactéries à 4 °C pendant 2 h.
- Traiter les bactéries avec 3 % H2O2 pendant 30 min.
- Maintenez les bactéries à 37 °C dans le bouillon LB comme témoin négatif.
- Préparez diverses concentrations de CuNP comme décrit à l’étape 3.1.1 et traitez les bactéries avec des CuNP de 20 nm ou de 60 nm à des concentrations de 1 μg/mL, 5 μg/mL, 10 μg/mL et 100 μg/mL pendant 24 h.
- Lavez les bactéries incubées deux fois avec du PBS pour éliminer les nanoparticules restantes.
- Préparer le colorant diacétate de 2′,7′-dichlorodihydrofluorescéine (H2DCFDA) dans du PBS à une concentration finale de 5 μM.
- Remettre en suspension les pastilles bactériennes dans 5 μM de DHFDAH2et mesurer l’intensité de fluorescence à une émission de 520/30 nm à l’aide d’un cytomètre en flux.
REMARQUE : L’intensité de la fluorescence verte FL1 est en corrélation avec le niveau de ROS dans la culture traitée. Il est recommandé d’effectuer cette opération en trois exemplaires pour plus de précision statistique.
Résultats
Activités antimicrobiennes de CuNP de deux tailles chez trois agents pathogènes
Trois agents pathogènes opportunistes (E. coli, S. aureus et A. baumannii) ont été utilisés pour tester les activités bactéricides des CuNP. Les bactéries ont été traitées avec des concentrations de 0 μg/mL, 1 μg/mL, 5 μg/mL, 10 μg/mL, 50 μg/mL et 100 μg/mL de CuNP de 20 nm ou de 60 nm, et les activités bactéricides ont été déterminées à l’aide de la concentration bactéricide minimale (MBC) dérivée du dénombrement des colonies. Nos résultats ont montré des effets bactéricides positifs des deux tailles de CuNP (Figure 1) pour les trois souches. Chez E. coli, des diminutions significatives du nombre de colonies ont été observées à partir de 1 μg/mL et 5 μg/mL pour les traitements CuNP à 20 nm et 60 nm, respectivement (figure 1A). En revanche, des réductions notables du nombre de colonies de S. aureus ont été observées pour toutes les concentrations de PNcu des deux tailles (figure 1B). Dans le cas d’A. baumannii, des concentrations plus élevées de CuNP (5 μg/mL dans les CuNP de 20 nm et 10 μg/mL dans les CuNP de 60 nm) étaient nécessaires pour réduire le nombre de colonies (figure 1C).
Nos études précédentes ont indiqué que les CuNP plus petites (20 nm) présentent une capacité bactéricide plus extraordinaire que les plus grandes (60 nm)7,12. Ici, des tendances similaires ont été montrées, indiquant des résultats cohérents. De plus, ces résultats suggèrent que les bactéries à Gram positif (dans ce cas, S. aureus) sont plus sensibles aux CuNP que les bactéries à Gram négatif testées (E. coli et A. baumannii).
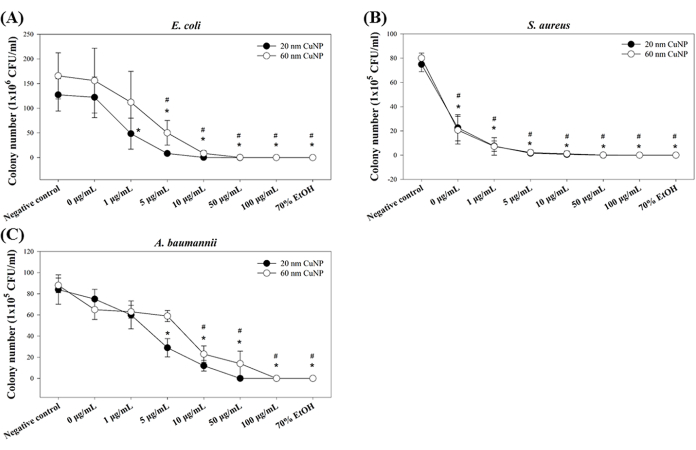
Figure 1 : Activité bactéricide de CuNP de deux tailles différentes chez trois espèces bactériennes. E. coli (A), S. aureus (B) et A. baumannii (C) ont été traités avec des concentrations variables de CuNP de 20 nm ou de 60 nm, et le nombre de colonies bactériennes a été déterminé. Les bactéries traitées au PBS et à 70 % d’alcool ont servi de témoins négatifs et positifs, respectivement. Les données sont exprimées sous forme de moyenne ± d’écart-type (ET) à partir de quatre expériences indépendantes, chacune réalisée en trois exemplaires. Les valeurs aberrantes ont été identifiées grâce à une inspection visuelle. Le test de Shapiro-Wilk a été utilisé pour évaluer la normalité des données. Des comparaisons statistiques ont été effectuées à l’aide du test t de Student. Les astérisques (*) et les signes dièse (#) indiquent P < 0,05 pour les traitements CuNP à 20 nm et 60 nm par rapport au témoin négatif, respectivement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dommages mortels aux bactéries via la génération de ROS induite par CuNP
Les mécanismes proposés par lesquels les CuNP tuent les bactéries varient. Deux théories principales sont discutées : le remplacement des protéines de l’amas fer-soufre par du cuivre libéré par les nanoparticules, et la production de ROS induite par CuNP13,14. La production de ROS a été évaluée chez trois bactéries traitées au CuNP afin d’en explorer les mécanismes (Figure 2). E. coli, S. aureus et A. baumannii ont été traités avec différentes concentrations de CuNP de 20 nm ou 60 nm, suivis de l’application de DHFDAH2pour la détection des ROS. Des fractions élevées de populations fluorescentes vertes ont été mesurées par cytométrie en flux dans toutes les concentrations de traitements CuNP à 20 nm et 60 nm (Figure 2). Il est intéressant de noter que les populations de cellules positives dans les traitements CuNP 20 nm étaient indépendantes de la concentration (Figure 2A). Notamment, des concentrations plus faibles de CuNP de 20 nm ont entraîné une génération plus élevée de ROS, tandis que des concentrations plus élevées ont montré une fraction plus faible de cellules positives. Cependant, ce phénomène n’a pas été observé dans les cellules traitées par CuNP à 60 nm (Figure 2B). Aucune différence significative n’a été observée entre les trois bactéries traitées avec des CuNP de 20 nm ou de 60 nm (figure 2). De légères élévations du nombre de populations positives ont été détectées à 0 μg/mL, ce qui peut être attribué à des dispersants et à la pression osmosée (figure 2).
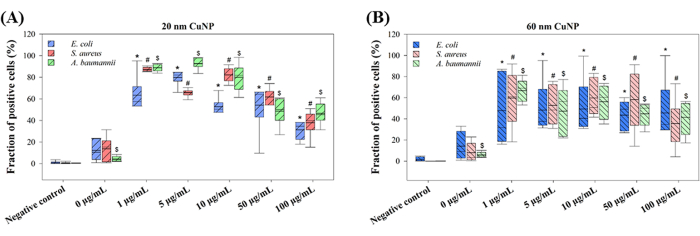
Figure 2 : Génération de ROS après traitement avec des CuNP de deux tailles différentes chez trois espèces bactériennes. E. coli, S. aureus et A. baumannii ont été exposés à différentes concentrations de CuNP de 20 nm (A) ou de 60 nm (B). La production de ROS a été évaluée à l’aide d’une colorationH2DCFDA après un traitement CuNP, et la fraction de cellules fluorescentes positives a été analysée par cytométrie en flux. Les données sont présentées sous forme de moyenne ± ET à partir de cinq expériences indépendantes, chacune réalisée en trois exemplaires. Les valeurs aberrantes ont été identifiées grâce à une inspection visuelle. Le test de Shapiro-Wilk a été utilisé pour évaluer la normalité des données. Des comparaisons statistiques ont été effectuées à l’aide de l’analyse à sens unique de Kruskal-Wallis. Les symboles (*, # et $) indiquent P < 0,05 pour les traitements CuNP à 20 nm et 60 nm par rapport au témoin négatif, respectivement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Quatre modulateurs de PCD ont révélé les mécanismes de mort bactérienne des CuNPs
Quatre modulateurs de la PCD ont été utilisés dans des expériences ultérieures pour explorer davantage les mécanismes de mort cellulaire induits par les traitements CuNP chez trois agents pathogènes. Ces modulateurs - SBI, Z-VAD, NSA et Wort - étaient connus pour bloquer les voies de transduction du signal associées à l’apoptose (Z-VAD), à l’autophagie (SBI et Wort) et à la nécroptose (NSA) dans les cellules de mammifères15-17. Des études ont suggéré que la PCD n’est pas limitée aux organismes multicellulaires ; différentes formes de PCD ont été observées dans des colonies bactériennes en réponse à des conditions difficiles, bénéficiant à l’ensemble de la colonie et facilitant les stratégies adaptatives telles que la transformation génétique et la formation de biofilms10. Sur la base de cette compréhension, nous avons examiné si les voies liées aux PCD contribuent à la mort cellulaire induite par la CuNP chez les bactéries. Les trois bactéries, E. coli, S. aureus et A. baumannii, ont été prétraitées avec les quatre modulateurs, puis co-traitées avec deux tailles de CuNP et les modulateurs (figure 3).
Les vabilités cellulaires ont montré des diminutions dépendantes de la concentration dans les deux tailles de traitements CuNP chez trois bactéries (figure 3), ce qui correspond aux résultats présentés à la figure 1. Chez E. coli, une augmentation de la survie a été observée dans le groupe Z-VAD sous traitement avec 1 μg/mL et 5 μg/mL de CuNPs de 20 nm, ainsi que dans le groupe NSA sous traitement avec 10 μg/mL de CuNPs de 20 nm (figure 3A). Cependant, le Z-VAD s’est avéré efficace pour sauver la survie d’E. coli à toutes les concentrations de traitements à 60 nm-CuNP, mais pas à 100 μg/mL (figure 3B). Des résultats différents sur la viabilité de S. aureus suggèrent des voies bactéricides particulières dans les traitements CuNP à 20 nm (figure 3C). La NSA a joué un rôle essentiel dans toutes les concentrations de traitements CuNP à 20 nm, tandis que la Z-VAD n’était efficace qu’à 1 μg/mL de CuNP à 20 nm. S. aureus n’a montré aucune réponse aux modulateurs à n’importe quelle concentration, à l’exception de la Z-VAD à 10 μg/mL de traitements CuNP à 60 nm (figure 3D). Des tendances similaires à celles observées chez E. coli ont été observées chez A. baumannii traité avec des CuNP à 20 nm (figure 3E). Le Z-VAD s’est avéré efficace pour secourir à 1 μg/mL, 5 μg/mL et 10 μg/mL dans les traitements CuNP à 20 nm et 60 nm, tandis que le NAS n’a augmenté la viabilité qu’à 10 μg/mL avec des CuNP à 20 nm. L’ISO n’a montré ses effets que chez A. baumannii traité avec des CuNP à 60 nm à des concentrations de 1 μg/mL et 5 μg/mL (figure 3F).

Figure 3 : Effet des modulateurs de la PCD sur la survie bactérienne après un traitement avec des CuNP de deux tailles différentes. E. coli (A, B), S. aureus (C, D) et A. baumannii (E, F) ont été traités avec du PBS (témoin négatif) et des concentrations variables (0 μg/mL, 1 μg/mL, 5 μg/mL, 10 μg/mL, 50 μg/mL et 100 μg/mL) de CuNP de 20 nm ou de 60 nm en l’absence (simulée) ou en présence des modulateurs de PCD SBI, Z-VAD, NSA et Wort. Les bactéries traitées avec de l’alcool à 70 % ont servi de témoin positif. La viabilité cellulaire a été évaluée à l’aide d’un test de viabilité disponible dans le commerce. Les données sont présentées sous forme de moyenne ± ET à partir d’au moins trois expériences indépendantes, chacune réalisée en trois exemplaires. Les valeurs aberrantes ont été identifiées grâce à une inspection visuelle. Le test de Shapiro-Wilk a été utilisé pour évaluer la normalité des données. Des comparaisons statistiques ont été effectuées à l’aide de l’ANOVA et du test t de Student. Un astérisque (*) indique que P < 0,05 pour les traitements CuNP par rapport au témoin négatif, tandis qu’un double croisement (‡) indique P < 0,05 pour les comparaisons entre le simulacre et d’autres modulateurs à chaque concentration. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Des effets synergiques du bactéricide ont également été observés avec les dispersants et les CuNP (figure 3). Le SBI, le moût et la NSA ont amélioré la viabilité bactérienne chez S. aureus lorsqu’ils ont été exposés à des SDS dans 0 μg/mL de CuNPs de 60 nm (figure 3F). Le moût a augmenté les taux de survie chez A. baumannii traité avec des CuNP de 20 nm et 60 nm dans des groupes fictifs (Figure 3E,F). La NSA a également augmenté la viabilité d’A. baumannii dans le traitement simulé avec des CuNP de 60 nm (Figure 3F). En revanche, le SBI a diminué la viabilité chez E. coli traité avec le simulacre de CuNP de 60 nm (Figure 3B), tandis que le Z-VAD et le NSA ont réduit les taux de survie chez A. baumannii traité avec le simulacre de CuNPs de 20 nm (Figure 3E). Ces résultats suggèrent que les mécanismes bactéricides de ces trois bactéries, lorsqu’elles sont traitées avec des dispersants, pourraient différer de ceux impliquant des nanoparticules.
Le cuivre est un oligo-élément essentiel pour divers processus biologiques, et il est essentiel de maintenir l’équilibre des ions cuivre au sein des bactéries. Les composants importants présents dans le système d’homéostasie du cuivre chez les bactéries régulent l’absorption, la distribution et l’excrétion du cuivre par le biais des ATPases exportatrices de cuivre, des protéines chaperonnes de cuivre et des régulateurs transcriptionnels sensibles au cuivre (Figure 4). Ces composants modulent l’expression des protéines de liaison et de transport du cuivre en réponse aux niveaux de cuivre intracellulaires, assurant une concentration appropriée pour les processus essentiels tout en prévenant la toxicité18.
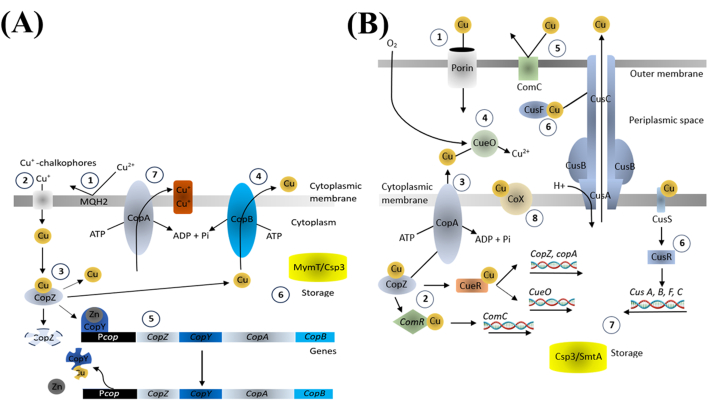
Figure 4 : Homéostasie du cuivre chez les bactéries à Gram positif (A) et à Gram négatif (B). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Nous postulons que l’effet bactéricide des CuNPs est étroitement lié à la perturbation des mécanismes d’homéostasie du cuivre. Lorsque les bactéries sont submergées par un excès de cuivre, le processus de régulation normal ne peut pas suivre, ce qui entraîne un stress oxydatif par la génération de ROS et l’activation du système bactérien PCD. Ceci, à son tour, régule à la baisse la synthèse des protéines importantes et favorise la production de protéines liées à la mort. L’application des modulateurs démontre comment ces agents pourraient améliorer la capacité de survie des bactéries, indiquant que la destruction bactérienne induite par CuNP interfère également avec des processus tels que l’autophagie et la protéolyse, entraînant finalement la mort bactérienne. Ces résultats mettent en évidence l’importance des voies PCD dans la mort bactérienne induite par CuNP.
Discussion
Cette étude a examiné les effets antimicrobiens et les mécanismes des CuNP de deux tailles et de concentrations variées contre E. coli, S. aureus et A. baumannii. En utilisant les protocoles établis, il a été observé que les effets bactéricides induits par CuNP impliquent un stress oxydatif et une activation potentielle de la PCD. Cependant, l’interaction entre l’homéostasie des métaux et les réponses bactériennes au stress reste largement inexplorée. Des études antérieures ont identifié des stratégies de résistance bactérienne, telles que des pompes d’efflux de cuivre et des protéines de liaison aux métaux, qui peuvent affecter la sensibilité au CuNP19. De plus, la cytotoxicité potentielle des ions cuivre reste une préoccupation pour les applications thérapeutiques, soulignant la nécessité d’une optimisation minutieuse du dosage20. Une meilleure compréhension des mécanismes bactéricides des CuNP est essentielle pour faire progresser leur utilisation sûre et efficace.
La discussion ici mettra l’accent sur les aspects procéduraux de cette méthode et leurs implications. Les étapes critiques du protocole comprennent la préparation et la dispersion appropriées du CuNP, la garantie de cultures bactériennes uniformes à une densité optique à 600 nm (DO600) de 0,5 pour des résultats reproductibles, et la remise en suspension précise des granules bactériennes dans des solutions de CuNP pour éviter l’agrégation. La séquence appropriée d’ajout de modulateurs, en particulier en ce qui concerne l’exposition à CuNP, est cruciale pour des résultats expérimentaux efficaces. Les traitements témoins, y compris les témoins négatifs (PBS) et positifs (70 % d’alcool), ainsi qu’un contrôle à blanc CuNP, sont essentiels pour établir la viabilité de base et s’assurer que les effets observés sont directement liés au traitement CuNP.
La méthode comprend également des mesures quantitatives de la viabilité cellulaire, combinant le comptage des colonies avec le test PrestoBlue pour une évaluation précise de l’activité bactéricide. De plus, la détection des ROS à l’aide du colorantH2DCFDA et de la cytométrie en flux est une étape analytique clé pour comprendre le stress oxydatif induit par les CuNPs, établissant la production de ROS comme un facteur contribuant à la mort cellulaire bactérienne. Les modifications et le dépannage de la méthode se concentrent sur l’ajustement des concentrations du modulateur en fonction de la sensibilité de chaque souche bactérienne, l’optimisation des temps d’incubation et la garantie de paramètres de cytométrie en flux appropriés pour détecter les ROS avec précision. Cependant, l’étude est limitée par le fait qu’elle ne porte que sur trois souches bactériennes et par la variabilité potentielle des effets des modulateurs de la PCD entre différentes espèces bactériennes. Un effet dépendant de la taille a été observé, les CuNP plus petits montrant une activité bactéricide plus importante, mais une exploration plus approfondie des variations de taille et de concentration est nécessaire pour bien comprendre leur impact.
Cette méthode fournit une approche complète pour évaluer les CuNP en tant qu’agents antimicrobiens potentiels. La combinaison d’essais de colonie, de tests de viabilité cellulaire, de détection de ROS et d’études de modulateurs PCD offre une compréhension multidimensionnelle des mécanismes bactéricides de CuNP. Cette étude met en évidence le potentiel des CuNP dans la lutte contre les bactéries résistantes aux médicaments et présente des opportunités pour le développement de thérapies antimicrobiennes ciblées qui manipulent les voies bactériennes des DCP. De plus, les applications de la méthode s’étendent au développement de revêtements de biomatériaux à base de CuNP pour les dispositifs médicaux afin de prévenir les infections. En tant qu’outil fondamental pour comprendre la DCP bactérienne, ce protocole est une ressource précieuse pour faire progresser la recherche sur la biologie bactérienne et les stratégies antimicrobiennes.
Déclarations de divulgation
L’auteur ne déclare aucun conflit d’intérêts, financier ou autre.
Remerciements
Nous sommes reconnaissants du soutien du Core Facility Center de l’Université Tzu Chi, à Taïwan.
matériels
| Name | Company | Catalog Number | Comments |
| Acinetobacter baumannii Bouvet and Grimont strain | American Type Culture Collection (ATCC), Manassas, VA, USA | 17978 | Bacteria for CuNP toxocity experiment |
| Bio-Rad iMark Microplate Reader | Bio-Rad Laboratories, Hercules, CA, USA | 168-1130 | Used to measure absorbance in bacterial viability assays. |
| cell-permeant 2’,7’-dichlorodihydrofluorescein diacetate (H2DCFDA) | Sigma-Aldrich, Saint Louis, MO, USA | D6883 | Used for detecting reactive oxygen species (ROS) in treated bacterial cells. |
| Copper nanoparticles (CuNPs) 25 nm | Sigma-Aldrich, St. Louis, MO, USA | 774081 | Used to prepare CuNP stock solution |
| Copper nanoparticles (CuNPs) 60-80 nm | Sigma-Aldrich, St. Louis, MO, USA | 774103 | Used to prepare CuNP stock solution |
| Escherichia coli (Migula) Castellani and Chalmers | American Type Culture Collection (ATCC), Manassas, VA, USA | 25922 | Bacteria for CuNP toxocity experiment |
| Gallios flow cytometer | Beckman Coulter, Brea, CA, USA | Used for flow cytometric analysis in multiple experiments, including reactive oxygen species detection. | |
| LB agar | FocusBio, Miaoli, Taiwan | LBA500 | Used for culturing bacteria |
| Luria-Bertani (LB) broth | Becton, Dickinson and Company, Sparks, MD, USA | 244620 | Used for culturing bacteria |
| Necrosulfonamide (NSA) | Sigma-Aldrich, St. Louis, MO, USA | 480073 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| PrestoBlue Cell Viability Reagent | Invitrogen, Carlsbad, CA, USA | P50200 | Used for assessing cell viability via fluorescence. |
| SBI-0206965 (SBI) | BioVision, Milpitas, CA, USA | 9580 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich, St. Louis, MO, USA | L4509 | Used as a dispersant for copper nanoparticles to reduce aggregation. |
| Staphylococcus aureus | American Type Culture Collection (ATCC), Manassas, VA, USA Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 13567 | Bacteria for CuNP toxocity experiment |
| Varioskan LUX multimode microplate reader | Thermo Fisher Scientific, Waltham, MA, USA | VLBLATGD2 | Used for measuring fluorescence in cell viability assays |
| Wortmannin (Wort) | Abcam, MA, USA | ab120148 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Z-VAD-FMK (Z-VAD) | Sigma-Aldrich, St. Louis, MO, USA | V116 | Used as a modulator for pretreatment in bacterial death pathway studies. |
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon