Method Article
Estudio de la muerte celular programada inducida por nanopartículas de cobre en bacterias
En este artículo
Resumen
Las nanopartículas de cobre actúan como agentes antimicrobianos al generar especies reactivas de oxígeno. Aquí, se presentan procedimientos que demuestran que las nanopartículas de cobre son efectivas contra tres patógenos clínicamente relevantes y que ciertas vías de muerte celular programada están involucradas en este proceso bactericida.
Resumen
Recientemente, la preocupación por los patógenos multirresistentes y las infecciones incurables ha aumentado debido al uso excesivo y mal uso de los antibióticos. Los nanomateriales, como las nanopartículas metálicas y de óxido metálico, han ganado popularidad en el campo biomédico como posibles nuevas estrategias para combatir patógenos multirresistentes. Este estudio investigó el uso de nanopartículas de cobre (CuNPs) como bactericida contra tres patógenos oportunistas comunes adquiridos en el hospital: Escherichia coli (E. coli), Acinetobacter baumannii (A. baumannii) y Staphylococcus aureus (S. aureus), que están desarrollando cada vez más resistencia a los medicamentos. Se presentan protocolos detallados para sintetizar CuNPs de dos tamaños (20 nm y 60 nm) y evaluar su eficacia bactericida mediante ensayos de colonias. Se exploraron los mecanismos de acción antimicrobiana que subyacen a las CuNPs mediante la evaluación de los cambios en la producción de especies reactivas de oxígeno. Además, se aplicaron cuatro moduladores que inhiben las funciones de las proteínas humanas para estudiar la posible participación de las vías de muerte celular programada (PCD) en la muerte bacteriana. A través de este enfoque, se sugiere la posible aparición de cepas resistentes al cobre, basándose en la investigación sobre las proteínas de homeostasis del cobre, incluidos los reguladores transcripcionales dependientes del cobre. Estos hallazgos proporcionan una metodología completa para estudiar los efectos bactericidas de las CuNP y su papel potencial en el tratamiento de la resistencia a los antibióticos.
Introducción
Las bacterias resistentes a los medicamentos son una causa grave de preocupación en medicina. Su rápida aparición ha reducido la eficacia de los antibióticos convencionales, lo que ha dado lugar a más complicaciones clínicas. Representan una amenaza importante para la salud pública y crean una necesidad urgente de nuevos agentes antimicrobianos. Una vía de investigación son los nanomateriales. Los nanomateriales poseen propiedades fisicoquímicas únicas que les permiten interactuar con los microbios de formas que comprometen su viabilidad. Por ejemplo, las nanopartículas de plata (AgNP) inducen estrés oxidativo en las bacterias, lo que resulta en disfunción de proteínas, ruptura de membrana, daño en el ADN y, en última instancia, muerte celular. Por otro lado, las nanopartículas de oro (AuNPs) son conocidas por sus propiedades antifúngicas y pueden mejorar el efecto bactericida de los antibióticos al servir como portadores2.
Además, las nanopartículas de cobre (CuNP) también han atraído una atención considerable debido a su potente efecto antimicrobiano y su bajo costo de producción. Los estudios sugieren que las CuNPs exhiben actividad bactericida de amplio espectro por la interrupción de la actividad enzimática y la generación de especies reactivas de oxígeno (ROS)3. La carga positiva de las CuNPs facilita su penetración en las bacterias, potenciando su absorción celular4. Este mecanismo hace que los CuNPs sean una opción prometedora para el recubrimiento de superficies, como en implantes, para prevenir infecciones3. Un hallazgo interesante, sin embargo, es que el efecto bactericida de las CuNPs parece depender del tamaño. Algunos estudios han encontrado que las CuNPs más pequeñas exhiben una mayor actividad antibacteriana, probablemente debido a su superior relación superficie-volumen5.
La generación de ROS causa daños generalizados a las células y bacterias, incluyendo peroxidación lipídica, disfunción proteica, fragmentación del ADN e inhibición de la gluconeogénesis/glucogenólisis, y está involucrada en la necrosis o muerte celular programada (PCD)6,7,8. Estudios recientes han revelado que existen sistemas de PCD en las bacterias, con modos de acción y efectores similares a los de los sistemas eucariotas9. Las comunidades bacterianas pueden inducir PCD en respuesta al estrés, incluido el estrés oxidativo, a través de un sistema toxina-antitoxina (TA)10. En términos simples, el sistema toxina-antitoxina consiste en toxinas que pueden interrumpir los procesos celulares esenciales y antitoxinas que pueden formar complejos estables con las toxinas para inhibir su toxicidad en condiciones normales de crecimiento. La mayoría de las bacterias y arqueas contienen loci TA en sus genomas, a menudo presentes en múltiples copias de ADN extracromosómico y cromosómico. Existen varios tipos de sistemas TA, siendo de particular interés el tipo II TA (conocido como módulo MazE/MazF). En condiciones de estrés, las antitoxinas se degradan, lo que permite que las toxinas inhiban sus objetivos celulares. En E. coli y S. aureus, la toxina MazF se activa en respuesta a condiciones de estrés como el estrés oxidativo, las altas temperaturas y la inanición de aminoácidos. En consecuencia, la expresión de la antitoxina MazE se reduce, liberando la toxina MazF10. Los estudios han encontrado que MazF permite la síntesis de proteínas que permiten que una pequeña subpoblación sobreviva en condiciones adversas, mientras que la mayor parte de la población sufre muerte celular mediada por mazEF. Esta muerte celular puede ser dependiente de ROS, donde ROS induce inhibición transcripcional o traduccional, o independiente de ROS, donde el daño en el ADN desencadena las vías de muerte11.
Este estudio explora los mecanismos por los cuales las CuNPs inducen la muerte bacteriana. En lugar de centrarse únicamente en el sistema de TA, se emplearon cuatro moduladores de PCD, utilizados previamente en nuestra investigación 7,12, para investigar las posibles vías de PCD en las bacterias.
Al examinar los efectos bactericidas de las CuNPs de dos tamaños diferentes (20 y 60 nm) a diferentes concentraciones, y utilizar métodos como los ensayos de colonias, la detección de ROS y los moduladores de PCD (SBI, Z-VAD, NSA y Wortmannin), esta investigación destaca que la PCD no es exclusiva de los organismos multicelulares, sino que también ocurre en comunidades bacterianas bajo estrés. Al proporcionar protocolos detallados, este trabajo tiene como objetivo permitir a los investigadores evaluar la eficacia de CuNP y los mecanismos bactericidas en sus propios sistemas. Además, estos hallazgos avanzan en la comprensión de la PCD bacteriana y respaldan el desarrollo de terapias basadas en CuNP para combatir las bacterias resistentes a los antibióticos.
Protocolo
Los reactivos y el equipo utilizado en este estudio se enumeran en la Tabla de Materiales.
1. Preparación de nanopartículas de cobre
- Obtenga nanopolvos de cobre comerciales (25 nm y 60-80 nm) de una fuente comercial.
- Utilice dodecil sulfato de sodio (SDS) de 1,0 mM como dispersante para dos tamaños de nanopartículas de 1 mg/mL.
- Disperse las nanopartículas mediante un baño ultrasónico durante al menos 30 minutos a temperatura ambiente. Las nanopartículas completamente dispersas están listas para su uso en experimentos posteriores.
2. Preparación de bacterias
- Obtenga la cepa 25922 de E. coli (Migula) Castellani y Chalmers y la cepa A. baumannii Bouvet y Grimont de la Colección Americana de Cultivos Tipo. Obtener S. aureus del Centro de Investigación y Recolección de Recursos Biológicos.
- Cultivar las bacterias en caldo Luria-Bertani (LB) en condiciones aeróbicas a 37 °C.
- Diluir los cultivos bacterianos en medio LB hasta una densidad óptica a 600 nm (OD600) de aproximadamente 0,5.
3. Evaluación de la viabilidad celular
- Ensayo de colonias
- Utilice soluciones madre de CuNP (1 mg/mL) para preparar varias concentraciones de dos tamaños de CuNPs, incluyendo 0 μg/mL, 1 μg/mL, 5 μg/mL, 10 μg/mL, 50 μg/mL y 100 μg/mL.
- Divida los cultivos bacterianos preparados en el paso 2.3 en tubos de microcentrífuga y centrifugue a 3300 × g durante 10 min a temperatura ambiente.
- Retenga los gránulos bacterianos y agregue diferentes concentraciones de dos tamaños de CuNP, respectivamente, con un pipeteo suave.
- Trate los gránulos bacterianos con PBS y alcohol al 70% como controles negativos y positivos, respectivamente.
- Incubar todas las bacterias tratadas agitando a 200 rpm a 37 °C durante 24 h.
- Después de la incubación, lave todas las bacterias tratadas con PBS y extiéndalas en placas de agar LB. Coloque las placas en una incubadora a 37 °C durante 24 h.
- Cuente el número de colonias en cada grupo de tratamiento al día siguiente y realice un análisis estadístico. Se recomienda realizar esto por triplicado para mayor precisión estadística.
- Estudio del mecanismo bactericida
- Prepare las bacterias como se describe en el paso 3.1.2 y trátelas con 5 μM de SBI-0206965 (SBI) durante 2 h, 0,5 μM de necrosulfonamida (NSA) durante 1 h, 100 nM de wortmannina (mosto) durante 30 min, o 100 nM de Z-VAD-FMK (Z-VAD) durante 30 min.
- Tratar conjuntamente las bacterias con diferentes concentraciones de dos tamaños de soluciones de CuNP, como se describe en el paso 3.1.1, en presencia o ausencia de 5 μM de SBI, 0,5 μM de NSA, 100 nM de mosto y 100 nM de Z-VAD.
- Centrifugar las bacterias después de los tratamientos con moduladores (paso 3.2.1) y eliminar los sobrenadantes.
- Vuelva a suspender los gránulos bacterianos en soluciones preparadas en el paso 3.2.2 e incubelos agitándolos a 200 rpm a 37 °C durante 24 h.
- Tratar las bacterias con etanol al 70% y PBS como controles positivos y negativos, respectivamente. Utilice una solución sin CuNPs como control en blanco de CuNP (0 μg/mL; simulado) en las mismas condiciones de inhibidor para cada grupo. Incubar todas las muestras durante 24 h adicionales.
- Después de la incubación, agregue reactivo de viabilidad celular a los cultivos en una proporción de volumen de 1:10. Incubar los cultivos durante otras 2 h agitando a 37 °C.
- Centrifugar los cultivos (paso 3.1.2) después de las 2 h de incubación. Transfiera los sobrenadantes fluorescentes a placas de 96 pocillos. Mida la fluorescencia utilizando una longitud de onda de excitación de 560 nm y una longitud de onda de emisión de 590 nm con un lector de microplacas.
- Diluir el sobrenadante restante a 10-5 y 10-4 y extenderlo en placas de agar LB para su cultivo.
- Cuente las colonias individuales al día siguiente.
4. Detección de especies reactivas de oxígeno
- Prepare los cultivos bacterianos como se describe en el paso 2.3 y divídalos en tubos de microcentrífuga.
- Tratar las bacterias con diversas condiciones de estrés como grupos de control positivos inductores de ROS (datos no mostrados en los resultados). Los tratamientos se describen en los pasos 4.2.1-4.2.4.
- Exponga las bacterias a una luz ultravioleta de 405 nm durante 3 h. Incubar las bacterias a 45 °C durante 2 h.
- A continuación, incubar las bacterias a 4 °C durante 2 h.
- Tratar las bacterias con 3% H2O2 durante 30 min.
- Mantener las bacterias a 37 °C en caldo LB como control negativo.
- Prepare varias concentraciones de CuNPs como se describe en el paso 3.1.1, y trate las bacterias con CuNPs de 20 nm o 60 nm a concentraciones de 1 μg/mL, 5 μg/mL, 10 μg/mL y 100 μg/mL durante 24 h.
- Lave las bacterias incubadas dos veces con PBS para eliminar las nanopartículas restantes.
- Prepare el colorante de diacetato de 2′,7′-diclorodiclorofluoresceína (H2DCFDA) en PBS a una concentración final de 5 μM.
- Vuelva a suspender los gránulos bacterianos en 5 μM deH2DCFDA y mida la intensidad de fluorescencia a una emisión de 520/30 nm utilizando un citómetro de flujo.
NOTA: La intensidad de la fluorescencia verde FL1 se correlaciona con el nivel de ROS en el cultivo tratado. Se recomienda realizar esto por triplicado para mayor precisión estadística.
Resultados
Actividades antimicrobianas de CuNPs de dos tamaños en tres patógenos
Se utilizaron tres patógenos oportunistas (E. coli, S. aureus y A. baumannii) para probar las actividades bactericidas de los CuNPs. Las bacterias se trataron con 0 μg/mL, 1 μg/mL, 5 μg/mL, 10 μg/mL, 50 μg/mL y 100 μg/mL de CuNPs de 20 nm o 60 nm, y las actividades bactericidas se determinaron utilizando la concentración bactericida mínima (CMM) derivada de los recuentos de colonias. Nuestros resultados mostraron efectos bactericidas positivos de ambos tamaños de CuNPs (Figura 1) para las tres cepas. En E. coli, se observaron disminuciones significativas en el número de colonias a partir de 1 μg/mL y 5 μg/mL para los tratamientos con CuNP de 20 nm y 60 nm, respectivamente (Figura 1A). En contraste, se mostraron reducciones notables en los recuentos de colonias de S. aureus en todas las concentraciones de ambos tamaños de CuNPs (Figura 1B). Para A. baumannii, se necesitaron concentraciones más altas de CuNPs (5 μg/mL en CuNPs de 20 nm y 10 μg/mL en CuNPs de 60 nm) para lograr una reducción en el conteo de colonias (Figura 1C).
Nuestros estudios previos indicaron que los CuNPs más pequeños (20 nm) exhiben una capacidad bactericida más extraordinaria en comparación con los más grandes (60 nm)7,12. Aquí, se mostraron tendencias similares, lo que indica los resultados consistentes. Además, estos hallazgos sugieren que las bacterias grampositivas (en este caso, S. aureus) son más susceptibles a las CuNPs que las bacterias gramnegativas analizadas (E. coli y A. baumannii).
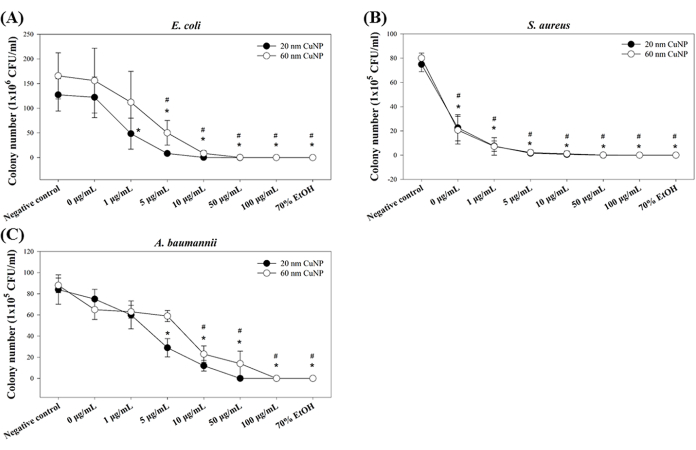
Figura 1: Actividad bactericida de CuNPs de dos tamaños diferentes en tres especies bacterianas. E. coli (A), S. aureus (B) y A. baumannii (C) se trataron con concentraciones variables de CuNPs de 20 nm o 60 nm, y se determinaron los recuentos de colonias bacterianas. Las bacterias tratadas con PBS y 70% con alcohol sirvieron como controles negativos y positivos, respectivamente. Los datos se expresan como la media ± la desviación estándar (DE) de cuatro experimentos independientes, cada uno realizado por triplicado. Los valores atípicos se identificaron a través de una inspección visual. Se utilizó la prueba de Shapiro-Wilk para evaluar la normalidad de los datos. Las comparaciones estadísticas se realizaron mediante la prueba t de Student. Los asteriscos (*) y los signos de libra (#) indican P < 0,05 para los tratamientos con CuNP de 20 nm y 60 nm en relación con el control negativo, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
Daño letal a las bacterias a través de la generación de ROS inducida por CuNP
Los mecanismos propuestos por los cuales las CuNPs matan a las bacterias varían. Se están discutiendo dos teorías principales: el reemplazo de las proteínas del grupo de hierro-azufre por el cobre liberado de las nanopartículas, y la producción de ROS inducida por CuNP13,14. Se evaluó la producción de ROS en tres bacterias tratadas con CuNP para explorar los mecanismos (Figura 2). E. coli, S. aureus y A. baumannii se trataron con diferentes concentraciones de CuNPs de 20 nm o 60 nm, seguido de la aplicación de H2DCFDA para la detección de ROS. Se midieron altas fracciones de poblaciones de fluorescentes verdes por citometría de flujo en todas las concentraciones de tratamientos con CuNP de 20 nm y 60 nm (Figura 2). Curiosamente, las poblaciones de células positivas en los tratamientos con CuNP de 20 nm fueron independientes de la concentración (Figura 2A). En particular, las concentraciones más bajas de CuNPs de 20 nm causaron una mayor generación de ROS, mientras que las concentraciones más altas mostraron una fracción más baja de células positivas. Sin embargo, este fenómeno no se observó en las células tratadas con CuNP de 60 nm (Figura 2B). No se observaron diferencias significativas entre las tres bacterias tratadas con CuNPs de 20 nm o 60 nm (Figura 2). Se detectaron elevaciones leves de las poblaciones positivas en 0 μg/mL, lo que puede atribuirse a los dispersantes y a la presión de ósmosis (Figura 2).
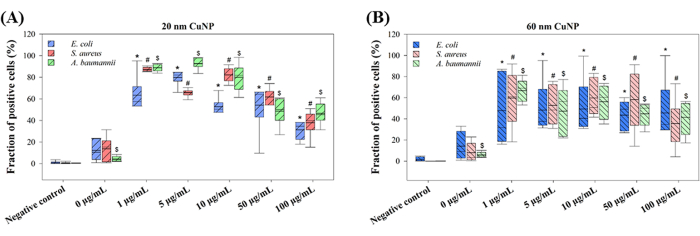
Figura 2: Generación de ROS tras el tratamiento con CuNPs de dos tamaños diferentes en tres especies bacterianas. E. coli, S. aureus y A. baumannii fueron expuestas a diferentes concentraciones de CuNPs de 20 nm (A) o 60 nm (B). La producción de ROS se evaluó mediante tinción de H2DCFDA tras el tratamiento con CuNP, y la fracción de células fluorescentes positivas se analizó mediante citometría de flujo. Los datos se presentan como la media ± DE de cinco experimentos independientes, cada uno realizado por triplicado. Los valores atípicos se identificaron a través de una inspección visual. Se utilizó la prueba de Shapiro-Wilk para evaluar la normalidad de los datos. Las comparaciones estadísticas se realizaron mediante el análisis unidireccional de Kruskal-Wallis. Los símbolos (*, # y $) indican P < 0,05 para los tratamientos de CuNP de 20 nm y 60 nm en relación con el control negativo, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
Cuatro moduladores de PCD revelaron los mecanismos de muerte bacteriana de las CuNPs
Se utilizaron cuatro moduladores de PCD en experimentos posteriores para explorar más a fondo los mecanismos de muerte celular inducidos por los tratamientos con CuNP en tres patógenos. Se sabía que estos moduladores -SBI, Z-VAD, NSA y Wort- bloqueaban las vías de transducción de señales asociadas con la apoptosis (Z-VAD), la autofagia (SBI y Wort) y la necroptosis (NSA) en células de mamíferos15-17. Los estudios han sugerido que la PCD no se limita a los organismos pluricelulares; Se han observado diferentes formas de PCD en colonias bacterianas en respuesta a condiciones adversas, beneficiando a toda la colonia y facilitando estrategias adaptativas como la transformación genética y la formación de biopelículas10. Sobre la base de esta comprensión, examinamos si las vías relacionadas con la PCD contribuyen a la muerte celular inducida por CuNP en bacterias. Las tres bacterias, E. coli, S. aureus y A. baumannii, fueron pretratadas con los cuatro moduladores, seguidas de un cotratamiento con dos tamaños de CuNPs y los moduladores (Figura 3).
Las viabilidades celulares mostraron disminuciones dependientes de la concentración en ambos tamaños de tratamientos con CuNP en tres bacterias (Figura 3), lo que coincide con los resultados presentados en la Figura 1. En E. coli, se observó un aumento de la supervivencia en el grupo Z-VAD bajo tratamiento de 1 μg/mL y 5 μg/mL de CuNPs de 20 nm, así como en el grupo de NSA bajo tratamiento con 10 μg/mL de CuNPs de 20 nm (Figura 3A). Sin embargo, el Z-VAD fue eficaz para rescatar la supervivencia de E. coli en todas las concentraciones de tratamientos con 60 nm-CuNP, pero no a 100 μg/mL (Figura 3B). Diferentes resultados de viabilidad en S. aureus sugieren vías bactericidas particulares en los tratamientos con CuNP de 20 nm (Figura 3C). La NSA desempeñó un papel fundamental en todos los tratamientos con concentraciones de CuNP de 20 nm, mientras que el Z-VAD solo fue eficaz a 1 μg/mL de CuNPs de 20 nm. S. aureus no mostró respuesta a los moduladores a ninguna concentración, excepto para Z-VAD a 10 μg/mL de tratamientos con CuNP de 60 nm (Figura 3D). Se observaron tendencias similares en las tasas de supervivencia celular a las observadas en E. coli en A. baumannii tratados con CuNPs de 20 nm (Figura 3E). El Z-VAD fue eficaz en el rescate a 1 μg/mL, 5 μg/mL y 10 μg/mL en tratamientos con CuNP de 20 nm y 60 nm, mientras que el NAS aumentó la viabilidad solo a 10 μg/mL de CuNPs de 20 nm. El SBI mostró sus efectos solo en A. baumannii tratado con CuNPs de 60 nm a concentraciones de 1 μg/mL y 5 μg/mL (Figura 3F).

Figura 3: Efecto de los moduladores de PCD sobre la supervivencia bacteriana tras el tratamiento con CuNPs de dos tamaños diferentes. E. coli (A,B), S. aureus (C,D) y A. baumannii (E,F) se trataron con PBS (control negativo) y concentraciones variables (0 μg/mL, 1 μg/mL, 5 μg/mL, 10 μg/mL, 50 μg/mL y 100 μg/mL) de CuNPs de 20 nm o 60 nm en ausencia (simulacro) o presencia de los moduladores de PCD SBI, Z-VAD, NSA y mosto. Las bacterias tratadas con alcohol al 70% sirvieron como control positivo. La viabilidad celular se evaluó mediante un ensayo de viabilidad disponible comercialmente. Los datos se presentan como la media ± DE de al menos tres experimentos independientes, cada uno realizado por triplicado. Los valores atípicos se identificaron a través de una inspección visual. Se utilizó la prueba de Shapiro-Wilk para evaluar la normalidad de los datos. Las comparaciones estadísticas se realizaron mediante ANOVA y prueba t de Student. Un asterisco (*) indica P < 0,05 para los tratamientos con CuNP en comparación con el control negativo, mientras que una cruz doble (‡) indica P < 0,05 para las comparaciones entre el simulacro y otros moduladores en cada concentración. Haga clic aquí para ver una versión más grande de esta figura.
También se observaron efectos sinérgicos del bactericida con los dispersantes y CuNPs (Figura 3). SBI, Wort y NSA mejoraron la viabilidad bacteriana en S. aureus cuando se expusieron a SDS en 0 μg/mL de CuNPs de 60 nm (Figura 3F). El mosto aumentó las tasas de supervivencia en A. baumannii tratado con CuNPs de 20 nm y 60 nm en grupos simulados (Figura 3E,F). La NSA también aumentó la viabilidad de A. baumannii en el tratamiento simulado con CuNPs de 60 nm (Figura 3F). Por el contrario, el SBI disminuyó la viabilidad en E. coli tratada con el simulacro de CuNPs de 60 nm (Figura 3B), mientras que el Z-VAD y el NSA redujeron las tasas de supervivencia en A. baumannii tratado con el simulacro de CuNPs de 20 nm (Figura 3E). Estos resultados sugieren que los mecanismos bactericidas en estas tres bacterias, cuando se tratan con dispersantes, podrían diferir de los que involucran nanopartículas.
El cobre es un oligoelemento esencial para varios procesos biológicos y es vital para mantener el equilibrio de los iones de cobre dentro de las bacterias. Los componentes importantes que se encuentran en el sistema de homeostasis del cobre en las bacterias regulan la absorción, distribución y excreción de cobre a través de las ATPasas exportadoras de cobre, las proteínas chaperonas de cobre y los reguladores transcripcionales que responden al cobre (Figura 4). Estos componentes modulan la expresión de proteínas de unión y transporte de cobre en respuesta a los niveles de cobre intracelular, asegurando una concentración adecuada para procesos esenciales y evitando la toxicidad18.
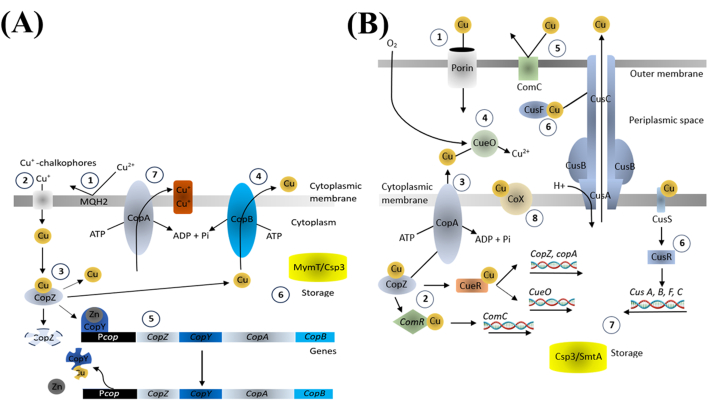
Figura 4: Homeostasis del cobre en bacterias grampositivas (A) y gramnegativas (B). Haga clic aquí para ver una versión más grande de esta figura.
Postulamos que el efecto bactericida de los CuNPs está estrechamente relacionado con la disrupción de los mecanismos de homeostasis del cobre. Cuando las bacterias se ven abrumadas por el exceso de cobre, el proceso regulador normal no puede seguir el ritmo, lo que provoca estrés oxidativo a través de la generación de ROS y la activación del sistema bacteriano PCD. Esto, a su vez, regula a la baja la síntesis de proteínas importantes y promueve la producción de proteínas relacionadas con la muerte. La aplicación de los moduladores demuestra cómo estos agentes podrían mejorar la supervivencia bacteriana, lo que indica que la muerte bacteriana inducida por CuNP también interfiere con procesos como la autofagia y la proteólisis, lo que en última instancia resulta en la muerte bacteriana. Estos resultados ponen de manifiesto la importancia de las vías de PCD en la muerte bacteriana inducida por CuNP.
Discusión
Este estudio investigó los efectos y mecanismos antimicrobianos de las CuNPs en dos tamaños y diferentes concentraciones contra E. coli, S. aureus y A. baumannii. Utilizando los protocolos establecidos, se observó que los efectos bactericidas inducidos por CuNP involucran estrés oxidativo y potencial activación de PCD. Sin embargo, la interacción entre la homeostasis de los metales y las respuestas bacterianas al estrés sigue siendo en gran medida inexplorada. Estudios previos han identificado estrategias de resistencia bacteriana, como bombas de eflujo de cobre y proteínas de unión a metales, que pueden afectar la susceptibilidad a CuNP19. Además, la citotoxicidad potencial de los iones de cobre sigue siendo una preocupación para las aplicaciones terapéuticas, lo que pone de relieve la necesidad de una optimización cuidadosa de la dosis20. Una comprensión más profunda de los mecanismos bactericidas de las CuNPs es esencial para avanzar en su uso seguro y eficaz.
En la discusión aquí se enfatizarán los aspectos procedimentales de este método y sus implicaciones. Los pasos críticos del protocolo incluyen la preparación y dispersión adecuadas de CuNP, asegurando cultivos bacterianos uniformes a una densidad óptica a 600 nm (OD600) de 0,5 para resultados reproducibles, y la resuspensión precisa de gránulos bacterianos en soluciones de CuNP para evitar la agregación. La secuencia adecuada de adición de moduladores, particularmente en relación con la exposición a CuNP, es crucial para obtener resultados experimentales efectivos. Los tratamientos de control, incluidos los controles negativos (PBS) y positivos (70% de alcohol), así como un control en blanco de CuNP, son esenciales para establecer la viabilidad inicial y garantizar que los efectos observados estén directamente relacionados con el tratamiento con CuNP.
El método también incluye mediciones cuantitativas de la viabilidad celular, combinando el recuento de colonias con el ensayo PrestoBlue para una evaluación precisa de la actividad bactericida. Además, la detección de ROS mediante colorante H2DCFDA y citometría de flujo es un paso analítico clave para comprender el estrés oxidativo inducido por las CuNP, estableciendo la producción de ROS como un factor que contribuye a la muerte celular bacteriana. Las modificaciones y la resolución de problemas del método se centran en ajustar las concentraciones del modulador en función de la susceptibilidad de cada cepa bacteriana, optimizar los tiempos de incubación y garantizar la configuración adecuada de la citometría de flujo para detectar ROS con precisión. Sin embargo, el estudio está limitado por su enfoque en solo tres cepas bacterianas y la variabilidad potencial en los efectos de los moduladores de PCD en diferentes especies bacterianas. Se observó un efecto dependiente del tamaño, con CuNPs más pequeñas mostrando una mayor actividad bactericida, pero se necesita una mayor exploración de las variaciones de tamaño y concentración para comprender completamente su impacto.
Este método proporciona un enfoque integral para evaluar las CuNPs como posibles agentes antimicrobianos. La combinación de ensayos de colonias, pruebas de viabilidad celular, detección de ROS y estudios de moduladores de PCD ofrece una comprensión multifacética de los mecanismos bactericidas de CuNP. Este estudio destaca el potencial de las CuNP en la lucha contra las bacterias resistentes a los medicamentos y presenta oportunidades para desarrollar terapias antimicrobianas dirigidas que manipulen las vías bacterianas de la PCD. Además, las aplicaciones del método se extienden al desarrollo de recubrimientos de biomateriales basados en CuNP para dispositivos médicos para prevenir infecciones. Como herramienta fundamental para comprender la PCD bacteriana, este protocolo es un recurso valioso para avanzar en la investigación sobre la biología bacteriana y las estrategias antimicrobianas.
Divulgaciones
El autor declara no tener ningún conflicto de intereses, financieros o de otro tipo.
Agradecimientos
Estamos agradecidos por el apoyo del Centro de Instalaciones Centrales de la Universidad de Tzu Chi, Taiwán.
Materiales
| Name | Company | Catalog Number | Comments |
| Acinetobacter baumannii Bouvet and Grimont strain | American Type Culture Collection (ATCC), Manassas, VA, USA | 17978 | Bacteria for CuNP toxocity experiment |
| Bio-Rad iMark Microplate Reader | Bio-Rad Laboratories, Hercules, CA, USA | 168-1130 | Used to measure absorbance in bacterial viability assays. |
| cell-permeant 2’,7’-dichlorodihydrofluorescein diacetate (H2DCFDA) | Sigma-Aldrich, Saint Louis, MO, USA | D6883 | Used for detecting reactive oxygen species (ROS) in treated bacterial cells. |
| Copper nanoparticles (CuNPs) 25 nm | Sigma-Aldrich, St. Louis, MO, USA | 774081 | Used to prepare CuNP stock solution |
| Copper nanoparticles (CuNPs) 60-80 nm | Sigma-Aldrich, St. Louis, MO, USA | 774103 | Used to prepare CuNP stock solution |
| Escherichia coli (Migula) Castellani and Chalmers | American Type Culture Collection (ATCC), Manassas, VA, USA | 25922 | Bacteria for CuNP toxocity experiment |
| Gallios flow cytometer | Beckman Coulter, Brea, CA, USA | Used for flow cytometric analysis in multiple experiments, including reactive oxygen species detection. | |
| LB agar | FocusBio, Miaoli, Taiwan | LBA500 | Used for culturing bacteria |
| Luria-Bertani (LB) broth | Becton, Dickinson and Company, Sparks, MD, USA | 244620 | Used for culturing bacteria |
| Necrosulfonamide (NSA) | Sigma-Aldrich, St. Louis, MO, USA | 480073 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| PrestoBlue Cell Viability Reagent | Invitrogen, Carlsbad, CA, USA | P50200 | Used for assessing cell viability via fluorescence. |
| SBI-0206965 (SBI) | BioVision, Milpitas, CA, USA | 9580 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich, St. Louis, MO, USA | L4509 | Used as a dispersant for copper nanoparticles to reduce aggregation. |
| Staphylococcus aureus | American Type Culture Collection (ATCC), Manassas, VA, USA Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 13567 | Bacteria for CuNP toxocity experiment |
| Varioskan LUX multimode microplate reader | Thermo Fisher Scientific, Waltham, MA, USA | VLBLATGD2 | Used for measuring fluorescence in cell viability assays |
| Wortmannin (Wort) | Abcam, MA, USA | ab120148 | Used as a modulator for pretreatment in bacterial death pathway studies. |
| Z-VAD-FMK (Z-VAD) | Sigma-Aldrich, St. Louis, MO, USA | V116 | Used as a modulator for pretreatment in bacterial death pathway studies. |
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados