Method Article
בדיקת הרכבה מחדש של Split-Luciferase למדידת מגעים אנדופלסמיים בין הרשתית למיטוכונדריה בתאים חיים
In This Article
Summary
הקמנו בדיקת הרכבה מחדש של לוציפראז מפוצל כדי לפקח על המגעים האנדופלסמיים בין הרשתית למיטוכונדריה בתאים חיים. באמצעות בדיקה זו, אנו מתארים פרוטוקול למדידה כמותית של רמת הצימודים הבין-אברונים הללו בתאי HEK293T, בתנאי של טיפול כימי.
Abstract
אתרי מגע אנדופלסמיים בין רטיקולום למיטוכונדריה ממלאים תפקיד קריטי בבריאות התא ובהומאוסטזיס, כגון ויסות Ca2+ והומאוסטזיס שומנים, דינמיקה מיטוכונדריאלית, ביוגנזה אוטופגוזום ומיטופגוזום ואפופטוזיס. כישלון בשמירה על צימוד תקין בין ER למיטוכונדריה מעורב במחלות נוירודגנרטיביות רבות כגון מחלת אלצהיימר, מחלת פרקינסון, טרשת אמיוטרופית צידית ושיתוק ספסטי תורשתי. יש חשיבות רבה לחקור כיצד חוסר ויסות של מגעים מיטוכונדריאליים בחדר מיון יכול להוביל למוות של תאים, והאם תיקון מגעים אלה לרמה נורמלית יכול לשפר מצבים נוירודגנרטיביים. לפיכך, בדיקות משופרות המודדות את רמת המגעים הללו יכולות לסייע להאיר את המנגנונים הפתוגניים של מחלות אלה. בסופו של דבר, הקמת בדיקות פשוטות ואמינות תקל על פיתוח אסטרטגיות טיפוליות חדשות. כאן אנו מתארים בדיקת פיצול-לוציפראז כדי למדוד כמותית את רמת המגעים של ER-מיטוכונדריה בתאים חיים. ניתן להשתמש בבדיקה זו כדי ללמוד את התפקיד הפתופיזיולוגי של מגעים אלה, כמו גם לזהות את המודולטורים שלהם בסינון בתפוקה גבוהה.
Introduction
יחסי הגומלין בין חדר המיון למיטוכונדריה חיוניים להומאוסטזיס תאי ולהישרדות 1,2,3,4. עדויות קודמות מצביעות על כך שכל סוג של הפרעה או חוסר ויסות באתרי הקשר של ER-מיטוכונדריה יכול לתרום למספר מחלות נוירודגנרטיביות, מטבוליות וכלי דם, כמו גם סרטן 5,6,7,8,9,10. לדוגמה, עלייה חריגה של ספיגת Ca2+ במיטוכונדריה יכולה להוביל למוות תאי על ידי פתיחת נקבוביות מעבר חדירות מיטוכונדריה, אשר נראות בדרך כלל במודלים מסוימים של מחלת אלצהיימר 5,11. באופן דומה, מגע מופחת של ER-מיטוכונדריה יכול לגרום לירידה בייצור ATP ולפגיעה בצריכת Ca2+, כפי שניתן לראות במודלים של טרשת אמיוטרופית צידית 5,11,12. ככל שמתבצעים מחקרים נוספים בתחום המגעים בין המיטוכונדריה ל-ER, מתגלים חלבונים וגנים נוספים הקשורים למחלה שעשויים להשפיע על מגעים אלה. למרות הידע והראיות הנוכחיים המציגים את תפקידם של אתרי הקשר בין המיטוכונדריה למיון, עדיין נדרשת עבודה רבה כדי להבהיר כיצד מגעים אלה עלולים להוביל לאובדן תפקוד תאי ובסופו של דבר למוות תאי.
פותחו שיטות שונות להערכת הקרבה של שני הממברנות, המורפולוגיה המבנית, והמרחק בין שני אתרי המגע עם אברונים 3,4,13. הגישות לניטור צימוד ER-מיטוכונדריה כוללות הדמיה מבוססת סמן פלואורסצנטי14,15, הדמיה מבוססת כתב FRET16, והדמיה מבוססת פלואורסצנטיות מפוצלת17,18, המשתמשות באפיפלואורסנציה ומיקרוסקופ קונפוקלי. מיקרוסקופיה ברזולוציית על וברזולוציה אטומית הם גם כלים רבי עוצמה להדמיה מדויקת של מגעים בין אברונים, אם כי השימוש בהם בניתוח אתרי מגע עדיין מוגבל מכיוון שהם דורשים מיקרוסקופים ייעודיים ביותר ומומחיות טכנית19. בנוסף, מיקרוסקופ אלקטרונים תמסורת (TEM), מיקרוסקופ אלקטרונים סורק (SEM), וטכניקות EM אחרות כגון טומוגרפיית אלקטרונים (ET) ומיקרוסקופ אלקטרונים קריו-אלקטרונים, משמשים בדרך כלל מכיוון שהם מספקים הדמיה אולטרה-מבנית ברזולוציה גבוהה של אתרי המגע, שלעתים קרובות בלתי אפשרי לחקור באמצעות גישות ניסיוניות אחרות 20,21,22. עם זאת, שיטות מבוססות EM אלה הן טכניקת תפוקה נמוכה מאוד שיכולה להיות מושפעת גם מהליכי קיבוע כימיים. לאחרונה, שיטות מבוססות תיוג קרבה שימשו לזיהוי אתרי מגע, כמו גם לזיהוי חלבונים חדשים באתר מגע. לדוגמה, בדיקת קשירת קרבה (PLA) שימשה לכימות קרבת אברונים23,24, בעוד שגרסה מתוקנת של בדיקת אסקורבט פרוקסידאז (APEX) שימשה לזיהוי חלבונים חדשים באתר מגע25,26. חשוב להכיר בכך שלכל השיטות הללו שתוארו לעיל יש חוזקות ומגבלות מהותיות בזיהוי המגעים בין האברונים. לפיכך, זיווג של טכניקות שונות נדרש כדי לקבל פרשנות יסודית של אתרי הקשר אברונים.
בעבר הקמנו את בדיקת ההרכבה מחדש split-Renilla luciferase 8 (split-Rluc assay) כדי לנטר את רמת המגעים של קרום המיטוכונדריה ER-מיטוכונדריה (איור 1A)24,26,27. בקצרה, כל חצי מפוצל של Renilla luciferase מצומד עם רצף מיקוד ER או מיטוכונדריה. כאשר מדביקים יחד, כל מחצית מפוצלת של האנזים מתבטאת במיון או בקרום המיטוכונדריאלי. כאשר חדר המיון והמיטוכונדריה ממוקמים בסמיכות זה לזה, החצאים המפוצלים מתאחדים ומרכיבים מחדש את כל האנזים עם פעילות לוציפראז. עבור המבנה split-Rluc, השתמשנו Renilla luciferase 8 (Rluc8) ב pBAD/Myc-His27 עבור התבנית הראשונית. אתר הפיצול (בין חומצות אמינו 91 ו-92) נקבע על סמך דיווחים קודמים27. עבור המחצית ה-N-terminal של ה-Rluc8, רצפי DNA עבור חומצות אמינו 1-91 של ה-Rluc8 אוחדו לקצה ה-3' של התג FLAG ולרצף מיקוד המיטוכונדריה AKAP1 של העכבר בווקטור PCDNA3.1 TOPO על ידי PCR27. עבור חצי מסוף C המיועד למיון, רצפי DNA המקודדים חומצות אמינו 92-311 אוחדו לקצה 5' של תג myc ולרצף הלוקליזציה של שמרים UBC6 ER. כאן, שדרגנו את מבנה הפלסמיד המפוצל Rלוק כך שחצאים מפוצלים של Renilla luciferase מבוטאים בווקטור יחיד (pCAG) תחת אותו מקדם ולאחר מכן נחתכים לשני מקטעים כאשר T2A, רצף פפטידי 2A המתבקע מעצמו מווירוס Thosea asigna, מוכנס בין שני החצאים המפוצלים (איור 1B). מפת הדנ"א של פלסמיד ורצפים מופיעים בקובץ משלים 1 ובאיור משלים S1. באמצעות מערכת זו, מדדנו את ההשפעות של שלושה כימיקלים (מעכבים GTPases המעורבים פילמור אקטין ) על מגעים ER-מיטוכונדריה. בדיקת לוק מפוצלת Rזו היא מערכת בדיקה פשוטה אך חזקה לסינון בתפוקה גבוהה עבור אפנן מגע בין אברונים24.
Protocol
1. תחזוקת תאים וזריעה (יום 1)
- שמור על HEK293T תאים במדיה של תרבית תאים המכילה את מדיום הנשר המעובד של דולבקו (DMEM) עם 10% נסיוב בקר עוברי (FBS) (בצלחות תרבית של 100 מ"מ) באינקובטור לח ב 37 מעלות צלזיוס עם 5% CO2.
- לפני שמתחילים, בדוק את מפגש הצלחת על ידי צפייה מתחת למיקרוסקופ. כאשר התאים מגיעים למפגש של 80-90% בקירוב, התכוננו לזרוע את התאים בצלחת תרבית של 6 בארות על ידי הסרת המדיה ושטיפה עם 10 מ"ל של מלח חוצץ פוספט של דולבקו (DPBS).
- הסר את DPBS מצלחת התרבית ולטפל בתאים עם 1 מ"ל של 0.05% טריפסין-EDTA פנול אדום. דוגרים במשך 3 דקות, ואז מוציאים את הצלחת מהאינקובטור ומוסיפים 9 מ"ל של מדיה תרבותית (DMEM עם 10% FBS) כדי לעצור את תגובת הטריפסין. יש לאט לאט פיפטה למעלה ולמטה כדי להבטיח שכל התאים שעדיין דבוקים לצלחת נעקרו ממקומם. העבר את מתלה התא לצינור 50 מ"ל.
- צנטריפוגה ב 300 × גרם במשך 5 דקות בטמפרטורת החדר. הסר את המדיה והשהה מחדש את כדורי התא עם 1 מ"ל של מדיה טרייה (DMEM + 10% FBS).
- לספור את מספר התאים באמצעות hemocytometer.
- ודא פיזור אחיד של התאים על ידי ערבול עדין של הצינור. מיד להוציא 10 μL של השעיית התא ומניחים לתוך צינור microcentrifuge 1.7 מ"ל. הוסף 90 μL של מדיה לאותו צינור.
- לאחר ערבוב עדין של התאים והמדיה, יש לקחת את תרחיף התא ולמרוח 10 μL על כל אחד מתאי ההמוציטומטר על ידי פיפטציה עדינה מתחת לכיסוי.
- באמצעות מטרה של פי 10, מקדו את קווי הרשת של ההמוציטומטר תחת מיקרוסקופ. לאחר המיקוד, ספור את מספר התאים בקבוצה אחת של 16 ריבועים (4 x 4 ריבועים) באמצעות מונה ספירה ידנית. חזור על הפעולה עד שכל ארבע הקבוצות של 16 ריבועים נספרות.
- חשב את המספר הכולל של תאים/מ"ל על-ידי לקיחת ספירת התאים הממוצעת (מכל אחד מ-16 ריבועי פינה) והכפלתה ב- 105.
הערה: במקום להשתמש בהמוציטומטר כדי לספור תאים, ניתן להשתמש במונה תאים אוטומטי בהתאם להוראות היצרן.
- לאחר השלמת ספירת התאים, התכוננו לצלחת תאים בצלחת 6 בארות בצפיפות של 7.5 × 105 תאים/באר עם 2 מ"ל מדיה/באר. בצינור 50 מ"ל, להוסיף את נפח הדרוש של תאים יחד עם 13 מ"ל של מדיה. יש להוציא 2 מ"ל מתרחיף התאים המדולל לכל אחת מ-6 הבארות.
- לפני הציפוי, חשב את מספר התאים הדרוש עבור 7.5 × 105 תאים/באר באמצעות C1V1 = C2V2 כאשר C1 הוא ספירת התאים הראשונית (מספר התא/מ"ל), V1 הוא הנפח הדרוש מהשעיית התא הראשונית, C2 היא צפיפות תאי היעד הרצויה (מספר תא / מ"ל), ו-V2 הוא הנפח הסופי הדרוש לזריעת תאים.
- לאחר הניפוק, טפחו על הצלחת בעדינות מכל הצדדים כדי לפזר את התאים ולאחר מכן הניחו אותה באינקובטור לח בטמפרטורה של 37°C עם 5%CO2 למשך הלילה.
2. פוליאתילנימין (PEI) - טרנספקציה של תאים וזריעת תאים לאחר טרנספקציה (יום 2)
- מוציאים את צלחת 6 הקידוחים מהחממה ושואבים את אמצעי התרבות הקיימים מכל באר. הוסף 2 מ"ל של מדיה טרייה לכל באר.
- העבר את התאים עם DNA פלסמיד מפוצל Rluc (pCAG-MitoRluc N-T2A-R lucCER-IRES-mCherry) מומס במאגר TE (pH 8.0).
- עבור כל באר, ערבבו את הדנ"א (750 ננוגרם) וה-PEI (יחס הדנ"א/PEI = 1:3) ב-200 מיקרו-ליטר DMEM בצינור מיקרוצנטריפוגה בנפח 1.7 מ"ל. ערבלו במהירות את הדנ"א/PEI ברמה 8 במשך כ-2 שניות כדי להבטיח שהם יתערבבו היטב יחד ליצירת מורכבות. לאחר מכן, סובבו אותו במיני צנטריפוגה לזמן קצר (<3 שניות).
- תנו לתערובת הדנ"א/PEI לדגור בטמפרטורת החדר במשך 15 דקות ולאחר מכן הוסיפו את התערובת (על ידי הפלתה) לפני השטח של מצע התרבית בצלחת 6 בארות המכילה תאים. טפחו על הצלחת בעדינות (לפיזור אחיד של התערובת) ודגרו עליה באינקובטור לח בטמפרטורה של 37°C עם 5% CO2 למשך 6 שעות.
- בזמן הדגירה, הכינו צלחת 96 בארות מצופות פולי-D-ליזין (PDL) על ידי הוספה ראשונה של 70 מיקרוליטר PDL (50 מיקרוגרם/מ"ל ב-DPBS) לכל באר ודגירת באינקובטור לח ב-37°C עם 5%CO2 למשך שעה אחת לפחות. הסר את תמיסת PDL ולאחר מכן לשטוף כל באר 2x עם 100 μL של DPBS. בסוף הכביסה השנייה, ודא שכל ה- DPBS הנותרים הוסרו.
- ב 6 שעות לאחר transfection, להתכונן לזרוע את התאים transfected בצלחת מצופה PDL 96-well.
- הוציאו את צלחת 6 הקידוחים המכילה תאים נגועים מהאינקובטור, שאפו החוצה את התקשורת, ושטפו כל באר עם 2 מ"ל של DPBS. לאחר הסרת DPBS, להוסיף 350 μL של 0.05% Trypsin-EDTA פנול אדום לדגור במשך 1-2 דקות. כדי לעצור את תגובת הטריפסין, הוסף 1.7 מ"ל של מדיה לכל באר.
- לאחר העברת התאים יחד עם מדיה לצינור 50 מ"ל, סובבו את הצינור ב 300 × גרם במשך 5 דקות בצנטריפוגה שולחנית. שאפו את התקשורת והשעו מחדש את גלולת התא עם 1 מ"ל של מדיה טרייה. ספור את מספר התאים באמצעות המוציטומטר (כמתואר בשלב 1.5).
- זרעו את התאים בצלחת מצופה PDL של 96 בארות בצפיפות של 4 × 104 תאים/באר ב-100 מיקרוליטר של תרבית. לשם כך, בצינור 50 מ"ל, להוסיף את נפח התאים הדרוש (ראה להלן לחישוב) יחד עם נפח מתאים של מדיה (12 מ"ל נפח כולל). באמצעות פיפטה רב ערוצית, לחלק 100 μL של תרחיף התא המדולל לתוך כל אחת 96 בארות. לדגור על התאים במשך 18 שעות באינקובטור לח ב 37 ° C עם 5% CO2.
- חשב את מספר התאים הדרוש עבור 4 × 104 תאים/באר באמצעות C1V1 = C2V2 כאשר C1 הוא ספירת התאים הראשונית (מספר תא / מ"ל), V1 הוא הנפח הדרוש מהשעיית התא הראשונית, C2 הוא צפיפות תאי היעד הרצויה (מספר תא / מ"ל), ו- V2 הוא הנפח הסופי הדרוש לזריעת תאים.
3. טיפול כימי ובדיקת לוציפראז בתאים חיים (יום 3)
- בשפופרת מיקרופוגה של 1.7 מ"ל, הכינו את שלוש התמיסות הטריות של 50 מיקרומטר רוסין (50 מ"מ מלאי ב-DMSO), 25 מיקרומטר Ehop-016 (מלאי 25 מ"מ ב-DMSO) ו-50 מיקרומטר ZCL278 (50 מ"מ מלאי ב-DMSO) על ידי דילול כל תמיסת מלאי (50 מ"מ רוסין, 25 מ"מ Ehop-016 ו-50 מ"ל ZCL278; כולם ב-DMSO) בקנ"מ 1:1,000 בכמות הנדרשת (50 מיקרוליטר לבאר × מספר בארות) של מדיית תרבות. לכל תמיסה, הוסף מצע תא חי (מלאי 50 מילימטר ב- DMSO) עבור Renilla luciferase מדולל 1:2,000 לריכוז סופי של 25 מיקרומטר. כדי לייצר פתרונות ZCL278 של 0.5, 5 ו- 50 מיקרומטר, בצע דילולים סדרתיים באמצעות 50 מיקרומטר ZCL278 הראשוניים במדיה תרבותית.
הערה: אם זמן הדגירה הכימית הרצוי הוא פחות מ 1-1.5 שעות, התאים יכולים להיות preincducated עם מצע תא חי (עבור Renilla luciferase) במשך 1-1.5 שעות לפני שהם מטופלים עם כל כימיקל. אנו מוסיפים כימיקלים ומצע תאים חיים בו-זמנית כדי למטב את הפרוטוקול לבדיקת תרופות בתפוקה גבוהה. - מוציאים את המדיה מכל באר של צלחת 96 בארות המכילה תאים נגועים ומוסיפים 50 μL של תערובת מדיה כימית ומצע לכל באר.
- לאחר הדגירה על התאים במשך שעה, שעתיים או 5 שעות, מוציאים את צלחת התרבית מהאינקובטור, מעמיסים אותה על קורא לוחות ההארה ומודדים את עוצמת ההארה.
- לפני שתתחיל, ודא שקורא הלוחות מופעל. גש לתוכנת קורא לוחות המיקרו וצור קובץ חדש על-ידי לחיצה על הפעלה חדשה. הגדר את הטמפרטורה של קורא הלוחות ל- 37 ° C על ידי לחיצה על אינקובטור, בדיקת אפשרות הטמפרטורה והקלדת 37 ° C. תחת פריסת לוחות, בחר באפשרות לא ידוע וציין את הבארות למדידה על-ידי לחיצה וגרירה.
- תחת פרוטוקול, לחץ על Luminescence ושמור על הגדרות ברירת המחדל. לאחר סיום ההתקנה, טען את הצלחת עם המכסה לקורא הלוחות ובחר Run Plate In. נקישה התחל וחלון שמירת הקובץ יופיע. שמור את הקובץ בשולחן העבודה על-ידי שינוי שמו ולחיצה על שמור.
הערה: ההארה תמשיך להיות מיוצרת במשך >24 שעות לאחר הוספת מצע התא החי.
- לאחר השלמת הקריאה, הסר את הלוח מקורא הלוחות ולאחר מכן לחץ על הפעל צלחת פנימה כדי להחזיר את הקורא פנימה. לאחר השלמתה, הניחו את הצלחת בחזרה באינקובטור הלח (37°C, 5% CO2) עד לקריאה הבאה.
- בסיום, העבר את נתוני ההארה לתוכנית גרפים כדי להתוות יחידת הארה יחסית (RLU) (ציר y) עבור כל משתנה (לדוגמה, כימיקלים או ריכוזים) (ציר x) ולנתח את הנתונים.
4. אימות של בדיקת split-Rluc בשיטות אחרות.
- בצע בדיקות אחרות כגון בדיקת קשירת קרבה (PLA), מיקרוסקופ אלקטרונים תמסורת וניטור ספיגת סידן מיטוכונדריאלי כדי לאמת את התוצאות שהתקבלו מבדיקת split-Rluc כפי שתואר קודם לכן24.
תוצאות
השתמשנו בפרוטוקול שתואר לעיל כדי למדוד את רמת המגעים של ER-מיטוכונדריה עם הוספת שלוש תרכובות הידועות כמעכבות GTPases ספציפיים. CDC42, RHO ו-RAC הם GTPases המקדמים פילמור אקטין28 כאשר הם מופעלים ומעוכבים על ידי ZCL278, Rhosin ו-Ehop-016, בהתאמה24. HEK293T תאים שהודבקו ב-split-Rluc טופלו ב-DMSO (בקרה), ZCL278 (50 מיקרומטר), רוסין (50 מיקרומטר) או Ehop-016 (25 מיקרומטר) והודגרו במשך שעה, שעתיים ו-5 שעות. באמצעות קורא לוחות מדדנו את פעילות ה-split-R luc בנקודות זמן מוגדרות (איור 2).
תאים שטופלו ברוסין (מעכב RHO GTPase) לא הראו שינויים משמעותיים בפעילות הלוציפראז בהשוואה לתאי הבקרה שטופלו ב-DMSO לאחר שעה, שעתיים ו-5 שעות של הטיפול (p > 0.9999, p= 0.6956, p > 0.9999) (איור 2). תוצאות אלה מראות כי רוסין אינו משפיע על מגעי ER-מיטוכונדריה, דבר המצביע על כך שאין מעורבות של פעילות RHO GTPase בוויסות המגעים בין שני האברונים.
לעומת זאת, מעכב RAC GTPase Ehop-016 הראה פעילות לוציפראז נמוכה משמעותית מאשר DMSO בשעה, שעתיים ו-5 שעות של הטיפול (p = 0.0106, p = 0.0009, p = 0.0024) (איור 2). נתונים אלה מצביעים על כך שפעילות RAC GTPase נדרשת לשמירה על אינטראקציה תקינה של ER-מיטוכונדריה בתא.
לבסוף, מעכב CDC42 ZCL278 הראה את השינויים הדרסטיים ביותר בפעילות לוציפראז (איור 2). תאים שטופלו ב-ZCL278 הראו ירידה משמעותית בפעילות הלוציפראז בהשוואה לקבוצת הביקורת DMSO והיו בעלי ערכי ה-p הנמוכים ביותר בכל שלוש נקודות הזמן, תוך שמירה על p <-0.0001 לאורך כל הדרך. הנתונים שלנו מראים עיכוב חזק של צימוד ER-מיטוכונדריה כאשר פעילות CDC42 GTPase חסומה על ידי ZCL278, בהתאם לדוח הקודם שלנו באמצעות בדיקת split-Rluc המקורית שבוצעה בתאים הנגועים יחד עם שני וקטורים המקודדים כל מחצית של לוציפראז מפוצלבנפרד 24.
בהתחשב בתוצאות המרשימות עם ZCL278, במיוחד בהשוואה למעכבי GTPase אחרים, פעילות ZCL278 נבדקה עוד יותר בריכוזים שונים [0.5 מיקרומטר, 5 מיקרומטר, 50 מיקרומטר] מול בקרת DMSO. פעילויות לוציפראז שנמדדו ב -1 שעות, 2 שעות ו -5 שעות לאחר הטיפול הראו תגובה תלוית מינון; 0.5 מיקרומטר של ZCL278 הביא להשפעה החלשה ביותר על פעילות לוציפראז, בעוד ש-5 מיקרומטר הראו השפעה חזקה יותר, ו-50 מיקרומטר הראו את הירידה החזקה ביותר בפעילות האנזים המשוחזר (איור 3). יחד, התוצאות שלנו מראות כי ZCL278 מפחית את פעילות ה-split-R luc באופן תלוי מינון, וככל שהזמן מתקדם, ריכוזים גבוהים יותר של ZCL278 (מעכב CDC42) עדיין מראים שינוי משמעותי ביחס ל-DMSO הבקרה בהשוואה לריכוזים נמוכים יותר.
כדרך לאמת את בדיקת ה-split-Rluc שלנו, ניתן לבצע בדיקות עצמאיות מבוססות היטב, כגון בדיקת קשירת קרבה (PLA), מיקרוסקופ אלקטרונים תמסורת (TEM) וניטור ספיגת סידן מיטוכונדריאלי (איור 4 ונתונים שאינם מוצגים)24. איזופרוטרנול, אגוניסט לקולטן אדרנרגי β2, שהוא אחת התרכובות שזוהו במסך שלנו עבור מקדמי מגע עם ER-מיטוכונדריה (איור 4A), שימש כדי לאשר שפעילות הלוציפראז של ה-split-R luc לאחר הטיפול באיזופרוטרנול הוגברה עקב מגעים משופרים של ER-מיטוכונדריה, כפי שהודגם על-ידי שינויים בעוצמת אות PLA כמו גם ספיגת סידן מיטוכונדריאלי (איור 4B-E).
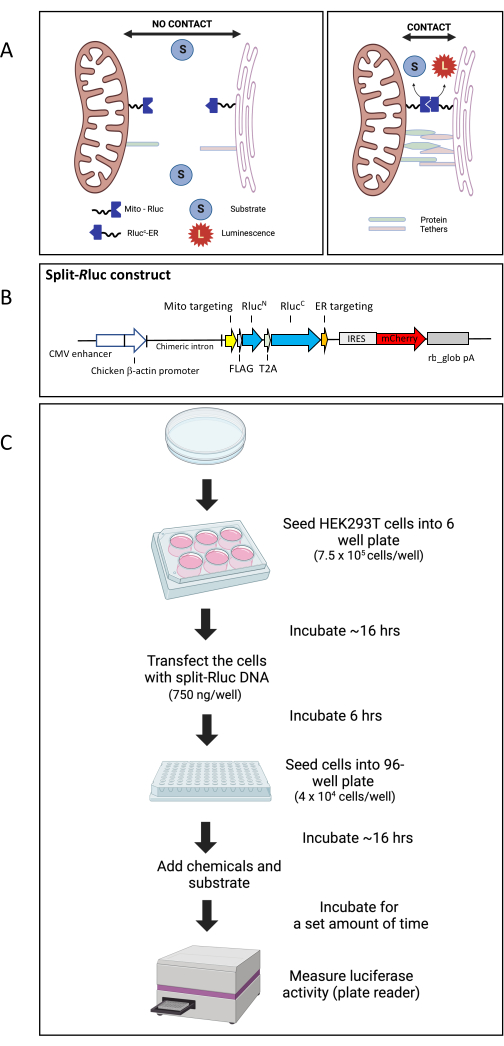
איור 1: מבחן ההרכבה מחדש של Split-R luc. (A) ייצוג סכמטי של מבחן Split-R Luc. כאשר אין מגעים בין המיטוכונדריה לבין הרשתית האנדופלסמית, המיטו-R lucN וה-RlucC-ER אינם מתקשרים ולכן אין פעילות Rluc8. עם זאת, אינטראקציה בין Mito-R lucN ו- RlucC-ER, שבה ה- ER וקרומי המיטוכונדריה באים במגע, גורמת לפעילות אנזימטית מלאה, אשר מזוהה על ידי המרת המצע ללומינסנציה. (B) מפה סכמטית של מבנה הדנ"א המפוצל Rluc (pCAG-MitoRluc N-T2A-R lucCER-IRES-mCherry). (C) דיאגרמה של זרימת עבודה עבור בדיקת split-Rluc בתאי HEK293T. קיצורים: מיטו = מיטוכונדריה; ER = רשתית אנדופלסמית; IRES, אתר כניסה ריבוזומלי פנימי; rb_glob pA, ארנב בטא-גלובין פולי adenylation אות; T2A, רצף פפטידי 2A החותך את עצמו מנגיף Thosea asigna. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: פעילויות לוק מפוצלות Rהמתאימות לרמות המגעים של ER-Mito בתאים שטופלו במעכבי GTPase. (A-C) פעילויות לוציפראז משוחזרות ב-(A) 1 שעות, (B) 2 שעות, או (C) 5 שעות לאחר DMSO (בקרה), Rhosin [50 μM], Ehop-016 [25 μM], או ZCL278 [50 μM] טיפול (n = 12 עבור כל קבוצה). כל הנתונים נותחו באמצעות ANOVA חד-כיווני עם השוואות מרובות. ערכי P מדווחים כ- p > 0.05 (ns), p ≤ 0.05 (*), p ≤ 0.01 (**), p ≤ 0.001 (***), p ≤ 0.0001 (****). קווי שגיאה מציינים ממוצע ± שגיאת תקן של מדידה. קיצורים: מיטו = מיטוכונדריה; ER = רשתית אנדופלסמית; RLU = יחידת אור יחסית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: פעילויות ה-split-R luc המודדות את רמות המגעים של ER-Mito בתאים שטופלו ב-ZCL278. (א-ג) פעילויות לוציפראז משוחזרות בריכוז (A) 1 h, (B) 2 שעות או (C) 5 שעות לאחר DMSO (בקרה) או ZCL278 בריכוז [0.5 μM], [5 μM], או [50 μM] (n = 12 לכל קבוצה). כל הנתונים נותחו באמצעות ANOVA חד-כיווני עם השוואות מרובות. ערכי P מדווחים כ- p > 0.05 (ns), p ≤ 0.05 (*), p ≤ 0.01 (**), p ≤ 0.001 (***), p ≤ 0.0001 (****). קווי שגיאה מציינים ממוצע ± שגיאת תקן של מדידה. קיצורים: מיטו = מיטוכונדריה; ER = רשתית אנדופלסמית; RLU = יחידת אור יחסית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: אימות של בדיקת לוק מפוצלת-R. (A) דוגמה לכימות של פעילות split-Rluc לאחר טיפול בתאי HEK293T עם 11 תרופות, כולל איזופרוטרנול, שזוהו במסך מורכב עבור מקדמי מגע ER-מיטוכונדריה. (B) דוגמה לבדיקת קשירת קרבה בתאי HeLa שטופלו ב-DMSO או באיזופרוטרנול (1 מיקרומטר). אות PLA (אדום) מציין מגע קרוב בין ER למיטו. Sec61-GFP (ירוק): כדי לתייג ER; DAPI (כחול): גרעין. (C) כימות אות PLA ב-A (n = 4 ניסויים עם 77-97 תאים כל אחד; מבחן מאן-ויטני). (D) ספיגת סידן מיטוכונדריאלי בתגובה להיסטמין (100 מיקרומטר). שינוי בעוצמה הפלואורסצנטית של Mito-R-GECO1 (הממוצע נלקח על פני מספר תאי HeLa) התווה כל 2.5 שניות בתאים שטופלו ב-DMSO או באיזופרוטרנול. חץ מציין תוספת היסטמין. (E) משמאל: שיא ספיגת הסידן המיטוכונדריאלי ב-A. מבחן t דו-זנבי לא מזווג (n = 10, DMOS; 14, איזופרוטרנול). מימין: קצב ספיגת הסידן במיטוכונדריה (כמו ב-A; 7.5 עד 12.5 שניות). מבחן מאן-ויטני (n = 12, DMSO; 11, איזופרוטרנול). נתון זה שונה מ Lim et al.24. קיצורים: RLU = יחידת אור יחסית; PLA = בדיקת קשירת קרבה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: סיכום הטכניקות הנוכחיות למגעים עם ER-מיטוכונדריה. רשימת יתרונות ומגבלות לכל שיטה. אנא לחץ כאן כדי להוריד טבלה זו.
קובץ משלים 1: קובץ zip המכיל רצף DNA (פורמטים PDF ו- GBK) של pCAG-MitoRluc N-T2A-R lucCER-IRES-mCherry. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S1: מפה של pCAG-MitoRluc N-T2A-R luc CER-IRES-mCherry. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
השתמשנו בבדיקת הרכבה מחדש של split-Renilla luciferase 8 (split-Rluc assay) כדי לכמת את רמת הצימודים של ER-מיטוכונדריה. במחקר זה, שינינו את המבנה המקורי של split-Rluc24 על ידי יצירת וקטור יחיד, pCAG-MitoRluc N-T2A-R lucCER-IRES-mCherry, קידוד כל רכיב split-Rluc (MitoRlucN ו- RlucCER) ורצף פפטידי 2A מפוצל מנגיף Thosea asigna כדי להבטיח ביטוי של אותה כמות של כל מחצית מפוצלת של לוציפראז. כמצע עבור Renilla luciferase, במקום coelenterazine, מצע תא חי שונה (נגזרת מוגנת של coelenterazine; ראה טבלה של חומרים) שימש מהסיבות הבאות. ראשית, שלא כמו coelenterazine אשר מייצר autoluminescence בסביבה מימית (במיוחד גרוע יותר בסרום), נגזרת מוגנת זו מייצרת autoluminescence נמוך מאוד (לעתים קרובות לא ניתן לזיהוי) בתווך המכיל 10% סרום, ולכן יחס אות לרקע שלה גבוה יותר מזה שנוצר על ידי coelenterazine. שנית, בשונה מקואלנטרזין, שם הלומינסנציה היא החזקה ביותר זמן קצר לאחר הוספת המצע אך מתחילה להצטמצם מהר מאוד, ההארה המיוצרת על ידי המצע החי שעבר שינוי מגיעה לנקודה הגבוהה ביותר שניתן להשיג כשעה וחצי לאחר הוספת המצע ונשארת רציפה במשך יותר מ-24 שעות. שינויים אלה בקינטיקה של התגובה מקלים על מדידת הארה בלוח רב-בארות, דבר שימושי מאוד לסינון בתפוקה גבוהה. יתר על כן, עוצמת האור הנוצרת על ידי המצע המוגן הנשארת קבועה בטווח הארוך מאפשרת מדידה של קבוצה אחת של דגימות במספר נקודות זמן, בניגוד למדידת קבוצות מרובות של דגימות המשמשות בנקודות זמן שונות (נקודה בודדת לדגימה).
באמצעות גרסה מעודכנת זו של מבנה ה-split-R luc, בדקנו אם RHO, RAC ו-CDC42 GTPases משתתפים ביצירת קשר עם ER-Mito. הוספנו מעכבי GTPase, Rhosin (מעכב RHO), Ehop-016 (מעכב RAC) ו-ZCL278 (מעכב CDC42), לתאי HEK293T המבטאים רכיבי split-Rluc. תוצאות הבדיקה שלנו מצביעות על כך ש- ZCL278 הוא המעכב החזק ביותר של היווצרות מגע ER-מיטוכונדריה ו- Ehop-016 הוא המעכב המשמעותי הבא, בעוד שרוסין לא השפיע על המגעים שלהם. נתונים אלה מצביעים על כך שפילמור אקטין בתיווך CDC42 (כמו גם פילמור בתיווך RAC במידה פחותה) נדרש כדי לשמור על מגעי ER-מיטוכונדריה בתא, בעוד פילמור אקטין בתיווך RHO כנראה אינו חשוב.
כדי להבטיח יעילות מרבית, ישנם שלבים קריטיים רבים שיש לקחת בחשבון עבור פרוטוקול זה. בראש ובראשונה, יש לבדוק את כמות המבנה הנגוע מכיוון שליותר מדי דנ"א יכולה להיות השפעה רעילה על התאים. שנית, מכיוון שלמספר התאים יכולה להיות השפעה משמעותית על רמות הלוציפראז שנמדדו, שמירה על צפיפות התאים קרובה למה שנאמר בפרוטוקול היא חיונית כדי להבטיח מפגש אידיאלי ועקבי של 80% תאים עד למועד הבדיקה. תיתכן ירידה בלומינסנציה אם התאים מגיעים למפגש במהלך זמן החשיפה לכימיקלים, מכיוון שתאים מתמזגים מייצרים פחות חלבון באופן כללי. שלישית, כדי להבטיח שהתאים לא יתנתקו במהלך הוספת כימיקלים ומצע, אנו משתמשים בפלטה בת 96 בארות המצופה מראש בפולי-די-ליזין. רביעית, עבור התרכובות (כולל המצע) המשמשות בפרוטוקול זה, חשוב לשמור אותן ב -20 ° C או פחות (-70 ° C) ב aliquots ולהוסיף אותם לתאים מופשרים מיד. לבסוף, בשל תנודות טמפרטורה אפשריות שיכולות להשפיע על פעילות לוציפראז, ייתכן שעדיף לבחור להשתמש בבארות הפנימיות ביותר של הצלחת ולהתעלם מהבארות המרפדות את החלק החיצוני של הצלחת.
בדיקת split-Rluc8 מציעה שיטה קלה אך חזקה לקביעת מגעי ER-מיטוכונדריה, אידיאלית לסינון בתפוקה גבוהה; עם זאת, יש כמה מגבלות שיש לציין. עבור הפיזיולוגיה של התא, קיימת בעיה של שינויים בהתנהגות התא עקב ביטוי יתר מתמיד של הדנ"א הבנוי. כיום, אנו עובדים על מבנה עם מקדם אינדוקציה כדי להילחם בשינויים הפוטנציאליים בפיזיולוגיה של התא עקב ביטוי יתר מתמיד. יתר על כן, כאשר בדיקה זו משמשת למטרת סינון, יש לציין כי תוצאות חיוביות כוזבות יכולות לנבוע מכל השפעה עקיפה של התרופות על i) רמות ביטוי, ii) יעילות ממוקדת אברונים של מקטעי החלבון האמורים, או iii) פעילויות אנזימטיות של luciferases מחדש. בשל מגבלות אלה, יש לבדוק בדיקה זו בשילוב עם שיטות אחרות כדי לאמת עוד יותר את התוצאות. טבלה 1 מתייחסת לשיטות שונות לבדיקת אתרי קשר אלה על יתרונותיהם וחסרונותיהם. ניצלנו שיטות אחרות, כולל אך לא מוגבל למבחני קשירת קרבה (PLA), אשר מזהים קרבה בין חלבונים, ומיקרוסקופ אלקטרונים תמסורת (TEM), המאפשר הדמיה ברורה של מגעי אברונים, בשילוב עם בדיקת split-Rluc כדי לאמת שהשינויים הנובעים מכך ב-RLU אכן נובעים משינויים באתרי מגע של ER-מיטוכונדריה (איור 4 ו-Lim et al.24). הראינו גם מתאם בין שינויים במגעים בין ER-מיטוכונדריה לבין פרמטרים פונקציונליים כמו העברת סידן וביקוע מיטוכונדריאלי (איור 4 ו-Lim et al.24). כדי להבטיח שהשפעת התרופות על פעילות ה-split-Rluc לא נובעת מביטוי מוגבר של הגן split-Rluc, ניתן להוסיף יחד עם התרופות מעכב שעתוק או תרגום, כפי שעשינו בעבר24.
עבור היישום של מערכת split-rluc בנוירונים מובחנים בתרבית שבה קצב הטרנספקציה נמוך, זיהום ויראלי (עם lentivirus המבטא רכיבי split-Rluc) תהיה גישה חלופית. ניתן להרחיב את השימוש בו כדי ליצור מערכת סינון שבה התאים (למשל, תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם) מהונדסים כך שיבטאו ביציבות כל רכיב של ה-split-Rluc, MitoRlucN ו-RlucCER, בין אם על ידי זיהום ויראלי או על ידי עריכת גנים בתיווך CRSPR. עם זאת, עבור מערכת ביטוי יציבה, יש להיות מודעים לכך שיכול להיות לחץ ברירה עבור תאים לסבול טוב יותר את מערכת split-Rluc, אשר עשוי שלא לייצג את המצב הפיזיולוגי הנורמלי. התאמה או בחירה זו עלולה לגרום להטיה בתוצאות הניסוי.
לסיכום, למרות כמה מהמגבלות שנדונו לעיל, Split-Rluc הוא בדיקה מהירה, פשוטה ורבת עוצמה לסינון בתפוקה גבוהה עבור מולקולות קטנות או גנים המווסתים את המגעים בין אברונים בתא, כפי שהוכח במחקר סינון התרופות הקודם שלנו24.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
המחברים מודים לד"ר ג'פרי גולדן (המרכז הרפואי סידרס-סיני) על הסקירה הביקורתית של כתב היד. עבודה זו מומנה בחלקה על ידי המכון הלאומי למחלות נוירולוגיות ושבץ (NINDS, R01NS113516).
Materials
| Name | Company | Catalog Number | Comments |
| 1.7 mL SafeSeal Microcentrifuge Tube | Sorenson | 16070 | |
| 6-well plate TC Treated | USA Scientific | CC7682-7506 | |
| 10 mL Pipette Tips OneTip | USA Scientific | 1110-3700 | |
| 10 μL pipette tips OneTip | USA Scientific | 1110-3700 | |
| 20-200 μL Beveled tips OneTip | USA Scientific | 1111-1210 | |
| 50 mL Polypropylene Conical Tube | Falcon | 352070 | |
| 96-Well Flipper Microtube Racks | ThermoFisher Scientific | 8770-11 | |
| 96-well plate TC Treated | USA Scientific | CC7682-7596 | |
| 100 mm x 20 mm TC Treated Dish | USA Scientific | CC7682-3394 | |
| 1250 μL Tips OneTip | USA Scientific | 1112-1720 | |
| Centrifuge 5910 Ri - Refrigerated Centrifuge | Eppendorf | 5943000131 | |
| Dimethyl sulfoxide, anhydrous, ≥99.9% | Sigma-Aldrich | 276855-100ML | |
| DMEM, high glucose | ThermoFisher Scientific | 11965092 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| EHop 016 | Bio-Techne Tocris | 6248 | Dissolve in DMSO; store at -70 °C |
| EnduRen Live Cell Substrate | Promega | E6481 | Store aliquots at -70 °C |
| Eppendorf 2-20 μL pipette | Eppendorf | 3123000039 | |
| Eppendorf Research plus 100-1000 μL pipette | Eppendorf | 3123000063 | |
| Eppendorf Research Plus 1-10 µL pipette | Eppendorf | 3123000020 | |
| Eppendorf Research plus 12-channel | Eppendorf | 3125000028 | |
| Eppendorf Research plus 200 μL pipette | Eppendorf | 3123000055 | |
| Fetal Bovine Serum, qualified, USDA-approved regions | ThermoFisher Scientific | 10437028 | |
| Forma Steri-Cycle CO2 Incubator, 184 L, Polished Stainless Steel | ThermoFisher Scientific | 381 | |
| Hand tally counter | Sigma-Aldrich | HS6594 | |
| HEK 293T Cells | ATCC | CRL-3216 | |
| Hemacytometer - Neubauer Bright Line, Double-Counting Chamber | LW Scientific | CTL-HEMM-GLDR | |
| Invitrogen TE Buffer | ThermoFisher Scientific | 8019005 | |
| Microscope | Zeiss | Axiovert 25 CFL | |
| Mini centrifuge | Benchmark Scientific | C1012 | |
| Multi Tube Rack For 50ml Conical, 15ml Conical, And Microcentrifuge Tubes | Boekel Scientific | 120008 | |
| PEI MAX - Transfection Grade Linear Polyethylenimine Hydrochloride (MW 40,000) | Polysciences | 24765-100MG | |
| Pipet-Aid XP | USA Scientific | 4440-0101 | |
| Poly-D-lysine hydrobromide | Sigma-Aldrich | P6407-5MG | |
| Rhosin hydrochloride | Bio-Techne Tocris | 5003 | Dissolve in DMSO; store at -70 °C |
| Trypsin-EDTA (0.05%), phenol red | ThermoFisher Scientific | 25300054 | |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | |
| Vortex | ThermoFisher Scientific | 2215365 | level 8 |
| VWR Vacuum Aspiration System | VWR | 75870-734 | |
| ZCL 278 | Bio-Techne Tocris | 4794 | Dissolve in DMSO; store at -70 °C |
References
- Aoyama-Ishiwatari, S., Hirabayashi, Y. Endoplasmic reticulum-mitochondria contact sites-emerging intracellular signaling hubs. Front Cell Dev Biol. 9, 653828(2021).
- Sassano, M. L., Felipe-Abrio, B., Agostinis, P. ER-mitochondria contact sites; a multifaceted factory for Ca2+ signaling and lipid transport. Front Cell Dev Biol. 10, 988014(2022).
- Scorrano, L., et al. Coming together to define membrane contact sites. Nat Commun. 10 (1), 1287(2019).
- Voeltz, G. K., Sawyer, E. M., Hajnóczky, G., Prinz, W. A. Making the connection: How membrane contact sites have changed our view of organelle biology. Cell. 187 (2), 257-270 (2024).
- Paillusson, S., et al. There's something wrong with my MAM; the ER-mitochondria axis and neurodegenerative diseases. Trends Neurosci. 39 (3), 146-157 (2016).
- Sasi, U. S. S., Sindhu, G., Raj, P. S., Raghu, K. G. Mitochondria associated membranes (MAMs): emerging drug targets for diabetes. Curr Med Chem. 27 (20), 3362-3385 (2019).
- Joshi, A. U., Kornfeld, O. S., Mochly-Rosen, D. The entangled ER-mitochondrial axis as a potential therapeutic strategy in neurodegeneration: A tangled duo unchained. Cell Calcium. 60 (3), 218-234 (2016).
- Moltedo, O., Remondelli, P., Amodio, G. The mitochondria-endoplasmic reticulum contacts and their critical role in aging and age-associated diseases. Front Cell Dev Biol. 7, 172(2019).
- Rieusset, J. The role of endoplasmic reticulum-mitochondria contact sites in the control of glucose homeostasis: an update. Cell Death Dis. 9 (3), 388(2018).
- Bouguerra, M. D., Lalli, E. ER-mitochondria interactions: Both strength and weakness within cancer cells. Biochim Biophys Acta Mol Cell Res. 1866 (4), 650-662 (2019).
- Tepikin, A. V. Mitochondrial junctions with cellular organelles: Ca2+ signalling perspective. Pflügers Arch. 470 (8), 1181-1192 (2018).
- Masson, G. L., Przedborski, S., Abbott, L. F. A computational model of motor neuron degeneration. Neuron. 83 (4), 975-988 (2014).
- Giamogante, F., Barazzuol, L., Brini, M., Calì, T. ER-mitochondria contact sites reporters: strengths and weaknesses of the available approaches. Int J Mol Sci. 21 (21), 8157(2020).
- Rizzuto, R., et al. Close contacts with the endoplasmic reticulum as determinants of mitochondrial Ca2+ responses. Science. 280 (5370), 1763-1766 (1998).
- Valm, A. M., et al. Applying systems-level spectral imaging and analysis to reveal the organelle interactome. Nature. 546 (7656), 162-167 (2017).
- Csordás, G., et al. Imaging interorganelle contacts and local calcium dynamics at the ER-mitochondrial interface. Mol Cell. 39 (1), 121-132 (2010).
- Cieri, D., et al. SPLICS: a split green fluorescent protein-based contact site sensor for narrow and wide heterotypic organelle juxtaposition. Cell Death Differ. 25 (6), 1131-1145 (2018).
- Kakimoto, Y., et al. Visualizing multiple inter-organelle contact sites using the organelle- targeted split-GFP system. Sci Rep. 8 (1), 6175(2018).
- Wu, M. M., Covington, E. D., Lewis, R. S. Single-molecule analysis of diffusion and trapping of STIM1 and Orai1 at ER-plasma membrane junctions. Mol Biol Cell. 25 (22), Mac.E14-06-1107 (2014).
- Csordas, G., et al. Structural and functional features and significance of the physical linkage between ER and mitochondria. J Cell Biol. 174 (7), 915-921 (2006).
- de Brito, O. M., Scorrano, L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature. 456 (7222), 605-610 (2008).
- Kremer, A., et al. Developing 3D SEM in a broad biological context. J Microsc. 259 (2), 80-96 (2015).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3 (12), 995-1000 (2006).
- Lim, Y., Cho, I. -T., Rennke, H. G., Cho, G. β2-adrenergic receptor regulates ER-mitochondria contacts. Sci Rep. 11 (1), 21477(2021).
- Lam, S. S., et al. Directed evolution of APEX2 for electron microscopy and proximity labeling. Nat Methods. 12 (1), 51-54 (2014).
- Cho, I. -T., et al. Ascorbate peroxidase proximity labeling coupled with biochemical fractionation identifies promoters of endoplasmic reticulum-mitochondrial contacts. J Biol Chem. 292 (39), 16382-16392 (2017).
- Lim, Y., Cho, I. -T., Schoel, L. J., Cho, G., Golden, J. A. Hereditary spastic paraplegia-linked REEP1 modulates endoplasmic reticulum/mitochondria contacts. Ann Neurol. 78 (5), 679-696 (2015).
- Arnold, T. R., Stephenson, R. E., Miller, A. L. Rho GTPases and actomyosin: Partners in regulating epithelial cell-cell junction structure and function. Exp Cell Res. 358 (1), 20-30 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved