Method Article
בידוד וניתוח שעתוק של סוגי תאי צמח
In This Article
Summary
ההיתכנות והיעילות של שיטות scRNA-seq בעלות תפוקה גבוהה מבשרות על עידן חד-תאי בחקר צמחים. מוצג כאן הליך חזק ומלא לבידוד סוגי תאי שורש ספציפיים של Arabidopsis thaliana ובנייה וניתוח של ספריית שעתוק לאחר מכן.
Abstract
באורגניזמים רב-תאיים, תכנות התפתחותי ותגובות סביבתיות יכולים להיות שונים מאוד בסוגי תאים שונים או אפילו בתוך תאים, מה שידוע בשם הטרוגניות תאית. בשנים האחרונות, בידוד תא בודד וסוג תא בשילוב עם טכניקות ריצוף הדור הבא (NGS) הפכו לכלים חשובים לחקר תהליכים ביולוגיים ברזולוציה של תא יחיד. עם זאת, בידוד תאי צמח הוא יחסית קשה יותר בשל נוכחותם של קירות תאי הצמח, אשר מגביל את היישום של גישות חד-תאיות בצמחים. פרוטוקול זה מתאר הליך חזק למיון תאים המופעלים על ידי פלואורסצנטיות (FACS) המבוסס על בידוד תא בודד וסוג תא עם תאי צמחים, המתאים לניתוח מולטי-אומיקס במורד הזרם ולמחקרים אחרים. באמצעות שימוש בקווי סמן פלואורסצנטיים של שורש Arabidopsis אנו מדגימים כיצד סוגי תאים מסוימים, כגון תאי פריסייקל של קוטב קסילם, תאי שורש ראשוניים רוחביים, תאי כובע שורש רוחביים, תאי קליפת המוח ותאים אנדודרמליים, מבודדים. יתר על כן, שיטת ניתוח תמלול יעילה במורד הזרם באמצעות Smart-seq2 מסופקת גם כן. שיטת בידוד התאים וטכניקות ניתוח התעתיק ניתנות להתאמה לסוגי תאים אחרים ולמיני צמחים ויש להן פוטנציאל יישום רחב במדעי הצמח.
Introduction
תאים הם היחידה הבסיסית של כל האורגניזמים החיים ומבצעים פונקציות מבניות ופיזיולוגיות. למרות שהתאים באורגניזמים רב-תאיים מראים סינכרוניות לכאורה, תאים מסוגים שונים ותאים בודדים מציגים הבדלים בתעתיק שלהם במהלך ההתפתחות ובתגובות סביבתיות. ריצוף RNA חד-תאי בתפוקה גבוהה (scRNA-seq) מספק עוצמה חסרת תקדים להבנת הטרוגניות תאית. יישום scRNA-seq במדעי הצמח תרם לבנייה מוצלחת של אטלס תאי צמח1, שימש לזיהוי טקסים תאיים נדירים ברקמות צמח2, סיפק תובנה לגבי הרכב סוגי התאים ברקמות צמחים, ושימש לזיהוי זהות תאית ופונקציות חשובות המשמשות במהלך התפתחות והתמיינות צמחים. בנוסף, ניתן להסיק מסלולי התפתחות מרחביים-זמניים ברקמות צמחים 1,2,3 כדי לגלות גנים חדשים של סמן4 ולחקור את תפקודם של גורמי שעתוק חשובים5 באמצעות scRNA-seq כדי לחשוף את השימור האבולוציוני של אותו סוג תא בצמחים שונים3. עקה אביוטית היא בין ההשפעות הסביבתיות החשובות ביותר על גדילה והתפתחות של צמחים. על ידי חקירת השינויים בהרכב סוגי התאים ברקמות צמחים בתנאי טיפול שונים באמצעות ריצוף שעתוק חד-תאי, ניתן גם לפתור את מנגנון תגובת העקה הא-ביוטית6.
הפוטנציאל לפתרון הטרוגניות שעתוק בין סוגי תאים באמצעות ריצוף scRNA תלוי בשיטת בידוד התאים ובפלטפורמת הריצוף. מיון תאים המופעלים על ידי פלואורסצנטיות (FACS) היא טכניקה נפוצה לבידוד תת-אוכלוסייה של תאים עבור scRNA-seq בהתבסס על פיזור האור והתכונות הפלואורסצנטיות של התאים. פיתוח קווי סמן פלואורסצנטיים על ידי טכנולוגיה טרנסגנית שיפר מאוד את יעילות בידוד התאים על ידי FACS7. ביצוע scRNA-seq באמצעות Smart-seq28 משפר עוד יותר את היכולת לנתח את ההטרוגניות התאית. לשיטת Smart-seq2 יש רגישות טובה לזיהוי גנים והיא יכולה לזהות גנים גם עם קלט תעתיק נמוך9. בנוסף לאיסוף סוגי תאים בתפזורת, ממייני תאים מודרניים מספקים תבנית מיון אינדקס של תא יחיד, המאפשרת ניתוח תעתיק ברזולוציה של תא בודד באמצעות Smart-seq210 או שיטות RNA-seq מרובות אחרות, כגון CEL-seq211. מיון תא בודד או סוג תא יכול לשמש פוטנציאלית עבור יישומים רבים אחרים במורד הזרם, כגון מחקרי מולטי-אומיקה מקבילים12,13. מוצג כאן פרוטוקול חזק ורב-תכליתי לבידוד סוגי תאי צמחים, כגון תאי פריסייקל בקוטב קסילם, תאי כובע שורש רוחביים, תאי שורש ראשוניים רוחביים, תאי קליפת המוח ותאים אנדודרמליים משורשי קווי תאי סמן Arabidopsis thaliana על ידי FACS. הפרוטוקול כולל גם בניית ספריית Smart-seq2 לניתוח תמלול במורד הזרם.
Protocol
הפרוטוקול הבא עבר אופטימיזציה עבור זרעי A. thaliana wild-type (WT) ללא קווי סמן פלואורסצנטי ופלואורסצנטי עבור סוגי תאי השורש הבאים: תאי פריסייקל בקוטב קסילם (J0121), תאי שורש ראשוניים לטרליים, תאי כובע שורש רוחביים (J3411), אנדודרמיס ותאי קליפת המוח (J0571) (איור 1A). כל קווי הסמנים התקבלו ממקור מסחרי (ראה טבלת חומרים), למעט קו סמן תא התחלת שורש רוחבי, שנוצר על ידי החדרת מבנה GFP מונע מקדם GATA23 לצמח ארבידופסיס מסוג בר בעקבות דו"ח14 שפורסם בעבר.
1. הכנת החומר הצמחי
- יש לעקר את זרעי A. thaliana WT ואת זרעי קו הסמן הפלואורסצנטי על ידי דגירה של הזרעים באקונומיקה של 20% באינקובטור מסתובב בטמפרטורת החדר למשך 15 דקות.
- שטפו את הזרעים במים מזוקקים פעמיים (ddH2O) שלוש עד חמש פעמים. בצעו שלב זה על ספסל סטרילי ונקי.
- מקציפים את זרעי קו ה-WT והכתב על מדיום Murashige ו-Skoog (MS) בחצי חוזק עם 0.8% אגר (w/v)15. לגדל את הצמחים אנכית במשך 5 ימים (16 שעות אור ב 23 ° C) לאחר ריבוד במשך 2 ימים ב 4 °C (75 °F).
2. Protoplasting
- הכינו את תמיסות הפרוטו-עמידות2,5, המכונות תמיסה א' ותמיסה ב' (ראו טבלת חומרים).
- הכן תמיסה A המכילה 400 mM mannitol, 0.05% BSA, 20 mM MES (pH 5.7), 10 mM CaCl2 ו-20 mM KCl (ראה טבלת חומרים). אחסנו את תמיסה A בטמפרטורה של -20°C למשך עד חודש אחד.
- הכינו תמיסה B על-ידי הוספת 1% (w/v) צלולאז R10, 1% (w/v) צלולאז RS, 1% (w/v) המיצלולאז, 0.5% (w/v) פקטוליאז, ו-1% (w/v) macerozyme R10 באליציטוט טרי של תמיסה A. אחסנו תמיסה B בטמפרטורה של -20°C למשך עד חודש אחד.
- הפשירו בעדינות את תמיסה א' ותמיסה ב' על קרח לפני תחילת הניסוי.
- חותכים את השורשים באמצעות להב נקי או מספריים, וקוצצים את השורשים לחתיכות ~0.5 ס"מ. השקיעו את השורשים ב-1.5 מ"ל של תמיסה B ולאחר מכן סיבוב עדין (בערך 18 סל"ד) בטמפרטורת החדר למשך 1.5-2 שעות.
- סנן את הפרוטופלסטים של השורש דרך רשת המסננת בגודל 40 מיקרומטר (ראה טבלת חומרים).
- שטפו את רשת המסננת עם 1-2 מ"ל של תמיסה A.
- שלב את הנוזלים של שלב 2.4 ושלב 2.5, וצנטריפוגה ב 300 x גרם במשך 5 דקות ב 4 ° C. השליכו את הסופרנאטנט עם פיפטה, השהו מחדש את גלולת התא ב 500-600 מיקרוליטר של תמיסה A, ולאחר מכן הניחו אותה על קרח מיד.
- העבר את תמיסת התאים המרחפים למבחנה חדשה של 5 מ"ל למיון תאים.
3. מיון תאים המופעלים על ידי פלואורסצנטיות (FACS)
- הפעל וסיים את שלבי הגדרת המכשיר במיון (ראה טבלת חומרים). בחרו את התעלות הפלואורסצנטיות, השתמשו בצמח WT (ללא פלואורסצנציה) כבקרה כדי לקבוע את קו הבסיס לפלואורסצנטיות עצמית, וכווננו את שער המיון בהתבסס על עוצמת הפלואורסצנטיות וסינגלי FSC/SSC (איור 2).
- הוסף 500 μL של תמיסה A (שלב 2.1.1) לתוך צינור איסוף של 1.5 מ"ל כדי למנוע נזק לתאים. לאסוף 2,000-3,000 תאים בכל צינור.
- לאחר המיון, מיד מניחים את הדגימות על קרח, צנטריפוגות את צינור האיסוף המכיל את התאים ב 300 x גרם במשך 5 דקות ב 4 ° C, ולהסיר את supernatant עם פיפטה.
- קח 2 μL של תאים ממוינים, ולבדוק פלואורסצנטיות באמצעות מיקרוסקופ פלואורסצנטי (ראה טבלה של חומרים).
- אחסן את התאים הממוינים ב- -80°C, או השתמש בהם מיד לבניית ספריה (שלב 4).
- למיון אינדקס של תא יחיד, מקם את לוח 96 הבארות במתאם. כיילו את מיקום הצלחת כך שהטיפה תיפול בחור המרכזי של הצלחת. בחר מצב מיון של תא בודד בעת המיון, הזן את מספר היעד של התאים הממוינים כ- 1 והתחל במיון.
4. הכנת ספריית Smart-seq2
- כתוצאה מכמות הקלט הנמוכה במיוחד, בצע בניית ספריית RNA-seq מסוג תא בודד בסביבה נטולת זיהום. לפני תחילת הניסוי, נקו את הספסל עם מזהם משטח8 (ראו טבלת חומרים) ו-75% אתנול.
- הכינו חיץ ליזיס (תערובת A) (טבלה 1) על ידי שילוב של 0.33 μL של 10% Triton X-100, 0.55 μL של מעכב RNase ו-0.22 μL של 0.1 M DTT (ראו טבלת חומרים).
- מוסיפים 1 μL של תערובת A לתוך מדגם ממוין, וטוחנים עם מזיק סטרילי. נפח המדגם המועדף הוא ≤0.5 מיקרוליטר; השתמש במים נטולי RNase כדי לפצות על נפח של 14 μL. העבר כל דגימת תא בודד לתוך צינור PCR דק דופן 0.2 מ"ל.
- הכינו תערובת B המכילה 0.44 מיקרוליטר פריימר תגובה אוליגו-dT30VN (RT) (100 מיקרומטר) ו-4.4 מיקרוליטר של dNTPs (10 מילימטר) (טבלה 2) (ראו טבלת חומרים).
- הוסיפו 4.4 מיקרוליטר של תערובת B ל-14 מיקרוליטר הדגימה בכל צינור, פיפטה בעדינות כדי לערבב את הדגימה, ודגרו על הדגימה בטמפרטורה של 72°C למשך 3 דקות. לאחר הדגירה, מיד לשים את הדגימות על קרח כדי הכלאה oligo-dT זנב פולי A.
- הכינו את תערובת תגובת השעתוק ההפוך (תערובת C) (טבלה 3) (ראו טבלת חומרים). הוסף 21.6 μL של תערובת C לכל צינור המכיל את הדגימות. הפעל את תוכנית RT במכשיר PCR נפוץ (טבלה 4).
- בצע את תגובת ההגברה מראש על קרח. הכינו תערובת D על ידי שילוב של 44 μL של תערובת 2x PCR פולימראז ו-0.88 μL של פריימר IS PCR (10 μM) (טבלה 5) (ראו טבלת חומרים). הוסף 40.8 μL של תערובת D למוצר תגובת RT של 40 μL, והפעל את תוכנית קדם-הגברה (טבלה 6).
- לטהר את מוצרי תגובת קדם-הגברה באמצעות חרוזי Ampure XP (ראה טבלת חומרים). הוסיפו 48 מיקרוליטר חרוזים (יחס של 0.6:1) לכל דגימה משלב 4.7, וערבבו בעדינות את הדגימות על ידי פיפט.
- יש לדגור על הדגימות בטמפרטורת החדר למשך 10 דקות. הניחו את צינורות ה-1.5 מ"ל המכילים את הדגימות על מעמד הפרדה מגנטית למשך 5 דקות. יש להשליך בזהירות את הסופרנאטנט מהדגימות מבלי להפריע לחרוזים.
- שטפו את החרוזים על ידי השעייתם מחדש ב-200 מיקרוליטר של 80% אתנול, והניחו את הדגימות על מעמד ההפרדה המגנטית (ראו טבלת חומרים) למשך 3 דקות נוספות לפני השלכת הסופרנטנט המכיל אתנול.
- ייבשו את הדגימות באוויר למשך 10 דקות, וכסו את הצינורית כדי למנוע זיהום וזיהום צולב במהלך ייבוש האוויר.
- השהה מחדש את החרוזים ב 20 μL של ddH2O, לדגור את הדגימות בטמפרטורת החדר במשך 5 דקות, ולאחר מכן להניח אותם על מעמד ההפרדה המגנטית במשך 5 דקות.
- פיפטה מוציאה 18 מיקרוליטר של הסופרנאטנט מכל צינור, ומעבירה את הדגימות לצינורות צנטריפוגות חדשים של 1.5 מ"ל. השתמש ב- 1 μL של הדגימה כדי להעריך את איכות ה- cDNA באמצעות ערכת כימות DNA, קבע את התפלגות הגודל של כל קדם-ספרייה באמצעות מנתח מקטעים (ראה טבלת חומרים), ואחסן את הדגימה הנותרת ב- -20 °C.
- בניית ספריית cDNA8 עבור ריצוף Illumina 16 מהמכפלה הקדם-ספרייתית של שלב4.13 באמצעות ערכת הכנת ספריית רצף (ראה טבלת חומרים).
- לטהר את הספריות (משלב 4.14) באמצעות חרוזי Ampure XP, לכמת את הספריות המטוהרות ולקבוע את התפלגות הגודל של כל ספרייה לאחר שלב 4.13.
הערה: אחסן ננו-שומות שוות של כל ספרייה, וודא שלאף אחת מהן אין את אותו שילוב של אינדקס Illumina. אחרת, ניתן לאגד את הספריות ביחס המבוסס על פלט הרצף הרצוי ולרצף אותן יחד באותו נתיב של רצף האילומינה. באופן כללי, ריצוף כל ספרייה לעומק של 4-6 GB, המניב >10 מיליון קריאות ממופות, מספק כיסוי פי 20x-30 של גנום Arabidopsis . עומקי רצף נמוכים יותר מקובלים גם הם, אך עשויים להשפיע על משמעות ניתוח הביטוי הדיפרנציאלי.
5. ניתוח נתוני RNA-seq
- חתוך את הקריאות הגולמיות באמצעות Trim-Galore17 ולאחר מכן מיפוי לגנום הייחוס באמצעות hisat218 (daehwankimlab.github.io/hisat2), והסר את המקטעים המשוכפלים PCR באמצעות Picard19 (broadinstitute.github.io/picard).
- בצע את עיבוד הספירה הגולמית וניתוח עוקב של הגנים המבוטאים באופן דיפרנציאלי (DEG) עם DESeq220 באמצעות לפחות שלושה עותקים ביולוגיים עבור כל דגימה. בצע אשכולות של ביטוי הגנים עם חבילת Pheatmap, והצג באופן חזותי במפת חום של ביטוי.
הערה: ערכי RPKM (קריאות לקילו-בסיס למיליון קריאות ממופות) של הגנים וה-TEs (רכיבים הניתנים לטרנספוזיה) חושבו באמצעות Stringtie18 (github.com/gpertea/stringtie) והוצגו באופן חזותי בדפדפן גנום.
תוצאות
בידוד פרוטופלסט
פרוטוקול זה יעיל למיון פרוטופלסטים של קווי סמן שורש פלואורסצנטי A. thaliana . קווי הסמנים האלה פותחו על-ידי מיזוג של חלבונים פלואורסצנטיים עם גנים שמתבטאים באופן ספציפי בסוגי תאי מטרה, או על-ידי שימוש בקווי מלכודת משפרים (איור 1). רקמות ואיברים רבים נותחו לסוגי תאים המבטאים סמנים פלואורסצנטיים ספציפיים בצמחי מודל ובגידולים.
אוכלוסיית FACS, תאים ממוינים ו- QC ספריה
על-ידי שימוש בצמח מסוג בר כבקרה והצבת שערים כגון פיזור קדמי (FSC) ופיזור צדדי (SSC), קבענו אוכלוסייה עיקרית של תאים מעניינים וקו בסיס לאוטופלואורסצנטיות, ומיינו בהצלחה את התאים המסומנים הספציפיים לפלואורסצנטיות (איור 2). איכות ספריות הרצף הסופיות (משלב 4.15) נקבעה על ידי ניתוח התפלגות גודל הפרגמנט. התוצאות המייצגות של ספריית RNA-seq של כ-2,000 תאי פריסייקל בקוטב קסילם, תאי פרימורדיה של שורש לטרלי, תאי אנדודרמיס/קליפת המוח ותאי כובע שורש רוחביים מוצגות באיור 3A-D.
ניתוח דפוסי ביטוי
ניתן להעריך את איכות נתוני הרצף מהליכי ניתוח מרובים, כגון עומק רצף, קצב מיפוי ודוחות fastQC. ניתן להדגים את הדיוק והרגישות של נתוני הריצוף על ידי נוכחות של סדרה של גנים מועשרים מסוג תא, אשר ניתן לזהות מניתוח DEG בין סוגי תאים מבודדים לבין הרקמה כולה. גנים עם רמות ביטוי גבוהות משמעותית בסוגי תאים מסוימים יכולים להיות מזוהים כגנים מועשרים מסוג תא. בינתיים, ניתן להשוות את תצוגות דפדפן הגנום של כל סוג תא זו לצד זו כדי להראות את רמות הביטוי של גנים סמנים ידועים ולבדוק אם ניתן לשחזר את תבנית הביטוי של גני הסמן בנתוני הביטוי של סוג התא. לדוגמה, הגנים המועשרים בכל אחד מארבעת סוגי תאי השורש קובצו והוצגו במפת חום, אשר הראתה את הספציפיות של ביטוי גנים בין סוגי תאים שונים (איור 4). YUCCA3, MYB36, WOX5 ו-PFA1 נבדקו, ודפוסי הביטוי היו כצפוי על פי דיווחים קודמים21,22,23,24. צינורות ניתוח נתונים ונתוני רצף גולמיים מייצגים זמינים במאגר ציבורי (github.com/gaolabsjtu/root_cell_types_RNAseq).
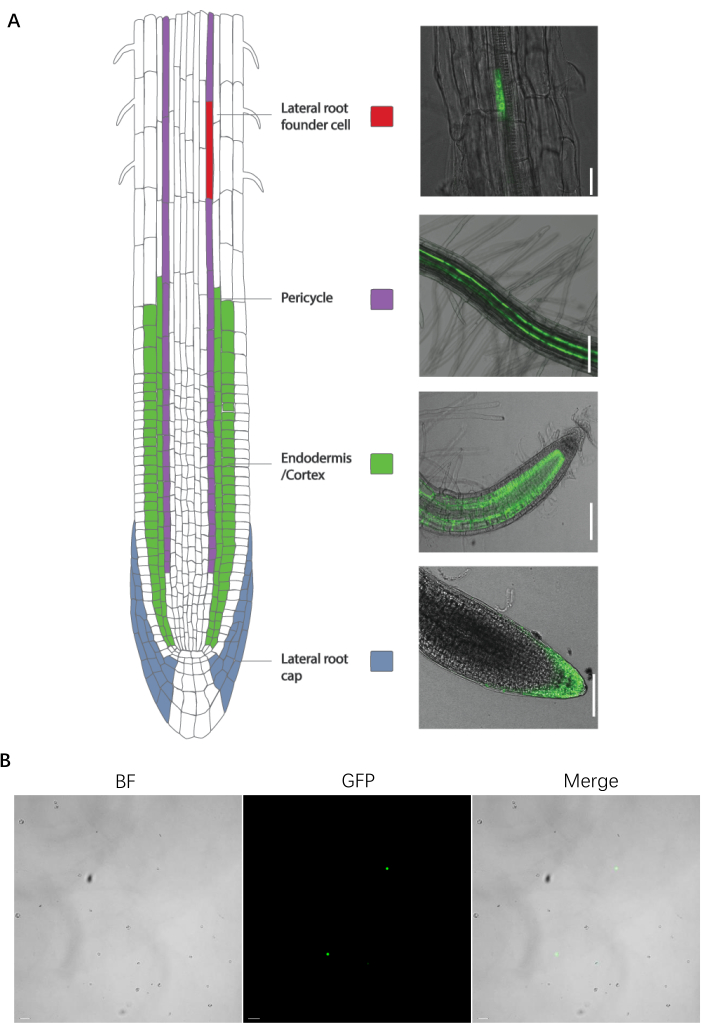
איור 1: קו סמן סוג התא הספציפי של הכנת שורש ופרוטופלסט . (A, משמאל) מבוא ותמונות של קו השמנה משופר. (א', מימין) קו סמן סוג התא הספציפי של השורש. (B) תמונה של הכנת הפרוטופלסט לפני המיון. פסי קנה המידה של תא מייסד השורש הצידי, הפריסייקל, האנדודרמיס/קליפת המוח, כובע השורש הצידי והפרוטופלסטים מייצגים 25 מיקרומטר, 100 מיקרומטר, 100 מיקרומטר, 75 מיקרומטר ו-20 מיקרומטר, בהתאמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: הקמת FACS עבור סוגי תאי שורש ספציפיים. דוגמה לניסוי FACS: (A) האוכלוסייה העיקרית באמצעות SSC ו- FSC; (B) שערי GFP חיוביים (+) ושערי GFP שליליים (−); (C) השדה הבהיר ו-(D) תמונות פלואורסצנטיות של התאים הממוינים. סרגל קנה המידה מייצג 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
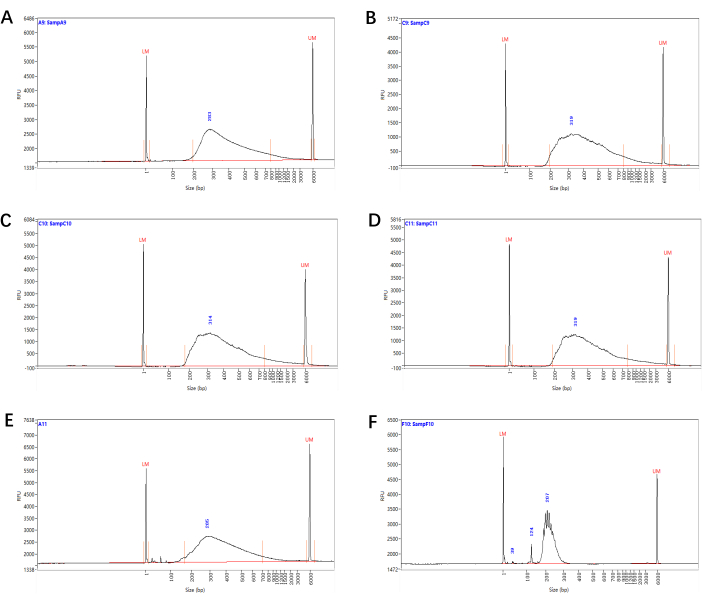
איור 3: התפלגות הגודל של ספריות רצף Smart-seq2. התפלגות גודל מקטעים מייצגת של ספריות הרצף (משלב 4.15) הנוצרות מתאי פריסייקל של קוטב קסילם (A), תאי פרימורדיה של שורש לרוחב (B), תאי אנדודרמיס/קליפת המוח (C) ותאי כובע שורש לטרליים (D). (E) ספרייה בגודל קטן עם פסגות דימר פריימר/מתאם, שעדיין ניתן לרצף לאחר בחירת גודל. (ו) ספרייה עם התפלגות גודל חריגה, המעידה על הכנה לא מוצלחת של הספרייה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: ניתוח גנים מועשרים בסוג התא. ניתוח DEG בוצע בין כל סוג תא לבין השורש כולו; גנים עם יותר מפי ארבעה upregulation בכל סוג תא זוהו כגנים מועשרים בסוג התא. גנים אלה שולבו, קובצו והודגמו בתרשים מפת החום (הפאנל העליון). הגנים המועשרים בסוג התא כללו גנים ידועים רבים של סמן; גני סמן אופייניים כגון YUCCA3, MYB36, WOX5 ו - PFA1 נבחרו להופיע בדפדפן הגנום (פאנל תחתון). קיצורים: LRP = פרימורדיה שורש לרוחב; אנדו/קור = אנדודרמיס/קליפת המוח; LRC = מכסה שורש רוחבי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| רכיבים | נפח (μL) |
| 10% טריטון X-100 | 0.33 |
| מעכב RNase | 0.55 |
| DTT (0.1 מטר) | 0.22 |
טבלה 1: מרכיבי תגובה להכנת חיץ ליזה של התא (תערובת A).
| רכיבים | נפח (μL) |
| Oligo-dT30VN (100 מיקרומטר) | 0.44 |
| dNTPs (10 mM) | 4.4 |
טבלה 2: מרכיבי תגובה להכנת תערובת B.
| רכיבים | נפח (μL) |
| מאגר SuperScript IV (5x) | 8.8 |
| בטאין (5 מטר) | 8.8 |
| DTT (0.1 מטר) | 2.2 |
| MgCl2 (1 מטר) | 0.264 |
| TSO (100 מיקרומטר) | 0.44 |
| תעתיק הפוך SuperScript IV (200 U/μL) | 2.2 |
| מעכב RNase | 1.1 |
טבלה 3: רכיבי תגובה להכנת תערובת PCR בשעתוק לאחור (תערובת C).
| מחזור | טמפרטורה (°C) | זמן |
| 1 | 50 | 90 דק' |
| 2-11 | 55 | 2 דקות |
| 50 | 2 דקות | |
| 12 | 70 | 15 דק' |
| 13 | 4 | ∞ |
טבלה 4: הגדרות PCR של שעתוק לאחור (RT) לסינתזה של cDNA מ-mRNA.
| רכיבים | נפח (μL) |
| KAPA HiFi HotStart ReadyMix (2x) | 44 |
| פריימר IS PCR (10 מיקרומטר) | 0.88 |
טבלה 5: מרכיבי תגובה להכנת תערובת תגובת קדם-הגברה (תערובת D).
| מחזור | טמפרטורה (°C) | זמן |
| 1 | 98 | 5 דקות |
| 2-13 | 98 | 20 שניות |
| 67 | 30 שניות | |
| 72 | 3 דקות | |
| 14 | 72 | 5 דקות |
| 15 | 4 | ∞ |
טבלה 6: הגדרות תוכנית PCR עבור תגובת קדם-הגברה.
Discussion
הפרוטוקול מבוסס Smart-seq2 יכול ליצור ספריות רצף אמינות מכמה מאות תאים8. איכות חומר המוצא חיונית לדיוק ניתוח התמלול. FACS הוא כלי רב עוצמה להכנת תאים מעניינים, אך הליך זה, במיוחד השלב הפרוטו-מתמשך, חייב להיות מותאם ליישומים צמחיים. מיקרודיסקציה ללכידת לייזר (LCM) או תאים מנותחים ידנית יכולים לשמש גם כקלט25,26, כך שהפרוטוקול המסופק כאן יכול לשמש במגוון מיני צמחים וסוגי תאים עם או בלי גני סמן ידועים.
הכנת החומר הצמחי
בביולוגיה התפתחותית של צמחים, FACS משמש בדרך כלל לבידוד אוכלוסיות תאים מועשרות המבטאות סמן פלואורסצנטי. הצמחים המבטאים סמן כזה הם פרוטופלסטיים, והפרוטופלסטים ממוינים בסופו של דבר לתת-אוכלוסיות טהורות בהתבסס על ביטוי הסמן הספציפי לסוג התא. לכן, האות של סמן פלואורסצנטי חייב להיות חזק וספציפי. בנוסף, על החוקר לבדוק מראש אילו סמנים ניתן למיין. מספר הזרעים הדרושים תלוי ברמת הביטוי, היכן הסמן מבוטא, כמה תאים דרושים ליישומים במורד הזרם, וכמה עותקים משוכפלים ממוינים. אם הביטוי הוא בסוג תא יחיד עם מעט מאוד תאים לכל צמח, בדרך כלל יש צורך במספר גדול יותר של צמחים מאשר אם הסמן מבוטא במספר גבוה יותר של תאים. עדיף לקבוע אמפירית את מספר הזרעים הדרושים לקווי סמן בודדים. חשוב במיוחד לבצע ניסויים מקדימים עם כל קו סמן כדי לייעל את חלון המיון ולדעת כמה תאים ינבעו ממספר קבוע של צמחים. אם החומר הניסיוני הוא שורשים, כדי למנוע מהשורשים לשקוע באגר וכדי להקל על חיתוך שורשים נקיים, ניתן להניח רשת בגודל מתאים ואוטוקלאבית על האגר המכיל מדיום לפני ציפוי הזרעים. ריבוד בטמפרטורה נמוכה מסייע לנביטת זרעים והתפתחותם, ולכן אנו ממליצים לרבד את הזרעים ב -4 מעלות צלזיוס למשך יומיים לאחר עיקור או ציפוי ולאחר מכן גידול הצמחים אנכית.
Protoplasting ו- FACS
פרוטופ ומיון 5-6 ימים לאחר הריבוד עובדים היטב. יש לסנן את פתרון א' ואת תמיסה ב' באמצעות מסננת בגודל 0.22 מיקרומטר. בנוסף, אחסון תמיסה B בטמפרטורה של -20°C לפרקי זמן ארוכים יותר מפחית את יעילות האנזימים. לפני שמתחילים, יש להפשיר בעדינות את תמיסה א' ותמיסה ב' על קרח, פעולה שאורכת כ-20 דקות. אין לנער את תמיסה ב', שכן טלטול תמיסה ב' עלולה לשבש את האנזימים ולגרום להיווצרות מוגזמת של בועות. שטיפת רשת המסננת עם תמיסה A מספר פעמים יכולה להגדיל את מספר התאים המתקבלים בשלב 2.5. כפי שמתואר בשלב 2.6, אין לשאוף את כל הסופרנאטנט, מכיוון שהפרוטופלסטים נמצאים בתחתית ליד הגלולה ולא ניתן לראותם. לפני המיון, עדיף לוודא כי ריכוז הפרוטופלסטים הוא כ 105-10 6 תאים / מ"ל כדי להשיג יעילות מיון טובה יותר. בעת הקמת ניסוי חדש, אותה רקמה ממפעל WT נדרשת כבקרה להקמת שער המיון. בשלב 3.1, מומלץ לבחור תחילה את תעלות הפלואורסצנטיות (למשל, PE ו-FITC) ולהשתמש בדגימת בקרה כדי לקבוע את האוכלוסייה העיקרית לפי SSC ו-FSC. בנוסף, מוצע להתאים את מיקום השער על ידי שינוי המתח של תעלת הפלואורסצנטיות כדי להבטיח שאות הבקרה ממוקם משמאל לשער (כלומר, הקבוצה השלילית ממוקמת מתחת ל -103). זמן המיון חייב להיות מוגבל ל -30 דקות או פחות מ -60 דקות כדי למנוע שינויים בביטוי גנים, אשר עלולים להתרחש עקב protoplasting או מיון. לאחר המיון, יש לאסוף מספר קטן של תאים ממוינים ולבדוק אם יש פלואורסצנטיות (שלב 3.4). יש להסיר כמה שיותר חיץ מהסופרנאטנט כדי למנוע השפעה על בניית הספרייה במורד הזרם (שלב 3.3).
בניית ספריית RNA-seq
לבניית ספריית RNA-seq, אנו ממליצים להשתמש בתאים מיד לאחר המיון כדי להפחית את ההתפרקות של ה- RNA. זה לא מומלץ להתחיל עם יותר מדי תאים, כמו זה עלול לגרום לספרייה באיכות ירודה עקב תגובות מספקות. מספר מחזורי ה-PCR בשלב 4.7 ובשלב 4.14 תלוי בכמות הקלט של RNA/cDNA. ניתן להגדיל את מספר המחזורים כאשר יש פחות קלט או להוריד כאשר יש יותר קלט. לכן, מומלץ לקחת חלק מהדגימות המעורבות משלב 4.7 ושלב 4.14 כדי להריץ את ה- PCR בזמן אמת עם אותו הליך הגברה ולאחר מכן לקבוע את מספר המחזורים הסופי בהתבסס על תוצאות ה- qPCR לפני ההגברה הרשמית של הספרייה / הספרייה המוקדמת. בנוסף, לפני שלב הטיהור 4.8, יש לאזן את חרוזי Ampure XP בטמפרטורת החדר למשך 10 דקות לפחות ולאחר מכן לערבל היטב. אין להגדיל את נפח החרוזים בשלב הטיהור מעל ליחס של 0.8:1. אחרת, זה יגדיל את הנשיאה של דימרים פריימר. בנוסף, יש להימנע מייבוש יתר של החרוזים בשלב 4.11 כדי למנוע השעיה קשה. ספרייה מקדימה מוסמכת צריכה להיות בגודל ממוצע של כ- 1.5-2 KB וכמות קטנה של קטעים קצרים (<500 bp). התפלגות גודל חריגה או שיאי דימר פריימר/מתאם בגודל קטן בספריות הם אינדיקטורים לאיכות ירודה, ויש להשליך את הדגימות האלה או לעבור סבבים נוספים של טיהור חרוזים (שלב 4.15) (איור 3E-F).
מגבלות
פרוטוקול זה יכול להיות מיושם כדי לבודד תאים מרקמות צמחים אחרות ומיני צמחים אחרים. עם זאת, תהליך בידוד התאים תלוי מאוד בהכנת הפרוטופלסטים. חלק מסוגי התאים קשים לבידוד, כגון תאי כלי דם ותאי מין נקביים, הממוקמים בפנים הרקמה ו/או מעטים במספרם. עבור תאים שקשה להכין עבורם פרוטופלסטים, מיון גרעינים המופעלים על ידי פלואורסצנטיות (FANS)27 הוא שיטה אופציונלית שניתן להשתמש בה. בינתיים, השימוש בפרוטוקול זה להשגת סוגי תאים ספציפיים על ידי FACS תלוי בזמינות של קווי סמן פלואורסצנטיים. היעדר קווי סימון כאלה מגביל את השימוש בשיטות אלה בגידולים ובצמחי גננות. היישום של טכנולוגיית RNA-seq חד-תאי בתפוקה גבוהה בגידולים יחשוף גנים חדשים של סמן ספציפי לסוג התא, אשר ניתן להשתמש בהם עוד יותר לפיתוח קווי סמן מסוג תא ולהרחבת יכולת היישום של מחקרי RNA-seq ומולטי-אומיקס מבוססי FACS.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
הקמנו פרוטוקול זה במתקן הרב-תאי היחיד של בית הספר לחקלאות וביולוגיה, אוניברסיטת ג'יאו טונג בשנחאי, ונתמכו על ידי הקרן הלאומית למדעי הטבע של סין (מענק מס '32070608), תוכנית שנחאי פוג'יאנג (מענק מס '20PJ1405800), ואוניברסיטת שנגחאי ג'יאו טונג (מענק מס 'Agri-X20200202, 2019TPB05).
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm strainer | Sorfa | 622110 | |
| Agar | Yeasen | 70101ES76 | |
| Agilent fragment analyzer | Aglient | Aglient 5200 | |
| Agilent high-sensitivity DNA kit | Aglient | DNF-474-0500 | |
| Ampure XP beads | BECKMAN | A63881 | |
| Betaine | yuanye | S18046-100g | |
| Bleach | Mr Muscle | FnBn83BK | 20% (v/v) bleach |
| BSA | sigma | 9048-46-8 | |
| CaCl2 | yuanye | S24109-500g | |
| Cellulase R10 | Yakult (Japan) | 9012-54-8 | |
| Cellulase RS | Yakult (Japan) | 9012-54-8 | |
| Centrifuge tube (1.5 mL) | Eppendolf | 30121589 | |
| DNase, RNase, DNA and RNA Away Surface Decontaminants | Beyotime | R0127 | |
| dNTPs (10 mM) | NEB | N0447S | |
| DTT (0.1 M) | invitrogen | 18090050 | |
| Ethanol | Sinopharm Chemical Reagent Co., Ltd | 100092680 | |
| FACS | BD FACS Melody | BD-65745 | |
| FACS | Sony | SH800S | |
| Filter tip (1000 µL) | Thermo Scientific | TF112-1000-Q | |
| Filter tip (200 µL) | Thermo Scientific | TF140-200-Q | |
| Filter tip (10 µL) | Thermo Scientific | TF104-10-Q | |
| Filter tip (100 µL) | Thermo Scientific | TF113-100-Q | |
| Fluorescent microscope | Nikon | Eclipse Ni-E | |
| Four-Dimensional Rotating Mixer | Kylin -Bell | BE-1100 | |
| Hemicellulase | sigma | 9025-56-3 | |
| IS PCR primer | 5'-AAGCAGTGGTATCAACGCAGAG T-3' | ||
| KAPA HiFi HotStart ReadyMix(2X) | Roche | 7958935001 | |
| KCl | Sinopharm Chemical Reagent Co., Ltd | 7447-40-7 | |
| Macerozyme R10 | Yakult (Japan) | 9032-75-1 | |
| Magnetic separation stand | invitrogen | 12321D | |
| Mannitol | aladdin | 69-65-8 | |
| MES | aladdin | 145224948 | |
| MgCl2 | yuanye | R21455-500ml | |
| Microcentrifuges | Eppendorf | Centrifuge 5425 | |
| Micro-mini-centrifuge | Titan | Timi-10k | |
| MS | Phytotech | M519 | |
| Nextera XT DNA Library Preparation Kit | illumina | FC-131-1024 | |
| oligo-dT30VN primer | 5'-AAGCAGTGGTATCAACGCAGAG TACTTTTTTTTTTTTTTTTTTTTTTT TTTTTTTTTTVN-3' | ||
| PCR instrument | Thermal cycler | A24811 | |
| Pectolyase | Yakult (Japan) | 9033-35-6 | |
| Plant marker lines | Nottingham Arabidopsis Stock Centre (NASC) | ||
| Qubit 1x dsDNA HS Assay Kit | invitrogen | Q33231 | |
| Qubit 2.0 fluorometer | invitrogen | Q32866 | |
| RNase inhibitor | Thermo Scientific | EO0382 | |
| RNase-free water | invitrogen | 10977023 | |
| Solution A | 400 mM mannitol, 0.05 % BSA , 20 mM MES (pH5.7), 10 mM CaCl2, 20 mM KCl | ||
| Solution B | 1 % (w/v)cellulase R10, 1 % (w/v) cellulase RS, 1 % (w/v)hemicellulase, 0.5 % (w/v)pectolyase and 1 % (w/v) Macerozyme R10 in a fresh aliquot of solution A | ||
| Sterile pestle | BIOTREAT | 453463 | |
| Strainer (40 µm ) | Sorfa | 251100 | |
| SuperScript IV reverse transcriptase (200 U/µL) | invitrogen | 18090050 | |
| SuperScript IV buffer (5x) | invitrogen | 18090050 | |
| Test tube (5 mL) | BD Falcon | 352052 | |
| Thin-walled PCR tubes with caps (0.5 mL) | AXYGEN | PCR-05-C | |
| Triton X-100 | Sangon Biotech | A600198-0500 | |
| TSO primer | 5'-AAGCAGTGGTATCAACGCAGAG TACATrGrG+G-3' | ||
| Vortex | Titan | VM-T2 |
References
- Zhang, T. -Q., Chen, Y., Liu, Y., Lin, W. -H., Wang, J. -W. Single-cell transcriptome atlas and chromatin accessibility landscape reveal differentiation trajectories in the rice root. Nature Communications. 12 (1), 2053(2021).
- Denyer, T., et al. Spatiotemporal developmental trajectories in the Arabidopsis root revealed using high-throughput single-cell RNA sequencing. Developmental Cell. 48 (6), 840-852 (2019).
- Liu, Q., et al. Transcriptional landscape of rice roots at the single-cell resolution. Molecular Plant. 14 (3), 384-394 (2021).
- Liu, Z., et al. Global dynamic molecular profiling of stomatal lineage cell development by single-cell RNA sequencing. Molecular Plant. 13 (8), 1178-1193 (2020).
- Shahan, R., et al. A single-cell Arabidopsis root atlas reveals developmental trajectories in wild-type and cell identity mutants. Developmental Cell. 57 (4), 543-560 (2022).
- Wendrich, J. R., et al. Vascular transcription factors guide plant epidermal responses to limiting phosphate conditions. Science. 370 (6518), (2020).
- Carter, A. D., Bonyadi, R., Gifford, M. L. The use of fluorescence-activated cell sorting in studying plant development and environmental responses. The International Journal of Developmental Biology. 57 (6-8), 545-552 (2013).
- Picelli, S., et al. Full-length RNA-seq from single cells using Smart-seq2. Nature Protocols. 9 (1), 171-181 (2014).
- Wang, X., He, Y., Zhang, Q., Ren, X., Zhang, Z. Direct comparative analyses of 10X genomics chromium and Smart-seq2. Genomics Proteomics Bioinformatics. 19 (2), 253-266 (2021).
- Serrano-Ron, L., et al. Reconstruction of lateral root formation through single-cell RNAsequencing reveals order of tissue initiation. Molecular Plant. 14 (8), 1362-1378 (2021).
- Hashimshony, T., et al. CEL-Seq2: Sensitive highly-multiplexed single-cell RNA-Seq. Genome Biology. 17, 77(2016).
- Macaulay, I. C., et al. G&T-seq: Parallel sequencing of single-cell genomes and transcriptomes. Nature Methods. 12 (6), 519-522 (2015).
- Angermueller, C., et al. Parallel single-cell sequencing links transcriptional and epigenetic heterogeneity. Nature Methods. 13 (3), 229-232 (2016).
- De Rybel, B., et al. A novel aux/IAA28 signaling cascade activates GATA23-dependent specification of lateral root founder cell identity. Current Biology. 20 (19), 1697-1706 (2010).
- Duncombe, S. G., Barnes, W. J., Anderson, C. T. Imaging the delivery and behavior of cellulose synthases in Arabidopsis thaliana using confocal microscopy. Methods in Cell Biology. 160, 201-213 (2020).
- Levy, S. E., Myers, R. M. Advancements in next-generation sequencing. Annual Review of Genomics and Human Genetics. 17 (1), 95-115 (2016).
- Ooi, C. C., et al. High-throughput full-length single-cell mRNA-seq of rare cells. PLoS One. 12 (11), e0188510(2017).
- Pertea, M., Kim, D., Pertea, G. M., Leek, J. T., Salzberg, S. L. Transcript-level expression analysis of RNA-seq experiments with HISAT, StringTie and Ballgown. Nature Protocols. 11 (9), 1650-1667 (2016).
- Tsyganov, K., Perry, A., Archer, S., Powell, D. RNAsik: A Pipeline for complete and reproducible RNA-seq analysis that runs anywhere with speed and ease. Journal of Open Source Software. 3, 583(2018).
- Love, M. I., Huber, W., Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biology. 15 (12), 550(2014).
- Kamiya, T., et al. The MYB36 transcription factor orchestrates Casparian strip formation. Proceedings of the National Academy of Sciences of the United States of America. 112 (33), 10533-10538 (2015).
- Zhang, Y., et al. Two types of bHLH transcription factor determine the competence of the pericycle for lateral root initiation. Nature Plants. 7 (5), 633-643 (2021).
- Haecker, A., et al. Expression dynamics of WOX genes mark cell fate decisions during early embryonic patterning in Arabidopsis thaliana. Development. 131 (3), 657-668 (2004).
- Chen, Q., et al. Auxin overproduction in shoots cannot rescue auxin deficiencies in Arabidopsis roots. Plant Cell Physiol. 55 (6), 1072-1079 (2014).
- Nichterwitz, S., et al. Laser capture microscopy coupled with Smart-seq2 for precise spatial transcriptomic profiling. Nature Communications. 7, 12139(2016).
- Long, J., et al. Nurse cell--derived small RNAs define paternal epigenetic inheritance in Arabidopsis. Science. 373 (6550), (2021).
- Gutzat, R., et al. Arabidopsis shoot stem cells display dynamic transcription and DNA methylation patterns. EMBO Journal. 39 (20), e103667(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved