Method Article
Isolement et analyse transcriptome de types de cellules végétales
Dans cet article
Résumé
La faisabilité et l’efficacité des méthodes de séquençage de l’ARNc à haut débit annoncent une ère unicellulaire dans la recherche sur les plantes. La présente ici est une procédure robuste et complète pour isoler des types spécifiques de cellules racinaires d’Arabidopsis thaliana et la construction et l’analyse ultérieures de la bibliothèque de transcriptomes.
Résumé
Dans les organismes multicellulaires, la programmation du développement et les réponses environnementales peuvent être très divergentes dans différents types de cellules ou même au sein des cellules, ce qui est connu sous le nom d’hétérogénéité cellulaire. Ces dernières années, l’isolement unicellulaire et de type cellulaire combiné aux techniques de séquençage de nouvelle génération (NGS) sont devenus des outils importants pour étudier les processus biologiques à résolution unicellulaire. Cependant, l’isolement des cellules végétales est relativement plus difficile en raison de la présence de parois cellulaires végétales, ce qui limite l’application d’approches unicellulaires chez les plantes. Ce protocole décrit une procédure robuste pour l’isolement unicellulaire et de type cellulaire basé sur le tri activé par fluorescence (FACS) avec des cellules végétales, qui convient à l’analyse multi-omique en aval et à d’autres études. À l’aide de lignes de marqueurs fluorescents racinaires d’Arabidopsis , nous démontrons comment des types de cellules particuliers, tels que les cellules péricycliques xylèmes, les cellules initiales des racines latérales, les cellules de la calotte radiculaire latérale, les cellules du cortex et les cellules endodermiques, sont isolés. En outre, une méthode efficace d’analyse du transcriptome en aval utilisant Smart-seq2 est également fournie. La méthode d’isolement cellulaire et les techniques d’analyse du transcriptome peuvent être adaptées à d’autres types de cellules et espèces végétales et ont un large potentiel d’application en phytotechnie.
Introduction
Les cellules sont l’unité fondamentale de tous les organismes vivants et remplissent des fonctions structurelles et physiologiques. Bien que les cellules des organismes multicellulaires montrent une synchronicité apparente, les cellules de différents types et les cellules individuelles présentent des différences dans leurs transcriptomes au cours du développement et des réponses environnementales. Le séquençage d’ARN unicellulaire à haut débit (scRNA-seq) fournit une puissance sans précédent pour comprendre l’hétérogénéité cellulaire. L’application de scRNA-seq en sciences végétales a contribué à la construction réussie d’un atlas des cellules végétales1, a été utilisée pour identifier les taxons cellulaires rares dans les tissus végétaux2, a fourni un aperçu de la composition des types cellulaires dans les tissus végétaux et a été utilisée pour identifier l’identité cellulaire et les fonctions importantes utilisées pendant le développement et la différenciation des plantes. De plus, il est possible de déduire des trajectoires de développement spatio-temporelles dans les tissus végétaux 1,2,3 pour découvrir de nouveaux gènes marqueurs4 et étudier les fonctions de facteurs de transcription importants5 en utilisant scRNA-seq afin de révéler la conservation évolutive d’un même type cellulaire chez différentes plantes3. Les stress abiotiques sont parmi les influences environnementales les plus importantes sur la croissance et le développement des plantes. En explorant les changements dans la composition des types cellulaires dans les tissus végétaux dans différentes conditions de traitement grâce au séquençage du transcriptome unicellulaire, on peut également résoudre le mécanisme de réponse au stress abiotique6.
Le potentiel de résolution de l’hétérogénéité transcriptionnelle entre les types cellulaires à l’aide du séquençage de l’ARNc dépend de la méthode d’isolement cellulaire et de la plate-forme de séquençage. Le tri cellulaire activé par fluorescence (FACS) est une technique largement utilisée pour isoler une sous-population de cellules pour scRNA-seq en fonction de la diffusion de la lumière et des propriétés de fluorescence des cellules. Le développement de lignes de marqueurs fluorescentes par la technologie transgénique a considérablement amélioré l’efficacité de l’isolement cellulaire par FACS7. La réalisation de scRNA-seq à l’aide de Smart-seq28 améliore encore la capacité à disséquer l’hétérogénéité cellulaire. La méthode Smart-seq2 a une bonne sensibilité pour la détection des gènes et peut détecter les gènes même avec une faible entréede transcrit 9. En plus de la collecte de types de cellules en vrac, les trieurs cellulaires modernes fournissent un format de tri à index unicellulaire, permettant l’analyse du transcriptome à une résolution de cellule unique en utilisant Smart-seq210 ou d’autres méthodes de séquençage d’ARN multiplexé, telles que CEL-seq211. Le tri unicellulaire ou de type cellulaire peut être potentiellement utilisé pour de nombreuses autres applications en aval, telles que les études multi-omiques parallèles12,13. Un protocole robuste et polyvalent est présenté ici pour isoler les types de cellules végétales, telles que les cellules péricycliques xylèmes, les cellules de la calotte radiculaire latérale, les cellules initiales des racines latérales, les cellules du cortex et les cellules endodermiques des racines des lignées cellulaires marqueurs d’Arabidopsis thaliana par FACS. Le protocole implique en outre la construction de la bibliothèque Smart-seq2 pour l’analyse du transcriptome en aval.
Protocole
Le protocole suivant a été optimisé pour les semences de type sauvage (WT) d’A. thaliana sans fluorescence et les lignes marqueurs fluorescentes pour les types de cellules racinaires suivants : cellules péricycliques xylèmes-pôles (J0121), cellules initiales des racines latérales, cellules de la calotte radiculaire latérale (J3411), cellules de l’endoderme et du cortex (J0571) (Figure 1A). Toutes les lignées marqueurs ont été obtenues à partir d’une source commerciale (voir le tableau des matériaux), à l’exception de la lignée de marqueurs de cellules d’initiation racinaires latérales, qui a été générée par l’introduction d’une construction GFP pilotée par le promoteur GATA23 dans une plante Arabidopsis de type sauvage à la suite d’un rapport publié précédemment14.
1. Préparation du matériel végétal
- Stériliser les graines d’A. thaliana WT et les graines de la lignée de marqueurs fluorescents en incubant les graines dans de l’eau de Javel à 20 % dans un incubateur rotatif à température ambiante pendant 15 min.
- Rincer les graines dans de l’eau bidistillée (ddH2O) trois à cinq fois. Effectuez cette étape sur un banc propre et stérile.
- Plaquer les graines de la ligne WT et reporter sur un milieu de Murashige et Skoog (MS) à demi-concentration avec une gélose à 0,8 % (p/v)15. Cultiver les plantes verticalement pendant 5 jours (16 h de lumière à 23 °C) après stratification pendant 2 jours à 4 °C.
2. Protoplasting
- Préparer les solutions protoplastiques2,5, appelées solution A et solution B (voir tableau des matières).
- Préparer la solution A contenant 400 mM de mannitol, 0,05 % de BSA, 20 mM de MES (pH 5,7), 10 mM de CaCl2 et 20 mM de KCl (voir le tableau des matières). Conserver la solution A à −20 °C jusqu’à 1 mois.
- Préparer la solution B en ajoutant 1 % (p/v) de cellulase R10, 1 % (p/v) de cellulase RS, 1 % (p/v) d’hémicellulase, 0,5 % (p/v) de pectolyase et 1 % (p/v) de macérozyme R10 dans une nouvelle partie aliquote de la solution A. Conservez la solution B à −20 °C pendant 1 mois maximum.
- Décongeler doucement la solution A et la solution B sur la glace avant de commencer l’expérience.
- Coupez les racines à l’aide d’une lame propre ou de ciseaux et coupez les racines en morceaux de ~0,5 cm. Immerger les racines dans 1,5 mL de solution B suivie d’une rotation douce (à environ 18 rpm) à température ambiante pendant 1,5 à 2 h.
- Filtrer les protoplastes racinaires à travers le maillage de la crépine de 40 μm (voir le tableau des matériaux).
- Rincer le filet de la crépine avec 1-2 mL de solution A.
- Combiner les liquides des étapes 2.4 et 2.5 et centrifuger à 300 x g pendant 5 min à 4 °C. Jeter le surnageant à l’aide d’une pipette, remettre en suspension la pastille de la cellule dans 500 à 600 μL de solution A, puis la placer immédiatement sur de la glace.
- Transférer la solution cellulaire remise en suspension dans un nouveau tube à essai de 5 mL pour le tri des cellules.
3. Tri cellulaire activé par fluorescence (FACS)
- Allumez et terminez les étapes de configuration de l’instrument sur le trieur (voir le tableau des matériaux). Sélectionnez les canaux de fluorescence, utilisez une plante WT (pas de fluorescence) comme témoin pour déterminer la ligne de base pour l’autofluorescence et ajustez la grille de tri en fonction de l’intensité de fluorescence et des singulets FSC/SSC (Figure 2).
- Ajouter 500 μL de solution A (étape 2.1.1) dans un tube de prélèvement de 1,5 mL pour éviter que les cellules ne soient endommagées. Recueillir 2 000 à 3 000 cellules par tube.
- Après tri, placer immédiatement les échantillons sur de la glace, centrifuger le tube de prélèvement contenant les cellules à 300 x g pendant 5 min à 4 °C et retirer le surnageant à l’aide d’une pipette.
- Prenez 2 μL de cellules triées et vérifiez la fluorescence à l’aide d’un microscope à fluorescence (voir le tableau des matériaux).
- Stockez les cellules triées à −80 °C ou utilisez-les immédiatement pour la construction de bibliothèques (étape 4).
- Pour le tri d’index unicellulaire, placez la plaque à 96 puits dans l’adaptateur. Calibrer la position de la plaque de sorte que la gouttelette tombe dans le trou central de la plaque. Sélectionnez le mode de tri à cellule unique lors du tri, entrez le nombre cible de cellules triées sur 1 et commencez le tri.
4. Préparation de bibliothèque Smart-seq2
- En raison de la très faible quantité d’entrées, effectuez la construction d’une bibliothèque RNA-seq de type unicellulaire dans un environnement exempt de contamination. Avant de commencer l’expérience, nettoyez le banc avec un décontaminant de surface8 (voir tableau des matériaux) et de l’éthanol à 75%.
- Préparer le tampon de lyse (mélange A) (tableau 1) en combinant 0,33 μL de Triton X-100 à 10 %, 0,55 μL d’inhibiteur de la RNase et 0,22 μL de DTT 0,1 M (voir le tableau des matériaux).
- Ajouter 1 μL de mélange A dans l’échantillon trié et broyer avec un pilon stérile. Le volume d’échantillon préférable est de ≤0,5 μL; utiliser de l’eau exempte de RNase pour porter le volume à 14 μL. Transférer chaque échantillon de cellule dans un tube PCR à paroi mince de 0,2 mL.
- Préparer le mélange B contenant 0,44 μL d’amorce de réaction de transcription inverse (RT) oligo-dT 30 VN (100 μM) et 4,4 μL de dNTP (10mM) (tableau 2) (voir le tableau des matières).
- Ajouter 4,4 μL de mélange B aux 14 μL d’échantillon dans chaque tube, pipeter doucement pour mélanger l’échantillon et incuber l’échantillon à 72 °C pendant 3 min. Après l’incubation, mettre immédiatement les échantillons sur de la glace pour hybrider l’oligo-dT à la queue poly A.
- Préparer le mélange réactionnel de transcription inverse (mélange C) (tableau 3) (voir tableau des matières). Ajouter 21,6 μL de mélange C à chaque tube contenant les échantillons. Activez le programme RT sur un instrument PCR commun (Tableau 4).
- Effectuer la réaction de préamplification sur la glace. Préparer le mélange D en combinant 44 μL de 2x mélange de polymérase PCR et 0,88 μL d’amorce IS PCR (10 μM) (tableau 5) (voir le tableau des matières). Ajouter 40,8 μL de mélange D aux 40 μL de produit de réaction RT et exécuter le programme de préamplification (tableau 6).
- Purifier les produits de réaction de préamplification à l’aide de billes Ampure XP (voir le tableau des matériaux). Ajouter 48 μL de billes (rapport 0,6:1) dans chaque échantillon de l’étape 4.7 et mélanger délicatement les échantillons par pipetage.
- Incuber les échantillons à température ambiante pendant 10 min. Placer les tubes de 1,5 mL contenant les échantillons sur un support de séparation magnétique pendant 5 min. Jetez soigneusement le surnageant des échantillons sans déranger les perles.
- Lavez les billes en les remettant en suspension dans 200 μL d’éthanol à 80 % et placez les échantillons sur le support de séparation magnétique (voir le tableau des matériaux) pendant encore 3 minutes avant de jeter le surnageant contenant de l’éthanol.
- Sécher les échantillons à l’air pendant 10 minutes et couvrir le tube pour éviter la contamination et la contamination croisée pendant le séchage à l’air.
- Remettez les billes en suspension dans 20 μL deddH2O, incuber les échantillons à température ambiante pendant 5 min, puis les placer sur le support de séparation magnétique pendant 5 min.
- Extraire à la pipette 18 μL du surnageant de chaque tube et transférer les échantillons dans de nouveaux tubes à centrifuger de 1,5 mL. Utiliser 1 μL de l’échantillon pour évaluer la qualité de l’ADNc à l’aide d’une trousse de quantification de l’ADN, déterminer la distribution granulométrique de chaque prébibliothèque à l’aide d’un analyseur de fragments (voir le tableau des matériaux) et conserver l’échantillon restant à −20 °C.
- Construire une bibliothèque d’ADNc8 pour le séquençageIllumina 16 à partir du produit de prébibliothèque de l’étape 4.13 à l’aide d’un kit de préparation de bibliothèque de séquençage (voir Tableau des matériaux).
- Purifiez les bibliothèques (à partir de l’étape 4.14) à l’aide des perles Ampure XP, quantifiez les bibliothèques purifiées et déterminez la distribution de taille de chaque bibliothèque à l’étape 4.13.
REMARQUE: Pool égal nanomoles de chaque bibliothèque, en veillant à ce qu’aucune d’entre elles n’ait la même combinaison d’indice Illumina. Sinon, les bibliothèques peuvent être regroupées dans un rapport basé sur la sortie de séquençage souhaitée et séquencées ensemble sur la même voie du séquenceur Illumina. Généralement, le séquençage de chaque bibliothèque à une profondeur de 4 à 6 Go, ce qui donne > 10 millions de lectures cartographiées, fournit une couverture 20x-30x du génome d’Arabidopsis . Des profondeurs de séquençage plus faibles sont également acceptables, mais peuvent affecter la signification de l’analyse de l’expression différentielle.
5. Analyse des données RNA-seq
- Coupez les lectures brutes à l’aide de Trim-Galore17 suivies d’une cartographie au génome de référence à l’aide de hisat2 18 (daehwankimlab.github.io/hisat2), et supprimez les fragments dupliqués par PCR à l’aide de Picard19 (broadinstitute.github.io/picard).
- Effectuer le traitement du comptage brut et l’analyse ultérieure des gènes exprimés différentiellement (DEG) avec DESeq220 en utilisant au moins trois réplicas biologiques pour chaque échantillon. Effectuez le regroupement de l’expression génique avec le package Pheatmap et visualisez dans une carte thermique d’expression.
NOTE: Les valeurs RPKM (lectures par kilobase par million de lectures cartographiées) des gènes et des TE (éléments transposables) ont été calculées avec Stringtie18 (github.com/gpertea/stringtie) et visualisées dans un navigateur génomique.
Résultats
Isolation du protoplaste
Ce protocole est efficace pour le tri des protoplastes des lignées marqueurs radiculaires fluorescentes d’A. thaliana. Ces lignées de marqueurs ont été développées par la fusion de protéines fluorescentes avec des gènes exprimés spécifiquement dans les types de cellules cibles, ou en utilisant des lignes de pièges amplificateurs (Figure 1). De nombreux tissus et organes ont été disséqués en types cellulaires exprimant des marqueurs fluorescents spécifiques dans des plantes et des cultures modèles.
Population FACS, cellules triées et CQ de bibliothèque
En utilisant une plante de type sauvage comme témoin et en définissant des portes telles que la diffusion vers l’avant (FSC) et la diffusion latérale (SSC), nous avons déterminé une population majeure de cellules d’intérêt et une base de référence pour l’autofluorescence et avons trié avec succès les cellules marquées spécifiques à la fluorescence (Figure 2). La qualité des bibliothèques de séquençage final (à partir de l’étape 4.15) a été déterminée par l’analyse de la distribution de la taille des fragments. Les résultats représentatifs de la bibliothèque de séquençage de l’ARN d’environ 2 000 cellules péricycliques xylèmes, cellules primordiennes racines latérales, cellules endodermiques/cortex et cellules de la calotte racinaire latérale sont présentés à la figure 3A-D.
Analyse des modèles d’expression
La qualité des données de séquençage peut être évaluée à partir de plusieurs procédures d’analyse, telles que la profondeur de séquençage, le taux de cartographie et les rapports fastQC. La précision et la sensibilité des données de séquençage peuvent être démontrées par la présence d’une série de gènes enrichis de type cellulaire, qui peuvent être identifiés à partir de l’analyse DEG entre les types de cellules isolées et le tissu entier. Les gènes ayant des niveaux d’expression significativement plus élevés dans certains types cellulaires peuvent être identifiés comme des gènes enrichis de type cellulaire. Pendant ce temps, les vues du navigateur génomique de chaque type de cellule peuvent être comparées côte à côte pour montrer les niveaux d’expression des gènes marqueurs connus et tester si le modèle d’expression des gènes marqueurs peut être reconstruit dans les données d’expression du type cellulaire. À titre d’exemple, les gènes enrichis dans l’un des quatre types de cellules racinaires ont été regroupés et montrés dans une carte thermique, qui a montré la spécificité de l’expression génique parmi différents types de cellules (Figure 4). YUCCA3, MYB36, WOX5 et PFA1 ont été examinés, et les profils d’expression étaient conformes aux attentes selon les rapports antérieurs21,22,23,24. Les pipelines d’analyse des données et les données de séquençage brutes représentatives sont disponibles dans un référentiel public (github.com/gaolabsjtu/root_cell_types_RNAseq).
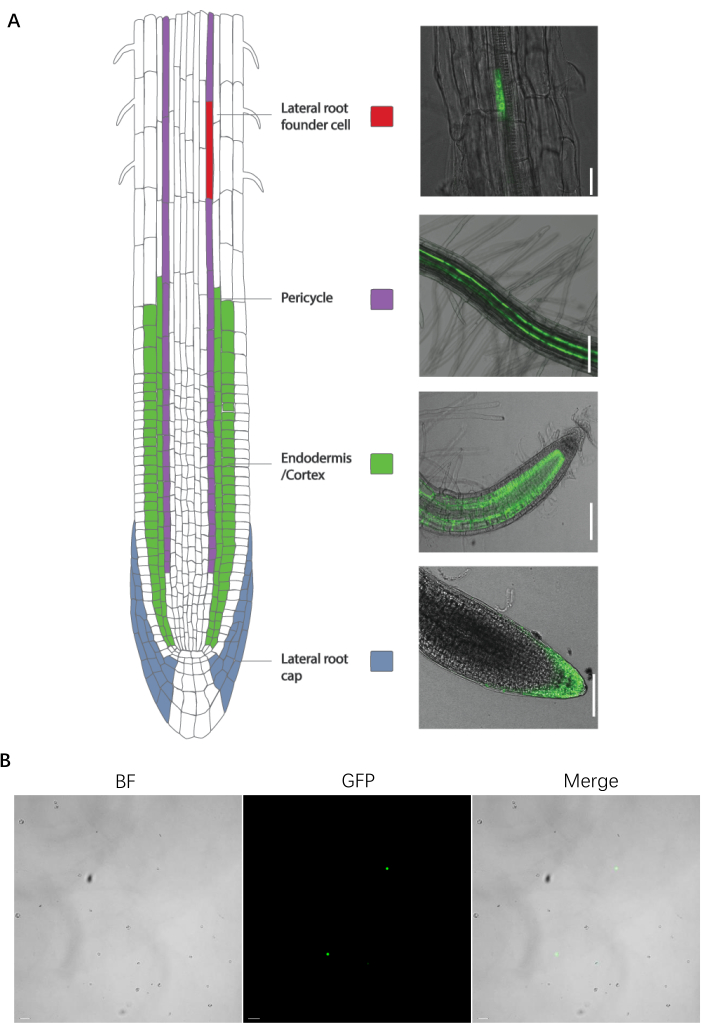
Figure 1 : Ligne marqueuse spécifique du type cellulaire de la préparation des racines et des protoplastes. (A, à gauche) Introduction et images de la ligne de piégeage Enhancer. (A, à droite) Ligne marqueuse de type de cellule spécifique de la racine. (B) Une image de la préparation de protoplaste avant le tri. Les barres d’échelle pour la cellule fondatrice de la racine latérale, le péricycle, l’endoderme / cortex, la calotte radiculaire latérale et les protoplastes représentent respectivement 25 μm, 100 μm, 75 μm et 20 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Établissement de la FACS pour des types spécifiques de cellules racinaires. Exemple d’expérience FACS : (A) la population principale utilisant les SSC et les FSC; (B) les portes GFP-positives (+) et GFP-négatives (−); (C) les images de fond clair et (D) de fluorescence des cellules triées. La barre d’échelle représente 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
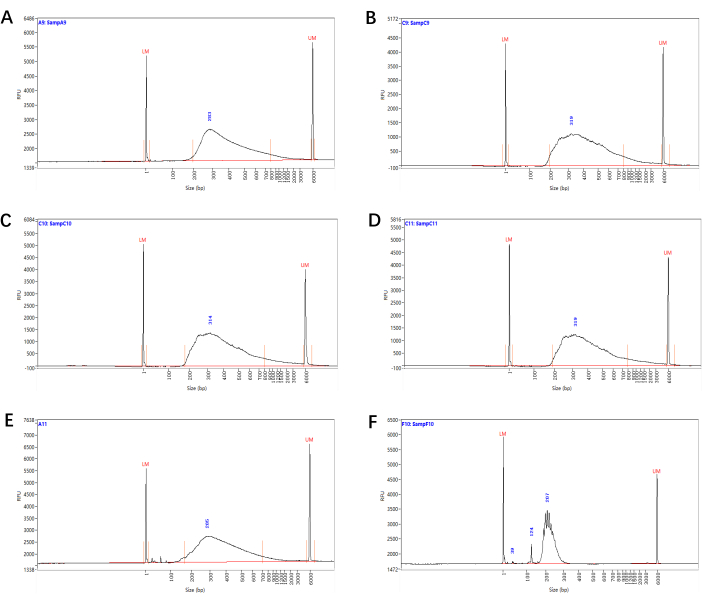
Figure 3 : Distribution de taille des bibliothèques de séquençage Smart-seq2. Distributions représentatives de la taille des fragments des bibliothèques de séquençage (à partir de l’étape 4.15) générées à partir de cellules péricycliques xylèmes (A), de cellules primordiennes de racines latérales (B), de cellules endodermiques/cortex (C) et de cellules latérales de la calotte radiculaire (D). (E) Une bibliothèque de petite taille avec des pics de dimères d’amorce/adaptateur, qui peuvent encore être séquencés après la sélection de la taille. (F) Une bibliothèque avec une répartition anormale de la taille, ce qui indique un échec de la préparation de la bibliothèque. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Analyse génique enrichie par type cellulaire. Une analyse DEG a été effectuée entre chaque type de cellule et la racine entière; Les gènes avec une régulation positive plus de quatre fois dans chaque type de cellule ont été identifiés comme des gènes enrichis en types cellulaires. Ces gènes ont été combinés, regroupés et visualisés dans le diagramme de la carte thermique (panneau supérieur). Les gènes enrichis par type cellulaire comprenaient de nombreux gènes marqueurs connus; des gènes marqueurs typiques tels que YUCCA3, MYB36, WOX5 et PFA1 ont été choisis pour apparaître dans le navigateur génomique (panneau inférieur). Abréviations : LRP = primordia racine latérale; Endo/Cor = endoderme/cortex; LRC = calotte radiculaire latérale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Composants | Volume (μL) |
| 10% Triton X-100 | 0.33 |
| Inhibiteur de la RNase | 0.55 |
| TNT (0,1 Mo) | 0.22 |
Tableau 1 : Composants réactionnels pour la préparation du tampon de lyse cellulaire (mélange A).
| Composants | Volume (μL) |
| Oligo-dT30VN (100 μM) | 0.44 |
| dNTP (10 mM) | 4.4 |
Tableau 2: Composants réactionnels pour la préparation du mélange B.
| Composants | Volume (μL) |
| Tampon SuperScript IV (5x) | 8.8 |
| Bétaïne (5 M) | 8.8 |
| TNT (0,1 Mo) | 2.2 |
| MgCl2 (1 M) | 0.264 |
| GRT (100 μM) | 0.44 |
| SuperScript IV transcriptase inverse (200 U/μL) | 2.2 |
| Inhibiteur de la RNase | 1.1 |
Tableau 3 : Composants réactionnels pour la préparation du mélange PCR à transcription inverse (mélange C).
| Cycle | Température (°C) | Heure |
| 1 | 50 | 90 min |
| 2-11 | 55 | 2 min |
| 50 | 2 min | |
| 12 | 70 | 15 min |
| 13 | 4 | ∞ |
Tableau 4 : Paramètres de PCR de transcription inverse (RT) pour la synthèse de l’ADNc à partir de l’ARNm.
| Composants | Volume (μL) |
| KAPA HiFi HotStart ReadyMix (2x) | 44 |
| Amorce PCR IS (10 μM) | 0.88 |
Tableau 5 : Composants réactionnels pour la préparation du mélange réactionnel de préamplification (mélange D).
| Cycle | Température (°C) | Heure |
| 1 | 98 | 5 min |
| 2-13 | 98 | 20 s |
| 67 | 30 s | |
| 72 | 3 min | |
| 14 | 72 | 5 min |
| 15 | 4 | ∞ |
Tableau 6 : Paramètres du programme PCR pour la réaction de préamplification.
Discussion
Le protocole basé sur Smart-seq2 peut générer des bibliothèques de séquençage fiables à partir de plusieurs centaines de cellules8. La qualité du matériel de départ est essentielle pour la précision de l’analyse du transcriptome. FACS est un outil puissant pour préparer les cellules d’intérêt, mais cette procédure, en particulier l’étape de protomination, doit être optimisée pour les applications en usine. La microdissection par capture laser (LCM) ou les cellules disséquées manuellement peuvent également être utilisées comme entrée25,26, de sorte que le protocole fourni ici peut potentiellement être utilisé dans une variété d’espèces végétales et de types de cellules avec ou sans gènes marqueurs connus.
Préparation du matériel végétal
En biologie du développement des plantes, FACS est généralement utilisé pour isoler les populations de cellules enrichies exprimant un marqueur fluorescent. Les plantes qui expriment un tel marqueur sont protoplastées, et les protoplastes sont finalement triés en sous-populations pures en fonction de l’expression du marqueur spécifique au type cellulaire. Par conséquent, le signal du marqueur fluorescent doit être fort et spécifique. De plus, le chercheur doit vérifier quels marqueurs peuvent être triés à l’avance. Le nombre de graines nécessaires dépend du niveau d’expression, de l’endroit où le marqueur est exprimé, du nombre de cellules nécessaires pour les applications en aval et du nombre de réplications triées. Si l’expression est dans un seul type de cellule avec très peu de cellules par plante, généralement un plus grand nombre de plantes est nécessaire que si le marqueur est exprimé dans un nombre plus élevé de cellules. Il est préférable de déterminer empiriquement le nombre de graines nécessaires pour les lignées marqueurs individuelles. Il est particulièrement important d’effectuer des expériences préliminaires avec chaque ligne de marqueur pour optimiser la fenêtre de tri et savoir combien de cellules résulteront d’un nombre fixe de plantes. Si le matériel expérimental est constitué de racines, pour éviter que les racines ne s’enfoncent dans la gélose et pour faciliter la coupe de racines propres, un treillis autoclavé de taille appropriée peut être posé sur la gélose contenant du milieu avant le placage des semences. La stratification à basse température favorise la germination et le développement des graines, nous suggérons donc de stratifier les graines à 4 ° C pendant 2 jours après la stérilisation ou le placage, puis de faire pousser les plantes verticalement.
Protoplasting et FACS
La protoplastification et le tri 5-6 jours après la stratification fonctionnent bien. Les solutions A et B doivent être filtrées à l’aide d’une crépine de 0,22 μm. De plus, le stockage de la solution B à −20 °C sur de longues périodes diminue l’efficacité des enzymes. Avant de commencer, la solution A et la solution B doivent être décongelées doucement sur de la glace, ce qui prend environ 20 minutes. La solution B ne doit pas être agitée, car l’agitation La solution B peut perturber les enzymes et provoquer une formation excessive de bulles. Le lavage du treillis de la crépine avec la solution A plusieurs fois peut augmenter le nombre de cellules obtenues à l’étape 2.5. Comme décrit à l’étape 2.6, le surnageant entier ne doit pas être aspiré, car les protoplastes sont au fond près de la pastille et ne peuvent pas être vus. Avant le tri, il est préférable de s’assurer que la concentration de protoplastes est d’environ 105-10 6 cellules/mL pour obtenir une meilleure efficacité de tri. Lors de la mise en place d’une nouvelle expérience, le même tissu de l’usine WT est nécessaire comme contrôle pour la mise en place de la porte de tri. À l’étape 3.1, il est recommandé de sélectionner d’abord les canaux de fluorescence (p. ex. PE et FITC) et d’utiliser un échantillon témoin pour déterminer la population principale selon les SSC et les FSC. De plus, il est suggéré d’ajuster la position de la grille en modifiant la tension du canal de fluorescence pour s’assurer que le signal de commande est situé à gauche de la grille (c.-à-d. que le groupe négatif est situé en dessous de 103). Le temps de tri doit être limité à 30 min ou moins de 60 min pour éviter les altérations de l’expression des gènes, qui peuvent survenir en raison de la protoplasting ou du tri. Après le tri, un petit nombre de cellules triées doit être recueilli et vérifié pour la fluorescence (étape 3.4). Autant de tampon que possible doit être retiré du surnageant pour éviter tout impact sur la construction de la bibliothèque en aval (étape 3.3).
Construction de la bibliothèque RNA-seq
Pour la construction de la bibliothèque RNA-seq, nous recommandons d’utiliser des cellules immédiatement après le tri pour réduire la dégradation de l’ARN. Il n’est pas conseillé de commencer avec trop de cellules, car cela peut entraîner une bibliothèque de mauvaise qualité en raison de réactions inadéquates. Le nombre de cycles de PCR aux étapes 4.7 et 4.14 dépend de la quantité d’ARN/ADNc d’entrée. Le nombre de cycles peut être augmenté lorsqu’il y a moins d’entrées ou abaissé lorsqu’il y a plus d’entrées. Par conséquent, il est recommandé de prélever certains des échantillons mélangés des étapes 4.7 et 4.14 pour exécuter la PCR en temps réel avec la même procédure d’amplification et de déterminer ensuite le nombre final de cycles en fonction des résultats de la qPCR avant l’amplification formelle de la prébibliothèque/bibliothèque. De plus, avant l’étape de purification 4.8, les billes Ampure XP doivent être équilibrées à température ambiante pendant au moins 10 minutes, puis bien vortexées. Le volume des billes dans l’étape de purification ne doit pas être augmenté au-dessus du rapport 0,8: 1. Sinon, cela augmentera le transfert des dimères d’apprêt. De plus, il faut éviter de trop sécher les billes à l’étape 4.11 pour éviter une remise en suspension difficile. Une pré-bibliothèque qualifiée doit avoir une taille moyenne d’environ 1,5 à 2 Ko et une petite quantité de fragments courts (<500 pb). Des distributions granulométriques anormales ou des pics de dimères d’amorce/adaptateur de petite taille dans les bibliothèques sont des indicateurs de mauvaise qualité, et ces échantillons doivent être jetés ou subir d’autres cycles de purification des billes (étape 4.15) (figure 3E-F).
Limitations
Ce protocole peut être appliqué pour isoler des cellules d’autres tissus végétaux et d’autres espèces végétales. Cependant, le processus d’isolement cellulaire dépend fortement de la préparation des protoplastes. Certains types de cellules sont difficiles à isoler, comme les cellules vasculaires et les cellules sexuelles féminines, qui sont situées à l’intérieur du tissu et/ou sont peu nombreuses. Pour les cellules pour lesquelles il est difficile de préparer des protoplastes, le tri des noyaux activés par fluorescence (FANS)27 est une méthode facultative qui peut être utilisée. Pendant ce temps, l’utilisation de ce protocole pour obtenir des types de cellules spécifiques par FACS dépend de la disponibilité de lignes de marqueurs fluorescents. L’absence de telles lignes de marquage limite l’utilisation de ces méthodes dans les cultures et les plantes horticoles. L’application de la technologie de séquençage d’ARN unicellulaire à haut débit dans les cultures révélera de nouveaux gènes marqueurs spécifiques au type cellulaire, qui pourront être utilisés pour développer des lignées de marqueurs de type cellulaire et élargir la capacité d’application des études de séquençage d’ARN de type cellulaire et multi-omiques basées sur FACS.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous avons mis en place ce protocole dans l’installation multi-omique unicellulaire de l’École d’agriculture et de biologie de l’Université Jiao Tong de Shanghai et avons été soutenus par la Fondation nationale des sciences naturelles de Chine (subvention n ° 32070608), le programme Pujiang de Shanghai (subvention n ° 20PJ1405800) et l’Université Jiao Tong de Shanghai (subvention n ° Agri-X20200202, 2019TPB05).
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm strainer | Sorfa | 622110 | |
| Agar | Yeasen | 70101ES76 | |
| Agilent fragment analyzer | Aglient | Aglient 5200 | |
| Agilent high-sensitivity DNA kit | Aglient | DNF-474-0500 | |
| Ampure XP beads | BECKMAN | A63881 | |
| Betaine | yuanye | S18046-100g | |
| Bleach | Mr Muscle | FnBn83BK | 20% (v/v) bleach |
| BSA | sigma | 9048-46-8 | |
| CaCl2 | yuanye | S24109-500g | |
| Cellulase R10 | Yakult (Japan) | 9012-54-8 | |
| Cellulase RS | Yakult (Japan) | 9012-54-8 | |
| Centrifuge tube (1.5 mL) | Eppendolf | 30121589 | |
| DNase, RNase, DNA and RNA Away Surface Decontaminants | Beyotime | R0127 | |
| dNTPs (10 mM) | NEB | N0447S | |
| DTT (0.1 M) | invitrogen | 18090050 | |
| Ethanol | Sinopharm Chemical Reagent Co., Ltd | 100092680 | |
| FACS | BD FACS Melody | BD-65745 | |
| FACS | Sony | SH800S | |
| Filter tip (1000 µL) | Thermo Scientific | TF112-1000-Q | |
| Filter tip (200 µL) | Thermo Scientific | TF140-200-Q | |
| Filter tip (10 µL) | Thermo Scientific | TF104-10-Q | |
| Filter tip (100 µL) | Thermo Scientific | TF113-100-Q | |
| Fluorescent microscope | Nikon | Eclipse Ni-E | |
| Four-Dimensional Rotating Mixer | Kylin -Bell | BE-1100 | |
| Hemicellulase | sigma | 9025-56-3 | |
| IS PCR primer | 5'-AAGCAGTGGTATCAACGCAGAG T-3' | ||
| KAPA HiFi HotStart ReadyMix(2X) | Roche | 7958935001 | |
| KCl | Sinopharm Chemical Reagent Co., Ltd | 7447-40-7 | |
| Macerozyme R10 | Yakult (Japan) | 9032-75-1 | |
| Magnetic separation stand | invitrogen | 12321D | |
| Mannitol | aladdin | 69-65-8 | |
| MES | aladdin | 145224948 | |
| MgCl2 | yuanye | R21455-500ml | |
| Microcentrifuges | Eppendorf | Centrifuge 5425 | |
| Micro-mini-centrifuge | Titan | Timi-10k | |
| MS | Phytotech | M519 | |
| Nextera XT DNA Library Preparation Kit | illumina | FC-131-1024 | |
| oligo-dT30VN primer | 5'-AAGCAGTGGTATCAACGCAGAG TACTTTTTTTTTTTTTTTTTTTTTTT TTTTTTTTTTVN-3' | ||
| PCR instrument | Thermal cycler | A24811 | |
| Pectolyase | Yakult (Japan) | 9033-35-6 | |
| Plant marker lines | Nottingham Arabidopsis Stock Centre (NASC) | ||
| Qubit 1x dsDNA HS Assay Kit | invitrogen | Q33231 | |
| Qubit 2.0 fluorometer | invitrogen | Q32866 | |
| RNase inhibitor | Thermo Scientific | EO0382 | |
| RNase-free water | invitrogen | 10977023 | |
| Solution A | 400 mM mannitol, 0.05 % BSA , 20 mM MES (pH5.7), 10 mM CaCl2, 20 mM KCl | ||
| Solution B | 1 % (w/v)cellulase R10, 1 % (w/v) cellulase RS, 1 % (w/v)hemicellulase, 0.5 % (w/v)pectolyase and 1 % (w/v) Macerozyme R10 in a fresh aliquot of solution A | ||
| Sterile pestle | BIOTREAT | 453463 | |
| Strainer (40 µm ) | Sorfa | 251100 | |
| SuperScript IV reverse transcriptase (200 U/µL) | invitrogen | 18090050 | |
| SuperScript IV buffer (5x) | invitrogen | 18090050 | |
| Test tube (5 mL) | BD Falcon | 352052 | |
| Thin-walled PCR tubes with caps (0.5 mL) | AXYGEN | PCR-05-C | |
| Triton X-100 | Sangon Biotech | A600198-0500 | |
| TSO primer | 5'-AAGCAGTGGTATCAACGCAGAG TACATrGrG+G-3' | ||
| Vortex | Titan | VM-T2 |
Références
- Zhang, T. -. Q., Chen, Y., Liu, Y., Lin, W. -. H., Wang, J. -. W. Single-cell transcriptome atlas and chromatin accessibility landscape reveal differentiation trajectories in the rice root. Nature Communications. 12 (1), 2053 (2021).
- Denyer, T., et al. Spatiotemporal developmental trajectories in the Arabidopsis root revealed using high-throughput single-cell RNA sequencing. Developmental Cell. 48 (6), 840-852 (2019).
- Liu, Q., et al. Transcriptional landscape of rice roots at the single-cell resolution. Molecular Plant. 14 (3), 384-394 (2021).
- Liu, Z., et al. Global dynamic molecular profiling of stomatal lineage cell development by single-cell RNA sequencing. Molecular Plant. 13 (8), 1178-1193 (2020).
- Shahan, R., et al. A single-cell Arabidopsis root atlas reveals developmental trajectories in wild-type and cell identity mutants. Developmental Cell. 57 (4), 543-560 (2022).
- Wendrich, J. R., et al. Vascular transcription factors guide plant epidermal responses to limiting phosphate conditions. Science. 370 (6518), (2020).
- Carter, A. D., Bonyadi, R., Gifford, M. L. The use of fluorescence-activated cell sorting in studying plant development and environmental responses. The International Journal of Developmental Biology. 57 (6-8), 545-552 (2013).
- Picelli, S., et al. Full-length RNA-seq from single cells using Smart-seq2. Nature Protocols. 9 (1), 171-181 (2014).
- Wang, X., He, Y., Zhang, Q., Ren, X., Zhang, Z. Direct comparative analyses of 10X genomics chromium and Smart-seq2. Genomics Proteomics Bioinformatics. 19 (2), 253-266 (2021).
- Serrano-Ron, L., et al. Reconstruction of lateral root formation through single-cell RNAsequencing reveals order of tissue initiation. Molecular Plant. 14 (8), 1362-1378 (2021).
- Hashimshony, T., et al. CEL-Seq2: Sensitive highly-multiplexed single-cell RNA-Seq. Genome Biology. 17, 77 (2016).
- Macaulay, I. C., et al. G&T-seq: Parallel sequencing of single-cell genomes and transcriptomes. Nature Methods. 12 (6), 519-522 (2015).
- Angermueller, C., et al. Parallel single-cell sequencing links transcriptional and epigenetic heterogeneity. Nature Methods. 13 (3), 229-232 (2016).
- De Rybel, B., et al. A novel aux/IAA28 signaling cascade activates GATA23-dependent specification of lateral root founder cell identity. Current Biology. 20 (19), 1697-1706 (2010).
- Duncombe, S. G., Barnes, W. J., Anderson, C. T. Imaging the delivery and behavior of cellulose synthases in Arabidopsis thaliana using confocal microscopy. Methods in Cell Biology. 160, 201-213 (2020).
- Levy, S. E., Myers, R. M. Advancements in next-generation sequencing. Annual Review of Genomics and Human Genetics. 17 (1), 95-115 (2016).
- Ooi, C. C., et al. High-throughput full-length single-cell mRNA-seq of rare cells. PLoS One. 12 (11), e0188510 (2017).
- Pertea, M., Kim, D., Pertea, G. M., Leek, J. T., Salzberg, S. L. Transcript-level expression analysis of RNA-seq experiments with HISAT, StringTie and Ballgown. Nature Protocols. 11 (9), 1650-1667 (2016).
- Tsyganov, K., Perry, A., Archer, S., Powell, D. RNAsik: A Pipeline for complete and reproducible RNA-seq analysis that runs anywhere with speed and ease. Journal of Open Source Software. 3, 583 (2018).
- Love, M. I., Huber, W., Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biology. 15 (12), 550 (2014).
- Kamiya, T., et al. The MYB36 transcription factor orchestrates Casparian strip formation. Proceedings of the National Academy of Sciences of the United States of America. 112 (33), 10533-10538 (2015).
- Zhang, Y., et al. Two types of bHLH transcription factor determine the competence of the pericycle for lateral root initiation. Nature Plants. 7 (5), 633-643 (2021).
- Haecker, A., et al. Expression dynamics of WOX genes mark cell fate decisions during early embryonic patterning in Arabidopsis thaliana. Development. 131 (3), 657-668 (2004).
- Chen, Q., et al. Auxin overproduction in shoots cannot rescue auxin deficiencies in Arabidopsis roots. Plant Cell Physiol. 55 (6), 1072-1079 (2014).
- Nichterwitz, S., et al. Laser capture microscopy coupled with Smart-seq2 for precise spatial transcriptomic profiling. Nature Communications. 7, 12139 (2016).
- Long, J., et al. Nurse cell--derived small RNAs define paternal epigenetic inheritance in Arabidopsis. Science. 373 (6550), (2021).
- Gutzat, R., et al. Arabidopsis shoot stem cells display dynamic transcription and DNA methylation patterns. EMBO Journal. 39 (20), e103667 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon