Method Article
ייצור הטרנסגניים צמחים עם הוספות עותק יחיד באמצעות וקטור בינארי BIBAC-ג'י
In This Article
Summary
באמצעות pBIBAC-GW וקטור בינארי הופך ייצור הטרנסגניים צמחים עם הוספות עותק יחיד ללא פגע, תהליך קל ופשוט. . הנה, סדרה של פרוטוקולים מוצג מדריך את הקורא לאורך התהליך הטרנסגניים תודרנית מפעלים לייצור, ובדיקות את הצמחים על intactness, להעתיק מספר התוספות.
Abstract
בעת יצירת הצמחים הטרנסגניים, בדרך כלל המטרה היא שיהיה יציב לביטוי transgene. פעולה זו דורשת שילוב יחיד, שלם של transgene, גם מרובת עותקים שילובים נחשפים לעיתים קרובות ג'ין להחרשת. הווקטור שער תואמת בינארית המבוסס על חיידקי מלאכותי כרומוזומים (pBIBAC-GW), כמו אחרים נגזרים pBIBAC, מאפשר החדרת transgenes עותק יחיד עם יעילות גבוהה. כמו שיפור pBIBAC המקורי, קלטת שער נשלטה לתוך pBIBAC-ג'י, כך הרצפים של עניין ניתן עכשיו בקלות לשלב ההעברה וקטור DNA (T-DNA) על-ידי שיבוט שער. בדרך כלל, השינוי עם pBIBAC-GW תוצאות יעילות של 0.2-0.5%, לפיה מחצית transgenics נושא שילוב יחיד-עותק שלם ב- T-dna. PBIBAC-GW הווקטורים זמינים עם עמידות Glufosinate-אמוניום או DsRed זריחה במעילים seed עבור בחירה בצמחים, ועם התנגדות kanamycin כבחירה של חיידקים. . הנה, סדרה של פרוטוקולים מוצג שמנחים את הקורא לאורך התהליך של יצירת הצמחים הטרנסגניים באמצעות pBIBAC-GW: החל משילוב מחדש את רצפי עניין לתוך וקטור pBIBAC-GW של בחירה, לשתול טרנספורמציה עם Agrobacterium, מבחר של transgenics, ובדיקות את הצמחים על מספר intactness, ולהעתיק הכיסויים באמצעות DNA סופג. תשומת לב ניתנת לתכנון אסטרטגיה blotting DNA לזהות copy יחיד מרובי שילובים-לוקוסים מרובות.
Introduction
בעת יצירת הצמחים הטרנסגניים, בדרך כלל המטרה היא לקיים את transgene(s) משולב stably הביע. זו יכולה להיות מושגת על ידי עותק בודד ללא פגע שילובים של transgene. שילובים מרובות עלולה לגרום ביטוי מוגבר transgene, אלא גם ג'ין להחרשת. וכמובן transgenes סביר יותר אם רצפים שנוספו מסודרים טנדם או הפוך חזרה1,2,3,4. וקטורים בינארי משמשים הסעות ב Agrobacterium-מתווכת טרנספורמציה ניסויים כדי לספק את רצפי עניין לתוך הגנום הצמח. מספר שילובים לתוך הגנום הצמח תלויה עותק מספר בינארי וקטור ב-5, Agrobacterium tumefaciens6. וקטורים בינאריים נפוצים רבים הן וקטורי העתק גבוהה, ולכן התשואה מספר עותק transgene ממוצע גבוה: 3.3 ל 4.9 עותקים תודרנית5.
ניתן להוריד את מספר שילובים T-DNA באמצעות וקטורים בינארי כי יש מספר נמוך-עותק tumefaciens א, כגון BIBAC7, או על-ידי שיגור T-DNA בין כרומוזום tumefaciens א 5. המספר הממוצע של שילובי transgene במקרים כאלה הוא מתחת 25,8,9,10. בשל היותם עותק יחיד ב- tumefaciens א, וגם ב- Escherichia coli, BIBAC-נגזרים יכול לתחזק ולספק בונה גדול כמו 150 kb11.
GW תואמי BIBAC וקטורים10,12 לאפשר הקדמה קלה של הגנים של עניין לתוך הווקטור באמצעות שער שיבוט. השימוש בטכנולוגיה שער מאוד מפשט את הליך השיבוט, אבל גם מתגבר על בעיות נפוצות המשויך וקטורים נמוך-העתקה-מספר גדול13,14, כגון תשואה נמוכה של DNA ומבחר מצומצם של הגבלת ייחודי אתרים זמינים עבור שכפול7,11. נגזרות pBIBAC-GW זמינים גם התנגדות Glufosinate-אמוניום (pBIBAC-בר-GW) או DsRed זריחה במעילים הזרע (pBIBAC-RFP-GW) לבחירת צמחים (איור 1)10,12. עבור שני וקטורים, גן עמידות kanamycin משמש סמן הבחירה של חיידקים.
לשלב הווקטורים pBIBAC-GW: מניפולציה גנטית ב e. coliו שילובים עותק יחיד (2) שלם ב הפיסקו יעילות גבוהה ועיצוב קל (1). PBIBAC-GW וקטורים התשואה על שילובים בממוצע 1.7 ב תודרנית כמחצית הצמחים הטרנסגניים נושא יחיד משולב T-DNA10.
ביטוי יציב של transgenes הוא דרישה עבור רוב transgenics שנוצר. Transgene יציב הביטוי יכולה להיות מושגת על ידי שילובים ללא פגע, עותק יחיד. עבודה עם הצמחים הטרנסגניים נושא שלם, עותק יחיד שילובים היא, עם זאת, חשוב אפילו יותר אם לדוגמה, המטרה היא לחקור את היעילות של תהליכים מבוססי-כרומטין, כגון מוטגנזה מכוונת, רקומבינציה, או לתקן את התלות של אלה תהליכים על המיקום גנומית ומבנה כרומטין במתחם הכניסה. על האינטרסים שלנו, ללמוד את התלות של oligonucleotide ביים מוטגנזה מכוונת (ODM) על ההקשר המקומי גנומית, קבוצה של קווים כתב עם תוספות ללא פגע, עותק יחיד של גנים כתב מוטגנזה מכוונת היה (איור 2) שנוצר10. באמצעות ערכת שורות, זה הוצג כי היעילות ODM משתנה בין לוקוסים הטרנסגניים משולב במקומות שונים גנומית, למרות רמות הביטוי transgene להיות דומה למדי.
Protocol
1. הוספת רצף של עניין וקטור בינארי
-
להכין את שער הכניסה וקטורים בינארי.
- לבודד את הווקטור שער כניסה הכוללת של מקטע דנ א או הגן עניין באמצעות ערכת הכנה מיני לפי ההמלצות של הספק.
הערה: BIBAC-GW וקטורים דורשים שימוש kanamycin (ק מ) לבחירה של חיידקים, לכן, השתמש וקטור כניסה עם עוד סמן ההתנגדות במקום kanamycin. למשל, וקטור pENTR ג ' נרל מוטורס, נושא גן עמידות גנטמיצין, הוא בחירה טובה12. - הפץ ולבודד את הווקטור BIBAC-GW של עניין. השתמש זן e. coli אשר עמיד בפני הרעילות של הגן ccdB מתנה בתוך בקלטת שער. ולבודד BIBAC-וקטורים באמצעות פרוטוקולים או ערכות שתוכננה במיוחד עבור פלסמידים גדול פי השאות של הספק.
- לבודד את הווקטור שער כניסה הכוללת של מקטע דנ א או הגן עניין באמצעות ערכת הכנה מיני לפי ההמלצות של הספק.
-
לבצע את תגובת שער.
- להכין את התגובה רקומבינציה LR לפי ההמלצות של הספק. לערבב את המרכיבים הבאים בצינור microcentrifuge 1.5 mL בטמפרטורת החדר (RT): 100 – 300 ng כניסה שיבוט (supercoiled), 300 ng של BIBAC-GW וקטור, LR Clonase התגובה מאגר (הריכוז הסופי: 1 x). לכוונן את עוצמת התערובת µL 16 עם טה (10 מ"מ. טריס, 1 מ מ EDTA, pH 8.0). לבסוף, להוסיף 4 µL LR Clonase האנזים לערבב, לערבב בעזרת vortexing. דגירה התערובת 25 ° c עבור 1 h.
- לסיים את התגובה LR על-ידי הוספת 2 µL של פתרון Proteinase K (2 µg/µL) לתערובת מוכן בשלב 1.2.1. לערבב, דגירה ב 37 מעלות צלזיוס למשך 10 דקות.
-
להפוך e. coli עם תערובת התגובה שער על ידי אלקטרופורציה.
- Desalt את תערובת התגובה LR לפני אלקטרופורציה.
הערה: שלב זה הוא קריטי עבור אלקטרופורציה מוצלחת. להלן דיאליזה שיטה זו שיטות המתוארים, אך אחרים כגון משקעים עם סודיום אצטט, אתנול יכול לשמש גם.- היכונו הגדרת מסנן דיאליזה התגובה LR. שופכים 20 מיליליטר מים יונים הנדסה גנטית לתוך צלחת פטרי סטריליות. מקום דיסק סנן ממברנה (גודל הנקבוביות = 0.025 מיקרומטר) על פני המים.
- Pipette התגובה LR כולו בזהירות על גבי הקרום ולאפשר את התערובת עד dialyze ב RT לשעה.
- להוסיף 5 µL של המיקס LR desalted לתאים DH10B אלקטרו-המוסמכת cuvette אלקטרופורציה (0.1 ס מ). Electroporate התאים (V 1.5/ס, התנגדות 200 Ω, קיבוליות 25 µF), מיד להוסיף 1 מ"ל ומחוממת מראש Catabolite אופטימלית סופר הדיכוי (SOC) בינוני על התאים, ואחריו הדגירה ב 37 מעלות צלזיוס במשך 45 דקות, 180 סל ד. (SOC בינוני, 1 l: 20 גר', מה נשארתי טריפטון, 5 גר' שמרים לחלץ, 0.5 גר' NaCl, 2.5 מ של 1 מ' אשלגן כלורי, 20 מ של 1 מ' מסנן-עיקור גלוקוז).
הערה: DH10B תאים הרבה מכדי התאים האחרים, e. coli stably לשמור על פלסמידים גדולים.
הערה: התנאים אלקטרופורציה אופטימלית תלויות המכשיר אלקטרופורציה בשימוש. - גלולה החיידקים במהירות המרבית עבור 30 s באמצעות של microcentrifuge, להסיר את עודף SOC, resuspend בגדר כ 50-100 µL בינוני לוריא-Bertani (ליברות). להפיץ את החיידקים על צלחות kanamycin-ליברות (ק-ליברות) (ריכוז ק מ, µg 40/mL), דגירה הלוחות ב 37 מעלות צלזיוס למשך הלילה. (LB בינוני, 1 l: 10 גרם של מה נשארתי טריפטון, 5 גר' שמרים לחלץ, 10 גרם של NaCl. בינוני מוצק הוסיפו אגר, 15 גר'/ליטר).
- Desalt את תערובת התגובה LR לפני אלקטרופורציה.
-
לזהות את המעו ף משולבות מחדש של BIBAC-ג'י, לבודד דנ א פלסמיד.
- כדי שתוכל לגדול על צלחות ק מ- LB, התאים e. coli צריך להכיל את פלסמיד BIBAC-GW משולבות מחדש של שבו רצף ccdB מוחלף עם הוספת הרצוי. השתמש המושבה פולימראז תגובת שרשרת (PCR)15 כדי לבדוק אם מושבות חיידקים על הצלחת להכיל את פלסמידים הנכונה, יש עמוד השדרה BIBAC-GW והוספה של עניין.
- כדי לזהות את עמוד השדרה pBIBAC-בר-GW, לבצע תגובה15 PCR עם תחל DM1969 5'-GCGACGAGCCAGGGATAG-3 'ו DM1970 5'-ATCAGTGCGCAAGACGTGAC-3'. קבוצה זו תחל מגביר את קטע bp 563 של הגן בר .
- כדי לבדוק הנוכחות של עמוד השדרה BIBAC-RFP-GW, לבצע PCR15 תגובה, באמצעות תחל M737 5'-CGTGTAAAAAGCTTAGACTG-3 'ו M892 5'-AACAGATGGTGGCGTCCC-3'. שילוב זה פריימר מגביר את קטע bp 791 חופפים הרצף promotor ו- rfp cruciferin.
- לבצע PCR15 תגובות באמצעות תחל גנים ספציפיים כדי לבדוק נוכחות של הוספה עניין.
- לחסן מושבה בודדת חיובית ב- 2-5 מ ל LB בינוני המכיל kanamycin (40 µg/mL) עבור בידוד של דנ א16. דגירה-37 מעלות צלזיוס על תפקודי לב / נשימה-180 סל ד, בין לילה.
- לבודד את פלסמיד דנ א (ראה שלב 1.1.2).
- כדי שתוכל לגדול על צלחות ק מ- LB, התאים e. coli צריך להכיל את פלסמיד BIBAC-GW משולבות מחדש של שבו רצף ccdB מוחלף עם הוספת הרצוי. השתמש המושבה פולימראז תגובת שרשרת (PCR)15 כדי לבדוק אם מושבות חיידקים על הצלחת להכיל את פלסמידים הנכונה, יש עמוד השדרה BIBAC-GW והוספה של עניין.
2. הכנת tumefaciens א לטבילה פרחוני של תודרנית
-
להפוך BIBAC-GW נגזרים כדי tumefaciens א.
- להכין תאים אלקטרו-המוסמכת של המסייע זן C58C1 נושאת את pCH32 tumefaciens א פלסמיד7. לגדול חיידקים בנוכחות טטרציקלין (5 µg/mL), ריפאמפיצין (100 µg/mL) כדי לבחור את pCH32 ולהבטיח צמיחת תאים Agrobacterium .
- להוסיף 0.25-0.5 µg-DNA של נגזרת pBIBAC-ג'י, מראש מומס במים 10 – 20 µL סטרילי הנדסה גנטית יונים, לתאים 20 µL המוסמכת Agrobacterium אלקטרופורציה וואקום (0.1 ס מ). לשמור תאים על קרח.
- Electroporate התאים (1.5 V/ס מ, התנגדות 400 Ω, קיבוליות 25 µF). מיד לאחר אלקטרופורציה, להוסיף 1 מ"ל ומחוממת מראש (28 מעלות צלזיוס) SOC בינוני של חיידקים, דגירה התאים ב 28 מעלות צלזיוס למשך 60-90 דקות.
- להפיץ 100 µL ואת שאר החיידקים על צלחות LB נפרד המכיל ריפאמפיצין (100 µg/mL), טטרציקלין (5 µg/mL) ו kanamycin (40 µg/mL) ולאחר תקופת דגירה בחושך ב 28 ° C של 1-2 ימים.
-
הכינו את המתלים Agrobacterium .
- בדוק על-ידי ה-PCR מספר המושבות tumefaciens א מהצלחת מוכן בשלב 2.1.4, נוכחות של הווקטור המתאים (ראה שלב 1.4.1).
- פס שמושבה בודדת אישר להכיל את הווקטור בינארי עם תותב המתאים בצלחת LB אנטיביוטיקה (ראה שלב 2.1.4). לגדול-28 מעלות צלזיוס למשך הלילה.
- חזור על ומבטא עם שמושבה בודדת שהושג בשלב 2.2.2.
- לחסן מושבה בודדת ב- 2.5 מ של מדיום LC בתוספת אנטיביוטיקה (ראה שלב 2.1.4) עבור preculture. דגירה על 28 מעלות צלזיוס במשך לפחות 8 שעות או למשך הלילה, 180 סל ד. (LC בינוני, 1 l: 10 גרם של מה נשארתי טריפטון, 5 גר' שמרים לחלץ, 0.5 g של NaCl, 2.5 גר' MgSO4 · 7 שעות2א, 2 גרם מלטוז).
- הוסף את preculture צעד 2.2.4. 250 מ ל LC בתוספת אנטיביוטיקה (ראה שלב 2.1.4) ולחצו לגדול ב 28 ° C, ב 180 סל ד, בין לילה.
- צניפה התרבות על ידי ספינינג-g x 5,500 עבור 12 מינימלית מחדש להשעות בגדר 100 מ ל תמיסת המכילה 5% סוכרוז, 0.05% Silwet L-77, 0.5 x גב' Pour ההשעיה לתוך מיכל סטרילי לטבילה פרחוני של הצמחים.
3. תודרנית טרנספורמציה
-
היכונו הצמחים תודרנית לשינוי.
- לגדל צמחים תודרנית בחדר גדילה מבוקרת חממה או היסטוריים עד שהם פורחים (12 סירים עם 9 צמחים כל לכל טבילה).
- קליפ את המנעולים הראשונה כדי לאפשר יותר משני ברגים להגיח. צמחים מוכנים לטבילה 4-6 ימים לאחר החיתוך, כאשר הצמחים יש ראשים פרח לא בשלה רבים ורבים לא מופרית siliques.
-
טובלים פרחוני
- טובלים התפרחות במשך 5-10 s ההשעיה Agrobacterium מוכן בשלב 2.2.6. השתמש עצבנות עדין.
- לעטוף את החלקים מעל הקרקע של הצמחים תיאחז הסרט כדי לשמור על לחות גבוהה, מכסים של סירים צמח עם קופסא כדי לשמור על הצמחים בחושך. דגירה הצמחים במשך יומיים בחדר חממה/צמיחה.
- הסר את תיבת ואת הסרט תיאחז ולגדול הצמחים לפדיון בחדר חממה/צמיחה.
הערה: כדי להגדיל את היעילות של טרנספורמציה, הצמחים אותו ניתן מחדש טבל 7 ימים לאחר טבילה ראשונה. - לקצור את הזרעים. בריכה ולנתח את הזרעים (T1) של צמחים, טרנספורמציה עם הבונה אותו, כערכה בודדת.
-
מסך עבור הצמחים הטרנסגניים.
- על המסך עבור הצמחים הטרנסגניים טרנספורמציה עם נגזרת pBIBAC-RFP-GW, לנתח את הזרעים באמצעות מיקרוסקופ זריחה. על מנת לזהות ביטוי DsRed במעילים זרע, תמונה את הזרעים של עירור של 560 ננומטר, פליטה של 600-650 ננומטר. להפריד את הזרעים פלורסנט עמיתיהם הלא-פלורסנט באמצעות מלקחיים.
- על המסך עבור הצמחים הטרנסגניים טרנספורמציה עם נגזרת pBIBAC-בר-GW, לזרוע את הזרעים במגשים מלא אדמה (~ 2,500 זרעים/0.1 מ'2). כדי להבטיח אפילו שמתפשטת של זרעים מגשים, להשעות את הזרעים ב- 0.1% אגר ב 0.5 x בינוני Murashige Skoog (MS), להפיץ את הזרעים באמצעות פיפטה של 1 מ"ל.
הערה: כדי לעורר את הזרעים לנבוט באופן סינכרוני, דגירה הזרעים לפחות 2 ימים ב- 4 מעלות צלזיוס. זה יכול להיעשות לפני או אחרי זורעים את הזרעים.- לרסס את השתילים עם 0.5% Glufosinate-אמוניום פתרון 2 שבועות ו- 3 שבועות לאחר הזריעה המגשים. השתמש 500 מ"ל של Glufosinate-אמוניום פתרון לכל 1 מ'2.
- העברת השתילים ששרד סירים נפרדים. תמונה אופיינית של מגש עם שתילים לפני ואחרי טיפול Glufosinate-אמוניום (השני) מוצגים באיור3.
- לנתח את הצמחים Glufosinate אמוניום-עמיד על ידי ה-PCR לנוכחות של הבונה של הריבית (ראה שלב 1.4.1. עבור תחל).
- לבודד את ה-DNA גנומי צמח עבור ה-PCR באמצעות השיטה המתוארת על ידי אדוארדס. et al. 17
4. אפיון את Transgenics על המספר ועל שלמות של שילובי T-DNA
- האסטרטגיה של הגבלת digestions
הערה: לקבוע את מספר שילובים T-DNA ואת היושר שלהם על ידי DNA סופג באמצעות אנזימי הגבלה. שיטה זו מאפשרת לזהות יחיד, אך גם חזר על שילובים-לוקוסים זהים או שונים בגנום.- השתמש סדרה של הגבלת digestions כדי לזהות את דפוסי אינטגרציה שונים אפשריים:
- בחר אנזים שחותך פעם אחת באמצע T-DNA, כדי שתוכל לחקור באופן עצמאי את רצפי ויוצאת של אתר ההגבלה (איור 4A ואיור 7 א-ג). ראה איור 4A, והאגדה איור על התוצאות הצפויות ועל פרשנות.
- בחר אנזים או שילוב של אנזימים חותכים את הרצף כולו עניין בו זמנית (איור 4B וכן איור 7 א-D). כל סטייה מן האורך ידוע מציין לחיתוך בקלטת משולב.
הערה: לטפל כדי להשתמש רק אנזימי הגבלה שאינם רגישים ציטוזין מתילציה.
- השתמש סדרה של הגבלת digestions כדי לזהות את דפוסי אינטגרציה שונים אפשריים:
- להכין דגימות ה-DNA גנומי.
- לבודד את ה-DNA גנומי מצמחים נושאת הבונה של ריבית. שיטה miniprep CTAB DNA יכול לשמש עבור בידוד של דנ א18. לדנ א כתם ניתוח של תודרנית דנ א, 2 – 2.5 µg של דנ א גנומי נדרש. להמיס את הדנ א ב 50 µL של טה.
- בדוק את שלמות הדנ א על ידי ג'ל אלקטרופורזה16. שלמות הדנ א נודד כלהקה דיסקרטית אחד בחלק העליון של הג'ל. ניתן לזהות DNA השפלה כמו הנוכחות של כתם. כדי למנוע נזק לדנ א עקב חוזר ונשנה לאפס-מפשיר, נשמרות דגימות דנ א גנומי ב 4 º C.
- לעכל את הדנ א (2-2.5 µg במקרה של דנ א גנומי תודרנית ) בהנפח הכולל של 50 µL, בן לילה, באמצעות מאגר תנאים שהוצעה על ידי הספק אנזים.
- במבחנה, מערבבים 2 – 2.5 µg של תודרנית הדנ א, 5 µL 10 x הגבלת מאגר 5 אנזים הגבלה U סך של 50 µL מים יונים הנדסה גנטית.
- להוסיף צבע טעינה (1 x ריכוז סופי) הדגימות ההגבלה לפני טעינת על ג'ל. עבור מעקב ויזואלי טוב, השתמש באחת מהאפשרויות הבאות: comigrating עם שברים קטנים (כחול Bromophenol, 350 – 400 bp), או comigrating עם שברים גדולים יותר (Cylene cyanol, kbp 3-4).
- הפעל את הג'ל הדנ א.
- להכין הרבה זמן (20 ס"מ) 0.5 x TBE agarose ג'ל19. האחוזים של agarose הג'ל תלוי גודל המקטע צפוי. 0.8-1% מפריד בצורה אופטימלית בין שברי > בגודל של 1 kb. השתמש 1 – 1.5% agarose על שברי < 1 kb. אל תוסיף אתידיום ברומיד לג'ל. (5 x TBE, l: 54 1g של Trizma בסיס, 27.5 גר' חומצת, g 3.75 של EDTA).
הערה: כדי למנוע זיהום ה-DNA, מגשי ג'ל לשימוש שלא נעשה בהם שימוש כדי fractionate פלסמיד ו- PCR מוגבר הדנ א. - לטעון את הדגימות ג'ל19.
- להוסיף סמני DNA הג'ל הנמצאים בטווח גודל של השברים הצפוי. לטעון כ 1 µg של סמן (50-250 ng של קטע בגדלים שונים) על הג'ל כדי לאפשר הדמיה על ידי אור UV.
- Fractionate בן לילה של ה-DNA-מתח נמוך (40 – 50 V/500 mA) גודל.
- להכין הרבה זמן (20 ס"מ) 0.5 x TBE agarose ג'ל19. האחוזים של agarose הג'ל תלוי גודל המקטע צפוי. 0.8-1% מפריד בצורה אופטימלית בין שברי > בגודל של 1 kb. השתמש 1 – 1.5% agarose על שברי < 1 kb. אל תוסיף אתידיום ברומיד לג'ל. (5 x TBE, l: 54 1g של Trizma בסיס, 27.5 גר' חומצת, g 3.75 של EDTA).
- היכונו העברה של ה-DNA של הג'ל agarose למוח ניילון.
- להעביר את הג'ל במגש נפרד, את הכתם למשך 20-25 דקות ב- 0.5 x TBE המכיל אתידיום ברומיד (5 µg/mL) על-ידי סיבוב ב 40 סל ד ב תפקודי לב / נשימה.
- דמיינו את הג'ל על transilluminator UV. ודא ההפרדה בגודל של ה-DNA גנומי, כולל הניראות של להקות בלוויין דיסקרטית (איור 5A). כתם לכיוון מידות משקל מולקולרי נמוך מצביע על DNA השפלה.
- על transilluminator UV, שכב שקיפות על הג'ל, לסמן את המיקום של החריצים הלהקות מרקר עם עט מרקר (איור 5B). זה יקל קביעת גודל השברים hybridized מאוחר יותר, במקרה סמן רצפי לא hybridize במיוחד עם החללית ה-DNA. על ידי המציינת את השברים סמן בשלב זה, זה ניתן לאתר את הגודל של השברים hybridizing.
- מקם את הג'ל לתוך המגש, לשטוף עם מים יונים הנדסה גנטית, ולאחר לתוכה 0.25 M HCl למשך 15 דקות כדי fragmentize את ה-DNA בתוך הג'ל. לשטוף עם מים יונים הנדסה גנטית. השתמש HCl מספיק מים כדי לכסות את הג'ל במגש, וסובב את המגש עם הג'ל המשוקע ב 40 סל ד ב תפקודי לב / נשימה.
- דגירה הג'ל במאגר דנטורציה עבור 30 דקות לשטוף עם מים יונים הנדסה גנטית. השתמש מאגר מספיק מים כדי לכסות את הג'ל במגש, וסובב את המגש עם הג'ל המשוקע ב 40 סל ד ב תפקודי לב / נשימה. (דנטורציה מאגר: 0.5 M NaOH, 1.5 M NaCl).
- דגירה הג'ל במאגר ניטרול במשך 30 דקות לשטוף עם מים יונים הנדסה גנטית. השתמש מאגר מספיק מים כדי לכסות את הג'ל במגש, לסובב את המגש עם ג'ל המשוקע ב 40 סל ד ב תפקודי לב / נשימה. (ניטרול מאגר: 0.5 M טריס, 1.5 M NaCl, 220 מ"מ HCl, pH 7.6).
- להעביר את ה-DNA קרום ניילון.
- הכינו את הכיוונון להעברה נימי של ה-DNA גנומי. מניחים צלחת פלסטיק (בערך בגודל של הג'ל או גדול יותר) על מגש מלא עם 20 x תמיסת מלח-נתרן ציטראט (האס). מקפלים פיסת נייר סינון עבה מעל המגש, כך שניהם מקצוותיו תלויות הממונים. חותכים חתיכה בגודל ג'ל של ניילון הטעון חיובית ממברנה N Hybond +, ו- 2 חתיכות נייר סינון עבה. (20 x האס: NaCl 3 מ', 0.3 M סודיום ציטרט).
- הכינו את ההתקנה blotting (איור 6) על ידי הנחת הג'ל, חריצי למטה על נייר הסינון בצלחת פלסטיק. מקום Hybond N+ קרום עליון, ואחריו 2 שכבות של נייר סינון. טרום רטוב כל שכבה ב 20 x SSC לפני הוספתן לאסיפה. הקפד להסיר את כל בועות האוויר בין שכבות כמו אלה לעכב את העברת הדנ א.
- מכסים את מכלול עם שכבה עבה של נייר טישו. מניחים צלחת פלסטיק עם משקל, כגון בקבוק קטן, על העליונה. ודא כי הלחץ מחולק באופן שווה על-פני הג'ל. פעולה זו תבטיח העברה נכונה של ה-DNA.
הערה: המשקל צריך להיות בערך 200-300 גר'; משקולות כבדים ה"בלתי העברת הדנ א. - לכסות את האזור שמסביב ההרכבה, כולל נייר סינון חשוף, עם תיאחז הסרט (איור 6) כדי למנוע אידוי של מאגר x SSC 20, המטרה שנימי כוחות לכיוון קרום ניילון. כתם בן לילה.
- לסמן את המיקום של חריצים, שם, ו/או של תאריך על גבי הקרום עם עיפרון, ולהסיר את הקרום מההרכבה. שימו לב כי הצד התחתון בא במגע עם הג'ל, נושא ה-DNA.
- מיד לתקן את ה-DNA למוח על ידי הקרנת UV (2,400 µJ/m2) באמצעות Crosslinker UV.
הערה: תנאים Crosslinking תלויות בסוג של הממברנה משמש.
הערה: בשלב זה הקרום ניתן להיות מאוחסנים ב-20 ° C, המשמש הכלאה עם מכשיר בדיקה מאוחר יותר. לשטוף את הקרום תפור 2 x האס ואני חותם על זה מראש מקופל צינורות פוליאתילן heat-sealable לפני הנחת ב-20 ° C.
- להכין את החללית של הכלאה.
- להגביר את רצף כדי לשמש את המכשיר עבור ה-DNA סופג PCR20. 50-100 ננוגרם של קטע ה-PCR kbp bp-2 250 משמש מכשיר בדיקה. שני רגשים נפרדים, אחד hybridizing אזור הגבול הנכון proximal והשני באזור proximal גבולו השמאלי ב- T-dna, יכול לשמש כדי להעריך את הנוכחות של כולו T-DNA (איור 4A ואיור 7).
- לדלל 50-100 ננוגרם של מוצר ה-PCR µL 24 של הנדסה גנטית יונים מים במבחנה.
- Denature את המוצר PCR מדולל על ידי הרתחה זה עבור 5 דקות בתוך בלוק מים או חום, ואז צנני ישירות על קרח.
- הפשרת premade GCT-מיקס על קרח. (GCT-מיקס: dGTP, dCTP, dTTP (כל 0.5 מ"מ), אקראי hexamers 43.2 ng/µL, Acetylated BSA 1.33 מ"ג/מ"ל, 33 מ מ של β-mercaptoethanol, Hepes 0.67 מ', מ מ 0.17 טריס pH 6.8, 17 מ"מ MgCl).
- הוסף µL 21 של GCT-לערבב 2 U של Klenow פרגמנט למוצר ה-PCR.
- להוסיף 2 µL של ATP [32P] לתערובת, דגירה ב 37 ° C עבור 1 h.
התראה: כל השלבים הכרוכים ATP [32P] צריך להתבצע בסביבה המיועד לעבודה רדיואקטיבי תוך שימוש ההגנה המתאים.
הערה: ודא [32P] מ- ATP הוא טרי (לא יותר מ 1 בחצי משרה עבר). - להכין G-50 ספדקס עמודה (גס או בינוני)21 לטיהור החללית עם תוויות של טריטוריה נוקלאוטידים (רדיואקטיבי). לקחת מזרק 2 mL, ו כיסוי לשקע עם מעגל קטן של נייר סינון עבה. להוסיף 2 מיליליטר ספדקס G-50 מומס טה לתוך המזרק, להסיר כל נוזל מן העמודה על-ידי ספינינג.
- למקם את העמודה לתוך צינור פלסטיק 15 מ"ל, לטעון את המכשיר עם תוויות בעמודה ו ספין בטמפרטורת החדר (להגדיר לצנטריפוגה ב g 750 x, לאפשר את סל ד להגדיל עד 750 גרם x, אז תפסיק לצנטריפוגה ולאפשר את הסיבוב לירידה של 0 x g) כדי elute החללית. µL 200 של טה להוסיף העמודה ואת spin כדי elute את המכשיר הנותרים; חזור על פעם אחת. בתנאים אלה, שברי דנ א שכותרתו אינם נכללים המטריקס ספדקס, elute, בעוד נוקלאוטידים חופשי להישאר בעמודה.
- השתמש µL 300 של המכשיר שכותרתו למחזור הכלאה. תמשיך הנותרים החללית שכותרתו ב-20 ° C לשימוש מאוחר יותר. עם זאת, זכור את המחצית של ATP [32P].
- Hybridize את האבן החשופה של ה-DNA.
- חום 2 x SSC, הכלאה מאגר (15 מ"ל למחזור הכלאה, מקסימום של 2 שהכלים למחזור) עד 65 ° C. (הכלאה מאגר: 10% לתוספי סולפט, 1% מרחביות, 1 M NaCl, 50 מ מ טריס pH 7.5, מתמוסס ב 65 ° C, תמשיך aliquots ב-20 ° C).
- מחממים מראש תנור הכלאה ל 65 ° C.
- מניחים רשת ניילון מגש עם קצת מחומם (65 ° C) 2 x SSC כדי לכסות את המגש. את המקום את האבן החשופה של הדנ א על גבי הרשת, עם הצד ה-DNA. לגלגל את האבן החשופה יחד עם רשת השינוי והכנס את הגליל לתוך צינור הכלאה. יוצקים את 2 עודף x SSC.
- צינור microcentrifuge, מרתיחים µL 150 ה-DNA של הזרע סלמון (ריכוז 10 מ"ג/מ"ל) למחזור הכלאה במשך 5 דקות (ראה גם שלב 4.6.3). מגניב מיד על קרח והוסף למאגר הכלאה מחומם מראש.
- להוסיף את הפתרון זרע של מאגר-סלמון הכלאה ברכבת התחתית עם האבן החשופה. טרום hybridize-65 מעלות צלזיוס במשך לפחות שעה על גלגל מסתובב, על סל ד 12.
- בעת הדגירה מראש בשלב 4.7.5. . זה כמעט גמור, הרתיחה 300 µL של המכשיר עם תוויות עבור 5 דקות (ראה גם שלב 4.6.3) ולהוסיף מיד האבן החשופה לאחר הדגירה.
- Hybridize בן לילה הגלגל מסתובב ב 63 ° C, סל ד 12. לא pipette את המכשיר ישירות על האבן החשופה, אלא אל הפתרון זרע של מאגר-סלמון הכלאה.
- לשטוף את האבן החשופה.
- מחממים את פתרונות כביסה (1 x הצהבת, מרחביות 0.1% ו- 0.1 x SSPE, 0.1% מרחביות) עד 65 ° C. (20 x SSPE: 3 M NaCl, 230 מילימטר NaH2PO4, 20 מ מ EDTA, pH 7.0).
- תשליך את הפתרון הכלאה ולהוסיף כ 100 – 150 מ ל 1 x SSPE, 0.1% מרחביות לפתרון הצינורית הכלאה, לסגור את הצינור, וסובב בעבודת יד. יוצקים הכלאה ושטיפת פתרון פסולת רדיואקטיבית נוזלית המתאים.
- להוסיף בערך 100 – 150 מ ל 1 x SSPE, 0.1% מרחביות לפתרון הצינורית, סגור ולאחר דגירה הצינור למשך 15 דקות ב 63 ° C הגלגל מסתובב, סל ד 12. תבטל את הפתרון כביסה כראוי.
- להוסיף בערך 100 – 150 מ"ל של 0.1 x SSPE, 0.1% מרחביות לפתרון הצינורית הכלאה, סגור, וסובב את הצינור עבור 5 דקות ב 63 ° C, סל ד 12. תבטל את הפתרון כביסה כראוי.
- . קח את האבן החשופה יצאה מהשפופרת ולמקם אותו מגש ובו מספיק טרופה 0.1 x הצהבת, מרחביות 0.1% ו- shake למשך 3 דקות באמבט מים חזק ב- 65 מעלות צלזיוס. בינתיים, יש לשטוף את רשת השינוי מגש מלא במים.
- להוציא את האבן החשופה, למקם אותו בין פלסטיק מראש מקופל (צינורות פוליאתילן), בזהירות לנגב עודף נוזלים, והנח את כתם יבש בקצרה. שימו לב כי נוזל יהרוס את המסך phosphorimager.
- חותם את האבן החשופה בפלסטיק משלושה צדדים. להסיר את כל עודפי נוזלים המקיפים את האבן החשופה וסגור את צינור פלסטיק על ידי איטום הצד הרביעי. חתוך את העודף של פלסטיק. ודא שהאבן החשופה אטום לא דולף הפלסטיק הוא יבש מבחוץ.
- לחשוף את המסך phosphorimager.
- מקם את האבן החשופה אטום קלטת phosphorimager, עם המסך phosphorimager פונה לצד ה-DNA של האבן החשופה. לסגור את הקלטת ולהשאיר עבור ± 2 – 4 ימים, בהתאם לעוצמת תיוג רדיואקטיבי רגישות phosphorimager.
- סריקת המסך phosphorimager משתמש של phosphorimager. לטפל כדי לחשוף את המסך מעט ככל האפשר לאור לפני סריקה. לשמור את התמונה. למחוק את המסך מ אות על ידי לחשוף את זה באור בהיר.
- לנתח את האבן החשופה.
- הניתוח תלוי האסטרטגיה הגבלה בשימוש שלב 4.1. כאשר מנתחים את האבן החשופה המוכנים לפי האסטרטגיה המוצגים בשלב 4.1.1.1 (איור 4A), לספור את כמות הרסיסים זוהה. באסטרטגיה זו, מספר קטעים hybridized מתייחס למספר של שילובי T-DNA.
- השווה את המספר של השברים מזוהה עם מכשיר בדיקה עבור מימין (איור 7 ב) וכן את החלק הימני (איור 7C) ב- T-dna.
הערה: אם מספר שונה של קטעים hybridizing זוהה, ואז גם i) T-DNA עותקים מרובים (גם בכיוון ההפוך, או ישירות), או שהיישום ii) משולב T-DNAs נוכחים. - הערכת הגודל של קטעים hybridized על האבן החשופה בהתבסס על הגודל של הלהקות סמן, ולהשוות הגדלים של שברי hybridized לרסיס הצפוי גדלים מחושב בהתבסס על האסטרטגיה ההגבלה של טנדם הוספות (איור 4A) כדי זיהוי אפשרי טנדם סידור של T-DNAs. השתמש את דמות 4A כמדריך כדי לחשב את הגודל של קטעים הצפוי.
הערה: אם הגודל של קטעים hybridized אינו מסכים עם אלה מחושבים, ואז לוודאי אחת של שילובי הנוכחי אינה שלמה.
- השווה את המספר של השברים מזוהה עם מכשיר בדיקה עבור מימין (איור 7 ב) וכן את החלק הימני (איור 7C) ב- T-dna.
- כאשר מנתחים את האבן החשופה המוכנים לפי אסטרטגיה המוצגים בשלב 4.1.1.2 (איור 4B), להעריך את הגודל של השבר hybridizing על האבן החשופה בהתבסס על גודל סמן להקות, ולהשוות אותם עם הגודל הצפוי. הכנסת טקסט שלמים מניבה קטע בודד באורך מוגדר. כל סטייה של אורך הצפוי מציינת שילוב לא שלם (איור 7D).
- הניתוח תלוי האסטרטגיה הגבלה בשימוש שלב 4.1. כאשר מנתחים את האבן החשופה המוכנים לפי האסטרטגיה המוצגים בשלב 4.1.1.1 (איור 4A), לספור את כמות הרסיסים זוהה. באסטרטגיה זו, מספר קטעים hybridized מתייחס למספר של שילובי T-DNA.
- רצועת האבן החשופה של הכלאה מחדש (אופציונלי).
הערה: האבן החשופה אותו יכול שהוכלא ברצף עם הגששים שונים. לפני שתמשיך עם מכשיר בדיקה חדשה, רצועת בדיקה hybridized הקודם מ האבן החשופה.- כדי להסיר את המכשיר האבן החשופה, מקם את האבן החשופה מגש עם ה-DNA-הצד שלו פונה כלפי מטה. יוצקים עודף של 0.5% מרחביות במגש. מרתיחים את הקרום למשך 2-5 דקות. משך הטיפול תלוי בגודל GC-תוכן של המכשיר בשימוש. הגששים יותר, עשירה יותר-GC זקוק לטיפול ארוך יותר.
- אחרי ששללו, hybridize את האבן החשופה עם רובוט נוסף, או לאטום ולאחסן ב-20 ° C.
תוצאות
באמצעות מערכת BIBAC-ג'י, כתב בונה לימוד ODM בצמחים היו שנוצר10. המבנים היו בעיצוב שער כניסה וקטור pENTR-gm12 , מוכנס לתוך pBIBAC-בר-GW (איור 1) באמצעות התגובה רקומבינציה שער LR.
תודרנית נהפכו עם pDM19, BIBAC-בר-GW פלסמיד עם כתב mTurquoise-eYFP נושא של translational stop codon במסגרת הקריאה eYFP במיקום 120 (mTurquoise2-eYFP * 40) (איור 2)10. בסך הכל, 126 תודרנית הצמחים היו טרנספורמציה (9 צמחים לכל סיר, סירים 14). זרעים של צמחים אלה היו איחדו, שנזרעו על מגשים עם אדמה, מותר לגדל במשך שבועיים לפני הטיפול עם Glufosinate-אמוניום פתרון. רק שתילים לבטא את הגן בר (נוכח BIBAC-בר-GW) לשרוד Glufosinate-אמוניום טיפול (איור 3). בסך הכל, אותרו 11 transgenics הפך עם pDM19, המקביל יעילות טרנספורמציה של 0.02% של הזרעים ניתח.
במשך 11 transgenics מבודדים, DNA סופג שימש כדי לקבוע את המספר של שילובי T-DNA. למטרה זו, דנ א גנומי נחתך עם אליפותII או Scaאני (אסטרטגיה כמו המציאו על דמות 4A). שני אלה אנזימי הגבלה חותכים פעם אחת בלבד לתוך הרצף T-DNA (איור 7 א). הכלאה עם הגששים זיהוי הבר, eYFP קידוד אזורים מותרים זיהוי של מספר מקטעי DNA בהתאמה.
המספר של DNA בודדים קטעים על שהכלים המותר עבור הערכת מספר T-DNA הוספות בשורות כתב (טבלה 1). קטעים hybridizing יחיד עם בדיקה בר והן eYFP ציינו כי הנוכחות של שילוב T-DNA בודד. מ 11 transgenics ניתח, שש נשא שילובים יחיד. המספר הממוצע של שילובי היה 1.2.
6 שורות נושא שילוב T-DNA בודד, השלמות של הבונה כתב המוסף נבחנה באמצעות DNA סופג (אסטרטגיה כמו המציאו על דמות 4B). דנ א גנומי נחתך עם אליפותII ו- Pciאני לשחרר קטע 5.5 kb המכיל גנים היתוך בר והן mTurquoise-eYFP (איור 7 א). בדיקה נגד eYFP שימש כדי לזהות השבר הצפוי. כל הצמחים שנבדקו נשא של קטע שלם. שימו לב: השבר בדק אי-כלילה של השמאל והגבול הימני T-DNA, ולכן אינה בודקת את תקינות כולו T-DNA, אבל רק החלק המכיל את transgenes של עניין.
הביטוי של הגן כתב פלורסנט נקבע עצמאית עותק יחיד הטרנסגניים שורות שונות רק על ידי המיקום גנומית ב- T-dna. רמות התעתיק היחסי של הכתב מונחה יזם mTurquoise-eYFP CaMV-35S נמדדו על ידי RT-qPCR של ארבע שורות כתב DM19, נושאת שילובים ללא פגע, עותק יחיד אשר המיקום גנומית היה נחוש10. וריאציה רמות ביטוי גנים כתב בין השורות היה מינורי: ההפרש המרבי ברמות ה-RNA mTurquoise-eYFP היה 2-fold (איור 8A).
בשלב הבא, ה-ODM בוצע בשורות אלו כתב. שלושה מתוך ארבעת הקווים כתב עצמאיים הראו יעילות ODM דומה למדי (איור 8 ב'). עם זאת, שורה אחת, DM19 [4] 1, הניב של יעילות ODM נמוך מאוד לעומת הקווים האחרים. תוצאות אלו מצביעות על ה-ODM מושפע גנומית ההקשר המקומי. באיזה אופן הקשר גנומית המקומי של השילוב T-DNA ב- DM19 [4] 1 נבדלת מזו בשורות אחרות נשאר להיות מזוהה. ניתוח של datasets זמין על סימני כרומטין פעיל, לא פעיל באתרי אינטגרציה T-DNA גנומי בצמחים שאינם מהונדס לא סיפקו תשובה של10.

איור 1: מפות פונקציונלי של pBIBAC-GW וקטורים. pBIBAC-GW נגזרים זמינים גם התנגדות Glufosinate (bar) או זריחה DsRed במעילים זרע (DsRed) כסמן הבחירה בצמחים. עבור שני וקטורים, גן עמידות kanamycin הוא סמן הבחירה של חיידקים. שער ccdB קלטת מוצג בין ראשי חץ ירוק, המייצג רקומבינציה אתרי attR1 ו- attR2. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: לבנות כתב מוטגנזה מכוונת. הגנים כתב mTurquoise-eYFP מונעים על ידי promotor 35S-CaMV. MTurquoise קידוד האזור היא דבוקה של eYFP קידוד אזור הנושאות מוטציה C-A במיקום נוקלאוטיד 120, וכתוצאה מכך עצירה translational מוקדמת codon TAA ולאחר סיום מוקדם של התרגום של החלבון פיוז'ן. 3′ הסימן פוליאדנילציה Nopaline סינתאז (3' nos) משמש כדי לסיים שעתוק של ה לבנות22. לוקליזציה גרעיני אות (שקל) משמש כדי למקד את החלבונים לתרגם את הגרעין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3: מגש מלא עם תודרנית שתילים לפני ואחרי טיפול אמוניום Glufosinate. שתילים לא מבטא את הגן בר אשר נמצא ה-pBIBAC-בר-GW T-DNA למות לאחר להיות ריסס עם Glufosinate-אמוניום פתרון. התמונות להראות את המגש זהה של שתילים (א) לפני התזת Glufosinate-אמוניום, 14 ימים לאחר הזריעה, ו- (B) 10 ימים לאחר מכן, לאחר להיות ריסס פעמיים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
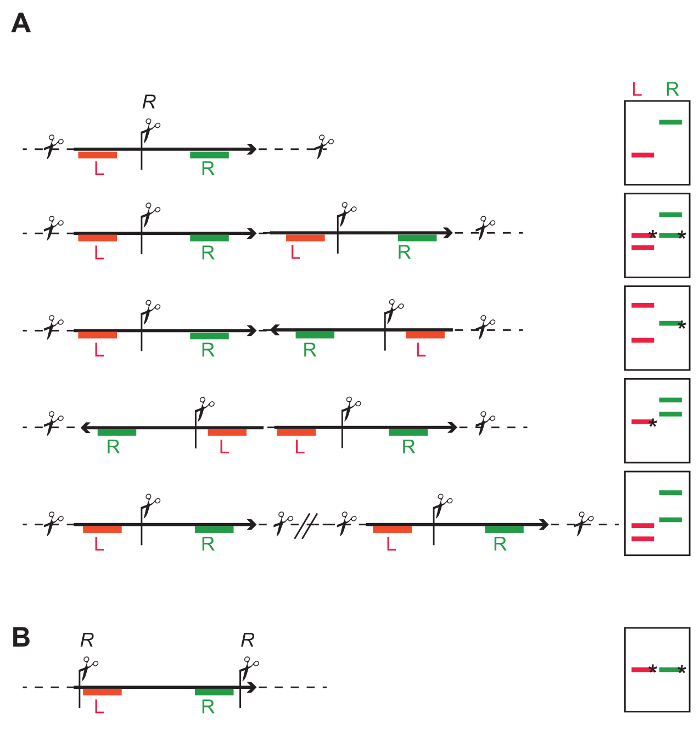
איור 4: דנ א כללי אסטרטגיה ההגבלה כדי לזהות את המספר ואת intactness של הוספת T-DNAs. אתר ההגבלה (א) אחד (R) באמצע T-DNA מאפשר בדיקה עצמאית של שמאל (L אדום), החלק הימני של T-DNA (R ירוק). הקריקטורות על הזכות מראים כי בהתאם יחיד - או מולטי - copy T-DNA שילובי, דפוסים סימון שונים מתקבלים עם ה-DNA סופג. להקות המסומנים * יש אורך מוגדר, בזמן האורך של להקות אחרות תלוי באתר הגבלת הקרוב ב- DNA גנומי איגוף. הוספה יחיד: L ו- R בדיקה שבר בשני לתת עצמאי אחד. גודל המקטע הממוצע הצפוי יכול להיות מחושב בהתבסס על התדר של אתר ההגבלה הגנום. גודל מינימלי הוא המרחק מאתר ההגבלה על הגבול השמאלי (ליברות) או הגבול הימני (RB), תלוי מאיזה צד של השילוב הוא להיות נחקר, אם T-DNA לא נפגע. טנדם חוזר: זונדי L ו- R אתן בשתי שני קטעים; עבור כל אחד מהשברים כולל איגוף דנ א גנומי הגישוש, השבר השני יש גודל הצפוי של והוא מזוהה על-ידי שני רגשים. Inverted repeat: בהתאם. הכיוון בקלטת משולב, או ל אחד, שני קטעים R, או שני L ו- R אחד יכול להיות מזוהה. בודדים הוספות יחיד: התוצאה היא מספר של קטעים עצמאית, מספר קטעים המתאים למספר של שילובים. (B) הגבלת האתרים על הגפיים ב- T-dna מאפשרים לקבוע את התקינות של השבר בין האתרים ההגבלה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
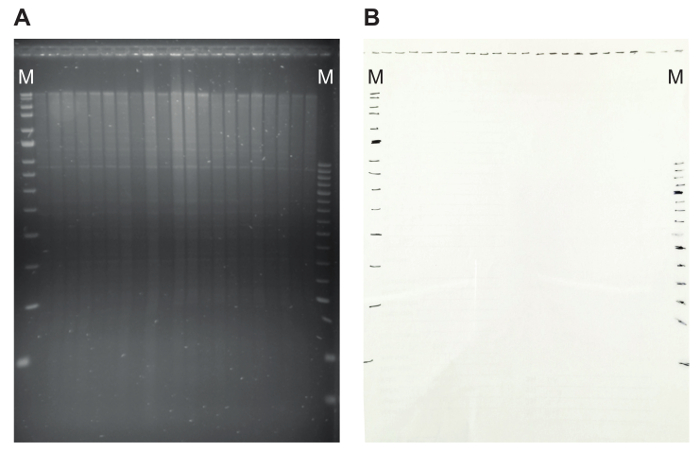
איור 5: ג'ל agarose עם הגבלת דפוס והשקיפות תואמות. (א) על הג'ל agarose, דנ א גנומי מתעכל עם EcoRאני מוצג. עיכול תקין של ה-DNA מודגם על ידי הנוכחות של להקות בלוויין דיסקרטית. (B) סימון המיקום של חריצי ולהקות סמן על שקיפות מאפשר ל מאוחר יותר בקלות לחשב את הגודל של hybridizing קטעים. כאן, סמני MRC הולנד (כחול ואדום) משמשים, שמסומן על ידי מ אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
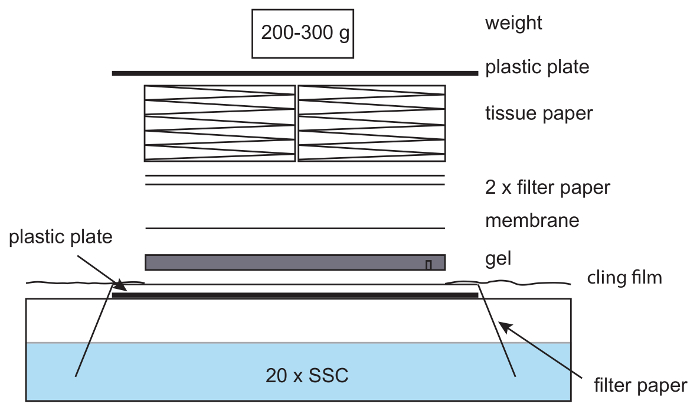
איור 6: ההתקנה עבור סופג נימי. בנימי סופג ההתקנה, נייר סינון מושם על צלחת פלסטיק עם קצוות הנייר מחזיק מאגר x SSC 20. הנייר הוא wetted עם 20 x SSC, ג'ל של agarose מונחת למעלה, ואחריו קרום ניילון, נייר סינון, ערימה של רקמות. קל משקל מושם על העליונה. טיפול נלקח כדי להסיר בועות אוויר בין ג'ל, נייר ממברנה. תיאחז הסרט משמש כדי למנוע ייבוש מתוך ההגדרה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
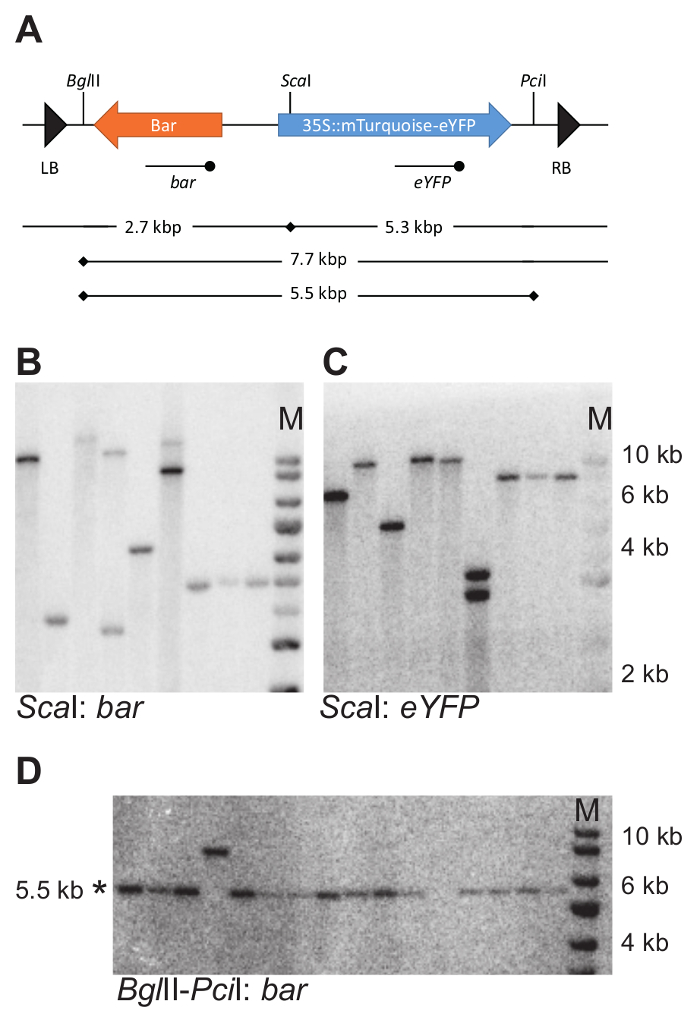
איור 7: דוגמה של DNA סופג אסטרטגיה והתוצאה ניסיוני. (א) DNA סופג אסטרטגיה כדי לקבוע את המספר ואת intactness של שילובי T-DNA. חיתוך מיקומים של אנזימים הגבלת הנבחר בתוך T-DNA מסומנים עם פסים אנכיים. הגששים eYFP , בר משמש הכלאה עם ה-DNA גנומי מתעכל מסומנים באמצעות קו עם הנקודה המרכזית להלן T-DNA. (B–D) DNA למשל אבנים בודדות. דנ א גנומי נחתך עם Sca, ואני את האבן החשופה נבדקה עם בדיקה גם בר וגם eYFP (B ו- C). הדנ א היה לחתוך עם אליפותII ו- Pci, ובחן גשש בר . שברים שלמים הם kbp 5.5 גודל (D). הערה ערכת דוגמיות ברה שונה לאלה המוצגים ב B ו- C * מציין את הגודל הצפוי שבר; מ', סמן. ב B, C ו- D משמש את הסמן באותו גודל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
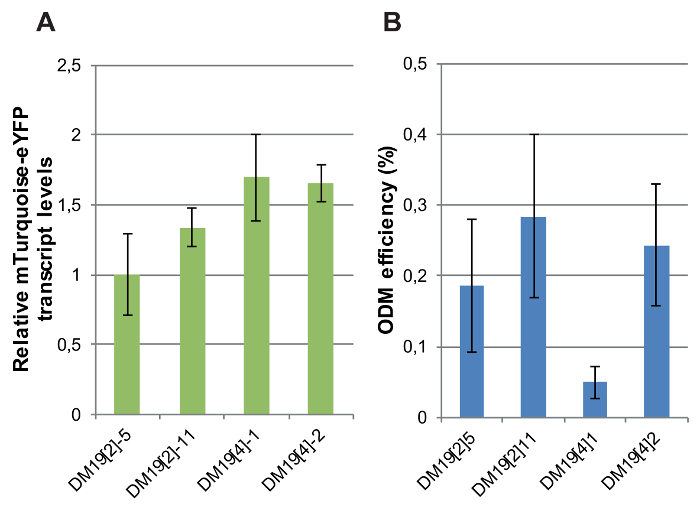
איור 8: רמות הביטוי mTurquoise-eYFP ו- ODM היעילות בקווים כתבת עצמאית mTurquoise-eYFP. (א) mTurquoise יחסית-eYFP התעתיק רמות נמדדת RT-qPCR בשורות כתב DM19. עבור נרמול שימשו התעתיק רמות של אקטין. יעילות (B) ODM נמדד קווי כתב DM19. עבור A ו- B, ברים מציינים את הממוצע של משכפל ביולוגית לפחות חמישה. קווי שגיאה מציינים ב- SEM אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| סוג של T-DNA לוקוס | ע נ של שילובי T-DNA | כתב שורה | מספר קטעים זוהה | שלמות | |||
| סרוק . אני | אליפות II | אליפות II/PciI | |||||
| בר | eYFP | בר | eYFP | eYFP | |||
| לוקוס בודד שילובים | 1 | 19 [2]-2 | 1 | 1 | 1 | 1 | + |
| 1 | 19 [2]-5 | 1 | 1 | 1 | 1 | + | |
| 1 | 19 [2]-9 | 1 | 1 | 1 | 1 | + | |
| 1 | 19 [2]-11 | 1 | 1 | 1 | 1 | + | |
| 1 | 19 [4]-1 | 1 | 1 | 1 | 1 | + | |
| 1 | 19 [4]-2 | 1 | 1 | 1 | 1 | + | |
| חוזר 2, הפוכה | 19 [2]-10 | 2 | 1 | 1 | 1 | + | |
| 2, שילוב לא שלם | 19 [2]-3 | 1 | 2 | 1 | 1 | ND | |
| שילובים לוקוס מרובים | 2 | 19 [2]-6 | 2 | 2 | 2 | ND | |
| 2 | 19 [2]-7 | 2 | 2 | 2 | 2 | ND | |
| 3/4 | 19 [2]-1 | 4 | 3 | 3 | 3 | ND | |
| דחיסות נייטרלית – לא נקבע. | |||||||
טבלה 1: סיכום של ה-DNA סופג נתונים עבור transgenics מבודדים לאחר שינוי עם pDM19.
Discussion
קריטי כדי לייצר transgenics עם שילובי יחיד, שלם של transgene הוא הבחירה של וקטור בינארי המשמש. וקטורים משפחה BIBAC שימשו להעביר רצפים של תחומי עניין רבים צמח מינים23,24,25,26,27,28. וקטורים BIBAC, BIBAC-ג'י, לרבות תשואות עותק יחיד שילובים עם יעילות גבוהה: המספר הממוצע של הוספות בכל שורה הוא 1.5-2, בהשוואה ל- 3 ומעלה עבור בינארי הנפוצות ביותר את המומנט5,9, 29. כמו שיפור משמעותי לעומת וקטורים אחרים BIBAC, עם הווקטורים BIBAC-ג'י, הרצפים של עניין ניתן בקלות להוסיף באמצעות שער רקומבינציה אתרי12. הווקטורים ששונה להתגבר על הבעיות הכללי של וקטורים BIBAC בעת שימוש באסטרטגיות שיבוט קונבנציונלי: i) מספר מוגבל מאוד של אתרים הגבלת ייחודי, ii) DNA נמוך תשואות. האתרים רקומבינציה שער להפוך וקטורים BIBAC-GW חלופה אטרקטיבית אחרת וקטורים בינארי ליצירת הצמחים הטרנסגניים.
כאן סדרה של פרוטוקולים, החל מיצירת BIBAC-GW נגזרים המכיל רצף של עניין, לשתול טרנספורמציה, ודנ א כתם ניתוח של מספר ואת intactness של הרצף הטרנסגניים מתואר. כמה מהפרוטוקולים דיווח בעיתון הזה, שער שיבוט, אלקטרופורציה של חיידקים, וטרנספורמציה צמח, מנהג נפוץ במעבדות רבות, יכול גם להתבצע עם שינויים קלים. חשוב לדעת כי BIBAC-ג'י הוא וקטור יחידה-עותק ב- e. coli וב - tumefaciens א. לכן, כאשר לבודד דנ א, התשואה היא נמוכה; מומלץ לשנות את קנה המידה ההליך בידוד.
ב- transgenics נושא מספר שילובים T-DNA, transgenes הציג נחשפים לעיתים קרובות על הגן להשתיק1,2,4,30, לכן עבור מרבית היישומים להימנע. כדי לזהות את הצמחים הטרנסגניים עם שילובי יחיד, ללא פגע, מומלץ להשתמש ניתוח חשופה הדנ א. תוך כדי שיטות לדנ סופג יכול לשמש לקביעת מספר העתקה T-DNA והתקינות של T-DNAs בקווים הטרנסגניים (סגרגציה ניתוח זנב-PCR, כמותיים PCR (qPCR), דיגיטלי droplet PCR), למרות העבודה אינטנסיבית, DNA סופג לעתים קרובות שיטת הבחירה. סגרגציה ניתוח אינו מסוגל להבחין בין מספר. ורווקה שילובים T-DNA-לוקוסים יחיד. זנב-PCR לעתים קרובות תחת הערכות העותק למספר, במיוחד אם אחד או יותר אינטגרציה T-DNA הוא נוכח31, qPCR צריך לפרט אופטימיזציה עבור תוצאות אמינות31,32. דיגיטלי droplet PCR היא שיטה מדויקת למדי לזיהוי מספר עותק אם הציוד הנדרש הוא זמין31. יתרון נוסף של ה-DNA סופג הוא נתיישב גילוי של קטום T-DNAs, אשר קל להחמיץ כל טכניקות מבוססות-PCR.
עם ניתוח הדנ א חשופה, שברי hybridizing על האבן החשופה צריך להיות טוב לזיהוי האות וגודל. מספר גורמים ידועים משפיעים על התוצאות של ה-DNA סופג. בנוסף מבחר מתאים של אנזימי הגבלה (אסטרטגיה המצוין איור 4), גודל סמני DNA מספקת איכות טובה דרוש. פחות מ-2 µg של גנומית תודרנית DNA לא תניב שברי טוב ניתן לזיהוי. בהתמודדות עם הגנום גדול יותר, ה-DNA יותר נדרש. כדי לקבל כמויות מספיקות של תודרנית דנ א, רקמות פרחוני או שתילים 1 - בן שבועיים יכול לשמש. אצווה בשתילים שגדלו על אחד פטרי מניב 2 – 8 µg של ה-DNA. כדי למנוע השפלה DNA במהלך בידוד, להקפיד כדי לעבד את החומר צמח מהר. יתר על כן, הדנ א צריך להיות resuspended, טריס-EDTA להפחית והשפלות שלו על-ידי nucleases, ומאוחסנים ב 4 ° C במקום-20 ° C כדי למנוע ה-DNA חותך בשל חזר מחזורי מפשיר לקפוא. אם לא בטוח כי כל דגימות די אן איי מתעכלים לחלוטין, הוא הציע כדי rehybridize את האבן החשופה DNA גשש זיהוי אזור גנומית אנדוגני, ייחודי. בעת בחירת רצפים בדיקה לזיהוי רצפי הטרנסגניים או אנדוגני, חשוב לבחור רק רצף ייחודי. כדי שניתן יהיה לקבוע בדיוק את גודלו של שברי hybridized, העמדות של ה-DNA ג'ל חריצים, להקות סמן הדנ א צריך להיות מסומן על שקיפות (איור 5B) כשמתכננים של ג'ל שהוכתמו אתידיום ברומיד (איור 5A) על אולטרה transilluminator. במקרה סמן רצפי לא hybridize עם החללית ה-DNA, או הכלאה חלקית, זה הדרך היחידה לאתר את הגודל של hybridizing קטעים.
לאחר טיפול נלקח כדי להשיג הכלאה טוב אות ו להעריך את גודל המקטע, הפרשנות של התוצאות blotting היא פשוטה. בעת שימוש באנזים הגבלה אחת בלבד ולאחר hybridizing עם שונים probes מזהה גם את החלק שמאלה או ימינה ב- T-dna, מספר קטעים שזוהו משקף את המספר של T-DNA הוספות. למשל, איור 7 ב, ג מציג את האבן החשופה DNA זהה, hybridized עם הגששים שונים, בר (איור 7 ב), משופרת צהוב חלבון פלואורסצנטי (eYFP) (איור 7C), באמצעות אסטרטגיה שמוצג באיור 7 א. כל הנתיבים, למעט 4, הצג את מספר שווה של קטעים על שני שהכלים: שני קטעים עבור קו 6 ושבר יחיד עבור כל שורות אחרות. מספר קטעים שזוהו הוא המספר של T-DNA הוספות.
כאשר מספר קטעים מזוהה עם הגששים מחייב גם השמאל או החלק הימני ב- T-dna שונה (למשל עבור איור 7 בג, שורה 4), הוספות לא שלם נוכחים או T-DNAs שהכנסת בסידור טנדם. הוספות טנדם להציג אורך קטע שאינן אקראיות מאחת השברים T-DNA (איור 4A, לוח נכון), יכול להיות מזוהה על-ידי השוואת גודל המקטע hybridized מה צפוי בהתבסס על האסטרטגיה ההגבלה. אסטרטגיית blotting נוספים עשוי להיות נחוץ כדי לאשר את סידור טנדם הוספות T-DNA. בדוגמת שמוצג על קו 4 (איור 7 ב, ג), שני הוספות מסודרים אוריינטציה חוזר הפוכה.
בעת הערכת את intactness של T-DNA או חלק ממנו, אורך המקטע hybridizing יכול להיות מחושב בהתבסס על האסטרטגיה ההגבלה. כל סטייה מן הגודל הצפוי מעיד על קיומם של ההכנסה לא שלם. למשל, ב- 7D איור, בנתיב 4, קטע hybridizing נודד-8 kbp, (במקום הצפוי kbp 5.5) המציינת את גודל של פרגמנט מוגברת עקב המחסור באחד האתרים ההגבלה.
BIBAC-GW וקטורים הן כלי מצויין ליצירת שילובים שלם עותק יחיד של מספר מיני צמחים. פרוטוקול דיווח כאן מספק הליך אמין לזהות צמחים עם שילובי יחיד, שלם של transgene עניין.
Disclosures
המחברים מצהירים אין מתחרים אינטרסים כלכליים או אחרים ניגודי עניינים.
Acknowledgements
מחקר זה נתמך על ידי ההולנדי בטכנולוגיית קרן STW (12385), אשר הוא חלק מהארגון הולנד על מחקר מדעי (בתחרות), אשר ממומן בחלקו על ידי משרד כלכלי פרשיות (OTP גרנט 12385 ל MS). אנו מודים קרול מ המילטון (אוניברסיטת קורנל, ארה ב) על מתן pCH20, עמוד השדרה של הווקטורים BIBAC-GW.
Materials
| Name | Company | Catalog Number | Comments |
| Kanamycin sulphate monohydrate | Duchefa | K0126 | |
| Gentamycin sulphate | Duchefa | G0124 | |
| Rifampicin | Duchefa | R0146 | |
| Tetracycline hydrochloride | Sigma | T-3383 | |
| DB3.1 competent cells | Thermo Scientific - Invitrogen | 11782-018 | One Shot ccdB Survival 2 T1R Competent Cells (A10460) by Invitrogen or any other ccdB resistant E. coli strain can be used instead |
| DH10B competent cells | Thermo Scientific - Invitrogen | 18290-015 | |
| Gateway LR clonase enzyme mix | Thermo Scientific - Invitrogen | 11791-019 | |
| tri-Sodium citrate dihydrate | Merck | 106432 | |
| Trizma base | Sigma-Aldrich | T1503 | |
| EDTA disodium dihydrate | Duchefa | E0511 | |
| Proteinase K | Thermo Scientific | EO0491 | |
| Bacto tryptone | BD | 211705 | |
| Yeast extract | BD | 212750 | |
| Sodium chloride | Honeywell Fluka | 13423 | |
| Potassium chloride | Merck | 104936 | |
| D(+)-Glucose monohydrate | Merck | 108346 | |
| Electroporation Cuvettes, 0.1 cm gap | Biorad | 1652089 | |
| Electroporator Gene Pulser | BioRad | ||
| Magnesium sulfate heptahydrate | Calbiochem | 442613 | |
| D(+)-Maltose monohydrate 90% | Acros Organics | 32991 | |
| Sucrose | Sigma-Aldrich | 84100 | |
| Silwet L-77 | Fisher Scientific | NC0138454 | |
| Murashige Skoog medium | Duchefa | M0221 | |
| Agar | BD | 214010 | |
| Glufosinate-ammonium (Basta) | Bayer | 79391781 | |
| Restriction enzymes | NEB | ||
| Ethidium Bromide | Bio-Rad | 1610433 | |
| Electrophoresis system | Bio-Rad | ||
| Sodium hydroxide | Merck | 106498 | |
| Hydrochloric acid | Merck | 100316 | |
| Blotting nylon membrane Hybond N+ | Sigma Aldrich | 15358 | or GE Healthcare Life Sciences (RPN203B) |
| Whatman 3MM Chr blotting paper | GE Healthcare Life Sciences | 3030-931 | |
| dNTP | Thermo Fisher | R0181 | |
| Acetylated BSA | Sigma-Aldrich | B2518 | |
| HEPES | Sigma-Aldrich | H4034 | |
| 2-Mercaptoethanol | Merck | 805740 | |
| Sephadex G-50 Coarse | GE Healthcare Life Sciences | 17004401 | or Sephadex G-50 Medium (17004301) |
| Dextran sulfate sodium salt | Sigma-Aldrich | D8906 | |
| Sodium Dodecyl Sulfate | US Biological | S5010 | |
| Salmon Sperm DNA | Sigma-Aldrich | D7656 | |
| Sodium dihydrogen phosphate monohydrate | Merck | 106346 | |
| Storage Phosphor screen and casette | GE Healthcare Life Sciences | 28-9564-74 | |
| Phosphor imager | GE Healthcare Life Sciences | Typhoon FLA 7000 | |
| UV Crosslinker | Stratagene | Stratalinker 1800 | |
| cling film (Saran wrap) | Omnilabo | 1090681 | |
| Agarose | Thermo Scientific - Invitrogen | 16500 | |
| Boric acid | Merck | 100165 | |
| DNA marker ‘Blauw’; DNA ladder. | MRC Holland | MCT8070 | |
| DNA marker ‘Rood’; DNA ladder | MRC Holland | MCT8080 | |
| Hexanucleotide Mix | Roche | 11277081001 | |
| Large-Construct Kit | Qiagen | 12462 | |
| Heat-sealable polyethylene tubing, clear | various providers | the width of the tubing should be wider than that of blotting membrane | |
| Heat sealer | |||
| Membrane filter disk | Merck | VSWP02500 | |
| Magnesium chloride | Merck | 105833 | |
| Hybridization mesh | GE Healthcare Life Sciences | RPN2519 |
References
- Jorgensen, R. A., Cluster, P. D., English, J., Que, Q., Napoli, C. A. Chalcone synthase cosuppression phenotypes in petunia flowers: comparison of sense vs. antisense constructs and single-copy vs. complex T-DNA sequences. Plant Mol Biol. 31 (5), 957-973 (1996).
- Stam, M., et al. Post-transcriptional silencing of chalcone synthase in Petunia by inverted transgene repeats. Plant J. 12, 63-82 (1997).
- Stam, M., Viterbo, A., Mol, J. N., Kooter, J. M. Position-dependent methylation and transcriptional silencing of transgenes in inverted T-DNA repeats: implications for posttranscriptional silencing of homologous host genes in plants. Mol Cell Biol. 18 (11), 6165-6177 (1998).
- Jin, Y., Guo, H. S. Transgene-induced gene silencing in plants. Methods Mol Biol. 1287, 105-117 (2015).
- Oltmanns, H., et al. Generation of Backbone-Free, Low Transgene Copy Plants by Launching T-DNA from the Agrobacterium Chromosome 1[W][OA]. Plant Physiol. , (2010).
- Ye, X., et al. Enhanced production of single copy backbone-free transgenic plants in multiple crop species using binary vectors with a pRi replication origin in Agrobacterium tumefaciens. Transgenic Res. , (2011).
- Hamilton, C. M. A binary-BAC system for plant transformation with high-molecular-weight DNA. Gene. 200 (1-2), 107-116 (1997).
- Frary, A., Hamilton, C. M. Efficiency and stability of high molecular weight DNA transformation: an analysis in tomato. Transgenic Res. 10 (2), 121-132 (2001).
- Vega, J. M., et al. Agrobacterium-mediated transformation of maize (Zea mays) with Cre-lox site specific recombination cassettes in BIBAC vectors. Plant Mol Biol. 66 (6), 587-598 (2008).
- Anggoro, D. T., Tark-Dame, M., Walmsley, A., Oka, R., de Sain, M., Stam, M. BIBAC-GW-based vectors for generating reporter lines for site-specific genome editing in planta. Plasmid. 89, 27-36 (2017).
- Hamilton, C. M., Frary, A., Lewis, C., Tanksley, S. D. Stable transfer of intact high molecular weight DNA into plant chromosomes. Proc Natl Acad Sci U S A. 93 (18), 9975-9979 (1996).
- Belele, C. L., Sidorenko, L., Stam, M., Bader, R., Arteaga-Vazquez, M. A., Chandler, V. L. Specific tandem repeats are sufficient for paramutation-induced trans-generational silencing. PLoS Genet. 9 (10), e1003773 (2013).
- Shizuya, H., et al. Cloning and stable maintenance of 300-kilobase-pair fragments of human DNA in Escherichia coli using an F-factor-based vector. Proc Natl Acad Sci U S A. 89 (18), 8794-8797 (1992).
- Shi, X., Zeng, H., Xue, Y., Luo, M. A pair of new BAC and BIBAC vectors that facilitate BAC/BIBAC library construction and intact large genomic DNA insert exchange. Plant Methods. 7, 33 (2011).
- Woodman, M. E., et al. Direct PCR of Intact Bacteria (Colony PCR). Curr Protoc Microbiol. , A.3D.1-A.3D.7 (2016).
- Ausubel, F. M., et al. Mol Biol. Current Protocols in Molecular Biology. 1, (2003).
- Edwards, K., Johnstone, C., Thompson, C. A simple and rapid method for the preparation of plant genomic DNA for PCR analysis. Nucleic Acids Res. 19 (6), 1349 (1991).
- Clarke, J. D. Cetyltrimethyl ammonium bromide (CTAB) DNA miniprep for plant DNA isolation. Cold Spring Harb Protoc. (3), (2009).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose Gel Electrophoresis for the Separation of DNA Fragments. J Vis Exp. (62), e3923 (2012).
- Green, M. R., Sambrook, J. . Molecular Cloning. , (2012).
- Sosa, J. M. Chromatography with Sephadex Gels. Anal Chem. 52 (6), 910-912 (1980).
- Depicker, A., Stachel, S., Dhaese, P., Zambryski, P., Goodman, H. M. Nopaline synthase: transcript mapping and DNA sequence. J Mol Appl Genet. 1 (6), 561-573 (1982).
- Feng, J., Vick, B. A., Lee, M. K., Zhang, H. B., Jan, C. C. Construction of BAC and BIBAC libraries from sunflower and identification of linkage group-specific clones by overgo hybridization. Theor Appl Genet. 113 (1), 23-32 (2006).
- Lee, M. K., et al. Construction of a plant-transformation-competent BIBAC library and genome sequence analysis of polyploid Upland cotton (Gossypium hirsutum L). BMC Genomics. 14, 208 (2013).
- Wang, W., et al. A large insert Thellungiella halophila BIBAC library for genomics and identification of stress tolerance genes. Plant Mol Biol. 72 (1-2), 91-99 (2010).
- Wu, C., et al. A BAC- and BIBAC-based physical map of the soybean genome. Genome Res. 14 (2), 319-326 (2004).
- Xu, Z., et al. Genome physical mapping from large-insert clones by fingerprint analysis with capillary electrophoresis: a robust physical map of Penicillium chrysogenum. Nucleic Acids Res. 33 (5), e50 (2005).
- Zhang, M., et al. Genome physical mapping of polyploids: a BIBAC physical map of cultivated tetraploid cotton, Gossypium hirsutum L. PLoS One. 7 (3), e33644 (2012).
- Frary, A., Hamilton, C. M. Efficiency and stability of high molecular weight DNA transformation: An analysis in tomato. Transgenic Res. , (2001).
- Stam, M., Viterbo, A., Mol, J. N. M., Kooter, J. M. Position-Dependent Methylation and Transcriptional Silencing of Transgenes in Inverted T-DNA Repeats: Implications for Posttranscriptional Silencing of Homologous Host Genes in Plants. Cell Biol. 18 (11), 6165-6177 (1998).
- Głowacka, K., Kromdijk, J., Leonelli, L., Niyogi, K. K., Clemente, T. E., Long, S. P. An evaluation of new and established methods to determine T-DNA copy number and homozygosity in transgenic plants. Plant Cell Environ. 39 (4), 908-917 (2016).
- Stefano, B., Patrizia, B., Matteo, C., Massimo, G. Inverse PCR and Quantitative PCR as Alternative Methods to Southern Blotting Analysis to Assess Transgene Copy Number and Characterize the Integration Site in Transgenic Woody Plants. Biochem Genet. 54 (3), 291-305 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved