Method Article
מעמיק פיסיולוגי ניתוח של אוכלוסיות תאים מוגדרות ב אקוטי רקמות פרוסות של איברי עכבר vomeronasal
In This Article
Summary
Here, we describe a physiological approach that allows identification and in-depth analysis of a defined population of sensory neurons in acute coronal tissue slices of the mouse vomeronasal organ using whole-cell patch-clamp recordings.
Abstract
In most mammals, the vomeronasal organ (VNO) is a chemosensory structure that detects both hetero- and conspecific social cues. Vomeronasal sensory neurons (VSNs) express a specific type of G protein-coupled receptor (GPCR) from at least three different chemoreceptor gene families allowing sensitive and specific detection of chemosensory cues. These families comprise the V1r and V2r gene families as well as the formyl peptide receptor (FPR)-related sequence (Fpr-rs) family of putative chemoreceptor genes. In order to understand the physiology of vomeronasal receptor-ligand interactions and downstream signaling, it is essential to identify the biophysical properties inherent to each specific class of VSNs.
The physiological approach described here allows identification and in-depth analysis of a defined population of sensory neurons using a transgenic mouse line (Fpr-rs3-i-Venus). The use of this protocol, however, is not restricted to this specific line and thus can easily be extended to other genetically modified lines or wild type animals.
Introduction
רוב בעלי החיים להסתמך בכבדות על החושים הכימיים שלהם לתקשר עם סביבתם. חוש הריח ממלא תפקיד חיוני למציאת והערכת מזון, הימנעות טורפים ואיתור שותפים ההזדווגות מתאים. ברוב היונקים, מערכת חוש הריח מורכב מלפחות ארבעה תת היקפי אנטומית והן מבחינה תפקודית ברורים: אפיתל ההרחה הראשי 1,2, גנגליון Grueneberg 3,4, האיבר במחיצה של Masera 5,6 ואת איבר יעקובסון. VNO כוללת המבנה החושי ההיקפי של מערכת חוש ריח האבזר (AOS), אשר ממלאת תפקיד מרכזי באיתור לאותות כימיים המעבירים מידע על זהות, מגדר, מעמד חברתי ומדינה מינית 7-10. VNO ממוקם בבסיס של מחיצת האף ממש מעל החיך. בעכברים, זה הוא צינור דו צדדי שהסתיים סמיות מגודר בתוך הקפסולה סחוסי 11-13. האורגן מורכב הן של epithe חושית המדיאלי בצורת חצי סהרlium כי מטפח את VSNs ושל חלק הלא-חושי בצד לרוחב. בין שניהם epithelia טמון לומן מלא ריר אשר מחובר אל חלל האף דרך הצינור הצר vomeronasal 14. כלי דם לרוחב גדולים בתוך הרקמה הלא-החושית מספקים מנגנון שאיבת כלי דם כדי להקל על כניסה של גדולות יחסית, בעיקר מולקולות בלתי נדיף כגון פפטידים או חלבונים קטנים לתוך לומן VNO באמצעות לחץ שלילי 15,16. הרכיבים המבניים של VNO נוכחים בלידה והאיבר מגיע לגודלו זמן קצר לפני גיל ההתבגרות 17. עם זאת, אם AOS מכרסם כבר תפקודי קטינים עדיין נושא לויכוח 18-20.
VSNs מאופיין הוא מיקומם אפיתל את סוג הקולט שהם מבטאים. VSNs להראות מורפולוגיה דו קוטבית עם אקסון מחוסר מיאלין לבין דנדריט פסגה יחיד שבולט כלפי הלום ומסתיים ידית הדנדריטים microvillous. גרזן VSNons fasciculate ליצור את עצב vomeronasal שמשאיר הקפסולה סחוסי בסוף dorso-הזנב, עולה לאורך מחצה, מעביר את הצלחת cribriform ופרויקטים הנורה חוש הריח אביזר (AOB) 21,22. האפיתל חושית vomeronasal מורכב משתי שכבות: השכבה הפסגה ממוקם קרוב יותר אל הצד luminal ונמלים הן V1R- וכל אבל סוג אחד של FPR-rs-להביע עצב. נוירונים אלה coexpress G-חלבון α-למקטע G αi2 ופרויקט לחלק הקדמי של AOB 23-25. עצב סנסורי ממוקם V2Rs המפורש שכבת בסיס יותר או FPR-rs1 לצד αo G ולשלוח האקסונים שלהם לאזור האחורי של AOB 26-28.
נוירונים vomeronasal מופעלים ככל הנראה על ידי semiochemicals קטן למדי 29-33 (V1Rs) או תרכובות חלבוניים 34-38 (V2Rs) כי מופרשים לתוך נוזלים שונים בגוף כגון שתן, רוק ולקרוע נוזל 37,39-41 . בניסויים באתרו הראו כי VSNs גם מופעלים על ידי פפטידים formylated שונים תרכובות מיקרוביאלית / צמודי דלקת 25,42. יתר על כן, heterologously הביע חלבונים-rs FPR לשתף ספקטרום אגוניסט עם FPRs לידי ביטוי את המערכת החיסונית, מה שמעיד על תפקיד פוטנציאלי גלאי עבור מחל conspecifics או מקורות מזון מקולקלים 25 (ראה אסמכתא 43).
יסוד להבנת יחסים ליגנד רצפטור ומפלה איתות במורד באוכלוסיות ספציפיות VSN הוא הערכה מפורטת של מאפייני biophysical הבסיסיים שלהם בסביבת ילידים. בעבר, ניתוח של איתות הסלולר יש יתרון מאוד מבעלי חיים מהונדסים גנטית המציינים אוכלוסיה מוגדרת של נוירונים ידי coexpressing חלבון בסמן פלורסנטי 30,44-49. בפרוטוקול זה, קו עכבר מהונדס המבטא FPR-RS3 יחד עם סמן פלואורסצנטי (FPR-RS3-i-ונוס) משמש.גישה זו מדגימה איך להעסיק כזה זן עכבר מהונדס גנטי כדי לבצע ניתוח אלקטרו של אוכלוסיית תאים לזיהוי אופטי באמצעות הקלטות תיקון- clamp נוירון הבודד בחתכי רקמת VNO עטרה חריפים. לחץ מונחה אוויר מערכת זלוף רב-קניים עבור גירויים חושיים וסוכנים תרופתיים מאפשר מהיר, הפיך מוקדי גירוי עצבי או עיכוב במהלך הקלטות. הקלטות כל תא בהכנות פרוסות לאפשר ניתוח מפורט של תכונות מהותיות, conductances מופעל במתח, כמו גם דפוסי פריקת פוטנציאל פעולה בסביבה המקורית של התא.
Protocol
נהלי כל החיה היו בהתאם לחקיקה מקומית ואיחוד האירופי על ההגנה על בעלי חיים המשמשים למטרות ניסוי (Directive 86/609 / EEC) ועם המלצות שהועלו על ידי הפדרציה של אגודות מדע בעלי חי מעבדה אירופאיות (FELASA). שניהם C57BL / 6 עכברים ועכברים FPR-RS3-i-ונוס שוכנו בקבוצות של שני המינים בטמפרטורת החדר על מחזור אור 12 שעות / כהה עם מזון כרצונך מים זמין. בניסויים צעירים (6-20 שבועות) של שני מינים היו בשימוש. אין הבדלים ברורים תלויה מגדרים נצפו.
1. פתרון כנה
- כן S 1 פתרון תאי: 4- (2-הידרוקסי-אתיל) piperazine-1-ethanesulfonic חומצה (HEPES) שנאגר פתרון תאי המכיל (מ"מ) 145 NaCl, KCl 5, 1 2 CaCl, 1 2 MgCl, 10 HEPES; pH = 7.3 (מנוכה עם NaOH); osmolarity = 300 mOsm (מנוכה עם גלוקוז).
- כן extracelluS 2 פתרון Lar: carbogen-מחומצן (95% O 2, 5% CO 2) פתרון תאיים המכילים (מ"מ) 125 NaCl, 25 NaHCO 3, 5 KCl, 1 2 CaCl, 1 MgSO 4, 5 BES; pH = 7.3; osmolarity = 300 mOsm (מנוכה עם גלוקוז).
- הכן 4% פתרון agarose טמפרטורה נמוכה gelling (S 3) להטבעת רקמות: 4% agarose טמפרטורה נמוכה gelling. ממיסים 2 גרם נמוכה gelling agarose ב 50 מ"ל של S 1 בבקבוק מעבדה זכוכית 100 מ"ל יחד עם בוחש מגנטי. כדי להמס את agarose, הנחת את הבקבוק בתוך אמבט מים (עם מכסה לא סגור היטב) על 70 מעלות צלזיוס למשך כ 20 דקות או עד הפתרון הופך שקוף תוך ערבוב. להתקרר ולשמור agarose מומסת באמבט מים שני ב 42 מעלות צלזיוס עד לשימוש נוסף.
- כן S 4 פתרון התאי: פתרון פיפטה המכיל (מ"מ) 143 KCl, 2 KOH, 1 EGTA, 0.3 CaCl 2 (Ca חינם 2 + = 110 ננומטר), 10 HEPES, 2 MgATP, 1 NaGTP;pH = 7.1 (מנוכה עם KOH); osmolarity = 290 mOsm.
- לשנות / להתאים רכב S 1, S 2 ו- S 4 פי תכנון ניסוי בודד (למשל, חוסמים תרופתיים לבודד סוגים מסוימים של זרמים מופעלי מתח).
2. סביבת עבודה כנה
- מלאו מחמצני תא אחסון פרוס עם S 2 לפחות 30 דקות לפני לנתיחה, במקום על קרח למשך התאמת טמפרטורה ו- pH פתרון oxygenate ברציפות.
- מלאו מאגר עבור הפרוסה superfusion על הקלטת התקנה עם S 2 ו חמצן ברציפות.
- לפני לנתיחה, למלא vibratome קאמרית עם S 2 ולסדר קרח כתוש סביב החדר. לחלופין, להעביר פתרון מחומצן חילוף קרח קר מחמצנים קאמריים לתוך vibratome קאמרית ולשמור מחמצנים ברציפות.
- מסדרים כלים מתכלים כירורגיים.
- מניחים חבילת ג'ל קרח מתחת לנתחמיקרוסקופ, מכסים במגבת נייר כדי למנוע רקמות VNO מן המקפיא אל החלק התחתון של המנה.
- סכין גילוח נקי על ידי שטיפה קצרה באתנול 70% ומים מזוקקים הר כדי vibratome. חלף עבור כל פגישת חיתוך.
3. VNO Dissection והטבעה
- להקריב בעלי חיים על ידי חשיפה קצרה ל- CO 2 לערוף באמצעות מספרי כירורגיות חדים. הערה: ככל שזמן להקריב את החיה לשים את הקפסולה VNO על קרח הוא קריטי, למזער את הזמן פחות מ -2 דקות. כדי לשמור על כדאיות רקמות, להטביע הן VNOs מלא גזור agarose תוך פחות מ -30 דקות.
- הסר את הלסת התחתונה עם מספרי כירורגיות גדולים. זן דרך חלל הפה ופצע את העצמות ושרירי לסת התחתונות של כל צד בנפרד.
- מניח את החלק הנותר של הראש הפוך על צלחת פטרי הגדולה.
- משוך כלפי חוץ את העור של הלסת העליונה וסביב קצה האף עם מלקחיים בינוניים כדי לקבל גישה טובה יותרחותכות.
- השתמש במספרי עצם לחתוך את החלק הגדול ביותר של החותכות בזווית ~ 45 ° בכיוון המקורי (איור 1 א). זה יקל הסרת הקפסולה VNO מחלל האף.
הערה: אין לחתוך את שורש השן כדי למנוע נזק קצה הקפסולה VNO. - תפוס את החיך העליון הנוקשה חלק המקורי שלה עם מלקחיים בינוניים ובזהירות לקלף בחזרה בחתיכה אחת בזווית שטוחה (איור 1 ב).
הערה: שוב ושוב לשטוף עם S קר כקרח 2. - השתמש במספריים באביב מיקרו לחתוך את היתוך הגרמי בין קצה העצם vomer והלסת. הכנס את הטיפים מספריים עם החלק המעוגל של קצה מצביע כלפי חוץ מן VNO בזהירות לחתוך את העצם בצעדים קטנים משני שמאל לרוחב בצד ימין הקפסולה VNO.
- כדי להסיר את הקפסולה VNO, להשתמש במספריים באביב מיקרו לחתוך את העצם vomer בחלק הזנב ובזהירות להרים את עצם vomer מתוך nASAL חלל באמצעות מלקחיים בינוניים. מיד להעביר את VNO אל צלחת פטרי קטנה תחת מיקרוסקופ סטריאו על חבילת ג'ל הקרח שבו השלבים הנותרים של הניתוח יבוצע.
- שוטפים את VNO כמות קטנה של קר כקרח S 2 כדי למנוע את רקמות מהתייבשות.
- הפרד את כמוסות סחוסים המכילות רקמות הרכות VNO ידי גרירה האחורית של עצם vomer עם מלקחיים בינוניים. מקם את הקפסולה עבור תצוגה הגבי כך פיצול בין שני VNOs הופך לגלוי (איור 1D i).
- השתמש בקצה מלקחיים בסדר להפריד הסחוס הוא כמוסות VNO מהעצם המרכזית, תוך שמירה על עצם vomer מרותק בחלק האחורי.
הערה: שימוש במלקחיים רק בשולי הקפסולה הסחוס להיזהר מאוד שלא לחדור מבעד הסחוס כמו האפיתל החישה העדין נפגע בקלות. - לאחר שני VNOs מופרדים, להתחיל להסיר את הסחוס encapsulating האשוחיםt VNO.
- תפוס את השולים העליונים של קפסולה עם אחד מלקחיים בסדר התפצל קיר הסחוס שצורף בעבר עד עצם vomer (בצד המדיאלי).
- כדי להסיר הנותרים סחוס להפוך את VNO עם צד לרוחב המעוגל שלה לתחתית המנה ובבטחה להצמיד הסחוס בצד אחד באמצעות מלקחיים. בזהירות להזיז את מלקחיים בסדר השני מהצד האחורי בזווית מאוד שטוח בין סחוס VNO לרופף את הקשר בין רקמות הסחוס.
- לאט לקלף את VNO מן הסחוס על ידי מחזיק אותו קצה הזנב שלה, כדי למנוע ניזק האפיתל החושי.
- לאחר VNO היא דחסה הקפסולה, הקפד להסיר את כל חלקי הסחוס הקטנים הנותרים כמו כל חלקים נותרים של סחוס תנתק את הרקמה שמסביב agarose במהלך תהליך החיתוך.
- המקום טיפה קטנה של קר כקרח S 2 על VNO גזור הראשון כדי למנוע נזק לרקמות. כלי דם גדולים על wil צד לרוחבl להיות גלוי המציין כי האיבר עדיין לא נפגע ולא נפגע גס במהלך הניתוח (איור 2 א ii). במקרה כלי דם ניזוק, הוא עדיין יהיה כדאי להמשיך עם חותך את VNO עוד המורפולוגיה הכוללת לא נפגמה בבירור.
- מיד לנתח את VNO השני.
- כדי להטביע את VNOs, למלא שתי צלחות פטרי הקטנות אל שולי עם מומסת S 3 (מאוחסן באמבט מים ב 42 ° C; ראה 1.3).
- החזק את VNO על קצה זנב הרחב עם מלקחיים בסדר, כדי למנוע פגיעת האפיתל החושית.
- לטבול את VNO ב agarose והעבר אותו אופקי הלוך ושוב כמה פעמים כדי להסיר את הסרט של פתרון תאי וכן כל בועות אוויר מפני השטח שלו.
- מקם את VNO אנכית עם קצה הזנב מול התחתון של המנה. במקום צובט את VNO עם המלקחיים ישירות, לשנות את הכיוון על ידי הזזת קצה מלקחי proximi הקרובty אל VNO.
הערה: האורינטציה במהלך ההטבעה היא קריטית שכן היא קובעת מטוס פרוס ונגישות עצב סנסורי במהלך הניסוי. - מניחים מנות על חבילת ג'ל הקרח ולהמתין עד agarose יש הקרושה.
הערה: אין לשנות את הנטייה VNO לאחר agarose החלה לחיזוק כמו זה יהיה לנתק את הרקמה מן agarose שמסביב.
4. רקמות VNO עטרה פרוסה
- השתמש מרית קטנה כדי להסיר גוש agarose מצלחת קטנה לתוך המכסה של צלחת פטרי גדולה, להעיף את agarose במהופך השארת טיפ הזנב של VNO כלפי מעלה.
- חותך את הגוש לתוך צורת פירמידה באמצעות אזמל כירורגי (3-4 מ"מ בקצה, 8-10 מ"מ בתחתית). יש להיזהר שלא לגרום נזק לרקמות מוטבע.
- להשתמש בדבק סופר לתקן את בלוק בצורת פירמידה למרכז הצלחת הדגימה vibratome ולחכות ~ 1 דק 'על הדבק להתייבש לחלוטין.
- מעביר את צלחת דגימת ג החיתוךhamber ולהכין את VNO השני, בהתאם. שמור צלחת עם הדגימה השנייה ב 4 ° C עד השימוש.
- השתמש microtome להב רוטט עם ההגדרות הבאות: עובי: 150-200 מיקרומטר; מהירות: 3.5 au = 0.15 מ"מ / sec; תדירות: 7.5 au = 75 הרץ. עבר פרוסות לתא מחמצנים עד לשימוש לאחר שבדק פרוסת מורפולוגיה לזמן קצר תחת מיקרוסקופ לנתח. פרוסות יכולות להישמר במשך כמה שעות.
5. הקלטות אלקטרו מתא בודד
- עבור הקלטות, משתמש במיקרוסקופ קבועה בשלב זקוף מצוידות מטרות טבילה במים, Dodt או בניגוד הפריע הפרש אינפרא אדום (IR-DIC), ואת קרינת EPI וכן CCD-מצלמה מקוררת. עבור רכישת נתונים, השתמש מגבר תיקון- clamp, לשלב את הראש, AD / לוח הממשק DA לבין מחשב (כולל תוכנת צריבה).
- הכינו מלאי של 10-20 טפטפות תיקון (4-7 MΩ). טפטפות משוך מן נימי זכוכית בורוסיליקט (1.50 מ"מ OD / 0.86 מזהה מ"מ) usinחולץ micropipette ga ו-פולנית אש עם microforge.
הערה: אש ליטוש הטיפים פיפטה הוא חיוני כאשר תיקום VSNs קטן למדי. זה יעזור למנוע פקיעת קרום התא בעת הפעלת לחץ שלילי על מנת לקבל חותמת עמידות גבוהה. לאחר ליטוש פתיחת פיפטה צריך להיות כ 1 מיקרומטר. - שמור טפטפות בצנצנת אחסון פיפטה כדי למנוע נזק הצטברות אבק עד השימוש.
- כן מערכת זלוף ידי מילוי מאגרי פתרון צינורות פי תכנון ניסוי.
הערה: הסר בועות אוויר וצינורית לחלוטין כפי שהם יפריעו הקלטות אלקטרו בחום. - התאם הלחץ להשיג ~ 3 מ"ל / זרימת דקות.
הערה: בלחצים גבוהים יגרמו לתנועה של פרוסת רקמות וכן סיום הקלטות אלקטרו. - עבר VNO פרוסה תא הדמיה ולתקן את העמדה פרוסה באמצעות עוגן נירוסטה חוטית עם 0.1 מ"מ עובי syntסיבי hetic (התרשים 2B - C).
הערה: אין לכסות את פרוסת רקמה עם אחד הנושאים סיבים סינתטיים אלא agarose סביב פרוסה. - העברה לחדר ההדמיה כדי הקלטה להתקנה פרוסה Superfuse ברציפות עם S מחומצן 2 בטמפרטורת החדר באמצעות יישום אמבטיה.
- התאם את נימי היניקה אל פני השטח של הפתרון ליצור יניקה איטית חליפין קבועים של פתרון אמבטיה. התאם את "עיפרון זלוף" 8-in-1 רב חבית מעל וקרוב החלק הלא-חושית של הפרוסה VNO המכיל את כלי הדם (איור 2 ג, 3 א) 50. זה יהיה מועיל לארגן עיפרון זלוף פיפטה ההקלטה להיות מול הפרוסה מכיוונים מנוגדים.
- חבר אלקטרודה השוואתית ופתרון אמבטיה באמצעות גשר אגר בצורת L (מלא 150 KCl מ"מ).
- מלאו פיפטה תיקון עם פיפטה פתרון S 4.
- הר פיפטה על האלקטרודה תיקון כסף מצופה כלוריד מחוברת אל במת הראש ללא מקרצף את הציפוי ולצרף בתקיפות.
- החל לחץ חיובי קלה (כ 1 מ"ל על מזרק פלסטיק 10 מ"ל) ל פיפטה את התיקון לפני הכניסה לאמבטיה.
- מנמיכים את פיפטה לתוך האמבט באמצעות מניפולטורים מיקרו רחוק מספיק כדי להיות מסוגל להטביע את המטרה מבלי להכות אותו (2D איור).
- צג התנגדות פיפטה (PIP R, בין 4-7 MΩ) באמצעות תוכנת אלקטרופיזיולוגיה מחובר לשלב את הראש.
הערה: אם R פיפ <4 MΩ קצה זכוכית שבורה. אם R פיפ> 10 MΩ, קצה יש סתימה ככל הנראה ואת פיפטה חייב להיות מוחלף. - דמיינו את פרוסת VNO עם המצלמה CCD באמצעות התערבות ההפרש לעומת אינפרא אדום אופטימיזציה (DIC) ולזהות תאים FPR-RS3-i-ונוס לבטא (או נוירונים שכותרתו דומה) באמצעות תאורה פלואורסצנטיו קוביית מסנן מתאימה.
- פוקוס פלורסנט היעד או תאים שאינם פלורסנט בהתאם לעיצוב ניסיוני.
- כדי להתקרב גוף התא, השתמש גלגלי יד רגישות מקסימלית. בשל לחץ חיובי, שקע קטן בקרום סומה תא הופך לגלוי פעם קצה פיפטה נמצא בסמיכות.
- שחרר לחץ חיובי להפעיל לחץ שלילי קל למצוץ בקרום התא על מנת להשיג חותם עמידות גבוהה (1-20 GΩ). החל יניקה קצרה ועדינה לשבש את קרום התא ולבסס את תצורת כל התא.
- צג התנגדות גישה ללא הרף במהלך הניסוי.
הערה: רק כולל נוירונים מפגינים התנגדות גישה קטנה ויציבה (≤3% של מכניסה; שינוי <20% במהלך הניסוי) לתוך ניתוח.
תוצאות
כדי לקבל תובנות לגבי מאפייני biophysical ופיזיולוגיים של אוכלוסיות תאים מוגדר, אנו מבצעים בחתכי רקמה העטרה חריפה של העכבר VNO (איור 1 - 2). לאחר דיסקציה, פרוסות יכולות להישמר פתרון תאי מחומצן קר כקרח (S 2) במשך כמה שעות. בשעה הגדרת הקלטה, חילופי מתמיד עם פתרון מחומצן טרי (איור 2 ד) מבטיח הכדאיות רקמות לאורך הניסוי. אנחנו כאן להעסיק מודל עכבר מהונדס (FPR-RS3-i-ונוס). VSNs ב coexpress זן זה חלבון סמן פלואורסצנטי עם-RS3 FPR, חבר אבטיפוס של הגנים ממשפחת FPR-RS (איור 3) מה שמאפשר זיהוי אופטי של אוכלוסיה מוגדרת של עצב סנסורי. קלטות אלקטרו לספק את אמצעי ניתוח מעמיק ברמה-התא הבודד. למשל, ניתוח של זרמי מתח מגודר מתבצע מהדק המתח מצב (איור 4 א - ב). כדי לבודד סוגים ספציפיים של זרמים יוניים, פרוסות superfused עם סוכנים תרופתיים כגון TTX לעכב זרמי מתח מגודר Na + (איור 4 א) או nifedipine לחסום מתח מגודר L- סוג Ca 2 + זרמים (איור 4B). יתר על כן, אנו שגרתי לבצע הקלטות כל תא בתצורת המהדק הנוכחית לנתח דפוסי פריקת פוטנציאל פעולה (איור 4C). בנוסף להקלטות כל תא, מצורף תא ההקלטות 'משוחרר חותם' לספק שיטה פולשנית פחות שמונעת דיאליזה של רכיבים תאיים (איור 5 א). פעולת הקלטה מונחה פוטנציאל זרמי קיבולים על יישום גירוי קצר מציע דרך רגישה ויעילה למסך הליגנדים חושי (למשל, חלבוני שתן גדולים; MUPs) מפעילים מוגדרים אוכלוסיות של תאים 51 (איור 5 ב).
= "Jove_content" FO: keep-together.within-page = "1"> 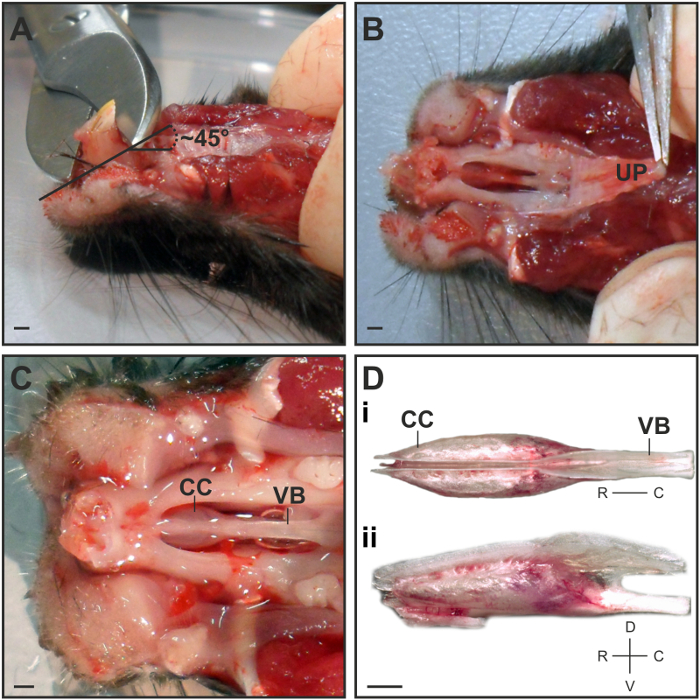
איור 1: Dissection של VNO. (א) להציג צד על ראש העכבר כדי להמחיש את המיקום ואת הזווית שבה החותכות נחתכות. (ב) לאור גחון המתארת את הנקודה הטובה ביותר לתפוס לקלף בחיך העליון (UP). (ג) צפה הגחון על הקפסולה סחוס (CC) כי מטפח את VNO ואת עצם vomer (VB) לאחר הסרת הלסת התחתונה, החותכות וטעמים. (ד) הגבה נוף של הקפסולה VNO הגזורה המתאר את הלוקליזציה הבילטרליים של שניהם (i D) VNOs. את התצוגה לרוחב ממחישה את שפת הסחוס בצד הגבה שבו שני VNOs צריכים להיות מופרדים (ד ii). סרגל קנה מידה = 1 מ"מ (A - D).517 / 54517fig1large.jpg "target =" _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2:. הכנה רקמות, הקלטה קאמרית הבמה מיקרוסקופ תצוגה לרוחב סכמטי על VNO כדי להמחיש את הקורס ואת המיקום של כלי דם הגדולים (BV) של החלק הלא-החושי של האפיתל (A i). השורה המקווקות מייצגת את שכבת חיתוך העטרה. נוף צדדי על VNO קלוף מתוך CC מציג את כלי הדם (A ii). (ב) Agarose-מוטבע פרוסת רקמות עטרת VNO הקבועה לחלק התחתון של תא קלטת מלאות פתרון באמצעות עוגן נירוסטה חוטית עם 0.1 מ"מ סיבים סינטטיים עבים אשכולות (SF). האזור התאגרף מתאר את agarose המקיף את פרוסת הרקמה. (Cנוף סכמטי) הממחיש את המיקום וכיוון של agarose (Ag) -embedded פרוס VNO עטרה ממוקמת בין שני סיבים. (ד) סקירה של חדר ההקלטה להציב על הבמה מיקרוסקופ. התא מצויד יישום אמבטיה (BA) עבור superfusion מתמיד עם S 2 מחומצן, עיפרון זלוף (PP) כדי להחיל גירויים חושיים או סוכנים תרופתיים, פיפטה ההקלטה (RP) מחוברת אל במת ראש המגבר, אלקטרודה ההשוואתית (RE ) ואת נימי (SC יניקה) כדי לשמור על חליפין קבוע של הפתרון בתא. סרגל קנה מידה = 1 מ"מ (א ii). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3: Tiss VNO עטרהue פרוסה. (א) תמונת Confocal (הקרנת מקסימלית) של 150 מיקרומטר פרוס רקמת VNO עטרה חריפה המראה את הפיזור של טאו-ונוס FPR-RS3 ניאון + נוירונים (ירוק) ב האפיתל החושית vomeronasal. כלי דם (BV), לומן (L), האפיתל חושית (SE). (ב) FPR-RS3 טאו-ונוס + נוירונים מפגינים דנדריט פסגה יחיד וכלה במבנה ידית דמוית בגבול לומינל. הקלטות כל תא מהדק תיקון בוצעו מ סומה VSN, פיפטה התיקון (PP). (C) מורפולוגיה של יחיד VSN עם ידית הדנדריטים (K) בקצה של דנדריט ארוך וצר (D), סומה תא (S) ואת האקסון (א) עוזב סומה בצד הבסיסי. ברי סולם, 50 מיקרומטר (א), 10 מיקרומטר (ב), 5 מיקרומטר (C). נתון זה יש הבדל בין 52. נא ללחוץ כאןכדי לצפות בגרסה גדולה יותר של דמות זו.
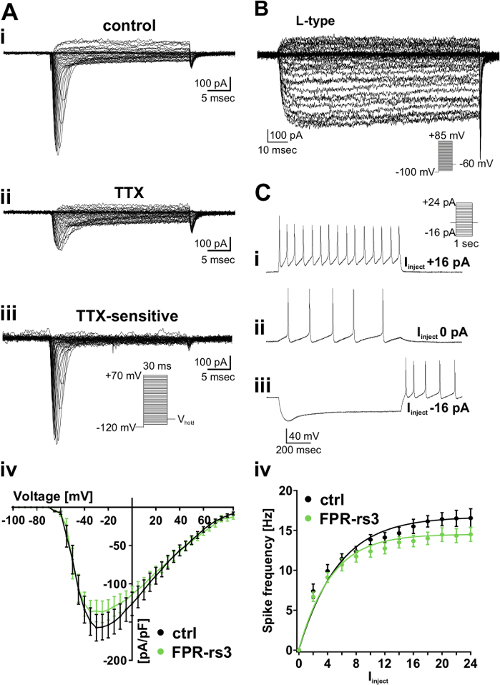
איור 4: מבודד מתח מגודרת Na + ו- Ca 2 + זרמים וכן הפרשות ספייק (א) עקבות נציג מהקלטות תיקון- clamp כל תא של זרם TTX רגיש מהירה והפעלה Na + ב FPR-RS3 + VSNs.. (A i) מתח הקלטת צעד בתנאים מבוקרים (פתרון תאי S 1; S 4 הפתרון התאי) מגלה חולפת מהר תלוי מתח פנימה נוכחי. (א ב) טיפול TTX (1 מיקרומטר) מפחית את הנוכחי בתוקף. דיגיטלית מופחתים עקבות (שליטה-TTX (א iii)) Reveמחא זרם Na + TTX הרגיש מגודר המתח. יחסים במתח הנוכחי של זרמי TTX רגישים Na + שבודדים נוירונים מלא FPR-RS3 + (א iv). (ב) הנציג Ca 2+ עקבות נוכחיות מבודדות פרמקולוגית (10 nifedipine מיקרומטר). (C) עקבות מהדק נוכחי נציג מראות דה / hyperpolarization ורכבות של (ריבאונד) פוטנציאל פעולה שנוצר על חיובי בשלבים (i C) והשלילי (C iii) הזרקה נוכחית. הערת הפעילות הספונטנית הנמדדת 0 זריקה הנוכחית PA (C ii). (Iv C) ירי תדירות מלא FPR-RS3 + נוירונים כפונקציה של הזרם המוזרק (אני מזריק). הגידול ההדרגתי ירי שיעור דומה לשליטהו FPR-RS3 + VSNs. שים לב VSNs הם רגיש להפליא זריקות נוכחיות אפילו picoamperes הנמוך נע 53-56. שים לב עקומות -אני f כבר "תקן רקע" באמצעות תדר spiking הספונטני ב 0 הזרקת הרשות נוכחית. נתונים הם אמצעי ± SEM. נתון זה יש הבדל בין 52. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 5: תאי 'תיקון רופף "הקלטות מ VSNs הבזליים (א) IR-DIC תמונה של פרוסה רקמת חריפה VNO המתארת את פיפטה הקלטה בשכבת הבסיס של האפיתל חושית.. (ב) הקלטה מקורית נציג של VSN הבזליים בתצורה מצורפת התא (&# 39; רופף חותם ') להגיב עם התפרצויות חולף קצרות קוצי גירויים לתדרך (3 שניות) עם ונקווה recombinantly הביעו חלבונים מרכזיים שתן (rMUPs) וכן ריכוז אשלגן גבוה (50 מ"מימ, 1 sec), בהתאמה (i B) . גדלה גבוהה של הקלטות שמוצגות (i B) ממחישה פרצי קוצים בתגובת גירויים (B ii). ברים אדומים מציינים זמן של גירוי, מרווח בין גירוי = 30 שניות, הקלטה רציפה, הפרעות <1 שניות (סימני חתך //). בר סולם = 5 מיקרומטר (א). לוח (א) יש הבדל בין התייחסות 38. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
VNO הוא מבנה chemosensory מאתר semiochemicals. נכון להיום, רוב הקולטנים vomeronasal נותר deorphanized כזוגות קולטן ליגנד רק כמה זוהו. בין אלה, V1rb2 תואר להיות מופעל על-ידי יצרן פרומון 2-heptanone שתן זכר 30, V2rp5 להיות מופעל על ידי ESP1 פרומון ספציפי זכר 57 וכן V2r1b ו V2rf2 כדי להיות מופעלים על ידי פפטידים MHC SYFPEITHI 48 ו SEIDLILGY 58, בהתאמה. תנאי מוקדם להבנת יחסים ליגנד לרצפטור אות תמרה הוא ידיעת מאפייני biophysical של אוכלוסיות VSN מוגדרות בסביבת ילידים. תכונות הממברנה פסיביות ואקטיביות, conductances היוני המתח מגודר ודפוסים פריקים פוטנציאל פעולה להגדיר את האמצעים ואת המידה שבה נוירונים קולטן להגיב chemosensory גירויים. קלטות אלקטרו בחתכי רקמה אקוטיות, בפרט, אשרle-תא הקלטות מהדק תיקון לספק שיטה מצוינת כדי לנתח תכונות אלה בפירוט רב.
שלב קריטי עבור הקלטות פיסיולוגיות מוצלחות ואמינות בחתכי רקמה הוא ההכנה עצם. כדי למקסם את תוחלת הזמן לבצע ניסויים, הרקמה חייבת להיות פרוסה והועברה פתרון מחומצן קר כקרח מייד לאחר דיסקציה. לאחר מכן, יכולות להישמר פרוסות במשך כמה שעות המאפשרות ניתוח של מספר לא מבוטל של תאים לכל יום ניסיוני. זה לוקח קצת תרגול כדי לקצר את הזמן לנתח ולהטביע הן VNOs של חיה אחת פחות מ -30 דקות. לאחר מכן, שיעור ההצלחה של נסיין מנוסה כדי להשיג כמה פרוסים שלמות רקמות עם תאי קיימא הוא הרבה מעל 75%. ביצוע הקלטות מהדק תיקון הוא גישה ניסויית נמוכה תפוקה בהשוואת הדמית Ca 2 +. עם זאת, היא מאפשרת ניתוח מפורט יותר תכליתי פעילות במישור מתחיל מתא הבודד עם זמני הרבה יותר גבוהרזולוציה. בתצורה כל התא, המדיום התאי הוא dialyzed ידי פתרון פיפטה. בעוד הפתרון פיפטה עלול שלא להציג את רכב cytosolic המדויק, הוא מספק את הנסיין עם שליטה מדויקת על שני תנאים יוניים חוּץ ו תאיים. לפרשנות אמינה של תוצאות, ניטור רציף של התנגדות גישה ועדכן דליפה הוא קריטי. לפעמים, עלייה משמעותית או שינוי חזק התנגדות גישה או לדלוף מוביל נוכחי לתוצאות uninterpretable ובכך דורשת הקלטות אלה אינם שורדים. יתר על כן, חשוב לציין כי כמה תרכובות תרופתיות בלתי הפיכה להיקשר טיוח לנכון להחליף פרוסות אחרי כל הקלטה.
הקלטה בתצורה מצורפת התא מונעת דיאליזה של רכיבים תאיים אינו משפיע על פוטנציאל הממברנה של התא. לכן, טכניקה זו מספקת דרך פחות פולשנית ומהירה יחסית של הקרנה. עם זאת, זה approאח מוגבל, בדרך כלל מרישום זרמי קיבולי פעולה סופר-סף מונחה פוטנציאל מהחלק החיצוני של קרום התא. קלטות Loose-תיקון הוכיחו להיות מתאים לניתוח ההתנהגות עם העלייה של מספרים גדולים יותר של עצב סנסורי בפרוסות VNO 38,54.
המודל המהונדס מועסק כאן מספק כלי אמין לזהות ולנתח את אוכלוסיית FPR-RS3 להביע VSNs. יתר על כן, הטכניקה המתוארת כאן ניתן להרחיב קווים שניים ללא תלות בגנוטיפ שלהם. למרות היתרון העצום של חוקרת לסוג תא מוגדר, באמצעות עכברים מהונדסים מגביל ניסויים לקווים הזמינים. לאחרונה, עם זאת, עריכת הגנום ממוקדת הפכה מהר יותר נוח עם טכניקת CRISPR / Cas9 59. לסיכום, ממוקד הקלטות תיקון- clamp בחתכי רקמת vomeronasal חריפות לספק גישה צדדית לאפיין תכונות biophysical והפיזיולוגיות של מוגדר populatיון של עצב סנסורי.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Ivan Rodriguez and Benoit von der Weid for generating the FPR-rs3-i-venus mouse line, their constructive criticism and fruitful discussions. This work was funded by grants of the Volkswagen Foundation (I/83533), the Deutsche Forschungsgemeinschaft (SP724/6-1) and by the Excellence Initiative of the German federal and state governments. MS is a Lichtenberg Professor of the Volkswagen Foundation.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose (low-gelling temperature) | PeqLab | 35-2030 | |
| ATP (Mg-ATP) | Sigma-Aldrich | A9187 | |
| Bis(2-hydroxyethyl)-2-aminoethanesulfonic acid (BES) | Sigma-Aldrich | B9879 | |
| Calcium chloride | Sigma-Aldrich | C1016 | |
| Ethylene glycol tetraacetic acid (EGTA) | Sigma-Aldrich | E3889 | |
| Glucose | Sigma-Aldrich | G8270 | |
| GTP (Na-GTP) | Sigma-Aldrich | 51120 | |
| (2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375 | |
| Magnesium chloride | Sigma-Aldrich | M8266 | |
| Potassium chloride | Sigma-Aldrich | P9333 | |
| Potassium hydroxide | Sigma-Aldrich | 03564 | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Sodium hydrogen carbonate | Sigma-Aldrich | S5761 | |
| Sodium hydroxide | Sigma-Aldrich | S8045 | |
| Name | Company | Catalog Number | Comments |
| Surgical tools and consumables | |||
| Large Petri dish, 90 mm | VWR | decapitation, dissection of VNO capsule | |
| Small Petri dish, 35 mm | VWR | lid for VNO dissection, dish for embedding in agarose | |
| Sharp large surgical scissor | Fine Science Tools | decapitation, removal of lower jaw | |
| Strong bone scissors | Fine Science Tools | cutting incisors | |
| Medium forceps, Dumont tweezers #2 | Fine Science Tools | removing skin and palate | |
| Micro spring scissors, 8.5 cm, curved, 7 mm blades | Fine Science Tools | cutting out VNO | |
| Two pairs of fine forceps, Dumont tweezers #5 | Fine Science Tools | dissecting VNO out of cartilaginous capsule | |
| Small stainless steel spatula | Fine Science Tools | handling agarose block and tissue slices | |
| Surgical scalpel | cutting agarose block into pyramidal shape | ||
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Amplifier | HEKA Elektronik | EPC-10 | |
| Borosilicate glass capillaries (1.50 mm OD/0.86 mm ID) | Science Products | ||
| CCD-camera | Leica Microsystems | DFC360FX | |
| Filter cube, excitation: BP 450-490, suppression: LP 515 | Leica Microsystems | I3 | |
| Fluorescence lamp | Leica Microsystems | EL6000 | |
| Hot plate magnetic stirrer | Snijders | 34532 | |
| Microforge | Narishige | MF-830 | |
| Micromanipulator Device | Luigs & Neumann | SM-5 | |
| Micropipette puller, vertical two-step | Narishige | PC-10 | |
| Microscope | Leica Microsystems | CSM DM 6000 SP5 | |
| Noise eliminator 50/60 Hz (HumBug) | Quest Scientific | ||
| Objective | Leica Microsystems | HCX APO L20x/1.00 W | |
| Oscilloscope | Tektronik | TDS 1001B | |
| Osmometer | Gonotec | Osmomat 030 | |
| Perfusion system 8-in-1 | AutoMate Scientific | ||
| pH Meter five easy | Mettler Toledo | ||
| Pipette storage jar | World Precision Instruments | e212 | |
| Recording chamber | Luigs & Neumann | Slice mini chamber | |
| Razor blades | Wilkinson Sword GmbH | Wilkinson Sword Classic | |
| Oxygenating slice storage chamber; alternative commercial chambers are: e.g., BSK1 Brain Slice Keeper (Digitimer) or the Pre-chamber (BSC-PC; Warner Instruments) | custom-made | ||
| Stereo microscope | Leica Microsystems | S4E | |
| Trigger interface | HEKA Elektronik | TIB-14 S | |
| Vibratome | Leica Microsystems | VT 1000 S | |
| Water bath | Memmert | WNB 45 |
References
- Firestein, S. How the olfactory system makes sense of scents. Nature. 413 (6852), 211-218 (2001).
- Mombaerts, P. Genes and ligands for odorant, vomeronasal and taste receptors. Nat. Rev. Neurosci. 5 (4), 263-278 (2004).
- Fuss, S. H., Omura, M., Mombaerts, P. The Grueneberg ganglion of the mouse projects axons to glomeruli in the olfactory bulb. Eur. J. Neurosci. 22 (10), 2649-2654 (2005).
- Roppolo, D., Ribaud, V., Jungo, V. P., Lüscher, C., Rodriguez, I. Projection of the Grüneberg ganglion to the mouse olfactory bulb. Eur. J. Neurosci. 23 (11), 2887-2894 (2006).
- Adams, D. R. Fine structure of the vomeronasal and septal olfactory epithelia and of glandular structures. Microsc. Res. Tech. 23 (1), 86-97 (1992).
- Ma, M., et al. Olfactory signal transduction in the mouse septal organ. J. Neurosci. 23 (1), 317-324 (2003).
- Dulac, C., Torello, A. T. Molecular detection of pheromone signals in mammals: from genes to behaviour. Nat. Rev. Neurosci. 4 (7), 551-562 (2003).
- Luo, M., Katz, L. C. Encoding pheromonal signals in the mammalian vomeronasal system. Curr. Opin. Neurobiol. 14 (4), 428-434 (2004).
- Brennan, P. A., Kendrick, K. M. Mammalian social odours: attraction and individual recognition. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 361 (1476), 2061-2078 (2006).
- Tirindelli, R., Dibattista, M., Pifferi, S., Menini, A. From Pheromones to Behavior. Physiol. Rev. 89, 921-956 (2009).
- Jacobson, L., Trotier, D., Doving, K. B. Anatomical description of a new organ in the nose of domesticated animals by Ludvig Jacobson (1813). Chem. Senses. 23 (6), 743-754 (1998).
- Keverne, E. B. The Vomeronasal Organ. Science. 286 (5440), 716-720 (1999).
- Breer, H., Fleischer, J., Strotmann, J. The sense of smell: multiple olfactory subsystems. Cell. Mol. Life Sci. C. 63 (13), 1465-1475 (2006).
- Liberles, S. D. Mammalian pheromones. Annu. Rev. Physiol. 76, 151-175 (2014).
- Meredith, M., O'Connell, R. J. Efferent control of stimulus access to the hamster vomeronasal organ. J. Physiol. 286, 301-316 (1979).
- Pankevich, D., Baum, M. J., Cherry, J. A. Removal of the superior cervical ganglia fails to block Fos induction in the accessory olfactory system of male mice after exposure to female odors. Neurosci. Lett. 345 (1), 13-16 (2003).
- Giacobini, P., Benedetto, A., Tirindelli, R., Fasolo, A. Proliferation and migration of receptor neurons in the vomeronasal organ of the adult mouse. Brain Res. Dev. Brain Res. 123 (1), 33-40 (2000).
- Coppola, D. M., O'Connell, R. J. Stimulus access to olfactory and vomeronasal receptors in utero. Neurosci. Lett. 106 (3), 241-248 (1989).
- Hovis, K. R., et al. Activity Regulates Functional Connectivity from the Vomeronasal Organ to the Accessory Olfactory Bulb. J. Neurosci. 32 (23), 7907-7916 (2012).
- Mucignat-Caretta, C. The rodent accessory olfactory system. J. Comp. Physiol. A Neuroethol. Sensory, Neural, Behav. Physiol. 196 (10), 767-777 (2010).
- Jia, C., Halpern, M. Subclasses of vomeronasal receptor neurons: differential expression of G proteins (Giα2 and G(αo)) and segregated projections to the accessory olfactory bulb. Brain Res. 719 (1-2), 117-128 (1996).
- Del Punta, K., Puche, C. A., Adams, N. C., Rodriguez, I., Mombaerts, P. A divergent pattern of sensory axonal projections is rendered convergent by second-order neurons in the accessory olfactory bulb. Neuron. 35 (6), 1057-1066 (2002).
- Belluscio, L., Koentges, G., Axel, R., Dulac, C. A map of pheromone receptor activation in the mammalian brain. Cell. 97 (2), 209-220 (1999).
- Rodriguez, I., Feinstein, P., Mombaerts, P. Variable patterns of axonal projections of sensory neurons in the mouse vomeronasal system. Cell. 97 (2), 199-208 (1999).
- Rivière, S., Challet, L., Fluegge, D., Spehr, M., Rodriguez, I. Formyl peptide receptor-like proteins are a novel family of vomeronasal chemosensors. Nature. 459 (7246), 574-577 (2009).
- Martini, S., Silvotti, L., Shirazi, A., Ryba, N. J. P., Tirindelli, R. Co-expression of putative pheromone receptors in the sensory neurons of the vomeronasal organ. J. Neurosci. 21 (3), 843-848 (2001).
- Matsuoka, M., et al. Immunocytochemical study of Gi2alpha and Goalpha on the epithelium surface of the rat vomeronasal organ. Chem. Senses. 26 (2), 161-166 (2001).
- Dulac, C., Torello, A. T. Molecular detection of pheromone signals in mammals: from genes to behaviour. Nat. Rev. Neurosci. 4 (7), 551-562 (2003).
- Leinders-Zufall, T., et al. Ultrasensitive pheromone detection by mammalian vomeronasal neurons. Nature. 405 (6788), 792-796 (2000).
- Boschat, C., et al. Pheromone detection mediated by a V1r vomeronasal receptor. Nat. Neurosci. 5 (12), 1261-1262 (2002).
- Novotny, M. V. Pheromones, binding proteins and receptor responses in rodents. Biochem. Soc. Trans. 31, 117-122 (2003).
- Nodari, F., et al. Sulfated steroids as natural ligands of mouse pheromone-sensing neurons. J. Neurosci. 28 (25), 6407-6418 (2008).
- Isogai, Y., et al. Molecular organization of vomeronasal chemoreception. Nature. 478 (7368), 241-245 (2011).
- Leinders-Zufall, T., et al. MHC class I peptides as chemosensory signals in the vomeronasal organ. Science. 306 (5698), 1033-1037 (2004).
- Chamero, P., et al. Identification of protein pheromones that promote aggressive behaviour. Nature. 450 (7171), 899-902 (2007).
- Kimoto, H., Haga, S., Sato, K., Touhara, K. Sex-specific peptides from exocrine glands stimulate mouse vomeronasal sensory neurons. Nature. 437 (7060), 898-901 (2005).
- Ferrero, D. M., et al. A juvenile mouse pheromone inhibits sexual behaviour through the vomeronasal system. Nature. 502 (7471), 368-371 (2013).
- Kaur, A. W., et al. Murine pheromone proteins constitute a context-dependent combinatorial code governing multiple social behaviors. Cell. 157 (3), 676-688 (2014).
- Ben-Shaul, Y., Katz, L. C., Mooney, R., Dulac, C. In vivo vomeronasal stimulation reveals sensory encoding of conspecific and allospecific cues by the mouse accessory olfactory bulb. PNAS. 107 (11), 5172-5177 (2010).
- Kimoto, H., et al. Sex- and strain-specific expression and vomeronasal activity of mouse ESP family peptides. Curr. Biol. 17 (21), 1879-1884 (2007).
- Spehr, M., et al. Parallel processing of social signals by the mammalian main and accessory olfactory systems. Cell. Mol. Life Sci. C. 63 (13), 1476-1484 (2006).
- Chamero, P., et al. G protein G{alpha}o is essential for vomeronasal function and aggressive behavior in mice. PNAS. , (2011).
- Bufe, B., Schumann, T., Zufall, F. Formyl peptide receptors from immune and vomeronasal system exhibit distinct agonist properties. J. Biol. Chem. 287 (40), 33644-33655 (2012).
- Bozza, T., Feinstein, P., Zheng, C., Mombaerts, P. Odorant receptor expression defines functional units in the mouse olfactory system. J. Neurosci. 22 (8), 3033-3043 (2002).
- Grosmaitre, X., Vassalli, A., Mombaerts, P., Shepherd, G. M., Ma, M. Odorant responses of olfactory sensory neurons expressing the odorant receptor MOR23: a patch clamp analysis in gene-targeted mice. PNAS. 103 (6), 1970-1975 (2006).
- Oka, Y., et al. Odorant receptor map in the mouse olfactory bulb: in vivo sensitivity and specificity of receptor-defined glomeruli. Neuron. 52 (5), 857-869 (2006).
- Ukhanov, K., Leinders-Zufall, T., Zufall, F. Patch-clamp analysis of gene-targeted vomeronasal neurons expressing a defined V1r or V2r receptor: ionic mechanisms underlying persistent firing. J. Neurophysiol. 98 (4), 2357-2369 (2007).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12 (12), 1551-1558 (2009).
- Pacifico, R., Dewan, A., Cawley, D., Guo, C., Bozza, T. An olfactory subsystem that mediates high-sensitivity detection of volatile amines. Cell Rep. 2 (1), 76-88 (2012).
- Veitinger, S., et al. Purinergic signalling mobilizes mitochondrial Ca2+ in mouse Sertoli cells. J. Physiol. 589 (Pt 21), 5033-5055 (2011).
- Kaur, A. W., et al. Murine pheromone proteins constitute a context-dependent combinatorial code governing multiple social behaviors. Cell. 157 (3), 676-688 (2014).
- Ackels, T., von der Weid, B., Rodriguez, I., Spehr, M. Physiological characterization of formyl peptide receptor expressing cells in the mouse vomeronasal organ. Front. Neuroanat. 8, 1-13 (2014).
- Liman, E. R., Corey, D. P. Electrophysiological characterization of chemosensory neurons from the mouse vomeronasal organ. J. Neurosci. 16 (15), 4625-4637 (1996).
- Cichy, A., et al. Extracellular pH Regulates Excitability of Vomeronasal Sensory Neurons. J. Neurosci. 35 (9), 4025-4039 (2015).
- Shimazaki, R., et al. Electrophysiological properties and modeling of murine vomeronasal sensory neurons in acute slice preparations. Chem. Senses. 31 (5), 425-435 (2006).
- Hagendorf, S., Fluegge, D., Engelhardt, C., Spehr, M. Homeostatic control of sensory output in basal vomeronasal neurons: activity-dependent expression of ether-à-go-go-related gene potassium channels. J. Neurosci. 29 (1), 206-221 (2009).
- Haga, S., et al. The male mouse pheromone ESP1 enhances female sexual receptive behaviour through a specific vomeronasal receptor. Nature. 466 (7302), 118-122 (2010).
- Leinders-Zufall, T., et al. A family of nonclassical class I MHC genes contributes to ultrasensitive chemodetection by mouse vomeronasal sensory neurons. J. Neurosci. 34 (15), 5121-5133 (2014).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337, 816-821 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved