Method Article
Análisis fisiológico en profundidad de poblaciones de células definidas en el infarto agudo del tejido Rebanadas del ratón órgano vomeronasal
En este artículo
Resumen
Here, we describe a physiological approach that allows identification and in-depth analysis of a defined population of sensory neurons in acute coronal tissue slices of the mouse vomeronasal organ using whole-cell patch-clamp recordings.
Resumen
In most mammals, the vomeronasal organ (VNO) is a chemosensory structure that detects both hetero- and conspecific social cues. Vomeronasal sensory neurons (VSNs) express a specific type of G protein-coupled receptor (GPCR) from at least three different chemoreceptor gene families allowing sensitive and specific detection of chemosensory cues. These families comprise the V1r and V2r gene families as well as the formyl peptide receptor (FPR)-related sequence (Fpr-rs) family of putative chemoreceptor genes. In order to understand the physiology of vomeronasal receptor-ligand interactions and downstream signaling, it is essential to identify the biophysical properties inherent to each specific class of VSNs.
The physiological approach described here allows identification and in-depth analysis of a defined population of sensory neurons using a transgenic mouse line (Fpr-rs3-i-Venus). The use of this protocol, however, is not restricted to this specific line and thus can easily be extended to other genetically modified lines or wild type animals.
Introducción
La mayoría de los animales dependen en gran medida de sus sentidos químicos para interactuar con su entorno. El sentido del olfato juega un papel esencial para la búsqueda y evaluación de los alimentos, evitar a los depredadores y la localización de los socios de acoplamiento adecuados. En la mayoría de los mamíferos, el sistema olfativo consiste en al menos cuatro subsistemas anatómicamente y funcionalmente distintos periféricos: el epitelio olfativo principal 1,2, el ganglio Grueneberg 3,4, el órgano septal de Masera 5,6 y el órgano vomeronasal. El VNO comprende la estructura sensorial periférica del sistema olfativo accesorio (AOS), que desempeña un papel importante en la detección de señales químicas que transmiten información acerca de la identidad, el género, el rango social y el estado sexual 7-10. El VNO está situado en la base del tabique nasal derecha por encima del paladar. En los ratones, es un tubo ciego bilateral fin encerrados en una cápsula cartilaginosa 11-13. El órgano se compone tanto de un epithe sensorial medial forma de media lunaLium que alberga los VSNS y de una parte no sensorial en el lado lateral. Entre ambos epitelios se encuentra un lumen lleno de moco que está conectado a la cavidad nasal a través de la estrecha conducto vomeronasal 14. Un vaso sanguíneo lateral grande en el tejido no sensorial proporciona un mecanismo de bombeo vascular para facilitar la entrada de moléculas relativamente grandes, en su mayoría no volátiles tales como péptidos o proteínas pequeñas en el lumen VNO a través de presión negativa 15,16. Los componentes estructurales del VNO están presentes en el nacimiento y el órgano alcanza el tamaño adulto poco antes de la pubertad 17. Sin embargo, si la AOS roedores ya es funcional en los menores sigue siendo objeto de debate 18-20.
VSNS se distinguen tanto por su ubicación epitelial y el tipo de receptor que expresan. VSNS muestran una morfología bipolar con un axón sin mielina y una sola dendrita apical que sobresale hacia el lumen y termina en una perilla dendríticas microvellosidades. VSN hachaons fasciculada para formar el nervio vomeronasal que sale de la cápsula cartilaginosa en el extremo dorso-caudal, asciende a lo largo del tabique, pasa la lámina cribosa y proyectos para el bulbo olfatorio accesorio (AOB) 21,22. El epitelio sensorial vomeronasal se compone de dos capas: la capa apical se encuentra más cerca del lado luminal y puertos tanto V1R- y todos menos un tipo de FPR-RS-expresando neuronas. Estas neuronas coexpresan los G αi2 G-proteína α-subunidad y proyecto a la parte anterior de la AOB 23-25. Las neuronas sensoriales situados en la capa basal más V2Rs expresas o FPR-RS1 junto G αo y envían sus axones a la región posterior de la AOB 26-28.
Vomeronasal neuronas son activadas por probable más bien pequeñas semioquímicos 29-33 (V1Rs) o compuestos proteicos 34-38 (V2Rs) que son secretadas en diversos fluidos corporales, tales como orina, saliva y fluido desgarran 37,39-41 . En experimentos in situ han demostrado que VSNS también se activan mediante péptidos formilados y diversos compuestos antimicrobianos / inflamación ligada 25,42. Por otra parte, expresaron de forma heteróloga FPR-rs proteínas comparten con agonistas espectros FPRs expresadas en el sistema inmunológico, lo que indica un papel potencial como detectores para la enfermedad de la misma especie o fuentes de alimentos en mal estado 25 (véase la referencia 43).
Es fundamental para la comprensión de las relaciones de receptor-ligando y cascadas de señalización corriente abajo en poblaciones específicas de VSN es una evaluación detallada de sus características biofísicas básicas en un entorno nativo. En el pasado, el análisis de la señalización celular se ha beneficiado enormemente de animales modificados genéticamente que marcan una población definida de las neuronas por la coexpresión de una proteína marcadora fluorescente 30,44-49. En este protocolo, una línea de ratón transgénico que expresa FPR-RS3 junto con un marcador fluorescente (FPR-RS3-i-Venus) se utiliza.Este enfoque es un ejemplo de cómo emplear una cepa de ratones genéticamente modificado para realizar el análisis electrofisiológico de una población de células ópticamente identificable mediante sola neurona patch-clamp grabaciones en cortes de tejido coronal VNO agudas. Una presión de aire comprimido sistema de perfusión de varios cañones para los estímulos sensoriales y agentes farmacológicos permite la estimulación neuronal rápida, reversible y focal o la inhibición durante las grabaciones. grabaciones de células enteras en el tramo preparativos permiten un análisis detallado de las propiedades intrínsecas, conductancias activados por voltaje, así como patrones de descarga del potencial de acción en el entorno nativo de la célula.
Protocolo
Todos los procedimientos con animales estaban en conformidad con la legislación local y de la Unión Europea sobre la protección de los animales utilizados con fines experimentales (Directiva 86/609 / CEE) y con las recomendaciones formuladas por la Federación de Asociaciones Europeas de Laboratorio de Ciencia Animal (FELASA). Ambos ratones C57BL / 6 y ratones Fpr-RS3-i-Venus fueron alojados en grupos de ambos sexos a temperatura ambiente en un 12 horas de luz / oscuridad ciclo con comida y agua ad libitum. Para los experimentos se utilizaron los adultos jóvenes (6-20 semanas) de ambos sexos. No se observaron diferencias obvias dependiente de género.
1. Preparación de la solución
- Preparar extracelular solución S 1: 4- (2-hidroxi-etil) piperazina-1-etanosulfónico (HEPES) tamponada solución extracelular que contiene (en mM) 145 NaCl, 5 KCl, 1 CaCl 2, 1 MgCl 2, 10 HEPES; pH = 7,3 (ajustado con NaOH); osmolaridad = 300 mOsm (ajustado con glucosa).
- preparar extracellular solución S 2: oxigenada Carbogen (95% O 2, 5% de CO 2) solución extracelular que contiene (en mM) 125 NaCl, 25 NaHCO 3, 5 KCl, 1 CaCl 2, 1 MgSO 4, 5 BES; pH = 7,3; osmolaridad = 300 mOsm (ajustado con glucosa).
- Preparar la solución de agarosa al 4% temperatura de gelificación baja (S 3) para la incrustación de tejidos: 4% de agarosa de baja temperatura de gelificación. Disolver 2 g de agarosa de baja gelificación en 50 ml de S 1 en una botella de vidrio de laboratorio 100 ml junto con un agitador magnético. Para fundir la agarosa, poner la botella en un baño de agua (con la tapa no herméticamente cerrado) a 70 ° C durante aproximadamente 20 min o hasta que la solución se vuelve transparente mientras se agita. Enfriar y mantener agarosa fundida en un segundo baño de agua a 42 ° C hasta su uso posterior.
- Preparar intracelular solución S 4: solución de la pipeta contenía (en mM) 143 KCl, 2 KOH, 1 EGTA, 0,3 CaCl 2 (libre de Ca 2 + = 110 nM), 10 HEPES, 2 MgATP, 1 NaGTP;pH = 7,1 (ajustado con KOH); osmolaridad = 290 mOsm.
- Modificar / ajustar la composición de S 1, S 2 y S 4 de acuerdo con el diseño experimental individual (por ejemplo, bloqueadores farmacológicos para aislar ciertos tipos de corrientes activados por voltaje).
2. Preparación del área de trabajo
- Llenar la oxigenación de la cámara de corte almacenar con S 2 al menos 30 min antes de la disección, el lugar en el hielo para el ajuste de la temperatura y el pH y la solución de compuesto oxigenado continuamente.
- Llenar el depósito de superfusión rebanada a la configuración de la grabación con S 2 y oxigenar continuamente.
- Antes de la disección, llenar vibratome cámara con S 2 y organizar hielo picado alrededor de la cámara. Como alternativa, transferir la solución oxigenada repuesto de hielo frío de la oxigenación de cámara en la cámara de vibratome y mantener la oxigenación de forma continua.
- Organizar las herramientas quirúrgicas y consumibles.
- Coloque paquete de gel de hielo bajo la disecciónmicroscopio, cubrir con una toalla de papel para evitar que el tejido VNO se congele al fondo del plato.
- hoja de afeitar limpia por aclarado brevemente en 70% de etanol y agua destilada y montar a vibratome. Reemplazar para cada sesión de rebanar.
3. VNO disección e incrustación
- El sacrificio de animales mediante una breve exposición a CO 2 y decapitar utilizando tijeras quirúrgicas agudas. Nota: Como el tiempo de sacrificar el animal de poner la cápsula VNO en hielo es crítica, minimizar el tiempo a menos de 2 min. Para mantener la viabilidad del tejido, incrustar tanto completamente disecado VNOs en agarosa en menos de 30 min.
- Retire la mandíbula inferior con grandes tijeras quirúrgicas. Entrar a través de la cavidad bucal y cortar los huesos y los músculos de la mandíbula cada lado por separado.
- Coloque la parte restante de la cabeza hacia abajo en la gran placa de Petri.
- Aparte la piel de la mandíbula superior y alrededor de la punta de la nariz con fórceps medio para obtener un mejor acceso a laincisivos.
- Use las tijeras para cortar hueso la mayor parte de los incisivos en un ángulo de 45 ° ~ en la dirección rostral (Figura 1A). Esto facilitará la eliminación de la cápsula VNO de la cavidad nasal.
Nota: No corte a la raíz del diente para evitar daños en la punta de la cápsula VNO. - Coge el paladar superior rígida en su parte rostral con fórceps medio y con cuidado la cáscara de nuevo en una sola pieza en un ángulo plano (Figura 1B).
Nota: En repetidas ocasiones enjuague con helado de S 2. - Con unas tijeras micro resorte para cortar la fusión ósea entre la punta del hueso vómer y la mandíbula. Inserte las puntas de las tijeras con la parte curva de la punta apuntando hacia fuera lejos del VNO y cuidadosamente cortar el hueso en pequeños pasos tanto de izquierda y lateral derecha de la cápsula VNO.
- Para quitar la cápsula VNO, utilizar tijeras micro resorte para cortar a través del hueso vómer en la parte caudal y levante con cuidado el hueso vómer fuera de la ncavidad ASAL utilizando pinzas medianas. Inmediatamente transferir el VNO a una pequeña placa de Petri con un microscopio estéreo en un paquete de gel de hielo donde se llevarán a cabo los pasos restantes de la disección.
- Enjuague el VNO en una pequeña cantidad de helado de S 2 para evitar que el tejido de la desecación.
- Se separan las cápsulas cartilaginosos que contienen los tejidos blandos VNO agarrando la parte posterior del hueso vómer con fórceps medianos. Coloque la cápsula para una vista dorsal de modo que una división entre ambas VNOs se hace visible (Figura 1D i).
- Use la punta de unas pinzas finas para separar tanto el cartílago cápsulas VNO de la espina central, manteniendo el hueso vómer inmovilizado en la parte trasera.
Nota: El uso de fórceps sólo en el borde de la cápsula de cartílago y tener mucho cuidado de no perforar a través del cartílago como el epitelio sensorial delicada se daña fácilmente. - Una vez que los dos están separados VNOs, empezar a eliminar el cartílago encapsular los abetost VNO.
- Agarrar el borde superior de la cápsula con una pinza fina y dividir distancia de la pared del cartílago conectado previamente al hueso vómer (cara medial).
- Para eliminar restante cartílago gire el VNO con su lado lateral curvada a la parte inferior del plato y de forma segura precisar el cartílago en un lado el uso de fórceps. Cuidadosamente mueva el segundo pinzas finas de la parte de atrás en un ángulo muy plano entre el cartílago y el VNO para aflojar la conexión entre el tejido y el cartílago.
- lentamente la cáscara del OVN del cartílago sosteniéndolo en su extremo caudal, para no dañar el epitelio sensorial.
- Una vez que el VNO se apalanca de la cápsula, asegúrese de eliminar todas las pequeñas piezas de cartílago que quedan como los trozos de cartílago se separe el tejido circundante de agarosa durante el proceso de corte.
- Colocar una pequeña gota de helado de S 2 en la primera VNO diseccionados para prevenir el daño tisular. Un vaso sanguíneo grande en el lado lateral Will se hace visible que indica que el órgano está intacta y no se groseramente dañado durante la disección (Figura 2A ii). En caso de que el vaso sanguíneo se daño, todavía valdrá la pena continuar con cortar el OVN, siempre y cuando la morfología general no se vio afectada claramente.
- Inmediatamente diseccionar el segundo VNO.
- Para incrustar el OVN, llenar los dos pequeñas placas de Petri hasta el borde de S derretida 3 (almacenado en baño de agua a 42 ° C; véase 1.3).
- Mantenga el VNO en el extremo caudal más amplio con unas pinzas finas para evitar daños en el epitelio sensorial.
- Sumergir el VNO en la agarosa y moverlo horizontalmente hacia atrás y adelante varias veces para eliminar la película de la solución extracelular, así como las burbujas de aire de su superficie.
- Coloque el VNO en posición vertical con la punta caudal hacia el fondo del plato. En lugar de pellizcar el OVN con las pinzas directamente, ajustar la orientación moviendo la punta fórceps en estrecha proximity al VNO.
Nota: Orientación durante la incrustación es crucial ya que determina plano de corte y la accesibilidad a las neuronas sensoriales durante el experimento. - Colocar platos en bolsa de hielo en gel de agarosa y espere hasta que se haya solidificado.
Nota: No cambie la orientación VNO una vez que la agarosa ha comenzado la solidificación ya que esto separar el tejido circundante de la agarosa.
4. coronal del tejido VNO rebanar
- Use pequeña espátula para quitar el bloque de agarosa del plato pequeño en la tapa de una gran placa de Petri, darle la vuelta al revés de agarosa dejando la punta caudal del VNO hacia arriba.
- Cortar el bloque en forma de pirámide con un bisturí quirúrgico (3-4 mm en la punta, de 8-10 mm en la parte inferior). Tenga cuidado de no dañar el tejido embebido.
- Utilice pegamento para fijar el bloque en forma de pirámide al centro de la placa de muestras vibratome y esperar ~ 1 minuto para que el pegamento se seque por completo.
- La transferencia de la placa de la muestra a la corte en rodajas cHamber y preparar la segunda VNO, en consecuencia. Mantenga la placa con la segunda muestra a 4 ° C hasta su uso.
- Use un microtomo de cuchilla vibrante con los siguientes valores: espesor: 150-200 micras; velocidad: 3,5 au = 0,15 mm / seg; Frecuencia: 7.5 au = 75 Hz. Transferir las rebanadas a la cámara de oxigenación hasta su uso después de inspeccionar brevemente la morfología rebanada bajo el microscopio de disección. Las rebanadas se pueden mantener durante varias horas.
5. sola célula Registros electrofisiológicos
- Para las grabaciones, utilice un microscopio de fase fija en posición vertical equipado con objetivos de inmersión en agua, Dodt o infrarrojos diferencial de interferencia de contraste (IR-DIC), y epi-fluorescencia, así como una cámara CCD enfriada. Para la adquisición de datos, utilizar un amplificador de patch-clamp, etapa de la cabeza, AD tarjeta de interfaz / DA y un PC (incluyendo software de grabación).
- Preparar un balance de 10-20 pipetas de parche (4-7) mO. pipetas de extracción de capilares de vidrio borosilicato (1,50 mm de diámetro exterior / 0,86 mm de diámetro interior) USINga extractor de micropipeta y extinción de esmalte con un microforge.
Nota: Fuego pulir las puntas de pipeta es crucial cuando los parches más pequeños VSNS. Esto ayudará a prevenir la ruptura de la membrana celular cuando se aplica presión negativa con el fin de obtener un sello de alta resistencia. Después de pulir la abertura de la pipeta debe ser aproximadamente 1 m. - Mantenga pipetas en un frasco de almacenamiento pipeta para evitar daños y la acumulación de polvo hasta su uso.
- Preparar sistema de perfusión rellenando depósitos de solución y el tubo de acuerdo con el diseño experimental.
Nota: Eliminar las burbujas de aire de la tubería por completo, ya que interferirán fuertemente con los registros electrofisiológicos. - Ajustar la presión para lograr ~ 3 flujo ml / min.
Nota: Las altas presiones causarán el movimiento de la lámina de tejido, así como la terminación de los registros electrofisiológicos. - Transferir VNO rebanada de cámara de imágenes y fijar la posición de fragmento utilizando anclaje de acero inoxidable cableado con 0,1 mm de espesor synthetic fibras (Figura 2 B - C).
Nota: No cubra la lámina de tejido con uno de los hilos de fibra sintética, sino más bien la agarosa que rodea la rebanada. - Cámara de imágenes Transferencia de configuración de la grabación y la rebanada de forma continua superfuse con S oxigenada 2 a temperatura ambiente a través de una aplicación del baño.
- Ajuste el capilar de succión a la superficie de la solución para crear una succión lenta para el intercambio constante de solución del baño. Ajuste el 8-en-1 de varios cañones para "lápiz de perfusión" por encima y cerca de la parte no sensorial de la rebanada VNO que contiene el vaso sanguíneo (Figura 2C, 3A) 50. Será beneficioso para organizar lápiz de perfusión y la pipeta de grabación sea frente a la rebanada de direcciones opuestas.
- Conectar el electrodo de referencia y solución del baño usando un puente de agar en forma de L (lleno de KCl 150 mM).
- Llene la pipeta de parche con la solución de la pipeta S 4.
- Montar la pipeta sobre el electrodo de parche de cloruro de plata-revestido conectado a la etapa de la cabeza, sin raspar el revestimiento y adherirse firmemente.
- Aplicar una ligera presión positiva (aproximadamente 1 ml en una jeringa de plástico 10 ml) a la pipeta de parche antes de entrar en el baño.
- Bajar la pipeta en el baño usando micro manipuladores lo suficiente como para ser capaz de sumergir el objetivo sin golpearlo (Figura 2D).
- Vigilar la resistencia de la pipeta (R pip, entre 4-7 mO) usando el software de electrofisiología conectado a la etapa de la cabeza.
Nota: Si R pip es <4 mO la punta de vidrio se rompe. Si R pip es> 10 mO, la punta es más probable obstruido y la pipeta debe ser reemplazado. - Visualizar el VNO rebanada con una cámara CCD usando contraste de interferencia diferencial optimizado para el infrarrojo (CID) e identificar FPR-RS3-i-Venus células que expresan (o similarmente neuronas marcadas) utilizando iluminación de fluorescenciay un cubo de filtro apropiado.
- Enfoque y fluorescentes diana o células no fluorescentes dependiendo del diseño experimental.
- Para acercarse al cuerpo celular, utilizar ruedas de mano para la máxima sensibilidad. Debido a la presión positiva, una pequeña mella en la membrana soma celular se hace visible una vez que la punta de la pipeta está en estrecha proximidad.
- Liberar la presión positiva y aplicar una ligera presión negativa para aspirar en la membrana celular a fin de obtener un sello de alta resistencia (1-20 GΩ). Aplicar succión corta y suave para romper la membrana celular y establecer la configuración de célula completa.
- Vigilar la resistencia acceso constante durante el experimento.
Nota: Sólo incluya las neuronas que exhiben resistencia acceso pequeño y estable (≤3% de entrada R, el cambio <20% en el transcurso del experimento) en el análisis.
Resultados
Para conocer las propiedades biofísicas y fisiológicas de las poblaciones de células definidas, realizamos cortes de tejido coronal agudas del ratón VNO (Figura 1 - 2). Después de la disección, rebanadas se pueden mantener en solución extracelular oxigenada enfriada con hielo (S 2) para varios hr. En la configuración de la grabación, un intercambio constante con solución oxigenada (Figura 2D) asegura la viabilidad del tejido durante todo el experimento. Nosotros aquí empleamos un modelo de ratón transgénico (FPR-RS3-i-Venus). VSNS en esta cepa coexpresan una proteína marcadora que emite fluorescencia con FPR-RS3, un miembro prototípico del FPR-rs familia de genes (Figura 3) que permite la identificación óptica de una población definida de las neuronas sensoriales. Los registros electrofisiológicos proporcionan los medios para el análisis en profundidad a nivel de una sola célula. Por ejemplo, el análisis de corrientes dependientes de voltaje se realiza en el voltaje-clampModo (Figura 4A - B). Para aislar determinados tipos de corrientes iónicas, rodajas se superfundieron con agentes farmacológicos tales como TTX para inhibir las corrientes de voltaje Na + (Figura 4A) o nifedipina para bloquear de voltaje de tipo L Ca 2 + corrientes (Figura 4B). Por otra parte, de manera rutinaria a cabo grabaciones de células enteras en la configuración de la pinza de corriente para analizar los patrones de descarga de potenciales de acción (Figura 4C). Además de células enteras grabaciones, grabaciones adjunta celular 'sueltas sello' proporcionan un método menos invasivo que previene la diálisis de los componentes intracelulares (Figura 5A). Acción de grabación potencial impulsada por corrientes capacitivas después de la aplicación a corto estímulo ofrece una manera sensible y eficaz para la detección de ligandos sensoriales (por ejemplo, las principales proteínas de la orina; MUPs) que activan las poblaciones de células 51 (Figura 5B) definido.
= "Jove_content" fo: keep-together.within-page = "1"> 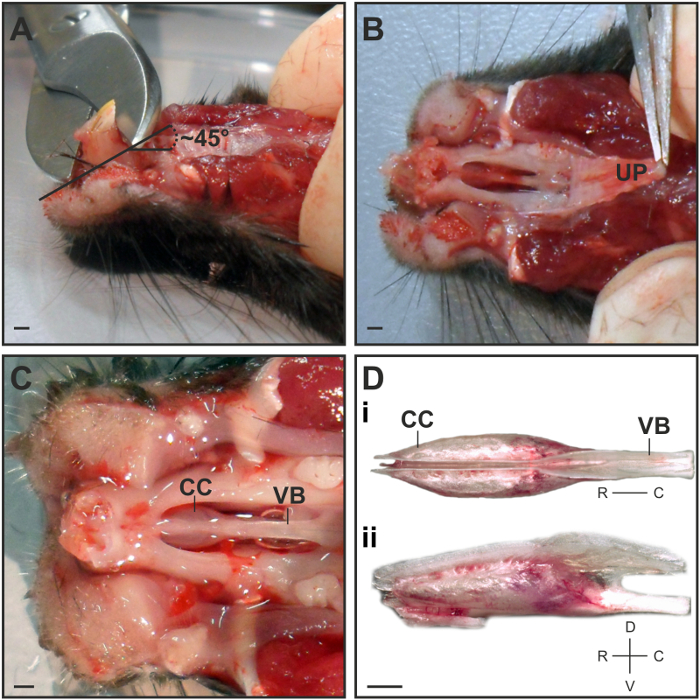
Figura 1: La disección del VNO. (A) Vista lateral de la cabeza del ratón para ilustrar la posición y el ángulo en el que se cortan los incisivos. (B) Vista ventral que representa el mejor punto de agarrar y despegue el paladar superior (UP). (C) Vista ventral sobre la cápsula de cartílago (CC) que alberga el VNO y el hueso vómer (VB) después de la eliminación de los más bajos de la mandíbula, incisivos y el paladar. Vista (D) Dorsal de la cápsula VNO diseccionado que representa la localización bilateral de ambos VNOs (D i). La vista lateral ilustra el borde del cartílago en la parte dorsal, donde tanto VNOs necesitan ser separados (D ii). Barra de escala = 1 mm (A - D).517 / 54517fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Figura 2:. Preparación de tejidos, la grabación de la cámara y la etapa de microscopio vista lateral esquemática en un VNO para ilustrar el curso y la posición del vaso sanguíneo grande (BV) en la parte no sensorial del epitelio (A i). La línea discontinua representa la capa de corte coronal. Vista lateral de un OVN pelado fuera de la CC muestra el vaso sanguíneo (A II). (B) de agarosa embebidos rebanada coronal tejido VNO fijado a la parte inferior de la cámara de registro solución llena el uso de un ancla de acero inoxidable con cable con 0,1 mm de espesor de fibra sintética hilos (SF). El área de caja representa la agarosa que rodea la lámina de tejido. (C) Vista esquemática que ilustra la posición y orientación de un agarosa (Ag) -embedded coronal rebanada VNO colocado entre dos fibras. (D) Visión general de la cámara de grabación colocado en la platina del microscopio. La cámara está equipada con aplicación del baño (BA) para la superfusión constante con oxigenada S 2, el lápiz de perfusión (PP) para aplicar estímulos sensoriales o agentes farmacológicos, la pipeta de grabación (RP) conectado a la etapa de la cabeza del amplificador, el electrodo de referencia (RE ) y el capilar de aspiración (SC) para mantener un constante intercambio de solución en la cámara. Barra de escala = 1 mm (A II). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: TISS VNO coronalesrebanada ue. (A) Imagen confocal (proyección máxima) de una lámina de tejido 150 micras aguda coronal VNO que muestra la distribución de los fluorescentes tau-Venus neuronas FPR-RS3 + (verde) en el epitelio sensorial vomeronasal. vasos sanguíneos (BV), lumen (L), el epitelio sensorial (SE). (B) FPR-RS3 tau-Venus + neuronas exhiben una sola dendrita apical que termina en una estructura de mando-como en el borde luminal. patch-clamp grabaciones de células enteras se realizaron desde el soma VSN, parche pipeta (PP). (C) Morfología de un solo VSN con el mando dendríticas (K) en la punta de la larga y estrecha dendrita (D), el soma celular (S) y el axón (A), dejando el soma en el lado basal. Barras de escala, 50 micras (A), 10 mm (B), 5 micras (C). Esta cifra ha sido modificado a partir de 52. Por favor, haga clic aquípara ver una versión más grande de esta figura.
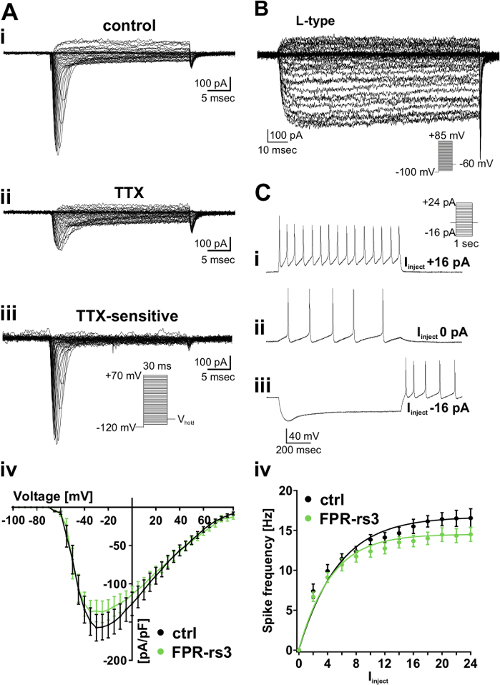
Figura 4: Aislado de voltaje de Na + y Ca 2 + corrientes, así como la descarga pico (A) trazas representativas de su conjunto de células patch-clamp grabaciones de una activación rápida corriente de Na + sensibles a TTX en FPR-RS3 + VSNS.. (A i) la grabación en incrementos de voltaje bajo condiciones de control (solución extracelular S 1; intracelular solución S 4) revela un transitorio rápido y dependiente de la tensión corriente de entrada. (A ii) el tratamiento TTX (1 M) disminuye fuertemente la corriente. Traza sustraída digital (control-TTX (A iii)) reveals la TTX sensibles al voltaje de corriente de Na +. Relaciones corriente-tensión de TTX sensibles a las corrientes de Na + aisladas de control de las neuronas y FPR-RS3 + (A iv). (B) Representante de Ca2 + trazas de corriente aislados farmacológicamente (10 M nifedipino). (C) las huellas de la abrazadera actual representativo que muestra el deshielo / hiperpolarización y los trenes de potenciales (rebote) de acción generados sobre positivo por etapas (i C) y negativo (C iii) la inyección de corriente. Tenga en cuenta la actividad espontánea medido a 0 pA inyección de corriente (C ii). (Iv C) frecuencia de disparo de control y FPR-RS3 + neuronas como una función de la corriente inyectada (I inyecto). El aumento gradual de la tasa de disparos es similar para el control dey FPR-RS3 + VSNS. Tenga en cuenta que VSNS son exquisitamente sensibles a las inyecciones de corriente incluso en las bajas oscilan picoamperes 53-56. Tenga en cuenta que las curvas f -I han sido "background-corregido" por medio de un rápido aumento de la frecuencia espontánea a 0 pA inyección de corriente. Los datos son medias ± SEM. Esta cifra ha sido modificado a partir de 52. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Extracelular grabaciones 'parche' suelta de VSNS basales (A) Imagen IR-DIC de una lámina de tejido VNO aguda que representa la pipeta de grabación en la capa basal del epitelio sensorial.. (B) Representante grabación original de un VSN basal en la configuración de conexión por células (y# 39; sueltas sello ') respondiendo con ráfagas transitorios cortos de picos para informar a estimulaciones (3 seg) con agrupados expresadas de forma recombinante principales proteínas urinarias (rMUPs) y una concentración de potasio elevada (50 mM, 1 seg), respectivamente (B i) . Mayor aumento de las grabaciones que se muestran en (B i) ilustra ráfagas de espigas en respuesta a estímulos (B II). Las barras rojas indican el tiempo de estimulación, entre estímulos intervalo = 30 seg, la grabación continua, interrupciones <1 seg (marcas de corte //). Barra de escala = 5 m (A). El panel (A) se ha modificado de referencia 38. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El VNO es una estructura chemosensory que detecta semioquímicos. Hasta la fecha, la mayoría de los receptores vomeronasal queda por deorphanized tan sólo se han identificado algunos pares receptor-ligando. Entre ellos, V1rb2 fue descrito para ser activado específicamente por la feromona urinaria 2-heptanona macho 30, V2rp5 para ser activado por el macho ESP1 feromona específica 57, así como V2r1b y V2rf2 a ser activados por los péptidos MHC SYFPEITHI 48 y SEIDLILGY 58, respectivamente. Un requisito previo para la comprensión de las relaciones de ligando de receptor y de transducción de señales es el conocimiento de las características biofísicas de las poblaciones de VSN definidas en un entorno nativo. propiedades de la membrana pasiva y activa, conductancias iónicas dependientes de voltaje y patrones de descarga del potencial de acción definen los medios y grado en que las neuronas receptoras responden a estímulos quimiosensoriales. Registros electrofisiológicos en cortes de tejido agudos y, en particular, quepatch-clamp grabaciones de células le proporcionan un excelente método para analizar estas propiedades con gran detalle.
Un paso crítico para las grabaciones fisiológicas exitosas y confiables en cortes de tejido es la preparación misma. Para maximizar el espacio de tiempo para llevar a cabo experimentos, el tejido debe ser cortado en lonchas y se transfiere a la solución oxigenada enfriada con hielo inmediatamente después de la disección. Después de eso, las rebanadas se pueden mantener durante varias horas lo que permite el análisis de un gran número de células por día experimental. Toma algo de práctica para reducir el tiempo para diseccionar e incrustar tanto VNOs de un animal en menos de 30 minutos. Después de eso, la tasa de éxito para un experimentador con experiencia para obtener varias rebanadas de tejido intacto con células viables es muy por encima de 75%. Realización de patch-clamp grabaciones es un enfoque experimental de bajo rendimiento en comparación con las imágenes de Ca2 +. Sin embargo, se permite un análisis más detallado y versátil de la actividad en el nivel de una sola célula con un temporal mucho mayorresolución. En la configuración de célula completa, el medio intracelular se dializa por la solución de la pipeta. Mientras que la solución de la pipeta puede no reflejar la composición exacta citosólica, proporciona el experimentador con control exacto sobre ambas condiciones iónicas extra e intracelulares. Para una interpretación fiable de los resultados, la monitorización continua de la resistencia acceso y la corriente de fuga es crucial. A veces, un aumento significativo o fuerte cambio en la resistencia de acceso o fugas cables de corriente a resultados no interpretables y por lo tanto exige estas grabaciones para ser desechados. Además, es importante señalar que algunos compuestos farmacológicos unen de forma irreversible los hagan necesario sustituir rebanadas después de cada grabación.
La grabación en la configuración de conexión celular impide la diálisis de componentes intracelulares y no influye en el potencial de membrana de la célula. Por lo tanto, esta técnica proporciona una forma menos invasiva y relativamente rápido de la detección. Sin embargo, esta aproACH se limita generalmente a la grabación de super-umbral de acción potenciales impulsada por corrientes capacitivas de la parte exterior de la membrana celular. Grabaciones sueltas parche han demostrado ser adecuado para analizar el comportamiento de un rápido aumento de un mayor número de neuronas sensoriales en rebanadas VNO 38,54.
El modelo transgénico empleado aquí proporciona una herramienta fiable para identificar y analizar la población de FPR-RS3 expresan VSNS. Por otra parte, la técnica descrita aquí se puede extender a otras líneas, independientemente de su genotipo. A pesar de la enorme ventaja de la investigación de un tipo de célula definida, utilizando ratones transgénicos limita experimentos a las líneas disponibles. Recientemente, sin embargo, la edición del genoma objetivo se ha vuelto más rápido y más asequible con el CRISPR / Cas9 técnica 59. En conclusión, dirigidos patch-clamp grabaciones en cortes de tejido vomeronasal agudos proporcionan un enfoque versátil para caracterizar las propiedades biofísicas y fisiológicas de un populat definidoion de las neuronas sensoriales.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We thank Ivan Rodriguez and Benoit von der Weid for generating the FPR-rs3-i-venus mouse line, their constructive criticism and fruitful discussions. This work was funded by grants of the Volkswagen Foundation (I/83533), the Deutsche Forschungsgemeinschaft (SP724/6-1) and by the Excellence Initiative of the German federal and state governments. MS is a Lichtenberg Professor of the Volkswagen Foundation.
Materiales
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose (low-gelling temperature) | PeqLab | 35-2030 | |
| ATP (Mg-ATP) | Sigma-Aldrich | A9187 | |
| Bis(2-hydroxyethyl)-2-aminoethanesulfonic acid (BES) | Sigma-Aldrich | B9879 | |
| Calcium chloride | Sigma-Aldrich | C1016 | |
| Ethylene glycol tetraacetic acid (EGTA) | Sigma-Aldrich | E3889 | |
| Glucose | Sigma-Aldrich | G8270 | |
| GTP (Na-GTP) | Sigma-Aldrich | 51120 | |
| (2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375 | |
| Magnesium chloride | Sigma-Aldrich | M8266 | |
| Potassium chloride | Sigma-Aldrich | P9333 | |
| Potassium hydroxide | Sigma-Aldrich | 03564 | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Sodium hydrogen carbonate | Sigma-Aldrich | S5761 | |
| Sodium hydroxide | Sigma-Aldrich | S8045 | |
| Name | Company | Catalog Number | Comments |
| Surgical tools and consumables | |||
| Large Petri dish, 90 mm | VWR | decapitation, dissection of VNO capsule | |
| Small Petri dish, 35 mm | VWR | lid for VNO dissection, dish for embedding in agarose | |
| Sharp large surgical scissor | Fine Science Tools | decapitation, removal of lower jaw | |
| Strong bone scissors | Fine Science Tools | cutting incisors | |
| Medium forceps, Dumont tweezers #2 | Fine Science Tools | removing skin and palate | |
| Micro spring scissors, 8.5 cm, curved, 7 mm blades | Fine Science Tools | cutting out VNO | |
| Two pairs of fine forceps, Dumont tweezers #5 | Fine Science Tools | dissecting VNO out of cartilaginous capsule | |
| Small stainless steel spatula | Fine Science Tools | handling agarose block and tissue slices | |
| Surgical scalpel | cutting agarose block into pyramidal shape | ||
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Amplifier | HEKA Elektronik | EPC-10 | |
| Borosilicate glass capillaries (1.50 mm OD/0.86 mm ID) | Science Products | ||
| CCD-camera | Leica Microsystems | DFC360FX | |
| Filter cube, excitation: BP 450-490, suppression: LP 515 | Leica Microsystems | I3 | |
| Fluorescence lamp | Leica Microsystems | EL6000 | |
| Hot plate magnetic stirrer | Snijders | 34532 | |
| Microforge | Narishige | MF-830 | |
| Micromanipulator Device | Luigs & Neumann | SM-5 | |
| Micropipette puller, vertical two-step | Narishige | PC-10 | |
| Microscope | Leica Microsystems | CSM DM 6000 SP5 | |
| Noise eliminator 50/60 Hz (HumBug) | Quest Scientific | ||
| Objective | Leica Microsystems | HCX APO L20x/1.00 W | |
| Oscilloscope | Tektronik | TDS 1001B | |
| Osmometer | Gonotec | Osmomat 030 | |
| Perfusion system 8-in-1 | AutoMate Scientific | ||
| pH Meter five easy | Mettler Toledo | ||
| Pipette storage jar | World Precision Instruments | e212 | |
| Recording chamber | Luigs & Neumann | Slice mini chamber | |
| Razor blades | Wilkinson Sword GmbH | Wilkinson Sword Classic | |
| Oxygenating slice storage chamber; alternative commercial chambers are: e.g., BSK1 Brain Slice Keeper (Digitimer) or the Pre-chamber (BSC-PC; Warner Instruments) | custom-made | ||
| Stereo microscope | Leica Microsystems | S4E | |
| Trigger interface | HEKA Elektronik | TIB-14 S | |
| Vibratome | Leica Microsystems | VT 1000 S | |
| Water bath | Memmert | WNB 45 |
Referencias
- Firestein, S. How the olfactory system makes sense of scents. Nature. 413 (6852), 211-218 (2001).
- Mombaerts, P. Genes and ligands for odorant, vomeronasal and taste receptors. Nat. Rev. Neurosci. 5 (4), 263-278 (2004).
- Fuss, S. H., Omura, M., Mombaerts, P. The Grueneberg ganglion of the mouse projects axons to glomeruli in the olfactory bulb. Eur. J. Neurosci. 22 (10), 2649-2654 (2005).
- Roppolo, D., Ribaud, V., Jungo, V. P., Lüscher, C., Rodriguez, I. Projection of the Grüneberg ganglion to the mouse olfactory bulb. Eur. J. Neurosci. 23 (11), 2887-2894 (2006).
- Adams, D. R. Fine structure of the vomeronasal and septal olfactory epithelia and of glandular structures. Microsc. Res. Tech. 23 (1), 86-97 (1992).
- Ma, M., et al. Olfactory signal transduction in the mouse septal organ. J. Neurosci. 23 (1), 317-324 (2003).
- Dulac, C., Torello, A. T. Molecular detection of pheromone signals in mammals: from genes to behaviour. Nat. Rev. Neurosci. 4 (7), 551-562 (2003).
- Luo, M., Katz, L. C. Encoding pheromonal signals in the mammalian vomeronasal system. Curr. Opin. Neurobiol. 14 (4), 428-434 (2004).
- Brennan, P. A., Kendrick, K. M. Mammalian social odours: attraction and individual recognition. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 361 (1476), 2061-2078 (2006).
- Tirindelli, R., Dibattista, M., Pifferi, S., Menini, A. From Pheromones to Behavior. Physiol. Rev. 89, 921-956 (2009).
- Jacobson, L., Trotier, D., Doving, K. B. Anatomical description of a new organ in the nose of domesticated animals by Ludvig Jacobson (1813). Chem. Senses. 23 (6), 743-754 (1998).
- Keverne, E. B. The Vomeronasal Organ. Science. 286 (5440), 716-720 (1999).
- Breer, H., Fleischer, J., Strotmann, J. The sense of smell: multiple olfactory subsystems. Cell. Mol. Life Sci. C. 63 (13), 1465-1475 (2006).
- Liberles, S. D. Mammalian pheromones. Annu. Rev. Physiol. 76, 151-175 (2014).
- Meredith, M., O'Connell, R. J. Efferent control of stimulus access to the hamster vomeronasal organ. J. Physiol. 286, 301-316 (1979).
- Pankevich, D., Baum, M. J., Cherry, J. A. Removal of the superior cervical ganglia fails to block Fos induction in the accessory olfactory system of male mice after exposure to female odors. Neurosci. Lett. 345 (1), 13-16 (2003).
- Giacobini, P., Benedetto, A., Tirindelli, R., Fasolo, A. Proliferation and migration of receptor neurons in the vomeronasal organ of the adult mouse. Brain Res. Dev. Brain Res. 123 (1), 33-40 (2000).
- Coppola, D. M., O'Connell, R. J. Stimulus access to olfactory and vomeronasal receptors in utero. Neurosci. Lett. 106 (3), 241-248 (1989).
- Hovis, K. R., et al. Activity Regulates Functional Connectivity from the Vomeronasal Organ to the Accessory Olfactory Bulb. J. Neurosci. 32 (23), 7907-7916 (2012).
- Mucignat-Caretta, C. The rodent accessory olfactory system. J. Comp. Physiol. A Neuroethol. Sensory, Neural, Behav. Physiol. 196 (10), 767-777 (2010).
- Jia, C., Halpern, M. Subclasses of vomeronasal receptor neurons: differential expression of G proteins (Giα2 and G(αo)) and segregated projections to the accessory olfactory bulb. Brain Res. 719 (1-2), 117-128 (1996).
- Del Punta, K., Puche, C. A., Adams, N. C., Rodriguez, I., Mombaerts, P. A divergent pattern of sensory axonal projections is rendered convergent by second-order neurons in the accessory olfactory bulb. Neuron. 35 (6), 1057-1066 (2002).
- Belluscio, L., Koentges, G., Axel, R., Dulac, C. A map of pheromone receptor activation in the mammalian brain. Cell. 97 (2), 209-220 (1999).
- Rodriguez, I., Feinstein, P., Mombaerts, P. Variable patterns of axonal projections of sensory neurons in the mouse vomeronasal system. Cell. 97 (2), 199-208 (1999).
- Rivière, S., Challet, L., Fluegge, D., Spehr, M., Rodriguez, I. Formyl peptide receptor-like proteins are a novel family of vomeronasal chemosensors. Nature. 459 (7246), 574-577 (2009).
- Martini, S., Silvotti, L., Shirazi, A., Ryba, N. J. P., Tirindelli, R. Co-expression of putative pheromone receptors in the sensory neurons of the vomeronasal organ. J. Neurosci. 21 (3), 843-848 (2001).
- Matsuoka, M., et al. Immunocytochemical study of Gi2alpha and Goalpha on the epithelium surface of the rat vomeronasal organ. Chem. Senses. 26 (2), 161-166 (2001).
- Dulac, C., Torello, A. T. Molecular detection of pheromone signals in mammals: from genes to behaviour. Nat. Rev. Neurosci. 4 (7), 551-562 (2003).
- Leinders-Zufall, T., et al. Ultrasensitive pheromone detection by mammalian vomeronasal neurons. Nature. 405 (6788), 792-796 (2000).
- Boschat, C., et al. Pheromone detection mediated by a V1r vomeronasal receptor. Nat. Neurosci. 5 (12), 1261-1262 (2002).
- Novotny, M. V. Pheromones, binding proteins and receptor responses in rodents. Biochem. Soc. Trans. 31, 117-122 (2003).
- Nodari, F., et al. Sulfated steroids as natural ligands of mouse pheromone-sensing neurons. J. Neurosci. 28 (25), 6407-6418 (2008).
- Isogai, Y., et al. Molecular organization of vomeronasal chemoreception. Nature. 478 (7368), 241-245 (2011).
- Leinders-Zufall, T., et al. MHC class I peptides as chemosensory signals in the vomeronasal organ. Science. 306 (5698), 1033-1037 (2004).
- Chamero, P., et al. Identification of protein pheromones that promote aggressive behaviour. Nature. 450 (7171), 899-902 (2007).
- Kimoto, H., Haga, S., Sato, K., Touhara, K. Sex-specific peptides from exocrine glands stimulate mouse vomeronasal sensory neurons. Nature. 437 (7060), 898-901 (2005).
- Ferrero, D. M., et al. A juvenile mouse pheromone inhibits sexual behaviour through the vomeronasal system. Nature. 502 (7471), 368-371 (2013).
- Kaur, A. W., et al. Murine pheromone proteins constitute a context-dependent combinatorial code governing multiple social behaviors. Cell. 157 (3), 676-688 (2014).
- Ben-Shaul, Y., Katz, L. C., Mooney, R., Dulac, C. In vivo vomeronasal stimulation reveals sensory encoding of conspecific and allospecific cues by the mouse accessory olfactory bulb. PNAS. 107 (11), 5172-5177 (2010).
- Kimoto, H., et al. Sex- and strain-specific expression and vomeronasal activity of mouse ESP family peptides. Curr. Biol. 17 (21), 1879-1884 (2007).
- Spehr, M., et al. Parallel processing of social signals by the mammalian main and accessory olfactory systems. Cell. Mol. Life Sci. C. 63 (13), 1476-1484 (2006).
- Chamero, P., et al. G protein G{alpha}o is essential for vomeronasal function and aggressive behavior in mice. PNAS. , (2011).
- Bufe, B., Schumann, T., Zufall, F. Formyl peptide receptors from immune and vomeronasal system exhibit distinct agonist properties. J. Biol. Chem. 287 (40), 33644-33655 (2012).
- Bozza, T., Feinstein, P., Zheng, C., Mombaerts, P. Odorant receptor expression defines functional units in the mouse olfactory system. J. Neurosci. 22 (8), 3033-3043 (2002).
- Grosmaitre, X., Vassalli, A., Mombaerts, P., Shepherd, G. M., Ma, M. Odorant responses of olfactory sensory neurons expressing the odorant receptor MOR23: a patch clamp analysis in gene-targeted mice. PNAS. 103 (6), 1970-1975 (2006).
- Oka, Y., et al. Odorant receptor map in the mouse olfactory bulb: in vivo sensitivity and specificity of receptor-defined glomeruli. Neuron. 52 (5), 857-869 (2006).
- Ukhanov, K., Leinders-Zufall, T., Zufall, F. Patch-clamp analysis of gene-targeted vomeronasal neurons expressing a defined V1r or V2r receptor: ionic mechanisms underlying persistent firing. J. Neurophysiol. 98 (4), 2357-2369 (2007).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12 (12), 1551-1558 (2009).
- Pacifico, R., Dewan, A., Cawley, D., Guo, C., Bozza, T. An olfactory subsystem that mediates high-sensitivity detection of volatile amines. Cell Rep. 2 (1), 76-88 (2012).
- Veitinger, S., et al. Purinergic signalling mobilizes mitochondrial Ca2+ in mouse Sertoli cells. J. Physiol. 589 (Pt 21), 5033-5055 (2011).
- Kaur, A. W., et al. Murine pheromone proteins constitute a context-dependent combinatorial code governing multiple social behaviors. Cell. 157 (3), 676-688 (2014).
- Ackels, T., von der Weid, B., Rodriguez, I., Spehr, M. Physiological characterization of formyl peptide receptor expressing cells in the mouse vomeronasal organ. Front. Neuroanat. 8, 1-13 (2014).
- Liman, E. R., Corey, D. P. Electrophysiological characterization of chemosensory neurons from the mouse vomeronasal organ. J. Neurosci. 16 (15), 4625-4637 (1996).
- Cichy, A., et al. Extracellular pH Regulates Excitability of Vomeronasal Sensory Neurons. J. Neurosci. 35 (9), 4025-4039 (2015).
- Shimazaki, R., et al. Electrophysiological properties and modeling of murine vomeronasal sensory neurons in acute slice preparations. Chem. Senses. 31 (5), 425-435 (2006).
- Hagendorf, S., Fluegge, D., Engelhardt, C., Spehr, M. Homeostatic control of sensory output in basal vomeronasal neurons: activity-dependent expression of ether-à-go-go-related gene potassium channels. J. Neurosci. 29 (1), 206-221 (2009).
- Haga, S., et al. The male mouse pheromone ESP1 enhances female sexual receptive behaviour through a specific vomeronasal receptor. Nature. 466 (7302), 118-122 (2010).
- Leinders-Zufall, T., et al. A family of nonclassical class I MHC genes contributes to ultrasensitive chemodetection by mouse vomeronasal sensory neurons. J. Neurosci. 34 (15), 5121-5133 (2014).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337, 816-821 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados