Method Article
En profondeur Physiological Analyse des populations de cellules définies dans le tissu Tranches aiguë de l'Vomeronasal Organ Souris
Dans cet article
Résumé
Here, we describe a physiological approach that allows identification and in-depth analysis of a defined population of sensory neurons in acute coronal tissue slices of the mouse vomeronasal organ using whole-cell patch-clamp recordings.
Résumé
In most mammals, the vomeronasal organ (VNO) is a chemosensory structure that detects both hetero- and conspecific social cues. Vomeronasal sensory neurons (VSNs) express a specific type of G protein-coupled receptor (GPCR) from at least three different chemoreceptor gene families allowing sensitive and specific detection of chemosensory cues. These families comprise the V1r and V2r gene families as well as the formyl peptide receptor (FPR)-related sequence (Fpr-rs) family of putative chemoreceptor genes. In order to understand the physiology of vomeronasal receptor-ligand interactions and downstream signaling, it is essential to identify the biophysical properties inherent to each specific class of VSNs.
The physiological approach described here allows identification and in-depth analysis of a defined population of sensory neurons using a transgenic mouse line (Fpr-rs3-i-Venus). The use of this protocol, however, is not restricted to this specific line and thus can easily be extended to other genetically modified lines or wild type animals.
Introduction
La plupart des animaux comptent beaucoup sur leurs sens chimiques pour interagir avec leur environnement. Le sens de l'odorat joue un rôle essentiel pour la recherche et l'évaluation des aliments, éviter les prédateurs et la recherche de partenaires d'accouplement appropriés. Dans la plupart des mammifères, le système olfactif est constitué d'au moins quatre sous - systèmes anatomiquement et fonctionnellement distincts périphériques: l'épithélium olfactif principal 1,2, 3,4 ganglion Grueneberg, l'organe septale Masera 5,6 et l'organe voméronasal. Le VNO comprend la structure sensorielle périphérique du système olfactif accessoire (AOS), qui joue un rôle majeur dans la détection des signaux chimiques qui transmettent des informations sur l' identité, le sexe, le rang social et de l' état sexuel 7-10. Le VNO est situé à la base de la cloison nasale juste au-dessus du palais. Chez la souris, il est un tube borgne se terminant bilatéral enfermées dans une capsule cartilagineuse 13/11. L'organe se compose de deux un épithélium sensoriel médial en forme de croissantlium qui abrite les VSN et d'une partie non-sensorielle sur le côté latéral. Entre les deux épithéliums se trouve une lumière de mucus rempli qui est relié à la cavité nasale par l'intermédiaire du voméronasal canal étroit 14. Un grand vaisseau sanguin latéral dans le tissu non-sensorielle fournit un mécanisme de pompage vasculaire pour faciliter l' entrée des molécules relativement grandes, essentiellement non volatiles , tels que des peptides ou de petites protéines dans la lumière à travers VNO pression négative 15,16. Les composants structurels du VNO sont présents à la naissance et l'organe atteint la taille adulte , peu avant la puberté 17. Toutefois, si l'AOS de rongeur est déjà fonctionnelle chez les juvéniles est encore sujette à débat 18-20.
VSN se distinguent à la fois par leur localisation epitheliale et du type de récepteur qu'elles expriment. VSN présentent une morphologie bipolaire avec un axone non myélinisées et un seul dendrite apicale qui fait saillie vers la lumière et se termine par un bouton microvillositaire dendritique. VSN axons fasciculate pour former le nerf voméronasal qui laisse la capsule cartilagineuse à la fin dorso-caudale, monte le long du septum, passe la lame criblée et les projets vers le bulbe olfactif accessoire (AOB) 21,22. L'épithélium sensoriel voméronasal se compose de deux couches: la couche apicale est située plus près du côté luminal et les deux ports V1R- et tous sauf un type de FPR-rs-exprimant les neurones. Ces neurones coexpriment du G-protéine α-unité Gai2 et projet à la partie antérieure de l'AOB 23-25. Les neurones sensoriels situés dans les V2Rs express de la couche basale plus ou TFP-RS1 aux côtés G et ao envoient leurs axones dans la région postérieure de l'AOB 26-28.
Les neurones sont susceptibles voméronasal activés par plutôt petits (29-33 sémiochimiques V1Rs) ou les composés protéiniques (34-38 V2Rs) qui sont sécrétées dans divers fluides corporels tels que l' urine, la salive et le fluide se déchirent 37,39-41 . Dans les expériences in situ ont montré que VSN sont également activés par des peptides formylés et divers / inflammation liée à des composés antimicrobiens 25,42. En outre, hétérologue exprimé les protéines du FPR-rs partagent des spectres agonistes avec FPRS exprimés dans le système immunitaire, ce qui indique un rôle potentiel en tant que détecteurs pour la maladie dans leurs congénères ou sources alimentaires gâtés 25 (voir référence 43).
Fondamental pour la compréhension des relations de récepteur-ligand et des cascades de signalisation en aval des populations VSN spécifiques est une évaluation détaillée de leurs caractéristiques biophysiques de base dans un environnement natif. Dans le passé, l'analyse de la signalisation cellulaire a grandement bénéficié d'animaux génétiquement modifiés qui marquent une population définie de neurones par coexpression d' une protéine marqueur fluorescent 30,44-49. Dans ce protocole, une lignée de souris transgénique qui exprime FPR-RS3 conjointement avec un marqueur fluorescent (Fpr-RS3-i-Venus) est utilisé.Cette approche illustre comment utiliser une telle souche de souris génétiquement modifiées pour effectuer une analyse électrophysiologique d'une population de cellules optiquement identifiable à l'aide unique neurone patch-clamp enregistrements dans des tranches de tissu VNO coronales aiguës. Une pression axée sur l'air système de perfusion multi-corps pour des stimuli sensoriels et agents pharmacologiques permet la stimulation neuronale rapide, réversible et focale ou inhibition pendant les enregistrements. enregistrements de cellules entières dans des préparations de tranche permettent une analyse détaillée des propriétés intrinsèques, conductances de tension activé, ainsi que les modes de décharge potentiels d'action dans l'environnement natif de la cellule.
Protocole
Toutes les procédures animales étaient en conformité avec la législation locale et l'Union européenne sur la protection des animaux utilisés à des fins expérimentales (directive 86/609 / CEE) et des recommandations formulées par la Fédération des animaux de laboratoire Associations Européennes de Sciences (FELASA). Les deux souris C57BL / 6 et souris Fpr-RS3-i-Vénus ont été logés dans des groupes des deux sexes à la température ambiante sur un 12 h cycle lumière / obscurité avec de la nourriture et de l' eau ad libitum. Pour les expériences de jeunes adultes (6-20 semaines) des deux sexes ont été utilisés. Aucune différence entre les sexes dépendant évidentes ont été observées.
1. Préparation de la solution
- Préparer une solution extracellulaire S 1: 4- (2-hydroxy-éthyl) pipérazine-1-éthanesulfonique (HEPES) solution tampon contenant extracellulaire (en mM) 145 NaCl, 5 KCl, 1 CaCl2, 1 MgCl2, 10 HEPES; pH = 7,3 (ajusté avec NaOH); osmolarité = 300 mOsm (ajusté avec du glucose).
- Préparer extracellulaire solution S2: carbogène désoxygéné (95% O 2, 5% CO 2) contenant une solution extracellulaire (en mM) 125 NaCl, 25 NaHCO 3, 5 KCl, 1 CaCl2, 1 MgSO4, 5 BES; pH = 7,3; osmolarité = 300 mOsm (ajusté avec du glucose).
- Préparer une solution d'agarose à 4% de faible gélification (S 3) pour l' incorporation de tissu: 4% à faible température de gélification d' agarose. Dissoudre 2 g de faible gélification agarose dans 50 ml de S 1 dans un 100 ml laboratoire de bouteille en verre avec un agitateur magnétique. Pour faire fondre l'agarose, mettre la bouteille dans un bain d'eau (avec couvercle pas hermétiquement fermé) à 70 ° C pendant environ 20 min ou jusqu'à ce que la solution devient transparente tout en remuant. Refroidir et conserver agarose fondu dans un second bain d'eau à 42 ° C jusqu'à utilisation ultérieure.
- Préparer une solution intracellulaire S 4: Solution Pipette contenant (en mM) 143 KCl, KOH 2, 1 EGTA, 0,3 CaCl2 (Ca2 + libre = 110 nM), 10 HEPES, 2 MgATP, 1 NaGTP;pH = 7,1 (ajusté avec KOH); osmolarité = 290 mOsm.
- Modifier / adapter la composition du S 1, S 2 et S 4 en fonction de la conception expérimentale individuel (par exemple, les inhibiteurs pharmacologiques pour isoler certains types de courants de tension activés).
2. Espace de travail Préparation
- Remplissez oxygénant chambre de tranche stockage avec S 2 au moins 30 min avant la dissection, le lieu sur la glace pour le réglage de la température et de pH et de la solution oxygéné en permanence.
- Remplir le réservoir de tranche surfusion à la configuration d' enregistrement avec S 2 et oxygéner en continu.
- Avant la dissection, remplir vibratome chambre avec S 2 et arranger la glace pilée autour de la chambre. Vous pouvez également transférer la solution oxygénée de glace froide de secours de la chambre oxygénant dans vibratome chambre et garder oxygénant en continu.
- Disposer des outils chirurgicaux et consommables.
- Placer le sachet de gel de glace sous la dissectionmicroscope, couvrir avec une serviette en papier pour éviter que le tissu VNO du gel au fond du plat.
- Nettoyer la lame de rasoir par un bref rinçage à l'éthanol à 70% et de l'eau distillée et monter à vibratome. Remplacer pour chaque session de tranchage.
3. VNO Dissection and Embedding
- Sacrifiez animaux brève exposition au CO 2 et décapitent en utilisant des ciseaux chirurgicaux tranchants. Remarque: Comme le temps de sacrifier l'animal à mettre la capsule VNO sur la glace est critique, minimiser le temps à moins de 2 min. Pour maintenir la viabilité des tissus, incorporer à la fois complètement disséqué VNO dans de l'agarose en moins de 30 min.
- Retirer la mâchoire inférieure avec de grands ciseaux chirurgicaux. Entrez par la cavité buccale et de couper les os mandibule et les muscles de chaque côté séparément.
- Placez la partie restante de la tête à l'envers dans la grande boîte de Pétri.
- Tirez loin la peau de la mâchoire supérieure et autour de la pointe du nez avec une pince moyenne pour obtenir un meilleur accès à laincisives.
- Utilisez des ciseaux d'os pour couper la plus grande partie des incisives à un angle de 45 ° ~ dans le sens rostral (figure 1A). Cela facilitera le retrait de la capsule VNO de la cavité nasale.
Note: Ne pas couper à la racine de la dent pour éviter d'endommager la pointe de la capsule VNO. - Prenez le palais supérieur rigide à sa partie rostrale avec une pince à moyen et éplucher soigneusement en un seul morceau à un angle plat (figure 1B).
Remarque: À plusieurs reprises rincer avec de la glace froide S 2. - Utilisez micro ciseaux à ressort pour couper la fusion osseuse entre la pointe de l'os vomer et la mâchoire. Insérez les pointes de ciseaux avec la partie courbe de la pointe pointant vers l'extérieur loin de la VNO et soigneusement couper l'os en petites étapes à la fois sur la gauche et à droite de côté latéral de la capsule VNO.
- Pour retirer la capsule VNO, utiliser des micro ciseaux à ressort pour couper à travers l'os vomer à la partie caudale et soulevez délicatement l'os vomer de la ncavité asal en utilisant une pince moyenne. transférer immédiatement le VNO à une petite boîte de Pétri sous un microscope stéréo sur un pack de gel de glace où les étapes restantes de la dissection seront effectuées.
- Rincer le VNO dans une petite quantité de glace-froid S 2 pour empêcher le tissu de se dessécher.
- Séparer les capsules cartilagineuses qui contiennent les tissus mous VNO en saisissant l'arrière de l'os vomer avec une pince moyenne. Positionner la capsule pour une vue dorsale de sorte qu'une scission entre les deux VNO devient visible (figure 1D i).
- Utilisez la pointe d'une pince fine pour séparer les deux capsules de cartilage VNO de l'os central tout en gardant l'os vomer coincé dans la partie arrière.
Remarque: Utilisez une pince seulement au bord de la capsule du cartilage et être très prudent de ne pas percer le cartilage comme l'épithélium sensoriel délicat est facilement endommagé. - Une fois que les deux VNO sont séparés, commencer à enlever le cartilage encapsuler les sapinst VNO.
- Prenez le rebord supérieur de la capsule avec une pince fine et de diviser l'écart de la paroi du cartilage qui a été précédemment attaché à l'os vomer (côté médial).
- Pour enlever le cartilage restant tourner le VNO avec son côté latéral incurvé vers le bas du plat et solidement cerner le cartilage d'un côté à l'aide de pinces. Déplacez doucement la deuxième pince fine de la face arrière à un angle très plat entre le cartilage et VNO pour desserrer la connexion entre le tissu et le cartilage.
- Lentement peler le VNO loin du cartilage en le tenant à son extrémité caudale, pour éviter d'endommager l'épithélium sensoriel.
- Une fois que le VNO est levered de la capsule, assurez-vous d'enlever toutes les petites pièces de cartilage restants comme tous les morceaux de cartilage va détacher le tissu à partir entourant agarose pendant le processus de tranchage.
- Placer une petite goutte de glace-froid S 2 sur le premier VNO disséqué pour éviter des dommages aux tissus. Un gros vaisseau sanguin sur le côté latéral will deviennent visibles indiquant que l'organe est encore intact et n'a pas été gravement endommagé lors de la dissection (figure 2A ii). Dans le cas où le vaisseau sanguin a été endommagé, il sera toujours utile de poursuivre le tranchage du VNO aussi longtemps que la morphologie globale n'a pas été altérée clairement.
- disséquer immédiatement la deuxième VNO.
- Pour intégrer le VNO, remplissez les deux petites boîtes de Pétri à la jante avec S fondu 3 (stocké dans un bain d'eau à 42 ° C; voir 1.3).
- Tenez le VNO sur l'extrémité caudale plus large avec une pince fine pour éviter d'endommager l'épithélium sensoriel.
- Immerger le VNO dans l'agarose et le déplacer horizontalement d'avant en arrière plusieurs fois pour enlever le film de la solution extracellulaire, ainsi que les bulles d'air de sa surface.
- Positionner le VNO verticalement avec la pointe caudale tournée vers le fond du plat. Au lieu de pincer le VNO avec la pince directement, ajuster l'orientation en déplaçant la pointe de pince en étroite proximité du VNO.
Note: Orientation lors de l'incorporation est cruciale car elle détermine plan de coupe et de l'accessibilité aux neurones sensoriels pendant l'expérience. - Placez les plats sur la banquise de gel et d'attendre jusqu'à ce que l'agarose est solidifié.
Note: Ne pas modifier l'orientation VNO une fois que l'agarose a commencé à solidifier car cela détacher le tissu de l'agarose environnant.
4. Coronal VNO Tissue Slicing
- Utiliser une petite spatule pour retirer le bloc d'agarose du petit plat dans le couvercle d'une grande boîte de Pétri, retourner l'agarose à l'envers en laissant sur la pointe caudale du VNO vers le haut.
- Couper le bloc en une forme pyramidale à l'aide d'un scalpel chirurgical (3-4 mm à la pointe, 8-10 mm en bas). Prenez soin de ne pas endommager le tissu enrobé.
- Utilisez super glue pour fixer le bloc en forme de pyramide au centre de la plaque d'échantillon vibratome et attendre ~ 1 min pour la colle sécher complètement.
- Transférer la plaque d'échantillon au tranchage chambre et de préparer la deuxième VNO, en conséquence. Maintenir la plaque avec le deuxième spécimen à 4 ° C jusqu'à utilisation.
- Utilisez un microtome à lame vibrante avec les paramètres suivants: épaisseur: 150-200 pm; Vitesse: 3,5 au = 0,15 mm / s; fréquence: 7,5 au = 75 Hz. Transférer les tranches à la chambre oxygénant jusqu'à utilisation après avoir inspecté brièvement tranche la morphologie sous le microscope de dissection. Les tranches peuvent être conservés pendant plusieurs heures.
5. unicellulaires électrophysiologiques Recordings
- Pour les enregistrements, utiliser un microscope de stade montant fixe équipé d'objectifs d'immersion en eau, Dodt ou infrarouge interférant différentiel contraste (IR-DIC) et epi-fluorescence ainsi qu'une caméra CCD refroidie. Pour l'acquisition des données, utiliser un amplificateur de patch-clamp, le stade de la tête, AD / DA carte d'interface et un PC (y compris les logiciels d'enregistrement).
- Préparer un stock de 10-20 pipettes de patch (4-7 mQ). pipettes Pull de capillaires en verre borosilicate (1,50 mm OD / 0,86 mm ID) USINga micropipette extracteur et le feu-polir avec un microforge.
Remarque: Fire polissage des embouts de pipette est crucial quand patcher les plutôt petites VSN. Cela aidera à éviter la rupture de la membrane cellulaire lors de l'application de pression négative afin d'obtenir un joint haute résistance. Après le polissage de l'ouverture de la pipette doit être d'environ 1 pm. - Maintenir les pipettes dans un récipient de stockage de la pipette pour éviter tout dommage et de l'accumulation de poussière jusqu'à son utilisation.
- Préparer le système de perfusion en remplissant les réservoirs de solution et de tubes selon la conception expérimentale.
Remarque: Retirer les bulles d'air à partir de tubes car ils vont fortement interférer avec les enregistrements électrophysiologiques. - Régler la pression pour atteindre ~ 3 ml / écoulement min.
Remarque: Les hautes pressions vont provoquer un mouvement de la tranche de tissu, ainsi que la fin des enregistrements électrophysiologiques. - Transfert VNO tranche à la chambre d'imagerie et fixer la position de tranche en utilisant l'ancre en acier inoxydable câblé avec 0,1 mm d'épaisseur syntfibres HETIC (Figure 2B - C).
Remarque: Ne couvrez pas la tranche de tissu avec l'un des fils de fibre synthétique, mais plutôt l'agarose entourant la tranche. - Chambre d'imagerie de transfert pour enregistrer la configuration et tranche en continu superfuse avec S oxygénée 2 à température ambiante par l' intermédiaire d' une application de bain.
- Ajuster le capillaire d'aspiration à la surface de la solution pour créer une aspiration constante lente pour un échange de solution de bain. Réglez le 8-en-1 multi-tonneau "crayon de perfusion» ci - dessus et à proximité de la partie non-sensorielle de la tranche VNO qui contient le vaisseau sanguin (figure 2C, 3A) 50. Il sera bénéfique pour organiser un crayon de perfusion et l'enregistrement pipette pour être en face de la tranche à partir des directions opposées.
- Connecter l'électrode de référence et la solution de bain à l'aide d'un pont d'agar en forme de L (rempli de 150 mM de KCl).
- Remplir la pipette en patch avec une solution de pipette S 4.
- Monter la pipette sur l'électrode de patch de chlorure revêtu d'argent relié à l'étage de la tête sans gratter le revêtement et fixer solidement.
- Appliquer une légère pression positive (environ 1 ml sur une seringue en plastique de 10 ml) à la pipette de patch avant d'entrer dans le bain.
- Abaisser la pipette dans le bain à l' aide assez loin manipulateurs micro pour pouvoir plonger l'objectif sans frapper (figure 2D).
- Surveiller la résistance de la pipette (R pip, entre 4-7 MQ) en utilisant le logiciel d'électrophysiologie connecté à l'étage de la tête.
Remarque: Si R pip est <4 MQ la pointe de verre est cassé. Si R pip est> 10 MQ, la pointe est très probablement bouché et la pipette doit être remplacé. - Visualisez la tranche VNO avec une caméra CCD en utilisant le contraste d'interférence différentiel infrarouge optimisé (DIC) et identifier FPR-RS3-i-Venus des cellules exprimant (ou similaire neurones marqués) en utilisant un éclairage à fluorescenceet un cube de filtre approprié.
- Focalisation et fluorescent cible ou des cellules non fluorescentes en fonction de la conception expérimentale.
- Pour approcher le corps cellulaire, utiliser des roues à main pour une sensibilité maximale. En raison de la pression positive, une petite brèche dans la membrane cellulaire soma devient visible une fois que la pointe de la pipette se trouve à proximité.
- Relâchez la pression positive et appliquer une légère pression négative pour aspirer dans la membrane cellulaire afin d'obtenir un joint de haute résistance (1-20 GQ). Appliquer courte et douce d'aspiration pour perturber la membrane cellulaire et à établir la configuration de cellule entière.
- Surveiller la résistance d'accès en permanence pendant l'expérience.
Remarque: Inclure seulement les neurones présentant une résistance d'accès petite et stable (≤3% de l' entrée R; le changement <20% par rapport au cours de l'expérience) dans l' analyse.
Résultats
Pour mieux comprendre les propriétés biophysiques et physiologiques des populations cellulaires définies, nous effectuons des coupes de tissu coronales aiguës de la souris VNO (Figure 1 - 2). Après dissection, les tranches peuvent être conservés dans oxygénée solution extracellulaire glacée (S 2) pour plusieurs heures. A la configuration de l' enregistrement, un échange constant avec une solution oxygénée frais (figure 2D) assure la viabilité des tissus tout au long de l'expérience. Nous employons ici un modèle de souris transgénique (TFP-RS3-i-Vénus). VSN dans cette souche coexprimer une protéine marqueur fluorescent avec FPR-RS3, un membre prototypique de la famille des gènes du FPR-rs (Figure 3) permettant une identification optique d'une population définie de neurones sensoriels. Les enregistrements électrophysiologiques fournissent les moyens pour une analyse en profondeur au niveau d'une seule cellule. Par exemple, l'analyse des courants de voltage-dépendants est effectuée en voltage-clampMode (figure 4A - B). Pour isoler des types spécifiques de courants ioniques, les tranches sont perfusées avec des agents pharmacologiques tels que la TTX à inhiber les courants de voltage-dépendants de Na + (figure 4A) ou la nifedipine pour bloquer voltage-dépendants de type L Ca2 + courants (figure 4B). De plus, nous effectuons régulièrement des enregistrements de cellules entières dans la configuration de pince de courant pour analyser les modèles de décharge potentiels d'action (figure 4C). En plus des enregistrements de cellules entières, des enregistrements cellule attachée »lâche-joint» fournissent une méthode moins invasive qui empêche la dialyse des composants intracellulaires (figure 5A). Potentiel conduit d'action Enregistrement courants capacitifs lors de l' application à court stimulus offre un moyen sensible et efficace pour dépister les ligands sensoriels (par exemple, les principales protéines urinaires; SPMI) qui activent des populations de cellules 51 (figure 5B) définis.
= "Jove_content" fo: keep-together.within-page = "1"> 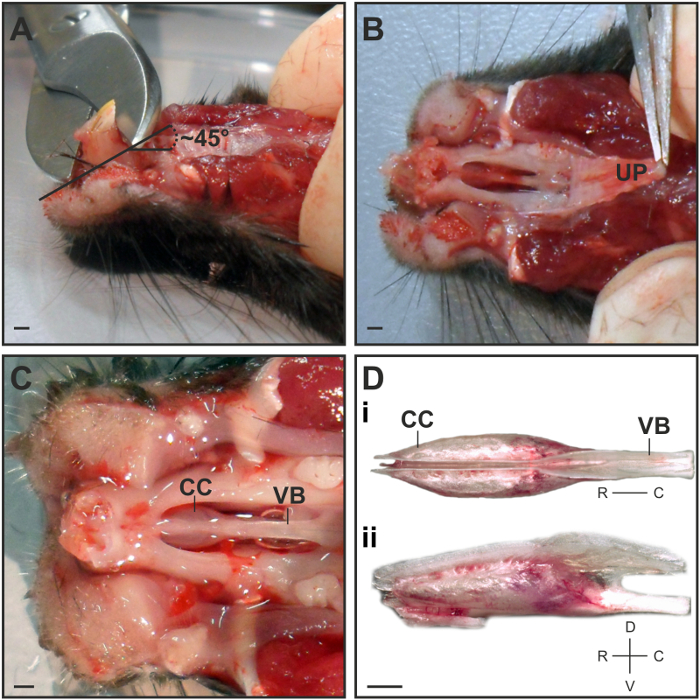
Figure 1: Dissection du VNO. (A) Vue latérale sur la tête de la souris pour illustrer la position et l' angle auquel les incisives sont coupées. (B) Vue ventrale représentant le meilleur point de saisir et de peler le palais supérieur (UP). (C) Vue ventrale sur le cartilage capsule (CC) qui abrite le VNO et l'os vomer (VB) après avoir enlevé les faibles mâchoires, les incisives et les palais. Vue (D) Dorsale de la capsule VNO disséqués représentant la localisation bilatérale des deux VNO (D i). La vue latérale illustre le rebord du cartilage sur la face dorsale où les deux VNO doivent être séparés (D II). Barre d' échelle = 1 mm (A - D).517 / 54517fig1large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2:. Préparation des tissus, la chambre et le stade de microscope enregistrement vue latérale schématique sur un VNO pour illustrer le cours et la position du gros vaisseau sanguin (BV) dans la partie non-sensorielle de l'épithélium (A i). La ligne pointillée représente la couche de coupe coronale. Vue latérale sur une VNO pelé hors de la CC montre le vaisseau sanguin (A II). (B) Agarose incorporé coronale tranche de tissu VNO fixé au fond de la chambre d'enregistrement solution remplis à l' aide d' une ancre en acier inoxydable câblé avec 0,1 mm d' épaisseur en fibres synthétiques (SF) des fils. La zone encadrée représente l'agarose entourant la tranche de tissu. (C) Vue schématique illustrant la position et l'orientation d'un agarose (Ag) -embedded coronale tranche VNO positionné entre deux fibres. (D) Vue d'ensemble de la chambre d'enregistrement placé sur la platine du microscope. La chambre est équipée d'application de bain (BA) pour surfusion constante avec S 2, le crayon de perfusion oxygéné (PP) pour appliquer des stimuli sensoriels ou des agents pharmacologiques, la pipette d'enregistrement (RP) connecté à l'étage de tête de l' amplificateur, l'électrode de référence (RE ) et le capillaire d'aspiration (SC) afin de maintenir un échange constant de la solution dans la chambre. Barre d' échelle = 1 mm (A ii). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3: tiss VNO coronalesue tranche. (A) d'image confocale (projection maximum) d'un coronale tranche de tissu aiguë VNO 150 um montrant la répartition des tau-Vénus + neurones FPR-RS3 fluorescent (vert) dans l'épithélium sensoriel voméronasal. Vaisseau sanguin (BV), la lumière (L), de l'épithélium sensoriel (SE). Neurones (B) TFP-RS3 tau-Vénus + présentent un seul dendrite apical se terminant dans une structure de bouton ressemblant à la frontière luminal. Whole-cell patch-clamp enregistrements ont été effectués à partir du soma VSN, pipette de patch (PP). (C) Morphologie d'un seul VSN avec le bouton dendritique (K) à la pointe de la longue et étroite dendrites (D), le soma cellulaire (S) et l'axone (A) en laissant le soma du côté basal. Les barres d'échelle, 50 pm (A), 10 um (B), 5 um (C). Ce chiffre a été modifié à partir de 52. S'il vous plaît cliquez icipour voir une version plus grande de cette figure.
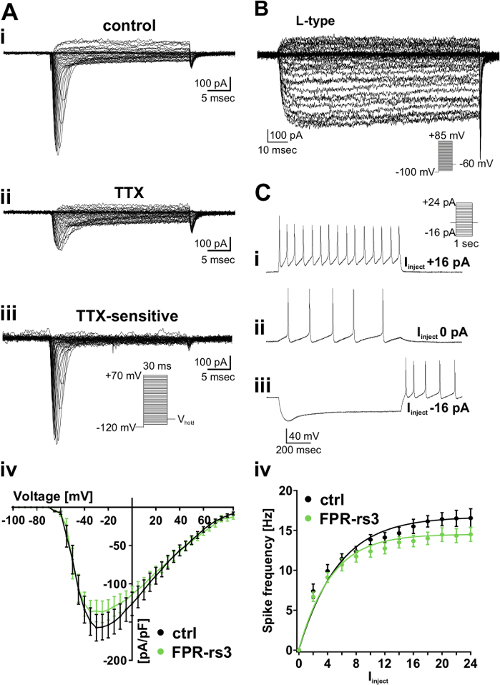
Figure 4: Isolated voltage-dépendants Na + et Ca 2+ courants ainsi que la décharge de la pointe (A) des traces représentatives de la cellule entière patch-clamp enregistrements d'une activation rapide de courant sensible à TTX Na + dans FPR-RS3 + de VSN.. (A i) Tension enregistrement étape dans des conditions de contrôle (solution extracellulaire de S 1; solution intracellulaire S 4) révèle un transitoire rapide et dépendant de la tension courant entrant. (A ii) le traitement de la TTX (1 uM) diminue fortement le courant. Trace soustraites numérique (contrôle-TTX (A iii)) Reveals le courant de Na + voltage-dépendants sensible à la TTX. Les relations courant-tension des courants Na + sensibles à TTX neurones isolés à partir de contrôle et de FPR-RS3 + (A iv). (B) représentant Ca 2+ traces de courant isolées pharmacologiquement (10 uM nifédipine). (C) représentatifs des traces de serrage actuelle montrant de- / hyperpolarisation et les trains de potentiels (rebond) d'action générés lors de positif par étapes (C i) et négatif (C iii) d'injection de courant. Notez l'activité spontanée mesurée à 0 pA injection de courant (C ii). (C iv) la fréquence de mise à feu de contrôle et de FPR-RS3 + neurones en fonction du courant injecté (I injecter). L'augmentation progressive de la cadence de tir est similaire pour le contrôleet FPR-RS3 + VSN. Notez que VSN sont extrêmement sensibles aux injections de courant , même dans les basses picoampère gamme 53-56. Notez que les courbes -I f ont été "background-corrigée" en utilisant la fréquence de dopage spontanée à 0 pA injection de courant. Les données sont des moyennes ± SEM. Ce chiffre a été modifié à partir de 52. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 5: enregistrements extracellulaires 'patch lâche »de VSN basales (A) l' image IR-DIC d'une tranche de tissu VNO aiguë représentant la pipette d'enregistrement dans la couche basale de l'épithélium sensoriel.. (B) d'enregistrement d' origine représentant d'un VSN basale dans la configuration cellule attachée (&# 39; lâche-joint) répondre avec de courtes rafales transitoires de pointes pour informer excitations (3 sec) avec des protéines urinaires majeures exprimées par recombinaison regroupées (rMUPs) et une concentration de potassium élevée (50 mM, 1 sec), respectivement (B i) . Un grossissement plus d'enregistrements présentés dans (B i) illustre des éclats de pointes en réponse à des stimulations (B ii). Les barres rouges indiquent le temps de la stimulation, l'intervalle inter-stimulus = 30 sec, enregistrement continu, des interruptions <1 sec (marques de coupe //). Barre d'échelle = 5 um (A). Panel (A) a été modifié par la référence 38. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Le VNO est une structure chemosensory qui détecte écomones. A ce jour, la plupart des récepteurs de voméronasal reste à deorphanized car seules quelques paires récepteur-ligand ont été identifiés. Parmi ceux -ci , V1rb2 a été décrit pour être spécifiquement activé par la phéromone urinaire 2-heptanone mâle 30, V2rp5 à être activé par le mâle phéromone spécifique ESP1 57 ainsi que V2r1b et V2rf2 à être activés par les peptides du CMH SYFPEITHI 48 et SEIDLILGY 58, respectivement. Une condition préalable à la compréhension de la transduction du récepteur-ligand relations et le signal est la connaissance des caractéristiques biophysiques des populations de VSN définies dans un environnement natif. propriétés des membranes passives et actives, conductances ioniques voltage-dépendants et des motifs de décharge d'action potentiel définissent les moyens et mesure dans laquelle les neurones récepteurs répondent aux chemosensory stimuli. Les enregistrements électrophysiologiques dans des tranches de tissu aiguës et, en particulier, quienregistrements de patch-clamp le-cellulaires fournissent une excellente méthode pour analyser ces propriétés en détail.
Une étape cruciale pour les enregistrements physiologiques efficaces et fiables dans des tranches de tissu est la préparation elle-même. Afin de maximiser l'intervalle de temps pour effectuer des expériences, le tissu doit être tranché et transféré à la solution oxygénée glacée immédiatement après dissection. Par la suite, les tranches peuvent être conservés pendant plusieurs heures permettant l'analyse d'un nombre important de cellules par jour expérimental. Il faut une certaine pratique pour réduire le temps de disséquer et d'intégrer à la fois les VNO d'un animal en moins de 30 min. Après cela, le taux de réussite pour un expérimentateur expérimenté pour obtenir plusieurs coupes de tissus intacts avec des cellules viables est bien au-dessus de 75%. Exécution d' enregistrements de patch-clamp est une approche expérimentale à faible débit par rapport à Ca l'imagerie. Pourtant, il permet une analyse plus détaillée et polyvalent de l'activité sur le niveau d'une seule cellule avec un temporel beaucoup plus élevérésolution. Dans la configuration de la cellule entière, le milieu intracellulaire est dialysée par la solution de la pipette. Alors que la solution de la pipette peut ne pas refléter la composition exacte cytosolique, il fournit l'expérimentateur avec un contrôle précis sur les deux conditions ioniques extra- et intracellulaires. Pour une interprétation fiable des résultats, un suivi continu de la résistance d'accès et le courant de fuite est crucial. Parfois, une augmentation ou une forte variation de la résistance d'accès ou de fuite conducteurs de courant à des résultats non interprétables et exige donc ces enregistrements à être mis au rebut. Par ailleurs, il est important de noter que certains composés se lient de manière irréversible pharmacologiques les rendant nécessaire le remplacement des tranches après chaque enregistrement.
L'enregistrement dans la configuration cellule attachée empêche la dialyse des composants intracellulaires et n'a aucune influence sur le potentiel de membrane de la cellule. Ainsi, cette technique offre un moyen moins invasif et relativement rapide du dépistage. Cependant, cette approach est généralement limitée à l'enregistrement des courants capacitifs super-seuil potentiel conduit d'action à partir de l'extérieur de la membrane cellulaire. Enregistrements patch en vrac se sont avérées aptes à analyser le comportement de dopage d' un plus grand nombre de neurones sensoriels en tranches VNO 38,54.
Le modèle transgénique employé ici fournit un outil fiable pour identifier et analyser la population de FPR-RS3 exprimant VSN. De plus, la technique décrite ici peut être étendue à d'autres lignes, quel que soit leur génotype. Malgré l'énorme avantage d'enquêter sur un type de cellule définie, en utilisant des souris transgéniques limite des expériences sur les lignes disponibles. Récemment, cependant, l' édition du génome ciblé est devenu plus rapide et plus abordable avec le CRISPR / technique cas9 59. En conclusion, la cible des enregistrements de patch-clamp en tranches de tissu voméronasal aigus offrent une approche polyvalente pour caractériser les propriétés biophysiques et physiologiques d'un populat définiion des neurones sensoriels.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
We thank Ivan Rodriguez and Benoit von der Weid for generating the FPR-rs3-i-venus mouse line, their constructive criticism and fruitful discussions. This work was funded by grants of the Volkswagen Foundation (I/83533), the Deutsche Forschungsgemeinschaft (SP724/6-1) and by the Excellence Initiative of the German federal and state governments. MS is a Lichtenberg Professor of the Volkswagen Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose (low-gelling temperature) | PeqLab | 35-2030 | |
| ATP (Mg-ATP) | Sigma-Aldrich | A9187 | |
| Bis(2-hydroxyethyl)-2-aminoethanesulfonic acid (BES) | Sigma-Aldrich | B9879 | |
| Calcium chloride | Sigma-Aldrich | C1016 | |
| Ethylene glycol tetraacetic acid (EGTA) | Sigma-Aldrich | E3889 | |
| Glucose | Sigma-Aldrich | G8270 | |
| GTP (Na-GTP) | Sigma-Aldrich | 51120 | |
| (2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375 | |
| Magnesium chloride | Sigma-Aldrich | M8266 | |
| Potassium chloride | Sigma-Aldrich | P9333 | |
| Potassium hydroxide | Sigma-Aldrich | 03564 | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Sodium hydrogen carbonate | Sigma-Aldrich | S5761 | |
| Sodium hydroxide | Sigma-Aldrich | S8045 | |
| Name | Company | Catalog Number | Comments |
| Surgical tools and consumables | |||
| Large Petri dish, 90 mm | VWR | decapitation, dissection of VNO capsule | |
| Small Petri dish, 35 mm | VWR | lid for VNO dissection, dish for embedding in agarose | |
| Sharp large surgical scissor | Fine Science Tools | decapitation, removal of lower jaw | |
| Strong bone scissors | Fine Science Tools | cutting incisors | |
| Medium forceps, Dumont tweezers #2 | Fine Science Tools | removing skin and palate | |
| Micro spring scissors, 8.5 cm, curved, 7 mm blades | Fine Science Tools | cutting out VNO | |
| Two pairs of fine forceps, Dumont tweezers #5 | Fine Science Tools | dissecting VNO out of cartilaginous capsule | |
| Small stainless steel spatula | Fine Science Tools | handling agarose block and tissue slices | |
| Surgical scalpel | cutting agarose block into pyramidal shape | ||
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Amplifier | HEKA Elektronik | EPC-10 | |
| Borosilicate glass capillaries (1.50 mm OD/0.86 mm ID) | Science Products | ||
| CCD-camera | Leica Microsystems | DFC360FX | |
| Filter cube, excitation: BP 450-490, suppression: LP 515 | Leica Microsystems | I3 | |
| Fluorescence lamp | Leica Microsystems | EL6000 | |
| Hot plate magnetic stirrer | Snijders | 34532 | |
| Microforge | Narishige | MF-830 | |
| Micromanipulator Device | Luigs & Neumann | SM-5 | |
| Micropipette puller, vertical two-step | Narishige | PC-10 | |
| Microscope | Leica Microsystems | CSM DM 6000 SP5 | |
| Noise eliminator 50/60 Hz (HumBug) | Quest Scientific | ||
| Objective | Leica Microsystems | HCX APO L20x/1.00 W | |
| Oscilloscope | Tektronik | TDS 1001B | |
| Osmometer | Gonotec | Osmomat 030 | |
| Perfusion system 8-in-1 | AutoMate Scientific | ||
| pH Meter five easy | Mettler Toledo | ||
| Pipette storage jar | World Precision Instruments | e212 | |
| Recording chamber | Luigs & Neumann | Slice mini chamber | |
| Razor blades | Wilkinson Sword GmbH | Wilkinson Sword Classic | |
| Oxygenating slice storage chamber; alternative commercial chambers are: e.g., BSK1 Brain Slice Keeper (Digitimer) or the Pre-chamber (BSC-PC; Warner Instruments) | custom-made | ||
| Stereo microscope | Leica Microsystems | S4E | |
| Trigger interface | HEKA Elektronik | TIB-14 S | |
| Vibratome | Leica Microsystems | VT 1000 S | |
| Water bath | Memmert | WNB 45 |
Références
- Firestein, S. How the olfactory system makes sense of scents. Nature. 413 (6852), 211-218 (2001).
- Mombaerts, P. Genes and ligands for odorant, vomeronasal and taste receptors. Nat. Rev. Neurosci. 5 (4), 263-278 (2004).
- Fuss, S. H., Omura, M., Mombaerts, P. The Grueneberg ganglion of the mouse projects axons to glomeruli in the olfactory bulb. Eur. J. Neurosci. 22 (10), 2649-2654 (2005).
- Roppolo, D., Ribaud, V., Jungo, V. P., Lüscher, C., Rodriguez, I. Projection of the Grüneberg ganglion to the mouse olfactory bulb. Eur. J. Neurosci. 23 (11), 2887-2894 (2006).
- Adams, D. R. Fine structure of the vomeronasal and septal olfactory epithelia and of glandular structures. Microsc. Res. Tech. 23 (1), 86-97 (1992).
- Ma, M., et al. Olfactory signal transduction in the mouse septal organ. J. Neurosci. 23 (1), 317-324 (2003).
- Dulac, C., Torello, A. T. Molecular detection of pheromone signals in mammals: from genes to behaviour. Nat. Rev. Neurosci. 4 (7), 551-562 (2003).
- Luo, M., Katz, L. C. Encoding pheromonal signals in the mammalian vomeronasal system. Curr. Opin. Neurobiol. 14 (4), 428-434 (2004).
- Brennan, P. A., Kendrick, K. M. Mammalian social odours: attraction and individual recognition. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 361 (1476), 2061-2078 (2006).
- Tirindelli, R., Dibattista, M., Pifferi, S., Menini, A. From Pheromones to Behavior. Physiol. Rev. 89, 921-956 (2009).
- Jacobson, L., Trotier, D., Doving, K. B. Anatomical description of a new organ in the nose of domesticated animals by Ludvig Jacobson (1813). Chem. Senses. 23 (6), 743-754 (1998).
- Keverne, E. B. The Vomeronasal Organ. Science. 286 (5440), 716-720 (1999).
- Breer, H., Fleischer, J., Strotmann, J. The sense of smell: multiple olfactory subsystems. Cell. Mol. Life Sci. C. 63 (13), 1465-1475 (2006).
- Liberles, S. D. Mammalian pheromones. Annu. Rev. Physiol. 76, 151-175 (2014).
- Meredith, M., O'Connell, R. J. Efferent control of stimulus access to the hamster vomeronasal organ. J. Physiol. 286, 301-316 (1979).
- Pankevich, D., Baum, M. J., Cherry, J. A. Removal of the superior cervical ganglia fails to block Fos induction in the accessory olfactory system of male mice after exposure to female odors. Neurosci. Lett. 345 (1), 13-16 (2003).
- Giacobini, P., Benedetto, A., Tirindelli, R., Fasolo, A. Proliferation and migration of receptor neurons in the vomeronasal organ of the adult mouse. Brain Res. Dev. Brain Res. 123 (1), 33-40 (2000).
- Coppola, D. M., O'Connell, R. J. Stimulus access to olfactory and vomeronasal receptors in utero. Neurosci. Lett. 106 (3), 241-248 (1989).
- Hovis, K. R., et al. Activity Regulates Functional Connectivity from the Vomeronasal Organ to the Accessory Olfactory Bulb. J. Neurosci. 32 (23), 7907-7916 (2012).
- Mucignat-Caretta, C. The rodent accessory olfactory system. J. Comp. Physiol. A Neuroethol. Sensory, Neural, Behav. Physiol. 196 (10), 767-777 (2010).
- Jia, C., Halpern, M. Subclasses of vomeronasal receptor neurons: differential expression of G proteins (Giα2 and G(αo)) and segregated projections to the accessory olfactory bulb. Brain Res. 719 (1-2), 117-128 (1996).
- Del Punta, K., Puche, C. A., Adams, N. C., Rodriguez, I., Mombaerts, P. A divergent pattern of sensory axonal projections is rendered convergent by second-order neurons in the accessory olfactory bulb. Neuron. 35 (6), 1057-1066 (2002).
- Belluscio, L., Koentges, G., Axel, R., Dulac, C. A map of pheromone receptor activation in the mammalian brain. Cell. 97 (2), 209-220 (1999).
- Rodriguez, I., Feinstein, P., Mombaerts, P. Variable patterns of axonal projections of sensory neurons in the mouse vomeronasal system. Cell. 97 (2), 199-208 (1999).
- Rivière, S., Challet, L., Fluegge, D., Spehr, M., Rodriguez, I. Formyl peptide receptor-like proteins are a novel family of vomeronasal chemosensors. Nature. 459 (7246), 574-577 (2009).
- Martini, S., Silvotti, L., Shirazi, A., Ryba, N. J. P., Tirindelli, R. Co-expression of putative pheromone receptors in the sensory neurons of the vomeronasal organ. J. Neurosci. 21 (3), 843-848 (2001).
- Matsuoka, M., et al. Immunocytochemical study of Gi2alpha and Goalpha on the epithelium surface of the rat vomeronasal organ. Chem. Senses. 26 (2), 161-166 (2001).
- Dulac, C., Torello, A. T. Molecular detection of pheromone signals in mammals: from genes to behaviour. Nat. Rev. Neurosci. 4 (7), 551-562 (2003).
- Leinders-Zufall, T., et al. Ultrasensitive pheromone detection by mammalian vomeronasal neurons. Nature. 405 (6788), 792-796 (2000).
- Boschat, C., et al. Pheromone detection mediated by a V1r vomeronasal receptor. Nat. Neurosci. 5 (12), 1261-1262 (2002).
- Novotny, M. V. Pheromones, binding proteins and receptor responses in rodents. Biochem. Soc. Trans. 31, 117-122 (2003).
- Nodari, F., et al. Sulfated steroids as natural ligands of mouse pheromone-sensing neurons. J. Neurosci. 28 (25), 6407-6418 (2008).
- Isogai, Y., et al. Molecular organization of vomeronasal chemoreception. Nature. 478 (7368), 241-245 (2011).
- Leinders-Zufall, T., et al. MHC class I peptides as chemosensory signals in the vomeronasal organ. Science. 306 (5698), 1033-1037 (2004).
- Chamero, P., et al. Identification of protein pheromones that promote aggressive behaviour. Nature. 450 (7171), 899-902 (2007).
- Kimoto, H., Haga, S., Sato, K., Touhara, K. Sex-specific peptides from exocrine glands stimulate mouse vomeronasal sensory neurons. Nature. 437 (7060), 898-901 (2005).
- Ferrero, D. M., et al. A juvenile mouse pheromone inhibits sexual behaviour through the vomeronasal system. Nature. 502 (7471), 368-371 (2013).
- Kaur, A. W., et al. Murine pheromone proteins constitute a context-dependent combinatorial code governing multiple social behaviors. Cell. 157 (3), 676-688 (2014).
- Ben-Shaul, Y., Katz, L. C., Mooney, R., Dulac, C. In vivo vomeronasal stimulation reveals sensory encoding of conspecific and allospecific cues by the mouse accessory olfactory bulb. PNAS. 107 (11), 5172-5177 (2010).
- Kimoto, H., et al. Sex- and strain-specific expression and vomeronasal activity of mouse ESP family peptides. Curr. Biol. 17 (21), 1879-1884 (2007).
- Spehr, M., et al. Parallel processing of social signals by the mammalian main and accessory olfactory systems. Cell. Mol. Life Sci. C. 63 (13), 1476-1484 (2006).
- Chamero, P., et al. G protein G{alpha}o is essential for vomeronasal function and aggressive behavior in mice. PNAS. , (2011).
- Bufe, B., Schumann, T., Zufall, F. Formyl peptide receptors from immune and vomeronasal system exhibit distinct agonist properties. J. Biol. Chem. 287 (40), 33644-33655 (2012).
- Bozza, T., Feinstein, P., Zheng, C., Mombaerts, P. Odorant receptor expression defines functional units in the mouse olfactory system. J. Neurosci. 22 (8), 3033-3043 (2002).
- Grosmaitre, X., Vassalli, A., Mombaerts, P., Shepherd, G. M., Ma, M. Odorant responses of olfactory sensory neurons expressing the odorant receptor MOR23: a patch clamp analysis in gene-targeted mice. PNAS. 103 (6), 1970-1975 (2006).
- Oka, Y., et al. Odorant receptor map in the mouse olfactory bulb: in vivo sensitivity and specificity of receptor-defined glomeruli. Neuron. 52 (5), 857-869 (2006).
- Ukhanov, K., Leinders-Zufall, T., Zufall, F. Patch-clamp analysis of gene-targeted vomeronasal neurons expressing a defined V1r or V2r receptor: ionic mechanisms underlying persistent firing. J. Neurophysiol. 98 (4), 2357-2369 (2007).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12 (12), 1551-1558 (2009).
- Pacifico, R., Dewan, A., Cawley, D., Guo, C., Bozza, T. An olfactory subsystem that mediates high-sensitivity detection of volatile amines. Cell Rep. 2 (1), 76-88 (2012).
- Veitinger, S., et al. Purinergic signalling mobilizes mitochondrial Ca2+ in mouse Sertoli cells. J. Physiol. 589 (Pt 21), 5033-5055 (2011).
- Kaur, A. W., et al. Murine pheromone proteins constitute a context-dependent combinatorial code governing multiple social behaviors. Cell. 157 (3), 676-688 (2014).
- Ackels, T., von der Weid, B., Rodriguez, I., Spehr, M. Physiological characterization of formyl peptide receptor expressing cells in the mouse vomeronasal organ. Front. Neuroanat. 8, 1-13 (2014).
- Liman, E. R., Corey, D. P. Electrophysiological characterization of chemosensory neurons from the mouse vomeronasal organ. J. Neurosci. 16 (15), 4625-4637 (1996).
- Cichy, A., et al. Extracellular pH Regulates Excitability of Vomeronasal Sensory Neurons. J. Neurosci. 35 (9), 4025-4039 (2015).
- Shimazaki, R., et al. Electrophysiological properties and modeling of murine vomeronasal sensory neurons in acute slice preparations. Chem. Senses. 31 (5), 425-435 (2006).
- Hagendorf, S., Fluegge, D., Engelhardt, C., Spehr, M. Homeostatic control of sensory output in basal vomeronasal neurons: activity-dependent expression of ether-à-go-go-related gene potassium channels. J. Neurosci. 29 (1), 206-221 (2009).
- Haga, S., et al. The male mouse pheromone ESP1 enhances female sexual receptive behaviour through a specific vomeronasal receptor. Nature. 466 (7302), 118-122 (2010).
- Leinders-Zufall, T., et al. A family of nonclassical class I MHC genes contributes to ultrasensitive chemodetection by mouse vomeronasal sensory neurons. J. Neurosci. 34 (15), 5121-5133 (2014).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337, 816-821 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon