Method Article
פרוטוקול פשוט ומהיר לללא אנזימי רקמות אנושיות טריות לנתק לניתוח להחדרה לימפוציטים
* These authors contributed equally
In This Article
Summary
This protocol describes the rapid non-enzymatic dissociation of fresh human tissue fragments for qualitative and quantitative assessment of CD45+ cells (lymphocytes/leukocytes) present in various normal and malignant human tissues. Additionally, the supernatant obtained from the primary tissue homogenate can be collected and stored for further analysis or experimentation.
Abstract
היכולת של תאים ממאירים ללהתחמק ממערכת החיסון, המתאפיינת בבריחת גידול משני תגובות חיסון מולדים ובעלי כושר הסתגלות, מקובל כיום כסימן היכר חשוב של הסרטן. המחקר שלנו על סרטן השד מתמקד בתפקיד הפעיל שלימפוציטים גידול הסתננות לשחק בהתקדמות גידול ותוצאת מטופל. לקראת מטרה זו, פיתחנו מתודולוגיה לבידוד המהיר של תאי הלימפה שלמים מרקמות נורמליות ולא נורמליות במאמץ כדי להעריך אותם בסמוך למדינה האם שלהם. Homogenates הוכנה באמצעות תכנית Dissociator מכאנית שתי התאוששות כדאיות ותא גדלה תוך שמירת רקמות לעומת ביטוי קולט משטח לאנזים-מעוכלות. יתר על כן, עיכול אנזימטי של החומר מסיס שנותר לא התאושש CD45 תאים + נוספים מצביעים על כך שמדידות כמותיות ואיכותיות בhomogenate העיקרי העשויים באמת משקפות תת-אוכלוסיות שחדרו בfragm הרקמהאף אוזן גרון. תאי הלימפה בhomogenates אלה יכולים להיות בקלות מאופיינת באמצעות חיסוני (פנוטיפ, הפצה, וכו ') או מולקולרי (DNA, RNA ו / או חלבון) מתקרב. גם תאי CD45 + יכולים לשמש לטיהור תת-אוכלוסייה, התרחבות במבחנה או הקפאה. יתרון נוסף של גישה זו הוא שsupernatant הרקמה העיקרי מhomogenates יכול לשמש כדי לאפיין ולהשוות ציטוקינים, כמוקינים, נוגדנים ואנטיגנים הנמצאים ברקמות נורמליות וממאירים. פונקציות זה פרוטוקול טוב מאוד לרקמות שד אנושיות וצריכה להיות ישימות למגוון רחב של רקמות נורמליות ולא נורמליות.
Introduction
The tumor microenvironment is composed of various cell types with numerous studies showing they each play distinct and important roles in tumorigenesis1,2. These include, but are not limited to, infiltrating immune cells, stromal cells, endothelial cells and tumor cells3. Ex vivo studies of tumor infiltrating lymphocytes (TIL; CD45+ cells or leukocytes, which are predominantly lymphocytes in breast tumors) from fresh human tissue samples is made difficult by their low frequency, the small sample sizes often available for research and the potential for loss of viability during extraction. Because immune cells infiltrating tumors are usually present as passengers rather than permanent residents in general they are easier to release from the tissue matrix.
Dissociating tumor tissue while maintaining cellular integrity is technically challenging and has traditionally been performed using a combination of mechanical and enzymatic steps to prepare single cell suspensions4-8. This approach involves lengthy incubation periods and is associated with a significant reduction in cell viability as well as the loss of cell surface receptors by enzymatic cleavage. High quality flow cytometric studies characterizing TIL in the tumor microenvironment as well as clean purifications of CD45+ subpopulations by flow cytometry or antibody-coated beads are more difficult to achieve from enzyme-digested tumor tissue. In addition, the supernatant (SN) from the resulting tumor homogenate is not amenable to further analysis including quantification of secreted proteins (cytokines, chemokines, immunoglobulins or tumor antigens) or experimental treatment of normal cells, because of the potential for protein degradation in the enzymatic digests.
In our search for a method to prepare single cell homogenates from breast tissues [including tumor, non-adjacent non-tumor (NANT) and normal (from mammary reductions) breast tissues] without enzymatic digestion, we tested a variety of mechanical homogenization techniques. Homogenates prepared using a mechanical dissociator had increased cell viability (2-fold) and total cell recovery (2-fold) while preserving surface receptor expression. Enzymatic digestion of the remaining insoluble material did not recover additional CD45+ cells suggesting they were all released in the initial homogenate. Thus, this rapid and simple approach allows both qualitative and quantitative assessment of the CD45+ subpopulations present in various normal and malignant human tissues. An added advantage of this approach is that the SN from the initial homogenate (primary tissue SN) can be collected and stored for further analysis or experimentation.
Protocol
הערה: כל הדגימות נרכשו באמצעות פרוטוקול שאושר על ידי ועדת האתיקה הרפואית של מכון ז'ול בורדה בכתב הסכמה מהדעת שהתקבלה מכל מטופל.
1. הכנת homogenate רקמות
- לנתח רקמות resected (רקמה ממארת ונורמלית שעברה כריתה מחדר הניתוח) נמצא במעבדה הפתולוגית על ידי צוות מיומן לאיסוף מיידי. גידול, Nant (נלקח המרחק הרחוק ביותר מהגידול ככל האפשר) ושברי רקמה נורמלים מעובדים בתוך 1 באופן שגרתי - 3 שעות של כריתה כירורגית במעבדה BSL2 באמצעות נהלי בטיחות ביולוגיים סטנדרטיים לרקמות אנושיות. תרשים זרימה של הפרוטוקול באיור 1.
- לשקול את כל שברי הרקמה (רגיל, Nant וגידול) ולמדוד את האורך, רוחב, וגובה (גובה x אורך x רוחב). זהו צעד חשוב לנורמליזציה הבאה של תת-אוכלוסיות של תאים, RNA שחולץ, וכו '
NOTE: מגוון רחב של גודל מדגם הוא בין 100 ל -10,000 מ"מ 3 ללא שומן במידת האפשר. - חותם בר הגידול בשקופית זכוכית לצביעת H & E כדי לוודא שהרקמה היא למעשה חלק של הגידול.
- לעשות זאת על ידי לחיצה על שקופית מיקרוסקופ זכוכית על בר הגידול והפעלת לחץ עדין עם האצבעות שלך לכמה שניות.
- תקן את השקופיות עם isopropanol למשך 2 דקות ואחריו צעד כביסה במים. Counterstain הרקמה למשך 30 שניות עם hematoxylin של מאיר.
- לשטוף את השקופית בשש אמבטיות של מים. כתם בPhloxine B 2% למשך 15 שניות.
- לשטוף באמבטיה של מים אחד ואחריו ארבע אמבטיות של isopropanol ולסיים עם אמבטיה אחת של מים.
- דגירה בisopropanol דקות 1 וניקוז. ברור בשתי אמבטיות של קסילן.
- הר עם הרכבה בינונית מבוסס קסילן. לבחון ל- תאי גידול (איור 2).
הערה: בעיקר, תאים סרטניים לדבוק שקופית המוטבעות - סטרומה, הלימפה או מודעהipose תאים רק לעתים נדירות נותרו, ולהשאיר רווחים בין התאים הסרטניים (איור 2).
- מניחים את בר הרקמה בצלחת תרבות קטנה המכילה 1 מיליליטר של הגדרה כימית, המדיום הסלולרי hematopoietic סרום ללא (להלן כבינוני) בטמפרטורת חדר לקוביות אותו לחתיכות קטנות (~ 1 - 2 מ"מ 2) באמצעות סטרילי אזמל.
- העבר את הכל (שברי רקמה + בינוני) לצינור C Dissociator מכאני.
- יש לשטוף את צלחת פטרי ואזמל עם 2 מיליליטר של מדיום בעזרת פיפטה פסטר ולהוסיף את זה לצינור C (נפח בינוני לניתוק = 3 מיליליטר).
- השתמש בA.01 המכנית תכנית Dissociator לצינורות C (התכנית העדינה ביותר) לhomogenize ברי הרקמה לתוך השעיה תא בודדת. מניחים את צינור C במנגנון ולהפעיל את התכנית פעמיים ברציפות (מחזור אחד = 25 שניות).
הערה: הליך הומוגניזציה זה כבר נקבע ואושר לרקמת שד אנושית, קיבה אחרתאו או רקמת סוגים ייתכן שיצטרכו להשתמש בתכנית אחרת וצריכים להיבדק ראשון. - הסר את צינור C מהמנגנון ולמזוג homogenate ישירות לתוך מסננת תא 40 מיקרומטר יושבת על צינור 50 מיליליטר. שימוש באותה פיפטה פסטר כמו בשלב 1.6, להעביר כל נוזל שנותר בצינור ג 'למסננת התא.
- העבר את הנוזל המסונן לתוך צינור 15 מיליליטר באמצעות קצה micropipette 1 מיליליטר. באופן זמני לשמור את מסננת התא ושפופרת 50 מיליליטר שלה.
- יש לשטוף את צינור C עם 3 מיליליטר נוסף של מדיום ולהעביר את זה, שוב באמצעות אותו פיפטה פסטר כמו בשלב 1.6, למסננת התא עדיין יושבת על צינור 50 מיליליטר. לסחוט סכום מקסימאלי של הנוזל שיורית לכודים ברקמות unhomogenized לתוך צינור 50 מיליליטר בעדינות על ידי הזזתו סביב המסננת עם טפטפת נקי פסטר או טיפ 1 מיליליטר שנזרק משם בהמשך, כדי למנוע זיהום eluate.
- מניחים את מסננת התא במהופך על tהוא צינור מקורי C ולשטוף עם 3 מיליליטר של מדיום, כך שרקמת unhomogenized הטיפות בחזרה לתוך צינור C.
- -Homogenize מחדש כמו בשלב 1.7 לשני מחזורים של תכנית A.01.
- יוצקים homogenate השני זה דרך מסננת התא יושבת על צינור 50 מיליליטר, לשטוף את צינור C שוב עם 3 בינוני מיליליטר (כמו בשלב 1.10) ולהעביר עם פיפטה פסטר למסננת התא יושבת על צינור 50 מיליליטר שוב לוחץ מרבי כמות הנוזל מרקמת חיבור שיורית לכודה במסננת התא.
- בשלב זה, בהיקף של ~ 2.5 מיליליטר הוא בצינור 15 מ"ל ו~ 9 מיליליטר בשפופרת 50 מיליליטר.
2. הפרדה של רקמות ותאי Supernatant
- צנטריפוגה homogenates ב -15 מיליליטר ו -50 מיליליטר צינורות במשך 15 דקות ב 600 XG בטמפרטורת חדר.
- למזוג SN מצינור 15 מיליליטר לתוך צינור נקי ובאופן זמני לאחסן על 4 מעלות צלזיוס. supernatant זה = גידול ראשוני, Nant או ti הרגילssue SN (נפח סופי של 2.5 מיליליטר) יובהר בהמשך וaliquoted לפני האחסון ב -80 ° C עבור ניתוחים בעתיד (ראה להלן).
- בטל supernatant מצינור 50 מיליליטר.
- בעדינות resuspend שני כדורי התא בנפח סופי של 1 מיליליטר בינוני. בקצרה, ראשון לשבור בעדינות התא גלולה בשני הצינורות (על ידי הקשה על הצינור על משטח קשה). Resuspend תא גלולה הרופפת במ"ל 50 עם 500 μl של מדיום ולהעביר השעיה תא זה לצינור 15 מיליליטר לresuspend גלולה השני. חזור על שלב זה פעם אחת עם 500 μl השני של מדיום להתאוששות המרבית של תאים.
- העברת 10 μl של ההשעיה תא צינור קטן, לערבב עם 10 μl של trypan כחול (דילול של 1: 1) ולספור את מספר תאי קיימא באמצעות hemocytometer.
הערה: בשלב זה כל חלק של ההשעיה התא יכול גם להיות מנותח על ידי הזרימה cytometry כדי להעריך גודל תא, גרעיניות ואם ארצה במספר מוגבל של סמנים תת-אוכלוסייה ליותר PreCהערכת ISE של חלוקת התא היחסית בhomogenate לפני ניתוח או ניסויים נרחבים. כל הניתוחים על ידי זרימת cytometry לשלב תיוג CD45 לנורמליזציה של תת-אוכלוסיות. - גלולה התאים על ידי צנטריפוגה XG ב 300 במשך 10 דקות בטמפרטורת חדר. התאים מן הגידול, Nant, או רקמה נורמלית מוכנים לטיהור או ניתוח נוסף עכשיו. צעדים נוספים אלה הם הטובים ביותר כאשר היא מבוצעת באותו היום כניתוח.
הערה: לניתוח תזרים cytometric אך לא תא מיון תאי דם האדומים שיורית יש lysed לאחר תיוג נוגדנים על ידי הוספת 0.4 מיליליטר של חיץ תמוגה תא דם האדום לתא גלולה, מייד vortexing 1 שניות ודוגרים על מינימום של 10 דקות בחדר טמפרטורה (מוגן מפני אור) לפני הניתוח.
3. הבהרה של Supernatant רקמות
- צנטריפוגה הצינורות 1.5 מיליליטר עם SN הרקמה ב 15,000 XG במשך 15 דקות ב 4 מעלות צלזיוס.
- להסיר בזהירות tהוא supernatant בלי לגעת או להפריע גלולה. מעביר צינור נקי (או צינורות) תלוי במספר ובהיקף של aliquots הרצוי.
- אחסן את supernatant ב -80 ° C לשימוש עתידי.
4. דם חולה
- לאסוף דגימת דם מכל מטופל כביקורת על ידי venipuncture לתוך צינורות heparinized היום לפני הניתוח. צנטריפוגה הדם ב 400 XG במשך 10 דקות ב 20 מעלות צלזיוס עם הבלם מלהשיג את הפלזמה ומעיל באפי.
- הסר את הפלזמה ולהבהיר את זה על ידי צנטריפוגה ב10,000 XG במשך 15 דקות בטמפרטורה של 20 מעלות צלזיוס. Aliquot ופלזמה חנות ב -80 ° C לשימוש עתידי. לדלל את המעיל באפי במדיום
- הפרד את תאי mononuclear באמצעות צנטריפוגה שיפוע ficoll-hypaque סטנדרטית לפני ניתוח מיידי, בידוד תת-אוכלוסייה, DNA / RNA / הפקת חלבון או הקפאה.
5. cytometry הזרימה
- תאי תווית על פי ייצורההוראות של r ב 4 ° C, מוגן מפני אור. תאי דם אדום בLyse השעיות תא מברי רקמה לאחר תיוג נוגדנים על ידי הוספת 0.4 מיליליטר של חיץ תמוגה תא לתא גלולה.
- מערבולת מייד ל1 שניות ודגירת מינימום של 10 דקות בטמפרטורת חדר, מוגן מפני אור. להעביר את התאים שכותרתו בcytometer זרימה לרכישת נתונים ללא שטיפה.
תוצאות
עיכול אנזימתי של שברי רקמות עם שני פתרונות זמינים מסחרי ניתוק רקמה או תערובות מעבדה שונות של collagenase, DNase ו / או מעכבי hyaluronidase, לדבוק במגוון רחב של קולטנים על פני השטח של תאים. המחקרים שלנו, התמקדו בתחילה בתאי CD4 + T חדירת גידולים בשד, הוצגו במהירות עם בעיה טכנית עיקרי בשל מחשוף של הקולטנים CD4 משטח תוך שימוש בפרוטוקולים סטנדרטי עיכול אנזימטי 4-8. בדקנו מגוון רחב של אנזימי collagenase עם או בלי DNase ומעכבי hyaluronidase, מציאת collagenase שI ו- II הסיר לחלוטין CD4 מתא השטח, למרות כדאיות גבוהה לימפוציטים (איור 3 א). השפעה מתונה על CD4 נצפתה עם IV collagenase בזמנים קצרים דגירה (1 - שעה 2) עם תיוג נוגדן CD4 נמוך שהתגלו בבלוטה לימפה מתעכלת ורקמת גידול בהשוואה לדם מעוכל ומח עצם מאותו החולה (איור 3; שים לב כי בשל מגבלות על הרקמה שאנו מקבלים לא הצלחנו להשוות צומת מתעכלת ולא מעוכלת לימפה ורקמת גידול). הפסד זה של CD4 אושר להיות תוצר לוואי טכני של מערכת עיכול IV collagenase על ידי השוואת תאי CD4 + T לא מעוכלים ומתעכלים מבודדים מהדם תורם בריא (מידע לא מוצג). בעוד שניתן לבודד תאי CD4 lo T אלה מברי רקמה-מתעכל IV collagenase באמצעות חרוזים מגנטיים, האוכלוסיות המטוהרים לעתים קרובות מכילות כמויות משתנות של זיהום על ידי תאים אחרים ממייקרו-הסביבה של גידול ובכך היו הכי מוצלחים למטרות הניסוי שלנו.
בחיפוש מתמיד אחר גישה טובה יותר, בשנת 2008 בדקנו Dissociator המכני חדש ללא שימוש באנזימים. מנגנון זה מיוצר homogenates רקמת שד במהירות וביושרת קולט משטח נשמר 9. זרימת נציג cytometry חלקות נקודות של follo homogenates תאים הסרטניניתוק כנף ותיוג עם נוגדנים ספציפיים כנגד תאי אפיתל (EpCAM) וכדוריות דם לבנות (CD45) מוצגים באיור 3 ג. תמונות אלה הן תצפיות שגרתיות אופייניות לhomogenates גידול בשד. פרוטוקול זה אינו משנה באופן משמעותי את הכדאיות של CD45 + תאים (תאים מתים 4%); עם זאת, יש אובדן ניכר של EpCAM תאי קיימא + (תאים מתים 38% בגידול הראו; משתנה בין גידולים). למרות ההפסד הזה, + EpCAM קיימא וCD45 + תת ניתן להפריד על בסיס הגודל והמבנה לתאי האפיתל גדולים (= תאים סרטניים), תאי האפיתל קטנים וCD45 + תאים גדולים וקטן CD45 + תאים (רוב התאים , שהם בעיקר לימפוציטים; איור 3 ג).
העלייה המשמעותית בCD45 + תאי קיימא שהושגה באמצעות גישה זו מאפשרת הרכישה של ססגוניות לשחזור זרימת cytometry נתונים (באמצעותעד עשרה צבעים) כדי לאפיין באופן מלא יותר תת TIL בסרטן השד. זרימת נציג cytometry חלקות נקודות של תת TIL העיקרי מוצגת באיור 4, עם הניסויים שבוצע בהוכחה כי אפשר גם לזהות ולכמת תת תאי T ו- B קטין חדירת הגידול 10-12, כוללים צביעה תאית לT וקנונים שעתוק תא B גורמי 12. אסטרטגיות gating לימפוציטים מסוג מבוססות על תאי CD45 + קיימא מזוהה עם כתם כדאיות (הערה:. גידולים יכולים להשתנות במידה רבה בכמות פסולת תאית ותאי האפיתל מתים תלוי בתת-סוג BC, כיתה, וכו '). גישה זו שמשה בהצלחה לטהר תת-אוכלוסיות לימפוציטים מhomogenate עם חרוזים מגנטיים או מיון תא לניתוח ביטוי גנים באמצעות מערכים או qRT-PCR 9. מתווכים מסיסים בSN, כולל ציטוקינים ונוגדנים, כבר לכמת באמצעות הישג מפואר immunoassay מבוסס עם נתונים כתוצאה מנורמלים לגודל של בר הרקמה. השוואה של ביטוי ציטוקינים (בריכת Th1 / Th2 / Th7 / Th9 / TH17) או נוגדנים כולל (IgA, IgE, IgG, IgM) בBC SN עם SN מרקמת שד נורמלי מגלה עליות הן הבקשורים לרקמת הגידול (איור 5). SN של הרקמה העיקרית אלה גם כבר ניתחו בצורה יעילה לאנטיגנים 10-12 ומשמשים לטיפול באופן ניסיוני לימפוציטים מתורמים בריאים, ובכך לשחזר את הפנוטיפ TIL בתאים נורמלים 9.
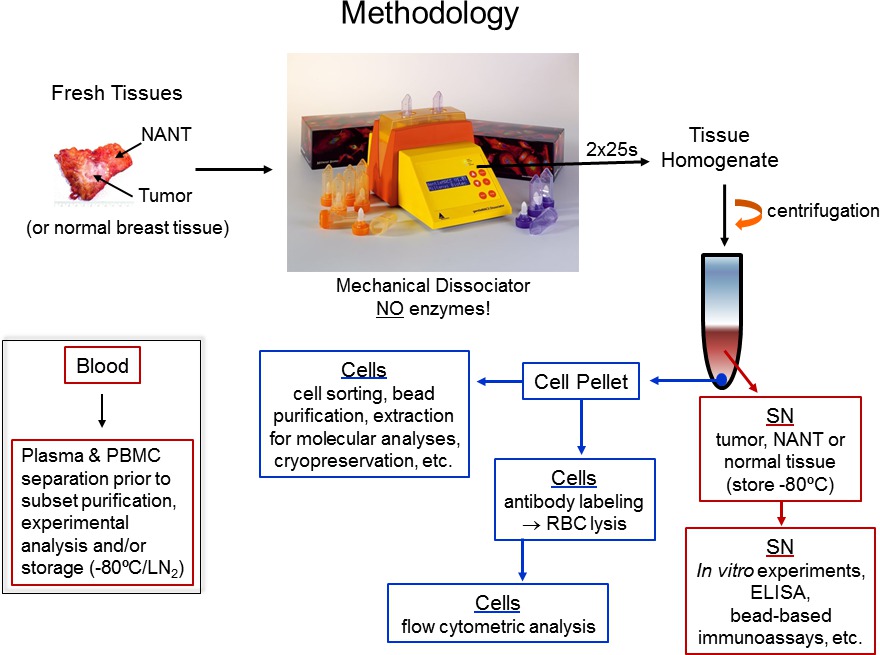
תרשים זרימת 1. פרוטוקול איור. ההליך שלנו לעיבוד רקמות אנושיות טריות וכמה גישות אנליטיות שלאחר מכן ניתן להשתמש כדי להעריך לימפוציטים שחדר רקמות אנושיות מוצג.

איור 2. H & E מוכתמת תמונה של חותם רקמת גידול שד. חותם זה, נלקח מבר רקמת גידול שד טרי, מראה הנוכחות של תאים סרטניים עם השטחים הפתוחים המשקפים אזורים שלא הועברו. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של נתון זה.

. איור 3. אופטימיזציה של ניתוק רקמת שד לניתוח הלימפוציטים ניתוח cytometric של זרימה: ביטוין CD4 () על לימפוציטים מסוג ממעוכל וCollagenase I / II מתעכל רקמת גידול; ביטוי CD4 על הלימפוציטים מהבלוטה לימפה ושנינות רקמה מתעכל גידול (B)h Collagenase IV ובהשוואה לתאי דם במח עצם לא מעוכלים מאותו המטופל; ניתוח ו( C) של לויקוציטים הכולל (CD45 +) ותאי אפיתל (+ EpCAM) מרקמת גידול במהירות מכאנית ניתק באמצעות הפרוטוקול מתואר כאן. הכדאיות של תאי האפיתל ותאי CD45 + שימוש בפרוטוקול שלנו נבחנת באמצעות השילוב של צבע כדאיות ניתן לתקן. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

ניתוח התזרים cytometric איור 4. גידול הסתננות תת הלימפוציטים בhomogenate. ססגוניות בוצע ביום של ניתוח לאחר ניתוק מכאני באמצעות הפרוטוקול המתואר כאן. תאי קיימא ותת-אוכלוסיות לימפוציטים גדולותמחדש לראות: CD3 הוא סמן תא T מחבת, CD4 ו CD8 הם סמני משנה תא מרכזיים T וCD19 הוא סמן תא B מחבת. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
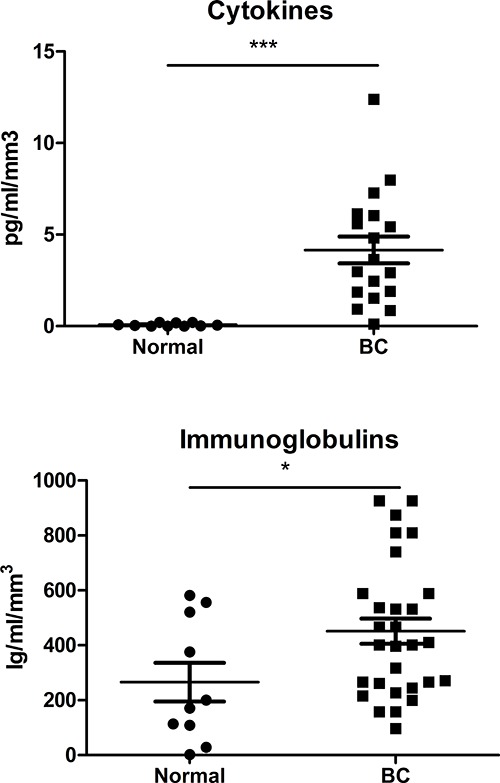
איור 5. מתווכים מסיסים בsupernatant. פנל של ציטוקינים (Th1 / Th2 / Th7 / Th9 / TH17) ונוגדנים (IgA, IgE, IgG, IgM) הוערכו באמצעות immunoassays מבוסס חרוז לנתח SN נגזר מרגיל ולפני הספירה רקמות באמצעות הפרוטוקול המתואר כאן.
Discussion
מחקר זה מתאר שיטה מותאמת להכנה המהירה של homogenates רקמת שד הנורמלית וממאירים ללא עיכול אנזימטי למיון לאחר תא, חילוץ, הקפאה ו / או ניתוח פנוטיפי של CD45 + תת-אוכלוסיות. המטרה של הגישה הניסויית הזה היא לייצר תמונות של TIL המשקף באופן הדוק את מדינתם in vivo ולהשוות אותם לרקמות נורמליות עם מניפולציה מינימאלית של הרקמות טריות מחדר הניתוח. נכון להיום, במעבדה שלנו השתמשה בפרוטוקול זה כדי לנתח> 250 רקמות טריות לפנה"ס (גידול וNant),> 35 רקמות שד נורמליות מהפחתת החלב. באופן עקרוני, פרוטוקול זה צריך להיות ישים ישירות לסוגים אחרים גידול או רקמות; עם זאת, כמה אופטימיזציה ייתכן שתהיה צורך (כלומר, התכנית המכנית דיסוציאציה, מספר המחזורים, תקשורת הנפח, וכו '). לרקמות עם חדירת הלימפוציטים נמוכה, באמצעות שבר רקמה גדול יותר עשוי להיות necessהאר"י, וזה מה שאנחנו עושים לרקמות נורמליות שבו ספירת הלימפוציטים היא נמוכה. לחלופין, ניתן להוסיף צעד צנטריפוגה שיפוע צפיפות להעשיר את ההשעיה לויקוציטים. ניתוח זה של תת-אוכלוסיות תאים האנושיות T ו- B חדירת גידולים בשד כולל הערכה של על ידי הזרימה cytometry> 100 סמנים (cytometry זרימת נתונים עבור 74 סמנים זמינים בנתונים המשלימים של גו-Trantien, et al. 9) וטיהור של הלימפוציטים ספציפיים תת-אוכלוסיות לניתוחים חיסוניים ומולקולריים שלאחר מכן. יתר על כן, יש לנו הערכת ציטוקינים, כמוקינים, נוגדנים ואנטיגנים סרטניים בSN הגידול הראשוני (בהשוואה לNant וSN רקמה הנורמלית) 10,11 כהשתקפות של מתווכים המולקולריים אלה במייקרו-הסביבה של הגידול. יש לנו גם בדקתי את ההשפעה של טיפול לימפוציטים דם היקפיים מתורמים בריאים עם SN גידול והראה שרבים מהשינויים בביטוי הגנים שזוהו TIL ניתן לשחזר באופן ספציפי 9.
במייקרו-הסביבה שלהם, תאי הגידול וסטרומה מתקיימים הדוק יותר במטריצת הרקמות מתאי מערכת החיסון, שהם אופייני נודדים. השיטה המתוארת כאן מספקת דרך פשוטה ומהירה לבידוד וניתוח TIL ללא עיכול אנזימטי. הניסיונות הרבים שלנו להצטרף לגישת הומוגניזציה מכאנית זה עם עיכול אנזימטי קצר לייצר תאי קיימא והלימפה חיובית קולט ואפיתל מאותו קטע הגידול לא הצליח. הומוגניזציה רקמות ביעילות משחררת לימפוציטים אבל התוצאה היא אובדן משמעותי של כדאיות תא סרטני. עיכול אנזימטי קצר של הרקמה משחרר תאי קיימא גידול (גידול המספר הכולל כפונקציה של זמן עיכול), אבל יש לו את התוצאה של ירידה מקבילה בביטוי של קולטני רבים, ניכר במיוחד לימפוציטים. לפיכך, לניתוח ההשוואתי של תאים סרטניים וTIL מאותה הקיבהאו שזה עדיין יש צורך לעבד בנפרד שני שברי גידול רציפים.
נכון לעכשיו, רוב המחקרים שנועדו לאפיין TIL יש מועסקי עיכול אנזימטי (שעות לO / N) לעתים קרובות בשילוב עם צורה כלשהי של נתיחה מכאנית 4-8. הרחבת TIL לניתוח או טיפול נוסף בדרך כלל כרוכה הטיפוח לאחר מכן vivo לשעבר של TIL או שברי רקמת גידול עם סוכני גירוי (ימים עד שבועות) 13-15. השיטה המהירה, אינה אנזימטית לניתוק רקמה המתואר כאן מספקת דרך פשוטה ושחזור לחילוץ CD45 + תאים שלמים מברי רקמה נורמלים ולא נורמלים לפני ההתרחבות או הניתוח שלהם. רכישה מהירה של CD45 + תאים מחולים שעברו tumorectomy אולי יכולה להיות מפותחת לשימוש בסמנים ביולוגי assay פרוגנוסטיים. בנוסף, הוא עשוי להניב TIL עם פוטנציאל גדול יותר להרחבת vivo לשעבר לפני מאמץ immunotherapy.
Disclosures
The authors declare that no conflict of interest exists.
Acknowledgements
עבודה זו נתמכה על ידי מענקי fromthe קרן בלגית למחקר מדעי (FNRS), Les Amis de l'Institut Bordet, FNRS הפעולה Télévie, התכנית למלחמה בסרטן בבלגיה, Fonds לאמבו-Marteaux, Fonds JC Heuson וFonds Barsy.
Materials
| Name | Company | Catalog Number | Comments |
| GentleMacs Dissociator | Miltenyi Biotec | 130-093-235 | BD Medimachine is somewhat equivalent |
| Centrifuge 5810 R | Eppendorf | or other standard table top centrifuge | |
| Centrifuge 5417 R | Eppendorf | or other standard microcentrifuge | |
| Esco Class II A2 Biosafety Cabinet | ESCO global | or other standard BSL2 hood | |
| Inverted Microscope | Nikon eclipse TS100 | or other microscope compatible for a hemacytometer | |
| Bürker Chamber | Marienfield | 640210 | or other standard hemacytometer |
| Navios Flow Cytometer | Beckman Coulter | or other flow cytometer (8-10 color recommended) | |
| GentleMacs C-Tube | Miltenyi Biotec | 130-096-344 | BD Medimachine uses Filcon |
| Cell Culture Dish | Sarstedt | 72,710 | or other non-pyrogenic plasticware |
| Disposable Scalpel | Swann-Morton | 0510 | or standard single use sterile scalpel |
| BD Cell Strainer 40 µm | Becton Dickinson | 734-0002 | or other non-pyrogenic plasticware |
| BD Falcon Tube 50 ml | Becton Dickinson | 352070 | or other non-pyrogenic plasticware |
| BD Falcon Tube 15 ml | Becton Dickinson | 352097 | or other non-pyrogenic plasticware |
| BD FACS Tube 5 ml | Becton Dickinson | 352008 | or other non-pyrogenic plasticware |
| Sterile Pasteur Pipette 5 ml | VWR | 612-1685 | or other non-pyrogenic plasticware |
| Microfuge Tube 1.5 ml | Eppendorf | 7805-00 | or other non-pyrogenic plasticware |
| X-Vivo 20 | Lonza | BE04-448Q | serum-free medium recommended |
| Phosphate buffered saline | Lonza | BE17-516F | standard physiological PBS |
| Trypan blue | VWR | 17942E | or other vital stain |
| VersaLyse | Beckman Coulter | A09777 | for flow cytometry experiments |
| Fixable viability Dye eFluor 780 | eBioscience | 65-0865-14 | for flow cytometry experiments |
| anti-CD3 FITC | BD Biosciences | 345763 | for flow cytometry experiments |
| anti-CD3 Vio Blue | Miltenyi Biotec | 130-094-363 | for flow cytometry experiments |
| anti-CD4 PE | BD Biosciences | 345769 | for flow cytometry experiments |
| anti-CD4 APC | Miltenyi Biotec | 130-091-232 | for flow cytometry experiments |
| anti-CD8 ECD | Beckman Coulter | 737659 | for flow cytometry experiments |
| anti-CD8 PerCP | BD Biosciences | 345774 | for flow cytometry experiments |
| anti-CD19 APC-Vio770 | Miltenyi Biotec | 130-096-643 | for flow cytometry experiments |
| anti-CD45 VioGreen | Miltenyi Biotec | 130-096-906 | for flow cytometry experiments |
References
- Chen, D. S., Mellman, I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 39 (1), 1-10 (2013).
- Boudreau, A., van't Veer, J. L., Bissell, M. J. An 'elite hacker': breast tumors exploit the normal microenvironment program to instruct their progression and biological diversity. Cell Adh Migr. 6 (3), 236-248 (2012).
- Gajewski, T. F., Schreiber, H., Fu, Y. X. Innate and adaptive immune cells in the tumor microenvironment. Nat Immunol. 14 (10), 1014-1022 (2013).
- Quezada, S. A., et al. Limited tumor infiltration by activated T effector cells restricts the therapeutic activity of regulatory T cell depletion against established melanoma. J Exp Med. 205 (9), 2125-2138 (2008).
- Grange, C., et al. Phenotypic characterization and functional analysis of human tumor immune infiltration after mechanical and enzymatic disaggregation. J Immunol Methods. 372 (1-2), 119-126 (2011).
- McCauley, H. A., Guasch, G. Serial orthotopic transplantation of epithelial tumors in single-cell suspension. Methods Mol Biol. 1035, 231-245 (2013).
- Gros, A., et al. Myeloid cells obtained from the blood but not from the tumor can suppress T-cell proliferation in patients with melanoma. Clin Cancer Res. 18 (19), 5212-5223 (2012).
- Zirakzadeh, A. A., Marits, P., Sherif, A., Winqvist, O. Multiplex B cell characterization in blood, lymph nodes, and tumors from patients with malignancies. J Immunol. 190 (11), 5847-5855 (2013).
- Gu-Trantien, C., et al. CD4(+) follicular helper T cell infiltration predicts breast cancer survival. J Clin Invest. 123 (7), 2873-2892 (2013).
- Buisseret, L., et al. Lymphocytes Infiltrating Breast Cancer : Density, Composition And Organization. Annals of Oncology. 25 (1), 17 (2014).
- Garaud, S., et al. Characterization of B Cells Infiltrating Human Breast Cancer. Annals of Oncology. 25 (1), 18 (2014).
- Gu-Trantien, C., et al. Cxcl13-Producing Follicular Helper T Cells In Human Breast Cancer. Annals of Oncology. 25 (1), 17 (2014).
- Yee, C. The use of endogenous T cells for adoptive transfer. Immunol Rev. 257 (1), 250-263 (2014).
- Butler, M. O., et al. Ex vivo expansion of human CD8+ T cells using autologous CD4+ T cell help. PLoS One. 7 (1), 30229 (2012).
- Ye, Q., et al. Engineered artificial antigen presenting cells facilitate direct and efficient expansion of tumor infiltrating lymphocytes. J Transl Med. 9, 131 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved